廖云霞 1 ,费良航 1 ,夏明星 3 ,伍冬志 1 ,陈 偲 1,2 ,汪开拓 1,2, *
关键词: 葡萄;β-氨基丁酸;诱导抗性;模式;品质
葡萄(Vitis vinifera L.)为葡萄科葡萄属木质藤本植物,在全球温带及亚热带地区均有广泛种植;在当今世界主要的商业水果中,葡萄鲜果产量常年位居前三,产销量极高。但葡萄果实为典型的非跃变型果实,采收时已接近完熟,自身抗病能力较弱,且贮运过程中易形成机械伤和果蒂断面,因此极易遭受果实主要致病菌——灰葡萄孢(Botrytis cinerea)的侵染而爆发大面积灰霉病 [1] 。传统的二氧化硫或波尔多液处理虽可有效控制葡萄采后灰霉病的发展,但长期施用会导致化学残留并增强病原菌耐药性,从而降低食用安全性。采用绿色激发子来诱导果实抗病性可有效降低宿主对病原菌的敏感性,减少采后病害的发生,因此日益受到关注 [2] 。根据形成模式的差异可将诱导抗性分为直接诱导作用和Priming(敏化反应)作用。相较于直接诱导作用,Priming作用可“储藏”抗病性,避免植物在低病害压力下启动防卫反应,故能减少植物适应度的损失;但当植物遭受严重病原菌侵染时,其组织内可出现强烈的活性氧迸发,急速促进病程相关基因(pathogenesis-related genes,PRs)的表达和植保素的合成,因此是一种经济的植物防卫策略 [3] 。但在采后领域,激发子诱导采后果蔬抗病性的具体模式仍缺乏特征性研究。
β-氨基丁酸(β-aminobutyric acid,BABA)为一种从暴晒的番茄根系中分离的非氨基酸类蛋白质,具有充当信号分子调控植物防卫反应的功能 [4] 。采后BABA处理可有效诱导苹果 [5] 、柑橘 [6] 、芒果 [7] 、水蜜桃 [8] 和草莓 [9] 等果实活性氧迸发、抗病相关物质合成和PRs表达等抗病性反应,从而降低采后病害的发生率。因此,本研究以‘巨峰’葡萄果实为试材,分析经不同浓度BABA处理后果实在活性氧迸发、植保素合成和PRs表达上的差异,明确其抗病性反应的具体形成机制,以为进一步开发BABA保鲜方案提供依据。
‘巨峰’葡萄果实(Vitis vinifera L.×V. labrusca L.‘Kyoho’)为供试材料,于2016年7月采摘自重庆市万州区新田有机葡萄种植基地,3 h内运回实验室。剔除病虫害、机械伤以及未成熟果实,仔细剪下果穗上果粒,挑选大小均一、转色均匀并达到商业成熟度的单果粒,用清水仔细洗去残土和灰尘,以自然风吹干。
B. cinerea分离自腐烂葡萄果实,纯化鉴定后分出单孢子在PDA培养基上扩大培养(25 ℃),随后将菌种接种在PDA斜面培养基上低温保存(4 ℃)。使用前,将斜面上菌种转接至PDA平板上,在25 ℃下活化10 d后用质量分数0.9%无菌生理盐水将菌种配成1×10 5 个/mL的孢子悬浮液。
BABA(纯度≥99%) 德国Meker公司;白藜芦醇、白藜芦醇脱氢二聚体标准品 美国Sigma公司;乙腈(色谱纯) 中国国药集团有限公司;Tripure Isolation Reagent试剂盒(用于RNA提取) 美国罗氏公司;SuperScript II试剂盒(用于RNA逆转录) 美国Invitrogen公司;Vac 6cc C 18 固相萃取小柱(1 g装填量,90 μm颗粒直径)、纤维素膜(0.45 μm孔径) 美国Supelco公司;乙醇、丙酮、甲酸和醋酸等有机溶剂均为国产分析纯。
810R冷冻离心机 德国Eppendorf公司;UV2600i紫外-可见分光光度计、LC-20A高效液相色谱仪 日本岛津公司;PL601电子天平 瑞士Mettler-Toledo公司;902-ULTS超低温冰箱 美国Thermo公司;PTC200聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc XR凝胶成像仪 美国伯乐公司;DYCP-31DN琼脂糖水平电泳仪 北京六一生物科技有限公司;BSC-150恒温恒湿培养箱 上海博迅医疗生物仪器股份有限公司。
1.3.1 实验设计
前期研究已证实,1~500 mmol/L BABA处理可显著诱导多种果实采后抗病性反应 [8-9] ,因而以该范围浓度进行实验。将挑选出的葡萄果实用体积分数70%乙醇溶液进行表面消毒后随机分成两大组,每组约1 000 颗果实,随后再将每组果实随机分成5 份。第一组为模拟接种组,每份果实在减压罐中分别用0(对照)、1、10、100、500 mmol/L的BABA溶液减压(-0.01 MPa)浸泡15 min后,于20 ℃下存放6 h,随后用无菌手术针在果实赤道对称位置穿刺2 个孔(深2 mm、直径1.5 mm),模拟接种组和B. cinerea接种组在每个穿刺部位用移液枪分别注射15 μL的无菌蒸馏水和1.0×10 5 个/mL的B. cinerea孢子悬浮液。处理后的果实用无菌聚乙烯塑料盒进行分装,每个处理分装约15 盒,随后置于(20±1)℃、相对湿度(90±3)%的环境中贮藏5 d。贮藏期间每天测定葡萄果实灰霉病发病率和病斑直径,同时用手术刀切取非穿刺部位健康果肉组织,用液氮速冻后置于-80 ℃超低温冰箱中贮存备用。每个时间点随机选取20~25 颗果实进行测定并取样,每个处理重复3 次,整个实验重复2 次。
1.3.2 指标测定
1.3.2.1 发病率和病斑直径的测定
当葡萄果实表面病斑直径超过1.5 mm时,记录为发病果实。发病果实病斑直径用游标卡尺直接量出。发病率按式(1)计算。
1.3.2.2 H 2 O 2 含量的测定
称取1 g果实冷冻样品,用5 mL冷丙酮仔细研磨,匀浆液置于超声波发生器中振荡提取1 h,随后以8 000×g、2 ℃离心15 min。取1 mL上清液参照Patterson等 [10] 的方法测定果实内源H 2 O 2 含量,单位为μmol/kg,结果以鲜质量计。
1.3.2.3 抗病相关酶活力的测定
称取5 g果实冷冻样品,用20 mL缓冲液研磨匀浆以提取粗酶液。参照Abeles等 [11] 的方法测定几丁质酶和β-1,3-葡聚糖酶活力,均以U/mg表示活力。提取液中蛋白质含量参照Bradford [12] 的方法测定。
1.3.2.4 PRs表达丰度的测定
参考文献[13],取1 g果实冻样用试剂盒提取葡萄果实RNA。取1 mg RNA用试剂盒逆转录cDNA第一链,Oligo(dT)为引物。用Primer Premier 6.0软件设计VvNPR1.1(GSVIVT00016536001)、VvChit4(AY137377)、VvPR2(AJ277900)基因特异性引物(表1)。以葡萄18S rRNA基因为内参。PCR的产物经琼脂糖凝胶电泳分离,用溴化乙锭染色后用凝胶成像仪扫描并定量分析 [14] 。
表1 葡萄果实PRs特异性引物序列
Table 1 Sequences of primers used for PCR amplification of PRs in grape berries
1.3.2.5 植保素单体含量的测定
称取2 g果实冷冻样品,用7 mL冰丙酮匀浆并以8 000×g、2 ℃离心10 min,取上清液用氮气吹干,随后用10 mL含体积分数0.2%甲酸的冰乙腈溶液溶解,再经纤维素薄膜(0.45 μm孔径)过滤后参照Verhagen等 [15] 的方法测定样品中白藜芦醇和白藜芦醇脱氢二聚体含量,单位为μmol/kg,结果以鲜质量计。
1.3.2.6 可溶性糖含量的测定及甜度指数的计算
称取2 g贮藏第5天的模拟接种组果实冷冻样品,经10 mL体积分数95 %冰乙醇溶液匀浆并以8 000×g、2 ℃离心10 min,取上清液经旋转蒸发器在40 ℃下蒸发后,残留物用去离子水溶解后经纤维素薄膜过滤后采用高效液相色谱法 [16] 测定果糖、葡萄糖和蔗糖含量,单位为mmol/kg,结果以鲜质量计。甜度指数按式(2)计算 [17] 。
果实发病率和病斑直径平行测定5 次,其余指标均平行测定3 次。运用SAS 8.2软件对实验数据进行显著性分析(Duncan’s多重比较法),以P<0.05表示差异显著,P<0.01表示差异极显著。


图1 不同浓度BABA处理对模拟接种葡萄果实灰霉病发病率(A)及对B. cinerea接种果实灰霉病发病率(B)和病斑直径(C)的影响
Fig. 1 Effects of BABA treatment at different concentrations on disease incidence (A) in mock-inoculated grape berries, and disease incidence (B)and lesion diameter (C) in B. cinerea-inoculated grape berries
如图1A所示,对于模拟接种组,10~500 mmol/L BABA处理组在贮藏3 d后发病率显著降低(P<0.05),而1 mmol/L BABA处理组与对照组相比无显著差异(P>0.05)。由图1B、C可知,B. cinerea接种可加速葡萄果实的腐烂,贮藏5 d后对照组发病率超过50%,说明B. cinerea在果实伤口处增殖迅速;经10~500 mmol/L BABA处理并接种B. cinerea的葡萄果实其发病率和病斑直径在贮藏3 d后均显著低于只接种B. cinerea果实(P<0.05),而1 mmol/L BABA处理组与对照组相比无显著差异(P>0.05)。

图2 不同浓度BABA处理对模拟接种葡萄果实(A)和B. cinerea接种果实(B)中H 2 O 2 生成量的影响
Fig. 2 Effects of BABA treatment at different concentrations on H 2 O 2 production in mock-inoculated (A) and B. cinerea-inoculated (B) grape berries
模拟接种葡萄果实在20 ℃贮藏期间,1、10 mmol/L BABA处理组与对照组果实相比,其H 2 O 2 生成量无显著差异(P>0.05);100、500 mmol/L BABA处理则显著促进了H 2 O 2 生成量的上升,其含量在贮藏第2天和第1天分别达到峰值,随后急剧下降(图2A)。如图2B所示,葡萄果实只接种B. cinerea后,其H 2 O 2 含量在贮藏第2天出现峰值,其数值为贮藏前的2.4 倍;经10~500 mmol/L BABA处理并接种B. cinerea果实中H 2 O 2 含量在整个贮藏期间均显著高于只接种病原菌果实(P<0.05);其中10 mmol/L BABA较100、500 mmol/L BABA处理更明显地提高了果实在贮藏第1天的H 2 O 2 含量峰值。
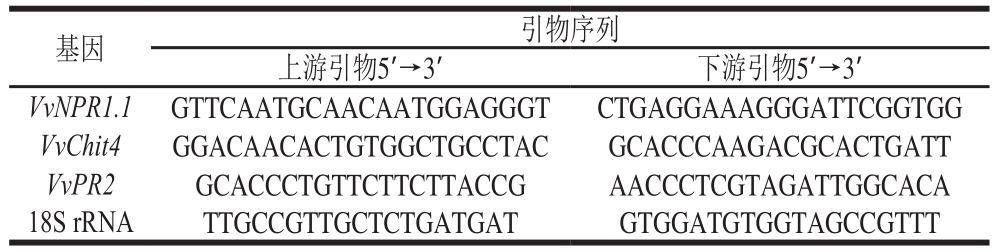
模拟接种的对照组果实中几丁质酶活力在贮藏(20 ℃)前3 d呈缓慢上升趋势,随后逐渐下降;β-1,3-葡聚糖酶活力则呈先缓慢上升后逐渐下降趋势;1、10 mmol/L BABA处理对模拟接种果实的几丁质酶和β-1,3-葡聚糖酶活力无显著影响(P>0.05),而100、500 mmol/L BABA处理可直接促进几丁质酶和β-1,3-葡聚糖酶活力的上升,使两种酶活力在整个贮藏期间均显著高于对照组(图3A 1 、B 1 )(P<0.05)。由图3A 2 、B 2 可知,10~500 mmol/L BABA处理可有效促进B. cinerea接种果实中两种抗病相关酶活力的上升;经10 mmol/L BABA处理并接种B. cinerea果实中几丁质酶活力在整个贮藏期间均显著高于100、500 mmol/L BABA处理组(P<0.05),而β-1,3-葡聚糖酶活力则在贮藏第2天出现明显峰值,其数值分别为同期100、500 mmol/L BABA处理组的1.70 倍和1.43 倍。
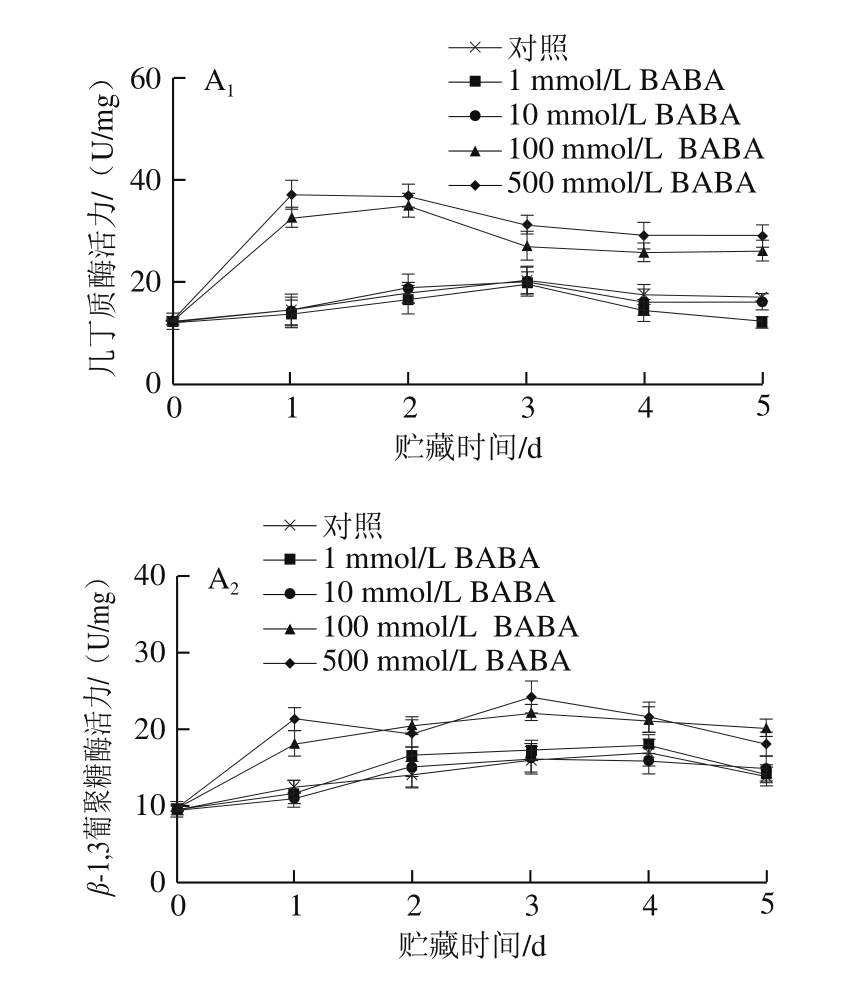

图3 不同浓度BABA处理对模拟接种葡萄果实和B. cinerea接种果实中几丁质酶和β-1,3-葡聚糖酶活力的影响
Fig. 3 Effects of BABA treatment at different concentrations on activities of chitinase and β-1,3-glucanase in mock-inoculated and B. cinerea-inoculated grape berries

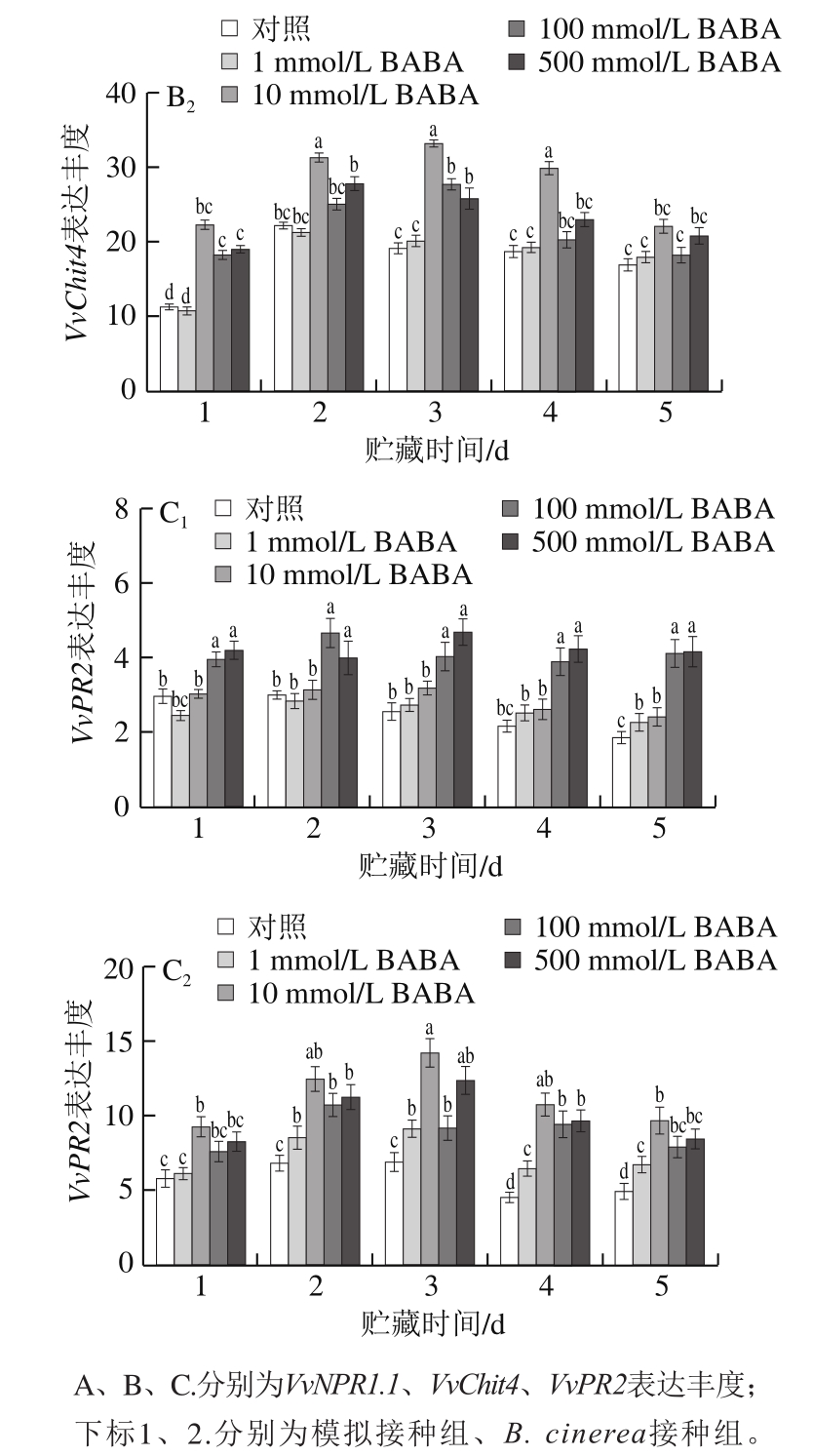
图4 不同浓度BABA处理对模拟接种葡萄果实和B. cinerea接种果实中VvNPR1.1、VvChit4和VvPR2基因表达丰度的影响
Fig. 4 Effects of BABA treatment at different concentrations on expression levels of VvNPR1.1, VvChit4 and VvPR2 in mock-inoculated and B. cinerea-inoculated grape berries
如图4A 1 、B 1 、C 1 所示,模拟接种葡萄果实在20 ℃贮藏期间,同一浓度BABA处理组的PRs如VvNPR1.1和VvPR2(β-1,3-葡聚糖酶基因)表达丰度在整个贮藏期间无显著变化(P>0.05),而VvChit4表达丰度均随贮藏时间延长呈现逐渐上升趋势;1 mmol/L 和10 mmol/L BABA处理对葡萄果实中VvNPR1.1、VvChit4和VvPR2基因表达丰度未产生明显影响,而经100 mmol/L和500 mmol/L BABA处理的果实在贮藏1 d后PRs表达丰度均显著高于对照组果实(P<0.05)。由图4A 2 、B 2 、C 2 可知,B. cinerea接种显著诱导了葡萄果实中PRs的表达,VvNPR1.1、VvChit4和VvPR2基因表达丰度在贮藏前期均出现峰值;经高浓度(100、500 mmol/L)BABA处理和B. cinerea接种的果实,其VvNPR1.1和VvChit4基因表达丰度在贮藏前3 d内均显著高于只病原菌接种果实;10 mmol/L BABA处理则较100 mmol/L或500 mmol/L BABA处理可更明显诱导接种果实中PRs的表达,使其表达丰度一直维持在最高水平。
图5 不同浓度BABA处理对模拟接种葡萄果实和B. cinerea接种果实中白藜芦醇和白藜芦醇脱氢二聚体含量的影响
Fig. 5 Effects of BABA treatment at different concentrations on contents of trans-resveratrol and ε-viniferin in mock-inoculated and B. cinerea-inoculated grape berries
如图5A 1 、B 1 所示,模拟接种的对照组果实在20 ℃贮藏期间,其主要植保素单体白藜芦醇含量呈缓慢上升趋势,白藜芦醇脱氢二聚体含量在贮藏1 d内逐渐上升,随后基本保持稳定;1、10 mmol/L BABA处理对模拟接种果实中白藜芦醇和白藜芦醇脱氢二聚体含量无显著影响(P>0.05),而100、500 mmol/L BABA处理可明显提高这两种植保素单体含量。由图5A 2 、B 2 可知,与模拟接种果实相比,BABA处理可有效诱导B. cinerea接种果实中白藜芦醇和白藜芦醇脱氢二聚体含量的上升,经10 mmol/L BABA处理并接种B. cinerea果实中白藜芦醇和白藜芦醇脱氢二聚体含量均高于100 mmol/L或500 mmol/L BABA处理组。

图6 不同浓度BABA处理对模拟接种组葡萄果实可溶性糖含量(A)和甜度指数(B)的影响
Fig. 6 Effects of BABA treatment at different concentrations on contents of individual soluble sugars (A) and sweetness index (B) in grape berries
如图6所示,经1 mmol/L BABA处理的模拟接种组葡萄果实在20 ℃下贮藏5 d后,其果糖、葡萄糖和蔗糖含量以及甜度指数均与对照组相比无显著差异(P>0.05);100、500 mmol/L BABA处理则可抑制葡萄果实可溶性糖的积累;而经10 mmol/L BABA处理的果实中葡萄糖和蔗糖含量和甜度指数则均显著高于对照组(P<0.05)。
BABA作为一种绿色的抗性激发子,可充当信号分子通过交联应答机制启动植物的抗病性反应 [18] 。在本研究中,10~500 mmol/L BABA处理均可有效诱导B. cinerea接种组葡萄果实H 2 O 2 迸发、抗病相关酶活力上升、PRs表达和植保素合成,从而显著提升果实贮藏期间抗病水平。同时,前研究也发现,10~500 mmol/L BABA可直接抑制病原菌B. cinerea的孢子萌发和菌丝体生长 [9] 。因此,BABA可通过直接抑制病原菌生长以及间接诱导抗病性来降低葡萄果实贮藏期间灰霉病发病率。
H 2 O 2 是典型的活性氧自由基,其在植物遭受病原菌侵染时会应激并大量生成,再通过复杂的机制向下游传导并放大抗性信号,从而启动PRs表达以及PR蛋白和抗病相关物质的合成 [19] 。PRs非表达子居于植物组织中不同抗病信号传导途径的交叉位点,可直接在胞内与功能性转录因子结合,从而全面调控PRs表达和抗病相关物质合成 [20] 。这其中,VvNPR1.1是葡萄NPR基因家族中已被克隆的一个基因,可直接调节葡萄PRs的表达 [21] 。几丁质酶和β-1,3-葡聚糖酶是植物中最典型的抗病相关酶,对真菌细胞壁具有直接水解作用 [22] ;VvChit4和VvPR2基因经转录和翻译后可分别合成这两种酶以提升果实抗病性 [23] 。白藜芦醇和白藜芦醇脱氢二聚体是葡萄植保素的最主要单体物质,两者的合成量与抗病相关酶活力和PRs表达丰度呈明显正相关关系 [24] 。在本研究中,1 mmol/L BABA处理未能直接诱导葡萄果实任何抗病性反应;而经100、500 mmol/L BABA处理的葡萄果实,无论是进行模拟接种或病原菌B. cinerea接种,均在贮藏第1天出现了明显的H 2 O 2 迸发、抗病相关酶(几丁质酶和β-1,3-葡聚糖酶)活力和PRs(VvNPR1.1和VvPR2)表达丰度的急剧上升以及植保素(白藜芦醇和白藜芦醇脱氢二聚体)合成的增加。这表明高浓度BABA直接诱导的葡萄果实抗病反应,与是否接种病原菌无直接关系。10 mmol/L BABA处理无法诱导模拟接种葡萄果实的直接抗病性反应,但在贮藏后期仍可通过Priming作用启动防卫反应,从而抑制果实腐烂;但对经10 mmol/L BABA处理的果实进行损伤接种B. cinerea后,其果实内活性氧产生量明显升高,同时伴随着PRs表达量和抗病相关物质含量的显著提升。这暗示10 mmol/L BABA不能够直接诱导葡萄果实活性氧迸发、PRs表达和植保素合成,但在病原菌侵染的状态下可迅速激活这些防卫反应。因此,上述结果说明,BABA处理浓度与果实抗病反应模式密切相关,即在有效浓度内,高浓度的BABA处理可诱导葡萄果实的直接抗病性反应,而低浓度的BABA处理则诱导果实Priming作用。前期研究同样发现,较低有效浓度的苯丙噻唑硫代乙酸甲酯(benzo-thiadiazole-7-carbothioic acid S-methyl ester,BTH)或茉莉酸甲酯(methyl jasmonate,MeJA)处理不能直接诱导草莓 [9] 、葡萄 [13] 和杨梅 [25] 果实抗病性反应,但可诱导Priming抗性从而使果实在遭受病原菌侵染时急剧表达PRs并大量合成酚类、木质素和植保素等抗病相关物质。
植物抗病性反应是一种基于逆境响应的应激反应,易影响植物组织或细胞正常的生理代谢 [26] 。高浓度的BABA处理可诱导拟南芥典型的系统获得性抗性,但同时也抑制了植株生长 [27] ;前期研究发现,BTH或MeJA在诱导葡萄细胞PRs表达的同时,也伴随着细胞内含物质量的下降 [28-29] 。在本研究中,100、500 mmol/L BABA处理抑制了葡萄果实在贮藏期间果糖、葡萄糖和蔗糖的积累,并同时降低了果实甜度指数;而经10 mmol/L BABA处理的果实在贮藏期间,其可溶性糖含量及甜度指数均高于高浓度处理组果实。这说明高浓度BABA诱导的直接抗病反应虽可抑制葡萄果实采后腐烂,但也导致了果实品质的下降;Priming作用能较好保持抗病性反应和底物消耗之间的平衡,减少果实品质过度的损耗,但Priming抗性分子层面的信号传导和代谢机理仍有待研究。
10~500 mmol/L BABA处理可显著降低葡萄果实在贮藏期间由B. cinerea引起的灰霉病发病率;高浓度(100、500 mmol/L)BABA可诱导葡萄果实直接抗病反应,而低浓度(10 mmol/L)BABA则诱导果实Priming抗性;100、500 mmol/L BABA处理抑制了葡萄果实贮藏期间可溶性糖的积累,而10 mmol/L BABA处理可维持果实较高的可溶性糖含量和甜度指数。
参考文献:
[1] ROMANAZZI G, KARABULUT O A, SMILANICK J L.Combination of chitosan and ethanol to control postharvest gray mold of table grapes[J]. Postharvest Biology and Technology, 2007, 45(1):134-140. DOI:10.1016/j.postharvbio.2007.01.004.
[2] SCHIRRA M, D’AQUINO S, CABRAS P, et al. Control of postharvest diseases of fruit by heat and fungicides: efficacy, residue levels, and residue persistence. a review[J]. Journal of Agricultural and Food Chemistry, 2011, 59(16): 8531-8542. DOI:10.1021/jf201899t.
[3] CONRATH U. Molecular aspects of defence priming[J].Trends in Plant Science, 2011, 16(10): 524-531. DOI:10.1016/j.tplants.2011.06.004.
[4] COHEN Y, VAKNIN M, MAUCH-MANI B. BABA-induced resistance: milestones along a 55-year journey[J]. Phytoparasitica,2016, 44(4): 513-538. DOI:10.1007/s12600-016-0546-x.
[5] ZHANG C F, WANG J M, ZHANG J G, et al. Effects of β-aminobutyric acid on control of postharvest blue mould of apple fruit and its possible mechanisms of action[J]. Postharvest Biology and Technology, 2011, 61(2): 145-151. DOI:10.1016/j.postharvbio.2011.02.008.
[6] PORAT R, MCCOLLUM T G, VINOKUR V, et al. Effects of various elicitors on the transcription of a β-1,3-endoglucanase gene in citrus fruit[J]. Journal of Phytopathology, 2002, 150(2): 70-75. DOI:10.1046/j.1439-0434.2002.00719.x.
[7] ZHANG Z K, YANG D P, YANG B, et al. β-Aminobutyric acid induces resistance of mango fruit to postharvest anthracnose caused by Colletotrichum gloeosporioides and enhances activity of fruit defense mechanisms[J]. Scientia Horticulturae, 2013, 160: 78-84.DOI:10.1016/j.scienta.2013.05.023.
[8] 汪开拓, 廖云霞, 袁坤明, 等. β-氨基丁酸处理对桃果实采后灰霉病的影响及其诱导抗病模式研究[J]. 食品与发酵工业, 2016, 42(2):65-71. DOI:10.13995/j.cnki.11-1802/ts.201602012.
[9] WANG K T, LIAO Y X, XIONG Q, et al. Induction of direct or priming resistance against Botrytis cinerea in strawberries by β-aminobutyric acid and their effects on sucrose metabolism[J].Journal of Agricultural and Food Chemistry, 2016, 64(29): 5855-5865.DOI:10.1021/acs.jafc.6b00947.
[10] PATTERSON B D, MACRAE E A, FERGUSON I B. Estimation of hydrogen peroxide in plant extracts using titanium (IV)[J].Analytical Biochemistry, 1984, 139(2): 487-492. DOI:10.1016/0003-2697(84)90039-3.
[11] ABELES F B, BOSSHART R P, FORRENCE L E, et al. Preparation and purification of glucanase and chitinase from bean leaves[J]. Plant Physiology, 1971, 47(1): 129-134. DOI:10.1104/pp.47.1.129.
[12] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(Suppl 1/2): 248-254. DOI:10.1006/abio.1976.9999.
[13] WANG K T, LIAO Y X, KAN J Q, et al. Response of direct or priming defense against Botrytis cinerea to methyl jasmonate treatment at different concentrations in grape berries[J]. International Journal of Food Microbiology, 2015, 194: 32-39. DOI:10.1016/j.ijfoodmicro.2014.11.006.
[14] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 −ΔΔCT method[J].Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262.
[15] VERHAGEN B W M, TROTEL-AZIZ P, COUDERCHET M, et al.Pseudomonas spp. -induced systemic resistance to Botrytis cinerea is associated with induction and priming of defense responses in grapevine[J]. Journal of Experimental Botany, 2010, 61(1): 249-260.DOI:10.1093/jxb/erp295.
[16] CAO S F, ZHENG Y H, YANG Z F, et al. Effect of methyl jasmonate on quality and antioxidant activity of postharvest loquat fruit[J].Journal of the Science of Food and Agriculture, 2009, 89(12): 2064-2070. DOI:10.1002/jsfa.3691.
[17] KEUTGEN A J, PAWELZIK E. Quality and nutritional value of strawberry fruit under long term salt stress[J]. Food Chemistry, 2008,107(4): 1413-1420. DOI:10.1016/j.foodchem.2007.09.071.
[18] COHEN Y R. β-aminobutyric acid-induced resistance against plant pathogens[J]. Plant Disease, 2002, 86(5): 448-457. DOI:10.1094/PDIS.2002.86.5.448.
[19] O’BRIEN J A, DAUDI A, BUTT V S, et al. Reactive oxygen species and their role in plant defence and cell wall metabolism[J]. Planta,2012, 236(3): 765-779. DOI:10.1007/s00425-012-1696-9.
[20] MOU Z L, FAN W H, DONG X N. Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes[J].Cell, 2003, 113(7): 935-944. DOI:10.1016/S0092-8674(03)00429-X.
[21] LE HENANFF G, HEITZ T, MESTRE P, et al. Characterization of vitis vinifera NPR 1 homologs involved in the regulation of Pathogenesis-Related gene expression[J]. BMC Plant Biology, 2009,9(1): 54-67. DOI:10.1186/1471-2229-9-54.
[22] WALLY O, JAYARAJ J, PUNJA Z. Comparative resistance to foliar fungal pathogens in transgenic carrot plants expressing genes encoding for chitinase, β-1,3-glucanase and peroxidise[J]. European Journal of Plant Pathology, 2009, 123(3): 331-342. DOI:10.1007/s10658-008-9370-6.
[23] LE HENANFF G, FARINE S, KIEFFER-MAZET F, et al. Vitis vinifera VvNPR 1.1 is the functional ortholog of AtNPR 1 and its overexpression in grapevine triggers constitutive activation of PR genes and enhanced resistance to powdery mildew[J]. Planta, 2011,234(2): 405-417. DOI:10.1007/s00425-011-1412-1.
[24] TIMPERIO A M, D’ALESSANDRO A, FAGIONI M, et al.Production of the phytoalexins trans-resveratrol and delta-viniferin in two economy-relevant grape cultivars upon infection with Botrytis cinerea in field conditions[J]. Plant Physiology and Biochemistry,2012, 50(1): 65-71. DOI:10.1016/j.plaphy.2011.07.008.
[25] WANG K T, JIN P, HAN L, et al. Methyl jasmonate induces resistance against Penicillium citrinum in Chinese bayberry by priming of defense responses[J]. Postharvest Biology and Technology, 2014,98(1): 90-97. DOI:10.1016/j.postharvbio.2014.07.009.
[26] CIPOLLINI D, PURRINGTON C B, BERGELSON J. Costs of induced responses in plants[J]. Basic & Applied Ecology, 2003, 4(1):79-89. DOI:10.1078/1439-1791-00134.
[27] VAN HULTEN M, PELSER M, VAN LOON L C, et al. Costs and benefits of priming for defense in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006,103(14): 5602-5607. DOI:10.1073/pnas.0510213103.
[28] WANG K T, LIAO Y X, CAO S F, et al. Effects of benzothiadiazole on disease resistance and soluble sugar accumulation in grape berries and its possible cellular mechanisms involved[J]. Postharvest Biology and Technology, 2015, 102: 51-60. DOI:10.1016/j.postharvbio.2015.02.011.
[29] 汪开拓, 廖云霞, 狄华涛, 等. 茉莉酸甲酯诱导葡萄悬浮细胞防卫反应机制的研究[J]. 园艺学报, 2015, 42(7): 1225-1232. DOI:10.13995/j.cnki.11-1802/ts.201602012.
Different Modes of Disease Resistance Response Induced by β-Aminobutyric Acid at Different Concentrations in Grape Berries
LIAO Yunxia 1 , FEI Lianghang 1 , XIA Mingxing 3 , WU Dongzhi 1 , CHEN Si 1,2 , WANG Kaituo 1,2, *
(1. College of Biology and Food Engineering, Chongqing Three Gorges University, Chongqing 404100, China;2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;3. Chongqing Entry-Exit Inspection and Quarantine Bureau, Chongqing 404100, China)
Abstract: The effect of β-aminobutyric acid (BABA) treatment at different concentrations ranging from 1‒500 mmol/L on the induction of disease resistance in postharvest grape berries and the resistance responses were investigated in the present study. The results showed that BABA treatment could effectively induce disease resistance against Botrytis cinerea infection in grape berries during storage at 20 ℃. Both mock-inoculated and B. cinerea-inoculated grape berries treated with 100 or 500 mmol/L BABA exhibited typical resistance responses, namely H 2 O 2 burst, enhanced expression of defenserelated genes including VvNPR1.1, VvChit4 and VvPR2, and increased activities of chitinase and β-1,3-glucanase as well as the accumulation of stilbene phytoalexins such as trans-resveratrol and its oligomer ε-viniferin. BABA at a concentration of 10 mmol/L had no effect on inducing disease resistance in grape berries directly. However, in grape berries pretreated with 10 mmol/L BABA and then inoculated with B. cinerea, H 2 O 2 production, the transcription levels of pathogenesis-related genes and the contents of phytoalexins significantly increased among all treatments. Meanwhile, 10 mmol/L BABA-treated grape berries maintained higher contents of soluble sugars and higher sweetness index when compared with those treated with BABA at 100 and 500 mmol/L. These results implied that high concentration of BABA (100 and 500 mmol/L) could directly activate defense responses, while low concentration of BABA (10 mmol/L) could trigger a priming defense to prevent substrate overconsumption and maintain fruit quality.
Keywords: grape; β-aminobutyric acid; induced resistance; mode; quality
LIAO Yunxia, FEI Lianghang, XIA Mingxing, et al. Different modes of disease resistance response induced by β-aminobutyric acid at different concentrations in grape berries[J]. Food Science, 2018, 39(17): 221-228. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201817036. http://www.spkx.net.cn
文章编号: 1002-6630(2018)17-0221-08
引文格式: 廖云霞, 费良航, 夏明星, 等. 不同浓度β-氨基丁酸处理对葡萄果实抗病性的诱导模式[J]. 食品科学, 2018, 39(17):221-228. DOI:10.7506/spkx1002-6630-201817036. http://www.spkx.net.cn
中图分类号: TS255.36
文献标志码: A
*通信作者简介: 汪开拓(1983—),男,教授,博士,研究方向为农产品贮藏。E-mail:wangkaituo83@gmail.com
DOI: 10.7506/spkx1002-6630-201817036
基金项目: 国家自然科学基金面上项目(31671913);重庆市基础与前沿研究计划项目(cstc2015jcyjA80028);第五批重庆市高校优秀人才支持计划项目(2017019);重庆三峡学院科研创新团队建设计划项目(201703);2016年度重庆市大学生创新性实验计划项目(201610643009)
第一作者简介: 廖云霞(1991—),女,硕士研究生,研究方向为农产品贮藏。E-mail:960997311@qq.com
(1.重庆三峡学院生物与食品工程学院,重庆 404100;2.南京农业大学食品科技学院,江苏 南京 210095;3.重庆出入境检验检疫局,重庆 404100)
收稿日期: 2017-05-12
摘 要: 分析了不同浓度(1~500 mmol/L)β-氨基丁酸(β-aminobutyric acid,BABA)处理对采后葡萄果实抗病反应的诱导作用并明确相关抗性反应的模式。结果显示,10~500 mmol/L BABA处理可有效抑制果实在20 ℃贮藏期间灰葡萄孢(Botrytis cinerea)的侵染,从而降低果实发病率。在有效作用浓度中,经高浓度(100、500 mmol/L)BABA处理的模拟接种和B. cinerea接种葡萄果实均出现H 2 O 2 迸发、病程相关基因(VvNPR1.1、VvChit4和VvPR2)表达量提升、抗病相关酶(几丁质酶和β-1,3-葡聚糖酶)活力升高和植保素单体(白藜芦醇和白藜芦醇脱氢二聚体)积累等一系列典型抗病性反应。10 mmol/L BABA处理不能直接诱导果实上述抗病反应,但经10 mmol/L BABA处理的果实在接种B. cinerea后则出现最显著的H 2 O 2 生成量、PRs转录水平和植保素含量上升现象。同时,低浓度(10 mmol/L)BABA处理的葡萄果实中可溶性糖含量和甜度指数均显著高于高浓度(100、500 mmol/L)处理果实。这些结果暗示,高浓度(100 mmol/L或500 mmol/L)BABA处理可诱导葡萄果实的直接抗病反应;10 mmol/L BABA处理则诱导Priming(敏化反应)作用,以使果实在病原菌侵染时展现强烈抗病性;同时,Priming抗性较直接诱导作用可有效防止底物的过度消耗,以维持果实贮藏品质。