陈益春,刘 骞,姜 帅,曹传爱,张 欢,孔保华*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要: 在以猪血浆蛋白水解物(porcine plasma protein hydrolysates,PPPH)作为乳化剂所制备的水包油(oil-in-water,O/W)型乳状液中添加氧化单宁酸(oxidised tannic acid,OTA),研究OTA添加量对乳状液贮藏期间物理稳定性的改善,测定乳状液在贮藏期间的粒径、Zeta电位、絮凝指数、凝结指数和乳状液中蛋白质分配系数的变化趋势,并且利用激光共聚焦显微镜观察乳状液的微观结构。结果表明,在乳状液1~10 d的贮藏期间,与对照组相比,随着OTA添加量的增加,D [3,2] 、D [4,3] 、絮凝指数以及凝结指数显著降低(P<0.05),且在OTA添加量1%时达到最低(P<0.05);相反,Zeta电位随着OTA添加量的增加显著提高(P<0.05),且在OTA添加量1%时达到最高(P<0.05)。同时,OTA的添加在一定程度上促进了PPPH的交联,能够显著增加其在乳状液界面蛋白膜表面的分布(P<0.05);另外,乳状液的微观结构进一步验证OTA添加量1%的处理组能够在油滴表面形成最紧密和厚重的界面蛋白膜。研究结果表明,在PPPH制备的O/W型乳状液中添加OTA,能够显著提高其在整个储藏期间的物理稳定性,为OTA在乳状液食品中的应用提供了实验参考。
关键词: 氧化单宁酸;猪血浆蛋白水解物;水包油型乳状液;交联;物理稳定性
水包油(oil-in-water,O/W)型乳状液是油滴分散在水相而形成的热力学不稳定分散体系,其在食品行业应用中较为广泛 [1] 。而由于环境温度、液滴大小、界面张力、表观黏度等物理因素的变化,会导致体系出现絮凝、聚集、分层等物理状态失稳的现象 [2-3] 。因此,在实际制备O/W型乳状液过程中,通常会添加不同种类表面活性剂或乳化剂以达到提高乳状液稳定性的作用。大量研究已表明,一些化学合成的、具有低分子质量的表面活性剂(比如吐温、斯潘等),由于其出色的界面分散能力,已经成功应用于乳状液的制备 [4] 。但是,关于这些化学合成乳化剂在人体中的安全性、毒性以及对新陈代谢的影响等问题,极大地限制了其在食品乳状液体系中的广泛应用。另外,相对于化学合成的乳化剂来说,一些蛋白质 [5-7] (比如大豆蛋白、乳清蛋白等)由于能够通过疏水作用力吸附在油水界面上,并且能够在油滴表面形成保护膜,可以通过范德华力和静电排斥作用维持乳化体系的稳定性 [8] 。但是,相关研究表明,这些蛋白质具有相对致密的分子结构,限制了其在油水界面上分子构象的重新排布,从而影响其在油滴表面的吸附作用 [9] 。
与此同时,蛋白酶水解对于蛋白质本身的乳化活性具有很大的影响,这主要是由于肽链断裂所造成的。然而,具有较低水解度的蛋白质水解物相对于未水解蛋白来说,能够在一定程度上改善其自身的乳化活性,主要归因于长肽链灵活可变的构象以及由于水解而暴露出来的疏水核心 [10] 。Lam等 [11] 研究发现,具有较大分子质量的多肽中同时含有较多的疏水基团和亲水基团,因此在乳化体系的形成过程中,疏水基团能够与油滴相互结合,而亲水基团则通过空间位阻效应稳定整个体系中油滴的大小,从而达到提高乳状液稳定性的目的。然而,Balange等 [12] 研究表明,氧化多酚类物质能够作为一种良好的交联剂,用于改善蛋白质的功能性质。虽然较未氧化的多酚相比,氧化多酚的抗氧化能力有些下降;但氧化多酚能够与一些氨基酸(比如色氨酸、半胱氨酸、酪氨酸、蛋氨酸等)中的亲核基团发生诱导交联反应 [13] 。另外,Aewsiri等 [14] 研究发现,利用氧化多酚修饰以后的明胶制备乳状液,能够显著提高乳状液在储藏期间的物理稳定性,同时还可以明显抑制乳状液中脂质氧化的发生。单宁酸是存在植物中的一种天然多酚类化合物,其作为天然蛋白交联剂具有高效、低毒等优点。而且,单宁酸中较多的邻苯二酚结构更易氧化为邻苯醌,通过侧链反应形成二聚物。同时,氧化形成的醌类化合物可与肽链上的巯基、氨基反应形成C—N及C—S,实现多肽分子的交联,以达到提高水解物乳化能力的目的。
在前期研究 [15] 中,以适度水解的猪血浆蛋白水解物(porcine plasma protein hydrolysate,PPPH)为乳化剂制备O/W型乳状液,与Intarasirisawat等 [16] 研究结果相似,乳状液在整个储藏期仍具有分层、絮凝等不稳定的现象。基于此,本实验研究添加氧化单宁酸(oxidised tannic acid,OTA)提高以PPPH作为乳化剂所制备的菜籽油O/W型乳状液的物理稳定性,分析探讨整个乳状液在储藏期间的粒径、絮凝指数、凝结指数、Zeta电位和乳状液中蛋白质分配系数的变化趋势,并对其微观结构进行观察,为PPPH和OTA在复杂的乳状液类食品体系中的应用提供实验参考。
猪血浆蛋白粉(蛋白质量分数70%) 黑龙江北大荒肉类有限公司;碱性蛋白酶 丹麦Novozymes公司;菜籽油 恒大兴安有限公司;单宁酸、磷酸氢二钠、磷酸二氢钠、盐酸、氢氧化钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)等均为国产分析纯,实验用水均为超纯水。
JD500-2电子天平 沈阳龙腾电子称量仪器有限公司;AL-104型精密电子天平 梅特勒-托利多仪器(上海)有限公司;DK-8B电热恒温水浴锅 上海精宏实验设备有限公司;JB-2恒温磁力搅拌器 上海雷磁新泾仪器有限公司;GL-21M冷冻离心机 湖南湘仪实验室仪器开发有限公司;T18匀浆机 德国IKA公司;UT-1800紫外-可见光分光光度计 北京普析通用仪器有限公司;JY92-IIN超声细胞粉碎机 宁波新芝生物科技股份有限公司;S-3400N型激光共聚焦电子显微镜日本日立公司。
1.3.1 PPPH的制备
参照李月等 [15] 的方法将经过预热处理(95 ℃,5 min)的4%猪血浆蛋白溶液(pH 8.0)加入碱性蛋白酶(酶与底物质量比为2∶100)置于55 ℃水浴环境下水解1 h。水解过程以1 mol/L NaOH溶液调节pH值保持恒定(pH 8)。水解结束后95 ℃水浴5 min进行灭酶,用1 mol/L HCl溶液将水解液pH值调至7.0。水解物于9 000×g离心10 min除去悬浮物。
1.3.2 OTA的制备
参照Aewsiri等 [14] 方法制备OTA。将单宁酸溶于蒸馏水(2 g/100 mL),用1 mol/L NaOH溶液将pH值调至9。随后40 ℃通入高纯度氧气(99.5%)1 h,以确保单宁酸氧化为OTA。
1.3.3 PPPH乳状液的制备
菜籽油与PPPH溶液(质量分数4%,10 mmol/L磷酸盐缓冲溶液,pH 7.0)以体积比1∶9混合,用高速均质机于13 500 r/min均质2 min。然后将粗乳状液置于20 kHz、70%能量的条件下超声3 min。然后,分别加入不同添加量的OTA(体积分数0.1%、0.5%、1.0%、1.5%,下同),再用高速均质机13 500 r/min均质30 s,调整所有乳状液的pH值为7.0。与此同时,在制备粗乳状液时,加入0.02 g/100 mL NaN 3 溶液作为抑菌剂。制备好的乳状液于25 ℃贮藏,并且在第1、4、7和10天测定指标。为了防止乳状液在储藏期间腐败变质以及长时间的放置发生质量劣变,最终的储藏期定为10 d。
1.3.4 粒径大小及分布测定
参照Aewsiri等 [14] 方法略作改动。采用马尔文2000激光粒度散射仪测定乳状液粒径大小及分布。其中,D [3,2] 表示表面积平均粒径,D [4,3] 表示体积平均粒径。粒径变化率按公式(1)计算:
式中:d 1 为第1天粒径;d n 为第n天粒径。
1.3.5 絮凝指数和凝结指数测定
参照Intarasirisawat等 [16] 方法将乳状液溶于蒸馏水及1% SDS溶液中。絮凝指数和凝结指数由式(2)、(3)计算:

式中:D [4,3]+SDS 、D [4,3]-SDS 分别为含1% SDS和不含SDS乳状液的体积平均粒径;D [4,3]+SDS,in 和D [4,3]+SDS,t 表示含1% SDS在第0天和设定的贮存期内乳状液液滴的体积平均粒径。
1.3.6 Zeta电位测定
将上述乳状液稀释100 倍,采用动态光散射仪在室温(大约22 ℃)条件下测定其各组乳状液的Zeta电位。
1.3.7 蛋白在乳状液中的分布
参照Li Yuanyuan等 [17] 方法测定新鲜乳状液中的蛋白在各相的分布。取1 mL乳状液于EP管中,25 ℃、15 000×g离心45 min。然后取下层清液再离心30 min,最后将2 次离心后的下层清液过0.22 μm滤膜,将滤液稀释到一定倍数,采用Lowry法 [18] 测定蛋白含量。蛋白在两相中分配系数、水相中蛋白质量分数、界面蛋白质量分数按公式(4)~(6)计算:
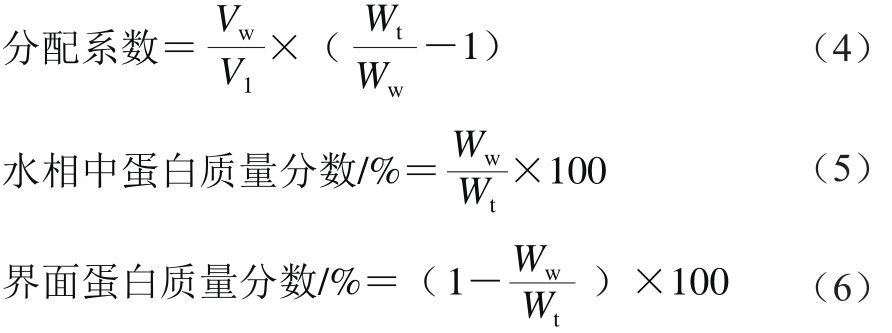
式中:V w 为水的体积/mL;V l 为油的体积/mL;W t 为总蛋白质量浓度/(mg/mL);W w 为水相中蛋白质量浓度/(mg/mL)。
1.3.8 激光共聚焦显微镜观察
参照Li Yuanyuan等 [17] 方法采用激光共聚焦显微镜观察乳状液中油滴和蛋白质的分布情况。以尼罗红(0.1%溶于乙醇)和尼罗兰(0.1%溶于超纯水)分别为脂质和蛋白染料。取1 mL乳状液与25 μL尼罗红和20 μL尼罗兰混合染色后,取5 μL于载玻片,并盖上盖玻片,于室温下,40 倍物镜下观察。其中,脂质和蛋白质的激发波长分别为633 nm和488 nm。
每个实验重复3 次,结果表示为  ±s。数据统计分析采用Statistix 8.1软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用Sigmaplot 12.5软件作图。
±s。数据统计分析采用Statistix 8.1软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用Sigmaplot 12.5软件作图。
液滴粒径的大小是乳状液的物理稳定性及贮藏期的重要参数 [19] ,乳状液液滴粒径越大,其体系越不稳定。由表1可知,与空白对照组相比,添加OTA能够显著降低整个乳状液体系的D [3,2] 和D [4,3] (P<0.05)。而且,随着储藏时间延长到第10天时,添加OTA能够明显抑制整个乳状液体系D [3,2] 和D [4,3] 的增加(P<0.05)。与此同时,根据粒径变化率可以看出,添加OTA以后,能够显著降低乳状液在储藏期间的粒径变化率(P<0.05)。研究结果表明添加OTA会引起肽的交联反应 [20-21] ,可使足够的肽吸附在油水界面处,在油滴表面形成较强的薄膜,从而使乳状液不易发生絮凝,提高整体乳状液在储藏期间的稳定性。Hebishy等 [22] 研究表明,大量油水界面上吸附的有效蛋白能够显著提高界面蛋白的吸附率及油滴表面的覆盖率,从而有效地抑制液滴的絮凝和聚集。另外,OTA添加量1%的乳状液具有最低的D [3,2] 和D [4,3] (P<0.05),而OTA添加量1.5%的乳状液的粒径较添加1% OTA的乳状液显著增加(P<0.05),这可能是由于过多的OTA中的邻位醌形成二聚体,或与多肽侧链的氨基或巯基共价结合,使液滴絮凝导致粒径的增大。
表1 不同添加量OTA对PPPH制备的O/W型乳状液在储藏期间粒径变化的影响
Table 1 Effect of different concentrations of OTA incorporation on particle size of oil-in-water emulsion during storage

注:同列不同大写字母表示差异显著,P<0.05。
絮凝指数及凝结指数的大小影响储藏期间乳状液的稳定性 [23] 。由表2可以看出,在储藏期间,所有样品的絮凝指数和凝结指数呈上升趋势,在只含PPPH的乳状液中,乳化后添加OTA可显著降低乳状液的絮凝指数和凝结指数(P<0.05)。Wooster等 [24] 发现乳状液的物理稳定性由作用力的平衡状态决定,例如范德华吸引力、静电斥力及空间位阻等。而OTA的添加增强了PPPH膜的形成,产生了较强的静电斥力和空间位阻,所以对降低乳状液的凝结具有一定的影响。凝结指数的增加归因于D [4,3] 的增加 [25] 。两液滴间由连续相薄膜阻止油滴间的接触,而这层薄膜可以自发地打破,一旦薄膜破裂,局部拉普拉斯压力差作用使油滴向压力较低的部位移动,也就导致油滴间的聚集,引起粒径的增加,从而引起凝结指数的增加 [15] 。而通过适当添加OTA,除增强PPPH薄膜的厚度及提高稳定性,其还提供更多的负电荷,这就很好地说明了添加1% OTA的PPPH乳状液凝结指数最小的原因。添加1.5% OTA的实验组可能由于较高浓度的OTA诱导肽交联,使肽无法充分吸附在界面处,从而引起凝结指数的增大。
表2 不同添加量OTA对PPPH制备的O/W型乳状液在储藏期间絮凝指数和凝结指数变化的影响
Table 2 Effect of different concentrations of OTA incorporation on flocculation index and creaming index of oil-in-water emulsion during storage

注:同一指标同列不同大写字母表示差异显著,P<0.05;同一指标同行不同小写字母表示差异显著,P<0.05。
添加OTA的PPPH乳状液絮凝指数要显著低于对照组,且在10 d储藏期内,对照组的絮凝指数显著增加,显示较快的絮凝发生现象。这可能是由于添加OTA的乳状液的液滴表面被更多的PPPH覆盖,尤其是在1% OTA下,从而减少液滴间架桥而引起的絮凝。较高的絮凝指数显示较快的发生絮凝,这与伴随的凝结增强而导致较高的凝结指数结果相一致。此外,从图1可以明显观察到添加OTA较只有PPPH的对照组物理稳定性明显提高。
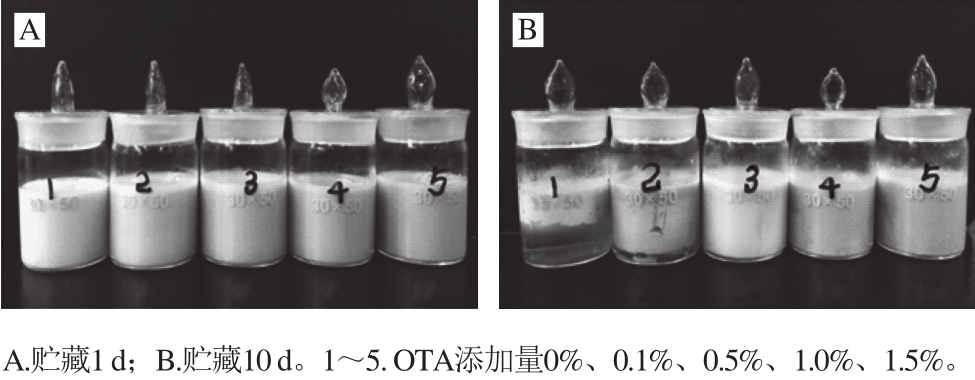
图1 不同添加量OTA的对PPPH制备的O/W型乳状液的储藏情况
Fig. 1 Pictures of oil-in-water emulsions with different concentrations of OTA during storage

图2 不同添加量OTA对PPPH制备的O/W型乳状液在储藏期间Zeta电位变化的影响
Fig. 2 Effect of different concentrations of OTA incorporation on Zeta potential of oil-in-water emulsion during storage
Zeta电位绝对值的大小反映液滴表面所带静电荷的多少,从而用于衡量静电相互作用,进而用来评价乳化体系的物理稳定性。由图2可知,新鲜及储藏期内的乳状液显示高度的负Zeta电位,新鲜乳状液的Zeta电位都低于-30 mV,即所有PPPH乳状液液滴表面都带负电荷。这是由于pH 8时,PPPH的羧基去质子化产生的负电荷。随着OTA添加量的增加,PPPH乳状液电势呈现先下降后上升的变化趋势,即液滴表面所带负电荷表现为先增多后减少(P<0.05)。这可能是由于OTA与一些带正电荷的氨基酸残基反应,或者由于诱导分子内或分子间肽交联,使负电荷残基被屏蔽,所以导致负电荷的增多 [26] 。其中,未添加OTA的PPPH乳状液Zeta电位为-31.77 mV,添加1% OTA乳状液液滴所带负电荷最多,Zeta电位为-35.37 mV。这是由于此时液滴比表面积较大,表面携带肽增加,导致其电势绝对值显著高于对照组(P<0.05)。继续增加OTA添加量,过多的OTA分子与PPPH结合,并诱导蛋白交联,使得比表面积减小,减少界面所带电荷。乳状液的Zeta电位绝对值大于30 mV都会表现为静电稳定 [27] ,而小于30 mV就会产生絮凝或凝结,这与上述实验结果相吻合。在储藏期内,由于离子相互作用使得液滴周围吸附蛋白,导致所有样品的Zeta电位的升高,从而引起静电斥力的降低。
表3 不同添加量OTA对PPPH制备的O/W型乳状液中水相及界面中蛋白分布的影响
Table 3 Effect of different concentrations of OTA incorporation on interfacial protein distribution and partition coefficient of oil-in-water emulsion
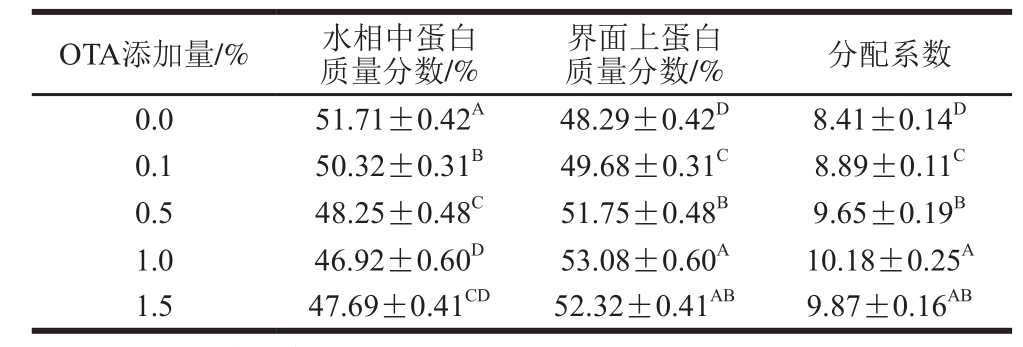
注:同列不同大写字母表示差异显著,P<0.05。
如表3所示,添加PPPH为乳化剂的乳状液蛋白在界面处的分布(质量分数48.29%),随着OTA添加量的增加,PPPH在界面的分布也相应增加(P<0.05)。其中,添加1% OTA乳状液的界面蛋白分布率最高,质量分数达53.08%,其分配系数最大,为10.18。继续增加OTA的添加量至1.5%,界面蛋白质量分数及分配系数分别减少至52.32%和9.87。这说明适当添加量的OTA可以促进PPPH及OTA在界面处的吸附,形成更加均匀致密的界面膜,而过多的OTA影响了PPPH吸附到界面上,有可能是过多的OTA使得PPPH吸附到界面的速率较其脱离的速率快,导致界面蛋白含量的下降,界面薄膜较薄,这进一步证实了1% OTA的PPPH乳状液表现出较高的物理稳定性。
添加PPPH乳状液的界面蛋白几乎含量可占到一半。这可能是由于pH 8条件下,猪血浆蛋白水解产生了较多的小分子肽,小分子肽可以在界面处覆盖更多大分子肽达不到的区域。此外,小分子肽在体系中的扩散速率和界面处的吸附速率较快,由吸附动力学和蛋白吸附原理可以解释OTA促进了PPPH的吸附,降低界面张力,从而使液滴粒径减小,这与Walstra等 [28] 的研究结果相一致。Anja等 [29] 研究表明当蛋白质在界面上吸附时,其构象会发生变化,增加与界面接触点的数量,从而降低界面张力。此外,吸附蛋白的大小、疏水性、浓度等因素都会影响界面张力,从而影响乳化体系的稳定性。
如图3所示,尼罗红染色的油及尼罗兰染色的蛋白在633 nm和488 nm的激发波长下分别呈现为红色和绿色。叠加产生的亮黄色图像表示界面处的蛋白吸附情况。激光共聚焦显微镜可对乳状液的界面结构、油滴分布、絮凝和凝结情况提供详细说明 [30] ,从而进一步分析粒径大小,絮凝、凝结指数等物理指标。如图3所示,在储藏第10天时,所有乳状液都有絮凝和凝结的现象,特别是单独以PPPH为乳化剂的乳化体系,其表现为明显的絮凝和凝结。随着OTA添加量的增加,表现为颗粒聚集和絮凝程度的下降及在水相中的均匀分散。在相同的显微镜倍数下,添加OTA的乳状液液滴更小,这与上述粒径的结果相一致。如图3箭头所示,其中F和C分别代表储藏期间乳状液液滴的絮凝和凝结,这可能是因为O/W界面处的蛋白分子结构展开暴露残基,这就会使界面处的分子通过—S—S—、C—N或C—S相互作用,从而导致如图3的液滴絮凝聚集现象。对比3A、B和3C、D两组图可知,添加OTA后,虽然油滴表面吸附的蛋白水解物与其他油滴的蛋白相互结合,但其更大程度上促进了与水相中PPPH地结合,从而使界面蛋白含量增加,这不仅增加了油滴表面的静电斥力,而且高度堆积的蛋白会相互作用形成致密的网状结构,从而使液滴间不易聚集。
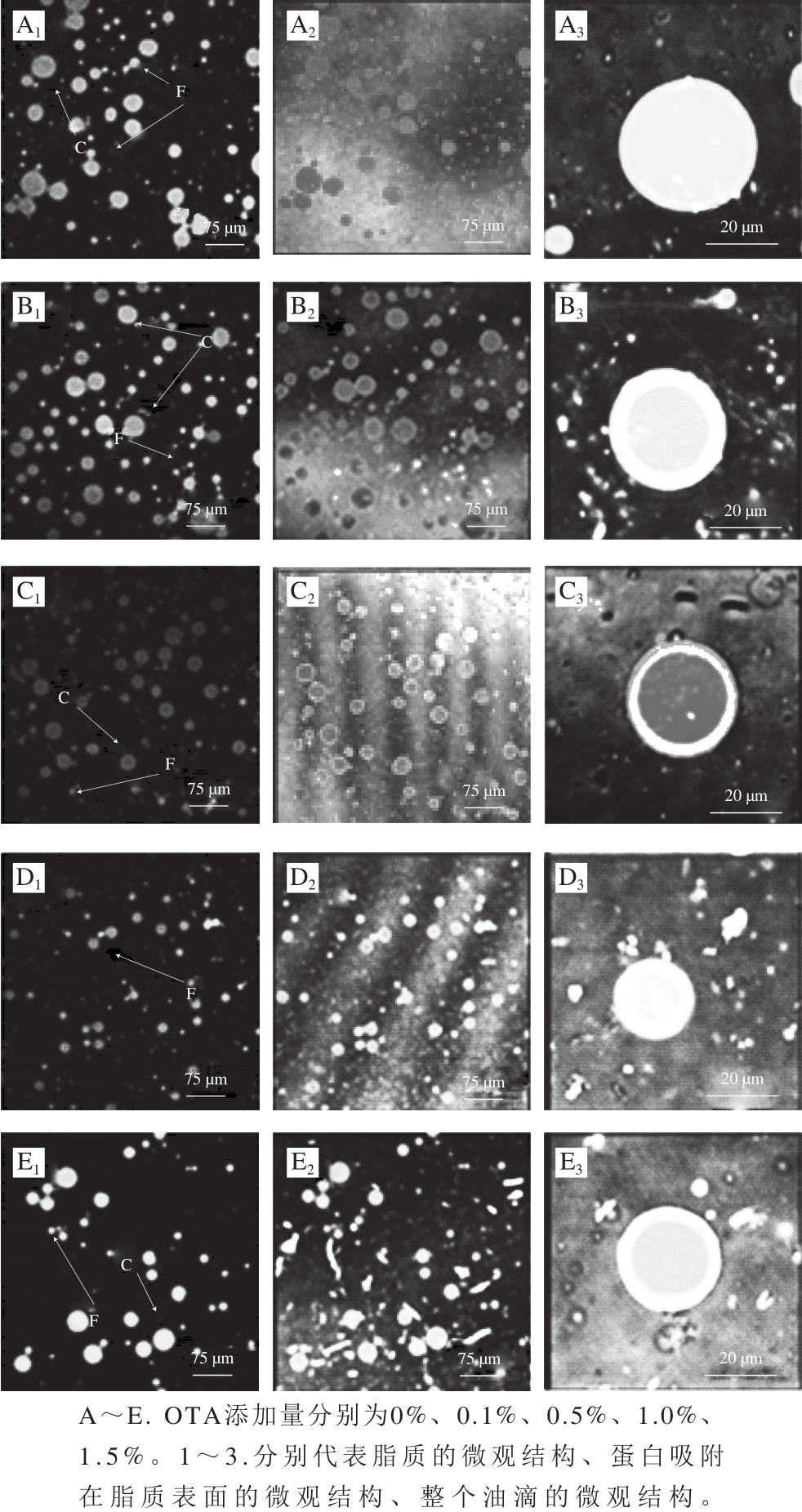
图3 不同添加量OTA对PPPH制备的O/W型乳状液在储藏第10天微观结构的变化
Fig. 3 CLSM micrographs of oil-in-water emulsions with different concentrations of OTA during storage
由图3可知,未添加OTA的乳状液液滴表面薄膜相对较薄,且分布不均匀。添加1% OTA的乳状液液滴外部包有较厚的亮黄色界面膜,这说明此时液滴表面所吸附的蛋白含量最多,更进一步支持了界面蛋白分布的结果,同时也说明OTA确实对乳状液界面膜的厚度及所吸附蛋白含量有一定的影响。Intarasirisawat等 [16] 研究结果表明OTA可以提高界面处鱼卵蛋白水解物的吸附,从而增强界面膜的厚度及致密性。这与本实验1% OTA的PPPH乳状液液滴粒径最小、界面薄膜最厚相吻合。
本实验主要针对添加不同添加量的OTA能够提高以PPPH作为稳定剂所制备的菜籽油O/W型乳状液的物理稳定性进行深入研究。通过乳状液在储藏期间(0~10 d)的粒径、絮凝指数、凝结指数、Zeta电位和乳状液中蛋白质分配系数的测定结果发现,添加OTA以后,能够明显提高整个乳状液在储藏期间的物理稳定性,尤其以1% OTA添加量的处理组为最佳。同时,蛋白在油水界面中的分布情况以及乳状液的微观结构直接验证了添加OTA以后能够促进乳状液物理稳定性的结果。因此,本实验为OTA在以蛋白水解物为乳化剂的乳状液中合理应用提供了参考支持。
参考文献:
[1] BAI L, HUAN S, LI Z, et al. Comparison of emulsifying properties of food-grade polysaccharides in oil-in-water emulsions: gum arabic, beet pectin, and cornfiber gum[J]. Food Hydrocolloids, 2017, 66(5): 144-153. DOI:10.1016/j.foodhyd.2016.12.019.
[2] 蔡志宁, 赵谋明. 蛋白质乳浊液体系稳定性研究进展[J]. 食品与发酵工业, 2005, 31(2): 73-77. DOI:10.13995/j.cnki.11-1802/ts.2005.02.020.
[3] 崔健, 郦金龙, 王盼, 等. 温度、pH和盐对乳清蛋白乳状液稳定性的影响[J]. 食品工业科技, 2010, 31(11): 84-87. DOI:10.13386/j.issn1002-0306.2010.11.048.
[4] QIAN C, MCCLEMENTS D J. Formation of nanoemulsions stabilized by model food-grade emulsifiers using high-pressure homogenization:factors affecting particle size[J]. Food Hydrocolloids, 2011, 25(5):1000-1008. DOI:10.1016/j.foodhyd.2010.09.017.
[5] FERNANDEZ-AVILA C, TRUJILLO A J. Ultra-high pressure homogenization improves oxidative stability and interfacial properties of soy protein isolate-stabilized emulsions[J]. Food Chemistry, 2016,209(10): 104-113. DOI:10.1016/j.foodchem.2016.04.019.
[6] HU M, MCCLEMENTS D J, DECKER E A. Lipid oxidation in corn oil-in-water emulsions stabilized by casein, whey protein isolate, and soy protein isolate[J]. Journal of Agricultural & Food Chemistry,2003, 51(6): 1696-1700. DOI:10.1021/jf020952j.
[7] SUN C H, GUNASEKARAN S, RICHARDS M P. Effect of xanthan gum on physicochemical properties of whey protein isolate stabilized oil-in-water emulsions[J]. Food Hydrocolloids, 2007, 21(4): 555-564.DOI:10.1016/j.foodhyd.2006.06.003.
[8] SANGHO L, LEFEVRE T, SUBIRADE M, et al. Effects of ultra-high pressure homogenization on the properties and structure of interfacial protein layer in whey protein-stabilized emulsion[J]. Food Chemistry,2009, 113(1): 191-195. DOI:10.1016/j.foodchem.2008.07.067.
[9] MIRIANI M, KEERATIURAI M, CORREDIG M, et al. Denaturation of soy proteins in solution and at the oil-water interface: a fluorescence study[J]. Food Hydrocolloids, 2011, 25(4): 620-626. DOI:10.1016/j.foodhyd.2010.07.020.
[10] ADJONU R, TORLEY P, AGBOOLA S. Whey protein peptides as components of nanoemulsions: a review of emulsifying and biological functionalities[J]. Journal of Food Engineering, 2014, 122(1): 15-27.DOI:10.1016/j.jfoodeng.2013.08.034.
[11] LAM R S, NICKERSON M T. Food proteins: a review on their emulsifying properties using a structure-function approach[J].Food Chemistry, 2013, 141(2): 975-984. DOI:10.1016/j.foodchem.2013.04.038.
[12] AMJAD B, SOOTTAWAT B. Enhancement of gel strength of bigeye snapper (Priacanthus tayenus) surimi using oxidised phenolic compounds[J]. Food Chemistry, 2009, 113(1): 61-70. DOI:10.1016/j.foodchem.2008.07.039.
[13] KROLL J, HARSHADRAI M R, ROHN S. Reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds[J]. Foodence & Technology Research, 2003, 9(3):205-218.
[14] AEWSIRI T, BENJAKUL S, VISESSANGUAN W, et al.Antioxidative activity and emulsifying properties of cuttlefish skin gelatin modified by oxidised phenolic compounds[J]. Food Chemistry,2009, 117(1): 160-168. DOI:10.1016/j.foodchem.2009.03.092.
[15] 李月, 孔保华, 王超, 等. 蛋白酶种类及水解时间对猪血浆蛋白水解物抗氧化性和乳化性的影响[J]. 肉类研究, 2016, 30(12): 7-11.DOI:10.15922/j.cnki.rlyj.2016.12.002.
[16] INTARASIRISAWAT R, BENJAKUL S, VISESSANGUAN W.Stability of emulsion containing skipjack roe protein hydrolysate modified by oxidised tannic acid[J]. Food Hydrocolloids, 2014,41(20): 146-155. DOI:10.1016/j.foodhyd.2014.03.034.
[17] LI Y Y, KONG B H, LIU Q, et al. Improvement of the emulsifying and oxidative stability of myofibrillar protein prepared oil-in-water emulsions by addition of zein hydrolysates[J]. Process Biochemistry,2017, 53(2): 116-124. DOI:10.1016/j.procbio.2016.11.010.
[18] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 263-275.
[19] HUCK-IRIART C, CANDAL R J, HERRERA M L. Effect of aqueous phase composition on stability of sodium caseinate/sunflower oil emulsions[J]. Food & Bioprocess Technology, 2013, 6(9): 2406-2418.DOI:10.1007/s11947-012-0901-y.
[20] HEBISHY E. Stability of sub-micron oil-in-water emulsions produced by ultra high pressure homogenization and sodium caseinate as emulsifier[J]. Chemical Engineering Transactions, 2015, 32: 79-90.DOI:10.1016/j.ifset.2015.09.013.
[21] GUDIPATI V, SANDRA S, MCCLEMENTS D J, et al. Oxidative stability and in vitro digestibility of fish oil-in-water emulsions containing multilayered membranes[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 8093-8099. DOI:10.1021/jf101348c.
[22] HEBISHY E, BUFFA M, GUAMIS B, et al. Physical and oxidative stability of whey protein oil-in-water emulsions produced by conventional and ultra high-pressure homogenization: effects of pressure and protein concentration on emulsion characteristics[J].Innovative Food Science & Emerging Technologies, 2015, 32(3838):79-90. DOI:10.1016/j.ifset.2015.09.013.
[23] PATIL U, BENJAKUL S. Characteristics of albumin and globulin from coconut meat and their role in emulsion stability without and with proteolysis[J]. Food Hydrocolloids, 2017, 69(8): 220-228.DOI:10.1016/j.foodhyd.2017.02.006.
[24] WOOSTER T J, AUGUSTIN M A. The emulsion flocculation stability of protein-carbohydrate diblockcopolymers[J]. Journal of Colloid & Interface Science, 2007, 313(2): 665-675. DOI:10.1016/j.jcis.2007.04.054.
[25] FREDRICK E, WALSTRA P, DEWETTINCK K. Factors governing partial coalescence in oil-in-water emulsions[J]. Advances in Colloid & Interface Science, 2010, 153(1): 30-42. DOI:10.1016/j.cis.2009.10.003.
[26] JIANG J, XIONG Y L. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J]. Meat Science, 2013, 93(3): 469-476.DOI:10.1016/j.meatsci.2012.11.002.
[27] YONG W, DONG L, WANG L J, et al. The effect of addition of flaxseed gum on the emulsion properties of soybean protein isolate (SPI)[J]. Journal of Food Engineering, 2011, 104(1): 56-62.DOI:10.1016/j.jfoodeng.2010.11.027.
[28] WALSTRA P. Principles of emulsion formation[J]. Chemical Engineering Science, 1993, 48(2): 333-349.
[29] SCHRODER A, BERTON-CARABIN C, VENEMA P, et al.Interfacial properties and physical stability of O/W emulsions containing hydrolyzed whey proteins[J]. Food Hydrocolloids, 2017,73(12): 129-140. DOI:10.1016/j.foodhyd.2017.06.001.
[30] BERNEWITZ R, SCHMIDT U S, SCHUCHMANN H P, et al.Structure of and diffusion in O/W/O double emulsions by CLSM and NMR-comparison with W/O/W[J]. Colloids & Surfaces A:Physicochemical & Engineering Aspects, 2014, 458(1): 10-18.DOI:10.1016/j.colsurfa.2014.01.002.
Improvement of Physical Stability of Emulsion Containing Porcine Plasma Protein Hydrolysates by Oxidized Tannic Acid
CHEN Yichun, LIU Qian, JIANG Shuai, CAO Chuan’ai, ZHANG Huan, KONG Baohua*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract: This study investigated the effect of adding oxidized tannic acid (OTA) to oil-in-water (O/W) emulsions prepared with porcine plasma protein hydrolysates (PPPH) as an emulsifier on improving their physical stability during storage.The changes in emulsion droplet size, Zeta potential, flocculation index, creaming index and protein partition coeきcient during storage were determined, and the microstructure was visualized via confocal laser scanning microscopy (CLSM). The results showed that compared with the control group, D [3,2] , D [4,3] , flocculation index and coagulation index were decreased significantly with the increase in OTA concentration (P < 0.05), whereas Zeta potential value was obviously increased (P < 0.05), reaching its maximum when 1% OTA was added, during the period from 1 to 10 d of storage. Meanwhile, OTA slightly induced cross-linking of PPPH, significantly increasing their distribution at the emulsion interface (P < 0.05). The CLSM micrographs also revealed that the interfacial membrane in emulsions with the addition of 1% OTA was more compact and more massive than other groups.The results indicated that the addition of OTA significantly improved the physical stability of O/W emulsions containing PPPH during storage, which will lay a theoretical foundation for the application of OTA in food emulsions.
Keywords: oxidized tannic acid; porcine plasma protein hydrolysates; oil-in-water emulsion; cross-linking; physical stability
CHEN Yichun, LIU Qian, JIANG Shuai, et al. Improvement of physical stability of emulsion containing porcine plasma protein hydrolysates by oxidized tannic acid[J]. Food Science, 2018, 39(18): 42-47. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201818007. http://www.spkx.net.cn
陈益春, 刘骞, 姜帅, 等. 氧化单宁酸提高含猪血浆蛋白水解物的乳状液物理稳定性[J]. 食品科学, 2018, 39(18): 42-47.DOI:10.7506/spkx1002-6630-201818007. http://www.spkx.net.cn
文章编号: 1002-6630(2018)18-0042-06
引文格式:
中图分类号: TS251.1
文献标志码: A
*通信作者简介: 孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh@163.com
DOI: 10.7506/spkx1002-6630-201818007
基金项目: 黑龙江省自然科学基金面上项目(C2018029);国家自然科学基金面上项目(31671788);东北农业大学“学术骨干”项目(16XG18)
第一作者简介: 陈益春(1993—),女,硕士研究生,研究方向为畜产品加工。E-mail:15045857716@163.com
收稿日期: 2017-08-10