 ,真空冷冻干燥得PEA。
,真空冷冻干燥得PEA。 魏君慧,薛 媛,冯 莉,张若曦,王小晶,雷宏杰*,徐怀德*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘 要: 以杏鲍菇为原料,分别利用碱溶酸沉法提取杏鲍菇分离蛋白(Pleurotus eryngii protein isolate,PEPI)、Osborne法分离主要蛋白组分,并研究其理化性质和功能分析。结果表明,杏鲍菇的蛋白质量分数为17.57%(以干质量计),以杏鲍菇清蛋白(Pleurotus eryngii albumin,PEA)为主,占总分离蛋白组分的81.12%。PEPI和PEA中均含18 种氨基酸,且必需氨基酸含量分别占总氨基酸含量的40.80%和40.51%。与PEPI相比,PEA的表面疏水性(265.25)显著高于PEPI(164.27)(P<0.05),而总巯基、二硫键含量较低,分别为61.53 μmol/g和10.39 μmol/g;热变性温度(100.98 ℃)低于PEPI(108.27 ℃),且PEA持水性(1.64 mL/g)、持油性(5.59 mL/g)显著低于PEPI(3.58、8.36 mL/g)(P<0.05)。PEPI和PEA的溶解性、起泡性、泡沫稳定性、乳化性及乳化稳定性随pH值的变化趋势均相似,在等电点时均为最低。傅里叶变换红外光谱显示PEPI和PEA的二级结构主要是β-折叠和β-转角,扫描电镜观察PEPI呈蜂巢结构。相比PEA,PEPI具有更好的理化性质和功能特性。
关键词: 杏鲍菇;分离蛋白;清蛋白;理化性质;功能特性
杏鲍菇(Pleurotus eryngii(DC. et Fr.)Quel.)属伞菌目侧耳科侧耳属菌类,又名刺芹侧耳 [1] 。1977年实现了商业性栽培,是近年来开发栽培成功的珍稀食药两用食用菌新品种 [2] 。我国的杏鲍菇栽培起步较晚,但发展快,目前已成为世界上杏鲍菇产量最大的国家,且生产量逐年增长,产地集中在河南、山东、黑龙江、福建、江苏、浙江等地区 [3] 。我国杏鲍菇主要用作鲜食,市面上主要以杏鲍菇粉、酱、脯、饮料、脆片 [2] 等初级加工产品为主,精深加工产品较少。因此,需要进一步开发杏鲍菇精深加工系列产品,开拓杏鲍菇产品市场。
杏鲍菇子实体色泽乳白、菌肉肥厚、质地脆嫩、兼具杏仁香味和鲍鱼风味,素有“平菇王”的美誉 [4] 。研究表明,杏鲍菇不仅富含多糖、蛋白、多酚、膳食纤维等营养成分,而且具有抗肿瘤、抗氧化、免疫调节、保肝和降血脂 [5-8] 等多种药理作用,因其独特的风味和丰富的营养价值,备受消费者青睐。杏鲍菇中蛋白质含量较高,约占其干质量的18.61% [9] ,明显高于蔬菜,可与肉、蛋和豆类媲美。近年来,国内外对杏鲍菇多糖的研究较多,主要表现在多糖的提取纯化、结构表征及生物活性等方面 [7,10-11] ,而对杏鲍菇蛋白的研究主要集中在提取 [12-14] 和酶解 [15] 方面,关于杏鲍菇蛋白的理化性质及功能特性的研究,国内外鲜有报道。
本研究以杏鲍菇为原料,对杏鲍菇分离蛋白(Pleurotus eryngii protein isolate,PEPI)和杏鲍菇清蛋白(Pleurotus eryngii albumin,PEA)的理化性质、功能特性进行研究,为杏鲍菇的综合利用以及相关蛋白产品的进一步开发应用提供实验支撑。
新鲜杏鲍菇购自陕西杨凌,样品切片后经40 ℃烘箱中烘干至恒质量、60 目粉碎过筛后置于4 ℃冷藏备用。
三羟甲基氨基甲烷(trihydroxymethyl aminomethane,Tris)、甘氨酸 北京索莱宝生物科技有限公司;考马斯亮蓝G-250、8-苯胺基-1-萘磺酸钠(8-aniline-1-naphthalenesulfonate sodium,ANS)、5,5’-二硫代-2-硝基苯甲酸(5,5’-dithio-bis-(2-nitrobenzoic acid),DTNB)美国Sigma公司;其余试剂均为国产分析纯。
GL-10MD大容量高速冷冻离心机 湖南湘仪离心机仪器有限公司;K9840型自动凯氏定氮仪 济南海能仪器有限公司;UV-1780型紫外-可见分光光度计岛津仪器(苏州)有限公司;FD5-2.5 E型冻干机 金西盟(北京)仪器有限公司;S-4800场发射扫描电镜日本日立公司;Vetex70傅里叶变换红外光谱仪德国布鲁克公司;Q2000差示扫描量热仪(differential scanning calorimeter,DSC) 美国Waters公司;LS55荧光分光光度计 美国PE公司。
1.3.1 杏鲍菇基本成分测定
蛋白质测定:GB/T 15673—2009《食用菌中粗蛋白含量的测定》;水分测定:GB/T 5009.3—2010《食品中水分的测定》;灰分测定:GB/T 12532—2008《食用菌灰分测定》;粗脂肪测定:GB/T 15674—2009《食用菌中粗脂肪含量的测定》;粗纤维测定:GB/T 5009.10—2003《植物类食品中粗纤维的测定》;总糖测定:GB/T 15672—2009《食用菌中总糖含量的测定》。
1.3.2 杏鲍菇蛋白组分分离
参照毛晓英 [16] Osborne分级提取的流程,依次用10 倍体积蒸馏水、8 倍体积2% NaCl溶液、8 倍体积75%乙醇溶液和8 倍体积0.2 mol/L NaOH溶液提取杏鲍菇粉中的PEA、球蛋白、醇溶蛋白和谷蛋白。
1.3.3 PEPI和PEA的制备
1.3.3.1 PEPI的制备
参照刘庆等 [12] 优化的碱溶酸沉法制备PEPI。具体操作如下:将杏鲍菇粉与去离子水以料液比1∶12(g/mL)混合,用1 mol/L NaOH溶液调pH值至10.0,30 ℃浸提30 min后,4 000 r/min离心20 min。收集上清液,残渣复提1 次,合并2 次上清液,用1 mol/L HCl溶液调至PEPI等电点3.6,静置30 min后4 000 r/min离心20 min,收集沉淀,水洗至中性后透析48 h,真空冷冻干燥得到PEPI。
1.3.3.2 PEA的制备
称取一定量的杏鲍菇粉末,加入10 倍体积蒸馏水,40 ℃搅拌2 h后,4 000 r/min离心20 min。将上清液pH值调至等电点4.0,缓慢加入一定量固体硫酸铵,使溶液中硫酸铵饱和度达到45%,4 ℃静置0.5 h,6 000 r/min离心15min;上清液继续追加硫酸铵,使溶液硫酸铵饱和度达到80%,4 ℃静置0.5 h,6 000 r/min离心15 min。合并2 次盐析得到的蛋白沉淀,水洗至中性后透析。过量的10% BaCl 2 溶液检测透析效果,至无白色沉淀生成,即水中不再含有  ,真空冷冻干燥得PEA。
,真空冷冻干燥得PEA。
1.3.4 PEPI和PEA氨基酸组成分析
精确称取一定量的样品,用6 mol/L的HCl溶液密封水解24 h,采用氨基酸分析仪按照GB/T 5009.124—2003《食品中氨基酸的测定》方法测定氨基酸含量(除色氨酸外)。色氨酸测定时用碱水解法按照GB/T 15400—1994《饲料中色氨酸测定方法 分光光度法》方法测定。
1.3.5 PEPI和PEA表面疏水性测定
采用ANS荧光探针法测定 [17] 。配制1.0 mg/mL的蛋白溶液,并用磷酸缓冲液(20 mmol/L,pH 7.4)稀释,调节蛋白质量浓度为0.1~1.0 mg/mL,取稀释后的蛋白溶液4.0 mL,加入20 μL的8 mmol/L ANS溶液,振荡,避光反应10 min后摇匀,采用LS55荧光分光光度计测定样品的荧光强度。以蛋白质量浓度为横坐标,荧光强度为纵坐标,初始阶段的曲线斜率为表面疏水性。
1.3.6 PEPI和PEA巯基和二硫键含量测定 [18]
游离巯基含量的测定:准确量取2.0 mL蛋白样品溶液,加入5.0 mL Tris-Gly缓冲液(0.086 mol/L Tris,0.09 mol/L Gly,4 mmol/L Na 2 EDTA,pH 8.0),再加入100 μL的Ellman试剂(10 mmol/L)。涡旋振荡混合均匀,25 ℃保温反应15 min后,在412 nm波长处测定吸光度。以不加Ellman试剂的溶液作为对照,同时以Tris-HCl(pH 8.0)代替样品测定空白值。每个样品测定3 次取平均值。
总巯基含量的测定:准确量取1.0 mL蛋白样品溶液,加入4.0 mL Tris-Gly-10 mol/L Urea溶液,再加入50 μL的Ellman试剂(10 mmol/L)。涡旋振荡混合均匀,25 ℃保温反应15 min后,在412 nm波长处测定吸光度。以不加Ellman试剂的溶液作为对照,同时测定空白值。每个样品测定3 次取平均值。巯基含量计算见式(1):
式中:73.53=10 6 /(1.36×10 4 ),1.36×10 4 为Ellman试剂的摩尔消光系数/(L/(mol·cm));A 412 nm =加Ellman试剂时样品溶液吸光度-不加Ellman试剂时样品溶液吸光度;D为稀释系数;c为样品蛋白质量浓度/(mg/mL)。
二硫键含量按照式(2)进行计算:
1.3.7 PEPI和PEA热稳定性测定
通过DSC分析蛋白样品的热变性温度和焓值。精确称取蛋白样品2 mg左右并记录质量。将样品均匀平铺在铝制坩埚中密封,以空铝盒作为空白对照。样品室的氮气流量为20 L/min,扫描温度范围为20~150℃,升温速率为10 ℃/min。
1.3.8 PEPI和PEA的溶解性测定 [19]
精确称取50 mg蛋白样品分散在25 mL蒸馏水中,用1 mol/L HCl或1 mol/L NaOH溶液调节溶液pH值为2.0~10.0,用蒸馏水补加至30 mL,室温振荡20 min后,4 000 r/min离心20 min,上清液采用Bradford法测定蛋白含量,根据式(3)计算蛋白溶解性:
1.3.9 PEPI和PEA持水性和持油性测定 [20]
准确称取0.10 g蛋白样品(大豆油)于离心管中,加入5.0 mL去离子水。混匀后静置30 min,4 000 r/min离心20 min,测定上清液体积。体积减少量即为样品吸水/吸油量,持水性/持油性用每克样品吸附水/油的体积表示。
1.3.10 PEPI和PEA起泡性和泡沫稳定性测定 [21]
分别配制1.0%的蛋白溶液15 mL,调节溶液pH值为2.0、4.0、6.0、8.0、10.0,体积记为V 0 。10 000 r/min均质2 min,室温下测定总体积V 1 ,静置10 min后再次测定总体积V 2 。起泡性和泡沫稳定性分别利用式(4)、(5)进行计算:
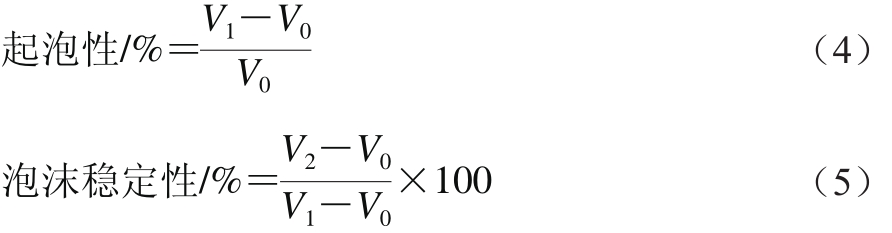
1.3.11 PEPI和PEA乳化性和乳化稳定性测定 [22]
分别配制0.10%蛋白溶液9.0 mL,调节pH值为2.0、4.0、6.0、8.0、10.0,再加3.0 mL大豆油混合,10 000 r/min均质2 min。立即从底部取50 μL乳状液,加入5 mL 0.1%的十二烷基硫酸钠溶液混匀,在500 nm波长处测定吸光度,记为A 0 。将乳化液静置10 min后,再次用上述方法测定吸光度,记为A 10 。根据式(6)、(7)分别计算乳化性和乳化稳定性:

式中:D为稀释倍数;Φ为油相的体积分数/%;L为光程(1 cm);c为乳浊液形成前蛋白溶液中的蛋白质量浓度/(g/mL);t为时间/min。
1.3.12 PEPI和PEA傅里叶变换红外光谱分析
采用溴化钾压片法测定。精确称取2.0 mg蛋白样品和200.0 mg溴化钾,研磨混合均匀后压制成片。室温下以空气为背景,光谱测量范围为4 000~400 cm -1 ,光谱分辨率为4 cm -1 ,信号扫描累加32 次。利用PeakFit v4.12软件对谱图酰胺I带1 600~1 700 cm -1 进行分析。对曲线依次进行基线校正、平滑处理、Gaussian去卷积、二阶导数拟合等数据处理,计算拟合图谱中各子峰积分面积得到二级结构的相对含量。
1.3.13 PEPI和PEA扫描电镜分析
将蛋白过100 目筛,取筛下物用双面胶黏在样品座上。将样品座置于离子溅射仪中,在样品表面蒸镀1 层10~20 nm厚的铂金膜,调节电镜至最佳拍摄视野,并放大倍数,观察并拍摄照片。
实验结果以  ±s表示。采用Origin 8.0软件进行数据图像处理,SPSS 20.0软件进行统计和差异显著性分析,P小于0.05为显著性差异。
±s表示。采用Origin 8.0软件进行数据图像处理,SPSS 20.0软件进行统计和差异显著性分析,P小于0.05为显著性差异。
杏鲍菇水分、粗纤维、总糖以及灰分质量分数(以干质量计)分别为(7.23±0.06)%、(7.66±0.17)%、(34.98±0.66)%、(4.99±0.04)%;蛋白质量分数为(17.57±0.90)%,高于云耳(Auricularia auricula)(10.3%)、银耳(Tremella fuciformis)(9.6%)及岩耳(Umbilicari)(9.0%)的蛋白质量分数 [23] ;粗脂肪质量分数仅为(0.76±0.02)%,说明杏鲍菇是一种高蛋白低脂肪的营养食品,可作为一种潜在的蛋白来源。
Osborne法分级分离PEPI结果表明,杏鲍菇中的PEA、球蛋白、醇溶蛋白和谷蛋白分别占总蛋白的81.12%、5.38%、4.03%和9.47%。PEPI主要以PEA为主,谷蛋白、球蛋白和醇溶蛋白的含量较低。
表1 PEPI、PEA和乳清蛋白、大豆蛋白的氨基酸组成和必需氨基酸评价比较
Table 1 Comparison of amino acid composition and essential amino acids of PEPI, PEA, whey protein and soy protein
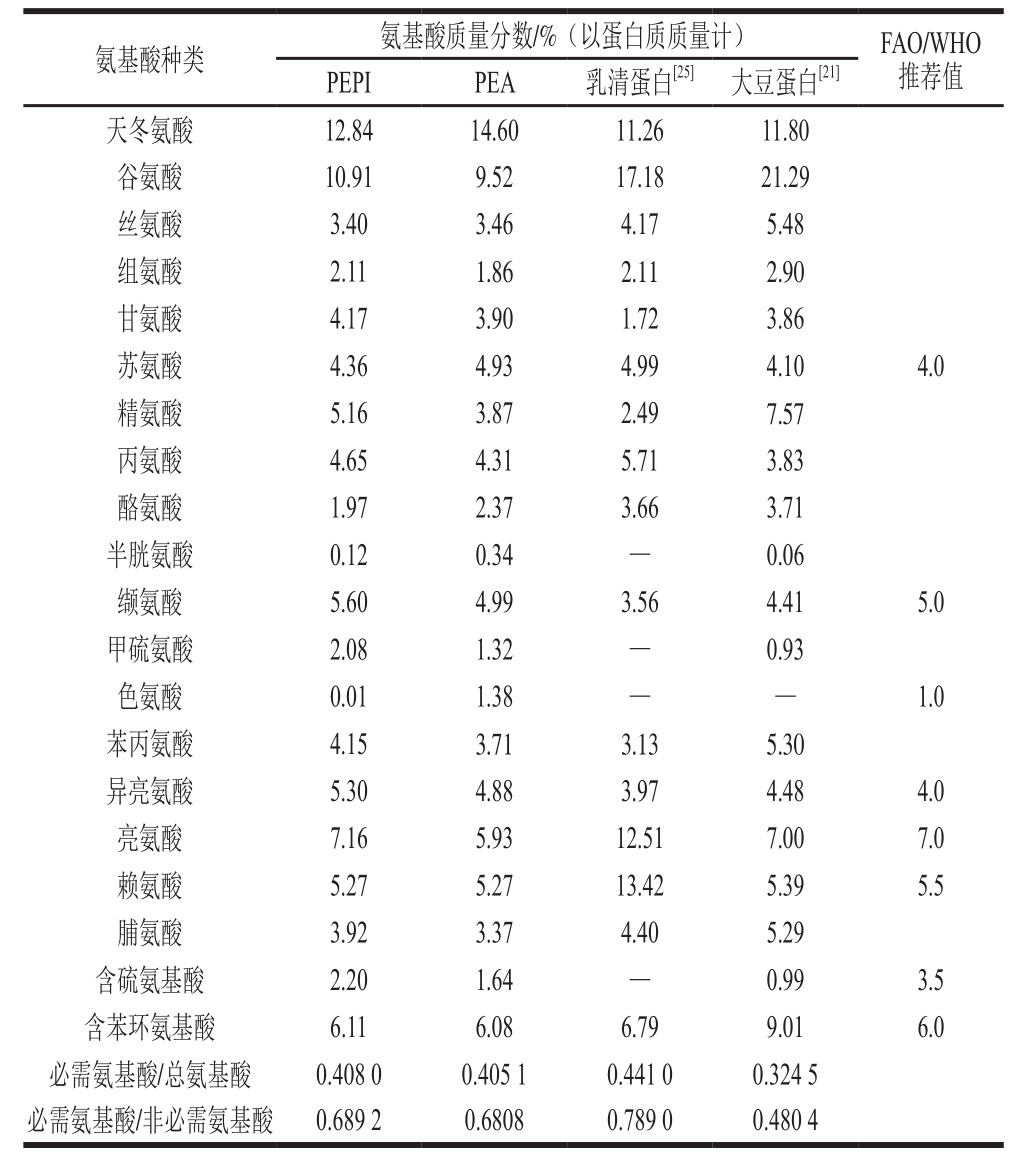
注:—.未报道。
由表1可知,天冬氨酸和谷氨酸均为酸性氨基酸,是PEPI和PEA氨基酸的主要成分,分别占12.84%、14.60%和10.91%、9.52%,与大多数贮藏蛋白相一致 [24] 。PEPI和PEA含有人体所必需的8 种氨基酸,必需氨基酸占总氨基酸的比例分别为40.80%和40.51%,略低于乳清蛋白(44.10%) [25] ;必需氨基酸与非必需氨基酸的比值分别为0.689 2和0.680 8,高于大豆蛋白(0.480 4) [21] ,均符合FAO/WHO提出的理想蛋白质规定(40%和0.6) [26] ,表明杏鲍菇蛋白可作为一种优质的蛋白来源。从必需氨基酸评价分析,PEPI和PEA的第1限制氨基酸分别为色氨酸和含硫氨基酸;第2限制氨基酸分别为含硫氨基酸和亮氨酸;赖氨酸是PEPI和PEA的第3限制氨基酸。PEPI和PEA中苏氨酸、异亮氨酸、赖氨酸等必需氨基酸含量高于FAO/WHO的推荐值。因此PEPI和PEA可作为一种营养功能成分添加到食品中以提高食品品质。
表面疏水性是测定蛋白质表面存在的疏水基团数量的指标,对评价蛋白分子的构象以及蛋白结构的稳定性和功能性质起关键作用 [27] 。如表2所示,PEA的表面疏水性(265.25)显著高于PEPI(164.27)(P<0.01),与之前研究报道的白木通种子(Akebia trifoliata var.australis)的结果相似 [28] 。表面疏水性有差异可能是由于蛋白质的氨基酸组成、三级构象不同所致。此外,蛋白在溶液中通过疏水相互作用或二硫键聚集发生折叠,降低表面疏水性 [28] 。
巯基和二硫键是维系蛋白空间结构的重要化学键。由表2可知,PEPI的总巯基含量(67.80 μmol/g)高于PEA(61.53 μmol/g)(P<0.05),表明PEPI更易与水结合。二硫键是共价键,能使肽链的空间结构更加紧密,与含硫氨基酸含量有关。PEPI的二硫键含量比PEA高,可能是PEA含硫氨基酸含量低,导致其二硫键含量低。二硫键通常被认为与蛋白的热稳定性相关,二硫键含量越高,打破二硫键使蛋白伸展所需的能量大,热变性温度也越高 [29] 。因此二硫键含量高的蛋白,表明其热稳定性好,结构更稳定。PEPI的二硫键含量高,表明其在食品加工热处理时稳定性高。
表2 PEPI和PEA的表面疏水性、巯基和二硫键含量
Table 2 Surface hydrophobicity, and sulfydryl and disulfide bond contents of PEPI and PEA

注:同行不同小写字母表示组间差异显著,P<0.05。
蛋白在加热过程中抵制聚集的能力是衡量其热稳定性的标准。蛋白的热稳定性用变性温度T和诱导变性所需的能量变性焓ΔH表示。DSC曲线中最大峰对应温度和峰面积即为T和ΔH。如图1所示,PEA的变性温度(100.98 ℃)低于PEPI(108.27 ℃),其可能原因是PEA二硫键含量较低。ΔH反映蛋白分子的疏水性和亲水性以及聚集程度,与蛋白二级结构的有序含量有关,吸热峰表示蛋白分子由于加热经历解折叠过程 [28] 。PEA的热变性焓(65.34 J/g)小于PEPI(86.44 J/g),推断其β-折叠有序结构所占比例较低,分子相对舒展,分子内部疏水性残基较多。此外,峰的宽窄与蛋白变性转变有关,峰宽表示变性时间长,热变性协同性差 [29] ,表明PEPI和PEA可能是由不同亚基组成的一类蛋白。
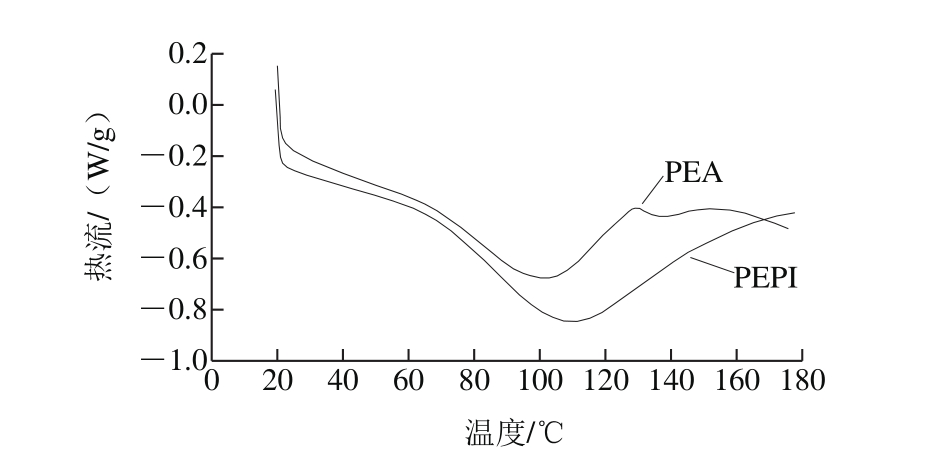
图1 PEPI和PEA的DSC图
Fig. 1 DSC graphs of PEPI and PEA
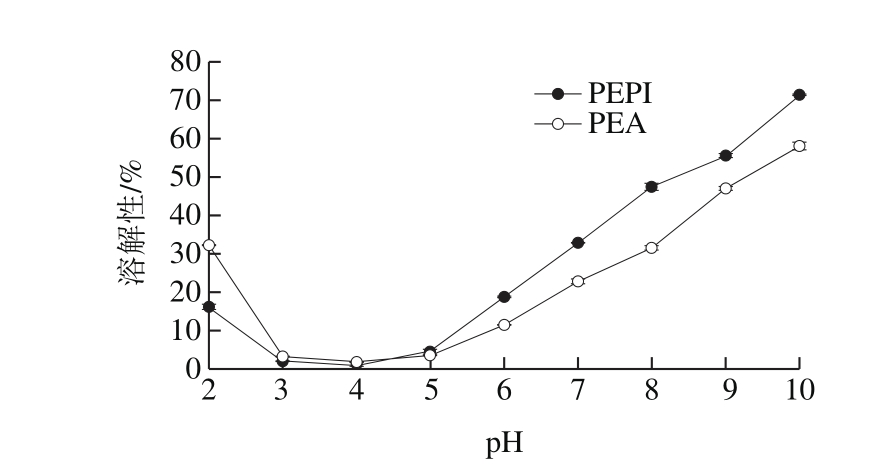
图2 PEPI和PEA溶解性
Fig. 2 Solubility of PEPI and PEA
如图2所示,随着pH值的增大,PEPI和PEA的溶解性先降低后升高,在pH值为4时蛋白分子表面正负电荷相等,处于中性状态,溶解性最小;当pH值小于或大于4时,蛋白分子表面出现较多的正或负电荷,静电斥力作用和蛋白离子水合作用增加,溶解性升高。这些结果与之前鸡腿菇蛋白、黑木耳蛋白及羊肚菌蛋白研究结果类似 [30-32] 。当pH值为7时,PEPI和PEA的溶解性均小于大豆蛋白(36.46%)和鸡蛋蛋白(91.39%) [33] 。此外,pH值在2~3之间时,PEPI溶解性较低,可能与其等电点较低有关。当pH值大于3时,PEPI的溶解性较高,这与其总巯基含量较高、表面疏水性较低相符。由于普通蛋白饮料的pH值为6.8~7.0,因此PEPI在蛋白饮料生产中的应用性优于PEA。
蛋白与水的结合能力受氨基酸组成、蛋白构象、表面极性和疏水性比值的影响 [24] 。PEPI的持水性(3.58 mL/g)显著高于PEA(1.64 mL/g)(P<0.05),PEPI持水性较大的原因可能是极性氨基酸残基较多,与水分子的作用较强。当蛋白的持水性为1.49~4.71 mL/g 时,较适合用于如汤、肉汁等黏性食品及焙烤食品 [18] 。由此可见,PEPI和PEA均可作为黏性食品中的重要成分。
持油性是蛋白质的非极性侧链对油脂的结合,用来衡量蛋白的吸油能力。PEPI的持油性(8.36 mL/g)显著高于PEA(5.59 mL/g)(P<0.05),PEPI和PEA持油性不同可能与其表观结构不同有关。
起泡性是指蛋白溶液在搅打过程中产生泡沫的能力;泡沫稳定性表示蛋白具有足够的黏度以维持泡沫并防止破裂和聚结的能力。由图3A可知,在pH 2~10范围内,PEPI和PEA的起泡性先减小后增大,pH值为4时,PEPI和PEA的起泡性最低。这可能是由于在等电点时,蛋白溶解度低,蛋白沉淀较多,导致结合空气-水界面的蛋白不足,蛋白起泡性较小。随pH值的升高,蛋白质的净电荷增加,削弱了疏水性相互作用,增加了蛋白的柔韧性,起泡性得到提高。此外,PEPI的起泡性高于PEA,可能是因为PEPI在水中易溶,并且与水的作用增强后会提高蛋白的伸展性,气泡形成能力提升 [34] 。除pH值为8外,PEA的泡沫稳定性高于PEPI(图3B)。这可能是因为当pH值为8时,PEPI的蛋白浓度较高,蛋白质间分子作用较强,溶液黏度较大,因而呈现出较好的泡沫稳定性。当pH值较高时,泡沫稳定性降低可能是由于带相同负电蛋白分子间斥力的作用 [30] 。蛋白溶解性、柔韧性、膜的气体渗透性和强度以及泡沫的流变性能均会影响泡沫稳定性 [35] 。总之,PEPI可作为一种发泡成分添加到不同食品中。
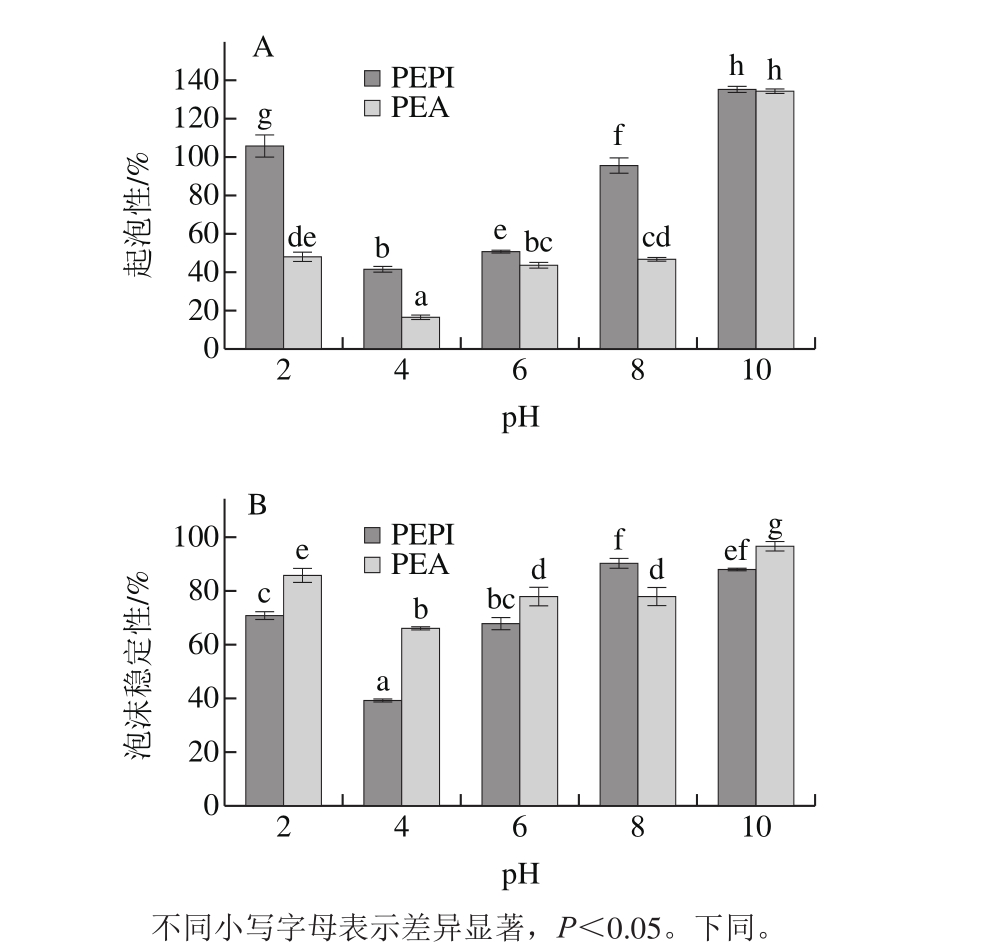
图3 不同pH值条件下PEPI和PEA的起泡性(A)和泡沫稳定性(B)
Fig. 3 Foaming capacity (A) and foam stability (B) of PEPI and PEA at different pH levels
乳化性表示蛋白乳液的形成能力,乳化稳定性是蛋白在规定时间内形成稳定乳状液能力的量度 [18] 。如图4A所示,在PEPI和PEA等电点处,净电荷几乎为零,其胶体作用较弱,乳化性较小,分别为31.52 m 2 /g和51.79 m 2 /g;除pH 4外,PEPI乳化性相比PEA较高,蛋白乳化性与pH值的关系跟溶解度与pH值关系相似。有研究表明 [24] ,乳化性可能受溶解度和表面疏水性单独或交互作用的影响。此外,蛋白表面疏水性的增强和蛋白表面亲水-疏水的平衡可以抑制蛋白与水的相互作用,提高蛋白的柔韧性,使蛋白扩散到空气-水界面速率更快 [24] 。图4B显示PEPI和PEA乳化稳定性随pH值升高呈现先降低后升高的趋势。在pH值接近等电点时,蛋白质的排斥力弱,有利于液滴的乳化聚合,乳化稳定性差。相反,当油滴周围电荷很高时,静电斥力有助于维持液滴稳定和延缓乳液聚合 [36] 。在食品加工过程中,常出现乳状液失稳的问题,因此乳化稳定性较高的PEPI在食品行业中有较大的优势 [28] 。

图4 不同pH值条件下PEPI和PEA的乳化性(A)和乳化稳定性(B)
Fig. 4 Emulsifying capacity (A) and emulsion stability (B) of PEPI and PEA at different pH levels
由图5可知,PEPI和PEA的光谱相似,有几个特征峰发生了变化,说明PEPI和PEA的氨基酸残基不同。蛋白质在红外区有若干特征吸收带,其中酰胺I带(1 600~1 700 cm -1 )的谱峰主要与氨基酸残基的C=O伸缩振动有关,反映α-螺旋、β-折叠、无规则卷曲和β-转角结构等信息 [37] 。
利用PeakFit v4.12软件对酰胺I带分析可知,PEPI二级结构主要由β-折叠和β-转角组成,相对含量分别为34.17%和35.21%。α-螺旋相对含量为22.39%,无规则卷曲最少,为8.23%。PEA的β-转角相对含量最高(39.44%),其次是β-折叠(26.66%),α-螺旋(18.75%)和无规则卷曲(15.14%)。PEPI有序结构(α-螺旋+β-折叠)相对含量(56.55%)高于PEA(45.42%),表明其整个分子构象有序,二级结构较稳定。PEPI的β-折叠较高,需要解折叠的能量大,与其热变性焓ΔH值较高相吻合。

图5 PEPI和PEA的傅里叶变换红外光谱图
Fig. 5 FTIR spectra of PEPI and PEA
利用扫描电镜对蛋白样品表面形貌进行二次电子信号成像。蛋白的表观形态主要影响其功能特性,如持水持油性、乳化性能等。由图6可知,PEA表面呈山脊状,局部有空洞,结构较为紧密;PEPI表面多孔,且孔径较小,呈蜂巢状。蜂巢结构具有良好的物理截留作用,主要改善蛋白的持水和持油性 [38] 。由此推断,PEPI的持水和持油性较好可能与其结构有关。

图6 PEA(a)和PEPI(b)的扫描电镜图
Fig. 6 Scanning electron micrographs of PEA (a) and PEPI (b)
杏鲍菇干粉中蛋白质量分数为17.57%,PEA占总分离蛋白组分的81.12%。PEPI和PEA中均含18 种氨基酸,其中天冬氨酸和谷氨酸是主要氨基酸,苏氨酸、异亮氨酸、赖氨酸等必需氨基酸含量高于FAO/WHO的推荐值。与PEPI相比,PEA表面疏水性较高,总巯基含量、溶解性和持水性较低;PEPI的含硫氨基酸含量较多,二硫键含量高,热变性温度高,有序结构(α-螺旋+β-折叠)含量高于PEA,二级结构较稳定。PEPI和PEA的溶解性、起泡性、泡沫稳定性、乳化性及乳化稳定性随pH值变化均呈现先减小后增大的趋势。PEPI呈蜂巢结构,物理截留作用较好,持油性高于PEA。在中性环境下,PEPI相比PEA具有较好的理化和功能特性。本研究结果为杏鲍菇蛋白产品开发及在食品加工中的应用提供实验支撑。
参考文献:
[1] MARIGAA M, PEI F, YANG W J, et al. Immunopotentiation of Pleurotus eryngii (DC. ex Fr.) Quel[J]. Journal of Ethnopharmacology,2014, 153(3): 604-614. DOI:10.1016/j.jep.2014.03.006.
[2] 王恒生, 刁治民, 陈克龙, 等. 杏鲍菇的研究进展及开发应用[J]. 青海草业, 2014, 23(2): 26-30.
[3] 宋宗民, 霍军平. 林地杏鲍菇种植技术[J]. 中国果菜, 2011(9): 16.
[4] 吴素蕊, 赵春艳, 邰丽梅, 等. 2012年—2014年我国食用菌生产区域产量和品种布局情况分析[J]. 中国食用菌, 2016(4): 1-4.DOI:10.13629/j.cnki.53-1054.2016.04.001.
[5] MISHRA K K, PAL R S, ARUNKUMAR R, et al. Antioxidant properties of different edible mushroom species and increased bioconversion eきciency of Pleurotus eryngii using locally available casing materials[J]. Food Chemistry, 2013, 138(2/3): 1557-1563.DOI:10.1016/j.foodchem.2012.12.001.
[6] YANG Z, XU J, FU Q, et al. Antitumor activity of a polysaccharide from Pleurotus eryngii on mice bearing renal cancer[J]. Carbohydrate Polymers, 2013, 95(2): 615-620. DOI:10.1016/j.carbpol.2013.03.024.
[7] CHEN J, MAO D, YONG Y, et al. Hepatoprotective and hypolipidemic effects of water-soluble polysaccharidic extract of Pleurotus eryngii[J]. Food Chemistry, 2012, 130(3): 687-694. DOI:10.1016/j.foodchem.2011.07.110.
[8] 黄家福, 林娇芬, 欧一新, 等. 杏鲍菇甲壳素对大鼠实验性脂肪肝的预防作用[J]. 食品科学, 2016, 37(5): 219-222. DOI:10.7506/spkx1002-6630-201605039.
[9] 张化朋, 张静, 刘阿娟, 等. 杏鲍菇营养成分及生物活性物质分析[J].营养学报, 2013, 35(3): 307-309. DOI:10.13325/j.cnki.acta.nutr.sin.2013.03.002.
[10] 黄倩, 岳田利, 袁亚宏, 等. 响应面试验优化超声-真空提取杏鲍菇多糖工艺[J]. 食品科学, 2015, 36(16): 77-82. DOI:10.7506/spkx1002-6630-201516014.
[11] MA G, YANG W, FANG Y, et al. Antioxidant and cytotoxicites of Pleurotus eryngii residue polysaccharides obtained by ultrafiltration[J].LWT-Food Science and Technology, 2016, 73: 108-116. DOI:10.1016/j.lwt.2016.05.049.
[12] 刘庆, 李超, 耿中华, 等. 碱提酸沉法制备杏鲍菇蛋白质的工艺优化[J].食品工业, 2013(10): 145-148.
[13] 张梦甜, 杨文建, 裴斐, 等. 响应面法优化酶法制备杏鲍菇蛋白及其营养评价[J]. 食品科学, 2015, 36(13): 125-130. DOI:10.7506/spkx1002-6630-201513024.
[14] 漆倩涯, 贠建民, 黄玉琴, 等. 超声破碎辅助蜗牛酶提取杏鲍菇蛋白工艺优化[J]. 食品科学, 2016, 37(22): 85-91. DOI:10.7506/spkxl002-6630-201622012.
[15] 程菲儿, 赵宇宏, 赵凡, 等. 杏鲍菇多肽生物活性的研究[J].食品工业科技, 2014, 35(17): 347-350. DOI:10.13386/j.issn1002-0306.2014.17.069.
[16] 毛晓英. 核桃蛋白质的结构表征及其制品的改性研究[D]. 无锡: 江南大学, 2012: 17-18.
[17] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta, 1980, 624(1): 13-20.DOI:10.1016/0005-2795(80)90220-2.
[18] HU H, ECY L C, WAN L, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids, 2013, 32(2): 303-311.DOI:10.1016/j.foodhyd.2013.01.016.
[19] DU M X, XIE J H, GONG B, et al. Extraction, physicochemical characteristics and functional properties of Mung bean protein[J].Food Hydrocolloids, 2017, 76: 131-140. DOI:10.1016/j.foodhyd.2017.01.003.
[20] EE-SAN T, NGOH Y Y, CHEE-YUEN G. A comparative study of physicochemical characteristics and functionalities of pinto bean protein isolate (PBPI) against the soybean protein isolate (SPI) after the extraction optimisation[J]. Food Chemistry, 2014, 152(2): 447-455.DOI:10.1016/j.foodchem.2013.12.008.
[21] KAUSHIK P, DOWLING K, MCKNIGHT S, et al. Preparation,characterization and functional properties of flax seed protein isolate[J]. Food Chemistry, 2016, 197(Pt A): 212-220. DOI:10.1016/j.foodchem.2015.09.106.
[22] JAIN S, ANAL A K. Optimization of extraction of functional protein hydrolysates from chicken egg shell membrane (ESM) by ultrasonic assisted extraction (UAE) and enzymatic hydrolysis[J]. LWT-Food Science and Technology, 2016, 69: 295-302. DOI:10.1016/j.lwt.2016.01.057.
[23] 高燕红, 鲁琳, 刘应亮. 6 种食用菌蛋白质与氨基酸的含量分析及评价[J]. 现代预防医学, 2010, 37(10): 1843-1846.
[24] DU Y, JIANG Y, ZHU X, et al. Physicochemical and functional properties of the protein isolate and major fractions prepared from Akebia trifoliata var. australis seed[J]. Food Chemistry, 2012, 133(3):923-929. DOI:10.1016/j.foodchem.2012.02.005.
[25] PEÑA-RAMOS E A, XIONG Y L, ARTEAGA G E. Fractionation and characterisation for antioxidant activity of hydrolysed whey protein[J]. Journal of the Science of Food & Agriculture, 2004, 84(14):1908-1918. DOI:10.1002/jsfa.1886.
[26] FAO/WHO. Energy and protein requirements[R]. Geneva: World Health Organization, 1973.
[27] CHANDRAPALA J, ZISU B, PALMER M, et al. Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J]. Ultrasonics Sonochemistry, 2011, 18(5):951-957. DOI:10.1016/j.ultsonch.2010.12.016.
[28] YU M, ZENG M, QIN F, et al. Physicochemical and functional properties of protein extracts from Torreya grandis seeds[J]. Food Chemistry, 2017, 227: 453. DOI:10.1016/j.foodchem.2017.01.114.
[29] 李永武. 绿豆清蛋白的提取及其功能特性和理化性质研究[D].大庆: 黑龙江八一农垦大学, 2014: 15-16.
[30] 赵春江, 孙进, 程玉, 等. 鸡腿菇子实体蛋白提取工艺优化及其特性研究[J]. 中国食品学报, 2012, 12(7): 88-96. DOI:10.16429/j.1009-7848.2012.07.016.
[31] 李福利, 张莉, 于国萍. 超声波辅助碱法提取黑木耳蛋白质及其性质研究[J]. 食品安全质量检测学报, 2015(6): 2092-2099.
[32] 张强, 吴彩娥. 羊肚菌菌丝体蛋白的理化特性及抗氧化活性[J].浙江农业学报, 2016, 28(8): 1408-1415. DOI:10.3969/j.issn.1004-1524.2016. 08.20.
[33] 彭菁, 章梦琦, 邢梦珂, 等. 沙米麸皮和外胚乳分离蛋白的理化及功能性质[J]. 食品科学, 2017, 38(13): 71-76. DOI:10.7506/spkx1002-6630-201713012.
[34] MUNDI S, ALUKO R E. Physicochemical and functional properties of kidney bean albumin and globulin protein fractions[J]. Food Research International, 2012, 48(1): 299-306. DOI:10.1016/j.foodres.2012.04.006.
[35] DENG Q, WANG L, WEI F, et al. Functional properties of protein isolates, globulin and albumin extracted from Ginkgo biloba seeds[J]. Food Chemistry, 2011, 124(4): 1458-1465. DOI:10.1016/j.foodchem.2010.07.108.
[36] YULIANA M, CHI T T, HUYNH L H, et al. Isolation and characterization of protein isolated from defatted cashew nut shell:influence of pH and NaCl on solubility and functional properties[J].LWT-Food Science and Technology, 2014, 55(2): 621-626.DOI:10.1016/j.lwt.2013.10.022.
[37] 王世新, 杨强, 李新华. 水分对冷冻小麦面团质构及面筋蛋白二级结构的影响[J]. 食品科学, 2017, 38(9): 149-155. DOI:10.7506/spkx1002-6630-201709024.
[38] 孙崇臻, 武文佳, 闵甜, 等. 不同制备方法桑叶蛋白功能性质的比较[J]. 现代食品科技, 2015(12): 242-249. DOI:10.13982/j.mfst.1673-9078.2015.12.036.
Physicochemical and Functional Properties of Pleurotus eryngii Protein Isolate and Albumin
WEI Junhui, XUE Yuan, FENG Li, ZHANG Ruoxi, WANG Xiaojing, LEI Hongjie*, XU Huaide*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Abstract: Protein isolate (PEPI) was extracted from Pleurotus eryngii by alkali dissolution followed by acid precipitation and the major protein components were isolated by the Osborne method. Their physicochemical and functional properties were studied. Results showed that the protein content of P. eryngii was 17.57% (dry mass), and the mainly protein fraction was albumin (PEA), accounting for 81.12% of the total protein isolate. Both PEPI and PEA contained 18 amino acids with essential amino acids accounting for 40.80% and 40.51% of the total, respectively. The surface hydrophobicity of PEA(265.25) was significantly higher compared to that of PEPI (164.27) (P < 0.05), while the contents of total sulfhydryl group and disulfide bonds were lower, which were 61.53 and 10.39 μmol/g, respectively. The thermal denaturation temperature of PEA (100.98 ℃) was lower than that of PEPI (108.27 ℃) and water holding capacity (1.64 mL/g) and oil holding capacity(5.59 mL/g) were significantly lower than those of PEPI (3.58 and 8.36 mL/g) (P < 0.05). The solubility, foaming capacity,foam stability, emulsifying property and emulsion stability of PEPI and PEA showed similar trend with pH, and were the lowest at pI. Fourier transform infrared spectroscopy (FTIR) showed that the secondary structures of PEPI and PEA consisted mainly of β-sheet and β-turn. Scanning electron microscopy showed that PEPI possessed a honeycomb structure.Compared to PEA, PEPI exhibited better functional properties.
Keywords: Pleurotus eryngii; protein isolate; albumin; physicochemical properties; functional properties
WEI Junhui, XUE Yuan, FENG Li, et al. Physicochemical and functional properties of Pleurotus eryngii protein isolate and albumin[J]. Food Science, 2018, 39(18): 54-60. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201818009.http://www.spkx.net.cn
魏君慧, 薛媛, 冯莉, 等. 杏鲍菇分离蛋白和清蛋白的理化性质及功能分析[J]. 食品科学, 2018, 39(18): 54-60.DOI:10.7506/spkx1002-6630-201818009. http://www.spkx.net.cn
文章编号: 1002-6630(2018)18-0054-07
引文格式:
中图分类号: TS201.21
文献标志码: A
*通信作者简介: 雷宏杰(1984—),男,讲师,博士,研究方向为果蔬加工与食品生物技术。E-mail:leihongjie000@163.com徐怀德(1964—),男,教授,学士,研究方向为饮料加工、果品蔬菜贮藏与加工、天然产物提取。E-mail:xuhuaide@aliyun.com
DOI: 10.7506/spkx1002-6630-201818009
基金项目: 杨凌示范区产学研用协同创新重大项目(2016CXY-14)
第一作者简介: 魏君慧(1992—),女,硕士研究生,研究方向为果蔬加工与贮藏。E-mail:weijunhui1231@163.com
收稿日期: 2017-08-17