
图1 样品序列长度分布图
Fig. 1 Length distribution profile of trimed sequences
高乾坤,焦琳舒,杜贺超,陆兆新,别小妹,吕凤霞*
(南京农业大学食品科学技术学院,江苏 南京 210095)
摘 要: 研究不同产地带鱼微生物群落的多样性,并探究其在冷藏过程中菌相的变化,利用高通量测序分析对产自江苏南通吕四港黄海海域和浙江舟山港东海海域的带鱼样品进行分析。结果表明:不同产地的新鲜带鱼样品菌群结构有很大差异,在属水平上,江苏南通吕四港带鱼样品中微生物主要以嗜冷菌属、栖热菌属与假交替单胞菌为主,而浙江舟山港带鱼样品中微生物菌属组成丰富,有7 种菌属的相对丰度相差不大,均为10%左右;冷藏6~8 d后,两种产地带鱼样品都以嗜冷菌属与Oceanisphaera为优势腐败菌属,两者相对丰度超过89%,对带鱼腐败变质影响显著。两种产地带鱼样品冷藏过程中细菌群落多样性及菌群结构变化,反映了带鱼在冷藏过程中潜在的卫生质量风险,可为后期带鱼冷藏过程质量安全监测及带鱼的防腐保鲜研究提供依据。
关键词: 带鱼;高通量测序;嗜冷杆菌属;Oceanisphaera
带鱼(Trichiurus haumela)是我国的主要海洋经济鱼种之一,其广泛分布于我国沿海各省并以东海产量最高,其味道鲜美,营养价值高,具有很高的经济效益。带鱼中富含不饱和脂肪酸,相比于家禽肉类,如牛肉、猪肉和鸡肉等,更易被人体吸收 [1] 。但同样因为其较高的脂肪酸含量比例,使其相较于其他家禽肉类更易氧化、腐败变质。另外,带鱼属于深海鱼种,生活在深水区,当被捕捞上岸之后便会死亡,不能像淡水鱼一样在捕捞、运输甚至销售过程中一直保持鲜活。因此,带鱼的防腐保鲜对于其发挥更大的经济效益,便成为一个至关重要的问题 [2-3] 。
带鱼的腐败,主要是由于腐败微生物引起的。鱼体是一个优良的天然“培养基”,富含各种营养基质,微生物会在鱼体快速繁殖生长,逐渐引起腐败。对这些致腐微生物的研究,是防腐的首要关键 [4] 。常用的腐败菌分析方法有传统的微生物培养分离、荧光定量聚合酶链式反应(polymerase chain reaction,PCR)与变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)等方法 [5-8] ,但是由于细菌之间的相互作用复杂,部分微生物培养条件困难,传统方法无法准确分离鉴定样品腐败期间细菌群落组成。有研究者将传统分离方法与16S rRNA分子鉴定技术相结合,对带鱼冷藏过程中的主要腐败微生物进行分离与快速鉴定发现,带鱼的主要优势腐败菌为腐败希瓦氏菌(Shewanella putrefaciens)与荧光假单胞菌(Pseudomonas fluorescens),但由于传统分离检测方法的局限性,仍无法对带鱼冷藏过程中微生物群落结构变化进行全面分析 [9-11] 。
近年来,随着分子生物学技术的发展,高通量测序技术应运而生。作为一种无需微生物分离培养的快速检测技术,高通量测序技术不仅可以检出难以培养的优势微生物,还能确定样品中大多数微生物的相对丰度 [9] 。因此,高通量测序技术已广泛应用于水土环境检测 [12-13] 、人体肠道微生物检测 [14-16] 、食品生产加工 [17-19] 等多方面。在扇贝柱 [20] 等水产品中微生物多样性分析上,高通量测序技术也是一种有效手段。
为了系统地研究不同产地带鱼从新鲜状态到腐败阶段的整个过程菌相的动态变化情况,更全面地了解带鱼贮藏过程中菌群变化规律,本实验以产自江苏南通吕四港黄海海域和浙江舟山港东海海域的带鱼为研究对象,采用Illumina Miseq高通量测序技术分析不同冷藏时间下的带鱼样品中的菌群组成情况及变化规律,为带鱼的防腐保鲜提供理论依据,也为开发水产品微生物快速鉴定方法以保障带鱼质量安全提供基础信息。
新鲜带鱼(200~250 g),当日早晨捕捞于江苏南通吕四港、浙江舟山港口,冰运至实验室。产自江苏南通的样品编号为HH,产自浙江舟山的样品编号为DH。经保鲜袋密封包装后放置于4 ℃冰箱冷藏。以购买当天带鱼作为对照组,记为0 d,其余为实验组,分别冷藏2、4、6、8 d。
细菌基因组DNA提取试剂盒 美国Omega公司;Axy Prep DNA凝胶回收试剂盒 美国Axygen公司。
5084R高速冷冻离心机 德国Eppendorf公司;PTC-100TM PCR仪 美国MJ Research公司;拍击式均质机法国Interscience公司。
1.3.1 提取DNA的样品处理
在无菌超净工作台中,将带鱼去头去尾去内脏,割取不同部位鱼肉组织,剪成块状。为保证采集样品的代表性,随机选取3 条带鱼样品进行混合。称取25 g鱼肉组织,置于无菌均质袋中,加入50 mL含0.1 g/100 mL蛋白胨的0.85 g/100 mL的生理盐水,均质10 min。经200 目无菌纱布过滤后,滤液1 000 r/min离心10 min,去沉淀,上清液于10 000 r/min离心10 min,弃上清液,沉淀重悬浮于1 mL TE buffer,-70 ℃冻存备用。
1.3.2 总DNA的提取
按照Omega公司细菌基因组DNA提取试剂盒的方法操作,提取细菌总DNA,并用1%的琼脂糖凝胶电泳检测提取效果。
1.3.3 PCR扩增及高通量测序
以提取的总细菌基因组DNA为模板,引物针对16S rRNA基因V3/V4区合成特异引物,利用338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物进行PCR扩增。扩增后的PCR产物进行2%琼脂糖凝胶电泳,经纯化后的样品进行定量检测。将检测后的样品委托上海美吉生物医药科技有限公司,进行高通量测序。
对MiSeq测序得到的双端序列数据进行处理,首先根据PE reads之间的overlap关系,将成对的reads拼接(merge)成一条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向 [21] 。
基于操作分类单元(operational taxonomic units,OTU)聚类分析结果,研究环境中微生物的多样性,通过单样本的多样性(Alpha多样性)分析微生物群落的丰度和多样性,以及对测序深度进行检测 [22] 。基于分类学信息,在各个分类水平上进行群落结构统计,综合讨论不同产地带鱼冷藏的微生物群落。

图1 样品序列长度分布图
Fig. 1 Length distribution profile of trimed sequences
采用Illumina Miseq高通量测序获得了江苏南通及浙江舟山两种产地带鱼样品的原始序列数据后,经Trimmomatic及FLASH软件优化数据后得到了10 个样本共388 229 条有效序列,序列平均长度为445.98~449.89 bp,主要集中在441~460 bp的区间长度内(图1)。随着样品量的不断增大,在样品量大于20 000时,OUT曲线(图2A)和Shannon-Wiener曲线趋于平坦(图2B),说明测序数据量合理,且测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息 [23] 。
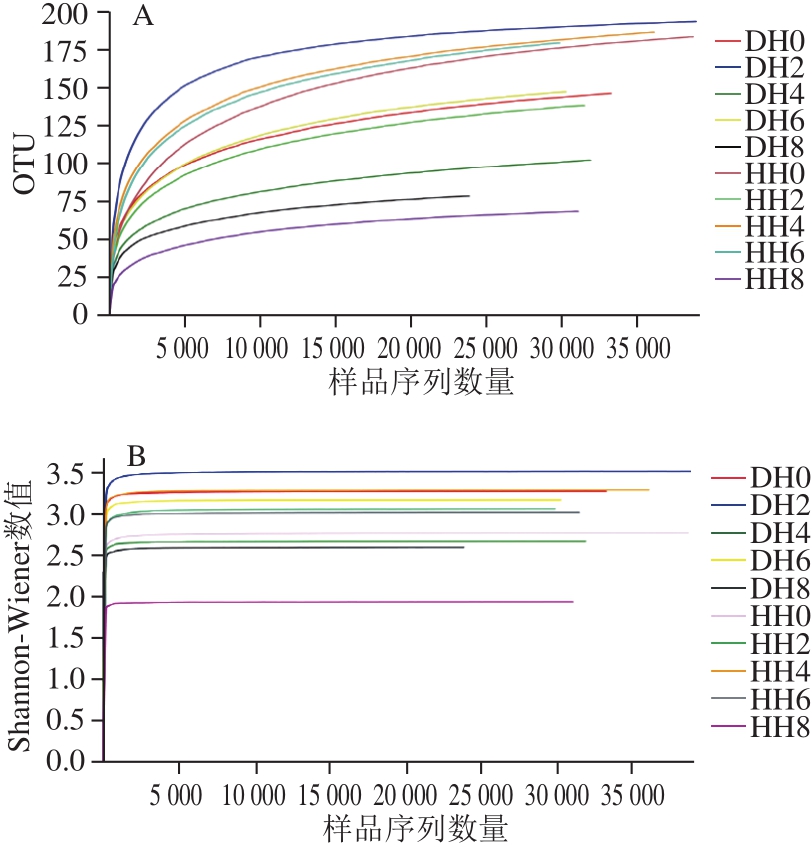
图2 稀释曲线(A)和 Shannon-Wiener曲线(B)分析
Fig. 2 Rarefaction curves (A) and Shannon-Wiener curves (B)
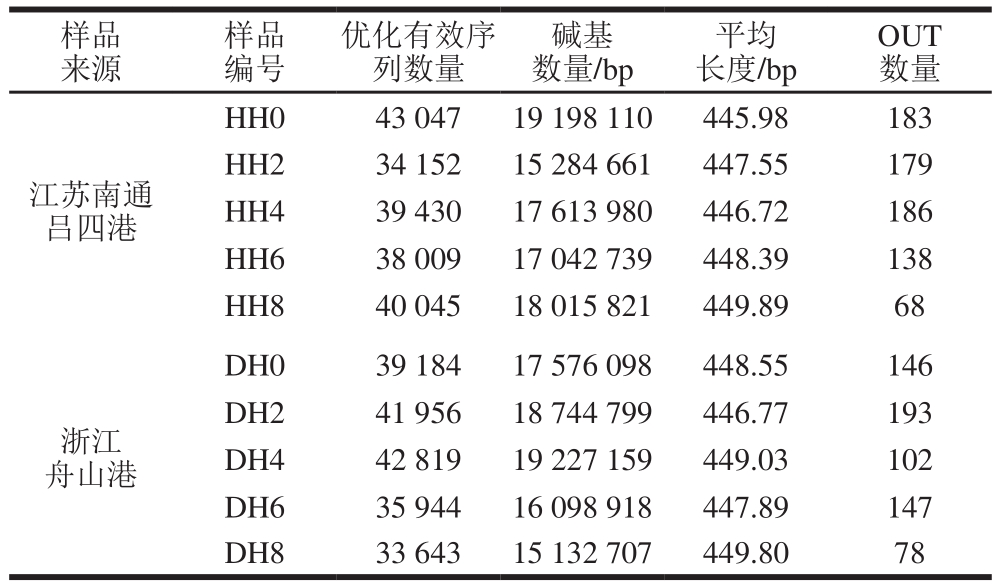
对样品进行OUT聚类分析,获得了OUT数量为209 个,涵盖了14 门,24 纲,46 目,78 科,129 属。产自江苏南通及浙江舟山的新鲜带鱼样品的OUT数量分别为183和146(表1),带鱼样品在经8 d冷藏后,OUT数量分别下降至68与78,即在冷藏期间,样品中的微生物种类在不断减少,尤其是在冷藏后期4~8 d时,OUT数量急速减少,可能是冷藏后期腐败程度较高,多种微生物无法生存导致。
表1 测序数据统计结果
Table 1 Statistical results of sequence data
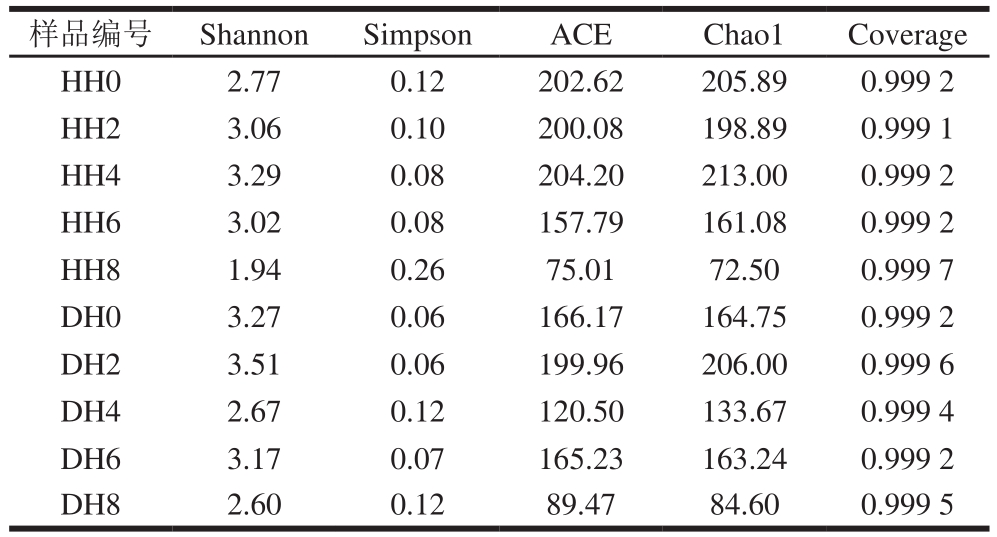
根据97%相似性水平下的OTU信息,采用Alpha多样性指标的Shannon、Simpson、ACE、Chao1及Coverage指数对样品微生物物种的丰富度和多样性进行评估。由表2可知, 各样品的Coverage都达到了0.999以上,即样品文库覆盖率高,序列未被检出的可能性较小,可用于样品细菌多样性分析。产地为江苏南通吕四港的带鱼样品的ACE、Chao1及Shannon指数在冷藏第4天时达到最高,Simpson值最低,这说明该产地带鱼在冷藏4 d后物种丰富度达到最高,可能由于此时带鱼中营养物质最为丰富,细菌生长迅速。而浙江舟山产地的带鱼样品的ACE、Chao1及Shannon指数在冷藏2 d时达到最高,冷藏6 d时,ACE、Chao1及Shannon指数略有回升,这现象可能是由腐败菌的大量增加造成的。冷藏8 d时,两种产地来源的带鱼样品的ACE、Chao1及Shannon指数均达到其最小值,Simpson值则刚好相反,这说明了在冷藏8 d后,带鱼样品中的细菌丰度及多样性最低。
表2 Alpha多样性指数
Table 2 Alpha diversity index
2.3.1 基于门水平的细菌菌群结构分析
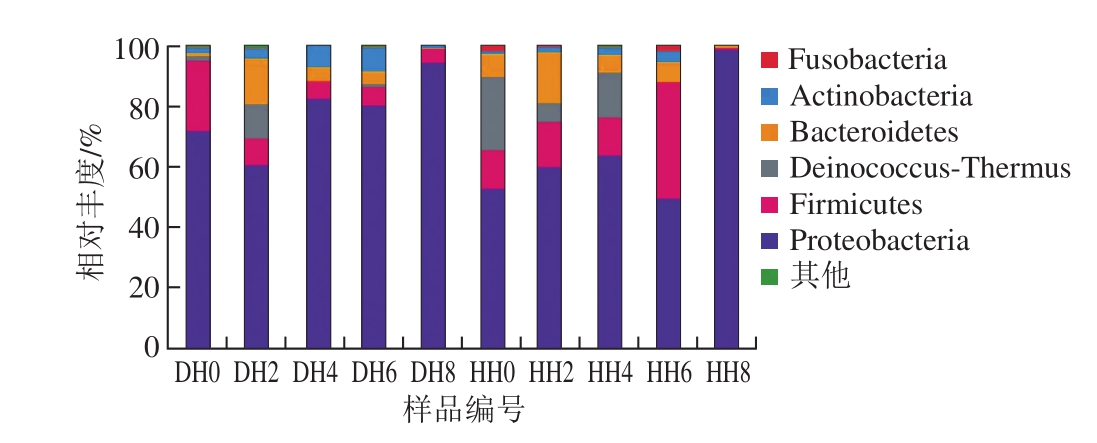
图3 基于门分类水平上的样品菌群分布图
Fig. 3 Bacterial distribution pattern at the phylum level
两种产地带鱼样本序列经RDP classifier软件进行分类分析,在门水平上,其样本群落组成如图3所示。产自江苏南通吕四港的新鲜带鱼样品总细菌组成主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、异常球菌-栖热菌门(Deinococcus-Thermus)及拟杆菌门(Bacteroidetes)组成,相对丰度分别为53.06%、12.64%、24.29%及7.51%,还包括少量的梭杆菌门(Fusobacteria)及放线菌门(Actinobacteria)。而产自浙江舟山港的新鲜带鱼样品总细菌组成主要以变形菌门与厚壁菌门为主,占据菌群总量的94.98%,余下5.02%为异常球菌-栖热菌门、拟杆菌门、梭杆菌门、放线菌门与极少量的其他门类。
在两种产地的带鱼样品整个冷藏过程期间,变形菌门始终占据优势,相对丰度为49.72%~98.84%,尤其是在冷藏后期,样品HH8与DH8中,变形菌门相对丰度皆在94%以上。其次是厚壁菌门,在江苏南通吕四港产地的带鱼样品中,第6天时,厚壁菌门相对丰度达到最高为38.39%,说明随着冷藏时间延长,厚壁菌门对带鱼的腐败变质起了越来越大的影响,其影响程度仅次于变形菌门。在两种产地的带鱼样品中,冷藏第2天,拟杆菌门的相对丰度皆有所增加,在样品HH2与DH2中产自最高可达到16.90%与15.01%,且随着冷藏时间的延长,拟杆菌门所占比例逐渐下降,直至冷藏第8天相对丰度已不足1%,说明拟杆菌门在带鱼腐败变质中并不是主要成因。
另外,两种不同产地带鱼样品之间菌落结构的主要差异为异常球菌-栖热菌门。产自浙江舟山港的带鱼样品在冷藏第0、2、6天时检出异常球菌-栖热菌门,其相对丰度分别为1.76%、11.61%和1.03%,而产自江苏南通吕四港的带鱼样品在冷藏0~4 d时都能检出异常球菌-栖热菌门,新鲜样品中相对丰度最高达到了24.29%。
2.3.2 基于属水平的细菌菌群结构分析
在属水平上,两种不同产地的带鱼样品在冷藏期间共分离得到了129 属,图4为相对丰度大于1%的菌群柱状分布图。嗜冷菌属(Psychrobacter)一直占据优势,在两种带鱼冷藏期间丰度呈上升趋势,冷藏8 d后,在江苏南通及浙江舟山产地带鱼样品中,嗜冷菌属微生物相对丰度分别达到了微生物总量的65.69%和55.88%,在带鱼腐败变质中起重要作用。现有研究报道,嗜冷菌属是低温冷藏食品的优势腐败菌,在牛奶、冷鲜肉及需冷藏海产品中都十分常见 [24-26] 。次要优势菌属为Oceanisphaera,此菌属首次报道于2003年,是分离自海底淤泥中的较为新型的菌属 [27] 。近年来相关多集中于该菌属新菌种的发现 [28-29] ,鲜见有研究发现其在水产品腐败中的作用。而通过高通量测序技术检测出Oceanisphaera是带鱼腐败变质的优势腐败菌属,这一研究结果说明,高通量测序技术可直接对待测样品中全部基因序列进行检测,可检测出无法培养的或较为新型的腐败菌,与传统分离检测技术相比更加快速全面。
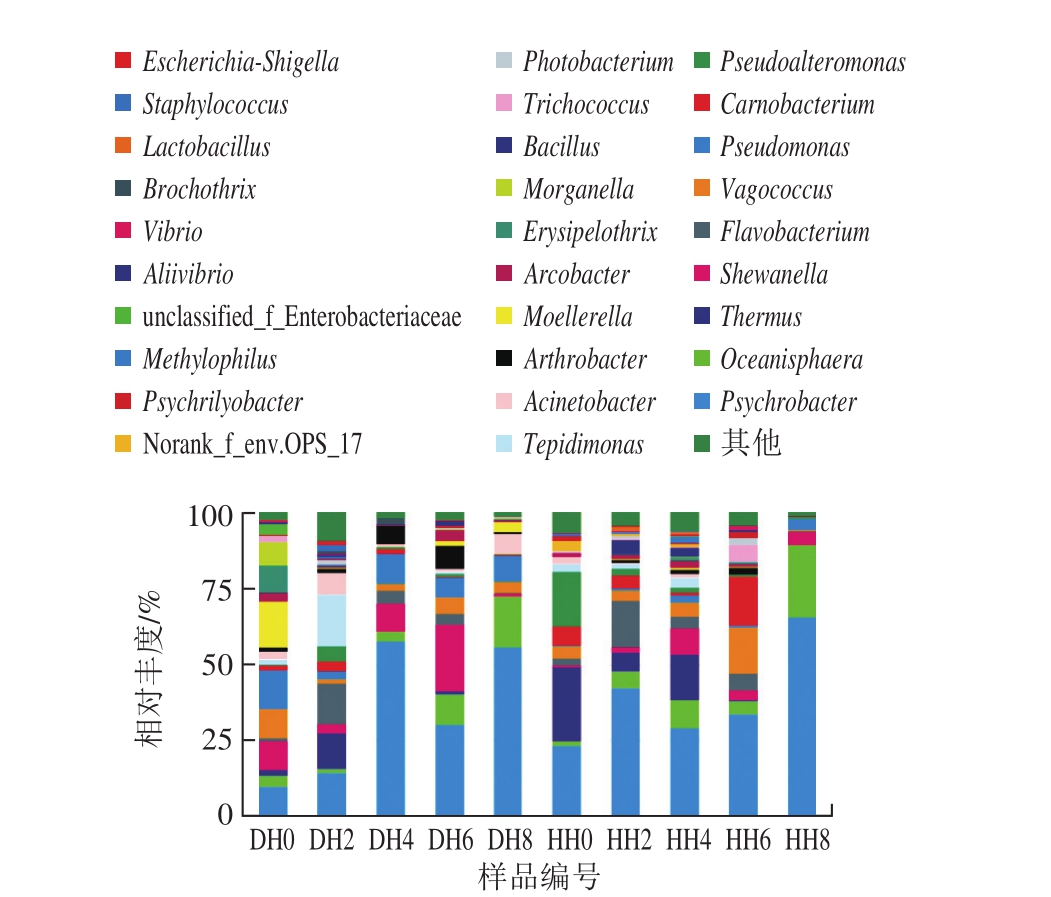
图4 基于属分类水平上的样品菌群分布图
Fig. 4 Bacterial distribution pattern at the genus level
此外,两种产地带鱼在冷藏期间微生物多样性与丰度有明显差异。产自江苏南通吕四港的带鱼样品在冷藏期间以嗜冷菌属、栖热菌属(Thermus)、Oceanisphaera、肉杆菌属(Carnobacterium)、漫游球菌属(Vagococcus)、黄杆菌属(Flavobacterium)、假交替单胞菌(Pseudoalteromonas)、希瓦氏菌属(Shewanella)为主。新鲜带鱼样品中,栖热菌属与假交替单胞菌所占比例仅次于嗜冷菌属,相对丰度分别为24.29%和17.96%。冷藏第2天后,假交替单胞菌相对丰度骤降至2.54%。冷藏第6天时,肉杆菌属与漫游球菌属含量明显增加,相对丰度分别达到16.08%与15.09%。这两属在进化关系上十分相近,是水产品的重要致病菌、腐败菌 [30-31] 。冷藏第8天时,相对丰度大于10%的仅有嗜冷菌属及Oceanisphaera两菌属,且此时微生物丰度及多样性达到最低值,即带鱼样品中的营养物质被极大的消耗,多数微生物已无法生存。
而产自浙江舟山港的带鱼样品在冷藏期间以嗜冷菌属、希瓦氏菌属、假单胞菌属(Pseudomonas)、Oceanisphaera、黄杆菌属、台湾温单胞菌属(Tepidimonas)、漫游球菌属、米勒氏菌属(Moellerella)为主。新鲜带鱼样品中,嗜冷菌属、希瓦氏菌属、假单胞菌属、漫游球菌属、米勒氏菌属、丹毒杆茵属(Erysipelothrix)、摩根菌属(Morganella)7 种菌属的相对丰度相差不大,均为10%左右。其中米勒氏菌属占最大比例为15.07%。冷藏2 d时,优势微生物种类有较大改变,黄杆菌属、台湾温单胞菌属、栖热菌属丰度提升,皆超出总微生物的10%。冷藏4~8 d时,嗜冷菌属、希瓦氏菌属、假单胞菌属、Oceanisphaera占绝对优势,带鱼腐败已基本结束,菌群组成变化较小,这4 类菌属在其腐败过程中起到了不容忽视的作用。蓝蔚青等 [9,32] 通过PCR-DGGE技术研究冷藏过程中带鱼的菌相变化时发现,嗜冷杆菌在前期亦是带鱼的优势腐败菌,与本研究结果不同的是,到腐败后期,希瓦氏菌属和弧菌属取代了嗜冷杆菌,占据优势地位。
此外,优势菌的比例与细菌总量呈正相关,在一定程度上反映样品在贮藏过程中腐败变质的情况。之前的实验结果显示,带鱼在4 ℃的贮藏过程中,菌落总数保持增长趋势。江苏南通吕四港的带鱼在贮藏2 d时,菌落总数已接近国标限量6(lg(CFU/g)),浙江舟山的带鱼在贮藏4 d时,也超过了这一限量。高通量测序的结果显示,江苏南通和浙江舟山的带鱼样品主要腐败菌嗜冷杆菌、Oceanisphaera和希瓦氏菌等也分别在第2天和第4天时呈现出上升趋势。第8天时,两个产地的样品优势腐败菌相对丰度超过89%,细菌总数和挥发性盐基氮含量都远超过了国标限量,带鱼严重腐败。说明这些优势菌与带鱼的腐败密切相关。
综上所述,带鱼在冷藏期间微生物群落以嗜冷菌属为主,两种不同产地的新鲜带鱼样品及冷藏前期的菌相差异较大,随着冷藏时间的延长,两者都以嗜冷菌属及Oceanisphaera为优势菌属,这与带鱼的深海生存环境及冷冻保藏的常规运输方式有十分重要的关系。
如图5所示,横坐标为PC1,其贡献率为41.81%。纵坐标为PC2,贡献率为25.07%。这两个主成分是样品微生物群落结构组成差异的主要因子。在PC1方向上,产自江苏南通吕四港的带鱼样品在冷藏不同时间的样本点分布差异十分显著,新鲜带鱼样本点与冷藏8 d的带鱼样本点处于PC1水平的两个极端,且冷藏2~6 d样本点分布于X轴中间,说明不同冷藏时间在PC1水平上对样品菌群结构变化影响显著;在PC2水平上,两种产地的样品点分布区域十分明显,江苏南通吕四港产地样本点基本上分布于Y轴的下方,浙江舟山产地样本点分布于Y轴的上方,即PC2是解释两种产地样品菌群结构变化的主要成分。
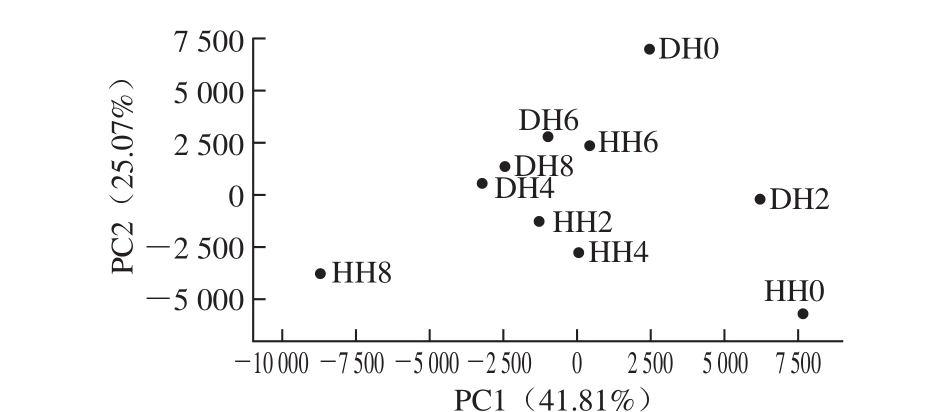
图5 样品PCA
Fig. 5 PCA scatter plot of PC1 vs. PC2 for bacterial communities
本研究以不同产地的带鱼为研究对象,采用Illumina Miseq高通量测序技术分析不同冷藏时期带鱼样品中菌群组成及变化情况。结果表明,两种产地带鱼在新鲜状态时菌相差异较大:产自江苏南通吕四港的新鲜带鱼样品以嗜冷菌属、栖热菌属与假交替单胞菌为主,相对丰度分别为23.25%、24.29%和17.96%;产自浙江舟山港的新鲜带鱼样品中菌群组成较为丰富,嗜冷菌属、希瓦氏菌属、假单胞菌属、漫游球菌属、米勒氏菌属、丹毒杆茵属、摩根菌属7 种菌属的相对丰度相差不大,均为10%左右。说明产地的区别是造成菌群组成有明显差异的主要原因。随着4 ℃贮藏时间的延长,带鱼腐败程度加剧,两个产地的带鱼菌种多样性都开始下降,由于氧气含量、温度、竞争等因素,优势菌数量逐渐增加变得显著,说明优势菌与带鱼的腐败有密切关系。并且两个产地的菌群组成愈发相近,都以嗜冷菌属与Oceanisphaera为优势腐败菌。其中嗜冷菌属作为主要优势腐败菌在带鱼腐败过程中起重要作用,而Oceanisphaera为带鱼腐败中的次要优势腐败菌,目前有关Oceanisphaera在水产品腐败中的研究尚鲜见报道。由此可见,相对于传统的分离鉴定方法,高通量测序技术在检测新型腐败菌时更具优势。高通量测序技术检测不同产地带鱼冷藏过程中微生物多样性的变化,不仅可以分析不同产地带鱼样品中微生物多样性的差异,更可以高效快速地分析带鱼腐败过程中的优势腐败菌,为今后带鱼质量安全监测及靶向研究带鱼防腐保鲜技术提供理论依据。
参考文献:
[1] 揭珍, 徐大伦, 杨文鸽. 新鲜带鱼营养成分及风味物质的研究[J].食品与生物技术学报, 2016, 35(11): 1201-1205. DOI:10.3969/j.issn.1673-1689.2016.11.013.
[2] 田晓萌, 李艺杰, 季冬青, 等. 我国带鱼保鲜技术研究进展[J].保鲜与加工, 2017, 17(4): 121-126. DOI:10.3969/j.issn.1009-6221.2017.04.022.
[3] 杨胜平, 谢晶, 高志立, 等. 冷链物流过程中温度和时间对冰鲜带鱼品质的影响[J]. 农业工程学报, 2013, 29(24): 302-310. DOI:10.3969/j.issn.1002-6819.2013.24.039.
[4] 甘柳红. 生物保鲜剂在带鱼保鲜中的应用[J]. 养殖与饲料, 2015(4):32-33. DOI:10.13300/j.cnki.cn42-1648/s.2015.04.033.
[5] ERCOLINI D. PCR-DGGE fingerprinting: novel strategies for detection of microbes in food[J]. Journal of Microbiological Methods,2004, 56(3): 297-314. DOI:10.1016/j.mimet.2003.11.006.
[6] POSTOLLEC F, FALENTIN H, PAVAN S, et al. Recent advances in quantitative PCR (qPCR) applications in food microbiology[J]. Food Microbiology, 2011, 28(5): 848-861. DOI:10.1016/j.fm.2011.02.008.
[7] 翁丽华, 江芸, 徐幸莲, 等. PCR-DGGE研究热鲜肉贮藏过程中的菌相变化[J]. 食品科学, 2012, 33(23): 199-203.
[8] LI X R, MA E B, YAN L Z, et al. Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J]. International Journal of Food Microbiology, 2011, 146(1): 31-37. DOI:10.1016/j.ijfoodmicro.2011.01.030.
[9] 蓝蔚青, 谢晶. 冷藏带鱼贮藏期间主要微生物动态变化的PCRDGGE分析[J]. 食品工业科技, 2012, 33(17): 118-122. DOI:10.13386/j.issn1002-0306.2012.17.012.
[10] DE MUINCK E J, TROSVIK P, GILFILLAN G D, et al. A novel ultra high-throughput 16S rRNA gene amplicon sequencing library preparation method for the Illumina HiSeq platform[J]. Microbiome,2017, 5(1): 68. DOI:10.1186/s40168-017-0279-1.
[11] CAPORASO J G, LAUBER C L, WALTERS W A, et al. Ultra-highthroughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J]. International Society for Microbial Ecology Journal, 2012, 6(8): 1621-1624. DOI:10.1038/ismej.2012.8.
[12] 牛世全, 龙洋, 李海云, 等. 应用Illumina MiSeq高通量测序技术分析河西走廊地区盐碱土壤微生物多样性[J]. 微生物学通报, 2017,44(9): 2067-2078. DOI:10.13344/j.microbiol.china.160824.
[13] STALEY C, UNNO T, GOULD T J, et al. Application of Illumina next-generation sequencing to characterize the bacterial community of the Upper Mississippi River[J]. Journal of Applied Microbiology,2013, 115(5): 1147-1158. DOI:10.1007/s00253-014-6213-6.
[14] QIN J, LI R, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464: 59-70.DOI:10.1038/nature08821.
[15] FRANKEL A E, FROEHLICH T W, KIM J, et al. Metagenomic shotgun sequencing to identify specific human gut microbes associated with immune checkpoint therapy efficacy in melanoma patients[J].Journal of Clinical Oncology, 2017, 19(10): 848-855. DOI:10.1016/j.neo.2017.08.004.
[16] 郑艺, 张家超, 郭壮, 等. 基于高通量测序技术分析肠道菌群及其影响因素的研究进展[J]. 中国食品学报, 2014, 14(11): 157-164.DOI:10.16429/j.1009-7848.2014.11.041.
[17] 陈泽斌, 李冰, 王定康, 等. 应用Illumina MiSeq高通量测序技术分析玉米内生细菌多样性[J]. 现代食品科技, 2016, 32(2): 113-120.DOI:10.13982/j.mfst.1673-9078.2016.2.018.
[18] 李晓然, 李洁, 刘晓峰, 等. 利用高通量测序分析云南豆豉中细菌群落多样性[J]. 食品与生物技术学报, 2014, 33(2): 137-142.DOI:10.13982/j.mfst.1673-9078.2014.12.011.
[19] DU R P, SONG G, ZHAO D, et al. Bacterial diversity and community structure during fermentation of Chinese sauerkraut with Lactobacillus casei 11MZ-5-1 by Illumina Miseq sequencing[J]. Letters in Applied Microbiology, 2017, 123(1): 139-137. DOI:10.1111/lam.12824.
[20] 赵帅, 周娜, 赵振勇, 等. 基于高通量测序分析盐角草根部内生细菌多样性及动态规律[J]. 微生物学报, 2016, 56(6): 1000-1008.DOI:10.13343/j.cnki.wsxb.20150422.
[21] ANDREEVSKAYA M, JOHANSSON P, LAINE P, et al. Genome sequence and transcriptome analysis of meat-spoilage-associated lactic acid bacterium Lactococcus piscium MKFS47[J]. Applied and Environmental Microbiology, 2015, 81(11): 3800-3811. DOI:10.1128/AEM.00320-15.
[22] LU X, LU P. Characterization of bacterial communities in sediments receiving various wastewater effluents with high-throughput sequencing analysis[J]. Microbial Ecology, 2014, 67(3): 612-623.DOI:10.1007/s00248-014-0370-0.
[23] 王伟, 冷凯良, 刘均忠, 等. 微生物扩增子高通量测序技术在水产品加工与贮藏研究中的应用[J]. 食品与发酵工业, 2017, 43(10): 263-268. DOI:10.13995/j.cnki.11-1802/ts.014760.
[24] 徐煜, 任婧. 原料乳中嗜冷菌种类及嗜冷芽孢杆菌研究进展[J]. 乳业科学与技术, 2015, 38(2): 29-32. DOI:10.7506/rykxyjs1671-5187-201502007.
[25] 孙丹丹, 卢士玲, 李开雄, 等. 贮藏温度对冷鲜羊肉微生物菌群生长变化的影响[J]. 食品工业科技, 2017, 38(4): 327-331. DOI:10.13386/j.issn1002-0306.2017.04.053.
[26] 郑振霄, 周聃, 冯俊丽, 等. 冷海水保藏下鲐鱼(Pneumatophorus japonicus)菌相变化规律及优势腐败菌的分离鉴定[J]. 现代食品科技, 2016, 32(4): 81-86. DOI:10.13982/j.mfst.1673-9078.2016.4.014.
[27] ROMANENKO L A, SCHUMANN P, ZHUKOVA N V, et al.Oceanisphaera litoralis gen. nov., sp. nov., a novel halophilic bacterium from marine bottom sediments[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(6): 1885-1888.DOI:10.1099/ijs.0.02774-0.
[28] ZHOU S, WANG H M, WANG Y W, et al. Oceanisphaera psychrotolerans sp. nova, isolated from coastal sediment samples[J].International Journal of Systematic and Evolutionary Microbiology,2015, 65(9): 2797-2802. DOI:10.1099/ijs.0.000331.
[29] LIU J, SUN Y, ZHANG D, et al. Oceanisphaera marina sp. nov.,isolated from a deep-sea seamount[J]. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(6): 1996-2000.DOI:10.1099/ijsem.0.001906.
[30] 郑勤琴, 段纲, 项勋, 等. 漫游球菌研究进展[J]. 中兽医医药杂志,2017, 36(5): 27-30. DOI:10.13823/j.cnki.jtcvm.2017.05.008.
[31] 高阳, 王俊钢, 顾燕玲, 等. 新疆额尔齐斯河流域冷水鱼肠道耐低温乳酸菌的分离筛选及其遗传差异[J]. 微生物学报, 2013, 53(1):82-91. DOI:10.13343/j.cnki.wsxb.2013.01.008.
[32] 蓝蔚青, 谢晶. PCR结合生理生化鉴定对冷藏带鱼主要细菌菌相组成分析[J]. 食品与发酵工业, 2012, 38(2): 11-17. DOI:10.13995/j.cnki.11-1802/ts.2012.02.003.
High-Throughput Sequencing Analysis of Microbial Community Diversity of Hairtail from Different Waters during Chilled Storage
GAO Qiankun, JIAO Linshu, DU Hechao, LU Zhaoxin, BIE Xiaomei, LÜ Fengxia*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: To investigate the diversity and dynamics of microbial communities in hairtail from different oceans during chilled storage. High-throughput sequencing was used to analyze the microbial communities of hairtail samples from different oceans in southeast China. The results showed that there were great differences in the microbial community structures of fresh hairtail samples from different geographical regions. At the genus level, Psychrobacter, Thermus and Oceanisphaera were the dominant bacteria in the samples from Nantong. Meanwhile, a wide variety of bacterial genera were found in the samples from Zhoushan and the relative abundances of seven different genera were similar, about 10%. After being refrigerated for 6–8 days, Psychrobacter and Oceanisphaera became the dominant spoilage bacteria in the samples from both regions. The relative abundances of the two genera exceeded 89%. The microbial community diversity and microbial community structure changes during the refrigerated storage of hairtail showed potential food safety risks.The findings of this study can provide experimental data for food safety monitoring during refrigerated storage of hairtail and its preservation.
Keywords: hairtail; high-throughput sequencing; Psychrobacter; Oceanisphaera
GAO Qiankun, JIAO Linshu, DU Hechao, et al. High-throughput sequencing analysis of microbial community diversity of hairtail from different waters during chilled storage[J]. Food Science, 2018, 39(18): 127-132. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201818020. http://www.spkx.net.cn
高乾坤, 焦琳舒, 杜贺超, 等. 高通量测序分析不同产地带鱼冷藏时微生物群落多样性[J]. 食品科学, 2018, 39(18):127-132. DOI:10.7506/spkx1002-6630-201818020. http://www.spkx.net.cn
文章编号: 1002-6630(2018)18-0127-06
引文格式:
中图分类号: TS254.4
文献标志码: A
*通信作者简介: 吕凤霞(1963—),女,教授,博士,研究方向为食品微生物与生物技术。E-mail:lufengxia@njau.edu.cn
DOI: 10.7506/spkx1002-6630-201818020
基金项目: “十二五”国家科技支撑计划项目(2015BAD16B04)
第一作者简介: 高乾坤(1994—),男,硕士研究生,研究方向为食品微生物。E-mail:2015108008@njau.edu.cn
收稿日期: 2017-12-05