金黄色葡萄球菌噬菌体qdsa001内溶素的特性预测及克隆表达
吕晓倩,王静雪*,林 洪
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘 要: 为获得噬菌体qdsa001的内溶素,本实验首先利用多种在线软件对内溶素lys56(GenBank:ARQ95812.1)的理化性质、信号肽、跨膜域和结构域等特性进行分析,然后选择克隆表达法制备目的蛋白。将合成的目的基因插入原核表达载体pET-30a中,构建重组质粒pET-30a-lys56,转化至大肠杆菌Rosetta(DE3)中,获得表达稳定的基因工程菌,经异丙基硫代-β-D-半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)诱导表达,利用镍琼脂糖亲和层析纯化表达产物。经在线软件预测结果显示,该蛋白分子质量为35.1 kDa,无信号肽和跨膜域,仅含有一个Ami_2结构域。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析显示重组蛋白表达成功,且以可溶性蛋白的形式存在于细胞破碎上清液,分子质量约35 kDa,与预期蛋白大小一致。重组蛋白最佳表达条件为:IPTG浓度0.5 mmol/L,20 ℃过夜诱导。
关键词: 金黄色葡萄球菌;噬菌体;生物信息分析;内溶素;克隆表达
金黄色葡萄球菌属于革兰氏阳性菌,是一种重要的病原菌,不仅能够引起人的化脓性疾病,同时也会引起食源性疾病 [1-3] 。近年来由于抗生素的滥用引发的多重耐药菌株的出现,给金黄色葡萄球菌的控制带来了极大的困难 [4-5] 。而噬菌体内溶素却可以很好地解决这一问题,噬菌体内溶素为噬菌体侵染宿主后期释放的一种能够特异性裂解细胞壁肽聚糖的蛋白 [6-7] 。已有研究表明内溶素能够有效抑制肺炎双球菌、炭疽芽孢杆菌、金黄色葡萄球菌、克雷伯菌、单核细胞性李斯特菌和沙门菌等多种病原菌 [8-12] 。
目前,获得内溶素的方法有两种,一种是物理提取法 [13] ,一种是克隆表达法 [14-15] 。物理提取法适用于任何噬菌体,但此法获得的酶液成分复杂,酶活稳定性较差,得率也相对较低,因此,此方法使用率低,通常制备内溶素时,大多采用的是克隆表达法。克隆表达法适用于有明确基因序列且基因序列功能明确为内溶素的噬菌体 [16] 。克隆表达的难点在于保证重组蛋白的成功表达同时还要保证酶的活性。
在前期工作中,本实验室分离得到一株烈性金黄色葡萄球菌噬菌体qdsa001 [17] ,并对其进行全基因组测序,基于相似性分析推测开放式阅读框56(ORF56)编码的蛋白为本株噬菌体的内溶素。本实验首先通过多种在线软件对ORF56编码内溶素的各项特性进行分析 [18] ,然后选择用克隆表达的方法获得该内溶素 [19-20] ,为下一步内溶素裂解特性及应用的研究提供理论支持。
1 材料与方法
1.1 材料与试剂
噬菌体为本实验室分离保存的烈性金黄色葡萄球菌噬菌体qdsa001,保存号为CCTCCM 2015553;金黄色葡萄球菌ATCC6538 美国典型微生物菌种保藏中心;感受态大肠杆菌TOP10、Rosetta(DE3) 上海生工生物工程股份有限公司;pET-30a质粒 德国Novagen公司。
LB肉汤、LB琼脂、TSB 北京陆桥技术有限责任公司;液体、固体培养基均由成品制剂与纯水按规定比例配制而成;卡那霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、咪唑索莱宝生物技术有限公司;SK3071非干扰型蛋白质量浓度测定试剂盒、Ni-IDA填料 上海生工生物工程股份有限公司;限制性内切酶NdeI、XhoI、T4连接酶 大连Takara公司。
1.2 仪器与设备
HZQ-F280全温振荡培养箱 太仓市华美生化仪器厂;JY88-II超声波细胞粉碎机 宁波新芝生物科技股份有限公司;HC-3018R高速冷冻离心机 安徽中科中佳学仪器有限公司;DYCZ-24DN迷你双垂直电泳槽北京六一仪器厂;Power Wave XS型酶标仪 美国BioTek公司。
1.3 方法
1.3.1 内溶素特性预测
1.3.1.1 内溶素基因的同源性分析
利用国际生物技术信息中心(National Center for Biotechnology Information,NCBI)(https://www.ncbi.nlm.nih.gov/)提供的局域相似性比对工具(Basic Local Alignment Search Tool,BLAST)(https://blast.ncbi.nlm.nih.gov/Blast.cgi),采用氨基酸序列比对,对ORF56编码的氨基酸序列进行检索比对。
1.3.1.2 内溶素理化特征预测
利用ExPASy Bioinformatics Resource Portal(http://us.expasy.org/tools/protparam.html)对内溶素的分子质量、等电点、氨基酸组成等理化特征进行预测。
1.3.1.3 内溶素结构域预测
采用SMART软件(http://smart.embl-heidelberg.de/)、InterProScan(http://www.ebi.ac.uk/interpro/scan.html)和NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对内溶素的模块化结构进行预测。
1.3.1.4 内溶素信号肽序列预测
利用SignalP 4.1服务器(http://www.cbs.dtu.dk/services/SignalP/)预测内溶素是否含有信号肽。
1.3.1.5 内溶素跨膜结构预测
利用TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)和TMHMM v2.0服务器(http://www.cbs.dtu.dk/services/TMHMM/)对内溶素进行跨膜区的预测。结合ProtScale程序(http://web.expasy.org/protscale/)预测蛋白质疏水性,辅助判断跨膜区预测的正确性。
1.3.2 内溶素基因的合成与表达载体的构建
1.3.2.1 内溶素基因的合成
根据内溶素基因序列设计42 条引物(表1),通过聚合酶链式反应扩增出足够量的目的基因产物。引物设计及序列合成均由上海生工生物工程股份有限公司完成。
表1 内溶素基因扩增所需引物
Table 1 Primer sequences used for amplification of target gene

引物序号 引物序列(5’-3’)ORF56-1 GACACCATATGATAGAAATTTGGAAAGGTGTAAGTGTTA ORF56-2 CCAATAGGCAGTAAATCATATCTAACACTTACACCTTTCCAAA ORF56-3 GATATGATTTACTGCCTATTGGGACAAGACGTACAGGTCA ORF56-4 AGGTTTTTTAACCGCCATAGCTTGACCTGTACGTCTTGTC ORF56-5 CTATGGCGGTTAAAAAACCTGTTTTTATTGTAGCTCATGATACA ORF56-6 TGAGCTGTAGTATTAATATTCCCTGTATCATGAGCTACAATAAAAAC ORF56-7 GGGAATATTAATACTACAGCTCAAAATAATGTAGATTATTACAAAAACAC ORF56-8 AGAAGCCCAATCAATGTTATATGTGTTTTTGTAATAATCTACATTATTT ORF56-9 ATATAACATTGATTGGGCTTCTACTGCATCCGCACATATC ORF56-10 TAATAGCTTCTTTATCATCTACAAAGATATGTGCGGATGCAGT ORF56-11 TTTGTAGATGATAAAGAAGCTATTATATGTATTCCTACTACAGAAAAAG ORF56-12 GTGTTATACAATACATGCCAAGCTTTTTCTGTAGTAGGAATACATA
续表1

引物序号 引物序列(5’-3’)ORF56-13 CTTGGCATGTATTGTATAACACTCCTATAGATGACCTATGGTAC ORF56-14 ACCATCATTAGCGTTAATACCGTACCATAGGTCATCTATAGGA ORF56-15 GGTATTAACGCTAATGATGGTGCTATTGGTGTAGAGATTTGT ORF56-16 AGCGTTCTTTATCACTAAAGTAACAAATCTCTACACCAATAGC ORF56-17 TACTTTAGTGATAAAGAACGCTCTAAAAAATCATTAGATAATGGAGC ORF56-18 GCTAAATAAGCTAAGACACGAGCTCCATTATCTAATGATTTTTTAG ORF56-19 TCGTGTCTTAGCTTATTTAGCTGAATACTGGGGTGTTGAT ORF56-20 ACCTGGCATATTTGTTTTGTAATCAACACCCCAGTATTCA ORF56-21 TACAAAACAAATATGCCAGGTCACCAAGACATCCAAAGCG ORF56-22 AAGTTACCTGGGTCTTGTTTGTCGCTTTGGATGTCTTGGT ORF56-23 AAACAAGACCCAGGTAACTTATTAGAAGCATGTGGATTAGG ORF56-24 CCTTATCTAAGTTACTAGTGTTTCTACCTAATCCACATGCTTCTAAT ORF56-25 TAGAAACACTAGTAACTTAGATAAGGAAGTAGCTAAGTATTACAAGAAAG ORF56-26 TTTCTTTACATCTACTGACTTAATAACTTTCTTGTAATACTTAGCTACTT ORF56-27 TTATTAAGTCAGTAGATGTAAAGAAATCAGGTAATGCTGAGCCT ORF56-28 TTTTAGTAGATTGTGTTTTTACTCTAGGCTCAGCATTACCTGA ORF56-29 AGAGTAAAAACACAATCTACTAAAACTATGTGGAGCTGGAAAGG ORF56-30 AATAGCTCTATCTGGATAAAAAGTACCTTTCCAGCTCCACATAG ORF56-31 TACTTTTTATCCAGATAGAGCTATTAAAGTTAGAAAATCTCCAGGAC ORF56-32 TCTCTATTTACTATAGTGCCTTTAAGTCCTGGAGATTTTCTAACTTT ORF56-33 TTAAAGGCACTATAGTAAATAGAGATTCATGGCTATACGATAAGGA ORF56-34 GTCAAACTCAACCCAATCATCCTTATCGTATAGCCATGAA ORF56-35 TGATTGGGTTGAGTTTGACCAAGTTATTAAAGTGGATGGC ORF56-36 GGATATTTAAATCTAATCCACCAATAGCCATCCACTTTAATAACTTG ORF56-37 TATTGGTGGATTAGATTTAAATATCCAAAACCAGGCTCTAGTAAAAA ORF56-38 CACATACAGCACAATAGAAATAATTTTTACTAGAGCCTGGTTTT ORF56-39 TTATTTCTATTGTGCTGTATGTGAGATAACAGATAAACAAGAACGT ORF56-40 TTTTTCCAAAATATTTTTCTTTCTTAATACGTTCTTGTTTATCTGTTATCT ORF56-41 ATTAAGAAAGAAAAATATTTTGGAAAAATAGATTGGAAACTCGAG ORF56-42 GTGTCCTCGAGTTTCCAATCTA
1.3.2.2 表达载体的构建及转化
将合成的目的基因纯化后用NdeI与XhoI双酶切,胶回收双酶切产物,与同样经双酶切的载体pET-30a连接;利用热击法将重组后的表达载体转入大肠杆菌TOP10感受态细胞,涂布于含卡那霉素和氯霉素的LB培养基上;挑选阳性克隆单菌落,提取质粒,经NdeI与XhoI双酶切鉴定正确后,送至上海生工生物工程有限公司测序。
取1 µL重组pET-30a-lys56质粒转化至Rosetta(DE3)表达菌株,42 ℃热击90 s,冰上静置2 min后涂平板(含30 µg/mL卡那霉素和34 µg/mL氯霉素),37 ℃恒温箱培养过夜。
1.3.3 重组蛋白最佳诱导条件的确定
挑取表达菌株的单菌落于LB培养基(含30 µg/mL卡那霉素和34 µg/mL氯霉素)试管中,37 ℃、220 r/min摇床培养过夜。次日,将培养的菌液按1∶100比例分别接种于LB培养基中(含30 µg/mL卡那霉素和34 µg/mL氯霉素),37 ℃、220 r/min培养约3 h。当OD 600 nm 值达到0.6左右时,添加终浓度为0.5 mmol/L的IPTG,220 r/min条件下分别20 ℃诱导过夜;37 ℃诱导4 h,未加IPTG诱导剂的作为阴性对照。4 000 r/min离心10 min收集菌体,弃上清液,菌体用磷酸盐缓冲溶液(phosphate buffer saline,PBS)(NaCl 8 g,KH 2 PO 4 0.2 g,Na 2 HPO 4 2.17 g,KCl 0.2 g,配制1 L PBS,pH 7.4)悬浮后,进行超声破碎,分别离心收集上清液和沉淀,沉淀用包涵体溶解液(8 mol/L Urea,50 mmol/L Tris-HCl,150 mmol/L NaCl,pH 8.0)溶解,对上清液和复融沉淀分别进行SDS-PAGE检测。
1.3.4 重组蛋白的纯化及检测
将5 mL Ni-IDA填料装入柱子中,以5 mL/min的流速用10 倍柱床体积的Binding Buffer(50 mmol/L Tris,500 mmol/L NaCl,pH 8.0)清洗平衡柱子直至基线平稳;以2 mL/min的流速上样并收集穿透液;再以10 mL/min的流速用10 倍柱床体积的Binding Buffer(50 mmol/L Tris,500 mmol/L NaCl,pH 8.0)清洗柱子后,用Wash Buffer I(50 mmol/L Tris,500 mmol/L NaCl,20 mmol/L Imidazole,pH 8.0)和Wash Buffer II(50 mmol/L Tris,500 mmol/L NaCl,50 mmol/L Imidazole,pH 8.0)分别以5 mL/min的流速洗脱杂蛋白,最终用Elution Buffer(50 mmol/L Tris,500 mmol/L NaCl,500 mmol/L Imidazole,pH 8.0)洗脱目的蛋白。将纯化好的目的蛋白透析到蛋白保存液(50 mmol/L Tris,300 mmol/L NaCl,pH 8.0)中,0.45 μm滤膜过滤浓缩分装,-80 ℃保存,并进行SDS-PAGE和Western Blot检测。
1.3.5 重组蛋白质量浓度的测定
利用SK3071非干扰型蛋白质量浓度测定试剂盒对纯化好的蛋白质量浓度进行测定。以吸光度为纵坐标,对应牛血清白蛋白量为横坐标,用Microsoft Excel软件绘制牛血清白蛋白标准曲线,获得标准曲线公式;将测得的待定量蛋白质样品溶液吸光度代入标准曲线公式中,计算出所对应的蛋白质样品质量浓度。
2 结果与分析
2.1 内溶素特性预测结果
2.1.1 内溶素同源性分析
利用BLAST中氨基酸序列比对工具BLASTP对噬菌体qdsa001中的内溶素基因编码的氨基酸进行检索,在公共检索数据库中有4 个同源性非常高的同源蛋白(表2),其中有2 个均为N-乙酰胞壁酰-L-丙氨酸酰胺酶,属于内溶素,并且比对结果E值均不大于0,可信度较高。由此可以断定ORF56编码的蛋白为噬菌体qdsa001的内溶素,并命名为lys56。
表2 噬菌体qdsa001内溶素BLAST结果
Table 2 Sequence analysis of endolysin-encoding gene of bacteriophage qdsa001 using BLAST

序列号 描述 总分 覆盖度/% E值 准确度/%YP_007005646.1 推定蛋白[葡萄球菌噬菌体SA11] 624 100 0.0 99 YP_009275933.1 N-乙酰胞壁酰-L-丙氨酸酰胺酶[葡萄球菌噬菌体Stau2] 622 100 0.0 99 YP_007677655.1 N-乙酰胞壁酰-L-丙氨酸酰胺酶[葡萄球菌噬菌体vB_SauM_Romulus] 620 100 0.0 98 APC42880.1 推定蛋白SAP1_015[葡萄球菌噬菌体StAP1] 619 100 0.0 98
2.1.2 内溶素理化特征预测结果
利用ExPAsy Bioinformatics Resource Portal预测内溶素的分子质量为35.1 kDa,等电点为8.97,氨基酸组成见表3。
表3 氨基酸组成
Table 3 Amino acid composition
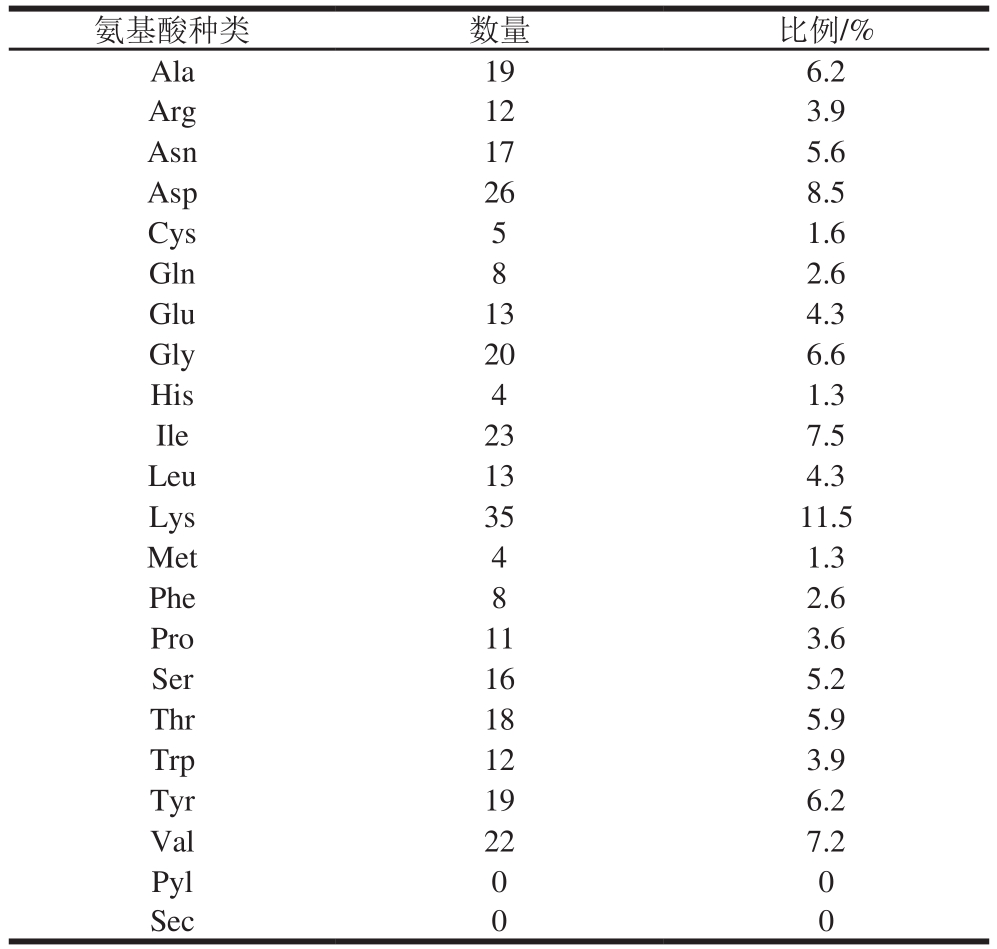
氨基酸种类 数量 比例/%Ala 19 6.2 Arg 12 3.9 Asn 17 5.6 Asp 26 8.5 Cys 5 1.6 Gln 8 2.6 Glu 13 4.3 Gly 20 6.6 His 4 1.3 Ile 23 7.5 Leu 13 4.3 Lys 35 11.5 Met 4 1.3 Phe 8 2.6 Pro 11 3.6 Ser 16 5.2 Thr 18 5.9 Trp 12 3.9 Tyr 19 6.2 Val 22 7.2 Pyl 0 0 Sec 0 0
2.1.3 内溶素结构域预测结果
利用3 个不同的软件对内溶素的结构域进行预测后显示,内溶素中仅存在一个结构域Ami_2,范围在18~162 个氨基酸(图1)。

图1 内溶素结构域预测
Fig. 1 Prediction of structural domain of endolysin
2.1.4 内溶素信号肽预测结果
利用SignalP 4.1对内溶素信号肽进行预测。信号肽剪切位点预测通过Y最大值来判断;是否为分泌蛋白通过S平均值来判断,若S大于0.5,则预测为分泌蛋白,存在信号肽。结果显示内溶素不含有信号肽。

图2 内溶素信号肽预测
Fig. 2 Prediction of signal peptide of endolysin
2.1.5 内溶素跨膜结构预测结果
一般蛋白折叠时会在潜在的跨膜区出现高疏水值区域,而TMHMM Server v.2.0和TMpred(一般分值大于1 500代表预测为跨膜螺旋区)都未预测到跨膜结构(图3A、C),ProtScale(负值越大表示亲水性越好,正值越大表示疏水性越好)进行了疏水性预测,也未预测到疏水性区域(图3B),两个预测结果相一致。因此,此内溶素中并无跨膜结构存在。
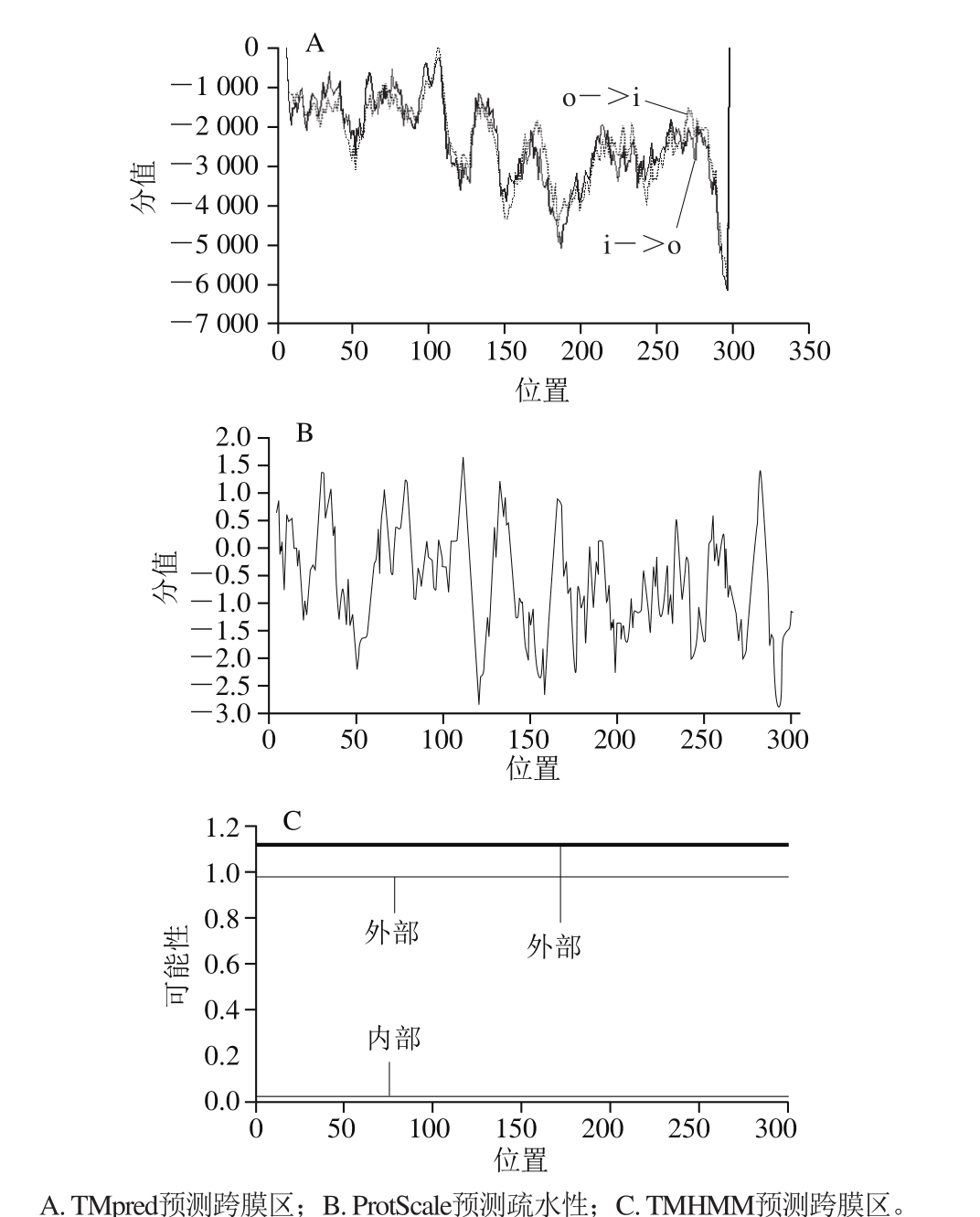
图3 内溶素基因编码蛋白跨膜区以及疏水性预测
Fig. 3 Prediction of transmembrane helices and hydrophobicity of endolysin
2.2 内溶素的克隆表达及纯化
2.2.1 重组质粒的构建与鉴定
由上海生工生物工程有限公司合成的目的基因,通过1%的琼脂糖凝胶电泳显示(图4),在1 000 bp左右有一清晰条带,与预期的片段大小918 bp相符合(泳道2)。将内溶素基因与原核表达载体pET-30a相连,构建重组质粒pET-30a-lys56。利用NdeI与XhoI双酶切重组质粒可以切出预期大小的片段(泳道3)。对重组质粒进行核苷酸测序鉴定,结果表明重组质粒的插入序列与内溶素目的基因一致。
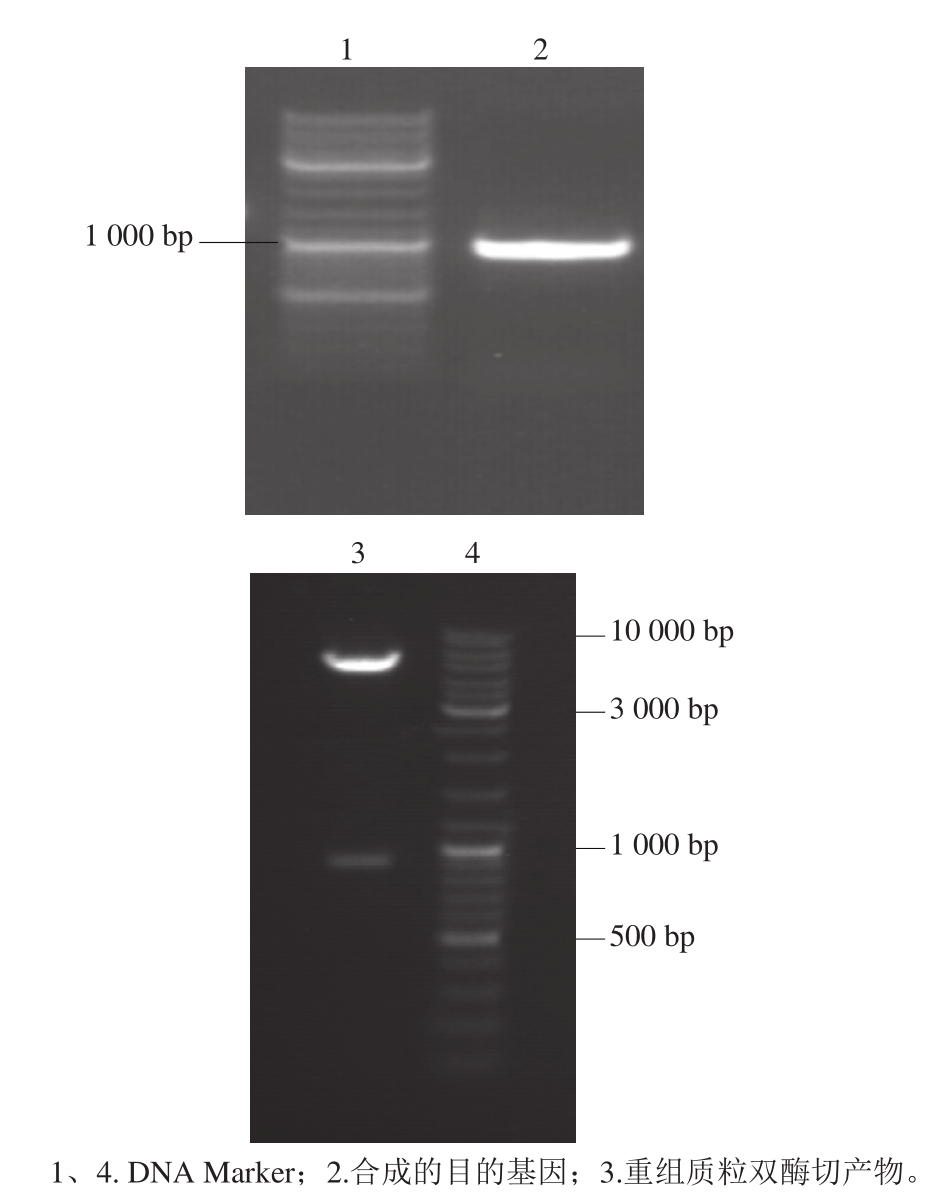
图4 合成的目的基因及重组质粒双酶切后电泳图
Fig. 4 Target gene and recombinant plasmid double digested by NdeI and XhoI
2.2.2 最佳诱导条件的确定

图5 重组蛋白SDS-PAGE图
Fig. 5 Endolysin expression detected by SDS-PAGE
由图5可见,经20 ℃过夜和37 ℃、4 h的条件诱导后,上清液和沉淀中在35.0 kDa处均有明显的蛋白条带,最终选择20 ℃过夜诱导作为诱导表达的最佳条件。
2.2.3 目的蛋白纯化及检测结果
将表达菌株在最佳诱导条件下培养后,超声裂菌并离心收集上清液,利用镍琼脂糖亲和层析对目的蛋白进行纯化。将上清液直接通过Ni-IDA层析介质,用不同浓度的咪唑洗脱,收集不同过程中流出的液体,并对其进行SDS-PAGE分析。由图6可见,咪唑浓度为20 mmol/L和50 mmol/L时,洗脱出大量杂蛋白,当咪唑浓度为500 mmol/L时,有大量的目的蛋白被洗脱。
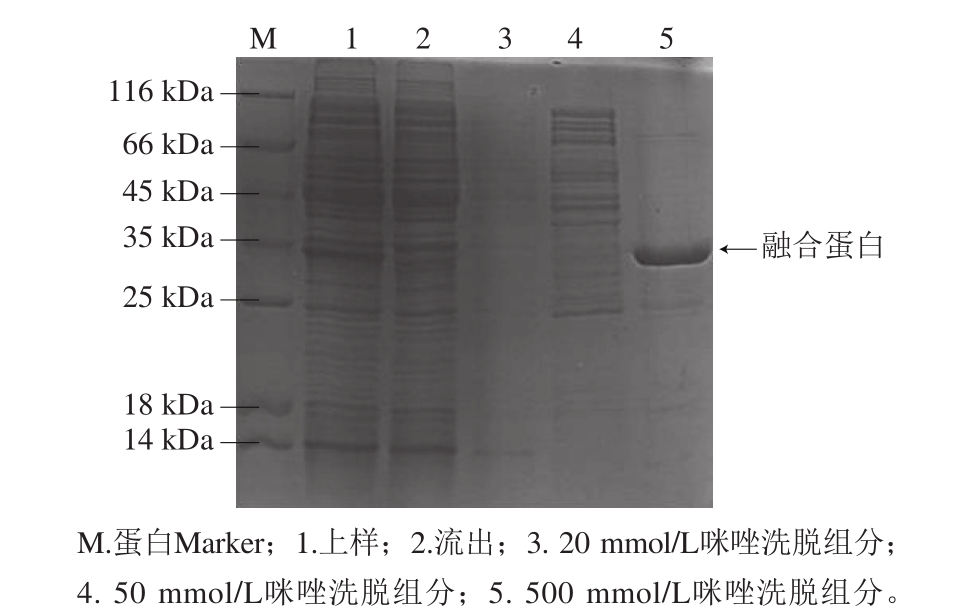
图6 镍琼脂糖亲和层析纯化SDS-PAGE图
Fig. 6 Purification of recombinant endolysin by Ni-IDA affinity chromatography
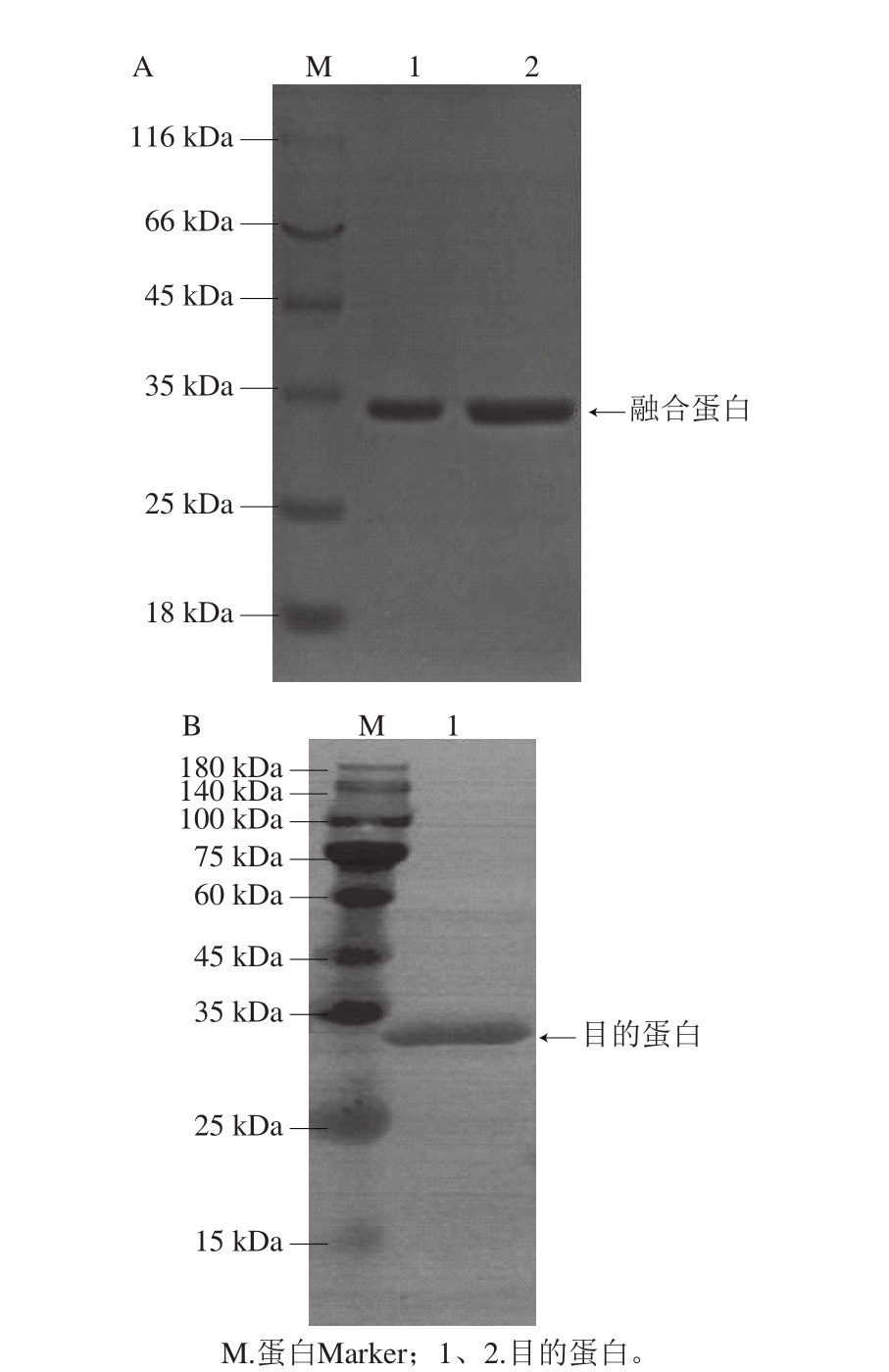
图7 纯化目的蛋白SDS-PAGE(A)及Western Blot免疫印迹(B)图
Fig. 7 SDS-PAGE (A) and Western Blot (B) analysis of purified recombinant protein
将得到的高纯度目的蛋白进行最终的SDS-PAGE及Western Blot检测,最终确定内溶素lys56表达成功(图7)。
2.2.4 目的蛋白质量浓度测定结果
蛋白质量浓度标准曲线方程为:y=-0.005 4x+0.980 1,R 2 =0.995 4。通过计算得到目的蛋白质量浓度为5.77 mg/mL。
3 讨 论
与噬菌体相比,内溶素在应用上具有众多优势,尤其是其成分仅为蛋白质,因而在食品的应用中安全性更具有保障 [21-23] 。
基于基因序列的分析通常是利用各种生物学软件通过与现有数据库信息的相似性比对,从而快速了解未知基因的功能,并对其编码蛋白进行功能和结构的预测 [24-26] 。本实验利用多种在线软件对内溶素的理化性质、信号肽、跨膜域和结构域等多个特性进行分析,结果显示内溶素lys56分子质量为35.1 kDa,等电点为8.97,无信号肽和跨膜域,仅拥有一个结构域Ami_2。
内溶素lys56因其编码基因为已知因素,故而选择克隆表达的方法获得内溶素。大肠杆菌表达系统是开发最早、技术最成熟的异源蛋白原核表达系统;pET系列质粒因其克隆表达融合蛋白的高效性以及带有多种可选择的融合标签,是目前应用最广泛的原核表达载体系统 [27-28] 。pET-30a质粒含有组氨酸标签,通常来说,组氨酸标签肽段相对亲水,不会对蛋白的三维结构产生影响,因此在通常情况下含有组氨酸标签的目的蛋白仍然能表现出完全的活性 [29] ,并且也可以大大地简化后续的纯化步骤 [30-31] 。本实验选择大肠杆菌TOP10为表达宿主菌,pET系列中的pET-30a质粒为表达载体,将合成的目的基因插入原核表达载体pET-30a中,成功地构建了重组质粒pET-30a-lys56,并转化至大肠杆菌TOP10中,获得了表达稳定的基因工程菌,经0.5 mmol/L IPTG于20 ℃过夜诱导,获得较高量目的蛋白的上清液表达。
总之,本研究通过生物信息学的方法快速分析了内溶素的各项特性并成功地表达了金黄色葡萄球菌噬菌体qdsa001的内溶素lys56,为其裂解特性、裂解机制的探究以及应用提供了理论支持。
参考文献:
[1] 向正刚, 耿毅, 张雨薇, 等. 四川兔源金黄色葡萄球菌毒力检测及分子分型[J]. 华南农业大学学报, 2017, 38(4): 62-68. DOI:10.7671/j.issn.1001-411X.2017.04.011.
[2] 李知敏, 王妹, 彭亮, 等. 江香薷挥发油的化学成分分析及其对金黄色葡萄球菌生物被膜的抑制作用[J]. 食品科学, 2016, 37(14):138-143. DOI:10.7506/spkx1002-6630-201614024.
[3] 杨岚, 郝永清, 何焱, 等. 金黄色葡萄球菌CP8-FnBPB-ClfA偶联蛋白对金黄色葡萄球菌性奶牛乳房炎的免疫效果研究[J]. 中国预防兽医学报, 2015, 37(3): 229-232. DOI:10.3969/j.issn.1008-0589.2015.03.16.
[4] 张欣, 喻华, 黄湘宁, 等. 2011-2015年四川省金黄色葡萄球菌对万古霉素及利奈唑胺耐药性变迁[J]. 中国感染控制杂志, 2017, 16(9):807-809; 824. DOI:10.3969/j.issn.1671-9638.2017.09.004.
[5] 廖平明. 金黄色葡萄球菌分布及耐药性分析[J]. 检验医学与临床,2017, 14(增刊1): 65-67. DOI:10.3969/j.issn.1672-9455.2017.25.030.
[6] CELIA L K, NELSON D, KERR D E. Characterization of a bacteriophage lysin (Ply700) from Streptococcus uberis[J].Veterinary Microbiology, 2008, 130(1/2): 107-117. DOI:10.1016/j.vetmic.2007.12.004.
[7] COURCHESNE N M, PARISIEN A, LAN C Q. Production and application of bacteriophage and bacteriophage-encoded lysins[J].Recent Patents on Biotechnology, 2009, 3(1): 37-45. DOI:10.2174/187 220809787172678.
[8] GAENG S, SCHERER S, NEVE H, et al. Gene cloning and expression and secretion of Listeria monocytogenes bacteriophage-lytic enzymes in Lactococcus lactis[J]. Applied and Environmental Microbiology,2000, 66(7): 2951-2958. DOI:10.1128/AEM.66.7.2951-2958.2000.
[9] YOONG P, SCHUCH R, NELSON D, et al. Identification of a broadly active phage lytic enzyme with lethal activity against antibioticresistant Enterococcus faecalis and Enterococcus faecium[J].Journal of Bacteriology, 2004, 186(14): 4808-4812. DOI:10.1128/JB.186.14.4808-4812.2004.
[10] OBESO J M, MARTÍNEZ B, RODRÍGUEZ A, et al. Lytic activity of the recombinant staphylococcal bacteriophage ΦH5 endolysin active against Staphylococcus aureus in milk[J]. International Journal of Food Microbiology, 2008, 128(2): 212-218. DOI:10.1016/j.ijfoodmicro.2008.08.010.
[11] 蔡天舒, 王静雪, 林洪, 等. 金黄色葡萄球菌噬菌体的生物学特性及其在牛奶中的抑菌应用[J]. 食品科学, 2013, 34(11): 147-151.DOI:10.7506/spkx1002-6630-201311033.
[12] 林洪, 李萌, 王静雪. 沙门氏菌噬菌体STP4-a重组内溶素抑菌特性分析[J]. 食品科学, 2015, 36(5): 104-108. DOI:10.7506/spkx1002-6630-201505020.
[13] 韩峰. 腐败希瓦氏菌噬菌体Spp001基因序列及其裂解活性研究[D].青岛: 中国海洋大学, 2014.
[14] 杨曦, 吉文汇, 曹冬梅, 等. 大肠杆菌O157 Stx噬菌体裂解酶的克隆表达及活性分析[J]. 上海交通大学学报(农业科学版), 2012, 30(4):25-30. DOI:10.3969/J.ISSN.1671-9964.2012.04.005.
[15] 王伟宇, 林洪, 王静雪. 副溶血弧菌噬菌体qdvp001重组内溶素诱导表达以及理化性质初步研究[J]. 食品工业科技, 2016, 37(16): 205-209. DOI:10.13386/j.issn1002-0306.2016.16.032.
[16] GUO M, FENG C, REN J, et al. A novel antimicrobial endolysin,LysPA26, against Pseudomonas aeruginosa[J]. Frontiers in Microbiology, 2017, 8: 293. DOI:10.3389/fmicb.2017.00293.
[17] 蔡天舒. 金黄色葡萄球菌噬菌体qdsa001的生理学特性及初步应用[D].青岛: 中国海洋大学, 2013.
[18] 姜勇, 胡尚连, 曹颖, 等. 青杨4CL基因的克隆及生物信息学分析[J]. 西南农业学报, 2016, 29(7): 1547-1553. DOI:10.16213/j.cnki.scjas.2016.07.009.
[19] CHANG Y, YOON H, KANG D, et al. Endolysin LysSA97 is synergistic with carvacrol in controlling Staphylococcus aureus in foods[J]. International Journal of Food Microbiology, 2017, 244: 19-26. DOI:10.1016/j.ijfoodmicro.2016.12.007.
[20] CHANG Y, RYU S. Characterization of a novel cell wall binding domain-containing Staphylococcus aureus endolysin LysSA97[J].Applied Microbiology and Biotechnology, 2017, 101(1): 147-158.DOI:10.1007/s00253-016-7747-6.
[21] 朱育玮, 李玉保, 王守荣, 等. 噬菌体及其治疗细菌感染的研究进展[J]. 中国畜牧兽医, 2015, 42(3): 769-773. DOI:10.11843/j.issn.1671-7236.2015.03.041.
[22] 王方正, 田中杰, 田文儒. 噬菌体内溶素对奶牛乳房炎致病菌的溶解作用[J]. 动物医学进展, 2015(4): 113-116. DOI:10.3969/j.issn.1007-5038.2015.04.026.
[23] 裴景亮, 付玉荣. 噬菌体治疗细菌感染的研究进展[J]. 浙江大学学报(医学版), 2013, 42(6): 700-704. DOI:10.3785/j.issn.1008-9292.2013.06.019.
[24] 李靖宇. 生物信息学在微生物生态学中的应用[J]. 安徽农业科学,2015, 22(22): 5-7; 56. DOI:10.3969/j.issn.0517-6611.2015.22.003.
[25] 吴仲鑫. 肠出血性大肠埃希菌O157:H7毒力基因eae的克隆、表达及生物信息学研究[D]. 广州: 南方医科大学, 2008. DOI:10.7666/d.y1395119.
[26] 付汉维. 十二指肠钩虫锰超氧化物岐化酶(AdMn-SOD)的生物信息学分析、表达及其活性研究[D]. 湛江: 广东医学院, 2009.DOI:10.7666/d.y2013553.
[27] 解庭波. 大肠杆菌表达系统的研究进展[J]. 长江大学学报C(自然科学版), 2008, 5(3): 77-82. DOI:10.3969/j.issn.1673-1409-B.2008.03.034.
[28] 祁浩, 刘新利. 大肠杆菌表达系统和酵母表达系统的研究进展[J]. 安徽农业科学, 2016, 44(17): 4-6; 52. DOI:10.3969/j.issn.0517-6611.2016.17.002.
[29] 朱娟, 范军, 朱苏文, 等. 含组氨酸标签的枯草杆菌5-氨基酮戊酸脱水酶的高效表达[J]. 安徽农业大学学报, 2006(4): 496-498.DOI:10.3969/j.issn.1672-352X.2006.04.013.
[30] 齐向辉, 孙储鹏, 何晨曦, 等. 一种带有组氨酸标签的新型表达载体的构建及应用[J]. 生物技术, 2010(6): 52-54. DOI:10.3969/j.issn.1004-311X.2010.06.195.
[31] 华伟伟, 徐维元, 黄建颖, 等. 组氨酸标签蛋白纯化介质的合成及应用[J]. 中国食品学报, 2016, 16(10): 80-86. DOI:10.16429/j.1009-7848.2016.10.011.
Characteristics and Expression of Endolysin from Staphylococcus aureus Bacteriophage qdsa001
LÜ Xiaoqian, WANG Jingxue*, LIN Hong
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract: This study aimed to obtain the endolysin lys56 encoded by Staphylococcus aureus phage qdsa001. First of all,the characteristics (physicochemical properties, signal peptide, transmembrane helices and structure domains) of lys56 were predicted by several online software. Subsequently, the target protein was obtained by cloning and expression. For this purpose, the target gene was synthesized and inserted into a prokaryotic expression vector pET-30a to construct recombinant plasmid pET-30a-lys56, which was subsequently transformed into E. coli Rosetta (DE3). Ni-IDA affinity chromatography was applied to purify the recombinant protein. The results showed that lys56 had a relative molecular mass of 35.1 kDa without signal peptide or transmembrane domain and contained only one Ami_2 domain. Sodium dodecyl sulfatepolyacrylamide gel electrophoresis (SDS-PAGE) showed that the recombinant protein was successfully expressed in the cell supernatant with a molecular mass of about 35 kDa, which was consistent with the expected size. Optimal expression of the endolysin lys56 was induced by 0.5 mmol/L isopropyl-β-D-thiogalactopyranoside (IPTG) overnight at 20 ℃.
Keywords: Staphylococcus aureus; bacteriophage; bioinformatics analysis; endolysin; cloning and expression
LÜ Xiaoqian, WANG Jingxue, LIN Hong. Characteristics and expression of endolysin from Staphylococcus aureus bacteriophage qdsa001[J]. Food Science, 2018, 39(18): 133-138. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201818021. http://www.spkx.net.cn
吕晓倩, 王静雪, 林洪. 金黄色葡萄球菌噬菌体qdsa001内溶素的特性预测及克隆表达[J]. 食品科学, 2018, 39(18):133-138. DOI:10.7506/spkx1002-6630-201818021. http://www.spkx.net.cn
文章编号: 1002-6630(2018)18-0133-06
引文格式:
中图分类号: Q786
文献标志码: A
*通信作者简介: 王静雪(1976—),女,教授,博士,研究方向为食品微生物。E-mail:snow@ouc.edu.cn
DOI: 10.7506/spkx1002-6630-201818021
基金项目: “十二五”国家科技支撑计划项目(2015BAD16B0902);现代农业产业技术体系建设专项(CARS-47)
第一作者简介: 吕晓倩(1991—),女,硕士研究生,研究方向为食品微生物。E-mail:lvxiaoqian66@163.com
收稿日期: 2017-08-23










