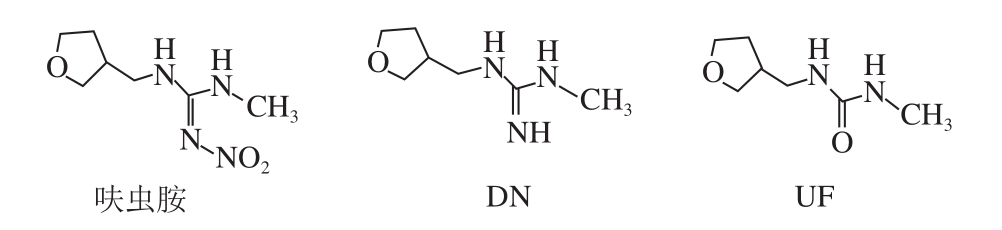
图1 呋虫胺及其代谢物DN、UF化学结构式
Fig. 1 Chemical structures of dinotefuran, DN and UF
吴延灿 1,2 ,蒋冰心 1 ,施艳红 3, *,戚传勇 2 ,操海群 1 ,唐 俊 3 ,商鲁宁 2 ,苏漪玲 2
(1.安徽农业大学植物保护学院,安徽 合肥 230036;2.合肥市农产品质量检测检验中心,安徽 合肥 230091;3.安徽农业大学资源与环境学院,安徽 合肥 230036)
摘 要: 建立超高效液相色谱-串联质谱检测蔬菜中呋虫胺及其代谢物1-甲基-3-[(3-四氢呋喃)甲基]二氢胍盐(1-methyl-3-(tetrahydro-3-furylmethyl) guanidium dihydrogen,DN)、1-甲基-3-[(3-四氢呋喃)甲基]脲(1-methyl-3-(tetrahydro-3-furylmethyl) urea,UF)残留的方法。蔬菜样品采用QuPPe分析方法处理后,经BEH-C 18 超高效液相色谱柱分离,采用电喷雾正离子模式,通过多反应监测方式测定,基质匹配标准曲线外标法定量。结果表明,呋虫胺及其代谢物在1.25~500 μg/L的质量浓度范围内线性关系良好,相关系数均大于0.991,方法检出限为0.04~0.66 μg/L,定量限为0.13~2.20 μg/L。在3 个添加水平条件下,呋虫胺及其代谢物DN、UF在黄瓜、番茄、马铃薯、甘蓝4 种基质中的添加回收率为72.0%~109.1%,相对标准偏差为1.4%~12.8%,最低添加量均为10 μg/kg。基质效应结果显示,呋虫胺及其代谢物大都表现为中等强度基质效应或强基质效应。该方法简单、准确、高效,可用于蔬菜样品中呋虫胺及其代谢物农药残留的快速筛查和定量检测。
关键词: 呋虫胺;代谢物;QuPPe;蔬菜;超高效液相色谱-串联质谱法;基质效应
呋虫胺是日本三井化学公司研发的第三代烟碱类杀虫剂,与现有的烟碱类杀虫剂结构相比,它的四氢呋喃基取代了以前的氯代吡啶基、氯代噻唑基,并不含卤族元素 [1-2] 。呋虫胺杀虫广谱,主要作用于昆虫的乙酰胆碱受体,阻断正常的神经传递,从而使昆虫死亡 [3-4] ,自2002年上市后便广泛用于防治水稻、蔬菜和水果上的各种害虫,如飞虱、蚜虫、叶蝉等 [5] 。截止2017年7月底,我国批准登记的呋虫胺产品已达78 个,主要登记使用在水稻、茶树、番茄、黄瓜、甘蓝和马铃薯等作物上 [6] 。研究发现,呋虫胺会在植物中代谢产生1-甲基-3-[(3-四氢呋喃)甲基]二氢胍盐(1-methyl-3-(tetrahydro-3-furylmethyl) guanidium dihydrogen,DN)、1-甲基-3-[(3-四氢呋喃)甲基]脲(1-methyl-3-(tetrahydro-3-furylmethyl) urea,UF)等物质,化学结构式见图1。这些代谢物的毒性与母体大致相同,并且比母体表现出更强的迁移性和持久性 [5] 。2017年6月18日起实施的GB 2763—2016《食品中农药最大残留限量》中 [7] ,仅对呋虫胺在稻米(2 mg/kg)、糙米(1 mg/kg)、棉籽(1 mg/kg)、黄瓜(2 mg/kg)中的最大残留限量(maximum residue limits,MRL)值进行了限定,但是对其他登记使用的农作物品种尚未制定MRL值,并且在残留定义这一项上只明确了呋虫胺母体,而对代谢物DN、UF并没有做要求。
目前,国内外报道呋虫胺的检测方法主要有酶联免疫 [5] 、高效液相色谱法 [8-12] 和高效液相色谱-串联质谱法 [13-21] ,但是,同时分析呋虫胺及其代谢物DN、UF的方法报道较少,目前仅报道了水稻 [22-23] 、蜂产品 [24] 、甜瓜 [25] 以及茶叶 [26] 上的残留分析方法,还鲜见蔬菜中呋虫胺及其代谢物的残留分析方法报道。近年来呋虫胺农药产品在蔬菜上的登记使用越来越广泛,为有效监测蔬菜中呋虫胺及其代谢物的残留情况,保障群众的消费安全,急需建立蔬菜中呋虫胺及其代谢物的快速检测方法。
QuPPe方法是欧盟农药残留参考实验室Anastassiades等 [27] 于2013年公布的一种采用甲醇提取植物源食品中极性农药的快速分析方法,目前该方法已经被应用到植物中三唑类杀菌剂 [28] 、草铵膦 [29] 和高氯酸盐 [30] 等极性化合物的研究中。呋虫胺及其代谢物属于极性较大的一类化合物。Rahmana等 [26] 研究发现甲醇是提取茶叶样品中呋虫胺及其代谢物最好的溶剂。因此,本研究采用QuPPe分析超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)检测,建立黄瓜、番茄、甘蓝、马铃薯等登记产品中呋虫胺及其代谢物DN、UF的残留分析方法,该方法简单、高效,能快速、准确地对蔬菜样品进行定量分析,以期为农产品中呋虫胺及其代谢物的日常监测和风险评估提供技术保障。

图1 呋虫胺及其代谢物DN、UF化学结构式
Fig. 1 Chemical structures of dinotefuran, DN and UF
蔬菜样品购于合肥市农贸市场。
呋虫胺(纯度99.50%) 德国Dr. Ehrenstorfer公司;DN(纯度97.0%)、UF(纯度97.0%) 北京勤诚亦信科技开发公司;甲醇、甲酸(均为色谱纯) 美国Tedia公司;乙酸(分析纯) 国药集团化学试剂有限公司;实验用水为密理博超纯水系统制备。
ACQUITY UPLC Xevo TQ超高效液相色谱-三重四极杆串联质谱仪(配有电喷雾离子源)、ACQUITY BEH C 18 色谱柱(2.1 mm×100 mm,1.7 μm) 美国Waters公司;ROTINA380离心机 德国Hettich Zentrifugen公司;VB424多位脉冲涡旋振荡器 德国Wiggens公司。
1.3.1 标准溶液配制
分别准确称取呋虫胺、DN、UF标准品于10 mL容量瓶中,用甲醇溶解定容配制成质量浓度为1 000 mg/L的母液。同时,用甲醇稀释成混合标准溶液(100 mg/L),4 ℃条件下保存备用。分别用不同基质的空白提取液逐级稀释混合标准溶液,配制成1.25、5、12.5、50、125、500 μg/L系列质量浓度的标准工作液。
1.3.2 样品前处理
准确称取10.0 g样品(甘蓝取5.0 g)于50 mL离心管中,加入10 mL 1%乙酸的甲醇溶液后涡旋提取2 min(2 500 r/min),以4 000 r/min离心5 min,取上清液到25 mL容量瓶中,用超纯水定容至刻度,混匀后过0.22 μm亲水性滤膜,供UPLC-MS/MS测定。
1.3.3 UPLC条件
分离采用ACQUITY BEH C 18 色谱柱(2.1 mm×100 mm,1.7 μm)。流动相A为0.05%甲酸溶液,流动相B为0.05%甲酸-甲醇溶液;梯度洗脱程序:0~0.25 min,70% A;3~4 min,5% A;4.01~5 min,70% A;运行时间5 min;流速0.25 mL/min;柱温40 ℃;进样量5 μL。
1.3.4 MS条件
电喷雾离子源,正离子模式;毛细管电压3.0 kV;离子源温度150 ℃;锥孔反吹气流量50 L/h;脱溶剂气温度350 ℃;脱溶剂气流量700 L/h;多反应监测模式。
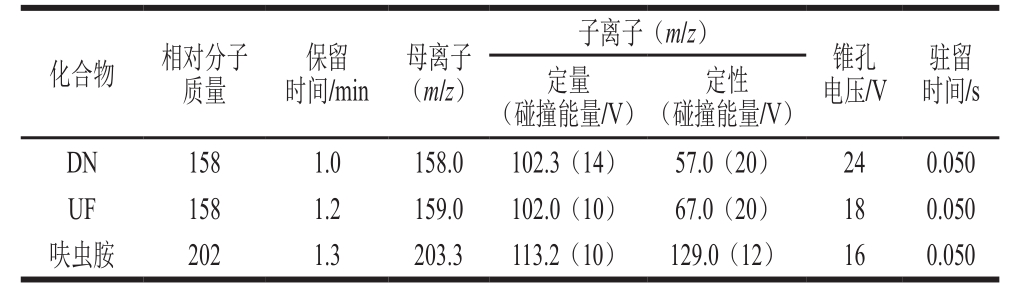
配制1 mg/L呋虫胺、DN、UF单一标准溶液,在全扫确定母离子后,采用仪器自动调谐模块对各目标化合物进行质谱条件优化,从而得到最优测定条件,见表1。
表1 呋虫胺及其代谢物的测定条件
Table 1 Optimized working parameter of ESI-MS/MS for dinotefuran and its metabolites
针对极性化合物弱保留的特点,Anastassiades等 [27] 推荐使用的为常规实验室不常备的阴离子交换色谱柱(Ionpac AS 11、Ionpac AS 11-HC)以及多孔渗水石墨柱(Hypercarb)。研究发现,采用100 mm规格的ACQUITY BEH C 18 色谱柱,通过降低流速(0.25 mL/min),调整流动相初始比例(与前处理方法相适应),可以获得呋虫胺及其代谢物较好的保留和峰形;加入甲酸可以提高呋虫胺及其代谢物的离子化效率,从而提高响应,标准溶液色谱图如图2所示。
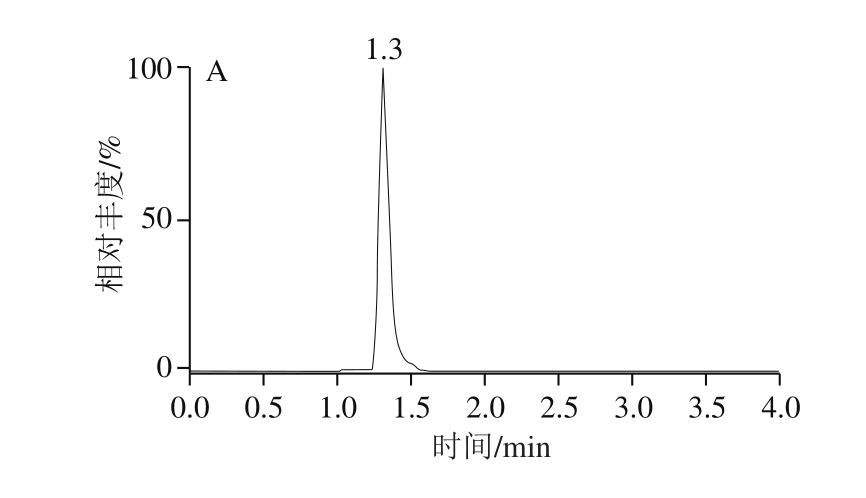
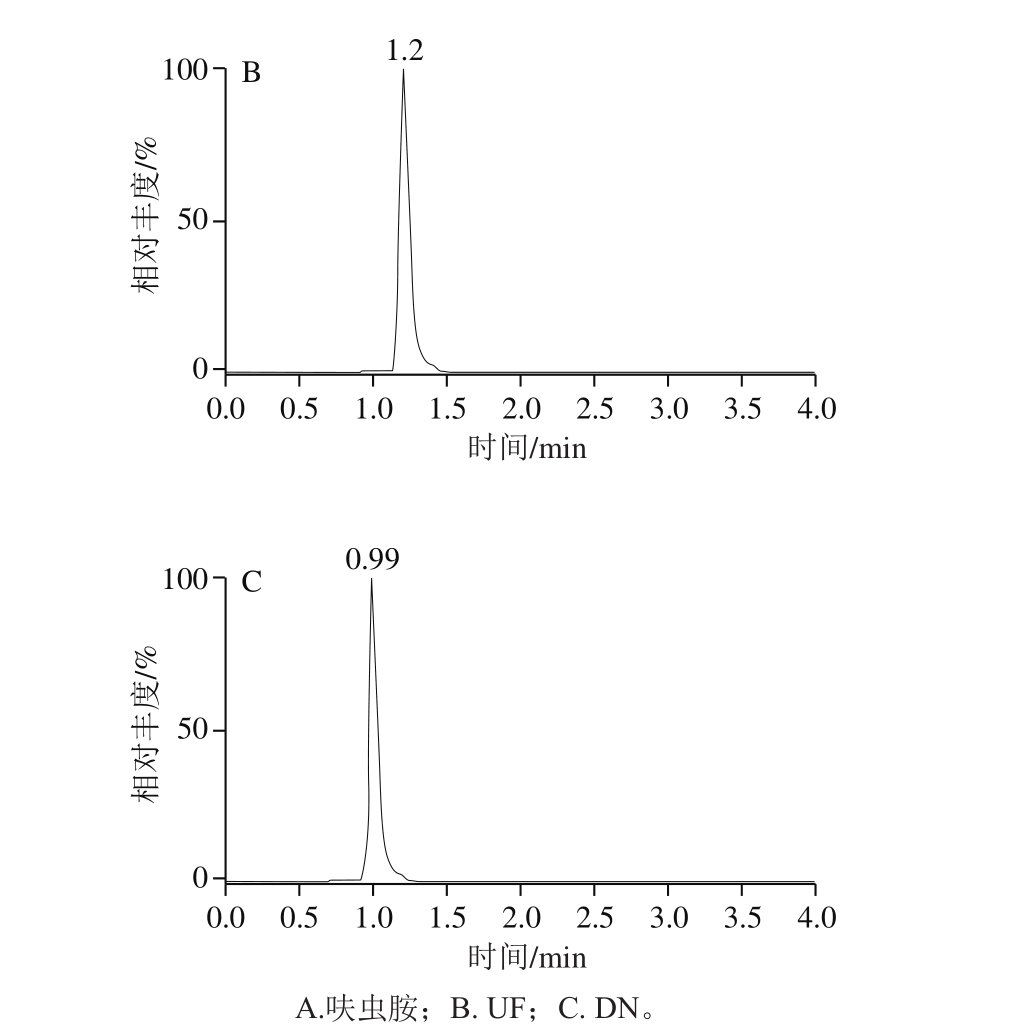
图2 呋虫胺及其代谢物定量离子图谱
Fig. 2 Quantitative ion chromatograms of dinotefuran and its metabolites
目前,同时测定呋虫胺及其代谢物的方法报道较少,大多数方法采用乙腈 [26] 或乙腈-甲醇混合溶液 [22] 提取,经过基质固相分散萃取 [26] 或固相萃取 [22] 等方式净化后再测定,步骤较为繁琐。相对于乙腈,甲醇的共提物更少,提取液几乎清澈透明,并且对于极性化合物呋虫胺及其代谢物有更好的提取效率 [26] ,因此本研究借鉴QuPPe方法 [27] ,选用酸化甲醇作为提取剂,采用抗干扰能力强的UPLC-MS/MS联用测定。蔬菜样品经提取后,用超纯水定容25 mL,不仅保证了待测液与流动相初始比例相似从而获得更好的峰形,而且稀释提取液也同时降低基质本底的干扰。甘蓝样品相对于其他样品提取效率较低,当取样量和提取剂比例为1∶1时,呋虫胺和DN的回收率均低于70%,因此本研究将甘蓝样品的取样量和提取剂比例调整为1∶2。
用黄瓜、番茄、马铃薯、甘蓝4 种蔬菜的空白基质提取液配制混合标准工作液(1.3.1节),采用UPLC-MS/MS进行分析,分别以峰面积(y)为纵坐标,质量浓度(x,μg/L)为横坐标绘制标准工作曲线;对低质量浓度(1.25 μg/L)基质匹配标准溶液进行分析,以3 倍信噪比确定方法的检出限,10 倍信噪比确定方法的定量限。如表2所示,在1.25~500 μg/L的质量浓度范围内,呋虫胺及其代谢物的相关系数均大于0.991 4,方法检出限为0.04~0.66 μg/L,方法定量限为0.13~2.20 μg/L,见表2。
表2 线性范围与检出限和定量限
Table 2 Linear ranges, linear regression equations, correlation coefficients (R 2 ), LODs, and LOQs
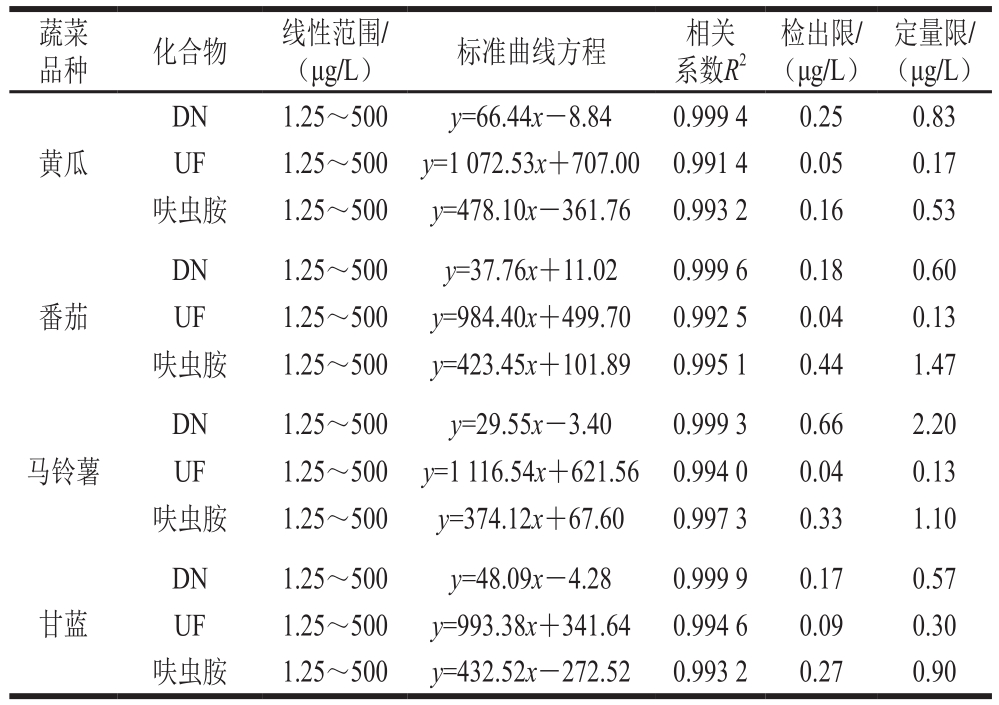
表3 呋虫胺及其代谢物的加标回收率及精密度(n=5)
Table 3 Recoveries and precisions (RSD) of dinotefuran and its metabolites from spiked samples (n= 5)
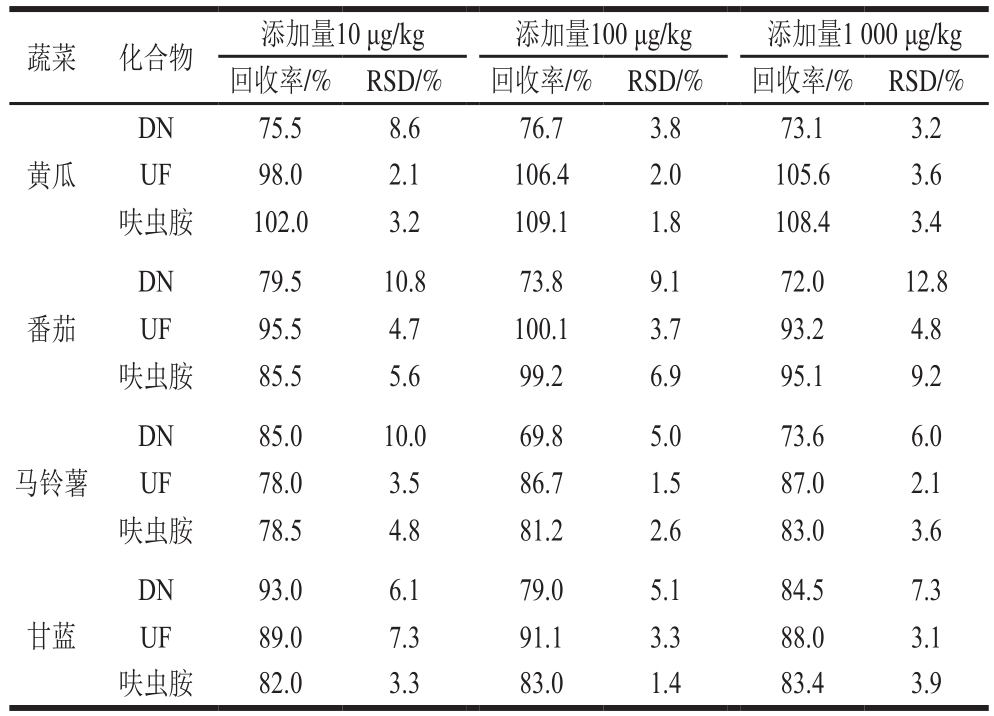
在空白基质中做添加回收实验,添加水平分别为10、100 μg/kg和1 000 μg/kg,每个添加水平重复5 次。如表3所示,在黄瓜、番茄、马铃薯、甘蓝4 种蔬菜中,呋虫胺及其代谢物的添加回收率为72.0%~109.1%,相对标准偏差(relative standard deviation,RSD)为1.4%~12.8%。呋虫胺及其代谢物DN、UF在黄瓜、番茄、马铃薯、甘蓝4 种蔬菜中的最低添加量均为10 μg/kg。
表4 呋虫胺及其代谢物的基质效应(n=3)
Table 4 Matrix effects of dinotefuran and its metabolites (n= 3)
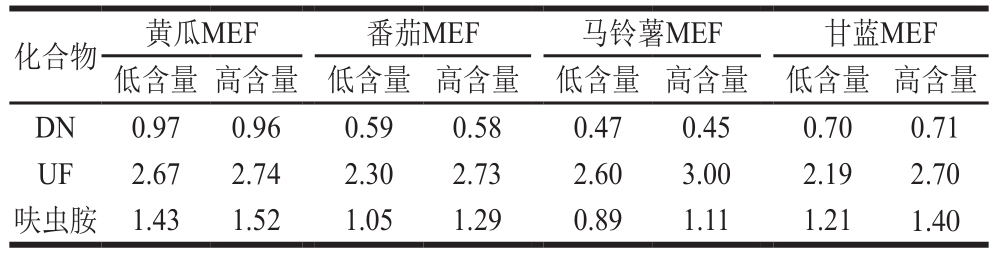
注:基质效应因子(matrix effects factor,MEF)。
本研究考察黄瓜、番茄、马铃薯和甘蓝4 种蔬菜基质中呋虫胺及其代谢物DN、UF的基质效应,分别用溶剂(甲醇-水,2∶3,V/V)和空白基质提取液配制标准溶液,设置12.5 μg/kg(低含量)和125 μg/kg(高含量)以考察不同含量条件下基质效应是否一致,各连续测定3 次。如表4所示,DN在黄瓜基质中表现为弱基质效应(0.8≤MEF≤1.2),在番茄和甘蓝基质中表现为中等强度基质效应(0.5<MEF<0.8),在马铃薯基质中表现为强基质效应(MEF≤0.5)。UF在4 种蔬菜基质中均表现为强基质效应(1.5≤MEF)。呋虫胺在马铃薯基质中表现为弱基质效应(0.8≤MEF≤1.2);在番茄基质中,低浓度表现为弱基质效应(0.8≤MEF≤1.2),高浓度表现为中等强度基质效应(1.2<MEF<1.5);在甘蓝基质中表现为中等强度基质效应(1.2<MEF<1.5);在黄瓜基质中,低浓度表现为中等强度基质效应(1.2<MEF<1.5),高浓度表现为强基质效应(1.5≤MEF)。DN普遍表现为基质减弱效应(MEF≤1),UF和呋虫胺普遍表现为基质增强效应(1≤MEF)。在本研究设置的2 个含量条件下,UF和呋虫胺在高含量条件下的基质效应要高于低含量,但是差异不显著(P<0.05)。考虑到不同蔬菜基质对呋虫胺及其代谢物结果影响较大,为了保证检测结果的准确度,在实际样品的检测过程中,需要使用基质匹配标准溶液才能有效的补偿基质效应对检测结果的干扰。
采用本方法对农贸市场所销售的24 件蔬菜样品(番茄7 件、黄瓜7 件、马铃薯5 件、甘蓝5件)中呋虫胺及其代谢物的残留量进行分析,其中有1 件黄瓜样品中检出呋虫胺,含量为10 μg/kg,DN含量为117 μg/kg,小于GB/T 2763—2016规定最大残留限量值2 mg/kg,其他样品中呋虫胺及其代谢物未检出。
目前鲜见针对蔬菜样品中呋虫胺及其代谢物检测方法的报道,而从近期的农药品种登记情况来看,呋虫胺产品已经被登记使用在番茄、黄瓜、甘蓝、马铃薯等蔬菜品种上。本实验参考欧盟农药残留参考实验室于2013年发布的针对极性农药的QuPPe分析方法,建立了QuPPe-UPLC-MS/MS同时测定蔬菜中呋虫胺及其代谢物农药残留的方法,该方法简单、快速,可满足蔬菜中呋虫胺及其代谢物的快速筛查和定量分析要求。与传统方法相比,QuPPe方法更加简单快速,结合UPLC-MS/MS检测,可以广泛应用于一些水果蔬菜基质中极性农药的快速批量分析。
参考文献:
[1] 李杜, 赵炎, 李红云, 等. 新一代烟碱类杀虫剂呋虫胺及中间体合成新工艺的研究[J]. 农药科学与管理, 2012, 33(9): 12-14.DOI:10.3969/j.issn.1002-5480.2012.09.004.
[2] WAKITA T, KINOSHITA K, YAMADA E, et al. The discovery of dinotefuran: a novel neonicotinoid[J]. Pest Management Science,2003, 59(9): 1016-1022. DOI:10.1002/ps.727.
[3] 孙明娜, 董旭, 王梅, 等. 呋虫胺在水稻中的残留消解及膳食风险评估[J]. 农药学学报, 2016, 18(1): 86-92. DOI:10.16801/j.issn.1008-7303.2016.0010
[4] MORI K, OKUMOTO T, KAWAHARAA N, et al. Interaction of dinotefuran and its analogues with nicotinic acetylcholine receptors of cockroach nerve cords[J]. Pest Management Science, 2002, 58(2):190-196. DOI:10.1002/ps.437.
[5] WATANABE E, BABA K, MIYAKE S. Analytical evaluation of enzyme-linked immunosorbent assay for neonicotinoid dinotefuran for potential application to quick and simple screening method in rice samples[J]. Talanta, 2011, 84(4): 1107-1111. DOI:10.1016/j.talanta.2011.03.019.
[6] 中国农药信息网. 农药登记数据查询[EB/OL]. [2017-09-15]. http://www.chinapesticide.gov.cn.
[7] 国家卫生和计划生育委员会, 农业部, 国家食品药品监督管理总局.食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国标准出版社, 2017: 66-67.
[8] 韦婕, 邓婕, 黄慧俐, 等. 高效液相色谱检测呋虫胺在稻田水和土壤中的残留及消解动态[J]. 农药学学报, 2015, 17(2): 195-200.DOI:10.3969/j.issn.1008-7303.2015.02.11.
[9] 乙小娟, 朱加叶, 丁萍, 等. 高效液相色谱法快速测定大米中的4 种烟碱农药残留量[J]. 食品科学, 2011, 32(6): 169-172.
[10] 刘纪松. 呋虫胺的环境行为及在麦田中的残留动态研究[D]. 南京:南京农业大学, 2015: 22.
[11] 李广领, 谷珊山, 郭文举, 等. 菠菜中3 种新烟碱杀虫剂多残留分析方法研究[J]. 植物保护, 2015, 41(4): 131-135. DOI:10.3969/j.issn.0529-1542.2015.04.024.
[12] HEM L, EL-ATY A M A, PARKA J H, et al. Determination of dinotefuran in pepper using liquid chromatography: contribution to safety evaluation[J]. Journal of the Korean Society for Applied Biological Chemistry, 2012, 55(6): 765-768. DOI:10.1007/s13765-012-2140-3.
[13] 张雯雯, 徐军, 张盈, 等. 超高效液相色谱-串联质谱法检测棉花和土壤中呋虫胺残留[J]. 植物保护, 2015, 41(2): 125-129. DOI:10.3969/j.issn.0529-1542.2015.02.022.
[14] 王冬兰, 简秋, 郑尊涛, 等. 水稻和土壤中呋虫胺残留的固相萃取/液相色谱-串联质谱分析方法[J]. 分析测试学报, 2016, 35(3): 351-354.DOI:10.3969/j.issn.1004-4957.2016.03.017.
[15] 李立, 付建, 初玉圣, 等. 食品中呋虫胺残留量的HPLC-MS/MS检测方法研究[J]. 食品科学, 2008, 29(11): 538-540. DOI:10.3321/j.issn:1002-6630.2008.11.124.
[16] JOVANOV P, GUZSVANY V, FRANKO M, et al. Multi-residue method for determination of selected neonicotinoid insecticides in honey using optimized dispersive liquid-liquid microextraction combined with liquid chromatography-tandem mass spectrometry[J].Talanta, 2013, 111: 125-133. DOI:10.1016/j.talanta.2013.02.059.
[17] KAMEL A. Refined methodology for the determination of neonicotinoid pesticides and their metabolites in honey bees and bee products by liquid chromatography-tandem mass spectrometry (LCMS/MS)[J]. Journal of Agricultural and Food Chemistry, 2010, 58(10):5926-5931. DOI:10.1021/jf904120n.
[18] XIE W, HAN C, QIAN Y, et al. Determination of neonicotinoid pesticides residues in agricultural samples by solid-phase extraction combined with liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2011, 1218: 4426-4433. DOI:10.1016/j.chroma.2011.05.026.
[19] 国家质量监督检验检疫总局. 粮谷中486 种农药及相关化学品残留量的测定 液相色谱-串联质谱法: GB/T 20770—2008[S]. 北京: 中国标准出版社, 2008: 18.
[20] 国家食品药品监督管理总局. 食品中呋虫胺残留量的测定 液相色谱-质谱/质谱法: GB 23200.51—2016[S]. 北京: 中国标准出版社,2016: 1-9.
[21] 国家食品药品监督管理总局. 食品中烯啶虫胺、呋虫胺等20 种农药残留量的测定 液相色谱-质谱/质谱法: GB 23200.37—2016[S].北京: 中国标准出版社, 2016: 3-15.
[22] 董旭, 段劲生, 王梅, 等. 呋虫胺及其代谢物在稻田环境中的残留规律[J]. 农药, 2016, 55(10): 753-756; 777. DOI:10.16820/j.cnki.1006-0413.2016.10.014.
[23] 李瑞娟, 宋国春, 于建垒, 等. 同时检测粮谷中呋虫胺及其代谢物UF、DN残留量的方法: CN105842357A[P/OL]. 2016-08-10. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCPD&dbname=SCPD2016&filename=CN105842357A.
[24] CHEN Z, DONG F, LI S, et al. Response surface methodology for the enantioseparation of dinotefuran and its chiral metabolite in bee products and environmental samples by supercritical fluid chromatography/tandem mass spectrometry[J]. Journal of Chromatography A, 2015, 1410: 181-189. DOI:10.1016/j.chroma.2015.07.067.
[25] RAHMAN M M, PARK J H, EL-ATY A M A, et al. Feasibility and application of an HPLC/UVD to determine dinotefuran and its shorter wavelength metabolites residues in melon with tandem mass confirmation[J]. Food Chemistry, 2013, 136(2): 1038-1046.DOI:10.1016/j.foodchem.2012.08.064.
[26] RAHMANA M M, EL-ATY A M A, CHOI J H, et al. Consequences of the matrix effect on recovery of dinotefuran and its metabolites in green tea during tandem mass spectrometry analysis[J]. Food Chemistry, 2015, 168: 445-453. DOI:10.1016/j.foodchem.2014.07.095.
[27] ANASTASSIADES M, KOLBERG D I, MACK D, et al. Quick method for the analysis of residues of numerous highly polar pesticides in foods of plant origin involving simultaneous extraction with methanol and LC-MS/MS determination[EB/OL]. (2013-05-02)[2017-09-15]. http://www.eurl-pesticides.eu/userfiles/file/EurlSRM/meth_QuPPe-PO_EurlSRM.pdf.
[28] KOLBERG D I S, ZECHMANN S, WILDGRUBE C, et al.Determination of triazole derivative metabo-lites (TDMs) in Fruit and vegetables using the QuPPe method and differential mobility spectrometry (DMS) and survey of the residue situation in organic and conventional produce[EB/OL]. (2016-05-02) [2017-09-15]. http://ejournal.cvuas.de/issue201602.asp.
[29] HAN Y, SONG L, ZHAO P, et al. Residue determination of glufosinate in plant origin foods using modified quick polar pesticides (QuPPe)method and liquid chromatography coupled with tandem mass spectrometry[J]. Food Chemistry, 2016, 197: 730-736. DOI:10.1016/j.foodchem.2015.11.021.
[30] HEPPERLE J, WOLHEIM A, KOLBERG D, et al. Analysis of perchlorate in food samples of plant origin applying the QuPPemethod and LC-MS/MS[EB/OL]. (2013-05-02) [2017-09-15]. http://ejournal.cvuas.de/docs/cvuas_ejournal_201302.pdf.
Simultaneous Determination of Dinotefuran and Its Metabolites in Vegetables by QuPPe-UPLC-MS/MS
WU Yancan 1,2 , JIANG Bingxin 1 , SHI Yanhong 3, *, QI Chuanyong 2 , CAO Haiqun 1 , TANG Jun 3 , SHANG Luning 2 , SU Yiling 2
(1. School of Plant Protection, Anhui Agricultural University, Hefei 230036, China;2. Hefei Testing and Inspection Center for Agricultural Products Quality, Hefei 230091, China;3. School of Resources and Environment, Anhui Agricultural University, Hefei 230036, China)
Abstract: A method for the simultaneous identification and quantification of dinotefuran and its metabolites 1-methyl-3-(tetrahydro-3-furylmethyl) guanidium dihydrogen (DN) and 1-methyl-3-(tetrahydro-3-furylmethyl) urea (UF) in vegetables(cucumber, tomato, potato, and cabbage) was developed using quick polar pesticides (QuPPe) extraction procedure combined with ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The analytes were separated on a UPLC BEH-C 18 column, detected in the positive ion mode (ESI + ) using multiple reaction monitoring (MRM), and quantified by an external standard method. The proposed method showed good linearity in the range of 1.25–500 μg/L with regression coeきcients of higher than 0.991. The limits of detection (LODs) ranged between 0.04 and 0.66 μg/L, and the limits of quantification (LOQs) were between 0.13 and 2.20 μg/L. The average recoveries of the analytes from spiked samples of cucumber, tomato, potato, and cabbage (the lowest spiked concentration level was 10 μg/kg) were in the range of 72.0%–109.1% with good precisions (relative standard deviation, RSD = 1.4%–12.8%). The majority of the analytes exhibited moderate or strong matrix effects. Results suggested that the method is simple, accurate, eきcient and useful for rapid screening and quantitative analysis of dinotefuran and its metabolites in vegetables.
Keywords: dinotefuran; metabolites; quick polar pesticides (QuPPe) extraction; vegetables; ultra performance liquid chromatography-tandem mass spectrometry; matrix effects
WU Yancan, JIANG Bingxin, SHI Yanhong, et al. Simultaneous determination of dinotefuran and its metabolites in vegetables by QuPPe-UPLC-MS/MS[J]. Food Science, 2018, 39(18): 262-266. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201818040. http://www.spkx.net.cn
吴延灿, 蒋冰心, 施艳红, 等. QuPPe-超高效液相色谱-串联质谱法测定蔬菜中呋虫胺及其代谢物残留[J]. 食品科学,2018, 39(18): 262-266. DOI:10.7506/spkx1002-6630-201818040. http://www.spkx.net.cn
文章编号: 1002-6630(2018)18-0262-05
引文格式:
中图分类号: O657
文献标志码: A
*通信作者简介: 施艳红(1976—),女,副教授,博士研究生,研究方向为农药残留与环境毒理。E-mail:shiyh@ahau.edu.cn
DOI: 10.7506/spkx1002-6630-201818040
基金项目: 国家自然科学基金青年科学基金项目(31601663)
第一作者简介: 吴延灿(1989—),男,博士研究生,研究方向为食品质量安全与农药残留分析。E-mail:wuyancan1989@163.com
收稿日期: 2017-09-30