不同前处理方法对猪组织中喹诺酮类兽药残留检测效果对比
王 杰,裴 斐,李 彭,白宇杰,方 勇,杨文建,马 宁,胡秋辉*
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
摘 要: 采用超高效液相色谱-三重四极杆质谱和飞行时间质谱技术,比较EMR-L、Oasis PRiME HLB和液液萃取法对猪组织中16 种喹诺酮类兽药残留检测效果的影响。目标兽药以基质匹配工作曲线进行定量,在1.0~100.0 μg/L范围内线性关系良好,在5、10、20 μg/kg加标量条件下使用超高效液相色谱-串联质谱检测,EMR-L和Oasis PRiME HLB方法处理的猪组织中加标回收率(71.7%~106.9%、70.7%~118.3%)、相对标准偏差(0.2%~16.8%、0.1%~17.8%)、定量限(0.13~0.56、0.27~1.36 μg/kg)和检出限(0.04~0.23、0.08~0.41 μg/kg)均满足方法学要求。针对不同基质成分样品,采用不同的前处理技术减少假阳性结果的产生,以适用于日益增长的动物源性食品兽药残留检测的需求。本研究采用的2 种方法操作简便、灵敏度高、重复性好,满足对猪组织中多兽药残留的定性、定量分析。
关键词: EMR-L;Oasis PRiME HLB;液液萃取;喹诺酮类;猪组织
喹诺酮类药物又称吡酮酸类或吡啶酮酸类,是人工合成的含4-喹诺酮基本结构的抗菌药。其主要以阻断DNA回旋酶,进一步造成细菌DNA的不可逆损害来达到抗菌效果 [1-3] 。目前应用于临床的喹诺酮类药物主要有诺氟沙星(norfloxacin,NOR)、环丙沙星(ciprofloxacin,CIP)、氧氟沙星(ofloxacin,OFL)等,该类药物对多种革兰氏阴性菌有良好的杀菌作用,并且价格低廉、抗菌谱广,被广泛应用于临床及兽药领域 [4-7] 。然而由于喹诺酮类药物有致癌、致畸、致突变的特点,滥用引发的环境危害和人类疾病风险成为目前的焦点,美国和欧盟都对喹诺酮类药物做出了相应的残留限量标准,我国农业部也已禁用洛美沙星(lomefloxacin,LOM)、培氟沙星(pefloxacin,PEF)、OFL和NOR 4 种合成抗菌药,并且规定动物肌肉组织中恩诺沙星(enrofloxacin,ENR)、达氟沙星、氟甲喹(flumequine,FLU)、沙拉沙星(sarafloxacin,SAR)、二氟沙星(difloxacin,DIF)、恶喹酸(oxolinic acid,OXO)的最高残留限量在10~500 μg/kg [8-9] 之间。因此,建立一种快速、便捷、高通量的方法对满足日益增长的监管需求具有重要意义。
动物源性食品具有基质复杂、干扰物质多、不易分离提纯等特点,因而前处理方法和质谱技术是影响兽药检测的关键 [10] 。传统的样品前处理方法包括液液萃取(liquid-liquid extraction,LLE)和固相萃取(solidphase extraction,SPE)等,近年来QuEChERS(quick,easy, cheap, effective, rugged, safe)法因其快速、便捷、有效等特点被由农药残留检测逐步应用于兽药残留检测领域 [11-13] 。然而QuEChERS方法还有许多方面需要改进,目前QuEChERS方法主要应用于低脂肪食品中,因此寻找适合于高脂肪的吸附剂对于兽残检测来说尤为重要。近期Agilent公司推出的增强型脂质去除 (enhanced matrix removal-lipid,EMR-L)技术是建立在QuEChERS法基础上的分散固相萃取盐包,它集成了QuEChERS方法的优点并采用了创新性的新型吸附剂,简化了传统操作步骤,对于兽药残留检测市场具有很好的前景 [14-17] 。EMR-L萃取技术包含两部分,EMR-L Polish管由1.6 g无水硫酸镁和0.4 g氯化钠组成,EMR-L d-SPE管中含有1.0 g特殊的吸附剂。Anumol等 [18] 对EMR-L与传统分散固相萃取技术做了系统的比较,研究表明与传统分散固相萃取技术相比,EMR-L在前处理后的基质共提物和产生的基质效应方面有显著优势,并且证明EMR-L由于其良好的净化效果可以很好地契合高分辨质谱满足高通量筛查。另外,Waters公司的Oasis PRiME HLB固相萃取柱系列一直是备受业界青睐的前处理产品 [19-22] ,固相填料由亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮聚合成,该方法操作便捷,只需经过简单前处理一步过柱,无需活化与平衡就能上机测样。Li Xiaowei等 [21] 运用Oasis PRiME HLB方法结合液相色谱-质谱联用技术检测猪粪中82 种兽药残留,97%兽药的定量限低于5 μg/kg,平均回收率在60%~110%之间。质谱法发展至今已经成为农兽残检测的重要手段,超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)基于其强大的定量和痕量检测能力可以同时检测识别数百种目标化合物,在兽药分析领域占据主导地位。高分辨质谱如四极杆飞行时间串联质谱(quadrupole-time-of-flight tandem mass spectrometry,Q-TOF/MS)作为一种广谱化的检测技术,其全扫描模式可提供碎片离子的精确质量数,优良的定性能力可以大大减少假阳性结果的产生 [23-24] 。
从目前文献来看,前处理方法种类繁多,应用于不同的质谱技术上有不同的结果,缺少对市售商业去脂产品的系统比较,不能很好地整合人力成本和时间成本。我国是猪养殖与消费大国,猪组织消耗量占世界总产量一半以上,因此开发建立猪组织中喹诺酮便捷可靠检测方法是保障猪组织质量安全的重要基础。基于此,本研究选用Oasis PRiME HLB固相萃取柱以及EMR-L萃取盐包,以传统的乙腈一步提取、正己烷去脂的LLE法作为对照,结合不同的质谱平台系统综合地研究比较三者的差异,旨在探索“猪肉基质-前处理手段-质谱检测类型”之间的适用匹配关系,为拓展兽残检测方法、提升检测技术水平、保障食品安全,提供技术参考和理论依据。
1 材料与方法
1.1 材料与试剂
新鲜猪肉、猪肝、猪肾,购自南京仙林农贸市场。
16 种喹诺酮类标准品(纯度≥99%):CIP(CAS#:85721-33-1)、克林沙星(clinafloxacin,CLX,CAS#:105956-97-6)、ENR(CAS#:93106-60-6)、FLU(CAS#:42835-25-6)、LOM(CAS#:98079-51-7)、NOR(CAS#:70458-96-7)、OFL(CAS#:82419-36-1)、SAR(CAS#:98105-99-8)、OXO(CAS#:14698-29-4)、PEF(CAS#:70458-92-3)、依诺沙星(enoxacin,ENO,CAS#:74011-58-8)、萘啶酸(nalidixic acid,NDA,CAS#:389-08-2)、西诺沙星(cinoxacin,CIN,CAS#:28657-80-9)、DIF(CAS#:98106-17-3)、奥比沙星(orbifloxacin,ORB,CAS#:113617-63-3)、司帕沙星(sparfloxacin,SPA,CAS#:110871-86-8) 美国Sigma公司;乙腈、甲醇、甲酸、正己烷(均为色谱纯)德国Merck公司。
16 种标准品分别称取10 mg于10 mL容量瓶中,用甲醇溶解定容配制成质量浓度为1 000 mg/L的单元素标准储备液,置于-20 ℃冰箱中贮存,保存期限为1 个月。根据需要将上述储备液混合稀释成不同质量浓度的混合标准溶液,现用现配。
1.2 仪器与设备
Xevo TQ-S UPLC-MS联用仪(包括Acquity UPLC系统、电喷雾离子源及MassLynx4.1数据处理系统)、Oasis PRiME HLB固相萃取柱 美国Waters公司;Triple TOF 5600+TOF/MS仪(配有电喷雾离子源及Analyst1.7数据处理系统) 美国AB公司;Nexer系列UPLC仪(配有DGU-20A5R脱气机、SIL-30AC自动进样器、SPDM-20A紫外检测器、CTO-30A柱温箱及LC-30AD溶液输送单元) 日本岛津公司;Infinity Lab Poroshell 120 EC-C 18 色谱柱(2.1 mm×100 mm,2.7 μm)、EMR-Lipid QuEChERS萃取盐包 美国Agilent公司;Milli-Q超纯水仪 美国Millipore公司;DL-5C离心机 上海安亭科学仪器厂;T18均质机 德国IKA公司;XW-80A微型旋涡混合仪 上海沪西分析仪器厂。
1.3 方法
1.3.1 色谱条件
色谱柱:Infinity Lab Poroshell 120 EC-C 18 色谱柱(2.1 mm×100 mm,2.7 μm);流速0.2 mL/min;柱温40 ℃;进样量5 μL。流动相A:0.1 %甲酸溶液;流动相B:0.1%甲酸-乙腈溶液。梯度洗脱程序:0~2.5 min,5%~55% B;2.5~5 min,55%~90% B;5~7 min,90%~5% B。UPLC-MS/MS与UPLC-Q-TOF/MS色谱条件相同。
1.3.2 MS条件
1.3.2.1 MS/MS条件
电喷雾离子源,正离子模式;脱溶剂温度450 ℃;毛细管电压2 300 V;脱溶剂气流速850 L/min;锥孔反吹气流速50 L/min;采集模式:多反应监测模式(multiple reaction monitoring,MRM)。质谱采集参数见表1。
表1 16 种喹诺酮类药物的质谱采集参数
Table 1 Parameters for UPLC-MS/MS analysis of the 16 quinolones
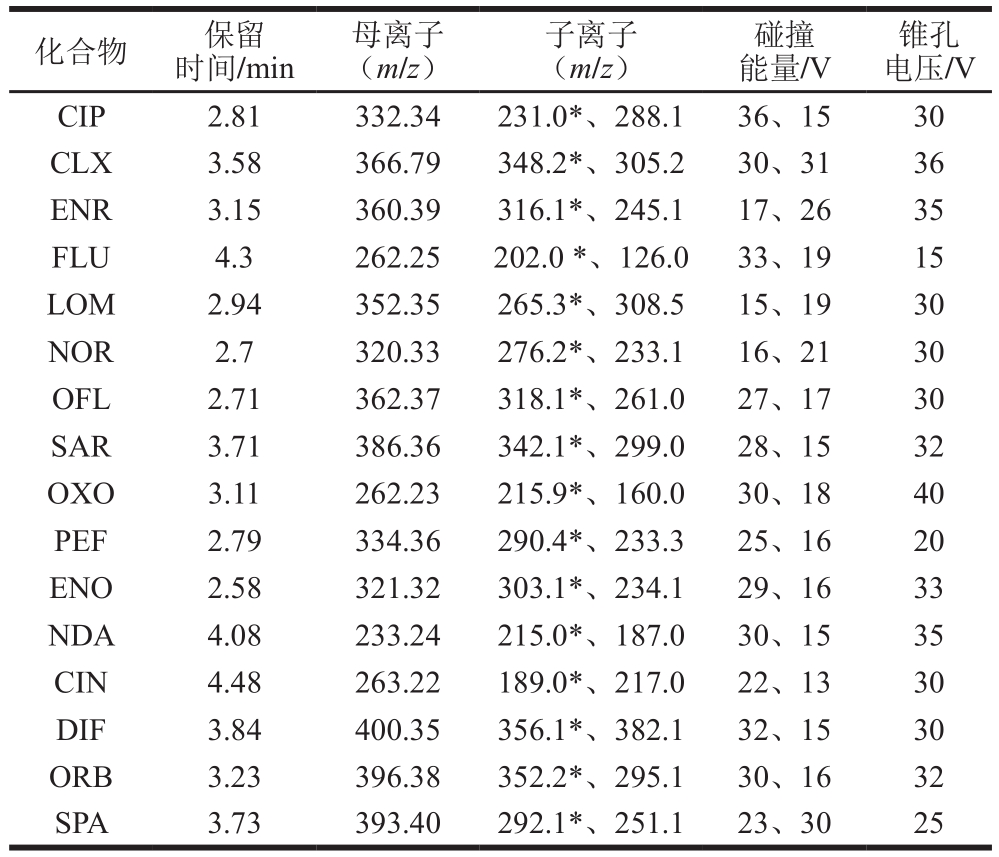
注:*.定量离子。
锥孔电压/V CIP 2.81 332.34 231.0*、288.1 36、15 30 CLX 3.58 366.79 348.2*、305.2 30、31 36 ENR 3.15 360.39 316.1*、245.1 17、26 35 FLU 4.3 262.25 202.0 *、126.0 33、19 15 LOM 2.94 352.35 265.3*、308.5 15、19 30 NOR 2.7 320.33 276.2*、233.1 16、21 30 OFL 2.71 362.37 318.1*、261.0 27、17 30 SAR 3.71 386.36 342.1*、299.0 28、15 32 OXO 3.11 262.23 215.9*、160.0 30、18 40 PEF 2.79 334.36 290.4*、233.3 25、16 20 ENO 2.58 321.32 303.1*、234.1 29、16 33 NDA 4.08 233.24 215.0*、187.0 30、15 35 CIN 4.48 263.22 189.0*、217.0 22、13 30 DIF 3.84 400.35 356.1*、382.1 32、15 30 ORB 3.23 396.38 352.2*、295.1 30、16 32 SPA 3.73 393.40 292.1*、251.1 23、30 25化合物 保留时间/min母离子(m/z)子离子(m/z)碰撞能量/V
1.3.2.2 Q-TOF/MS条件
电喷雾离子源,正离子模式;离子源温度550 ℃;电喷雾电压5 500 V;雾化气(GS1)流速55 μL/min;辅助加热气(GS2)流速55 μL/min;气帘气流速35 μL/min;去簇电压80 V;碰撞电压10 V;离子富集时间0.1 s;质量扫描范围m/z 100~1 000;采集模式:全离子扫描串联信息依赖检索(information dependent acquisition,IDA)。IDA模式下,去簇电压80 V;碰撞电压35 V;碰撞能量散布范围15 V;离子富集时间0.05 s。
1.3.3 样品前处理
1.3.3.1 提取
将猪肉、猪肝及猪肾分别搅拌均质后称取2 g(精确至0.1 g)于50 mL离心管中,加入10 mL含有0.1%甲酸的乙腈溶液,于旋涡混匀器上涡旋5 min后在40 ℃中超声水浴10 min,以4 000 r/min离心5 min,取上清液备用。
1.3.3.2 净化
EMR-L法:将5 mL超纯水加入EMR-L dSPE管中,涡旋15 s使其充分活化。取5 mL上清液立即加入活化后的EMR-L dSPE管中,涡旋5 min,40 ℃超声水浴10 min,以4 000 r/min离心5 min,收集5 mL上清液加入EMR-L Polish管中,重复上述涡旋、超声及离心步骤,取上清液过0.22 μm滤膜待测。
Oasis PRiME HLB法:取5 mL上清液装载至6 mL 200 mg规格Oasis PRiME HLB固相萃取柱中,无需活化和平衡,保持1 s一滴流速,收集流出液并过0.22 μm滤膜待测。
LLE法:将10 mL正己烷加入上清液中,涡旋振荡5 min后静置分层,去除上层正己烷层,重复去脂1 次,取下层清液过0.22 μm滤膜待测。
2 结果与分析
2.1 基质提取物
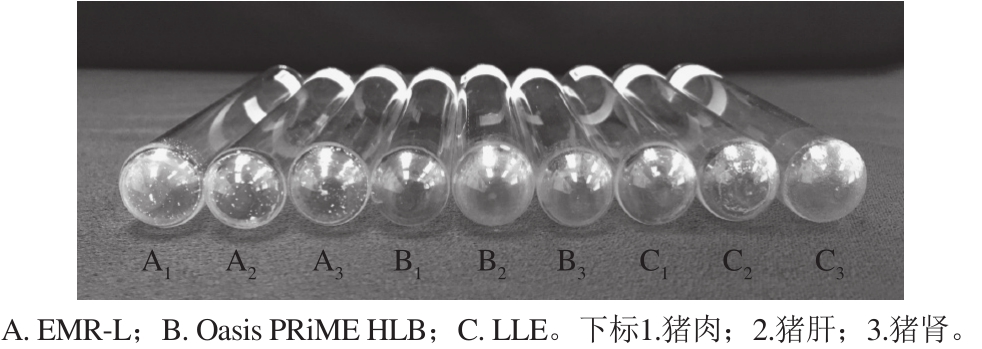
图1 猪组织中3 种方法处理后的基质提取物
Fig. 1 Extractives in porcine tissues with three sample preparation methods
基质提取物的比较是评价高通量检测方法可行性的重要标准 [25] ,通过EMR-L、Oasis PRiME HLB和LLE法分别净化过的猪肉、猪肝和猪肾基质,取1 mL烘干后的基质提取物见图1。由于喹诺酮类药物大多含有哌嗪和喹啉结构,呈弱碱性,因此在乙腈中加入少量甲酸可以有效促进其离子化效率。由图1可知,Oasis PRiME HLB方法的净化效果明显优于以单一溶剂提取的LLE法,这是因为其亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮聚合成的固相填料可以很好地吸附脂质 [26] 。EMR-L方法处理样品中有少量盐类物质析出,这是由于EMR-L方法的盐析步骤中含有大量NaCl和MgSO 4 。为了深入探索基质提取物对分离测定的影响,本研究分别考察3 种方法提取净化过后的样品质谱信号,重复进样100 次后,EMR-L与LLE法所处理样品的信号强度及峰形均有不同程度的降低,基线噪音与相对标准偏差(relative standard deviation,RSD)显著增高。研究证明大量的盐类及脂质会降低色谱分离和离子源电离效率,并会显著影响仪器灵敏度 [27] 。
2.2 基质效应
表2 猪组织中喹诺酮类兽药在UPLC-MS/MS检测下的基质效应
Table 2 Matrix effects for UPLC-MS/MS analysis of quinolones in porcine tissues using three sample preparation methods
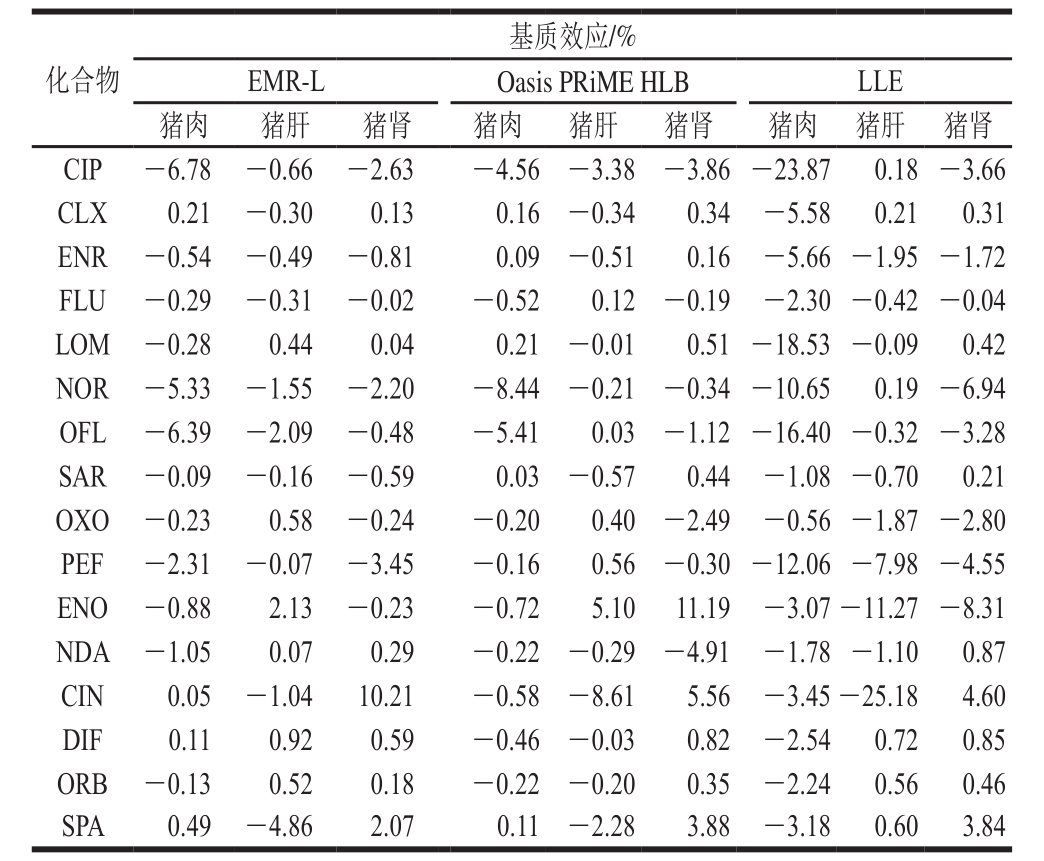
化合物基质效应/%EMR-L Oasis PRiME HLB LLE猪肉 猪肝 猪肾 猪肉 猪肝 猪肾 猪肉 猪肝 猪肾CIP -6.78 -0.66 -2.63 -4.56 -3.38-3.86-23.87 0.18-3.66 CLX 0.21 -0.30 0.13 0.16 -0.34 0.34 -5.58 0.21 0.31 ENR -0.54 -0.49 -0.81 0.09 -0.51 0.16 -5.66-1.95-1.72 FLU -0.29 -0.31 -0.02 -0.52 0.12-0.19 -2.30-0.42-0.04 LOM -0.28 0.44 0.04 0.21 -0.01 0.51-18.53-0.09 0.42 NOR -5.33 -1.55 -2.20 -8.44-0.21-0.34-10.65 0.19-6.94 OFL -6.39 -2.09 -0.48 -5.41 0.03-1.12-16.40-0.32-3.28 SAR -0.09 -0.16 -0.59 0.03 -0.57 0.44 -1.08-0.70 0.21 OXO -0.23 0.58 -0.24 -0.20 0.40-2.49 -0.56-1.87-2.80 PEF -2.31 -0.07 -3.45 -0.16 0.56-0.30-12.06-7.98-4.55 ENO -0.88 2.13 -0.23 -0.72 5.10 11.19 -3.07-11.27-8.31 NDA -1.05 0.07 0.29 -0.22 -0.29-4.91 -1.78-1.10 0.87 CIN 0.05 -1.04 10.21 -0.58 -8.61 5.56 -3.45-25.18 4.60 DIF 0.11 0.92 0.59 -0.46 -0.03 0.82 -2.54 0.72 0.85 ORB -0.13 0.52 0.18 -0.22 -0.20 0.35 -2.24 0.56 0.46 SPA 0.49 -4.86 2.07 0.11 -2.28 3.88 -3.18 0.60 3.84
基质效应是指样品中被分析物之外的组分,与目标分析物竞争电离所产生的影响。对于复杂样品的质谱分析中,特别是电喷雾离子源,如何减少基质效应是尤为关键的问题 [28] ,因此本研究采用基质标准曲线减少基质效应。制备基质标准曲线与对应质量浓度的溶剂标准曲线(加标量1、5、10、20、50、100 μg/kg),根据基质标准曲线与溶剂标准曲线斜率比值减1评价不同方法处理不同基质时的基质效应。当基质效应在±20%时,表明基质效应不明显;当基质效应大于20%时,表明有基质增强效应;当基质效应小于-20%时,表明有基质抑制效应。从表2可以看出,绝大部分喹诺酮类兽药在3 种基质和3 种前处理方法中基质效应不明显,仅有CIP和CIN在LLE法中出现了较强的基质抑制效应。因此,为了获得更好的定量效果,本研究使用空白基质匹配标准曲线来抵消基质效应。
2.3 方法学验证
将猪肉、猪肝、猪肾空白样品,配制6 个梯度水平的基质匹配混合标准溶液上机测定。以定量离子峰面积(y)为纵坐标,质量浓度(x,μg/L)为横坐标作定量工作曲线,得到猪组织中线性回归方程的相关系数r分别为0.991 4~0.999 9(EMR-L)、0.993 2~0.999 1(Oasis PRiME HLB)、0.990 2~1.000 0(LLE),表明经过3 种方法处理过的16 种喹诺酮类药物在1.0~100.0 μg/L范围内线性关系良好。以3 倍信噪比计算得到检出限分别为0.04~0.23(EMR-L)、0.08~0.41(Oasis PRiME HLB)、0.21~1.07 μg/kg(LLE),10 倍信噪比算得定量限分别为0.13~0.56(EMR-L)、0.27~1.36(Oasis PRiME HLB)、0.70~3.57 μg/kg(LLE)。
取空白样品加入16 种喹诺酮类混合标准溶液,配制成5、10、20 μg/kg 3 个水平的添加样品各6 份,进行回收率实验,如表3所示。EMR-L平均回收率(RSD)分别为猪肉:71.7%~98.1%(0.5%~9.0%),猪肝:80.3%~106.7%(0.2%~16.8%),猪肾:75.0%~106.9%(0.8%~14.3%);Oasis PRiME HLB平均回收率(RSD)分别为猪肉:76.1%~106.1%(0.2%~17.8%),猪肝:71.8%~118.3%(0.1%~15.6%),猪肾:70.7%~93.9%(1.3%~7.5%);LLE平均回收率(RSD)分别为猪肉:52.3%~98.8%(0.5%~11.5%),猪肝:64.4%~99.6%(0.3%~9.7%),猪肾:60.4%~87.6%(0.7%~18.8%),LLE方法所测样品中不在70%~120%之间的比例约为12.5%。由于猪肉、猪肝、猪肾样品含水量、基质组成成分差异等特点,与Oasis PRiME HLB相比EMR-L对含水量较高的猪肝、猪肾样品有较好的重复性;而Oasis PRiME HLB基于其特殊的亲脂平衡性,对于脂肪含量较高的猪肉有更好的脂质吸附效果。
表3 猪组织中喹诺酮类兽药在UPLC-MS/MS检测下的加标回收率和精密度(n=6)
Table 3 Recoveries and precision (RSDs) for quinolones spiked into porcine with three sample preparation methods by UPLC-MS/MS (n= 6)

回收率(相对标准偏差)/%EMR-L Oasis PRiME HLB LLE猪肉 猪肝 猪肾 猪肉 猪肝 猪肾 猪肉 猪肝 猪肾化合物 加标量/(μg/kg)CIP 5 79.2(7.1) 92.6(0.7) 89.6(4.5) 96.8(3.0) 71.8(2.94) 75.5(5.5) 67.5(0.7) 78.3(3.1) 70.2(7.6)10 80.8(6.9) 106.6(1.6) 99.6(14.3) 96.2(6.4) 76.1(9.6) 79.6(2.8) 52.5(2.2) 72.1(6.2) 61.7(2.6)20 73.2(4.4) 92.3(5.1) 97.8(8.2) 92.1(2.1) 74.7(11.6) 87.4(3.0) 72.2(6.1) 65.7(6.2) 75.4(3.9)CLX 5 82.7(3.7) 93.0(3.5) 84.1(2.8) 94.4(5.1) 74.5(3.4) 79.2(2.5) 65.7(2.5) 79.5(3.6) 64.7(6.6)10 85.5(3.4) 91.1(0.4) 96.9(11.9) 98.3 (7.7) 88.7(2.3) 73.5(4.8) 52.3(1.2) 72.6(6.8) 66.2(1.1)20 77.1(3.2) 101.2(1.8) 95.7(5.2) 86.5(4.0) 83.9(6.7) 77.7(1.8) 83.6(5.0) 69.5(1.8) 78.2(1.9)ENR 5 75.9(4.0) 97.1(7.1) 95.3(5.2) 81.43(5.7) 94.7(5.4) 70.7(1.8) 76.1(2.6) 79.7(8.0) 71.5(4.0)10 80.0(3.4) 86.4(5.6) 90.3(7.2) 98.6(11.4) 94.7(1.3) 78.9(6.7) 78.4(3.5) 85.0(5.2) 70.7(3.1)20 77.3(3.4) 97.6(3.2) 94.1(10.9) 98.6(0.8) 97.0(8.4) 87.5(4.9) 81.0(5.8) 95.6(8.0) 82.2(4.1)FLU 5 78.9(4.6) 94.7(4.2) 85.4(2.3) 88.3(3.0) 88.2(1.7) 72.3(1.8) 85.1(0.5) 73.4(4.1) 80.7(1.0)10 72.7(6.7) 92.7(3.9) 91.7(8.9) 97.7(4.3) 94.0(4.1) 81.2(3.0) 76.8(0.7) 95.9(4.5) 78.8(2.4)20 83.7(3.0) 100.7(3.0) 91.3(10.9) 90.2(8.5) 93.3(4.9) 85.4(5.2) 83.5(2.0) 91.9(3.1) 81.6(5.0)LOM 5 71.9(5.0) 94.8(16.8) 90.2(7.6) 82.8 (4.5) 99.2(6.29) 73.8(2.3) 70.6(3.3) 99.6(9.4) 72.6(2.9)10 80.2(3.2) 94.8(4.5) 98.2(13.7) 98.1(7.01) 90.7(6.5) 79.8(6.0) 77.8(4.21)96.1(4.6) 71.6(3.2)20 82.0(2.7) 97.93(5.7) 93.9(9.1) 90.2(10.5) 90.1(3.3) 73.8(4.9) 73.0(7.7) 78.1(3.2) 80.8(1.2)NOR 5 79.4(7.3) 93.5(5.0) 100.1(0.8) 97.6(2.3) 81.5(3.1) 81.0(4.5) 66.5(1.9) 83.6(5.3) 62.4(2.9)10 79.8(4.3) 93.8(1.2) 96.8(10.3) 93.6(17.8) 81.5(2.5) 76.6(1.5) 73.0(2.8) 86.1(6.8) 65.7(5.0)20 78.7(4.3) 102.4(3.1) 99.3(6.9) 94.9(1.7) 76.5(10.7) 83.9(5.7) 83.8(6.1) 70.6(5.2) 73.9(4.9)OFL 5 81.9(3.5) 103.6(7.9) 84.1(10.2) 85.7(2.0) 84.4(5.7) 81.3(3.3) 80.0(2.9)73.85(2.3)77.6(1.6)10 77.4(4.4) 97.8(2.0) 105.3(8.8) 98.5(16.8) 101.5(2.3) 76.3(5.2) 64.8(1.5) 93.7(4.8) 79.0(3.0)20 90.0(4.3) 93.0(3.9) 86.1(10.2) 95.3(3.0) 98.0(7.9) 84.0(2.5) 80.3(3.5) 89.8(2.9) 80.5(5.3)SAR 5 86.2(3.1) 85.4(4.8) 86.0(8.3) 92.2(4.0) 100.8(3.8) 76.3(1.6) 66.6(2.4) 75.3(7.7) 76.3(0.7)10 71.7(1.9) 84.6(2.1) 75.0(10.4) 102.7(7.6) 85.7(4.3) 78.9(3.5) 98.8(3.6) 98.0(5.1) 69.7(2.9)20 80.7(2.7) 98.9(5.2) 83.3(11.6) 93.2(6.5) 83.4(5.2) 77.6(3.2) 81.0(8.6) 79.1(2.8) 75.7(5.5)OXO 5 78.6(4.2) 80.3(3.3) 90.8(4.5) 87.5(5.4) 76.5(3.0) 77.1(6.4) 87.3(6.2) 70.0(5.7) 75.8(5.2)10 81.7(2.0) 98.8(3.0) 97.7(7.2) 102.7(1.7) 106.6(5.3) 78.9(5.1) 86.2(1.7) 81.0(2.1) 82.4(7.0)20 76.4(2.6) 92.9(4.4) 101.5(8.7) 84.4(4.6) 103.8(4.0) 80.7(1.5) 84.2(3.8) 95.0(3.1) 83.9(2.6)PEF 5 79.9(5.5) 87.8(4.7) 92.4(7.7) 76.1(3.3) 95.0(3.5) 75.8(1.6) 73.5(2.2) 75.7(9.7) 80.0(2.6)10 81.9(3.4) 84.6(0.3) 98.8(11.2) 98.1(15.1) 89.5(5.3) 84.0(2.8) 64.7(1.8) 92.2(4.7) 76.9(4.4)20 80.7(9.0) 101.2(4.3) 106.3(9.4) 88.3(4.7) 92.5(15.6) 89.5(4.9) 84.7(5.5) 80.5(3.4) 87.6(3.1)ENO 5 78.0(4.1) 80.9(6.78) 91.5(14.3) 95.1(4.5) 87.0(7.14) 79.5(2.6) 76.4(3.6) 77.7(5.0)60.4(11.1)10 80.2(1.0) 83.2(1.2) 90.0(9.3) 91.2(10.4) 77.5(10.2) 77.1(6.0) 71.5(11.5)88.6(4.5)80.5(18.8)20 85.3(2.7) 96.0(2.0) 88.0(11.2) 93.4(2.4) 81.2(5.9) 86.7(6.1) 80.9(2.4) 64.4(4.8) 73.4(8.5)NDA 5 71.7(1.7) 87.5(5.5) 106.9(3.1) 83.6(3.8) 99.6(2.8) 72.5(4.9) 85.7(1.0) 79.1(4.7) 86.8(3.5)10 94.9(4.0) 87.4(2.1) 84.2(12.3) 99.8(2.9) 94.3(0.1) 73.0(5.9) 81.1(6.7) 87.7(2.6) 77.7(2.6)20 98.1(3.5) 106.7(4.6) 104.2(9.1) 94.4(4.7) 91.2(2.0) 82.3(2.8) 80.1(5.1) 87.0(2.7) 81.2(2.3)5 93.9(3.1) 101.8(6.3) 87.1(3.0) 92.0(4.7) 75.9(1.5) 80.5(2.7) 73.2(6.2) 84.1(4.9) 86.6(4.1)10 84.7(5.2) 95.4(1.6) 77.9(5.7) 98.6(5.3) 93.0(2.1) 79.2(3.5) 77.9(5.7) 94.2(3.4) 82.6(3.6)20 95.8(2.6) 103.4(3.9) 77.5(4.6) 95.1(2.9) 93.0(0.8) 82.6(2.8) 77.5(4.6) 83.0(2.7) 78.9(3.6)CIN DIF 5 77.0(6.5) 92.4(7.1) 80.9(6.3) 81.6(0.2) 91.6(7.1) 74.6(7.5) 80.9(6.3) 79.0(3.0) 78.2(1.1)10 72.5(5.3) 93.3(2.6) 76.1(5.6) 97.1(2.4) 94.5(2.6) 78.0(5.5) 76.1(5.6) 81.9(4.5) 76.6(4.5)20 86.4(5.7) 106.3(5.1) 83.1(5.1) 91.6(4.1) 93.9(3.0) 79.6(2.1) 83.1(5.1) 85.4(2.0) 82.1(5.9)ORB 5 87.1(0.5) 89.0(5.2) 76.2(4.2) 96.0(5.9) 72.4(6.4) 79.5(1.3) 76.2(4.2) 75.7(5.6) 74.8(1.9)10 81.2(8.9) 93.3(1.9) 74.4(6.2) 97.3(4.0) 100.8(0.7) 77.7(4.1) 74.4(6.2) 97.6(4.2) 75.1(5.4)20 90.4(7.1) 105.9(2.1) 82.1(2.1) 92.3(2.9) 90.9(0.7) 83.5(3.9) 82.1(2.1) 82.9(2.1) 87.3(1.3)SPA 5 76.9(1.6) 86.5(2.8) 75.0(6.7) 106.1(3.7) 98.4(5.5) 82.5(1.5) 75.0(6.7) 83.4(1.8) 75.8(3.1)10 71.7(6.7) 83.0(0.2) 84.4(2.2) 103.8(5.6) 118.3(3.3) 93.8(1.9) 84.4(2.2) 83.6(0.3) 72.4(6.7)20 74.4(4.3) 91.6(4.3) 80.5(4.2) 99.0(2.1) 87.3(7.1) 93.9(3.1) 80.5(4.2) 76.5(5.1) 80.1(4.3)
2.4 Q-TOF/MS检测结果
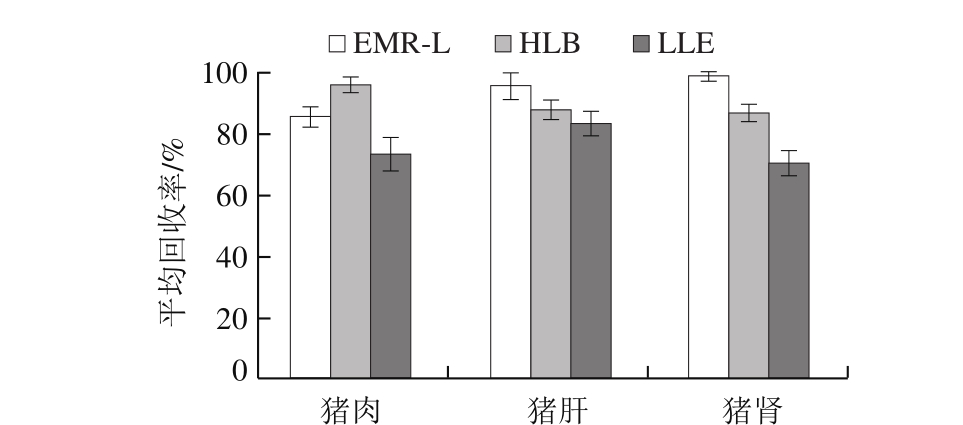
图2 猪组织中喹诺酮类兽药在Q-TOF/MS检测下的整体回收率
Fig. 2 Average recoveries of quinolones in porcine tissues with three sample preparation methods by Q-TOF/MS
为探索高分辨质谱在快速识别、定量筛查猪肉中兽药残留的可行性,将上述处理过的同一批次样品在选定条件下进行Q-TOF/MS检测。各化合物的基质效应均不明显,猪组织中喹诺酮类兽药整体回收率如图2所示。EMR-L分别为85.67%、95.61%、98.99%,Oasis PRiME HLB分别为96.12%、87.69%、86.58%,LLE分别为73.29%、83.17%、70.26%。2 种仪器的定量结果具有相似的趋势,由于Q-TOF/MS相对三重四极杆质谱灵敏度较低,其检测低限为1 μg/kg,但仍满足我国所规定的最大残留限量10~500 μg/kg。这体现了Q-TOF/MS在拥有精确定性靶向目标物优势之余,同样可以满足对3 种方法处理过的猪组织样品中喹诺酮类药物进行日常检测的需要 [29-30] 。
2.5 实际样品检测结果
为了进一步验证方法的可靠性,本研究采用3 种前处理方法结合三重四极杆质谱对1 个含有NOR的猪肉阳性样品进行检测,并以国标GB/T 21312—2007《动物源性食品中14 种喹诺酮药物残留检测方法》作为对照方法。结果显示,EMR-L、Oasis PRiME HLB、LLE和国标4 种方法的检测结果分别为(16.3±0.49)、(16.8±0.35)、(15.4±0.91) μg/kg和(16.6±0.27) μg/kg。EMR-L和Oasis PRiME HLB方法测定结果与国标相近,表明这2 种商业产品满足猪组织中喹诺酮类兽药残留的定性定量筛查。
3 结 论
本研究统一采用酸化乙腈作为提取溶剂沉淀蛋白促进离子化效率,分别比较了以EMR-L为代表的QuEChERS法、以Oasis PRiME HLB为代表的固相萃取法和使用正己烷去脂的LLE法,结合当前检测常用的两类质谱:三重四极杆质谱和以Q-TOF/MS为代表的高分辨质谱。从净化结果来看,EMR-L与Oasis PRiME HLB净化去脂效果均优于LLE法,但EMR-L基质提取物因盐析脱水步骤导致盐含量较高,重复进样后离子信号强度有一定的降低,对仪器的具体影响有待进一步研究。从方法验证来看,3 种方法的检出限、定量限及精密度满足残留分析要求。其中2 种商业产品基质效应不明显,猪组织中加标回收率均在70%~120%之间。从整体回收率看,EMR-L对于水分含量较高的猪肝、猪肾优于Oasis PRiME HLB;相对地,脂含量较高的猪肉中Oasis PRiME HLB重复性优于EMR-L。LLE方法所测样品中不在70%~120%之间的比例约为12.5%。与现行国家标准及行业标准相比,EMR-L与Oasis PRiME HLB能够缩短操作时间、节省人力和时间成本。根据高分辨和低分辨质谱定性定量的不同,以及不同样品基质组成差异,选用上述2 种方法相结合的方式进行处理检测,可以很好地避免假阳性结果的发生。本研究系统性将不同前处理方法结合不同检测手段引入猪组织的喹诺酮类兽药残留分析中,多角度评价了前处理方法对样品基质以及质谱检测的适用性,为当今环境中的食品安全监管提供了参考。
参考文献:
[1] 林黎, 张毅, 涂小珂, 等. 液相色谱-串联质谱法同时测定化妆品中的25 种喹诺酮类药物[J]. 色谱, 2015, 33(3): 275-281. DOI:10.3724/SP.J.1123.2014.10029.
[2] 孟哲, 石志红, 吕运开, 等. 超高效液相色谱-高分辨四级杆飞行时间质谱法快速筛查乳制品中磺胺类与氟喹诺酮类药物[J]. 分析化学,2014, 42(10): 1493-1500. DOI:10.11895/j.issn.0253-3820.140299.
[3] 韩合敬, 魏秀丽, 郝智慧, 等. 超高效液相色谱-串联质谱法测定中兽药散剂中4 种喹诺酮药物[J]. 黑龙江畜牧兽医, 2017(1): 282-285.DOI:10.13881/j.cnki.hljxmsy.2017.0191.
[4] 黄子敬, 王晓玲, 杨钦沾, 等. 超高效液相色谱-串联质谱法同时测定畜禽肉中磺胺类、喹诺酮类、硝基咪唑类兽药残留[J]. 分析试验室, 2014, 33(10): 1184-1188. DOI:10.13595 /j.cnki.issn1000-0720.2014.0278.
[5] 潘明飞, 王俊平, 方国臻, 等. 食品中农兽药残留检测新技术研究进展[J]. 食品科学, 2014, 35(15): 277-282. DOI:10.7506/spkx1002-6630-201415056.
[6] 厉文辉, 史亚利, 高立红, 等. 加速溶剂萃取-高效液相色谱-串联质谱法同时检测鱼肉中喹诺酮、磺胺与大环内酯类抗生素[J]. 分析测试学报, 2010, 29(10): 987-992. DOI:10.3969/j.issn.1004-4957.2010.10.001.
[7] 郝杰, 姜洁, 余建龙, 等. 固相萃取-超高效液相色谱-串联质谱法同时测定动物源性食品中多种兽药残留[J]. 食品科学, 2017, 38(12):266-272. DOI:10.7506/spkx1002-6630-201712041.
[8] Council Regulation (EEC). No. 470/2009, laying down community procedures for the establishment of residue limits of pharmacologically active substances in foodstuffs of animal origin, repealing Council Regulation (EEC) No. 2377/90 and amending Directive 2001/82/EC of the European Parliament and of the Council and Regulation (EC) No.726/2004 of the European Parliament and of the Council[J]. Journal of the European Union, 2006, L152: 11-22.
[9] United States Food and Drug Administration. CFR title 21-food and drugs, Part 556, Tolerances for residues of new animal drugs in food[EB/OL]. http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?cfrpart=556.
[10] 张元, 周伟娥, 李绍辉, 等. 动物源性食品中喹诺酮类残留前处理及分析方法的研究进展[J]. 食品工业科技, 2016, 37(5): 378-383.DOI:10.13386/j.issn.1002-0306.2016.05.069.
[11] ZHANG Y Q, LIU X, LI X, et al. Rapid screening and quantification of multi-class multi-residue veterinary drugs in royal jelly by ultra performance liquid chromatography coupled to quadrupole timeof-flight mass spectrometry[J]. Food Control, 2016, 60: 667-676.DOI:10.1016/j.foodcont.2015.09.010.
[12] COSTA F P, CALDAS S S, PRIMEL E G. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in canned and fresh peach[J]. Food Chemistry, 2014, 165(3): 587-593.DOI:10.1016/j.foodchem.2014.05.099.
[13] STOLKER A A M, RUTGERS P, OOSTERINK E, et al.Comprehensive screening and quantification of veterinary drugs in milk using UPLC-TOF-MS[J]. Analytical and Bioanalytical Chemistry, 2008,391(6): 2309-2322. DOI:10.1007/s00216-008-2168-8.
[14] 臧国栋, 符靖雯, 杨钦沾, 等. QuEChERS dSPE EMR-Lipid-LCMS-MS测定鸡蛋中3 种聚醚类抗球虫药物残留[J]. 安徽农业科学,2017, 45(32): 75-76. DOI:10.13989/j.cnki.0517-6611.2017.32.024.
[15] 李磊, 李海, 畅高婧, 等. QuEChERS EMR-Lipid-LC/MS/MS测定8 种β-受体激动剂[J]. 食品研究与开发, 2016, 37(9): 178-182.DOI:10.3969/j.issn.1005-6521.2016.09.042.
[16] 王飞, 宓捷波, 李淑静, 等. 改良的QuEChERS样本前处理/高效液相色谱-串联质谱法检测猪肉中四环素类兽药的残留[J]. 分析测试学报,2017, 36(2): 272-275. DOI:10.3969/j.issn.1004-4957.2017.02.021.
[17] HAN L J, MATARRITA J, SAPOZHNIKOVA Y, et al. Evaluation of a recent product to remove lipids and other matrix co-extractives in the analysis of pesticide residues and environmental contaminants in foods[J]. Journal of Chromatography A, 2016, 1449: 17-29.DOI:10.1016/j.chroma.2016.04.052.
[18] ANUMOL T, LEHOTAY S J, STEVENS J, et al. Comparison of veterinary drug residue results in animal tissues by ultrahighperformance liquid chromatography coupled to triple quadrupole or quadrupole-time-of-flight tandem mass spectrometry after different sample preparation methods, including use of a commercial lipid removal product[J]. Analytical and Bioanalytical Chemistry, 2017,409(10): 2639-2653. DOI:10.1007/s00216-017-0208-y.
[19] CHEN D M, YU J, TAO Y F, et al. Qualitative screening of veterinary anti-microbial agents in tissues, milk, and eggs of food-producing animals using liquid chromatography coupled with tandem mass spectrometry[J]. Journal of Chromatography B, 2016, 1017/1018: 82-88. DOI:10.1016/j.jchromb.2016.02.037.
[20] HAN R W, ZHANG N, YU Z N, et al. Simultaneous determination of 38 veterinary antibiotic residues in raw milk by UPLC-MS/MS[J].Food Chemistry, 2015, 181: 119-126. DOI:10.1016/j.foodchem.2015.02.041.
[21] LI X W, GUO P, SHAN Y W, et al. Determination of 82 veterinary drugs in swine waste lagoon sludge by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2017, 1499: 57-64. DOI:10.1016/j.chroma.2017.03.055.
[22] 李琴, 陶大利, 周红, 等. 超高效液相-串联质谱法同时测定生鲜乳中45 种兽药残留量[J]. 中国乳品工业, 2016, 44(1): 44-47.DOI:10.3969/j.issn.1001-2230.2016.01.010.
[23] 吴炜亮, 李晓明, 朱文亮, 等. 飞行时间质谱技术及其在食品安全检测中的应用[J]. 食品与机械, 2015, 31(3): 236-241. DOI:10.13652/j.issn.1003-5788.2015.03.053.
[24] 高馥蝶, 赵妍, 邵兵, 等. 超高效液相色谱-四极杆-飞行时间质谱法快速筛查牛奶中的农药和兽药残留[J]. 色谱, 2012, 30(6): 560-567.DOI:10.3724/SP.J.1123.2012.02021.
[25] 张科明, 梁飞燕, 邓鸣, 等. QuEChERS结合液相色谱-串联质谱法快速测定猪肉中多类兽药残留[J]. 色谱, 2016, 34(9): 860-867.DOI:10.3724/SP.J.1123.2016.06010.
[26] 李佩佩, 张小军, 张帅, 等. 通过式固相萃取结合超高效液相色谱-四级杆飞行时间质谱筛查鱼肉中多类兽药残留[J]. 浙江海洋学院学报, 2017, 36(3): 228-234. DOI:10.3969/j.issn.1008-830X.2017.03.008.
[27] 曹亚飞, 康健, 常巧英, 等. QuEChERS结合液相色谱-串联质谱法快速测定奶酪中多类兽药残留[J]. 色谱, 2015, 33(2): 132-139.DOI:10.3724/SP.J.1123.2014.10022.
[28] 罗辉泰, 谢梦婷, 黄晓兰, 等. 分散固相萃取-高效液相色谱-串联质谱法同时测定畜禽肉中63 种兽药残留[J]. 色谱, 2015, 33(4): 354-362. DOI:10.3724/SP.J.1123.2014.12005.
[29] 贡松松, 顾欣, 曹慧, 等. 超高效液相色谱-四极杆飞行时间质谱法快速筛查生鲜牛乳中的14 种磺胺类药物[J]. 分析测试学报, 2014,33(12): 1342-1348. DOI:10.3969/j.issn.1004-4957.2014.12.003.
[30] 朱万燕, 徐文远, 张伟, 等. 超高效液相色谱-四级杆-飞行时间质谱法同时快速检测水产品中37 种兽药残留[J]. 食品安全质量检测学报,2017, 8(2): 614-619. DOI:10.3969/j.issn.2095-0381.2017.02.041.
Comparison of Different Sample Pretreatments for the Analysis of Quinolone Residues in Porcine Tissues
WANG Jie, PEI Fei, LI Peng, BAI Yujie, FANG Yong, YANG Wenjian, MA Ning, HU Qiuhui*
(Key Laboratory of Grains and Oils Quality Control and Processing,Collaborative Innovation Center for Modern Grain Circulation and Safety, College of Food Science and Engineering,Nanjing University of Finance and Economics, Nanjing 210023, China)
Abstract: This study investigated the influence of different sample pretreatments: enhanced matrix removal-lipid(EMR-L) for lipid, Oasis PRiME hydrophile lipophilic balance (HLB) and liquid-liquid extraction (LLE) on the assay of 16 quinolone residues in porcine tissues by ultra-high performance liquid chromatography coupled to triple quadrupole tandem mass spectrometry (UPLC-TQ-MS/MS) or quadrupole-time-of-flight tandem mass spectrometry (Q-TOF/MS). The target compounds were quantified by the matrix-matched calibration curve. Good linearity was observed for all analytes in the range of 1.0–100.0 μg/L. The recoveries using the EMR-L and Oasis PRiME HLB methods at spiked concentration levels (5, 10 and 20 μg/kg) were 71.7%–106.9% and 70.7%–118.3% with relative standard deviations of 0.2%–16.8% and 0.1%–17.8%, respectively; the limits of quantification of the two methods were 0.13–0.56 and 0.27–1.36 μg/kg and the limits of detection were 0.04–0.23 and 0.08–0.41 μg/kg, respectively. All these figures of merit met the requirements for the determination of quinolones. In order to avoid false positive results, a suitable sample pretreatment method should be chosen for different matrix samples. The two pretreatment methods used in this study, thanks to their ease of operation, high sensitivity and good repeatability, could be suitable for the qualitative and quantitative analysis of multiple veterinary drug residues in porcine tissues.
Keywords: EMR-L; Oasis PRiME HLB; liquid-liquid extraction; quinolones; porcine tissues
WANG Jie, PEI Fei, LI Peng, et al. Comparison of different sample pretreatments for the analysis of quinolone residues in porcine tissues[J]. Food Science, 2018, 39(18): 309-314. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201818047. http://www.spkx.net.cn
王杰, 裴斐, 李彭, 等. 不同前处理方法对猪组织中喹诺酮类兽药残留检测效果对比[J]. 食品科学, 2018, 39(18):309-314. DOI:10.7506/spkx1002-6630-201818047. http://www.spkx.net.cn
文章编号: 1002-6630(2018)18-0309-06
引文格式:
中图分类号: S859.84
文献标志码: A
*通信作者简介: 胡秋辉(1962—),男,教授,博士,研究方向为食品质量与安全。E-mail:qiuhuihu@njue.edu.com
DOI: 10.7506/spkx1002-6630-201818047
基金项目: 江苏省农业科技自主创新资金项目(CX(16)1028);江苏高校优势学科建设工程资助项目(PAPD)
第一作者简介: 王杰(1994—),男,硕士研究生,研究方向为食品检测。E-mail:471704405@qq.com
收稿日期: 2018-04-08




