吕梁玉,罗华彬,吕鸣春,杨文鸽,张进杰,楼乔明,徐大伦,傅 佳*
(宁波大学食品与药学学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江海洋高效健康养殖协同创新中心,浙江 宁波 315211)
摘 要:以梅鱼鱼糜为原料,采用不同剂量(0、1、3、5、7、9 kGy)电子束辐照前处理,通过测定鱼糜凝胶持水性、白度和质构指标,结合鱼糜和鱼糜凝胶化学作用力、鱼糜肌原纤维蛋白组成及其流变学指标,探究电子束辐照对鱼糜凝胶特性的影响及机理。结果表明:在梅鱼鱼糜热诱导凝胶过程中,鱼糜蛋白疏水作用力和二硫键是稳定凝胶结构的主要化学作用力,5 kGy处理组鱼糜所形成的鱼糜凝胶白度、持水性、质构等性能指标优于其他剂量组;与对照组鱼糜相比,5 kGy处理组鱼糜储能模量(G’)高,而损耗角正切(tan δ)低;在变温过程中,梅鱼鱼糜G’的变化分3 个阶段,当温度低于31 ℃时,随着温度的升高G’缓慢增加;31~43℃时,G’有所下降;当温度高于43 ℃时,随着温度的升高G’迅速上升,鱼糜形成鱼糜凝胶。结论:适宜剂量(5 kGy)电子束辐照前处理显著影响梅鱼鱼糜化学作用力和流变特性(P<0.05),促进鱼糜凝胶形成,改善鱼糜品质。
关键词:电子束辐照;梅鱼鱼糜;化学作用力;凝胶特性;流变特性
食品辐照是一种新兴的食品加工技术,因其安全高效的特性而广泛应用于食品保鲜及品质改善[1-3]。研究表明,辐照对肉类食品进行杀菌的同时,会引起维持肌肉蛋白构象的化学作用力如氢键、二硫键、离子键、疏水力等发生变化,导致肌肉蛋白变性、聚集或凝胶化等,从而影响肉制品的品质。
鱼类经采肉、斩拌、擂溃、加热等工艺加工而成的具有弹性的凝胶即为鱼糜凝胶,凝胶的形成与鱼糜蛋白化学作用力的变化有关,而鱼糜凝胶性能、流变特性等均为评价鱼糜品质的重要指标。刘海梅等[4]研究了鲢鱼鱼糜凝胶形成过程,认为疏水作用力、二硫键等是维持鲢鱼鱼糜凝胶稳定结构的主要化学作用力,Lin Xianping等[5]以不同剂量电子束辐照带鱼鱼糜,得出类似结论。通过样品应力变化所得到的质构和流变性指标能反映肌肉蛋白的结构及其凝胶形成,Wang He等[6]采用0、1、3、6、9 kGy的60Co-γ射线辐照南美白对虾,并未发现辐照对样品的咀嚼度、弹性有显著影响。有关化学作用力、流变特性与鱼糜凝胶性能的相关研究不乏报道,如李立杰等[7]通过建立Burgers模型,研究了真空微冻状态下南美白对虾虾肉流变学特性的变化,认为贮藏后期虾肉黏性和弹性模量的明显下降与其肌肉组织状态及品质变化有关;Jaczynski等[8]以不同剂量电子束辐照狭鳕鱼糜,发现低剂量(≤6 kGy)辐照组鱼糜凝胶剪切力随着辐照剂量的增加而增加。但电子束辐照对鱼糜蛋白的影响研究较少,尤其是电子束辐照对梅鱼鱼糜流变学特性及其化学作用力的影响鲜见报道。
本实验以利用海水经济鱼类梅鱼加工而成的鱼糜为原料,研究不同电子束辐照剂量(0~9 kGy)对鱼糜流变特性、化学作用力及其凝胶特性的影响,确定合适的电子束辐照前处理鱼糜剂量,旨在为辐照技术在鱼糜加工中的应用提供参考。
冷冻梅鱼鱼糜 浙江兴业集团有限公司;食盐宁波市盐业有限公司;聚偏二氯乙烯肠衣(食品级)南通皇佳肠衣有限公司。
牛血清白蛋白、β-巯基乙醇、考马斯亮蓝R-250、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵、甘氨酸(分析纯) 国药集团化学试剂有限公司;三羟甲基氨基甲烷(tri-hydroxymethyl aminomethane,Tris)、Tris-马来酸(分析纯)美国S i g m a公司;福林-酚试剂、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、丙烯酰胺、N,N-甲叉双丙烯酰胺、N,N,N,N-四甲基乙二胺(N,N,N,N-tetramethylethylenediamine,TEMED)、广谱蛋白彩虹maker(分析纯,11~245 kDa) 北京索莱宝科技有限公司。
XHF-D高速分散器 宁波新芝生物科技股份有限公司;ML104/02型电子天平 梅特勒-托利仪器(上海)有限公司;Biofuge Stratos台式高速冷冻离心机 德国Thermo Scientific Sorvall公司;Spectra Max i3多功能酶标仪 美国Molecular Devices公司;EPS-300稳压稳流电泳仪 上海天能科技有限公司;TA.XT Plus质构仪 英国Stable Micro Systems公司;NBL1020电子直线加速器(能量10 MeV) 宁波超能科技股份有限公司;UMC 5真空斩拌机 德国Stephan Machinery公司;AR2000ex流变仪 美国TA仪器公司。
1.3.1 鱼糜辐照处理
参考Lin Xianping等[9]的方法,梅鱼鱼糜300 g/袋真空包装,利用电子直线加速器辐照,剂量分别为0、1、3、5、7、9 kGy,其中0 kGy为对照组,辐照剂量误差小于3%。每组剂量设3 个平行;为保证辐照均匀,辐照时各样品整齐排列,防止叠压造成平行样之间的差异。
1.3.2 鱼糜凝胶制备
取冷冻梅鱼鱼糜,冰箱冷藏室(4 ℃)解冻后置于真空斩拌机中低温空斩2 min,添加质量分数2.5%食盐继续斩拌8 min。将斩拌后的鱼糜溶胶灌入直径25 mm、长约10 cm的肠衣,肠衣两头扎紧,再进行二段式加热凝胶化(40 ℃加热60 min后,90 ℃高温凝胶化30 min),冷却得到鱼糜凝胶,4 ℃贮藏备用,保存时间不超过一周。
1.3.3 持水性测定
参照Sánchez-González等[10]的方法,将各组鱼糜凝胶切成2 mm厚薄片,用滤纸包好装入离心管底部,3 000 r/min离心10 min。记离心管质量为m,离心前后离心管与样品总质量分别为m1和m2。持水性按公式(1)计算。
1.3.4 白度测定
利用色差仪测定各组鱼糜凝胶色差,分析前用标准白板校正色差仪。白度按公式(2)计算。
式中:L*、a*、b*分别为鱼糜凝胶的亮度值、红绿值、黄蓝值。
1.3.5 质构指标测定
利用质构分析仪测定各组鱼糜凝胶的全质构指标。样品厚度约20 mm,测定参数:TPA模式,探头型号P50,测前速率1.0 mm/s,测试速率1.0 mm/s,测后速率1.0 mm/s,压缩比50%,触发值10 g,数据采集速率400 pps。
1.3.6 鱼糜及鱼糜凝胶化学作用力分析
参考Gómez-Guillen[11]、Careche[12]等的方法。配制A、B、C、D、E 5 种溶液,其中A为0.05 mol/L NaCl,B为0.6 mol/L NaCl,C为0.6 mol/L NaCl+1.5 mol/L尿素,D为0.6 mol/L NaCl+8 mol/L尿素,E为0.6 mol/L NaCl+8 mol/L尿素+0.05 mol/L β-巯基乙醇。实验分为5 组,每组取鱼糜或鱼糜凝胶2 g,分别加入10 mL的A、B、C、D、E溶液,混匀,4 ℃静置1 h,10 000 r/min离心15 min,福林-酚法测定上清液中的蛋白质量浓度。计算时,离子键、氢键、疏水作用力和二硫键的贡献分别以溶解于B溶液与A溶液中蛋白质量浓度之差、溶解于C溶液与B溶液中蛋白质量浓度之差、溶解于D溶液与C溶液中蛋白质量浓度之差、溶解于E溶液与D溶液中蛋白质量浓度之差表示。
1.3.7 鱼糜肌原纤维蛋白组成分析
参考Xiong Guangquan等[13]的方法略作修改。2 g鱼糜加20 mmol/L Tris-马来酸缓冲液20 mL(pH 7.0,含0.05 mol/L KCl),充分匀浆后10 000 r/min离心15 min,沉淀加入20 mmol/L Tris-马来酸缓冲液20 mL(pH 7.0,含0.6 mol/L KCl),充分匀浆,静置提取1 h后10 000 r/min离心15 min,上清液即为鱼糜肌原纤维蛋白溶液。采用福林-酚法测定肌原纤维蛋白含量。
参照Laemmli[14]的方法进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)实验。肌原纤维蛋白溶稀释至1 mg/mL,分离胶质量分数为10%,浓缩胶质量分数为5%,胶厚1 mm;样品上样量为10 µL,标准物上样量为5 µL,起始电压为80 V,进入分离胶后电压改为100 V。考马斯亮蓝R-250染色,凝胶成像系统拍照分析。
1.3.8 鱼糜流变学指标测定
参考Delgado-Pando等[15]的方法稍作修改。解冻后鱼糜空斩2 min,调节水分质量分数至80%。采用40 mm直径平板夹具,平行板间距为1 mm。上样量约为3 mL,石蜡密封防止水分蒸发,刮板刮去多余样品,分别进行频率扫描和温度扫描。频率扫描条件:振荡模式,频率范围为0.1~10 Hz(1 Hz=2π rad/s),温度为20 ℃。温度扫描条件:从20 ℃以2 ℃/min速率升温至90 ℃,保持温度2 min后以5 ℃/min速率降至20 ℃,振荡频率为1 Hz。
实验设置3~6 个平行,数据用平均值±标准差表示,Origin 9.0软件作图、SPSS 19.0软件处理数据,并进行单因素方差分析,Duncan多重比较检验显著性,P<0.05表示差异显著。
2.1.1 梅鱼鱼糜凝胶的持水性与白度
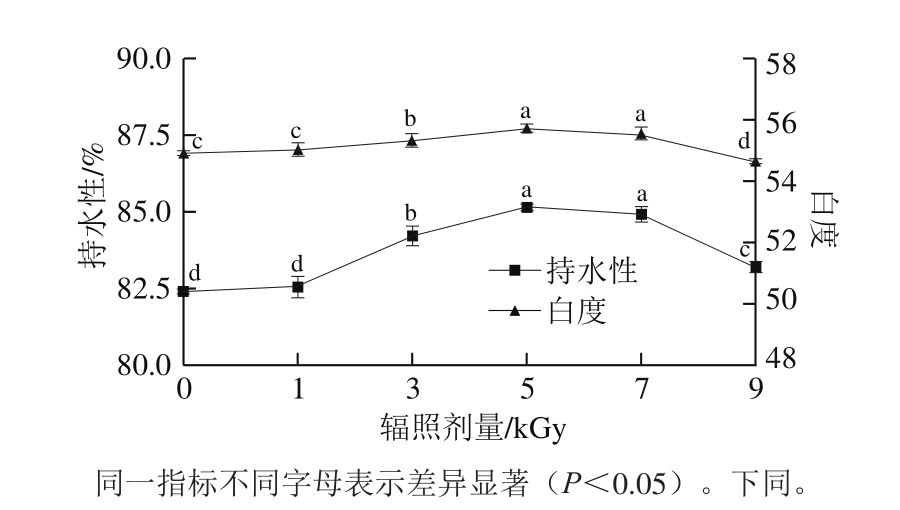
图 1 辐照剂量对梅鱼鱼糜凝胶持水性和白度的影响
Fig. 1 Effect of irradiation on water-holding capacity and whiteness of C. lucidus surimi gels
由图1可知,持水性和白度都是评价鱼糜凝胶品质的重要指标。鱼糜凝胶的持水性主要与其凝胶网状结构有关[16],电子束辐照会影响鱼糜凝胶结构,引起凝胶网络中的水分子重新排布,有可能使其凝胶的持水性增高。良好的凝胶色泽有助于提高消费者对产品的接受度,鱼糜凝胶白度与鱼糜蛋白变形程度与肌球蛋白的变性程度呈正相关[17],同时与鱼糜凝胶的持水性有关,持水性较好的鱼糜凝胶往往具有较好的色泽和透明度。
随着辐照剂量的增加,梅鱼鱼糜凝胶的持水性和白度总体都呈先上升后下降的趋势。与对照组相比,1 kGy处理组鱼糜凝胶的持水性并无显著变化,3~7 kGy处理组有显著上升(P<0.05),并在5 kGy处理组达到最大值,9 kGy处理组又降低,可能是由于小剂量辐照不足以引起水分子重新排布,而剂量过高又会破坏鱼糜凝胶的网状结构,引起持水性下降。Riebroy等[18]发现6 kGy60Co-γ辐照会引起大眼鲷鱼肉制品持水性的下降,认为持水性的改变与蛋白凝胶结构的形成有关。由图1可见,辐照剂量大于3 kGy时,梅鱼鱼糜凝胶白度显著上升(P<0.05),在5 kGy时达到最大值。Park[19]研究表明,白度与持水性有较强的关联性,持水性增加,白度也随之增大,本实验结果与此类似。针对提高梅鱼鱼糜凝胶持水性和白度,5 kGy和7 kGy都是较适的辐照剂量。
2.1.2 梅鱼鱼糜凝胶的质构特性
由图2可以看出,随着辐照剂量的增加,鱼糜凝胶硬度、弹性、黏聚性和咀嚼性均呈先上升后下降的趋势。5 kGy处理组鱼糜凝胶硬度、咀嚼性、黏聚性均达到最大值,而弹性最大值出现在7 kGy处理组。这与根据持水性和白度的变化所选择的辐照剂量一致。
硬度、咀嚼性、黏聚性、弹性等质构特性表征了肌肉蛋白凝胶的力学性能,借助这些指标可直观地了解凝胶状态,推测凝胶结构及其各组分的凝胶形成作用力[20-21],是评价鱼糜凝胶品质的重要指标。Jaczynski等[22]利用0、1、2、4 kGy剂量电子束辐照冷冻鱼糜制品,发现辐照后鱼糜制品硬度有显著提高,推测可能是辐照导致鱼糜蛋白之间的相互作用增强而引起。
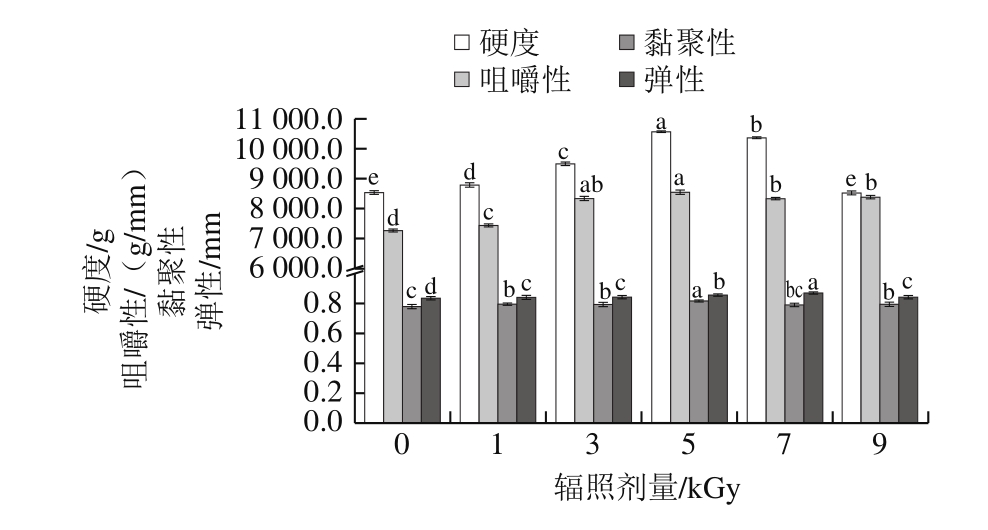
图 2 辐照剂量对梅鱼鱼糜凝胶质构特性的影响
Fig. 2 Effect of irradiation on textural properties of C. lucidus surimi gels
氢键、二硫键、离子键、疏水作用力等化学作用力与蛋白质的构象及鱼糜凝胶结构密切相关。随着辐照剂量的增加,梅鱼鱼糜和鱼糜凝胶的化学作用力发生变化,结果见图3、4。鱼糜中离子键和氢键的贡献远大于鱼糜凝胶,而疏水作用力和二硫键则相反。随着辐照剂量的增加,鱼糜、鱼糜凝胶中的离子键和氢键的贡献变化趋势基本一致,都是先减小后增加;在鱼糜中,5 kGy处理组离子键的贡献显著低于其他组(P<0.05),5 kGy和7 kGy处理组氢键的贡献没有显著差异(P>0.05),但均显著低于其余组(P<0.05)。各组鱼糜和鱼糜凝胶中二硫键的贡献均显著高于对照组(P<0.05),随辐照剂量增加,疏水作用力先增加后减小,并均在5 kGy处达到峰值。
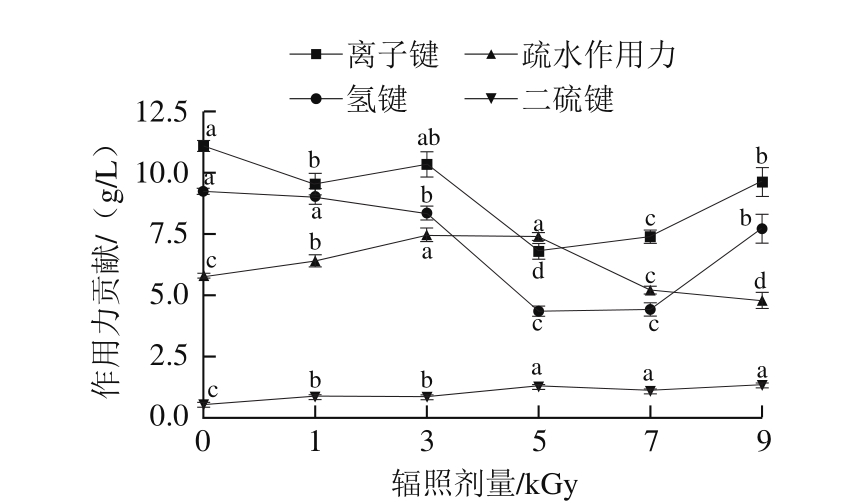
图 3 辐照剂量对梅鱼鱼糜化学作用力的影响
Fig. 3 Effect of irradiation on chemical interactions of C. lucidus surimi
Deng Siyao等[23]对辐照梅鱼鱼糜拉曼光谱进行分析,认为辐照有助于热诱导凝胶化过程中鱼糜蛋白二硫键的形成,可有效提高凝胶强度;Jaczynski等[8]研究了电子束辐照剂量对狭鳕鱼糜蛋白结构及其凝胶特性的影响,发现鱼糜蛋白的疏水性及二硫键形成量随着剂量的增加而增加,超过最适剂量6 kGy后又开始下降。通过本实验结果,认为在梅鱼鱼糜热诱导凝胶过程中,鱼糜蛋白疏水力和二硫键是稳定凝胶结构的主要化学作用力,Gómez-Guillen[11]、李杰[24]等研究亦有类似结论;相对其他辐照剂量,5 kGy的电子束辐照更有利于增加梅鱼鱼糜和鱼糜凝胶中的二硫键和疏水作用力,从而促进鱼糜凝胶的形成。
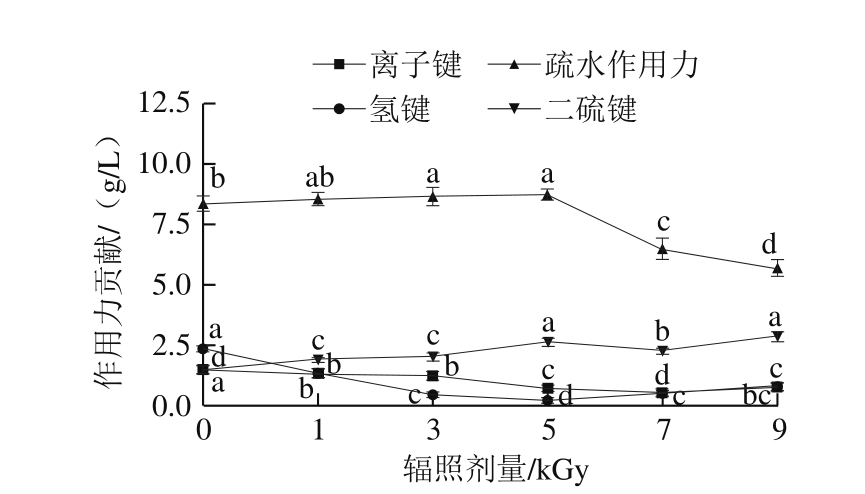
图 4 辐照剂量对梅鱼鱼糜凝胶化学作用力的影响
Fig. 4 Effect of irradiation on chemical interactions of C. lucidus surimi gels

图 5 梅鱼鱼糜肌原纤维蛋白SDS-PAGE谱图
Fig. 5 SDS-PAGE pattern of myof i brillar proteins from C. lucidus surimi
如图5所示,分子质量220 kDa左右条带为肌球蛋白重链,48 kDa左右的条带为肌动蛋白。经高剂量(≥7 kGy)电子束辐照之后,梅鱼鱼糜肌原纤维蛋白条带发生了变化,表现为肌球蛋白重链降解,但降解并不明显;肌动蛋白条带无明显变化。说明辐照对梅鱼鱼糜肌原纤维蛋白的降解作用并不显著,对梅鱼鱼糜凝胶的形成不会产生负面作用。
电子束辐照引起梅鱼鱼糜蛋白一定程度的变性,对鱼糜凝胶的持水性、白度和质构特性有显著的影响。综合辐照剂量对梅鱼鱼糜凝胶特性的影响及能源节省的考虑,认为5 kGy电子束辐照处理梅鱼鱼糜显著改善了梅鱼鱼糜品质,可作为合适的辐照剂量应用于实际生产。后续仅比较5 kGy处理组与对照组(0 kGy)梅鱼鱼糜的流变学特性。
2.4.1 频率对梅鱼鱼糜储能模量及损耗角正切的影响
在流变学中,储能模量(G’)也称弹性模量,反映蛋白凝胶网络结构的形成情况,是样品的弹性特征;与之相对应的耗能模量(G”)也称黏性模量,是样品的黏性特征。一般用损耗角正切tan δ,即G”与G’的比值来表征体系的黏弹性[25];tan δ小于1表明体系趋于固体特性,弹性成分占优势;tan δ大于1表明体系趋于流体特性,黏性成分占优势。
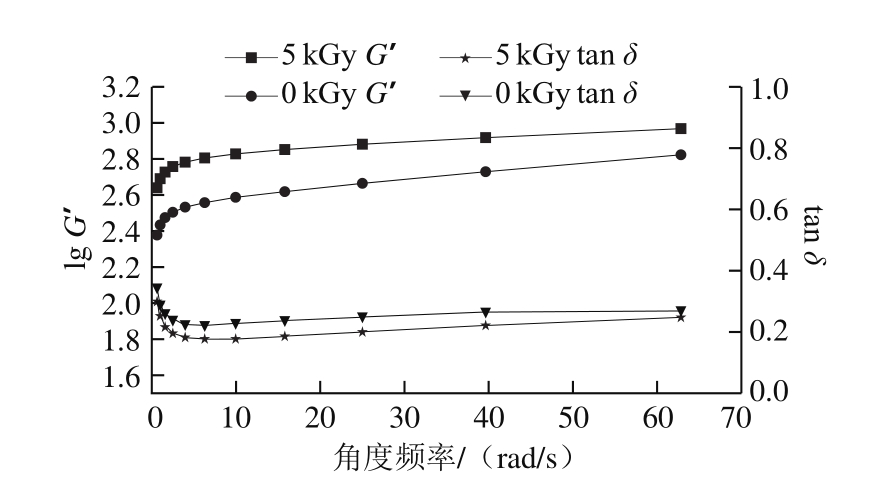
图 6 角度频率对梅鱼鱼糜储能模量及损耗角正切的影响
Fig. 6 Effect of frequency on storage modulus and tan δ of C. lucidus surimi
如图6所示,随着角度频率的增加,G’呈上升趋势,在频率小于2π rad/s(1 Hz)时增幅明显,大于2π rad/s时趋势平缓,而tan δ在频率小于2π rad/s时逐步减小,大于2π rad/s时缓慢增加,可能是由于鱼糜蛋白形成的凝胶结构相对稳固,较小的频率并不能破坏其凝胶结构,反而有助于凝胶网络的形成,频率过高则会破坏其三维结构,体系向黏性方向转变。5 kGy辐照后G’总是高于对照组(P<0.05),tan δ总是小于对照组(P<0.05),说明5 kGy辐照对梅鱼鱼糜凝胶弹性有一定的提升,这与之前质构特性的结果相一致。
2.4.2 温度对梅鱼鱼糜储能模量的影响
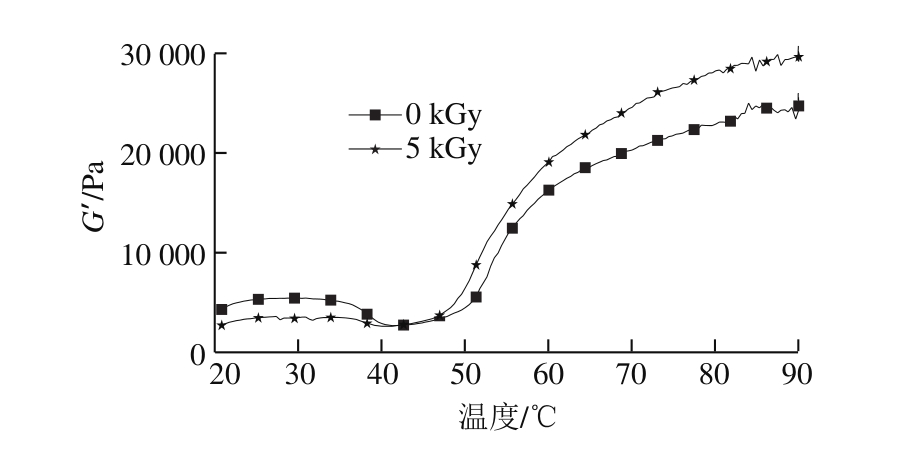
图 7 升温过程梅鱼鱼糜储能模量的变化
Fig. 7 Effect of temperature on storage modulus of C. lucidus surimi during heating process

图 8 降温过程梅鱼鱼糜储能模量的变化
Fig. 8 Effect of temperature on storage modulus of C. lucidus surimi during cooling process
如图7、8所示,在升温过程中,G’的变化大致分为3 个阶段。第一阶段为20~31 ℃,此阶段G’随温度的升高而升高,推测可能是由于鱼糜蛋白在低温下开始交联,并初步形成网状结构。第二阶段31~43 ℃,此阶段G’随温度的升高而减小,一方面可能是肌球蛋白开始解螺旋,破坏了蛋白的网络结构;另一方面可能是由于鱼糜内源蛋白酶的作用,影响了凝胶结构的形成。第三阶段43~90 ℃,G’随温度的升高迅速增大,这是蛋白质分子迅速展开,凝胶结构充分形成所引起[26]。
Xia Xiufang[27]、Chen Hongsheng[28]等研究发现,草鱼肌原纤维蛋白在升温过程中可分为20~55 ℃、55~63 ℃、63~85 ℃ 3 个阶段,温度区间的不同可能是鱼种的不同和实验的差异所造成。在降温过程中,G’迅速增大,说明快速降温有利于凝胶结构的形成。Sun Fengyuan[29]、Sun Xiangdong[30]等研究也有相同结论。总体上,鱼糜凝胶形成需经历升温和降温两个过程,在升温过程中应当避开G’迅速降低的温度区段;因此在实践中通常采用二段式加热的方法,经高温凝胶化后,迅速冷却会使鱼糜凝胶结构形成更充分。5 kGy辐照后低温凝胶化阶段优势并不明显,但高温凝胶化过程中G’的增长趋势明显强于对照组,可能是由于辐照暴露了相关活性基团,使凝胶网状结构充分形成。
电子束辐照处理引起梅鱼鱼糜化学作用力和流变特性的变化,并进一步影响热诱导所形成的鱼糜凝胶的色泽、质构及其流变特性;在梅鱼鱼糜热诱导凝胶过程中,鱼糜蛋白疏水力和二硫键是稳定凝胶结构的主要化学作用力。综合比较不同剂量(0、1、3、5、7、9 kGy)辐照后的梅鱼鱼糜凝胶持水性、白度及质构等指标,并结合SDS-PAGE结果,确定电子束前处理梅鱼鱼糜合适的辐照剂量为5 kGy。测定辐照前后鱼糜的流变学指标,发现5 kGy组鱼糜G’高,而tan δ低。此外,在变温实验中确定了梅鱼鱼糜凝胶形成过程中的3 个温度阶段,在后续的实验中有待优化二段式加热条件,进一步增强5 kGy辐照前处理对鱼糜凝胶品质的改善作用。
参考文献:
[1] YANG Zhen, WANG Haiyan, WANG Wei, et al. Effect of 10 MeV E-beam irradiation combined with vacuum-packaging on the shelf life of Atlantic salmon fillets during storage at 4 ℃[J]. Food Chemistry,2014, 145: 535-541. DOI:10.1016/j.foodchem.2013.08.095.
[2] FARKAS J, MOHÁCSI-FARKAS C. History and future of food irradiation[J]. Trends in Food Science & Technology, 2011, 22(2/3):121-126. DOI:10.1016/j.tifs.2010.04.002.
[3] 杨文鸽, 茅宇虹, 徐大伦, 等. 适宜电子束辐照延长醉泥螺货架期及蛋白质保持[J]. 农业工程学报, 2013, 29(13): 255-262. DOI:10.3969/j.issn.1002-6819.2013.13.032.
[4] 刘海梅, 熊善柏, 谢笔钧, 等. 鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化[J]. 中国水产科学, 2008, 15(3): 469-475.DOI:10.3321/j.issn:1005-8737.2008.03.013.
[5] LIN Xianping, YANG Wenge, XU Dalun, et al. Improving gel properties of hairtail surimi by electron irradiation[J]. Radiation Physics and Chemistry, 2015, 110(1): 1-5. DOI:10.1016/j.radphyschem.2014.12.017.
[6] WANG He, YANG Ruijin, LIU Yanning, et al. Effects of low dose gamma irradiation on microbial inactivation and physicochemical properties of fried shrimp (Penaeus vannamei)[J]. International Journal of Food Science and Technology, 2010, 45(6): 1088-1096.DOI:10.1111/j.1365-2621.2010.02179.x.
[7] 李立杰, 柴春祥, 鲁晓翔. 南美白对虾虾肉流变学模型的建立[J].食品科学, 2014, 35(11): 62-65. DOI:10.7506/spkx1002-6630-201411013.
[8] JACZYNSKI J, PARK J W. Physicochemical changes in Alaska pollock surimi and surimi gel as affected by electron beam[J]. Journal of Food Science, 2004, 69(1): 53-57. DOI:10.1111/j.1365-2621.2004.tb17855.x.
[9] LIN Xianping, YANG Wenge, XU Dalun, et al. Effect of electron irradiation and heat on the structure of hairtail surimi[J]. Radiation Physics and Chemistry, 2015, 114(1): 50-54. DOI:10.1016/j.radphyschem.2015.05.028.
[10] SÁNCHEZ-GONZÁLEZ I, CARMONA P, MORENO P, et al. Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman pectroscopy[J]. Food Chemistry,2008, 106(1): 56-64. DOI:10.1016/j.foodchem.2007.05.067.
[11] GÓMEZ-GUILLEN M C, BORDERÍAS A J, MONTERO P. Chemical interactions of nonmuscle proteins in the network of Sardine (Sardina pilchardus) muscle gels[J]. LWT-Food Science and Technology, 1997,30(6): 602-608. DOI:10.1006/fstl.1997.0239.
[12] CARECHE M, ALVAREZ C, TEJADA M. Suwari and kamaboko sardine gels: effect of heat treatment on solubility of networks[J].Journal of Agricultural and Food Chemistry, 1995, 43(4): 1002-1010.DOI:10.1021/jf00052a030.
[13] XIONG Guangquan, CHENG Wei, YE Lixiu, et al. Effects of konjac glucomannan on physicochemical properties of myofibrillar protein and surimi gels from grass carp (Ctenopharyngodon idella)[J]. Food Chemistry, 2009, 116(2): 413-418. DOI:10.1016/j.foodchem.2009.02.056.
[14] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.DOI:10.1038/227680a0.
[15] DELGADO-PANDO G, COFRADES S, RUIZ-CAPILLAS C,et al. Low-fat pork liver pâtés enriched with n-3 PUFA/konjac gel:dynamic rheological properties and technological behaviour during chill storage[J]. Meat Science, 2012, 92(1): 44-52. DOI:10.1016/j.meatsci.2012.04.002.
[16] GORDON A, BARBUT S. Effect of chloride salts on protein extraction and interfacial protein film formation in meat batters[J].Journal of the Science of Food and Agriculture, 1992, 58(2): 227-238.DOI:10.1002/jsfa.2740580211.
[17] 林娴萍, 杨文鸽. 辐照对肌肉蛋白凝胶性能的影响[J]. 辐射研究与辐射工艺学报, 2014, 32(1): 1-7. DOI:10.11889/j.1000-3436.2014.rrj.32.010101.
[18] RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al. Effect of irradiation on properties and storage stability of Som-fug produced from bigeye snapper[J]. Food Chemistry, 2007, 103(2): 274-286.DOI:10.1016/j.foodchem.2006.07.046.
[19] PARK J W. Surimi gel colors as affected by moisture content and physical conditions[J]. Journal of Food Science, 1995, 60(1): 15-18.DOI:10.1111/j.1365-2621.1995.tb05596.x.
[20] 杨谷毅, 王飞镝, 严霞波, 等. 蛋白质凝胶的结构表征和应用研究进展[J]. 材料导报, 2008, 22(4): 104-107. DOI:10.3321/j.issn:1005-023X.2008.04.026.
[21] CHAIJIAN M, PANPIPAT W, BENJAKUL S. Physicochemical properties and gel-forming ability of surimi from three species of mackerel caught in Southern Thailand[J]. Food Chemistry, 2010,121(1): 85-92. DOI:10.1016/j.foodchem.2009.12.007.
[22] JACZYNSKI J, PARK J W. Physicochemical properties of surimi seafood as affected by electron beam and heat[J]. Food Chemistry and Toxicology, 2003, 68(5): 1626-1630. DOI:10.1111/j.1365-2621.2003.tb12303.x.
[23] DENG Siyao, LÜ Liangyu, YANG Wenge, et al. Effect of electron irradiation on the gel properties of Collichthys lucidus surimi[J]. Radiation Physics and Chemistry, 2017, 130(1): 316-320.DOI:10.1016/j.radphyschem.2016.08.022.
[24] 李杰. 草鱼鱼糜凝胶及形成机理的研究[D]. 上海: 上海海洋大学,2011: 21-23.
[25] ZHAO Yanling, WANG Jiabo, SHAN Limei, et al. Effect of Radix isatidis polysaccharides on immunological function and expression of immune related cytokines in mice[J]. Chinese Journal of Integrative Medicine, 2008, 14(3): 207-211. DOI:10.1007/s11655-008-0207-2.
[26] 陈文博. 肌原纤维蛋白热诱导凝胶形成机制研究[D]. 南京: 南京农业大学, 2010: 42-44.
[27] XIA Xiufang, KONG Baohua, XIONG Youling, et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science,2010, 85(3): 481-486. DOI:10.1016/j.meatsci.2010.02.019.
[28] CHEN Hongsheng, DIAO Jingjing, LI Yuanyuan, et al. The effectiveness of clove extracts in the inhibition of hydroxyl radical oxidation-induced structural and rheological changes in porcine myofibrillar protein[J]. Meat Science, 2015, 111(2): 60-66.DOI:10.1016/j.meatsci.2015.08.017.
[29] SUN Fengyuan, HUANG Qilin, HU Ting, et al. Effects and mechanism of modif i ed starches on the gel properties of myof i brillar protein from grass carp[J]. International Journal of Biological Macromolecules,2014, 64(2): 17-24. DOI:10.1016/j.ijbiomac.2013.11.019.
[30] SUN Xiangdong, ARNTFIELD S D. Gelation properties of chicken myofibrillar protein induced by transglutaminase crosslinking[J].Journal of Food Engineering, 2011, 107(2): 226-233. DOI:10.1016/j.jfoodeng.2011.06.019.
Effect of Electron Beam Irradiation on Chemical Interactions, Rheological and Gel Properties of Collichthys lucidus Surimi
LÜ Liangyu, LUO Huabin, LÜ Mingchun, YANG Wenge, ZHANG Jinjie, LOU Qiaoming, XU Dalun, FU Jia*
(Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province, Collaborative Innovation Center for Zhejiang Marine High-Eff i ciency and Healthy Aquaculture, College of Food and Pharmaceutical Sciences,Ningbo University, Ningbo 315211, China)
Abstract:In this work, the effect of electron beam irradiation at different doses (0, 1, 3, 5, 7 and 9 kGy) on gel properties of Collichthys lucidus surimi was addressed and the underlying mechanism was elucidated. For this purpose, waterholding capacity (WHC), whiteness, texture, chemical interactions, myofibrillar protein composition and rheological properties of surimi samples were determined. The results indicated that hydrophobic force and disulphide bond played a major role in stabilizing heat-induced surimi gels. The whiteness, WHC, texture of surimi gels were better at 5 kGy than at other irradiation doses. Irradiation at 5 kGy resulted in higher storage modulus (G’) and lower loss tangent (tan δ)compared to the control group. G’ slowly increased with temperature up to 31 ℃, then slightly decreased with increasing temperature to 43 ℃ and finally increased rapidly again at temperatures higher than 43 ℃. As a result, surimi gels were formed. Finally, it is concluded that 5 kGy is the most suitable irradiation dose to induce gel formation and improve surimi quality due to its signif i cant effect on chemical interactions and rheological properties of surimi (P < 0.05).
Keywords:electron beam irradiation; Collichthys lucidus surimi; chemical interactions; gel properties; rheological properties
DOI:10.7506/spkx1002-6630-201819002. http://www.spkx.net.cn
LÜ Liangyu, LUO Huabin, LÜ Mingchun, et al. Effect of electron beam irradiation on chemical interactions, rheological and gel properties of Collichthys lucidus surimi[J]. Food Science, 2018, 39(19): 7-12. (in Chinese with English abstract)
吕梁玉, 罗华彬, 吕鸣春, 等. 电子束辐照对梅鱼鱼糜化学作用力、流变及其凝胶特性的影响[J]. 食品科学, 2018,39(19): 7-12. DOI:10.7506/spkx1002-6630-201819002. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0007-06
文献标志码:A
中图分类号:TS254.1
DOI:10.7506/spkx1002-6630-201819002
*通信作者简介:傅佳(1984—),女,讲师,硕士,研究方向为水产品加工与高值化利用。E-mail:fujia@nbu.edu.cn
第一作者简介:吕梁玉(1992—),女,硕士研究生,研究方向为水产品质量与安全控制。E-mail:125862797@qq.com
宁波大学学科项目(XKl15D241)
基金项目:国家自然科学基金面上项目(31371793);海洋公益性行业科研专项(201305013);
收稿日期:2017-07-13