闫峥蓉,赵 英,迟玉杰*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:蛋黄在-6 ℃以下冷冻贮藏会发生胶凝化现象,影响其在食品加工中的应用。本实验通过流变特性表征了冻藏180 d内蛋黄的胶凝化现象,并进一步通过理化性质、水分分布以及二级结构分析探究蛋黄胶凝化的成因。结果发现冻藏期间蛋黄表观黏度、黏性系数、弹性模量和黏性模量均显著增加,而流动指数和损耗角正切值显著减小,表明冷冻导致了蛋黄严重的胶凝化。平均粒径的增加、表面疏水性的增强、总巯基含量的下降、蛋黄水分分布的变化尤其是可冻结水含量的减少,都会导致蛋黄胶凝化;同时蛋黄蛋白质二级结构从无序向有序转变,也促进了蛋黄蛋白质的聚集,进一步诱导蛋黄胶凝化。本研究探究蛋黄胶凝化的原因,为进一步改善蛋黄在冷冻过程中出现胶凝化提供参考。
关键词:蛋黄;冻藏;胶凝化;成因分析
据农业部对全国500 个集贸市场的定点监测,自2017年以来,全国鸡蛋价格已连续6 个月下跌,累计跌幅一度达到37.1%,许多地方出现鸡蛋价格“比蔬菜还便宜”,导致了蛋鸡养殖的普遍亏损[1]。鸡蛋产量增加,存在一定积压,供需矛盾突出,是导致鸡蛋价格持续处于低谷的直接原因。因此,加大鸡蛋产品的深加工,增加鸡蛋需求量,是解决这一问题的有效途径,也有益于持久稳定鸡蛋的市场价格[2]。目前蛋粉、液蛋(冰蛋)是市场上常见的鸡蛋深加工产品,其中冰蛋因其制备工艺简单、最大限度保留鲜蛋营养价值、易于运输和贮藏的优点[3-4],深受企业和消费者的青睐。基于蛋黄丰富的营养价值(含质量分数16%蛋白质、33%脂类、4%碳水化合物及多种维生素和矿物质)和优良的乳化性质,冰蛋黄已经广泛应用于焙烤制品、鱼糜制品等食品加工工业。同时,随着我国冷冻行业的发展,冰蛋黄具有更广阔的发展空间。
然而,当蛋黄在-6 ℃以下冻藏时,会发生不可逆的表观黏度增加的现象,这种现象被称为蛋黄的胶凝化现象[5]。胶凝化会导致冰蛋黄失去新鲜蛋黄的流动性,难与其他食品组分混合,解冻时间延长;同时,蛋黄的胶凝化也会导致其功能性质的变化,如乳化能力下降,这些品质变化严重影响其在下游企业的实际应用[6-7]。Harrision等[8]对冻藏0~90 d的蛋黄进行研究,结果发现冷冻使蛋黄发生了胶凝化,表观黏度在冷冻24 h后显著增加,冷冻储存90 d的蛋黄具有最大表观黏度,相对于新鲜蛋黄增加了73 倍,并且其乳化活性下降了11.53%。卢晓明[9]也发现冷冻全蛋液的黏度随着冷冻时间的延长呈现上升趋势,且明显高于新鲜全蛋液。因此,控制冰蛋黄的胶凝化是目前冰蛋企业急需解决的问题之一,而了解其胶凝化具体成因,有利于更好地解决这一问题。
目前,尽管国内外已有一些关于冰蛋黄胶凝化和乳化性质的研究,但鲜有关于冻藏期间蛋黄胶凝成因的研究。本实验以冰蛋黄为研究对象,追踪其在冻藏期间的理化性质、流变特性、水分分布以及结构变化,以期从宏观和微观上对冻藏过程中蛋黄胶凝性化现象及其成因进行深入探究,为改善冰蛋黄的胶凝现象提供参考,对控制冰蛋黄品质变化、拓宽其在食品中的应用具有重要意义。
新鲜褐壳鸡蛋购自哈尔滨市万达超市。
5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid,DNTB)、8-苯胺-1-萘磺酸(8-(phenylamino) naphthalene-1-sulfonic acid,ANS)、Tris、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA) 美国Sigma公司;其他试剂均为分析纯。
Bohlin Gemini2旋转流变仪、Mastersizer 2000激光粒度仪 英国马尔文公司;F-4500荧光分光光度计日本日立公司;Mq-20低场核磁共振(low field nuclear magnetic resonance,LF-NMR)分析仪 德国布鲁克公司;高速台式离心机 上海安亭科学仪器厂;T-18分散机 德国IKA公司;TU-1810紫外-可见分光光度仪 北京普析通用仪器有限责任公司;Invia显微拉曼光谱仪 英国雷尼绍公司。
1.3.1 样品制备
市售新鲜鸡蛋经清洗后分离蛋黄,用滤纸去除系带和多余的蛋清液,挑破蛋黄膜,用电动搅拌机在300 r/min下搅拌15 min,得到新鲜的蛋黄液。然后置于-18 ℃冰箱中冻藏,分别于冻藏0、15、30、60、90、180 d后取出冷冻的蛋黄,常温解冻6 h得到冻蛋黄,用于后续实验。以不同冷冻时间的蛋黄为实验组,以新鲜蛋黄为对照组。
1.3.2 蛋黄流变性质的测定
采用旋转流变仪,在25 ℃下,选择2(°)/40 mm平板系统、1 mm平板间距,测定解冻蛋黄液的流变行为(静态流变和动态流变)。
蛋黄静态流变的测定:剪切速率为0~100 s-1。将所测得的表观黏度与剪切速率用幂律方程(式(1))进行拟合。
式中:η表示表观黏度/(Pa·s);K表示黏性系数/(Pa·sn);ε表示剪切速率/s-1;n表示流动指数。
蛋黄动态流变的测定:对样品进行小振幅扫描,观察样品的弹性模量(G’)、黏性模量(G”)、损耗角正切值(tan δ)。测定参数:扫描频率为0.1~40.0 Hz;应变力为1%。
1.3.3 理化性质的测定
1.3.3.1 粒径的测定
将样品用去离子水稀释成质量浓度为1 mg/mL的蛋黄溶液,9 000 r/min离心15 min,利用激光粒度仪对上清液进行粒径分析。操作参数:温度25 ℃;角度90°;波长632.8 nm。
1.3.3.2 巯基含量的测定
使用Ellman’s法测定蛋黄中蛋白质的巯基含量。准确称取1 g解冻后的蛋黄液分别用缓冲液1(称取5.4 g Tris、3.45 g Gly和0.6 g EDTA,用蒸馏水溶解并定容至500 mL,调至pH 8.0,测表面巯基含量)和缓冲液2(在缓冲液1基础上增加240 g尿素,测总巯基含量)稀释至100 mL,再取5 mL稀释液,加入0.1 mL 4 mg/mL Ellman’s试剂。混合后于25 ℃避光处反应1 h,然后5 000 r/min离心10 min,以Ellman’s试剂为空白,于412 nm波长处测定样品上清液的吸光度。按公式(2)计算巯基含量。
式中:A412nm为加Ellman’s试剂时样品的吸光度减去不加Ellman’s时样品的吸光度;D为稀释倍数;ρ为样品质量浓度/(mg/mL)。
1.3.3.3 表面疏水性的测定
将样品用磷酸盐缓冲液(浓度为0.01 mol/L,pH 7.0)稀释成5 个不同质量浓度梯度(0.01、0.05、0.10、0.20、0.40 mg/mL)。取4 mL样品稀释液加入20 μL 8 mmol/L ANS溶液,振荡10 s,避光放置3 min后测定。以磷酸盐缓冲液为空白,用荧光分光光度计测定样品的荧光强度。测定参数:激发波长370 nm,发射波长470 nm,狭缝2.5 nm。以蛋白质量浓度为横坐标,荧光强度为纵坐标,曲线斜率即为蛋白质分子的表面疏水性。
1.3.4 水分分布的测定
根据Aursand等[10]的方法并略作改动。将冻蛋黄样品解冻后放在专用的测定试管中(18 mm×180 mm),LF-NMR分析仪(横向弛豫时间T2的测定)的质子共振频率和磁场强度分别为20 MHz、0.47 T。使用Carr-Purcell-Meiboom-Gill(CPMG)程序测定蛋黄中的T2。每个样品在测试时程序会自动扫描8 次,每次扫描重复的间隔时间为2 s。测定后的每个样品的T2,通过CONTIN软件进行分析,得出相应的弛豫时间(T2b、T21、T22和T23)。
1.3.5 拉曼光谱的测定
参考Zhang Xuan等[11]的方法测定拉曼光谱。将解冻后的蛋黄液样品放入样品池进行拉曼光谱测定,测定参数为:激发光波长532 nm,激光功率25 mW,扫描范围400~2 000 cm-1,每次扫描时间60 s,积分10 次,4 次扫描进行累加。谱图处理:拉曼谱图基线校正、归属采用OMINIC软件,归一化处理以苯丙氨酸((1 003±1)cm-1)为内标,以此作为各拉曼峰峰强度变化的依据,谱图的拟合采用Origin 8.5软件。
所有数据均用SPSS 19.0软件进行方差分析,Duncan检验进行差异显著性分析,采用Origin Pro 8.5软件作图。结果以平均值±标准差表示,以P<0.05表示差异显著。样品分3 批次进行,每组实验做3 个平行。
2.1.1 冻藏期间蛋黄静态流变性质的变化
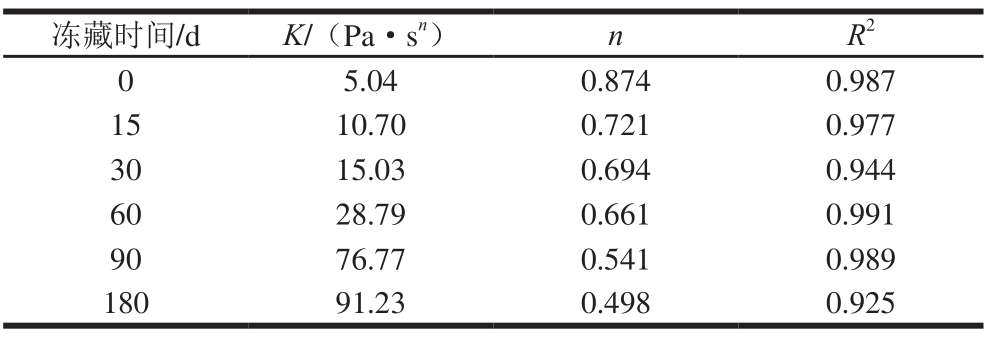
静态流变学可以研究单一方向稳态剪切作用下聚合物流体的流动和形变,可以较好地反映蛋黄胶凝化现象。由图1可知,随着冻藏时间的延长,表观黏度显著增加,表明经冷冻后,蛋黄出现了显著的胶凝化现象。赵维高等[12]在研究冻藏对巴氏杀菌蛋液的影响时也发现随着冻藏时间的延长,表观黏度显著增加,本研究结果与其一致。K为黏性系数,常用来表征流体的黏稠程度[13],一般K值越大表明液体越黏稠。研究结果显示,与对照组相比,冻藏180 d后蛋黄K值增加了17.1 倍,变化趋势与表观黏度一致,表明冷冻导致蛋黄黏稠度增大,胶凝化现象显著。同时,新鲜蛋黄与解冻后蛋黄的流动指数n值均在0~1之间,表明蛋黄属于典型的非牛顿假塑性流体,即表现出剪切稀释的流变行为。但经过冷冻处理的蛋黄n值明显小于新鲜蛋黄(0.874),由表1可知,随着冻藏时间的延长,n值逐渐减小,说明蛋黄的流动性变小。已有研究发现蛋黄的静态流变性质与分子链的长短和聚集程度有关,支链越多,聚集程度越大的液体越难剪切稀化[14],导致黏度增加,流动性下降,从而鸡蛋黄发生胶凝化现象;因此推测冻藏过程中蛋黄胶凝化现象与蛋黄蛋白质的聚集程度密切有关,聚集程度越高,表观黏度越大,胶凝现象越明显。这可能是由于蛋黄冻结使水分形成冰晶被移除,导致蛋黄中蛋白等固形物脱水,使蛋黄蛋白结构发生重排以致蛋白变性聚集。冷冻使蛋黄发生胶凝现象,导致蛋黄解冻后表观黏度增加,严重影响蛋黄在食品中的应用。
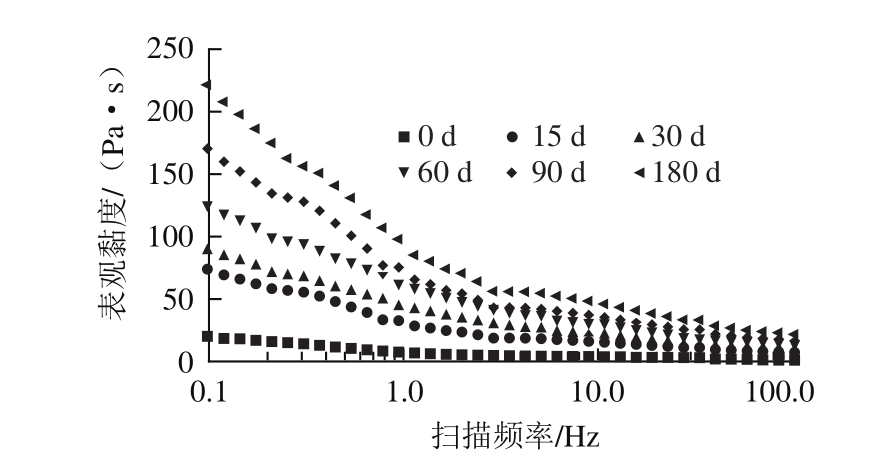
图 1 冻藏期间蛋黄静态流变性质的变化
Fig. 1 Changes in static rheological properties of egg yolk during frozen storage
表 1 冻藏期间蛋黄的牛顿幂律方程参数
Table 1 Newtonian power law equation parameters of yolk at different frozen storage times
2.1.2 冻藏期间蛋黄动态流变性质的变化
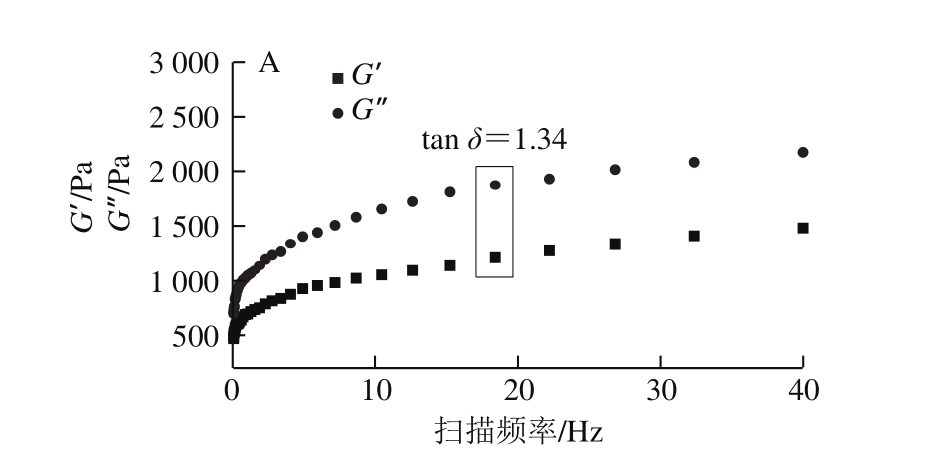
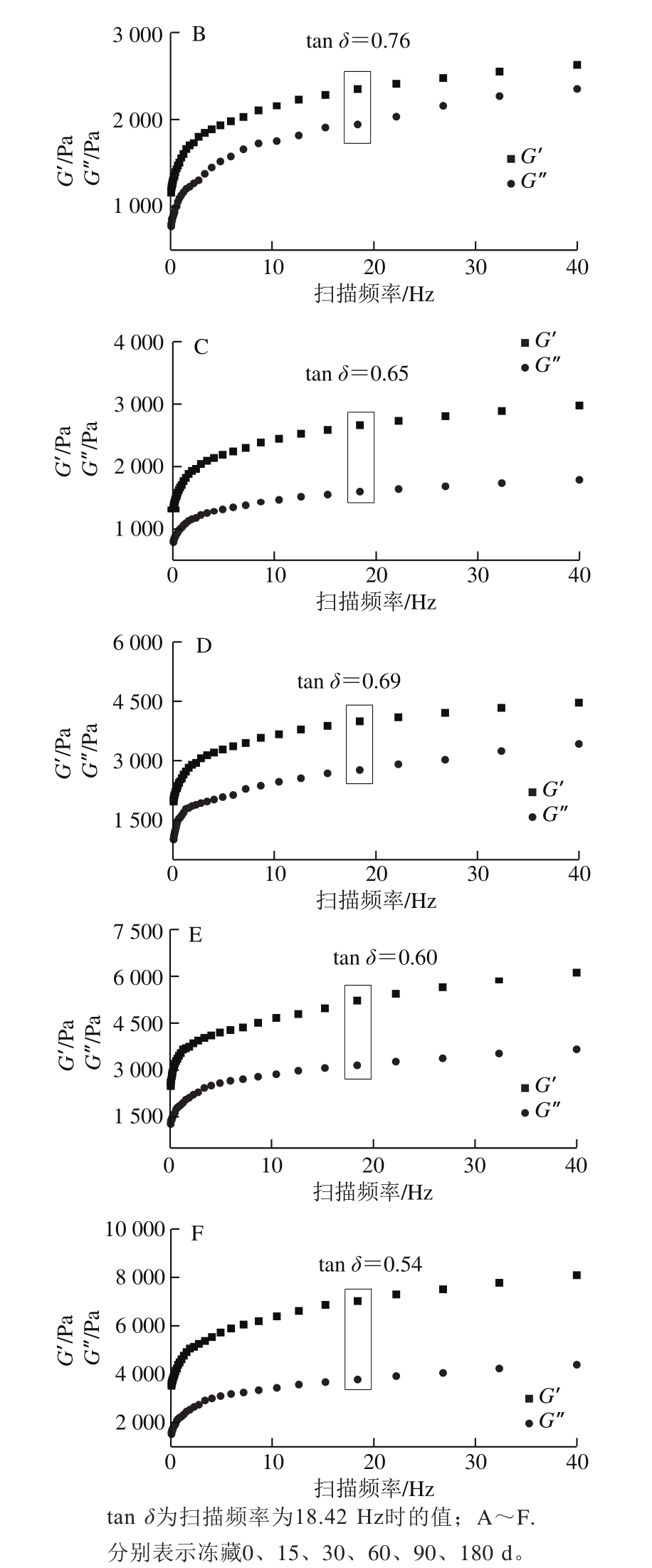
图 2 不同冻藏时间蛋黄的G’与G”的频率扫描图及tan δ
Fig. 2 Changes in G’ and G” as well as tan δ of egg yolk during frozen storage
动态流变学可以研究周期动态作用下聚合物流体的流动和形变,其中G’、G’’和tan δ是重要的指标参数[15]。由图2可知,所有样品G’、G’’均随着扫描频率的增加而增加,Telis等[16]对蛋黄进行动态频率扫描也发现了相同结果。随着冻藏时间的延长,G’、G’’数值呈增加的趋势,表明经冻藏后蛋黄黏弹性增大。蛋黄中蛋白质分子间相互作用力的增强以及聚集体的形成都会促使蛋黄体现更高的G’、G’’,诱导蛋黄胶凝化现象的发生[14]。对比发现,新鲜蛋黄的G’’>G’(tan δ>1),说明新鲜蛋黄表现的是流体的性质;而经过冷冻的蛋黄样品G’’小于G’(tan δ<1),即冷冻之后的蛋黄表现出类固体特性,其形态与凝固性酸奶的类固体特性相似,蛋黄由“流体”向“类固体”的转变说明蛋黄发生了胶凝化现象。随着冻藏时间的延长,tan δ由0.76(15 d)下降到0.54(180 d),降低了28.95%;说明蛋黄体系中高聚物的含量增多,类固体特性更加显著,胶凝化程度越严重。Telis等[17]报道冷冻之后的蛋黄蛋白聚集会形成一种物理凝胶,这种物理凝胶的连接方式比通过分子间作用力连接所形成的凝胶更复杂,它破坏了蛋黄原有的结构,从而使解冻后的蛋黄表现出胶凝化现象。Nys等[7]报道也发现,经冷冻贮藏蛋黄中的蛋白胶束结构被破坏,发生脱水,蛋白质之间的相互作用被破坏,非极性蛋白间的相互作用增强,对蛋黄的动态流变产生影响,导致蛋黄发生胶凝化。
表 2 冻藏期间蛋黄理化性质的变化
Table 2 Changes in physicochemical properties of egg yolk during frozen storage

注:同列肩标字母不同表示差异显著(P<0.05)。下同。
由表2可知,随着冻藏时间的延长,蛋黄溶液的平均粒径呈现增大趋势,冻藏180 d后蛋黄的平均粒径与新鲜蛋黄粒径相比增加了6.81 倍,蛋黄平均粒径的增大说明蛋黄蛋白质之间发生了聚集,从而引起了蛋黄胶凝化现象。Noh等[18]也发现冷冻形成的冰晶会促进大分子蛋白聚集体的形成,使大豆蛋白结构的粒径增大;分析其主要原因是冷冻促使冰晶形成,冰晶通过挤压作用使蛋黄固形物浓缩,进而促进了蛋黄蛋白质发生分子间聚集,导致粒径变大。表2结果显示,冻藏期间蛋黄表面疏水性呈上升趋势,180 d后相比于鲜蛋增加了39.22%。在0~180 d的冻藏期内,总巯基含量下降了31.64%(P<0.05),在60 d内降低了23.56%;表面巯基含量在冻藏180 d后降低了37.90%。上述变化的原因可能是冷冻产生冰晶,机械破坏了蛋黄的内部结构,使蛋黄的疏水基团暴露,导致表面疏水性增加,表面疏水作用力会使蛋黄中蛋白质聚集,促进蛋黄胶凝现象的发生;在冻藏期间巯基可能被氧化成二硫键或者发生其他反应,导致总巯基含量下降[19],二硫键的形成还会进一步稳定蛋黄的胶凝结构。由以上分析可知,蛋黄中蛋白质的聚集可能是导致冷冻蛋黄胶凝化的原因之一,同时疏水作用力的增强以及分子间二硫键的形成起到了稳定聚集体的作用,加剧了蛋黄胶凝化。
冷冻蛋黄表面常会有冰晶形成,为进一步探究冷冻蛋黄胶凝化的原因,采用LF-NMR技术分析蛋黄在不同冻藏时间的水分分布。蛋黄弛豫时间T2分布图表示的是不同冻藏时间蛋黄中3 种不同状态的水分分布情况。

图 3 冻藏期间蛋黄T2分布
Fig. 3 Representative distribution of relation time T2of egg yolk during frozen storage
由图3可知,所有蛋黄T2弛豫时间分布图主要包含4 个峰,T2b(0~10 ms)代表与大分子紧密连接的结合水,这部分水在冷冻过程中不会冻结,为不可冻结水;T21和T22(10~100 ms)代表不易流动水;T23(100~1 000 ms)代表自由水;不易流动水与自由水为可冻结水。由图3和表3知,T21分布区域最大,表明不易流动水(可冻结水)是蛋黄水分的主要存在状态。林向阳等[20]采用该技术研究鸡蛋的水分分布也有同样的结论。与新鲜蛋黄相比,冷冻处理后蛋黄的峰数量并没有发生变化,不易流动水所占比例仍是最高,随着冻藏时间的延长,T2b峰位置无明显变化(P>0.05),但是T21、T22、T233个峰都朝着较高弛豫时间方向移动,且峰面积也发生变化(表3)。
表 3 冻藏期间蛋黄T2横向弛豫时间及弛豫峰面积百分比的变化
Table 3 Changes in T2transverse relaxation time and peak area fraction of egg yolk during frozen storage

注:A.相应弛豫峰面积百分比。
随着冻藏时间的延长,T2b一直在1.45 ms左右波动,无显著变化(P>0.05);但T21、T22、T23均呈现增大趋势,与新鲜蛋黄比较,冻藏180 d冰蛋黄的T21增大了42.31%,T22增大了24.07%,T23增大了21.26%(P<0.05),表明经过冷冻后蛋黄蛋白质与水结合变得疏松,使得不易流动水和自由水减少。Wang Pei等[21]也发现面团在冷冻之后,由于疏水性基团的暴露弱化了蛋白质与各种水分之间的作用力,弛豫时间会向高T2方向移动,自由水分布减少。弛豫峰面积百分比A也可以用来反映各状态水分布的变化情况。冻藏过程中T2弛豫峰面积百分比见表2,随着冻藏时间的延长,A2b由4.86增加到11.33(P<0.05);这可能是因为在冻藏过程中蛋黄中部分蛋白通过表面疏水力或其他作用力发生聚集,紧密结合成网状结构,把一部分不易流动水包裹在蛋白内部,形成水-蛋白-水的聚合物,使部分不易流动水“态变”为结合水,导致了结合水含量增加,不易流动水含量减少。Wakamatu等[22]发现添加NaCl的蛋黄经冷冻后结合水含量减少,与本实验结果相反,可能是添加的NaCl使蛋黄中离子环境改变的缘故。相反地,冻藏导致A21、A22、A23数值均变小,表明不易流动水、自由水含量均减小,可以从两个方面来解释:一是蛋黄的部分不易流动水转化为结合水,使不易流动水减少;二是冷冻会形成冰晶,随着冻藏时间延长,冰晶逐渐增大进一步破坏了蛋白内部结构,导致蛋黄可冻结水分的流失,尤其是结合最不紧密的自由水[23];段云霞等[24]在研究贮藏期间白煮蛋品质的变化时,也发现随着贮藏时间的延长,蛋黄的不易流动水含量显著下降。通过采用LF-NMR技术对蛋黄中水分分布进行研究,推测在冷冻的作用下,蛋黄中结合水含量增加,可冻结水含量减少,导致蛋黄固形物浓度增加,改变了蛋黄内部环境,使蛋黄中蛋白质结构改变,进而加重了蛋黄胶凝化现象。因而蛋黄中结合水的增加,不易流动水、自由水的减少是蛋黄发生胶凝化现象的原因之一。
蛋白的二级结构主要由非共价作用力维持。当所处环境发生改变时,蛋白质分子会发生构象重排以达到能量最低来保持相对稳定状态。本研究采用拉曼光谱对冻藏不同时间的蛋黄进行分析,以期从蛋黄、蛋白二级结构的变化来说明蛋黄出现胶凝现象的原因,不同冻藏时间蛋黄的拉曼光谱见图4。
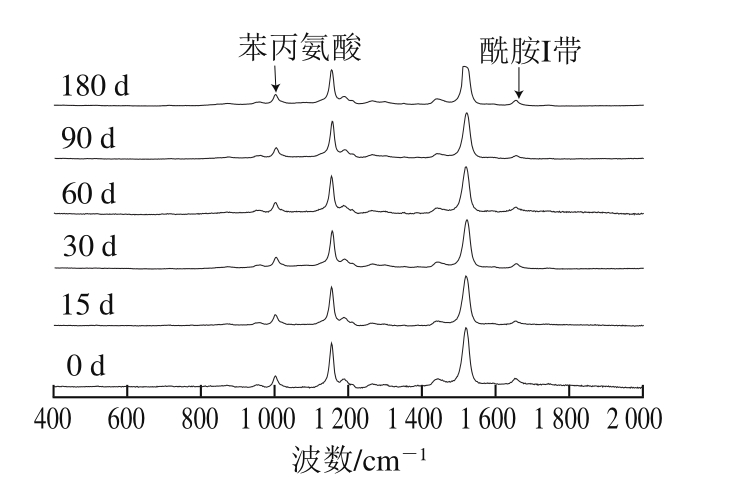
图 4 冻藏期间蛋黄拉曼光谱的变化
Fig. 4 Change in Raman spectrum of egg yolk during frozen storage
由图4可知,各组样品在(1 520±5)cm-1处都有一个很强的特征峰,归属于蛋黄脂蛋白烷基链C=C伸缩振动[25-26],经冻藏后,样品在此处的峰强度明显减弱,可能原因是水中-OH基团与蛋黄蛋白质的C=C发生共价结合,因此C=C振动减弱,这与结合水含量增加相符。拉曼光谱中酰胺Ⅰ带(1 600~1 700 cm-1)的特征峰归属于肽键的酰胺键伸缩振动,其振动频率取决于C=O和N-H之间的氢键性质,所以两者结合可以反映多肽或蛋白质的特定二级结构。Jackson等[27]将1 600~1 639 cm-1指认为β折叠、1 640~1 650 cm-1为无规卷曲(C=O与水形成氢键)、1 650~1 658 cm-1为α螺旋结构、1 661~1 700 cm-1为β转角结构。不同冻藏时间蛋黄蛋白二级结构的变化见表4。
表 4 冻藏期间蛋黄蛋白质二级结构变化
Table 4 Variation in secondary structures during frozen storage
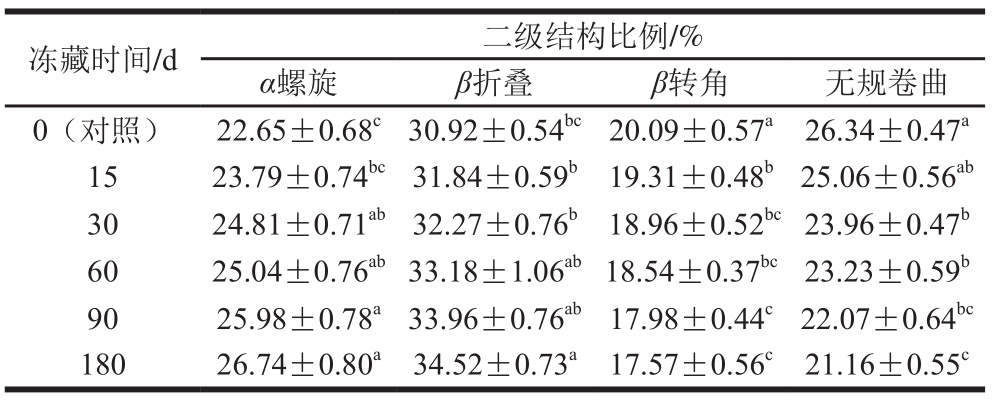
由表4可知,新鲜蛋黄蛋白质中主要的二级结构以α螺旋和β折叠为主,约占总构象含量的53.57%。阎微[28]在研究高压对蛋黄的影响时也有相似的报道。对比新鲜蛋黄样品,冷冻蛋黄蛋白质的α螺旋和β折叠随着冻藏时间的延长分别增加了18.06%和11.64%;而β转角、无规卷曲则分别减少了12.54%和19.67%。Jansens等[29]研究发现二级结构β折叠的增加会导致蛋白质的线性聚集即分子链变长。孙圳等[30]对解冻后的牛肉蛋白质进行二级结构的测定时,也发现无序结构向有序结构向转变。研究分析表明由于蛋黄中结合水以及可冻结水的析出,使蛋黄中固形物浓度增加,改变了蛋黄中离子环境,导致蛋黄蛋白质分子发生构象重排,蛋黄蛋白质的无序结构向α螺旋和β折叠等有序结构转变,内部相互作用力增强[31],导致蛋黄蛋白质聚集,最终导致胶凝化的产生。因此,蛋黄蛋白质二级结构的变化可以进一步表明冷冻使蛋黄蛋白质构象改变,发生了聚集,从而使蛋黄发生了胶凝现象。
在冻藏期间,蛋黄的静态流变和动态流变均发生变化,主要表现为黏度增加,流动性减少,出现流体向类固体的转变现象,表明冻藏中蛋黄表现出严重的胶凝化现象,这不利于冻蛋黄的实际应用。冻蛋黄凝胶化的成因主要包括以下几方面:1)冷冻促使蛋黄蛋白疏水作用力的增强和分子间二硫键的形成,加剧蛋白聚集,导致蛋黄胶凝化;2)冻蛋黄中不易流动水与自由水含量减少,使其固形物含量增加,增大了蛋黄的黏度,进而导致蛋黄胶凝化现象的发生;3)冷冻时冰晶的形成机械破坏了蛋黄蛋白质构象,使蛋白质二级结构发生改变,分子间作用力增大,蛋黄蛋白质聚集,促使蛋黄表现更高的G’、G’’,这也是蛋黄发生胶凝化的原因之一。通过对冰蛋黄胶凝化成因的分析,旨在为下一步改善冻融蛋黄的胶凝现象提供理论支持。
参考文献:
[1] 农业部. 1-5月份第一产业固定资产投资高位稳中略降, 休闲农业投资持续升温[EB/OL]. (2017-6-19)[2017-07-05]. http://www.moa.gov.cn/sjzz/jhs/touzi/201706/t201706195707556.htm.
[2] 迟玉杰. 蛋制品加工技术[M]. 北京: 中国轻工业出版社, 2011: 139-142.
[3] 毋引子, 赵英, 李胤楠, 等. NaCl对冻藏期间冰全蛋功能性质的影响[J].食品科学, 2016, 37(24): 299-305. DOI:10.7506/spkx1002-6630-201624047.
[4] 迟玉杰. 浅析中国蛋品加工行业现状及发展方向[J]. 中国家禽,2014, 36(12): 2-5. DOI:10.16372/j.issn.1004-6364.2014.12.020.
[5] STADELMAN W J, COTTERILL O J. Egg science and technology[M]. West Lafayette: Macmillan Education, 1995: 226-233.
[6] YAO L X, ZHOU W, WANG T, et al. Quantification of egg yolk contamination in egg white using UV/Vis spectroscopy: prediction model development and analysis[J]. Food Control, 2014, 43: 88-97.DOI:10.1016/j.foodcont.2014.02.037.
[7] NYS Y, BAIN M, VAN IMMERSEEL F. Improving the safety and quality of eggs and egg products[M]. Cambridge: Woodhead Publishing Limited, 2011: 563-564.
[8] HARRISON L J, CUNNINGHAM F E. Influence of frozen storage time on properties of salted yolk and its functionality in mayonnaise[J].Journal of Food Quality, 1986, 9(3): 167-174. DOI:10.1111/j.1745-4557.1986.tb00786.x.
[9] 卢晓明. 冷冻和热处理对蛋液功能特性的影响[J]. 中国家禽, 2012,34(13): 41-42. DOI:10.16372/j.issn.1004-6364.2012.13.004.
[10] AURSAND I G, GALLART-JORNET L, ERIKSON U, et al. Water distribution in brine salted cod (Gadus morhua) and salmon (Salmo salar): a low-f i eld1H NMR study[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15): 6252-6260. DOI:10.1021/jf800369n.
[11] ZHANG Xuan, HUANG Lixin, NIE Songqing, et al. FTIR characterization of the secondary structure of insulin encapsulated within liposome[J].Journal of Chinese Pharmaceutical Science, 2003, 12(1): 11-14.
[12] 赵维高, 刘文营, 黄丽燕, 等. 冷冻贮藏对巴氏杀菌全蛋液功能特性的影响[J]. 食品科技, 2012, 37(11): 50-53. DOI:10.13684/j.cnki.spkj.2012.11.040.
[13] CHEN H, WU F, DUAN X, et al. Characterization of emulsions prepared by egg yolk phosvitin with pectin, glycerol and trehalose[J].Food Hydrocolloids, 2013, 30(1): 123-129. DOI:10.1016/j.foodhyd.2012.05.007.
[14] 李云飞, 殷涌光, 徐树来. 食品物性学[M]. 北京: 中国轻工业出版社, 2010: 42-43.
[15] SONG Y H, ZHENG Q. Dynamic rheological properties of wheat fl our dough and proteins[J]. Trends in Food Science & Technology, 2007,18(3): 132-138. DOI:10.13684/j.cnki.spkj.2012.11.040.
[16] TELIS V R N, KIECKBUSCH T G. Viscoelasticity of frozen/thawed egg yolk as affected by salts, sucrose and glycerol[J]. Journal of Food Science, 1998, 63(1): 20-24.
[17] TELIS V R N, KIECKBUSCH T G. Viscoelasticity of frozen/thawed egg yolk[J]. Journal of Food Science, 1997, 62(3): 548-550.DOI:10.1111/j.1365-2621.1997.tb04427.x.
[18] NOH E J, PARK S Y, PAK J I, et al. Coagulation of soymilk and quality of tofu as affected by freeze treatment of soybeans[J].Food Chemistry, 2005, 91(4): 715-721. DOI:10.1016/j.foodchem.2004.06.050.
[19] ZHAO L, LI L, LIU G Q, et al. Effect of freeze-thaw cycles on the molecular weight and size distribution of gluten[J]. Food ResearchInternational, 2013, 53(1): 409-416. DOI:10.1016/j.foodres.2013.04.013.
[20] 林向阳, 金志强, 朱榕璧, 等. 利用核磁共振及其成像技术研究鸡蛋的腐败过程[J]. 中国食品学报, 2009, 9(2): 126-131.DOI:10.16429/j.1009-7848.2009.02.016.
[21] WANG Pei, XU Lei, NIKOO M, et al. Effect of frozen storage on the conformational, thermal and microscopic properties of gluten:comparative studies on gluten-, glutenin- and gliadin-rich fractions[J].Food Hydrocolloids, 2014, 35(3): 238-246. DOI:10.1016/j.foodhyd.2013.05.015.
[22] WAKAMATU T, SATO Y, SAITO Y. On sodium chloride action in the gelation process of low density lipoprotein (LDL) from hen egg yolk[J]. Journal of Food Science, 1983, 48(2): 507-512. DOI:10.1111/j.1365-2621.1983.tb10777.x.
[23] GANASEN P, BENJAKUL S. Physical properties and microstructure of pidan yolk as affected by different divalent and monovalent cations[J]. LWT-Food Science and Technology, 2010, 43(1): 77-85.DOI:10.1016/j.lwt.2009.06.007.
[24] 段云霞, 赵英, 迟玉杰. 基于低场核磁共振技术分析不同贮藏条件下白煮蛋水分分布及品质变化[J]. 食品科学, 2018, 39(9): 26-32.DOI:10.7506/spkx1002-6630-201809005.
[25] NARA M, OKAZAKI M, KAGI H. Infrared study of human serum very-low-density and low-density lipoproteins. implication of esterif i ed lipid C=O stretching bands for characterizing lipoproteins[J].Chemistry & Physics of Lipids, 2002, 117(1/2): 1-6.
[26] XUE H J, LI S, WANG H, et al. Laser Raman and infrared spectrum analysis of low-density lipoproteins purified from hen egg yolk[J].Spectroscopy & Spectral Analysis, 2012, 7(33): 2962-2965.DOI:10.5897/SRE12.1965.
[27] JACKSON M, MANTSCH H H. The use and misuse of FTIR spectroscopy in the determination of protein structure[J]. Critical Reviews in Biochemistry and Molecular Biology, 1995, 30(2): 95-120.DOI:0.3109/10409239509085140.
[28] 阎微. 高压和热处理对蛋黄体系中蛋白质的影响[D]. 无锡: 江南大学, 2009: 23-28.
[29] JANSENS K J A, BRIJS K, DELCOUR J A, et al. Amyloid-like aggregation of ovalbumin: effect of disulf i de reduction and other egg white proteins[J]. Food Hydrocolloids, 2016, 61: 914-922.
[30] 孙圳, 杨方威, 李侠, 等. ATR-FTIR分析冻结-解冻后的牛肉蛋白二级结构变化[J]. 光谱学与光谱分析, 2016, 36(11): 3542-3546.DOI:10.3964/j.issn.1000-0593(2016)11-3542-05.
[31] BAIER A K, KNORR D. Influence of high isostatic pressure on structural and functional characteristics of potato protein[J].Food Research International, 2015, 77: 385-390. DOI:10.1016/j.foodres.2015.05.053.
Phenomenon and Cause of Freeze-Induced Gelation of Yolk
YAN Zhengrong, ZHAO Ying, CHI Yujie*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:Yolk gelation occurs when stored at temperatures below −6 ℃, which will affect yolk application in food processing. The gelation of yolk frozen for 180 d was characterized by rheological properties, and the physicochemical properties, water distribution and secondary structure were analyzed to further explore the cause of yolk gelation. Apparent viscosity, viscosity coefficient (K) value, elasticity modulus (G’) and viscous module (G’’) in yolk were significantly increased, while fl ow index (n) value and loss tangent (tan δ) were signif i cantly decreased during frozen storage, suggesting that freezing led to serious gelation of yolk. Yolk gelation was caused by the increased average particle size and surface hydrophobicity, the decreased total sulfhydryl and the change in moisture distribution, and especially by the reduced freezable water content in yolk; meanwhile, the secondary structure transformation from a disordered to an ordered state of yolk proteins also promoted yolk protein aggregation and consequently induced yolk gelation. The cause of yolk gelation reported in this study provides a theoretical basis for further improving yolk gelation during freezing process.
Keywords:yolk; frozen storage; gelation; causal analysis
YAN Zhengrong, ZHAO Ying, CHI Yujie. Phenomenon and cause of freeze-induced gelation of yolk[J]. Food Science,2018, 39(19): 29-35. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819006. http://www.spkx.net.cn
闫峥蓉, 赵英, 迟玉杰. 冻藏期间蛋黄胶凝化现象及成因分析[J]. 食品科学, 2018, 39(19): 29-35. DOI:10.7506/spkx1002-6630-201819006. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0029-07
文献标志码:A
中图分类号:TS253.1
DOI:10.7506/spkx1002-6630-201819006
*通信作者简介:迟玉杰(1963—),女,教授,博士,研究方向为食品化学及农畜产品深加工。E-mail:yjchi323@126.com
第一作者简介:闫峥蓉(1992—),女,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:yzr979542352@163.com
基金项目:现代农业产业技术体系建设专项(CARS-40-K25)
收稿日期:2017-07-15