徐艳阳1,仇 洋1,王君旸1,张铁华1,*,颜伟强2,史成军3
(1.吉林大学食品科学与工程学院,吉林 长春 130022;2.汇能生物科技(江苏)有限公司,江苏 洪泽 223100;3.黑龙江飞鹤乳业有限公司,黑龙江 齐齐哈尔 161000)
摘 要:为探究黑果腺肋花楸多酚的抑菌效果及对α-淀粉酶活性的抑制作用,采用滤纸片法测定黑果腺肋花楸多酚对大肠杆菌、金黄色葡萄球菌、黄曲霉、烟曲霉、米根霉、岛青霉、康宁木霉的抑制效果,并考察温度和pH值对黑果腺肋花楸多酚抑制金黄色葡萄球菌和烟曲霉活性的影响。通过建立动力学模型研究黑果腺肋花楸多酚对α-淀粉酶活性的抑制作用。结果表明:黑果腺肋花楸多酚对7 种供试菌均有一定的抑制作用,对烟曲霉的抑制效果最强,最低抑菌浓度为0.171 9 mg/mL;黑果腺肋花楸多酚对金黄色葡萄球菌的抑菌效果在pH 5.0条件下最强;而对于烟曲霉,pH值的变化对抑菌效果有破坏作用。黑果腺肋花楸多酚对α-淀粉酶活性具有显著的抑制作用,并在0.10~0.70 mg/mL质量浓度范围内,对α-淀粉酶的抑制活性强于阳性对照阿卡波糖,该抑制作用属于可逆非竞争性抑制,抑制常数为0.193 2 mg/mL。在202 nm波长处,黑果腺肋花楸多酚能够引起α-淀粉酶紫外吸收的增强和吸收峰的红移。通过深入开发研究,黑果腺肋花楸多酚可作为具有辅助防腐抑菌功能的α-淀粉酶抑制剂。
关键词:黑果腺肋花楸;多酚;抑菌活性;α-淀粉酶抑制剂
黑果腺肋花楸(Aronia melanocarpa)系蔷薇科腺肋花楸属,是一种甜酸略带涩味的紫黑色浆果。黑果腺肋花楸树高0.5~3.0 m,树形呈丛状[1],鲜果产量达到10~15 t/hm2。黑果腺肋花楸原产于美国东北部,后传入欧洲[2-3],近年来在中国、朝鲜、俄罗斯、加拿大、波兰等国家均有广泛栽培[4],且品种已达30余个[5]。20世纪90年代初期,我国辽宁省干旱地区造林研究所从国外先后引进8 个品种[6]。2001年以后,黑果腺肋花楸已被推广到我国内蒙古、吉林、黑龙江、河南、河北、山东、新疆等12 个省,引种推广面积达到120 hm2[7-8]。黑果腺肋花楸果实中富含多酚、有机酸、三萜、甾醇、原花青素、花色苷、槲皮素、酚酸等活性成分以及还原糖、维生素、矿质元素等营养成分。现有研究表明,黑果腺肋花楸具有抗氧化、抗炎症、抗肿瘤、预防尿路感染、保护肝脏、降血糖、降血脂及防治心脑血管疾病等诸多生理功能。黑果腺肋花楸果实中多酚类物质总含量多达2.5%~3.5%[9],属于一种天然的多酚类活性物质,主要包括原花青素、花色苷、类黄酮、酚酸等[10],具有抗氧化、免疫调节、抗炎、降糖降脂、抗突变、抗菌以及治疗肥胖疾病等功效。黑果腺肋花楸资源丰富、经济价值高,是集食用、药用及保健等价值于一身的珍贵品种[5]。
黑果腺肋花楸中活性成分的功能性研究始于20世纪80年代,国外对其功能性研究主要集中在清除自由基能力等抗氧化活性和对人体代谢的影响等方面,而国内对功能性的研究则相对落后。Bräunlich等[11]通过研究黑果腺肋花楸提取物、亚组分及其化合物对防止生物膜形成及抑制大肠杆菌和蜡样芽孢杆菌在体外生长的能力,发现黑果腺肋花楸提取物中某些组分具有抗生物膜活性的作用。Denev等[12]研究了黑果腺肋花楸果叶提取物对大肠杆菌、李斯特菌和白色念珠菌等11 种人体病原菌的抑制活性,结果表明黑果腺肋花楸果叶提取物对金黄色葡萄球菌和普通变形杆菌均有抑制作用。Worsztynowicz等[13]研究得出黑果腺肋花楸中绿原酸是胰腺α-淀粉酶最有效的抑制剂,矢车菊素-3-葡萄糖苷能够有效抑制胰腺α-淀粉酶和脂肪酶的催化反应。但关于黑果腺肋花楸抑菌活性的研究报道甚少[14-15]。本研究对黑果腺肋花楸多酚的抑菌效果以及对α-淀粉酶的抑制作用进行探究,旨在为黑果腺肋花楸多酚在食品中作为兼具降脂功能的天然抗氧化剂,及黑果腺肋花楸资源的开发利用提供参考。
黑果腺肋花楸冻果由延边黑果科技发展有限公司提供。
大肠杆菌(Escherichia coli)由中国工业微生物菌种保藏管理中心提供;金黄色葡萄球菌(Staphylococcus aureus)、黄曲霉(Aspergillus flavus)、烟曲霉(Aspergillus fumigatus)、米根霉(Rhinpus oryzac)、岛青霉(Penicillium islandicum)、康宁木霉(Trichoderma koningii),均由吉林大学食品科学与工程学院微生物实验室提供。
苯酚、二水磷酸二氢钠、氯化钠、葡萄糖、氢氧化钠、十二水磷酸氢二钠、无水亚硫酸钠(均为分析纯)北京化工厂;酒石酸钾钠(分析纯) 天津市光复精细化工研究所;可溶性淀粉(分析纯) 天津市福晨化学试剂厂;氯霉素(分析纯) 北京鼎国生物技术有限公司;α-淀粉酶、蛋白胨、牛肉膏(均为生物纯)北京奥博星生物技术有限责任公司;琼脂(生物纯) 海南省琼海长坡琼青琼脂厂;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(化学纯) 国药集团化学试剂有限公司;阿卡波糖片 拜耳医药保健有限公司;Folin-Ciocalteus试剂为吉林大学食品科学与工程学院实验室自制。
细菌培养基(牛肉膏蛋白胨培养基)的制备:蛋白胨10.0 g、牛肉膏5.0 g、氯化钠5.0 g、蒸馏水1 000 mL,调节pH值至7.0,加入琼脂15~20 g,溶解后于高压灭菌锅中121 ℃灭菌20 min,备用。
真菌培养基(PDA培养基)的制备:马铃薯200.0 g、葡萄糖20.0 g、蒸馏水1 000 mL、琼脂15~20 g,自然pH值,于高压灭菌锅中121 ℃灭菌20 min,备用。
DNS试剂的配制:参考文献[16]中方法。
酶溶液的配制:参考文献[17]中方法配制磷酸盐缓冲液(pH 6.8)。将α-淀粉酶溶于磷酸盐缓冲液中,配成不同质量浓度的α-淀粉酶溶液。
101A-1ET电热鼓风干燥箱、DHP060恒温培养箱上海实验仪器厂有限公司;AL104型电子分析天平瑞士梅特勒-托利多仪器有限公司;DSX-280A不锈钢手提式灭菌器 上海申安医疗器械厂;FD-1C-80冷冻干燥机 北京博医康实验仪器有限公司;HH数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂;PB-10 pH计德国赛多利斯集团;RE-52-99旋转蒸发器 上海亚荣生化仪器厂;SHA-C水浴恒温振荡器 金坛市恒丰仪器厂;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;SW-CJ-1DF洁净工作台 上海博迅实业有限公司医疗设备厂;UV-4802型紫外-可见分光光度计尤尼科(上海)仪器有限公司;游标卡尺 哈尔滨量具刃具集团有限责任公司。
1.3.1 黑果腺肋花楸多酚的提取与纯化
黑果腺肋花楸冻果经室温解冻,清洗榨汁,果渣烘干,粉碎过60 目筛,在硫酸铵质量浓度0.324 g/mL、醇-水体积比0.69∶1、超声时间52 min、超声功率200 W条件下进行超声辅助乙醇-硫酸铵双水相体系提取黑果腺肋花楸果渣中多酚[18],经离心、减压浓缩(45 ℃)得到黑果腺肋花楸多酚粗提液。在进样液质量浓度4.64 mg/mL、自然pH值、进样体积6.0柱体积(bed volume,BV)、进样流速1.0 mL/min、乙醇体积分数60%、洗脱流速0.5 mL/min、洗脱体积2.5 BV条件下,采用HPD-600树脂对黑果腺肋花楸多酚粗提物进行分离纯化得到黑果腺肋花楸多酚纯化液(纯度为76.90%)[19-20]。再经冷冻干燥得到黑果腺肋花楸多酚冻干粉,置于干燥环境中储存备用。
1.3.2 供试菌种的活化与菌悬液的制备
在洁净工作台上,将7 种供试菌用平板划线法接种在相应的新鲜试管斜面培养基上,每个供试菌接种3 支试管,细菌放于37 ℃培养箱内恒温培养24 h,霉菌放于28 ℃培养箱内恒温培养48 h。供试菌种按上述方法反复活化3 次,制成浓度为106~107CFU/mL的菌悬液,置于4 ℃冰箱冷藏备用。
1.3.3 黑果腺肋花楸多酚抑菌活性的测定
采用滤纸片法测定黑果腺肋花楸多酚的抑菌效果。在洁净工作台上,每个无菌培养皿中加入0.2 mL适宜浓度的菌悬液,将灭菌融化的培养基冷却至45 ℃后倾注于培养皿中,每皿约15 mL,充分混匀,待凝固后制成含菌平板。将无菌滤纸片分别放入不同质量浓度(5.0、7.0、9.0、11.0、13.0 mg/mL)的黑果腺肋花楸多酚纯化液和无菌蒸馏水中浸泡15 min,充分吸收后取出并吸干多余溶液。每皿均匀分贴同种滤纸片3 片,空白对照滤纸片1 片,重复3 组。细菌置于37 ℃培养箱中倒置培养24 h,霉菌置于28 ℃培养箱中倒置培养48 h。培养结束后,采用十字交叉法测量抑菌圈直径,取平均值。
用2 倍稀释法将黑果腺肋花楸多酚纯化液稀释至0.171 9~11.000 0 mg/mL 7 个质量浓度梯度以测定最低抑菌浓度。按上述方法重复2 组进行培养,培养结束后,以完全无细菌生长的最低样液质量浓度作为最低抑菌浓度。
1.3.4 pH值对黑果腺肋花楸多酚抑菌活性的影响
将质量浓度为13.0 mg/mL黑果腺肋花楸多酚纯化液分别置于不同pH值(3.0、5.0、7.0、9.0、11.0)条件下处理30 min,另取未处理的样品作空白对照,以金黄色葡萄球菌、烟曲霉为指示菌,按照1.3.3节中方法进行抑菌实验。
1.3.5 α-淀粉酶活力的测定
参考Udupa等[21]的方法测定α-淀粉酶活力,并略作改动。将一定量的α-淀粉酶溶液置于比色管中,37 ℃条件下水浴15 min后,加入0.2 mL底物溶液(已预热至37 ℃),反应一定时间后,加入1.0 mL DNS试剂终止反应,并置于沸水浴中5 min,迅速冷却,加入3 mL蒸馏水稀释,于540 nm波长处测定吸光度。以磷酸盐缓冲液替代酶溶液作空白对照。
1.3.6 酶反应动力学的研究
通过改变反应体系中加入的α-淀粉酶溶液(0.02 mg/mL)体积,按照1.3.5节中方法,酶促反应开始时,每隔1 min加入1.0 mL DNS试剂终止反应,混合后置于沸水浴中5 min,迅速冷却,加入3 mL蒸馏水稀释,测定吸光度A540nm。
1.3.7 黑果腺肋花楸多酚对α-淀粉酶活性的抑制效果
将0.1 mL 0.02 mg/mL α-淀粉酶溶液置于试管中,分别加入0.1 mL不同质量浓度的黑果腺肋花楸多酚纯化液,37 ℃条件下水浴15 min后,加入0.2 mL底物溶液(已预热至37 ℃),反应3 min后,加入1.0 mL DNS试剂终止反应,并置于沸水浴中5 min,迅速冷却,加入3 mL蒸馏水稀释,在540 nm波长处测定吸光度。以磷酸盐缓冲液替代酶溶液作空白对照,阿卡波糖作阳性对照,每组实验重复3 次。按照下式计算黑果腺肋花楸多酚对α-淀粉酶活性的抑制率。
式中:A1、A2、A3分别为540 nm波长处空白对照、抑制剂管和背景对照的吸光度。
1.3.8 黑果腺肋花楸多酚对α-淀粉酶的抑制机理
选择底物质量浓度为0.5 g/100 mL,黑果腺肋花楸多酚纯化液质量浓度为0.1~0.5 mg/mL,在α-淀粉酶浓度分别为0.02、0.04、0.06、0.08 mg/mL条件下,按照1.3.7节中方法测定吸光度A540nm,并计算反应初始速率。以酶质量浓度为横坐标,反应初始速率为纵坐标作图,根据动力学图的特征判断黑果腺肋花楸多酚对α-淀粉酶的抑制类型。
选择酶质量浓度为0.02 mg/mL,黑果腺肋花楸多酚纯化液质量浓度为0.1~0.5 mg/mL,在不同的底物质量浓度(0.5 g/100 mL和1.0 g/100 mL)下,按照1.3.7节中方法测定吸光度A540nm,并计算反应初始速率。以抑制剂质量浓度为横坐标,反应初始速率的倒数为纵坐标作图,判断其具体抑制类型。
1.3.9 黑果腺肋花楸多酚对α-淀粉酶光谱性质的影响
移取2.5 mL 0.02 mg/mL α-淀粉酶溶液于石英比色皿中,扫描190~400 nm范围内的紫外吸收光谱。扫描完毕后,用移液器移取不同体积的黑果腺肋花楸多酚纯化液(0.30 mg/mL)于石英比色皿中,混匀后扫描190~400 nm范围内的紫外吸收光谱,得到不同体积的黑果腺肋花楸多酚纯化液与α-淀粉酶溶液相互作用后的紫外吸收光谱。
运用Microcal Origin 7.5软件进行图表的绘制和相关数据的处理,采用SPSS 17.0统计软件进行方差分析及邓肯氏多重比较分析,以P<0.05表示差异显著。
2.1.1 黑果腺肋花楸多酚的抑菌效果分析
通过测定抑菌圈直径大小评价黑果腺肋花楸多酚对不同供试菌的抑制作用,实验结果见表1。
表 1 黑果腺肋花楸多酚的抑菌效果
Table 1 Antimicrobial effect of Aronia melanocarpa polyphenols
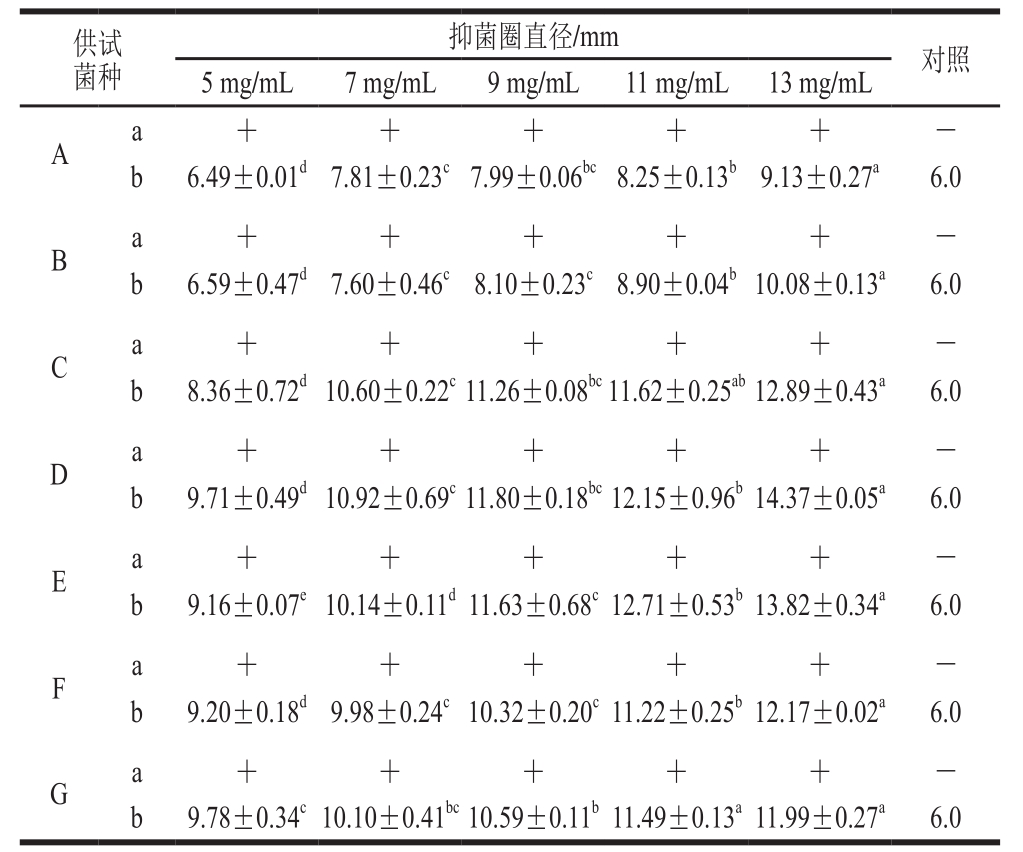
注:A.大肠杆菌;B.金黄色葡萄球菌;C.黄曲霉;D.烟曲霉;E.米根霉;F.岛青霉;G.康宁木霉;下同。a.实验阳性(+)或阴性(-);b.抑菌圈直径。同行肩标小写字母不同表示差异显著(P<0.05)。
以抑菌圈直径大于15 mm为高度敏感、10~15 mm为中度敏感、6~10 mm为低度敏感[22-23]。由表1可以看出,黑果腺肋花楸多酚对7 种供试菌均有一定的抑制作用,并且对霉菌的抑制效果强于对细菌的抑制效果。对于细菌而言,黑果腺肋花楸多酚对大肠杆菌、金黄色葡萄球菌的抑制效果均随其质量浓度的增大而加强。黑果腺肋花楸多酚对金黄色葡萄球菌的抑制效果略强于大肠杆菌,这一结果与苹果多酚的抑菌效果相似[24]。对于霉菌而言,黑果腺肋花楸多酚对烟曲霉的抑制作用最强。当多酚纯化液的质量浓度增加到13.0 mg/mL时,两种细菌对黑果腺肋花楸多酚均表现出低度敏感(抑菌圈直径处于6~10 mm之间),而烟曲霉对黑果腺肋花楸多酚则表现出中度敏感(抑菌圈直径处于10~15 mm之间)。综上所述,选择金黄色葡萄球菌和烟曲霉作为进一步研究的对象,其抑菌效果如图1所示。

图 1 黑果腺肋花楸多酚对金黄色葡萄球菌(A)和烟曲霉(B)的抑制效果
Fig. 1 Inhibitory effects of Aronia melanocarpa polyphenols on Staphylococcus aureus (A) and Aspergillus fumigatus (B)
2.1.2 pH值对黑果腺肋花楸多酚抑菌活性的影响
从图2可以看出,黑果腺肋花楸多酚在pH 3.0~11.0条件下均具有抑菌活性。对于金黄色葡萄球菌而言,抑菌圈直径随pH值的升高先变大后减小,在酸性条件下的抑菌效果比碱性条件下更强,当pH>7.0时,抑菌活性较对照组有所降低。这可能是因为黑果腺肋花楸多酚在自然情况下属于酸性物质,在碱性环境中其结构易受到破坏而引起抑菌效果的减弱。对于烟曲霉而言,随着pH值的升高,抑菌圈直径呈先变大后减小再变大的趋势,抑菌活性较对照组均有降低,具体原因有待于进一步探索。通过方差分析可得,pH值对金黄色葡萄球菌和烟曲霉的抑制效果影响均显著(P<0.05)。综上所述,在pH 5.0时,黑果腺肋花楸多酚对金黄色葡萄球菌的抑制效果最强,而对于烟曲霉,pH值的变化对抑菌效果有破坏作用。
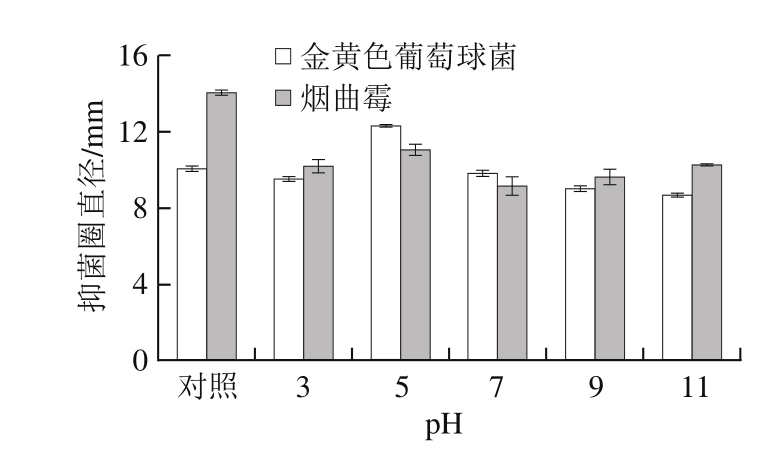
图 2 pH值对黑果腺肋花楸多酚抑菌活性的影响
Fig. 2 Effect of pH on antibacterial activity of Aronia melanocarpa polyphenols
2.1.3 最低抑菌浓度的测定结果
表 2 黑果腺肋花楸多酚最低抑菌浓度
Table 2 Minimum inhibitory concentrations of Aronia melanocarpa polyphenols

注:+.有抑菌现象;-.无抑菌现象。6和2为实验重复次数。
由表2可以看出,黑果腺肋花楸多酚对大肠杆菌和金黄色葡萄球菌的最低抑菌浓度均为2.750 0 mg/mL,对康宁木霉的最低抑菌浓度为1.375 0 mg/mL,对黄曲霉、米根霉、岛青霉的最低抑菌浓度为0.687 5 mg/mL,对烟曲霉的最低抑菌浓度为0.171 9 mg/mL,阴性对照组无抑菌现象。
2.2.1 酶反应动力学的研究结果
通过酶反应动力学实验确定最适酶量为0.1 mL,反应时间为3 min。
由Lineweaver-Burk曲线,可得到米氏常数Km为0.995 mg/mL,最大反应速率vmax为0.158 min-1。
2.2.2 黑果腺肋花楸多酚对α-淀粉酶活性的抑制效果
分别测定黑果腺肋花楸多酚和阿卡波糖在0.10~0.70 mg/mL质量浓度范围内对α-淀粉酶活性的抑制作用。由图3可知,随着黑果腺肋花楸多酚质量浓度的增加,抑制率先增大后趋于平缓。在研究的质量浓度范围内,黑果腺肋花楸多酚对α-淀粉酶活性的抑制作用强于等质量浓度的阿卡波糖。
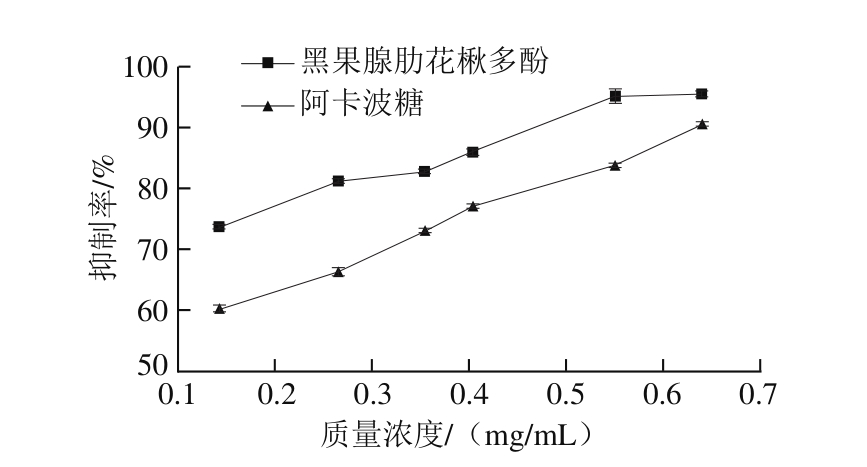
图 3 黑果腺肋花楸多酚和阿卡波糖对α-淀粉酶的抑制活性
Fig. 3 Inhibitory activity of Aronia melanocarpa polyphenols and acarbose on α-amylase
2.2.3 黑果腺肋花楸多酚对α-淀粉酶的抑制类型
根据酶与抑制剂的结合方式及抑制作用是否可逆,可将抑制类型分为可逆性抑制和不可逆性抑制。可逆性抑制是指抑制剂与酶通过非共价键结合,去除抑制剂后酶活性可以恢复;不可逆性抑制是指抑制剂与酶通过共价键结合引起酶失活,又被称为酶的修饰抑制[25]。由图4可以看出,未添加黑果腺肋花楸多酚溶液时,反应初始速率对酶质量浓度作图得到一条过原点的直线;当加入一定量黑果腺肋花楸多酚溶液后,由于抑制剂的量是恒定的,同样得到一条通过原点的直线,但斜率低于无抑制剂组直线的斜率。由此推断出黑果腺肋花楸多酚对α-淀粉酶活性的抑制类型为可逆性抑制。
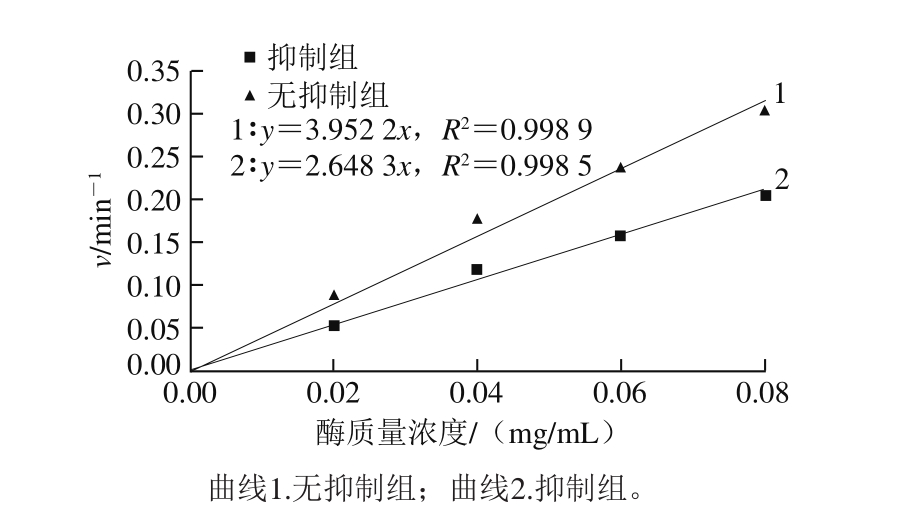
图 4 黑果腺肋花楸多酚对α-淀粉酶的抑制动力学曲线
Fig. 4 Kinetic curve of Aronia melanocarpa polyphenols for the inhibition of α-amylase
2.2.4 黑果腺肋花楸多酚对α-淀粉酶活性的可逆性抑制类型
根据抑制剂、酶和底物三者之间的关系,可逆性抑制分为竞争性抑制、非竞争性抑制和反竞争性抑制3 种类型[26]。以抑制剂质量浓度为横坐标,1/v为纵坐标作图,不同底物质量浓度对应的直线相交但不交于横坐标轴时,属于竞争性抑制;交于横坐标轴时,属于非竞争性抑制;平行则属于反竞争性抑制。抑制常数Ki为交点对应的抑制剂浓度[27]。由图5可知,黑果腺肋花楸多酚对α-淀粉酶活性的可逆抑制类型属于非竞争性抑制,抑制常数Ki为0.193 2 mg/mL。
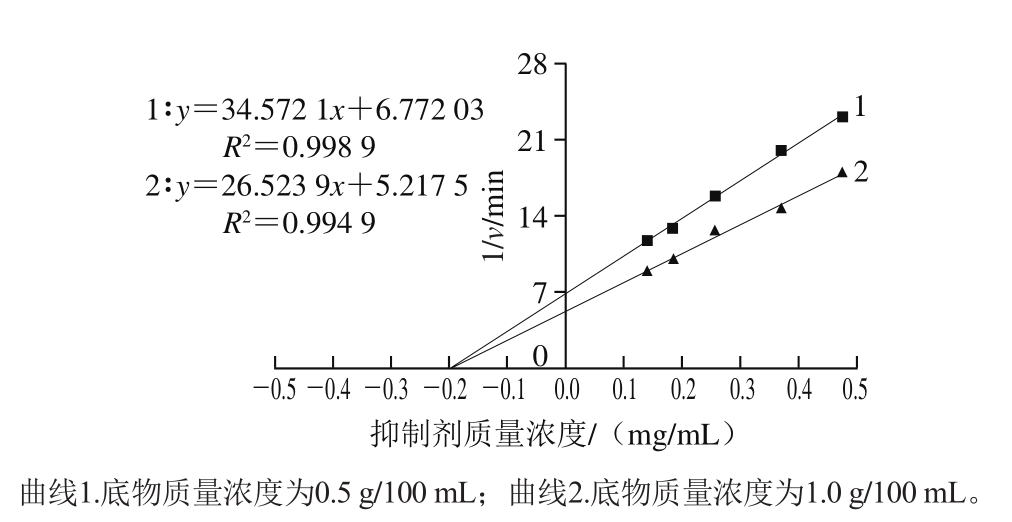
图 5 黑果腺肋花楸多酚对α-淀粉酶的可逆抑制类型
Fig. 5 Reversible inhibition type of Aronia melanocarpa polyphenols on α-amylase
2.2.5 黑果腺肋花楸多酚对α-淀粉酶光谱性质的影响
α-淀粉酶溶液在190~400 nm范围内存在202 nm与279 nm波长处2 个较大的吸收峰,由于202 nm波长处的波谱产生跳跃,影响比较结果,故选定190~250 nm作为考察范围,研究加入不同量黑果腺肋花楸多酚与α-淀粉酶溶液作用后的紫外吸收光谱。从图6中可以看出,在202 nm波长附近,吸光度随着黑果腺肋花楸多酚纯化液的加入而不断增加,最大吸收波长出现红移现象。这是因为黑果腺肋花楸多酚纯化液促进了酶构象发生变化,从而影响吸光度和吸收峰的变化[28]。继续增大黑果腺肋花楸多酚纯化液的加入量,紫外吸收峰的增幅逐渐变小,表明此时抑制剂与α-淀粉酶的相互作用已趋于平衡。
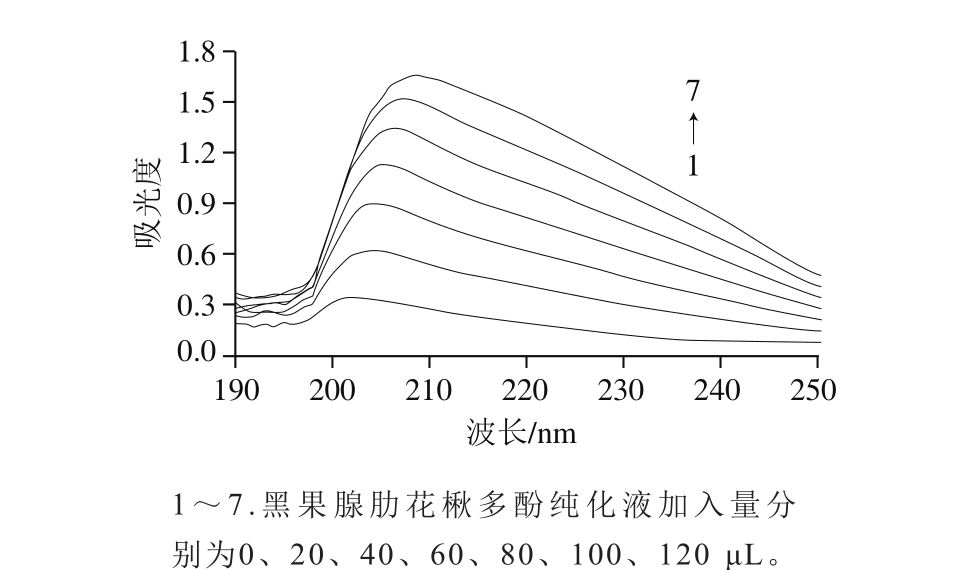
图 6 不同加入量抑制剂处理后α-淀粉酶的紫外吸收光谱
Fig. 6 Ultraviolet absorption spectra of α-amylase with different amounts of added inhibitor
通过滤纸片法发现黑果腺肋花楸多酚对大肠杆菌、金黄色葡萄球菌、黄曲霉、烟曲霉、米根霉、岛青霉、康宁木霉均有一定的抑制作用,其中对金黄色葡萄球菌的抑制作用强于大肠杆菌,对烟曲霉的抑制效果最强,最低抑制浓度为0.171 9 mg/mL;在pH 5.0条件下,黑果腺肋花楸多酚对金黄色葡萄球菌的抑制效果最强,而对于烟曲霉,处理温度和pH值的变化对抑菌效果均有破坏作用。通过研究黑果腺肋花楸多酚对α-淀粉酶活性的抑制动力学特性,表明黑果腺肋花楸多酚对α-淀粉酶具有显著的抑制作用,并且在0.10~0.70 mg/mL质量浓度范围内,黑果腺肋花楸多酚对α-淀粉酶的抑制活性强于阳性对照阿卡波糖;黑果腺肋花楸多酚对α-淀粉酶活性属于可逆非竞争性抑制,抑制常数为0.193 2 mg/mL。在202 nm波长处,黑果腺肋花楸多酚能够引起α-淀粉酶紫外吸收的增强和吸收峰的红移。本研究初步证实黑果腺肋花楸多酚对多种菌及α-淀粉酶活性具有一定的抑制作用,黑果腺肋花楸多酚可作为兼具防腐抑菌功能的α-淀粉酶抑制剂应用于食品、药品防腐保鲜中,同时也为黑果腺肋花楸资源的开发利用提供参考。
参考文献:
[1] OCHMIAN I D, GRAJKOWSKI J, SMOLIK M. Comparison of some morphological features, quality and chemical content of four cultivars of chokeberry fruits (Aronia melanocarpa)[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2012, 40(1): 253-260.
[2] SHARIF T, STAMBOULI M, BURRUS B, et al. The polyphenolicrich Aronia melanocarpa juice kills teratocarcinomal cancer stem-like cells, but not their differentiated counterparts[J]. Journal of Functional Foods, 2013, 5(3): 1244-1252. DOI:10.1016/j.jff.2013.04.007.
[3] DENEV P N, KRATCHANOV C G, CIZ M, et al. Bioavailability and antioxidant activity of black chokeberry (Aronia melanocarpa)polyphenols: in vitro and in vivo evidences and possible mechanisms of action: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2012, 11(5): 471-489. DOI:10.1111/j.1541-4337.2012.00198.x.
[4] 张连生, 韩文忠, 姜镇荣. 黑果腺肋花楸: 前途广阔的绿化新品种[J].农业科技与信息(现代园林), 2007(8): 63-64.
[5] 韩文忠, 马兴华. 黑果腺肋花楸的生物学特性和应用价值[J]. 辽宁林业科技, 2005(4): 40-42.
[6] 陈妍竹, 胡文忠, 姜爱丽, 等. 黑果腺肋花楸功能作用及食品加工研究进展[J]. 食品工业科技, 2016, 37(9): 397-400. DOI:10.13386/j.issn1002-0306.2016.09.071.
[7] 姜镇荣. 黑果腺肋花楸在三北地区的应用与发展[J]. 北方果树,2012(4): 21-23. DOI:10.16376/j.cnki.bfgs.2012.04.002.
[8] 姜镇荣. 黑果腺肋花楸产业化高效栽培技术研究的展望[J]. 辽宁林业科技, 2013(2): 42-43.
[9] KOKOTKIEWICZ A, JAREMICZ Z, LUCZKIEWICZ M. Aronia plants: a review of traditional use, biological activities, and perspectives for modern medicine[J]. Journal of Medicinal Food, 2010,13(2): 255-269. DOI:10.1089/jmf.2009.0062.
[10] CÁLIN-SÁNCHEZ Á, KHARAGHANI A, LECH K, et al. Drying kinetics and microstructural and sensory properties of black chokeberry (Aronia melanocarpa) as affected by drying method[J].Food and Bioprocess Technology, 2015, 8(1): 63-74. DOI:10.1007/s11947-014-1383-x.
[11] BRÄUNLICH M, ØKSTAD O A, SLIMESTAD R, et al. Effects of Aronia melanocarpa constituents on biof i lm formation of Escherichia coli and Bacillus cereus[J]. Molecules, 2013, 18(12): 14989-14999.DOI:10.3390/molecules181214989.
[12] DENEV P, KRATCHANOVA M, CIZ M, et al. Antioxidant,antimicrobial and neutrophil-modulating activities of herb extracts[J].Acta Biochimica Polonica, 2014, 61(2): 359-367.
[13] WORSZTYNOWICZ P, NAPIERALA M, BIALAS W, et al.Pancreatic α-amylase and lipase inhibitory activity of polyphenolic compounds present in the extract of black chokeberry (Aronia melanocarpa L.)[J]. Process Biochemistry, 2014, 49(9): 1457-1463.
[14] 王作弟.一种含支链氨基酸的黑果腺肋花楸食品:CN104605287A[P]. 2015-05-13[2017-06-20].
[15] 姜镇荣. 黑果腺肋花楸栽培技术[J]. 防护林科技, 2009(3): 118; 122.DOI:10.13601/j.issn.1005-5215.2009.03.042.
[16] 李环, 陆佳平, 王登进. DNS法测定山楂片中还原糖含量的研究[J]. 食品工业科技, 2013, 34(18): 75-77. DOI:10.13386/j.issn1002-0306.2013.18.043.
[17] 阿依仙木·加帕尔, 闫冬, 何雯, 等. 维药石榴花多酚提取物对α-葡萄糖苷酶和α-淀粉酶抑制作用的研究[J]. 新疆医科大学学报, 2013,36(5): 581-583; 587.
[18] XU Y Y, QIU Y, REN H, et al. Optimization of ultrasound-assisted aqueous two-phase system extraction of polyphenolic compounds from Aronia melanocarpa pomace by response surface methodology[J].Preparative Biochemistry and Biotechnology, 2017: 47(3): 312-321.
[19] 国石磊, 朱凤妹, 王娜, 等. 黑果腺肋花楸花色苷树脂纯化工艺及其稳定性研究[J]. 天然产物研究与开发, 2015, 27(9): 1636-1642.
[20] 李斌, 高凝轩, 刘辉, 等. 大孔树脂纯化黑果腺肋花楸多酚的工艺优化[J]. 食品科学, 2016, 37(16): 69-74. DOI:10.7506/spkx1002-6630-201616011.
[21] UDUPA S L, PRABHAKAR A R, TANDON S. α-Amylase inhibitors in foodstuffs[J]. Food Chemistry, 1989, 34(2): 95-101.
[22] 肖新生, 林倩英. 枇杷叶提取物抑菌作用研究[J]. 现代食品科技,2010, 26(1): 59-62. DOI:10.13982/j.mfst.1673-9078.2010.01.027.
[23] 王储炎, 艾启俊, 范涛, 等. 鹿蹄草提取物抑菌活性的研究[J].现代食品科技, 2011, 27(1): 26-28. DOI:10.13982/j.mfst.1673-9078.2011.01.020.
[24] 孙建霞. 苹果多酚的提取分离及其主要功能活性研究[D]. 泰安: 山东农业大学, 2005: 48-56.
[25] 王镜岩. 生物化学[M]. 北京: 高等教育出版社, 2002: 356-373.
[26] 刘艳丰, 黄惠华. 乌龙茶与普洱茶浸提液对胰α-淀粉酶的抑制作用[J]. 食品与发酵工业, 2010, 36(7): 54-57. DOI:10.13995/j.cnki.11-1802/ts.2010.07.041.
[27] 匙丹丹, 李楠, 刘世凯. 板栗种皮多酚的抗氧化性及其对α-淀粉酶抑制作用的研究[J]. 中国酿造, 2010, 29(4): 95-98.
[28] 刘自琴, 黄惠华. 绿茶和红茶浸提液对α-淀粉酶的抑制作用研究[J]. 现代食品科技, 2010, 26(7): 680-683. DOI:10.13982/j.mfst.1673-9078.2010.07.011.
α-Amylase Inhibitory Activity and Antibacterial Activity of Polyphenols from Aronia melanocarpa Berries
XU Yanyang1, QIU Yang1, WANG Junyang1, ZHANG Tiehua1,*, YAN Weiqiang2, SHI Chengjun3
(1. College of Food Science and Engineering, Jilin University, Changchun 130022, China;2. Huineng Biological Technological (Jiangsu) Co. Ltd., Hongze 223100, China;3. Heilongjiang Feihe Dairy Co. Ltd., Qiqihar 161000, China)
Abstract:This study was designed to explore the inhibitory effect of polyphenols from Aronia melanocarpa berries on α-amylase activity and their antibacterial activity. The antimicrobial activity against Escherichia coli, Staphylococcus aureus,Aspergillus fl avus, Aspergillus fumigatus, Rhizopus oryzae, Penicillium islandicum and Trichoderma koningii was investigated by the filter paper disc method, and the inf l uence of temperature and pH on the inhibition of Staphylococcus aureus and Aspergillus fumigatus was examined. The inhibitory effect of Aronia melanocarpa polyphenols on α-amylase were studied by kinetic modelling. The results demonstrated that Aronia melanocarpa polyphenols inhibited all seven strains tested. Among them, the strongest inhibitory effect against Aspergillus fumigatus was observed with a minimal inhibition concentration(MIC) of 0.171 9 mg/mL. At pH 5.0, Aronia melanocarpa polyphenols had the strongest antibacterial activity against Staphylococcus aureus. But the antibacterial activity against Aspergillus fumigatus could be destroyed by changing the pH.Furthermore, Aronia melanocarpa polyphenols had an obvious inhibitory effect on α-amylase. Compared with the positive control of acarbose, Aronia melanocarpa polyphenols were more active against α-amylase within the concentration range of 0.10–0.70 mg/mL. The inhibition was non-competitive and reversible and the inhibition constant was 0.193 2 mg/mL.Aronia melanocarpa polyphenols enhanced the ultraviolet absorption intensity of α-amylase at 202 nm and led to a redshift in the absorption peak wavelength. Therefore, Aronia melanocarpa polyphenols can be used as a new α-amylase inhibitor and antimicrobial agent.
Keywords:Aronia melanocarpa; polyphenol; antimicrobial activity; α-amylase inhibitor
XU Yanyang, QIU Yang, WANG Junyang, et al. α-Amylase inhibitory activity and antibacterial activity of polyphenols from Aronia melanocarpa berries[J]. Food Science, 2018, 39(19): 51-57. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819009. http://www.spkx.net.cn
徐艳阳, 仇洋, 王君旸, 等. 黑果腺肋花楸多酚的抑菌效果及对α-淀粉酶活性的抑制作用[J]. 食品科学, 2018, 39(19):51-57. DOI:10.7506/spkx1002-6630-201819009. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0051-07
文献标志码:A
中图分类号:TS202.1
DOI:10.7506/spkx1002-6630-201819009
*通信作者简介:张铁华(1970—),男,教授,博士,研究方向为食品科学与工程。E-mail:zhangth@jlu.edu.cn
第一作者简介:徐艳阳(1972—),女,副教授,博士,研究方向为食品营养与安全。E-mail:xuyy@jlu.edu.cn
江苏省淮安市“淮上英才计划”项目(20161229)
基金项目:吉林省国际科技合作项目(20120717);吉林大学科研业务费项目(3R2160274071);
收稿日期:2017-07-09