罗 敏1,陈德经1,2,*,韩 豪1,2,辛 茜1
(1.陕西理工大学生物科学与工程学院,陕西 汉中 723001;2.陕西理工大学,陕西省资源生物重点实验室,陕西 汉中 723001)
摘 要:采用醋酸和硝酸作为催化剂对米胚多糖进行硒化修饰,并对不同方法制备的硒化米胚多糖的抗氧化性进行研究。体外抗氧化活性研究:采用O2-·、·OH、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除实验以及还原力实验比较了米胚多糖(rice embryo polysaccharide,REP)、醋酸催化制备的硒化米胚多糖(selenium-containing rice embryo polysaccharide,Se-REP)1、硝酸催化制备的硒化米胚多糖(Se-REP2)抗氧化活性。体内抗氧化活性研究:主要考察米胚多糖及两种制备方法所得的硒化米胚多糖法体内抗氧化能力,测定小鼠血清、肝脏、肾脏、心脏组织中的超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平及总抗氧化能力(total antioxidant capacity,T-AOC)。结果表明:REP、Se-REP1、Se-REP2的5 个不同浓度对O2-·、·OH、DPPH自由基清均有不同程度的清除能力,其还原力随浓度的增加而增强。体内抗氧化活性研究发现:Se-REP1、Se-REP2可提高组织及血清中SOD、GSH-Px活力及T-AOC,且作用效果均强于REP,但在心脏中T-AOC的提高不显著。MDA含量在肝脏及肾脏中虽低于空白对照组,但效果不显著,而在血清和心脏中表现出较强的显著性,Se-REP2组的抗氧化酶活力最高。
关键词:米胚多糖;硒多糖;小鼠;抗氧化性
水稻是我国主要粮食作物之一,大米胚芽(简称米胚)是稻米的胚胎,含胚量较高,在大米籽粒中占2.0%~2.5%,在我国其年产量约有10万 t,也是谷物加工的副产物,在大米加工过程中大部分米胚芽脱落入副产品米糠中[1]。在国外,米胚被著称为“天赐营养源”[2],它具有极高的营养价值,营养成分比较全面且含量十分丰富,糖分质量分数27.13%、脂肪质量分数26.44%、蛋白质量分数22.25%、水分质量分数12.36%、粗纤维质量分数3.22%、灰分质量分数8.41%、钙含量37.40 mg/100 g、铁含量11.40 mg/100 g[3]。近年来研究发现,米胚多糖具有抗肿瘤、提高免疫力、降血糖、抗肥胖与心血管疾病、抗辐射等生理功能[4-8],因此广泛用于营养保健品、医药、功能食品等。
硒为Ⅵ族元素,是生物体所必需的矿物质,与人体健康密不可分。研究发现硒可降低癌症、心血管病发病率,并具有抗衰老作用[9]。发生在中国的克山病和大骨节病与体内低水平硒有关,补充适量的硒可增强人体免疫力、提高视力、防治肝坏死、延缓衰老[10]。根据1980年美国国家科学院公布的矿物质营养素硒的推荐的允许摄入量50~200 μg/(人·d)[11]。多糖和硒可防治多种疾病,近年来对多糖和硒活性的研究较为深入,但将多糖与硒有机结合成为硒多糖,国内外的研究尚处于起步阶段[12]。米胚多糖与硒结合生成有机化合物硒多糖,与大多数毒性较大的无机硒化合物相比更安全[13],且具备了硒元素与多糖自身的天然价值,更能增强生物活性和生物体的吸收与利用。研究表明,硒多糖具有抗氧化、抗肿瘤、降血糖、提高免疫力等功效[14-18]。
利用人工合成的硒多糖有灵芝硒多糖、枸杞硒多糖、大蒜硒多糖、甘草硒多糖、香菇硒多糖、红枣硒多糖[19-24],但将米胚多糖硒化及其体内外抗氧化功能鲜见文献报道。本实验根据枸杞多糖和红枣多糖的硒化方法[20,24],在不同条件下对米胚多糖(rice embryo polysaccharide,REP)进行硒化并测定其抗氧化活性,从而为硒化米胚多糖(selenium-rice embryo polysaccharide,Se-REP)的开发利用提供理论依据。
3 月龄昆明种小鼠48 只,购自西安交通大学医学院实验动物中心,许可证号SCXK(陕)2016-003,雌雄性各半,分笼饲养。
米胚(籼米) 勉县定军米业发展有限责任公司;米胚多糖(糖质量分数76.42%)由本研究室提供。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 北京索莱宝科技有限公司;过氧化氢、体积分数95%乙醇溶液 天津市富宇精细化工有限公司;硫酸亚铁、水杨酸 天津市北联精细化学品开发有限公司;邻苯三酚、三羟甲基氨基甲烷 上海源叶生物科技有限公司;盐酸 四川川化青上化工有限公司;铁氰化钾、磷酸二氢钠 天津市盛奥化学试剂有限公司;磷酸氢二钠 成都市科龙化学试剂厂;三氯化铁 天津市福晨化学试剂厂;三氯乙酸 上海精析化工科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、总抗氧化能力(total-antioxidant capacity,T-AOC)试剂盒南京建成生物工程研究所;考马斯亮蓝G250、牛血清白蛋白 上海蓝季科技发展有限公司。
DK-98-Ⅱ恒温水浴锅 天津市泰斯特仪器有限公司;JA5003电子天平 上海舜宇恒平科学仪器有限公司;UV-1750型紫外-可见分光光度仪 日本岛津仪器公司;TGL-20M离心机 湖南湘仪实验室仪器开发有限公司。
1.3.1 硒化米胚多糖的制备
Se-REP1制备:按前期研究优化实验条件制备硒化米胚多糖[25],称取米胚多糖1 g于50 mL烧杯中,加入25 mL蒸馏水超声使其完全溶解,边搅拌边加入1 mL冰醋酸,形成透明溶液。再加入溶于少量蒸馏水的0.5 g亚硒酸钠,于50 ℃水浴加热反应42 h。反应结束后浓缩至原体积的1/3,浓缩液装入透析袋中,去离子水透析过夜,然后取少量透析液加入抗坏血酸检测,直至无红色出现时停止透析,离心除去沉淀,然后加入体积分数95%乙醇溶液,乙醇的最终体积分数为85%,冰箱冷藏,静置12 h后,3 800 r/min离心10 min,沉淀用无水乙醇洗涤2 次,50 ℃真空干燥,得米胚硒多糖[26]。
Se-REP2制备:按前期研究优化实验条件制备硒化米胚多糖,称取1 g米胚多糖溶于50 mL体积分数0.5%硝酸溶液中,超声搅拌使其完全溶解,再加入用少量蒸馏水溶解的0.7 g亚硒酸钠,70 ℃下水浴加热6 h,反应结束后浓缩至原体积的1/3,浓缩液装入透析袋中,去离子水透析过夜,之后与Se-REP1步骤一致[27]。
Se-REP1、Se-REP2分别用硫酸蒽酮法[28]测定糖质量分数分别为46.13%、54.86%。原子荧光光度计[29]测定硒含量分别为(145.400±2.751)、(179.700±2.250)mg/kg。
1.3.2 体外抗氧化活性测定
1.3.2.1 ·OH清除率测定
采用Fenton体系[30],向试管中加入不同质量浓度的样品溶液2 mL,9 mmol/L硫酸亚铁2 mL、9 mmol/L水杨酸-乙醇溶液2 mL最后加入9 mmol/L双氧水2 mL启动反应,振荡混匀,37 ℃水浴保温30 min,冷却至室温后5 000 r/min离心10 min,取上清液在510 nm波长处每隔30 s测定其吸光度,以蒸馏水调零,平行测定吸光度3 次。按式(1)计算·OH的清除率。
式中:A0为不加样品溶液,加入水杨酸-乙醇显色剂的溶液吸光度;A1为加入样品溶液和水杨酸-乙醇显色剂的溶液吸光度;A2为加入样品溶液但不加水杨酸-乙醇显色剂的溶液吸光度。
1.3.2.2 DPPH自由基清除率测定
参考魏明等[31]的方法,取3 mL不同质量浓度的样品溶液于试管中,分别加入3 mL 0.1 mmol/L DPPH溶液(用体积分数95%乙醇溶液配制),振荡混合后,避光26 ℃下放置30 min,然后在517 nm波长处检测吸光度,用蒸馏水调零,平行测定吸光度3 次。按式(2)计算DPPH自由基清除率。
式中:A0为3 mL蒸馏水+3 mL DPPH溶液的吸光度;A1为3 mL样品溶液+3 mL DPPH溶液的吸光度;A2为3 mL样品溶液+3 mL 95%乙醇溶液的吸光度。
1.3.2.3 O2-·清除率测定
参考黄玲玲等[30]的方法并稍作修改,取不同质量浓度的样品溶液1 mL,加入0.05 mol/L Tris-HCl缓冲液(pH 8.2)4.5 mL,在25 ℃水浴10 min后,加入3 mmol/L邻苯三酚溶液0.2 mL混匀,在25 ℃水浴5 min,最后加入8 mmol/L HCl溶液终止反应,在299 nm波长处测定其吸光度,以蒸馏水调零,平行测定吸光度3 次。按式(3)计算O2-·清除率。
式中:A0为不加样品溶液,加入邻苯三酚的溶液吸光度;A1为加入样品溶液和邻苯三酚的溶液吸光度;A2为加入样品溶液但不加邻苯三酚的溶液吸光度。
1.3.2.4 还原力测定
参考徐春兰等[9]的方法,取不同质量浓度的样品溶液1 mL,加入0.2 mol/L的磷酸盐缓冲液(pH 6.6)2 mL和质量分数1%的铁氰化钾溶液2 mL,混匀,在50 ℃水浴20 min后,加入10%三氯乙酸溶液2 mL,混匀后5 000 r/min离心10 min,取上清液2 mL加入2 mL蒸馏水和0.5 mL质量分数0.1%三氯化铁溶液,反应10 min后,在700 nm波长处测定其吸光度,平行测定吸光度3 次,以蒸馏水调零。吸光度越大表示其还原力越强。
1.3.3 体内抗氧化活性测定
1.3.3.1 动物分组与给药
实验小鼠48 只,喂养基础饲料适应7 d后随机分为8 组,每组6 只,分为空白对照组(每天灌胃同样体积的0.9%生理盐水)、VC组(阳性对照,灌胃10 mg/kg VC)、REPH组(灌胃480 μg/(kg·d) REP)、REPL组(灌胃160 μg/(kg·d) REP)、Se-REP1H组(灌胃480 μg/(kg·d) Se-REP1)、Se-REP1L组(灌胃160 μg/(kg·d) Se-REP1)、Se-REP2H组(灌胃480 μg/(kg·d) Se-REP2)、Se-REP2L组(灌胃160 μg/(kg·d)Se-REP2),硒元素的使用量是按照人体推荐量及小鼠与人之间的剂量换算得出,连续灌胃30 d,第30天禁食过夜,称质量后,乙醚麻醉,心脏取血于1.5 mL离心管中,置于37 ℃水浴中放置30 min,然后转移到4 ℃过夜,次日于4 ℃、4 000 r/min离心10 min得到血清,迅速分离小鼠的肝脏、肾脏、心脏用预先准备好的冷生理盐水漂洗掉浮血,拭干,称质量后,按料液比1∶9加入生理盐水,制备成10%的组织匀浆液,4 ℃、4 000 r/min离心10 min,收集上清液于-20 ℃保存,按照试剂盒说明分别测定血清及各组织中的SOD、GSH-Px活力、T-AOC、MDA含量[32-33]。
1.3.3.2 考马斯亮蓝法测定蛋白质量浓度
考马斯亮蓝G-250显色液的制备:准确称取0.100 g考马斯亮蓝G-250,加入50 mL体积分数95%乙醇溶液,此时溶液为蓝色,再加入100 mL 体积分数85%磷酸溶液,此时溶液变为血红色,最后加入蒸馏水在室温条件下定容至1 L,溶液颜色最终变为褐色,过滤,避光保存[34]。
蛋白质标准曲线的建立:准确称取0.100 g牛血清白蛋白,用生理盐水溶解并定容到100 mL容量瓶,此标准溶液质量浓度为1 mg/mL。将标准溶液(1 mg/mL)用生理盐水稀释成0.2、0.4、0.6、0.8、1.0 mg/mL的蛋白标准液。分别取不同质量浓度的蛋白标准液1 mL于试管中,以蒸馏水作空白,分别加入5 mL考马斯亮蓝G-250溶液,摇匀,静置2 min,在595 nm波长处测定吸光度[34]。以吸光度(y)为纵坐标,蛋白质量浓度(x/(mg/mL))为横坐标,绘制标准曲线图,其标准曲线方程为:y=0.203 5x+0.154 2,R2=0.995 5。
样品的测定:准确移取样品溶液400 μL,加入600 μL生理盐水,按1.3.3.2节方法显色,测其吸光度,并计算样品蛋白质量浓度。
数据以 ±s表示,用Excel软件进行数据统计分析并作图、SPSS 20.0软件进行方差分析和多重比较。P<0.01为差异极显著。
±s表示,用Excel软件进行数据统计分析并作图、SPSS 20.0软件进行方差分析和多重比较。P<0.01为差异极显著。
2.1.1 ·OH清除能力

图 1 REP、Se-REP1、Se-REP2对·OH的清除能力
Fig. 1 Hydroxyl free radical scavenging capacity of REP, Se-REP1 and Se-REP2
从图1可知,REP、Se-REP1、Se-REP2在实验设置的质量浓度范围内对·OH的清除作用随质量浓度的增大而增强,且Se-REP1、Se-REP2的清除能力均比REP高。但清除作用显然均没有VC高。在质量浓度为0.5~1.5 mg/mL时,随质量浓度的增加REP、Se-REP1、Se-REP2对·OH的清除率显著升高,但当质量浓度在2.0 mg/mL以上时,随质量浓度的增加,清除率缓慢增加。质量浓度在2.5 mg/mL时,REP、Se-REP1、Se-REP2对·OH的清除率分别为64.12%、73.92%、79.75%,其半抑制浓度(50% inhibitory concentration,IC50)分别为1.49、1.02、0.71 mg/mL,而VC在质量浓度1 mg/mL时清除率达到95%以上。可见Se-REP2的抗氧化性优于Se-REP1、REP,可为以后制备硒化多糖在功效等方面提供理论依据。
2.1.2 DPPH由基清除能力

图 2 REP、Se-REP1、Se-REP2 对DPPH自由基的清除能力
Fig. 2 DPPH free radical scavenging capacity of REP, Se-REP1 and Se-REP2
从图2可以看出,REP、Se-REP1、Se-REP2 对DPPH自由基均有一定的清除作用,在实验设置的质量浓度0.5~2.5 mg/mL范围内,清除能力与质量浓度成正比,且Se-REP1、Se-REP2的清除能力均强于REP,但清除作用明显均小于VC。当质量浓度在2.5 mg/mL时,REP、Se-REP1、Se-REP2对DPPH自由基的清除率分别43.03%、50.23%、59.49%,其Se-REP1、Se-REP2的IC50分别为2.25、1.88 mg/mL,而VC在质量浓度1.5 mg/mL时清除率达到95%以上,可见Se-REP2的抗氧化性优于Se-REP1、REP,可为以后制备硒化多糖在功效等方面提供理论依据。
2.1.3 ·清除能力
·清除能力
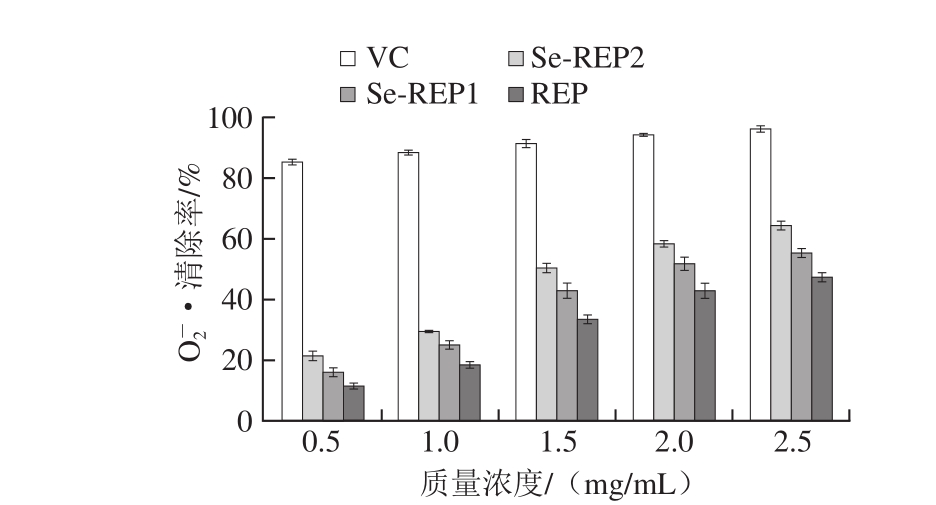
图 3 REP、Se-REP1、Se-REP2对 ·的清除能力
·的清除能力
Fig. 3 Superoxide anion radical scavenging capacity of REP, Se-REP1 and Se-REP2
从图3可以看出,在实验设置的质量浓度范围内REP、Se-REP1、Se-REP2对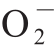 ·清除能力均有一定的清除作用,其清除能力与质量浓度成正比,且Se-REP1、Se-REP2的清除能力均强于REP。当质量浓度在2.5 mg/mL时,REP、Se-REP1、Se-REP2对
·清除能力均有一定的清除作用,其清除能力与质量浓度成正比,且Se-REP1、Se-REP2的清除能力均强于REP。当质量浓度在2.5 mg/mL时,REP、Se-REP1、Se-REP2对 ·的清除率分别为47.84%、55.84%、64.78%,其Se-REP1、Se-REP2的IC50分别为2.03、1.73 mg/mL,而VC在质量浓度2 mg/mL时清除率达到94%以上,此外REP、Se-REP1、Se-REP2的清除率与VC的
·的清除率分别为47.84%、55.84%、64.78%,其Se-REP1、Se-REP2的IC50分别为2.03、1.73 mg/mL,而VC在质量浓度2 mg/mL时清除率达到94%以上,此外REP、Se-REP1、Se-REP2的清除率与VC的 ·清除能力差异较大,可见Se-REP2的抗氧化性优于Se-REP1、REP,可为以后制备硒化多糖在功效等方面提供理论依据。
·清除能力差异较大,可见Se-REP2的抗氧化性优于Se-REP1、REP,可为以后制备硒化多糖在功效等方面提供理论依据。
2.1.4 还原力

图 4 REP、Se-REP1、Se-REP2的还原力
Fig. 4 Reducing power of REP, Se-REP1 and Se-REP2
从图4可知,REP、Se-REP1、Se-REP2都具有一定的还原力,且随着质量浓度的增加,其还原力增强,选用抗氧化剂较好的VC,在起始相同质量浓度范围内的还原力做对比,发现REP、Se-REP1、Se-REP2均比VC的还原力弱。
2.2.1 不同剂量REP、Se-REP1、Se-REP2对小鼠体质量的影响
小鼠的体质量在某种程度上显示了小鼠的生长情况,由表1知,随着给药时间的延长,每组小鼠的体质量也随之逐渐增加。将REP、Se-REP1、Se-REP2、VC与空白对照组相比较,不存在显著差异(P>0.05),表明小鼠的体质量不受REP、Se-REP1、Se-REP2影响,即对小鼠生长发育没有影响。
表 1 不同剂量REP、Se-REP1、Se-REP2对小鼠体质量的影响(n=6)
Table 1 Effects of REP, Se-REP1 and Se-REP2 at different doses on body mass in mice (n= 6)

2.2.2 不同剂量REP、Se-REP1、Se-REP2对小鼠血清中SOD、GSH-Px活力、T-AOC及MDA含量的影响
表 2 REP、Se-REP1、Se-REP2对小鼠血清中SOD、GSH-Px活力、T-AOC及MDA含量的影响(n=6)
Table 2 SOD, GSH-Px activity and T-AOC and MDA contents in serum of mice treated with REP, Se-REP1 and Se-REP2 (n= 6)

注:**.与空白对照组相比有极显著差异(P<0.01);同一指标中不同上标字母表示组间具有极显著差异(P<0.01)。下同。
由表2可知,REPH、SeREP1L、SeREP1H、SeREP2L、SeREP2H对于小鼠血清中MDA含量均产生极显著的降低效果(P<0.01),对小鼠血清中SOD活力而言,也均高于空白对照组(P<0.01),表现出较好的抗氧化活性。对于小鼠血清中GSH-Px活力而言,REP、SeREP1、SeREP2的效果均极显著强于空白对照组(P<0.01)。对于T-AOC的影响,REPH、SeREP1H、SeREP2H表现出极显著的升高(P<0.01),效果优于空白对照组。SeREP1、SeREP2在小鼠血清中的抗氧化能力强于REP,SeREP2比SeREP1的抗氧化能力强。
2.2.3 不同剂量REP、Se-REP1、Se-REP2对小鼠心脏中SOD、GSH-Px活力、T-AOC及MDA含量的影响
由表3可知,不同的组别对于小鼠心脏中的T-AOC没有显著的提高作用。REPH、SeREP1L、SeREP1H、SeREP2L、SeREP2H对于小鼠心脏中SOD、GSH-Px活力的提高作用均极显著强于空白对照组(P<0.01),VC组与REPL组无显著差异,效果接近,SeREP2H和SeREP1H效果极显著高于其余组别(P<0.01)。REPH、SeREP1H、SeREP2L、SeREP2H对小鼠心脏中的MDA含量与空白对照组相比具有极显著的降低作用(P<0.01),VC组与其余各组效果相差不大,SeREP2的MDA含量显著低于SeREP1、REP。在小鼠心脏中SeREP1、SeREP2的抗氧化能力强于REP,SeREP2比SeREP1的抗氧化能力强。
表 3 REP、Se-REP1、Se-REP2对小鼠心脏中SOD、GSH-Px活力、T-AOC及MDA含量的影响(n=6)
Table 3 SOD, GSH-Px activity and T-AOC and MDA contents in heart tissues of mice treated with REP, Se-REP1 and Se-REP2 (n= 6)

2.2.4 REP、Se-REP1、Se-REP2对小鼠肝脏中SOD、GSH-Px活力、T-AOC及MDA含量的影响
表 4 REP、Se-REP1、Se-REP2对小鼠肝脏中SOD、GSH-Px活力、T-AOC及MDA含量的影响(n=6)
Table 4 SOD, GSH-Px activity and T-AOC and MDA contents in liver of mice treated with REP, Se-REP1 and Se-REP2 (n= 6)

由表4可知,不同的组别对于小鼠肝脏中的MDA含量没有显著的降低作用。VC、REPH、SeREP1L、SeREP1H、SeREP2L、SeREP2H组小鼠肝脏中SOD活力均极显著高于空白对照组(P<0.01),表现出较好的抗氧化活性。对于小鼠肝脏中GSH-Px活力而言,REP、SeREP1、SeREP2的提高效果均极显著强于空白对照组(P<0.01)。对于T-AOC的影响,REPH、SeREP1H、SeREP2H表现出极显著升高(P<0.01),效果优于空白对照组,且SeREP1、SeREP2在小鼠肝脏中的抗氧化性比REP高。在小鼠肝脏中SeREP1、SeREP2的抗氧化能力强于REP,SeREP2比SeREP1的抗氧化能力强。
2.2.5 REP、Se-REP1、Se-REP2对小鼠肾脏中SOD、GSH-Px活力、T-AOC及MDA含量的变化影响
表 5 REP、Se-REP1、Se-REP2对小鼠肾脏中SOD、GSH-Px活力、T-AOC及MDA含量的影响(n=6)
Table 5 SOD, GSH-Px activity and T-AOC and MDA contents in kidney of mice treated with REP, Se-REP1 and Se-REP2 (n= 6)

由表5可知,不同的组别对于小鼠肾脏中的MDA含量没有显著降低作用。SeREP2H对小鼠肾脏中SOD活力的提高作用极显著强于其余各组(P<0.01),其抗氧化性强于VC、SeREP1和REP。REPH、SeREP1L、SeREP1H、SeREP2L、SeREP2H组小鼠肾脏中GSH-Px活力均极显著强于空白对照组(P<0.01),VC与REPL效果相当。对于T-AOC的影响,SeREP1H、SeREP2H与其余组别相比表现出极显著的提高作用(P<0.01)。在小鼠肾脏中SeREP1、SeREP2的抗氧化能力强于REP,SeREP2比SeREP1的抗氧化能力强。
对两种方法制备硒化的米胚多糖进行了体外抗氧化活性的研究,结果表明在设置的质量浓度范围内,硒化后的多糖对·OH、DPPH自由基、O2-·都具有良好的清除效果,且随着质量浓度的增加,清除率不断升高,且清除能力均优于多糖,其还原力也逐渐增强并优于多糖。此外两种制备方法中硝酸法制备的硒化米胚多糖的抗氧化能力比醋酸法制备的硒化米胚多糖更强。
体内抗氧化实验结果表明SeREP1、SeREP2与REP在一定程度上都可提高小鼠血清及组织中的SOD、GSH-Px活力及T-AOC,且作用效果均强于REP,但在心脏中T-AOC不显著,其中GSH-Px活力最显著,这与姚昭等[32]实验结果相似。Se-REP灌胃组的MDA含量在肝脏及肾脏中极虽低于空白对照组,但差异不显著,只在血清和心脏中极显著低于空白对照组(P<0.01)。SeREP2和SeREP1均比REP的抗氧化性强,且硝酸法制备的SeREP2活性较强于醋酸法制备的SeREP1,综合表明,硒化米胚多糖比米胚多糖的抗氧化活性强,可能是因为有机硒元素是许多酶的活性中心,其次SeREP2比SeREP1的抗氧化活性强,这可能是SeREP2中硒含量高于SeREP1而显示出的差异。可见,不同的方法制备的大米胚芽硒多糖的抗氧化能力也不同,研究结果可为开发出具有更高抗氧化活性的米胚硒化多糖提供理论依据。
参考文献:
[1] 李爱华. 试述大米胚芽的开发利用[J]. 粮食与油脂, 1997(1): 21-26.
[2] 李爱华. 米胚的营养价值和胚芽米的加工技术[J]. 粮食与饲料工业,1997(5): 9-12.
[3] 姚惠源. 吴嘉根. 谷物胚芽开发利用与研究途径的探讨[J]. 粮食与饲料工业, 1989(5): 17-22.
[4] 舒春林. 米糠多糖的提取、纯化及功能性研究进展[J]. 农业机械,2012, 33(13): 53-56. DOI:10.16167/j.cnki.1000-9868.2012.33.013.
[5] 谢黎虹, 廖西元, 朱智伟. 稻米中的功能因子及其生理作用[J].广州食品工业科技, 2003, 19(4): 108-110. DOI:10.13982/j.mfst.1673-9078.2003.04.040.
[6] 陈绍萱, 滕忠爱, 张勇胜, 等. 膳食纤维对Ⅱ型糖尿病患者血糖影响的临床观察[J]. 广西医科大学学报, 2009(3): 79-84. DOI:10.16190/j.cnki.45-1211/r.1999.03.022.
[7] HU G, YU W. Binding of cholesterol and bile acid to hemicelluloses from rice bran[J]. International Journal of Food Sciences and Nutrition,2013, 64(4): 461-466. DOI:10.3109/09637486.2012.749838.
[8] 聂莹, 罗非君, 曾晓楠. 米糠多糖生理功能研究及应用新进展[J]. 粮食与油脂, 2015, 28(11): 10-13.
[9] 徐春兰, 钦传光, 牛卫宁, 等. 硒化壳聚糖的制备及其体外抗氧化活性研究[J]. 化学与生物工程, 2009, 26(9): 45-48.
[10] IP C, DONG Y, GANTHER H E. New concepts in selenium chemoprevention[J]. Cancer and Metastasis Reviews, 2002, 21: 281-289.
[11] 张倩, 傅青峰, 夏弈明, 等. 硒与人体健康[J]. 中老年保健, 2016(1): 20-25.
[12] 刘占峰, 孙汉文. 多糖的化学修饰研究进展[J]. 河北大学学报(自然科学版), 2005, 25(1): 104-108.
[13] 王瑞红. 硒化多糖的制备及其表征[D]. 武汉: 华中师范大学, 2012: 1-50.
[14] XU J, ZHU S, YANG F, et al. The influence of selenium on the antioxidant activity of green tea[J]. Journal of the Science of Food and Agriculture, 2003, 83: 451-455.
[15] 陈亮. 天然富硒和人工富硒绿茶中硒多糖活性和结构的研究[D].上海: 上海师范大学, 2016: 1-97.
[16] LIU Y, SUN J, RAO S, et al. Antidiabetic activity of mycelia seleniumpolysaccharide from Catathelasma ventricosum in STZ-induced diabetic mice[J]. Food and Chemical Toxicology, 2013, 62: 285-291.
[17] 刘韫滔, 曾思琪, 唐倩倩, 等. 两种梭柄松苞菇富硒多糖的制备及其降血糖和抗氧化活性研究[J]. 现代食品科技, 2016, 32(10): 60-65.DOI:10.13982/j.mfst.1673-9078.2016.10.010.
[18] GUO Y, PAN D, LI H, et al. Antioxidant and immunomodulatory activity of selenium exopolysaccharide produced by Lactococcus lactis subsp. lactis[J]. Food Chemistry, 2013, 138(1): 84-89.
[19] 王红连, 张东升, 张凌裳, 等. 硒化灵芝多糖制备及免疫学相关研究[J]. 食品科学, 2009, 30(17): 316-318. DOI:10.3321/j.issn:1002-6630.2009.17.074.
[20] 梁淑轩, 马二红, 赵燕燕, 等. 醋酸催化下枸杞多糖的硒化修饰及抗肿瘤活性[J]. 食品研究与开发, 2011, 32(3): 160-164. DOI:10.3969/j.issn.1005-6521.2011.03.046.
[21] 沈伟哉, 温晓晓, 郑颖, 等. 大蒜多糖及其硒化产物抗氧化活性的比较研究[J]. 营养学报, 2011, 33(4): 380-384. DOI:10.13325/j.cnki.acta.nutr.sin.2011.04.018.
[22] 庞秀芬, 杨国农, 赵青. 甘草硒多糖的制备研究[J]. 化学工程, 2009,37(9): 63-66. DOI:10.3969/j.issn.1005-9954.2009.09.017.
[23] 陈国静, 焦志勤, 姚月梅. 香菇硒多糖抗氧化作用的研究[J]. 医药产业资讯, 2006, 3(17): 9-10.
[24] 张越锋, 李福燕, 吴瑛. 红枣多糖及红枣硒多糖抗氧化活性的比较研究[J]. 食品研究与开发, 2015, 36(3): 4-9. DOI:10.3969/j.issn.1005-6521.2015.03.002.
[25] 罗敏, 陈德经, 苏文. 大米胚芽锌多糖制备及其抗氧化活性[J]. 食品工业科技, 2017, 38(14): 238-243. DOI:10.13386/j.issn1002-0306.2017.14.046.
[26] 郝苗, 金黎明, 刘李娜, 等. 硒化枸杞多糖的制备及其抗氧化性研究[J]. 食品研究与开发, 2014, 35(6): 11-13; 40. DOI:10.3969/j.issn.1005-6521.2014.06.004.
[27] 宋逍, 赵鹏, 申婉容, 等. 款冬花硒多糖的制备及抗氧化性研究[J]. 食品工业科技, 2013, 34(13): 227-231. DOI:10.13386/j.issn1002-0306.2013.13.023.
[28] 张媛媛, 张彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学, 2016, 37(4): 158-163. DOI:10.7506/spkx1002-6630-201604028.
[29] 吴鑫, 王栋. 氢化物发生-原子荧光光度法测定甘薯粉中微量硒[J].现代预防医学, 2016, 43(6): 1014-1016.
[30] 黄玲玲, 苏彩霞, 张宗申, 等. 硒、锌元素对羊肚菌多糖抗氧化性的影响[J]. 食品与发酵工业, 2015, 41(7): 122-125. DOI:10.13995/j.cnki.11-1802/ts.201507022.
[31] 魏明, 王晨, 杨超英. 酶法协同超声波提取米糠多糖及其抗氧化活性研究[J]. 中国油脂, 2015, 40(1): 78-82.
[32] 姚昭, 李红艳, 张云龙, 等. 有机硒、无机硒、VE单独使用及有机硒与VE联用对大鼠体内抗氧化能力的影响[J]. 食品科学, 2013,34(15): 272-276. DOI:10.7506/spkx1002-6630-201315056.
[33] 田敏. 珊瑚状猴头菌成分分析及其多糖对小鼠抗氧化及免疫功能的影响[D]. 太原: 山西农业大学, 2013: 1-43.
[34] 赵璐, 何婷, 丁文欢, 等. 考马斯亮兰法(Bradford法)测定驼乳中蛋白质的含量[J]. 应用化工, 2016, 45(12): 2366-2368; 2372.DOI:10.16581/j.cnki.issn1671-3206.2016.12.042.
Antioxidant Activity of Selenium-Bound Rice Germ Polysaccharides
LUO Min1, CHEN Dejing1,2,*, HAN Hao1,2, XIN Xi1
(1. College of Biological Science and Engineering, Shaanxi University of Technology, Hanzhong 723001, China;2. Shaanxi Provincial Bio-resource Key Laboratory, Shaanxi University of Technology, Hanzhong 723001, China)
Abstract:In this paper, acetic acid and nitric acid were used as the catalysts for selenium modification of rice embryo polysaccharides (REP), and the antioxidant properties of the native and modi fied polysaccharides (Se-REP1 and Se-REP2)were studied. The in vitro antioxidant activity was evaluated by using O-2·, ·OH and 1,1-diphenyl-2-picrylhydrazyl (DPPH)free radical scavenging capacity and reducing power assays. The antioxidant activity in vivo was evaluated by determining the activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px), malondialdehyde (MDA) and total antioxidant capacity (T-AOC) in mouse serum, liver, kidney and heart tissues. The results showed that all the native and modi fied polysaccharides at five concentrations had different O-2·, ·OH and DPPH radical scavenging capacity, and their reducing power was increased with the increase of their concentration. Both Se-bound polysaccharides could improve the activity of SOD, GSH-Px and T-AOC in mice tissues and serum, and the effect was stronger than that of REP, but the activity of T-AOC in heart tissue was not signi ficantly different between the modi fied and native polysaccharides. The contents of MDA in liver and kidney were much lower than that in the control group although the effect was not signi ficant. On the other hand, the contents of MDA in serum and heart tissue showed an obvious signi ficance, and administration of Se-bound REP prepared with acetic acid showed the highest antioxidant enzyme activity in mice.
Keywords:rice embryo polysaccharide; selenium-bound polysaccharide; mice; antioxidant properties
LUO Min, CHEN Dejing, HAN Hao, et al. Antioxidant activity of selenium-bound rice germ polysaccharides[J]. Food Science,2018, 39(19): 58-63. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-2018190010. http://www.spkx.net.cn
罗敏, 陈德经, 韩豪, 等. 硒化米胚多糖的抗氧化性[J]. 食品科学, 2018, 39(19): 58-63. DOI:10.7506/spkx1002-6630-2018190010. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0058-06
文献标志码:A
中图分类号:TS210.1
DOI:10.7506/spkx1002-6630-2018190010
*通信作者简介:陈德经(1961—),男,教授,硕士,研究方向为食品生物技术。E-mail:cdjslg@126.com
第一作者简介:罗敏(1990—),女,硕士研究生,研究方向为食品生物化学。E-mail:1053378593@qq.com
基金项目:陕西省农业科技创新与攻关项目(2015NY012)
收稿日期:2017-05-11