罗敬文1,司风玲1,*,顾子玄2,王林玲1,孟秀秀3
(1.重庆师范大学生命科学学院,重庆 401331;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;3.食药用菌教育部工程研究中心,吉林 长春 130118)
摘 要:目的:研究玉木耳、黑木耳与毛木耳3 种木耳多糖的抗氧化活性与抑菌能力。方法:利用水提醇沉法获得了3 种木耳的多糖,并测定了其多糖含量;采用分光光度法分别测定了3 种木耳多糖的总抗氧化能力,羟自由基、超氧阴离子自由基、1,1-二苯基-2-三硝基苯肼自由基和亚硝酸根离子清除能力;同时进行了大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌实验。结果:相同提取条件下,玉木耳、黑木耳与毛木耳的粗多糖提取率分别为13.87%、11.26%、7.91%,其中3 种木耳多糖质量分数分别为49.22%、41.50%和37.97%;总抗氧化活性检测结果显示毛木耳多糖的总抗氧化能力最高,黑木耳多糖与玉木耳多糖抗氧化能力相当;其中玉木耳多糖对羟自由基清除能力略强于黑木耳多糖,且二者的超氧阴离子自由基清除能力相当,均强于毛木耳多糖;3 种木耳多糖对DPPH自由基的清除作用较明显,其中玉木耳多糖相对较优,可达80%;此外,黑木耳多糖对亚硝酸根离子的清除能力最好,略优于其他两种木耳多糖。对常见细菌的抑制作用而言,3 种木耳多糖均对大肠杆菌有一定的抑制作用,但黑木耳多糖和毛木耳多糖对金黄色葡萄球菌和枯草芽孢杆菌抑制作用较弱;仅玉木耳多糖对金黄色葡萄球菌和枯草芽孢杆菌有较好的抑制作用。结论:3 种木耳多糖具备各自不同的抗氧化活性与抑菌能力,且差异较为明显。
关键词:玉木耳多糖;黑木耳多糖;毛木耳多糖;抗氧化活性;抑菌能力
木耳属(Auricularia)真菌是世界第三大栽培食用菌,目前该属中共计木耳种类15 种[1-3]。我国是对其进行开发利用最早的国家,早在唐代即有“蕈尔”之说[4]。时至今日,我国的木耳产量占世界总产量的96%[5],且因木耳口感爽脆、营养丰富[6],成为我国传统的出口产品。我国栽培与食用的绝大多数为黑木耳(Auricularia auricula)与毛木耳(Auricularia polytricha)[7]。由此可见木耳这一食用菌的遗传背景单一,长此以往会导致其产量与品质的下降[8]。因此,我国的专家学者仍在进行着木耳变异菌株的栽培驯化、开发利用。吉林农业大学李玉院士团队研究获得的珍稀食用菌——玉木耳(Auricularia cornea var. Li),其正是从毛木耳菌株中分离纯化、驯化栽培而形成的遗传结构稳定、天然纯白色变异菌株[9]。
据报道,木耳之所有具有良好的药用价值,与其富含的多糖类物质密切相关[10-11]。木耳多糖具备降血糖、降血脂、抗炎症、抗肿瘤以及保护机体细胞等方面的作用[12-16],已经成为食品、医药与保健等领域的研究热点。但是现阶段的研究中,木耳多糖的提取与抗氧化性研究报道仍集中于黑木耳和毛木耳[17-20],对于玉木耳多糖的开发利用几近空白。此外,对于木耳多糖的抑菌效果研究也鲜见报道。因此,充分利用现有木耳种类对其多糖提取应用,将对提高玉木耳这一种质资源的开发,深化我国木耳的产业结构具有重要意义。本实验参照前人对天然产物中多糖的提取工艺、抗氧化活性、抑菌作用等[21-26]研究方法,探究了玉木耳、黑木耳与毛木耳三者在相同的多糖提取条件下其提取率、含量、抗氧化活性与抑菌能力的差异,以期为木耳属食用菌多糖的开发利用与比较研究提供基础数据与实验依据。
玉木耳来自吉林农业大学李玉院士团队,毛木耳和黑木耳干品均来自于吉林农业大学食药用菌教育部工程研究中心。枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)由重庆师范大学应用微生物研究所提供。
2,2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)总抗氧化能力测定试剂盒 碧云天生物技术有限公司;1,1-二苯基-2-三硝基苯肼(1,1-d i p h e n y l-2-picrylhydrazyl,DPPH)、邻苯三酚 美国Sigma公司;浓硫酸、苯酚、无水乙醇、氯仿、正丁醇、N-1-萘基乙二胺盐酸盐(均为分析纯) 重庆川东化工(集团)有限公司。所用水均为蒸馏水。
LB培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、水1 000 mL,pH 7.0~7.2;固体培养基为LB培养基加入琼脂15~20 g。
3K15高速冷冻离心机 美国Sigma公司;TP-602精密电子天平 北京赛多利斯公司;SW11-KP2水浴锅北京长风仪器仪表有限公司;JY88-II超声波细胞破碎仪宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发器上海亚荣实验设备有限公司产品;ReadMax-1900型光吸收全波长酶标仪 上海闪谱生物科技有限公司。
1.3.1 3 种木耳多糖的制备与含量测定
分别将玉木耳、毛木耳和黑木耳烘干,粉碎,过100 目筛,按料液比1∶130(m/V)加水浸泡2 h,超声波450 W破碎30 min[27],沸水浴中热浸提6 h;4 ℃、6 000 r/min离心10 min得上清液,滤渣用同法水提3 次,合并上清液;加入滤渣4 倍体积的体积分数95%乙醇溶液醇沉,静置10 h;反复醇沉3~5 次,减压浓缩,用无水乙醇洗涤;采用Sevag法[28-29]除蛋白,氯仿、正丁醇体积比4∶1,利用分液漏斗萃取,剧烈振荡,弃下层得上层液;6 000 r/min离心10 min取沉淀,重复操作直至沉淀物中间层无变性蛋白。再于流动的蒸馏水中透析4 d;反复冷冻干燥得到粗多糖,多糖质量分数采用硫酸-苯酚法测定[30-31],提取率按式(1)计算。
1.3.2 3 种木耳多糖的抗氧化活性测定
1.3.2.1 总抗氧化能力的测定
采用ABTS法测定总抗氧化能力。Trolox是一种VE的类似物,具有和VE相近的抗氧化能力,在本实验中用测定总抗氧化能力的参照[32]。将10 mmol/L Trolox标准溶液配制成0.15、0.30、0.60、0.90、1.20、1.50 mmol/L的标准品,各取10 μL于96 孔板中,各加入等量ABTS工作液,在734 nm波长处测定吸光度。将木耳粗多糖配制成质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的样品液,同法测定其吸光度,计算得出3 种木耳粗多糖溶液的总抗氧化能力。相同浓度情况下,以Trolox的总抗氧化能力为1,木耳多糖的抗氧化能力用其抗氧化能力和Trolox总抗氧化能力的比值表示。
1.3.2.2 羟自由基清除能力测定
羟自由基清除能力测定采用Fenton反应体系[33]。在10 mL试管中加入2 mL 6 mmol/L FeSO4溶液、2 mL 6 mmol/L H2O2溶液、2 mL 6 mmol/L水杨酸和2 mL不同质量浓度(0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/mL)的多糖样品,在37 ℃下反应1 h,在517 nm波长处测定其吸光度,以VC作对照。样品对羟自由基清除率计算如式(2)所示。
式中:A0为蒸馏水代替样品的吸光度;A1为样品吸光度;A2为蒸馏水替代H2O2时的吸光度。
1.3.2.3 超氧阴离子自由基清除能力测定
超氧阴离子自由基清除能力测定采用邻苯三酚自氧化法[34]。4.5 mL pH 8.2 Tris-HCl缓冲液(0.05 mol/L)分别与0.5 mL不同质量浓度(0.5~4.0 mg/mL)样品混合,置于25 ℃水浴中预热20 min,0.5 mL 25 mmol/L邻苯三酚溶液。混匀后于25 ℃水浴中反应5 min后,加1 mL 8 mol/L HCl溶液终止反应10 min,之后于420 nm波长处测定吸光度,以VC作对照。样品对超氧阴离子自由基清除率计算如式(3)所示。
式中:A1为样品的吸光度;A0为蒸馏水代替样品的吸光度。
1.3.2.4 DPPH自由基清除能力测定
DPPH自由基清除能力测定参照文献[35]。精确配制浓度为5 mmol/L的DPPH-乙醇溶液,分别精确吸取3 mL不同质量浓度(0.5~4.0 mg/mL)的3 种木耳多糖样品溶液,加入5 mL(5 mmol/L)DPPH-乙醇溶液,混匀后在室温下静置30 min,以5 mL无水乙醇和3 mL蒸馏水的混合液为参比,测定517 nm波长处的吸光度,以VC作对照。样品对DPPH自由基清除率计算如式(4)所示。
式中:A0为只加DPPH-乙醇溶液的吸光度;A1为样品和DPPH-乙醇溶液的吸光度;A2为样品溶液的吸光度。
1.3.2.5 NO2-清除活性测定
参照陈蕉等[36]的方法测定亚硝酸根离子(NO2-)清除能力。吸取不同质量浓度(0.5~4.0 mg/mL)的多糖溶液和VC水溶液,加入5 μg/mL的亚硝酸钠溶液2 mL,然后置于37 ℃水浴锅中反应30 min,各加入0.4 g/100 mL对氨基苯磺酸2 mL,摇匀静置5min;再加入0.2 g/100 mL盐酸萘乙二胺显色剂1 mL,摇匀加水定容,静置15 min后,在最大吸收波长540 nm处测吸光度,以VC作对照。样品对NO2-的清除率计算如式(5)所示。

式中:A0为水代替样品的吸光度;A1为不同质量浓度样品的吸光度。
1.3.3 玉木耳、黑木耳和毛木耳多糖抑菌实验
供试菌种的活化及菌悬液的制备:预先将3 种供试菌种接入相应的斜面培养基上进行活化,大肠杆菌与枯草芽孢杆菌置于37 ℃恒温培养箱中培养12~16 h,金黄色葡萄球菌于培养箱中培养24 h,然后分别挑取已活化的菌种接入液体培养基中,于37 ℃恒温振荡培养箱中培养12~16 h,在600 nm波长处测定细菌菌液OD值,各种细菌培养至相应OD值:大肠杆菌1.802、枯草芽孢杆菌2.06、金黄色葡萄球菌1.912。菌液于4 ℃下保存。无菌水稀释各菌液至适应该实验的浓度。
最低抑菌浓度(minimum inhibitory concentration,MIC)的测定:向平皿中分别移取不同质量浓度的稀释液各1 mL,再倒入各种菌种相应的培养基(温度在45 ℃左右)约14 mL,混匀,完全冷却凝固后,分别移取各菌悬液30 μL至相应培养基,涂布均匀,同时采用氨苄青霉素(50 mg/mL)做对照。在适宜温度下培养,每个质量浓度做3 个重复。
相同提取条件下,玉木耳、黑木耳与毛木耳的粗多糖提取率分别为13.87%、11.26%、7.91%。根据葡萄糖标准曲线得到线性回归方程为y=0.007 6x+0.011 6(R2=0.990 6),说明此线性拟合较好。用此回归方程,根据多糖置换因子ƒ玉木耳:1.816、ƒ黑木耳:1.724、ƒ毛木耳:1.619,得出粗多糖中玉木耳、黑木耳和毛木耳的多糖质量分数分别为:49.22%、41.50%和37.97%。结果表明,在3 种木耳在相同提取多糖工艺下玉木耳的多糖含量最高,黑木耳多糖次之,毛木耳多糖含量较少。王辰龙等[17]采用超声波协同复合酶法提取黑木耳粗多糖,提取率为19.14%;许晓燕等[11]通过正交试验优化提取工艺最终得到毛木耳粗多糖提取率为5.9%。
根据ABTS法的总抗氧化能力检测标准曲线,得出线性回归方程为y=-0.034 5x+0.431 8(R2=0.992 7),样品的总抗氧化能力在414 nm波长处吸光度呈现一次线性关系。根据标准曲线计算得出玉木耳、黑木耳和毛木耳多糖的总抗氧化能力。玉木耳多糖总抗氧化能力为2.206 mmol/g,黑木耳多糖总抗氧化能力为2.023 mmol/g,毛木耳多糖总抗氧化能力为2.762 mmol/g,玉木耳多糖和黑木耳多糖的总抗氧化能力几乎相当,毛木耳多糖中的总抗氧化能力较高,约为玉木耳和黑木耳多糖的1.3 倍。
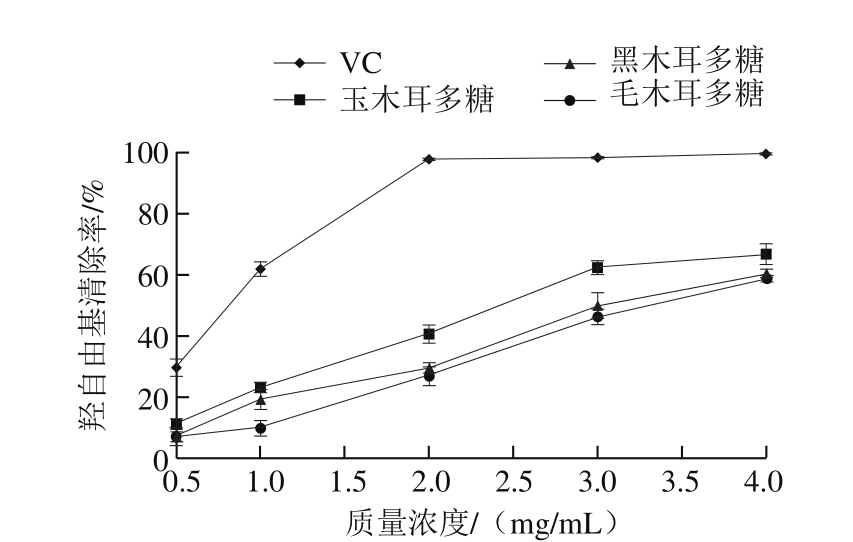
图 1 3 种木耳多糖羟自由基清除率
Fig. 1 Hydroxyl free radical scavenging activity of the polysaccharides from three Auricularia species
由图1可知,随着玉木耳、黑木耳和毛木耳3 种木耳多糖提取液质量浓度增加,相应的羟自由基清除率增加,3 种多糖对羟自由基清除能力由高到低依次为玉木耳多糖>黑木耳多糖>毛木耳多糖。由多糖溶液对羟自由基的清除曲线经回归处理可求出羟自由基的半清除率(half maximal inhibitory concentration,IC50),分别为玉木耳多糖2.36 mg/mL、黑木耳多糖3.14 mg/mL、毛木耳多糖3.33 mg/mL。玉木耳多糖的羟自由基清除效果最好,当质量浓度达到2.5 mg/mL时,清除率超过50%。玉木耳多糖羟自由基最高可达到66.61%;黑木耳多糖次之,当质量浓度达到4.0 mg/mL时,清除率可达到60.02%;毛木耳多糖质量浓度达到4.0 mg/mL时,对羟自由基清除率达到58.50%。

图 2 3 种木耳多糖对超氧阴离子自由基的清除作用
Fig. 2 Supe
roxide anion radical scavenging capacity of the polysaccharides from three Auricularia species
由图2可知,玉木耳、黑木耳、毛木耳多糖对超氧阴离子自由基具有较好的清除效果,随着多糖的质量浓度的增加,各多糖清除率也显著提高。3 种木耳多糖的超氧阴离子自由基清除活性由高到低依次为玉木耳多糖>黑木耳多糖>毛木耳多糖,由多糖溶液对超氧阴离子自由基的清除曲线经回归处理可求出超氧阴离子自由基的IC50,分别为玉木耳多糖1.117 mg/mL、黑木耳多糖2.286 mg/mL、毛木耳多糖3.201 mg/mL。玉木耳多糖的超氧阴离子自由基清除效果最好,当质量浓度2 mg/mL时,清除率超过50%,最高可达到74.66%;黑木耳多糖次之,当质量浓度3 mg/mL时,清除率达到50%,最高可达到68.69%;毛木耳多糖的质量浓度4 mg/mL时,清除率达到55.92%。

图 3 3 种木耳多糖对DPPH自由基的清除作用
Fig. 3 DPPH radical scavenging activity of the polysaccharides from three Auricularia species
由图3可知,随着玉木耳、黑木耳和毛木耳3 种木耳多糖提取液质量浓度增加,相应的DPPH自由基清除率增加,3 种多糖对DPPH自由基清除能力由高到低依次为玉木耳多糖>毛木耳多糖>黑木耳多糖。多糖溶液对DPPH自由基清除率的IC50分别为:玉木耳多糖1.317 mg/mL、毛木耳1.715 mg/mL、黑木耳10.340 mg/mL。玉木耳多糖的DPPH自由基清除效果最好,当质量浓度2 mg/mL时,清除率超过50%,最高可达到89.25%;黑木耳多糖效果较差,当质量浓度4 mg/mL时,清除率未达到50%。
 的清除作用
的清除作用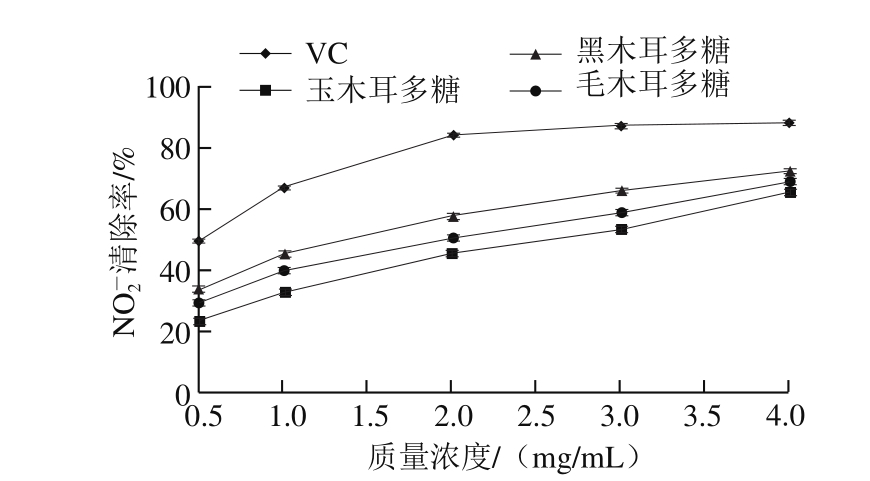
图 4 3 种木耳多糖对 的清除作用
的清除作用
Fig. 4 scavenging activity of the Auricularia polysaccharides
scavenging activity of the Auricularia polysaccharides
由图4可知,随着3 种木耳多糖提取液质量浓度增加, 清除率升高,3 种多糖对
清除率升高,3 种多糖对 清除能力由高到低依次为黑木耳多糖>毛木耳多糖>玉木耳多糖。多糖溶液对
清除能力由高到低依次为黑木耳多糖>毛木耳多糖>玉木耳多糖。多糖溶液对 清除率的IC50分别为:黑木耳多糖1.253 mg/mL、毛木耳多糖1.723 mg/mL、玉木耳多糖2.284 mg/mL。黑木耳多糖的NO2-清除效果最好,当质量浓度2 mg/mL时,清除率超过50%,最高可达到72.74%;玉木耳多糖效果较差,当质量浓度4 mg/mL时,清除率才能达到50%。
清除率的IC50分别为:黑木耳多糖1.253 mg/mL、毛木耳多糖1.723 mg/mL、玉木耳多糖2.284 mg/mL。黑木耳多糖的NO2-清除效果最好,当质量浓度2 mg/mL时,清除率超过50%,最高可达到72.74%;玉木耳多糖效果较差,当质量浓度4 mg/mL时,清除率才能达到50%。
表 1 不同供试菌在3 种木耳多糖存在时的生长情况
Table 1 Growth inhibitory effect of the Auricularia polysaccharides on different microorganisms

注:—.无菌生长;+.少量菌落生长;++.大量菌落生长。
玉木耳、黑木耳、毛木耳多糖对大肠杆菌、枯草芽孢杆菌、金黄色葡萄杆菌均有一定的抑制效果,但与阳性对照氨苄青霉素相比,抑菌效果均较弱。其中黑木耳与毛木耳多糖的抑菌效果相当,3 种木耳多糖抑菌效果均随着多糖质量浓度的增加而逐渐增强,MIC在0.500~2.000 mg/mL之间(表1)。黑木耳与毛木耳多糖对金黄色葡萄球菌和芽孢杆菌的抑制效果不明显,仅玉木耳多糖对其具备较好的抑菌作用。由此可见,3 种木耳多糖对实验中的微生物抑制具有一定的选择性。
本研究通过水提醇沉法从玉木耳、黑木耳和毛木耳中提取粗多糖,并测定了其中的多糖含量。此外,采用不同方法测定玉木耳、黑木耳和毛木耳多糖的总抗氧化能力,羟自由基、超氧阴离子自由基、DPPH自由基、 清除能力,以及其针对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌能力。得出结论如下:1)玉木耳的多糖含量最高,黑木耳其次,毛木耳的多糖含量最低;2)3 种木耳多糖的总抗氧化能力及对自由基的清除率随多糖溶液质量浓度的增加而升高,具有质量浓度依赖性;3)毛木耳多糖总抗氧化能力最高,黑木耳多糖和玉木耳多糖次之,但玉木耳多糖对羟自由基、超氧阴离子自由基和DPPH自由基的清除率均高于黑木耳和毛木耳多糖;4)玉木耳多糖对供试菌的抑菌活性较强(MIC≤1 mg/mL),可作为潜在的食品防腐剂。
清除能力,以及其针对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌能力。得出结论如下:1)玉木耳的多糖含量最高,黑木耳其次,毛木耳的多糖含量最低;2)3 种木耳多糖的总抗氧化能力及对自由基的清除率随多糖溶液质量浓度的增加而升高,具有质量浓度依赖性;3)毛木耳多糖总抗氧化能力最高,黑木耳多糖和玉木耳多糖次之,但玉木耳多糖对羟自由基、超氧阴离子自由基和DPPH自由基的清除率均高于黑木耳和毛木耳多糖;4)玉木耳多糖对供试菌的抑菌活性较强(MIC≤1 mg/mL),可作为潜在的食品防腐剂。
参考文献:
[1] MALYSHEVA V F, BULAKH E M. Contribution to the study of the genus Auricularia (Auriculariales, Basidiomycota) in Russia[J].Novosti Sistematiki Nizshikh Rastenii, 2014, 48: 164-180.
[2] KOBAYASI Y. The genus Auricularia[J]. Bulletin of the National Science Museum, 1981, 7(5): 656-692.
[3] WU F, YUAN Y, HE S H, et al. Global diversity and taxonomy of the Auricularia auricula-judae, complex (Auriculariales, Basidiomycota)[J].Mycological Progress, 2015, 14(10): 1-16. DOI:10.1007/s11557-015-1113-4.
[4] 刘波. 我国古籍中关于菌类的记述[J]. 生物学通报, 1958(6): 19-22.
[5] 马民. 黑龙江省东宁县黑木耳产业发展现状及对策研究[D]. 长春:吉林大学, 2014: 2-16.
[6] 刘振东, 刘江, 李梁, 等. 西藏林芝野生黑木耳与人工栽培黑木耳品质比较分析[J]. 食品与发酵工业, 2016, 42(2): 157-163.
[7] 吴芳. 木耳属的分类与系统发育研究[D]. 北京: 北京林业大学,2016: 1-6.
[8] 李黎. 中国木耳栽培种质资源的遗传多样性研究[D]. 武汉: 华中农业大学, 2011: 2-8.
[9] 李晓, 张阔谭. 木耳属白色变异菌株的研究进展[J]. 食药用菌, 2016,24(4): 230-233.
[10] ZHANG H, WANG Z Y, YANG L, et al. In vitro antioxidant activities of sulfated derivatives of polysaccharides extracted from Auricularia auricular[J]. International Journal of Molecular Sciences, 2011, 12(5):3288-3302. DOI:10.3390/ijms12053288.
[11] 许晓燕, 余梦瑶, 江南, 等. 用正交试验法优化毛木耳多糖提取工艺[J].中国食用菌, 2013, 32(1): 41-44.
[12] HU X Y, LIU C G, XUE W, et al. Hpyerglycemic and anti-diabetic nephritis activities of polysaccharides separated from Auricularia auricular in diet-streptozotocin-induced diabetic rats[J]. Experimental &Therapeutic Medicine, 2017, 13(1): 352-358. DOI:10.3892/etm.2016.3943.
[13] 李雪华, 龙盛京. 木耳多糖的提取与抗活性氧的研究[J]. 食品科学,2001, 22(3): 26-29. DOI:10.3321/j.issn:1002-6630.2001.03.005.
[14] KADNIKOVA I A, RUI C, KALENIK T K, et al. Chemical composition and nutritional value of the mushroom Auricularia auricula-judae[J]. Journal of Food and Nutrition Research, 2015,3(38): 478-482. DOI:10.14480/jm.2014.12.2.88.
[15] ZHAO S, RONG C B, LIU Y, et al. Extraction of a soluble polysaccharide from Auricularia polytricha and evaluation of its antihypercholesterolemic effect in rats[J]. Carbohydrate Polymers, 2015,122: 39-45. DOI:10.1016/j.carbpol.2014.12.041.
[16] 卞春, 王振宇, SHI J. 黑木耳多糖生物功能的研究进展[J]. 食品工业科技, 2015, 36(16): 390-394; 400.
[17] 王辰龙, 张子奇, 王曼, 等. 黑木耳多糖的提取分离及体外抗凝血作用研究[J]. 食品工业科技, 2013, 34(9): 238-241.
[18] 韩春然, 徐丽萍. 黑木耳多糖的提取、纯化及降血脂作用的研究[J]. 中国食品学报, 2007, 7(1): 54-58. DOI:10.3969/j.issn.1009-7848.2007.01.010.
[19] 李德海, 徐颖, 顾嘉琳, 等. 黑木耳多糖对猪肉糜质构及氧化特性的影响[J]. 食品科学, 2016, 37(15): 88-93. DOI:10.7506/spkx1002-6630-201615015.
[20] 许海林, 吴小勇, 聂少平, 等. 黑木耳多糖提取工艺优化及其对小鼠巨噬细胞功能的影响[J]. 食品科学, 2016, 37(10): 100-104.DOI:10.7506/spkx1002-6630-201610017.
[21] 张唐伟, 杨乐, 柳青海, 等. 地木耳多糖的抗氧化性与抑菌作用[J].食品与生物技术学报, 2011, 30(6): 868-873.
[22] FERREIRA I C F R, HELENO S A, REIS F S, et al. Chemical features of Ganoderma polysaccharides with antioxidant, antitumor and antimicrobial activities[J]. Phytochemistry, 2015, 114: 38-55.DOI:10.1016/j.phytochem.2014.10.011.
[23] SHARMA S K, GAUTAM N, ATRI N S. Optimized extraction,composition, antioxidant and antimicrobial activities of exo and intracellular polysaccharides from submerged culture of Cordyceps cicadae[J]. BMC Complementary and Alternative Medicine, 2015,15(1): 1-10. DOI:10.1186/s12906-015-0967-y.
[24] 王婷婷, 王少康, 黄桂玲, 等. 菊花主要活性成分含量及其抗氧化活性测定[J]. 食品科学, 2013, 34(15): 95-99. DOI:10.7506/spkx1002-6630-201315020.
[25] GAAFAR A A, IBRAHIM E A, ASKER M S, et al. Characterization of polyphenols, polysaccharides by HPLC and their antioxidant,antimicrobial and antiinflammatory activities of defatted moringa(Moringa oleifera L.) meal extract[J]. International Journal of Pharmaceutical & Clinical Research, 2016, 8(6): 565-573.DOI:10.1002/0471701343.sdp43765.
[26] 葛霞, 陈婷婷, 蔡教英, 等. 青钱柳多糖抗氧化活性的研究[J]. 中国食品学报, 2011, 11(5): 59-64. DOI:10.3969/j.issn.1009-7848.2011.05.010.
[27] 陈诚, 黄文丽, 李小林, 等. 毛木耳多糖提取研究进展[J]. 食品与发酵科技, 2014, 50(4): 89-92.
[28] 刘立梅. 黑木耳多糖的分别酶解法提取及脱蛋白工艺研究[J]. 中国酿造, 2009, 28(3): 124-126. DOI:10.3969/j.issn.0254-5071.2009.03.038.
[29] 齐慧玲, 魏绍云, 王继伦, 等. Sevag法去除白及多糖中蛋白的研究[J].天津化工, 2000(3): 20-21.
[30] 郭晓蕾, 朱思潮, 翟旭峰, 等. 硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J]. 中华中医药学刊, 2010, 28(9): 2000-2002.
[31] 吴玉娟, 王懿萍, 姜延伟, 等. 黄连多糖含量测定及抗氧化活性研究[J].时珍国医国药, 2008, 19(8): 1906-1908.
[32] GALLEGO M G, GORDON M H, SEGOVIA F J, et al. Caesalpinia decapetala extracts as inhibitors of lipid oxidation in beef patties[J]. Molecules, 2015, 20(8): 13913-13926. DOI:10.3390/molecules200813913.
[33] 刘建利. 宁夏乌拉尔甘草多糖的提取及其体外抗氧化活性的测定[J].食品与发酵工业, 2011, 37(7): 210-213.
[34] 张德华, 邓辉, 乔德亮. 植物多糖抗氧化体外实验方法研究进展[J].天然产物研究与开发, 2015, 27(4): 747-751.
[35] 李亚辉, 马艳弘, 黄开红, 等. 响应面法优化复合酶提取芦荟多糖工艺及其抗氧化活性分析[J]. 食品科学, 2014, 35(18): 63-68.DOI:10.7506/spkx1002-6630-201418012.
[36] 陈蕉, 黎云祥, 陈光登, 等. 两种岩白菜属植物根茎黄酮和多糖的提取及抗氧化活性研究[J]. 食品工业科技, 2009, 30(3): 98-101.
Antioxidant and Antimicrobial Activities of Polysaccharides from Three Species of Auricularia
LUO Jingwen1, SI Fengling1,*, GU Zixuan2, WANG Linling1, MENG Xiuxiu3
(1. College of Life Sciences, Chongqing Normal University, Chongqing 401331, China;2. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;3. Engineering Research Centre of Chinese Ministry of Education for Edible and Medicinal Fungi, Changchun 130118, China)
Abstract:Objective: To evaluate and compare the antioxidant and antimicrobial capacity of polysaccharides from Auricularia cornea var. Li, Auriculari auricula, Auricularia polytricha, was determined. Methods: The polysaccharides were obtained by water extraction followed by ethanol precipitation and the polysaccharide content was determined. The total antioxidant capacity and the scavenging activity against hydroxyl, superoxide anion, and 1,1-diphenyl-2-picrylhydrazyl(DPPH) free radicals and nitrite of the three polysaccharides were measured by spectrophotometry. Besides, the minimum inhibitory concentration (MIC) method was employed to compare the antimicrobial activity of the polysaccharides against Escherichia coli, Staphylococcus aureus and Bacillus subtilis. Results: Under the same conditions, the extraction yields of crude polysaccharides from Auricularia cornea var. Li, Auricularia auricula and Auricularia polytricha were 13.87%,11.26% and 7.91%, respectively, and the purities of the obtained polysaccharides were 49.22%, 41.50% and 37.97%,respectively. Among these, Auricularia polytricha polysaccharides had the highest total antioxidant capacity, while the antioxidant activities of the two other polysaccharides were lower and similar to each other. The hydroxyl radical scavenging capacity of Auricularia cornea var. Li polysaccharides was slightly stronger than that of Auricularia auricula, although both of them showed similar superoxide anion radical scavenging activity, which was stronger than that of Auricularia polytricha polysaccharides. Moreover, all three polysaccharides exhibited potent DPPH radical scavenging capacity with an inhibition percentage of 80% with Auricularia cornea var. Li polysaccharides being the most effective. Auriculari auricular polysaccharides had slightly higher nitrite scavenging capacity than the other polysaccharides. All these polysaccharides had an inhibitory effect on Escherichia coli, but Auricularia polytricha and Auricularia auricula showed weak inhibitory effect on Staphylococcus aureus or Bacillus subtilis. Only Auricularia cornea var. Li. polysaccharides presented a marked inhibitory effect on both Staphylococcus aureus and Bacillus subtilis. Conclusion: The polysaccharides from three Auricularia species have signif i cant differences in antioxidant and antibacterial capacity.
Keywords:Auricularia cornea var. Li polysaccharides; Auricularia auricula polysaccharides; Auricularia polytricha polysaccharides; antioxidant activity; antimicrobial activity
LUO Jingwen, SI Fengling, GU Zixuan, et al. Antioxidant and antimicrobial activities of polysaccharides from three species of Auricularia[J]. Food Science, 2018, 39(19): 64-69. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819011. http://www.spkx.net.cn
DOI:10.7506/spkx1002-6630-201819011. http://www.spkx.net.cn
罗敬文, 司风玲, 顾子玄, 等. 3 种木耳多糖的抗氧化活性与抑菌能力比较分析[J]. 食品科学, 2018, 39(19): 64-69.
引文格式:
文章编号:1002-6630(2018)19-0064-06
文献标志码:A
中图分类号:TS201.2
DOI:10.7506/spkx1002-6630-201819011
*通信作者简介:司风玲(1983—),女,实验师,硕士,研究方向为食品检测、贮藏与保鲜。E-mail:sifengling1217@163.com
第一作者简介:罗敬文(1995—),女,硕士研究生,研究方向为天然产物化学与食品开发。E-mail:530453047@qq.com
基金项目:重庆市社会民生科技创新专项(cstc2015shmsz80031)
收稿日期:2017-05-23