毕秀芳,陈丽伊,赵彩霞,车振明
(西华大学食品与生物工程学院,四川省食品生物技术重点实验室,四川 成都 610039)
摘 要:以多聚半乳糖醛酸酶(polygalacturonase,PG)为研究对象,探讨了在热与超声波作用下PG的钝化动力学。采用3,5-二硝基水杨酸比色法测定酶活力。结果表明:单独的热(≤45 ℃)或超声波(频率20 kHz,温度0 ℃,功率密度242、605、968 W/cm2)处理对PG钝化作用不明显,残留活力均在80%以上,并且处理15 min后,酶活力基本不变,动力学符合部分转化模型。但两者同时处理能使PG显著失活,钝化效果符合一级动力学模型。在20 kHz、35 ℃、605 W/cm2条件下处理16 min可使酶活力降至13.72%。先进行热处理(35 ℃、5 min)再进行超声波处理(0 ℃、605 W/cm2、0~10 min)或先进行超声波处理(0 ℃、605 W/cm2、5 min)再进行热处理(35 ℃、0~10 min)均不能有效钝化PG,表明只有在两者同时作用的前提下,才能表现出协同效应,达到更好的钝酶效果。PG是影响果蔬汁品质的主要酶之一,本实验不仅为超声波钝化PG提供了理论数据,也为果蔬汁加工提供了研究参考。
关键词:多聚半乳糖醛酸酶;热处理;超声波处理;协同作用;动力学
果汁是目前最受欢迎的饮料之一,尤其是一些复合果汁深得消费者喜爱[1-2]。随着果汁逐渐成为市场的消费热点,人们对其品质的要求也越来越高,而一些内源酶的存在会严重影响果汁的品质[3]。多聚半乳糖醛酸酶(polygalacturonase,PG)可以将脱酯果胶酸的α-(1-4)糖苷键随机水解为小片段,从而降解植物组织,影响果蔬汁的黏度和浊度[4]。虽然传统的热处理能有效钝酶,但同时会造成果蔬汁中一些热敏性营养成分如VC的损失[5]。非热处理技术能提高果蔬汁品质并确保安全性,且不会对营养物质造成不利影响[6]。如今,国内外学者对食品加工的研究已经从传统的热处理向非热处理技术转化[7]。
超声波技术(ultrasound,US)是一项新型的非热杀菌技术,能有效杀灭食品中的微生物,并且能保持食品的品质[8-9]。其中高场强超声波是指频率在20~100 kHz,功率密度在10~1 000 W/cm2范围内的超声波技术,在食品加工中最为常用,并受到各国学者的高度关注[10-11],其主要作用原理是空化效应和机械效应[12-13]。现今,超声波钝酶的研究已有较多报道,主要集中在多酚氧化酶[14-15]、过氧化物酶[16-17]、果胶甲基酯酶[18-19]和脂肪氧化酶[20-21]。Ma等[22]研究了不同超声波条件对PG的激活效果。然而目前对超声波对PG的钝化动力学研究较少,且缺乏热与超声波对酶钝化的相互关系的报道。因此,本研究以PG为研究对象,设计了热与超声波单独处理、同时处理、先后处理3 组实验,研究了不同温度、不同超声功率密度对PG的钝化动力学。为超声波钝化PG提供理论数据,并为果蔬汁加工提供参考。
PG(8 600 PGNU/g) 诺维信(中国)投资有限公司;多聚半乳糖醛酸(生物技术级,纯度85%) 源叶生物科技有限公司;D-半乳糖醛酸 北京索莱宝科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)为化学纯,其余试剂均为分析纯,购自成都科龙化工试剂厂。
SCIENTZ-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;FMB40制冰机 上海豫明仪器有限公司;WFJ7200分光光度计 尤尼柯(上海)仪器有限公司;MC-01000228 pH计 成都世纪方舟科技有限公司;HH-S4水浴锅 金坛市医疗仪器厂。
1.3.1 溶液配制
DNS试剂:用400 mL蒸馏水溶解3.15 g DNS,逐步加入200 mL NaOH溶液(0.5 mol/L),再加入91 g四水酒石酸钾钠、2.5 g苯酚、2.5 g无水亚硫酸钠,35 ℃温水浴,不断搅拌,直至溶液清澈透明。用蒸馏水定容至1 000 mL,保存在棕色瓶中。与二氧化碳隔绝,贮存期为6 个月。
0.5 mol/L的pH 5.0醋酸-醋酸钠缓冲液:先分别配制0.5 mol/L的醋酸溶液和醋酸钠溶液,再将两者混合至pH 5.0。
0.1 g/100 mL D-半乳糖醛酸溶液、0.5 g/100 mL多聚半乳糖醛酸溶液、PG稀释液(原酶液稀释4 000 倍)均用上述醋酸-醋酸钠缓冲液配制。
1.3.2 酶活力测定
参考周立等[23]的方法,并略作修改。
样品测定:将0.02 mL PG和0.3 mL 0.5 g/100 mL多聚半乳糖醛酸、0.68 mL醋酸缓冲液(pH 5.0)混合后,在50 ℃下反应30 min,然后加入1 mL DNS试剂,在100 ℃下煮沸5 min,冷却至室温,再加入8 mL蒸馏水稀释,用分光光度计测定540 nm波长处的吸光度。PG活力为每分钟水解D-半乳糖醛酸的质量,单位为mg/min。
D-半乳糖醛酸标准曲线的制作:配制质量浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mg/mL的D-半乳糖醛酸溶液,将1 mL不同质量浓度的D-半乳糖醛酸溶液与1 mL DNS溶液混合后,100 ℃煮沸5 min,冷却至室温,再加入8 mL蒸馏水稀释。用分光光度计测定540 nm波长处的吸光度,制作标准曲线,得标准曲线方程为:y=0.861 4x(R2=0.992 5)。
1.3.3 PG酶液处理
热处理:取10 mL酶液于100 mL烧杯中,置于水浴锅中保温,当酶液中心温度达到指定温度后开始计时,达到处理时间后取出。水浴温度分别为35、45、55、65 ℃,水浴时间分别为0.5、5.0、10.0、15.0、20.0、25.0、30.0 min。
超声波处理:取50 mL酶液于100 mL烧杯中,超声功率密度分别为242、605 W/cm2和968 W/cm2。脉冲间隔为2 s开2 s关,超声频率为20 kHz,探头(直径10 mm)浸入液面深度为2 cm,并采用冰浴,超声波处理时间分别为2、4、6、8、10、12、14 min。
热与超声波同时处理:固定水浴温度为35 ℃,超声功率密度分别为242、605 W/cm2和968 W/cm2,超声波处理时间分别为2、4、6、8、10、12、14 min,其余参数同上;固定超声功率密度为605 W/cm2,水浴温度分别采用25、35、45 ℃,超声波处理时间分别为2、4、6、8、10、12、14 min,其余参数同上。
热与超声波先后处理:第1组取50 mL酶液于100 mL烧杯中,在35 ℃的水浴锅中保温5 min,当酶液中心温度达到35 ℃开始计时,然后在冰浴条件下进行超声波处理,超声功率密度为605 W/cm2,超声时间分别为2、4、6、8、10 min;第2组取50 mL酶液于100 mL烧杯中,先在冰浴条件下进行超声波处理,超声功率密度为605 W/cm2,超声时间为5 min,再取10 mL超声处理后的酶液于100 mL烧杯中,在35 ℃的水浴锅中保温2、4、6、8、10 min。
1.3.4 PG活力钝化动力学分析
酶活力钝化一般符合一级动力学模型(式(1))。
式中:A为处理t min后的酶活力/(mg/min);A0为对照组酶活力/(mg/min);k为设定温度下的反应速率常数/min-1。
部分转化模型是一级动力学模型的特例,应用于存在稳定和不稳定形式的物质,随着处理时间的延长,稳定形式仍然不变的钝化过程。其模型公式如式(2)所示。
式中:A∞为延长处理时间后的酶活力/(mg/min)。
均方误差(mean square error,MSE)计算如式(3)所示。
式中:y为预测值;y1为实际值;n为观测个数;p为参数个数。
所有实验重复两次,使用Origin 8.5软件进行统计并绘图,数据采用SPSS 17.0软件进行方差分析(analysis of variance,ANOVA),以P<0.05表示差异显著。
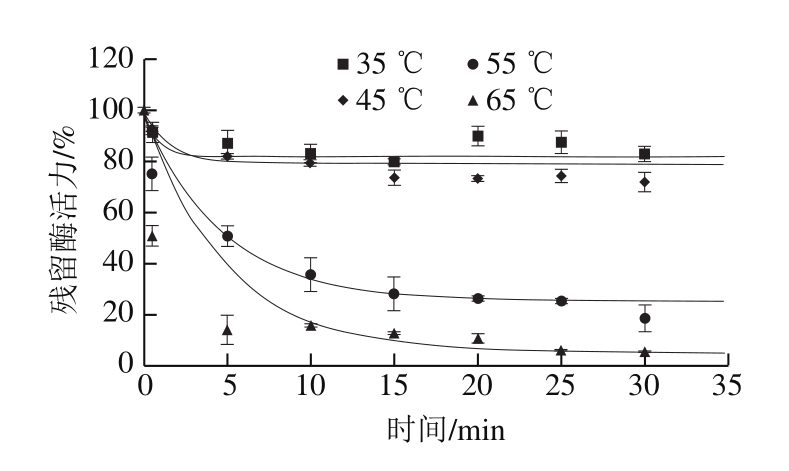
图 1 温度对PG活力的影响
Fig. 1 Effect of heat treatment temperature on PG activity
图1为温度对PG的钝化效果,并用动力学模型拟合。PG对热敏感,处理5 min时酶活力迅速下降,但在35 ℃下处理30 min仍有82.91%的残留酶活力。而随着温度升高,PG的钝化效果逐渐增强。55 ℃和65 ℃下处理30 min,PG残留活力分别为18.54%、5.01%。在4 个温度下,随着处理时间从15 min延长至30 min,酶活力未发生显著性变化。
部分转化模型能够较好拟合温度对PG的钝化效果(R2>0.96,MSE<5.0)。通过模型拟合计算得到PG的不可钝化部分A∞的值分别为82.00%、79.23%、25.36%、5.29%(表1)。说明当温度大于45 ℃时,温度对PG活力的影响很大。此外,处理15~30 min酶活力未发生显著性变化,该结果表明PG存在两个形式:不耐热(PG2)和耐热(PG1)形式。PG1是由PG2与热稳定糖蛋白β-亚基结构关联形成的二聚体,具有较强的耐热性,随着处理温度的升高,PG1可不同程度地向PG2转化[24]。因此,残留的PG活力可能是由于热稳定PG1的存在,而PG活力随着处理温度升高而下降可能是由于PG1转化成了热不稳定的PG2。高温虽能更好地钝化PG,但可能导致果蔬汁中的营养成分流失。由于在35 ℃条件下酶活力变化不大,因此选择35 ℃与超声波结合作进一步研究。
表 1 热和超声波对PG钝化动力学参数
Table 1 Estimation of inactivation kinetic parameters of PG under heat and ultrasonic treatment conditions
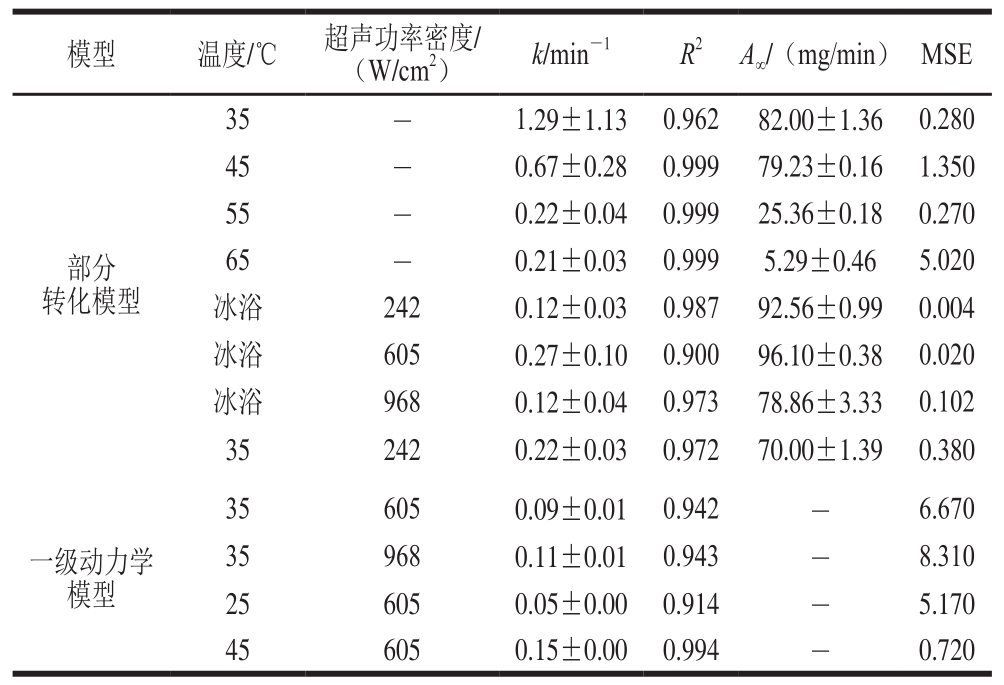

图 2 冰浴条件下不同超声功率密度对PG活力的影响
Fig. 2 Effect of ultrasonic power on PG activity under ice bath condition
如图2所示,冰浴条件下,3 种超声功率密度下,随着处理时间延长,PG活力均呈下降的趋势。在242 W/cm2和605 W/cm2超声功率密度下处理PG稀释液,对其活力影响不大,处理30 min后残留酶活力分别为93.25%、95.49%。随着处理功率密度提高到968 W/cm2,PG活力显著下降,但968 W/cm2处理12 min后残留酶活力仍有83.54%。单独超声波钝化PG遵循部分转化模型公式(R2>0.90,MSE<0.1),求得PG的不可钝化部分A∞的值在78%~96%之间(表1)。
超声波对酶的钝化作用主要归因于空化效应,是指液体中的微小气泡(气泡或气穴)在声场的作用下被激活,表现为这些气泡(空化核)的振荡、生长、收缩及崩溃等一系列动力学过程[25]。气泡收缩及崩溃瞬间,呈现出局部高温(>5 000 K)和高压(50 MPa),因而导致酶失活[26]。超声功率密度的增加也增强了空化效应,但可能由于冰浴条件抑制了这一情况的发生,因而钝化效果不明显。由图2可知,605 W/cm2条件下酶活力变化最小,因此选择605 W/cm2功率密度做进一步的研究。
2.3.1 35 ℃下不同超声功率密度对PG活力的影响
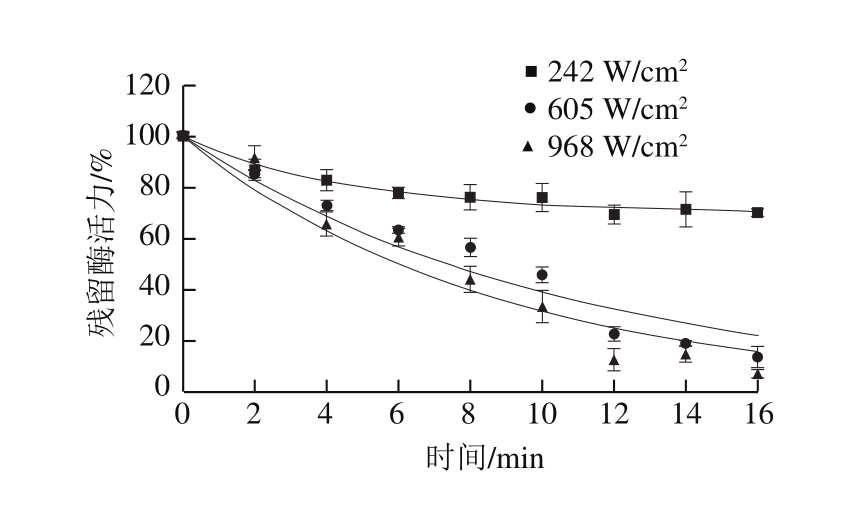
图 3 35 ℃下不同超声功率密度对PG活力的影响
Fig. 3 Effect of ultrasonic power on PG activity at 35 ℃
图3为35 ℃下不同超声功率密度对PG的钝化效果,随着处理时间延长,PG残留活力逐渐下降,超声功率密度由242 W/cm2增加到605 W/cm2,PG活力发生显著性下降(P<0.05),但从605 W/cm2上升至968 W/cm2时,PG活力差异不显著(P>0.05)。242、605、968 W/cm23 种功率密度处理PG稀释液16 min,PG活力分别下降了29.56%、86.28%、93.10%。一级动力学模型能够较好拟合此条件下对PG的钝化效果(R2>0.94,MSE<8.3),但242 W/cm2处理PG的钝化曲线则符合部分转化模型(R2=0.972,MSE=0.38)。相对冰浴条件下的超声波处理,与35 ℃水浴结合明显增强了超声波对PG的钝化效果,表明两者结合处理对PG的钝化有协同作用。超声波产生的空化效应使酶的二级、三级结构发生改变,从而导致酶失活[27-28]。王文宗等[14]也研究表明,超声波产生的能量可能导致维持酶分子二级结构的氢键断裂,导致构象变化,从而抑制酶促反应。温度的结合可能促进了这一作用,但具体的作用机制还需要进一步进行研究探索。另外,考虑到实际生产成本以及仪器使用寿命,可选用605 W/cm2功率密度结合热处理。
2.3.2 605 W/cm2的超声功率密度下不同温度对PG活力的影响
不同温度结合605 W/cm2的超声波处理对PG的钝化效果如图4所示。可以看出,随着时间延长,PG残留活力显著下降(P<0.05),处理16 min后残留活力均在30%以下。并且随着温度升高,钝化效果逐渐增强。相比单独的热处理,与超声波结合可以观察到两种形式的PG均发生失活,表明两者结合使用显著增强了对PG的钝化效果。
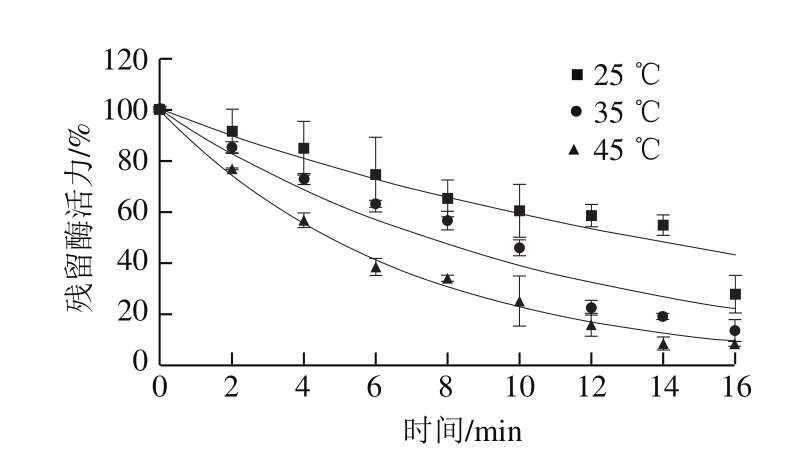
图 4 605 W/cm2的超声功率密度下不同温度对PG活力的影响
Fig. 4 Effect of treatment temperature on PG activity with ultrasonic treatment at 605 W/cm2powder density
此条件下的钝化曲线可用一级动力学进行拟合(R2>0.91,MSE<6.7)。动力学参数如表1所示,随着温度升高,钝化速率常数k从0.05 min-1增加到0.15 min-1,钝化效果逐渐增强。前人也报道过热与超声波结合对PG的钝化效果。Terefe等[29]研究显示,在20 kHz,60~75 ℃,80%能量条件下,蕃茄汁PG的失活率增加了2.3~4.0倍。Vercet等[30]发现20 kHz、振幅117 μm、200 kPa、70 ℃处理1 min使PG的活力降低62%。这种现象可以归因于热与超声波的协同效应,在实验条件下,单独的热或超声处理只导致PG2失活。而在加热过程中,超声处理可能导致PG1分解成不稳定的PG2和热稳定的β-亚基,随后通过加热和超声处理的协同作用使PG2失活[29,31]。
热与超声波结合处理显著增强了对PG的钝化效果,因此,为进一步研究热与超声波两者之间对PG钝化的相互关系,本实验研究了先热处理再超声波处理及先超声波处理再热处理对PG活力的影响。图5a为35 ℃水浴5 min后用605 W/cm2冰浴超声处理对PG活力影响,图5b为605 W/cm2冰浴超声5 min后35 ℃水浴处理对PG活力的影响。两组处理对PG活力影响不大,其残留活力均在85%以上。在本研究中,35 ℃水浴和605 W/cm2超声波单独处理分别造成18.00%、3.90%的PG失活,两者同时处理能钝化70%~90%的PG,并且随着时间延长能使其完全钝化,而两者先后处理只能使PG活力降低15%左右。说明热与超声波先后处理只能表现出两者中对PG最大的钝化效果,仅使PG2失活。因此,只有在热与超声波同时作用的前提下,才能表现出两者的协同效应,使PG1转化成PG2与β-亚基,从而达到更好的钝化效果。

图 5 热与超声波先后处理对PG活力的影响
Fig. 5 Effect of combination sequence of heat and ultrasonic treatment on PG activity
实验结果表明,单独的热(≤45 ℃)或超声波处理对PG钝化效果不明显,其残留活力均在80%以上。而两者同时处理PG酶液,表现出显著的协同效应,能更好钝化PG。在20 kHz、35 ℃、605 W/cm2功率密度条件下处理16 min可使酶活力降至13.72%。通过热与超声波先后处理酶液的实验结果得出,只有在两者同时作用的前提下,才能表现出协同效应,达到更好的钝化效果。以上实验结果不仅为超声波钝化PG提供了理论数据,也为果蔬汁加工提供了参考。
参考文献:
[1] 彭凌. 草莓汁、胡萝卜汁、曹茄汁复合饮料的制作[J]. 食品研究与开发, 2003, 24(6): 68-71.
[2] 蒋侬辉, 钟云, 易定财. 杨桃荸荠复合果汁的工艺研究[J]. 食品工业科技, 2007(1): 143-145. DOI:10.13386/j.issn1002-0306.2007.01.039.
[3] 程新峰, 蒋凯丽, 朱玉钢, 等. 超声波灭酶机制及其在食品加工中的应用[J]. 食品工业科技, 2016, 37(8): 351-357. DOI:10.13386/j.issn1002-0306.2016.08.066.
[4] CHO S W, LEE S, SHIN W. The X-ray structure of Aspergillus aculeatus polygalacturonase and a modeled structure of the polygalacturonase-octagalacturonate complex[J]. Journal of Molecular Biology, 2001, 311(4): 863-878. DOI:10.1006/jmbi.2001.4919.
[5] CHENG X F, ZHANG M, ADHIKARI B. The inactivation kinetics of polyphenol oxidase in mushroom (Agaricus bisporus) during thermal and thermosonic treatments[J]. Ultrasonics Sonochemistry, 2013,20(2): 674-679. DOI:10.1016/j.ultsonch.2012.09.012.
[6] GÓMEZ P L, WELTI-CHANES J, ALZAMORA S M. Hurdle technology in fruit processing[J]. Annual Review of Food Science and Technology, 2011, 2: 447-465. DOI:10.1146/annurevfood-022510-133619.
[7] CAMINITI I M, NOCI F, MUÑOZ A, et al. Impact of selected combinations of non-thermal processing technologies on the quality of an apple and cranberry juice blend[J]. Food Chemistry, 2011, 124(4):1387-1392. DOI:10.1016/j.foodchem.2010.07.096.
[8] CHEOK C Y, CHIN N L, YUSOF Y A, et al. Optimization of total monomeric anthocyanin (TMA) and total phenolic content (TPC)extractions from mangosteen (Garcinia mangostana Linn.) hull using ultrasonic treatments[J]. Industrial Crops and Products, 2013, 50: 1-7.DOI:10.1016/j.indcrop.2013.07.024.
[9] FENG H, BARBOSA-CÁNOVAS G V, WEISS J. Ultrasound technologies for food and bioprocessing[M]. New York: Springer,2011: 559-582. DOI:10.1007/978-1-4419-7472-3.
[10] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science& Technology, 2010, 21(7): 323-331. DOI:10.1016/j.tifs.2010.04.003.
[11] ZHENG L, SUN D W. Innovative applications of power ultrasound during food freezing processes: a review[J]. Trends in Food Science &Technology, 2006, 17(1): 16-23. DOI:10.1016/j.tifs.2005.08.010.
[12] SHIFERAW TEREFE N, BUCKOW R, VERSTEEG C. Qualityrelated enzymes in plant-based products: effects of novel foodprocessing technologies part 3: ultrasonic processing[J]. Critical Reviews in Food Science and Nutrition, 2015, 55(2): 147-158. DOI:10.1080/10408398.2011.586134.
[13] CHEMAT F, KHAN M K. Applications of ultrasound in food technology: processing, preservation and extraction[J].Ultrasonics Sonochemistry, 2011, 18(4): 813-835. DOI:10.1016/j.ultsonch.2010.11.023.
[14] 王文宗, 李琳, 林鸿佳, 等. 超声波对多酚氧化酶酶活力的影响及其机理[J]. 食品科学, 2010, 31(17): 331-334.
[15] BHAT R, GOH K M. Sonication treatment convalesce the overall quality of hand-pressed strawberry juice[J]. Food Chemistry, 2017,215: 470-476. DOI:10.1016/j.foodchem.2016.07.160.
[16] CRUZ R M S, VIEIRA M C, SILVA C L M. Effect of heat and thermosonication treatments on peroxidase inactivation kinetics in watercress (Nasturtium officinale)[J]. Journal of Food Engineering,2006, 72(1): 8-15. DOI:10.1016/j.jfoodeng.2004.11.007.
[17] FONTELES T V, COSTA M G M, DE JESUS A L T, et al. Power ultrasound processing of cantaloupe melon juice: effects on quality parameters[J]. Food Research International, 2012, 48(1): 41-48.DOI:10.1016/j.foodres.2012.02.013.
[18] GAMBOA-SANTOS J, MONTILLA A, SORIA A C, et al. Effects of conventional and ultrasound blanching on enzyme inactivation and carbohydrate content of carrots[J]. European Food Research and Technology, 2012, 234(6): 1071-1079. DOI:10.1007/s00217-012-1726-7.
[19] VILLANUEVA-TIBURCIO J E, VARGAS-SOLÓRZANO J W,GONZÁLEZ-REYNOSO O, et al. Effect of ultrasound and thermal treatment on pectin methylesterase activity in papaya (Carica papaya)juice[J]. The Journal of Microbiology, Biotechnology and Food Sciences, 2016, 5(5): 487-490. DOI:10.15414/jmbfs.2016.5.5.487-490.
[20] JABBAR S, ABID M, HU B, et al. Exploring the potential of thermosonication in carrot juice processing[J]. Journal of Food Science and Technology, 2015, 52(11): 7002-7013. DOI:10.1007/s13197-015-1847-7.
[21] LOPEZ P, BURGOS J. Lipoxygenase inactivation by manothermosonication: effects of sonication on physical parameters,pH, KCl, sugars, glycerol, and enzyme concentration[J]. Journal of Agricultural and Food Chemistry, 1995, 43(3): 620-625. DOI:10.1021/jf00051a012.
[22] MA X B, WANG W J, ZOU M M, et al. Properties and structures of commercial polygalacturonase with ultrasound treatment: role of ultrasound in enzyme activation[J]. RSC Advances, 2015, 5(130):107591-107600. DOI:10.1039/C5RA19425C.
[23] 周立, 李建吾, 郑远旗, 等. 还原糖法测定多聚半乳糖醛酸酶抑制蛋白活性的研究[J]. 四川大学学报(自然科学版), 1996, 33(3): 311-315.
[24] FACHIN D, VAN LOEY A M, NGUYEN B L, et al. Inactivation kinetics of polygalacturonase in tomato juice[J]. Innovative Food Science & Emerging Technologies, 2003, 4(2): 135-142. DOI:10.1016/S1466-8564(02)00090-5.
[25] RAVIYAN P, ZHANG Z, FENG H. Ultrasonication for tomato pectinmethylesterase inactivation: effect of cavitation intensity and temperature on inactivation[J]. Journal of Food Engineering, 2005,70(2): 189-196. DOI:10.1016/j.jfoodeng.2004.09.028.
[26] GONG C L, HART D P. Ultrasound induced cavitation and sonochemical yields[J]. The Journal of the Acoustical Society of America, 1998, 104(5): 2675-2682. DOI:10.1121/1.423851.
[27] MAWSON R, GAMAGE M, TEREFE N S, et al. Ultrasound in enzyme activation and inactivation[M]// FENG H, BARBOSACANOVAS G V, WEISS J. Ultrasound technologies for food and bioprocessing. New York: Springer, 2011: 369-404. DOI:10.1007/978-1-4419-7472-3_14.
[28] CASABONA C A, LYNG J G. The use of ultrasound for the inactivation of microorganisms and enzymes[M]// VILLAMIEL M, GARCIAPEREZ J V, MONTILLA A, et al. Ultrasound in food processing: recent advances. New Jersey: John Wiley & Sons, 2017:255-286. DOI:10.1002/9781118964156.ch9.
[29] TEREFE N S, GAMAGE M, VILKHU K, et al. The kinetics of inactivation of pectin methylesterase and polygalacturonase in tomato juice by thermosonication[J]. Food Chemistry, 2009, 117(1): 20-27.DOI:10.1016/j.foodchem.2009.03.067.
[30] VERCET A, SÁNCHEZ C, BURGOS J, et al. The effects of manothermosonication on tomato pectic enzymes and tomato paste rheological properties[J]. Journal of Food Engineering, 2002, 53(3):273-278. DOI:10.1016/S0260-8774(01)00165-0.
[31] POGSON B J, BRADY C J. Do multiple forms of tomato fruit endopolygalacturonase exist in situ?[J]. Postharvest Biology and Technology, 1993, 3(1): 17-26. DOI:10.1016/0925-5214(93)90023-V.
Inactivation Kinetics of Polygalacturonase after Heat and Ultrasonic Treatments
BI Xiufang, CHEN Liyi, ZHAO Caixia, CHE Zhenming
(Sichuan Key Laboratory of Food Bio-technology, School of Food and Bioengineering, Xihua University, Chengdu 610039, China)
Abstract:The inactivation kinetics of polygalacturonase (PG) after heat and ultrasonic treatments were investigated. PG activity was determined by colorimetry using 3,5-dinitrosalicylic acid. The results indicated that PG was not obviously inactivated by heat ( ≤ 45 ℃) or ultrasonic treatment alone (20 kHz; 0 ℃; 242, 605 or 968 W/cm2power density), retaining more than 80% of its original activity. The activity of PG was almost constant after 15 min of heat or ultrasonic treatment.The inactivation curve was well fitted with a partial transformation model. PG was signif i cantly inactivated by combined heat (25–45 ℃) and ultrasonic treatment and the inactivation curve was fitted with a first-order kinetic model. The activity of PG was decreased to 13.72% by ultrasonic treatment at 20 kHz, 35 ℃ and 605 W/cm2power density for 16 min. However,neither heat treatment (35 ℃ for 5 min) followed by ultrasonic treatment (605 W/cm2power density and 0 ℃ for 0–10 min)nor the reverse sequence (ultrasonic treatment for 5 min and subsequent heat treatment for 0–10 min) inactivated PG,indicating that ultrasonic and heat treatment could inactivate synergistically PG only when they were simultaneously carried out. The results from this study can provide theoretical data for the inactivation of PG by ultrasonic treatment in fruit and vegetable juice processing.
Keywords:polygalacturonase; heat treatment; ultrasonic treatment; synergistic effect; kinetics
BI Xiufang, CHEN Liyi, ZHAO Caixia, et al. Inactivation kinetics of polygalacturonase after heat and ultrasonic treatments[J]. Food Science, 2018, 39(19): 90-95. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819015. http://www.spkx.net.cn
DOI:10.7506/spkx1002-6630-201819015. http://www.spkx.net.cn
毕秀芳, 陈丽伊, 赵彩霞, 等. 热与超声波对多聚半乳糖醛酸酶的钝化动力学[J]. 食品科学, 2018, 39(19): 90-95.
引文格式:
文章编号:1002-6630(2018)19-0090-06
文献标志码:A
中图分类号:TS255.36
DOI:10.7506/spkx1002-6630-201819015
第一作者简介:毕秀芳(1990—),女,讲师,博士,主要从事果蔬加工、非热加工技术研究。E-mail:bxf1221@163.com
基金项目:国家自然科学基金青年科学基金项目(31601480);四川省高校重点实验室开放基金资助项目(szjj2016-018);西华大学重点科研基金资助项目(Z1620513);西华大学研究生创新基金项目(ycjj2018023)
收稿日期:2017-06-15