钟赛意,刘寿春,陈建平,苏伟明,谌素华,刘 海,秦小明
(广东海洋大学食品科技学院,广东省亚热带果蔬加工现代农业科技创新中心,广东 湛江 524088)
摘 要:采用饱和水溶液法和超声法制备高良姜油的羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)包合物,以包合率和得率为指标筛选出较优的方法,通过显微镜观察、薄层色谱分析、傅里叶变换红外光谱分析、紫外光谱分析等对包合物的结构进行表征,并测定高良姜油及其包合物对羟自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力和还原能力、对DNA氧化损伤的保护作用、对紫外线诱导红细胞溶血的影响以及在模拟胃液条件下其阻断亚硝胺合成作用的变化。结果表明:饱和水溶液法制备高良姜油-HP-β-CD包合物优于超声法,高良姜油能被有效包合,且对其化学成分几乎无影响;高良姜油及其包合物具有较好的清除羟自由基、DPPH自由基的能力和较高的还原能力,对DNA氧化损伤具有保护作用,能抑制紫外线诱导的红细胞溶血,并且可有效抑制亚硝胺的合成;包合后高良姜油的抗氧化活性及抑制亚硝胺合成的能力得到显著提升(P<0.05)。
关键词:高良姜油;羟丙基-β-环糊精;包合物;抗氧化活性;抑制亚硝胺合成
高良姜(Alpinia oきcinarum Hance)又名徐闻良姜,别名小良姜,为姜科植物的干燥根茎,是一种热带、亚热带多年生山姜属植物,是常见的调味品和食用香料,广泛分布于广东、海南和广西等地区,其中广东湛江徐闻县是其原产地。高良姜已被国家卫生和计划生育委员会列为“药食两用”的农产品之一[1],具有较高的药用和食用价值。前人研究表明其具有温胃、止呕、散寒止痛的功效[2],以及促进渗透性、抗溃疡、抗炎、抗缺氧等药理作用[3]。高良姜油为高良姜主要的有效成分之一,但其难溶于水,见光、遇热易分解,且具有较强的挥发性,同时其性甘辣,直接服用刺激性较大,这也是许多植物精油存在的共性问题;如果能克服这些问题,将高良姜油进一步制成咀嚼片、冲剂、饮料等,将大大拓宽其用途[4]。羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)是β-CD的羟丙基衍生物,具有亲水表面与疏水内腔,能更显著增大难溶性物质的溶解度,其水溶性较β-CD大大提高,溶血性也更低,具有更高的安全性,为低毒、安全、有效的药物增溶剂。目前,尚鲜有采用HP-β-CD制备高良姜油包合物并对其活性影响进行研究的报道。因此,本研究拟采用HP-β-CD包合高良姜油,并采用显微镜、薄层色谱(thin layer chromatography,TLC)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)、紫外(ultraviolet,UV)光谱等仪器对包合物的结构特征进行鉴定,同时对其抗氧化活性和抗亚硝胺合成作用进行评价,旨在为高良姜油的进一步开发利用提供一定的依据。
高良姜油由广东海洋大学食品科技学院农产品加工实验室自制。新鲜高良姜采自广东湛江徐闻县龙塘镇高良姜原产基地,将根茎洗净干燥,粉碎后过80 目筛备用,采用超临界二氧化碳萃取得到淡黄色、澄清透明的高良姜油,以棕色小玻璃瓶避光常温保存。
HP-β-CD(食品级) 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析纯)、胃蛋白酶(生化试剂)、小牛胸腺DNA 美国Sigma公司;质量分数2%绵羊红细胞(red blood cell,RBC) 郑州百基生物科技有限公司;邻苯三酚、双氧水、硫酸亚铁、邻二氮菲、抗坏血酸、铁氰化钾、硫酸铜、亚硝酸钠、氯化钠、碳酸钠、对氨基苯磺酸、盐酸萘乙二胺、α-萘胺、二甲胺和香草醛 中国国药(集团)上海化学试剂公司;其他试剂均为国产分析纯。
AUW120电子天平 日本SHIMADZU公司;KQ-500DB型数控超声波清洗器 昆山市超声仪器有限公司;FD8508型冷冻干燥机 韩国iLShinBioBase公司;5810R高速台式冷冻离心机 德国Eppendorf公司;HSB-Ш循环水式多用真空泵 郑州长城科工贸有限公司;EYELA旋转蒸发仪 上海爱朗仪器有限公司;UV-5100 UV-可见分光光度计 上海元析仪器有限公司;TU-1901双光束UV-可见分光光度计 北京普析通用仪器有限责任公司;TENSOR27型FT-IR仪 德国Bruker公司;XD-101倒置显微镜 南京江南永新光学有限公司;BPCL型超微弱化学发光测量仪 中国科学院生物物理所。
1.3.1 高良姜油-HP-β-CD包合物制备方法的筛选
1.3.1.1 饱和水溶液法
参考文献[5]的方法并略作改动:将高良姜油和HP-β-CD按质量比1∶8进行投料。准确称取3.534 g的HP-β-CD溶解于100 mL蒸馏水中制成HP-β-CD饱和水溶液。另取0.495 mL高良姜油溶于20 mL无水乙醇中制成高良姜油-乙醇溶液。将HP-β-CD饱和水溶液放入恒温摇床,在40 r/min、45 ℃下搅拌1 h,边摇边缓慢滴入高良姜油-乙醇溶液。取出冷却至室温后放入冰箱(4 ℃)冷藏24 h,真空抽滤,减压蒸馏回收乙醇,然后放入真空冷冻干燥机干燥96 h,研碎后过80 目筛,得到白色粉末状包合物。平行制备3 份。
1.3.1.2 超声法
参考文献[5]的方法并略作改动:同1.3.1.1节制得高良姜油-乙醇溶液,然后将HP-β-CD饱和水溶液放入超声波清洗机,缓慢滴加高良姜油-乙醇溶液,40 r/min、45 ℃下超声1 h。取出冷却至室温后放入冰箱(4 ℃)冷藏24 h,真空抽滤,减压蒸馏回收乙醇,然后放入真空冷冻干燥机干燥96 h,研碎后过80 目筛,得到白色粉末状包合物。平行制备3 份。按公式(1)计算两种制备方法的得率。
1.3.2 包合率的测定
参考文献[6]的方法,准确称取包合物的质量,将包合物置于圆底烧瓶中,加300 mL蒸馏水和几粒沸石,连接挥发油测定器,保持微沸直到油量不再增加时停止加热,放置1 h,至高良姜油呈淡黄色时读数,得到高良姜油的体积,并按照公式(2)计算包合率。
1.3.3 高良姜油-HP-β-CD包合物的表征
1.3.3.1 显微镜观察
用吸管吸取新制备的高良姜油-HP-β-CD包合物与HP-β-CD溶液各一滴分别置于载玻片上,涂匀并分散开,在光学显微镜下观察其显微形态。
1.3.3.2 TLC法测定
参考文献[4]的方法,将包合物中馏出的挥发油和高良姜油加入体积分数50%乙醇溶液,同时称取适量高良姜油-HP-β-CD包合物、HP-β-CD和HP-β-CD与高良姜油的物理混合物制成饱和溶液。分别吸取上述5 种溶液各10 μL,并依次点于同一个硅胶板上,用正己烷-乙醚(体积比8∶2)作为展开剂,取出晾干后喷洒体积分数5%香草醛-浓硫酸试剂,并在105 ℃下烘至斑点清晰显色。
1.3.3.3 FT-IR法测定
参考文献[7]的方法,分别称取高良姜油、HP-β-CD、高良姜油-HP-β-CD包合物、HP-β-CD与高良姜油的物理混合物,将样品和KBr按质量比1∶100混合,用玛瑙研钵研磨至红外光下不反光为止,压片,并在4 000~400 cm-1范围扫描,得到FT-IR图谱。
1.3.3.4 UV法测定
参考文献[8]的方法,分别取适量高良姜油、HP-β-CD、高良姜油-HP-β-CD包合物、HP-β-CD与高良姜油的物理混合物溶解于纯甲醇中并定容至25 mL,然后置于双光束UV-可见分光光度计中,在波长190~400 nm范围内扫描,以纯甲醇为空白,测定其吸光度。
1.3.4 高良姜油-HP-β-CD包合物水溶性观察
称取等质量的高良姜油和高良姜油-HP-β-CD包合物分别放入两支试管,依次加入10 mL蒸馏水,用力振荡,观察对比其水溶性。
1.3.5 高良姜油-HP-β-CD包合物抗氧化活性的测定
1.3.5.1 DPPH自由基清除能力的测定
参考文献[9-10]的方法并略作改动:各取2 mL质量浓度分别为0.5、1.0、2.0、4.0、8.0 mg/mL的高良姜油、高良姜油-HP-β-CD包合物以及高良姜油与HP-β-CD的物理混合物,依次加入2 mL 0.2 mmol/L DPPH-乙醇溶液,用力振荡使其混合均匀,置于室温下避光反应30 min。在517 nm波长处测吸光度记为Ai,同时测定2 mL DPPH-乙醇溶液+2 mL乙醇的吸光度记为A0,2 mL样品溶液+2 mL乙醇的吸光度记为Aj。所有测定平行3 次,并按公式(3)计算DPPH自由基清除率。
1.3.5.2 ·OH清除能力的测定
参考文献[11]的方法并略作改进:取5 支试管分别加入1 mL 1.5 mmol/L邻二氮菲溶液、2 mL pH 7.4磷酸盐缓冲液(phosphate buffer salinen,PBS),加入0.5、1.0、2.0、4.0、8.0 mg/mL的高良姜油、高良姜油-HP-β-CD包合物以及高良姜油与HP-β-CD的物理混合物各2 mL于试管中,再加入1 mL 0.75 mmol/L硫酸亚铁溶液,用力振荡使其充分混匀,最后加入体积分数0.01% H2O21 mL,保持37 ℃下恒温反应45 min后,在536 nm波长处测吸光度记为As。用1 mL蒸馏水代替H2O2,测得吸光度记为Ab,用1 mL蒸馏水代替样品溶液,测得吸光度记为Ap。所有测定平行3 次,羟自由基(·OH)清除率按公式(4)进行计算。

1.3.5.3 还原能力的测定
取质量浓度分别为0.5、1.0、2.0、4.0、8.0 mg/mL的高良姜油、高良姜油-HP-β-CD包合物以及高良姜油与HP-β-CD的物理混合物各2.5 mL,加入2.5 mL 0.2 mol/L PBS(pH 6.6)和2.5 mL质量分数1%铁氰化钾溶液,50 ℃的恒温水浴中保温20 min,再加入2.5 mL质量分数10%三氯乙酸溶液,在3 000 r/min下离心10 min。取3.5 mL上清液与0.5 mL去离子水和0.5 mL的质量分数0.1%三氯化铁溶液混合均匀,在700 nm波长处测吸光度。所有测定平行3 次。
1.3.5.4 对DNA氧化损伤的保护作用
参考文献[1 2-1 3]的方法并略作改动:建立CuSO4-Phen-VC-H2O2-DNA的化学发光反应体系。使Phen、Cu2+、VC和DNA的最终浓度分别为3.5×10-3、2.0×10-4、2.0×10-3mol/L和质量浓度150 μg/mL。在样品池中依次加入200 μL质量浓度分别为0.5、1.0、2.0、4.0、8.0 mg/mL的高良姜油、高良姜油-HP-β-CD包合物以及高良姜油与HP-β-CD的物理混合物溶液、1.6 mL DNA/Cu2+/Phen体系溶液和200 μL VC,混匀后置于化学发光测量仪中,打开记录系统,立即注入400 μL H2O2溶液,启动发光装置,每隔4 s采集数据1 次,记录9 min内的总发光强度CL2,用蒸馏水做对照测总发光强度CL1,不加H2O2溶液时的发光强度为本底发光强度CL0,按公式(5)计算DNA损失抑制率。
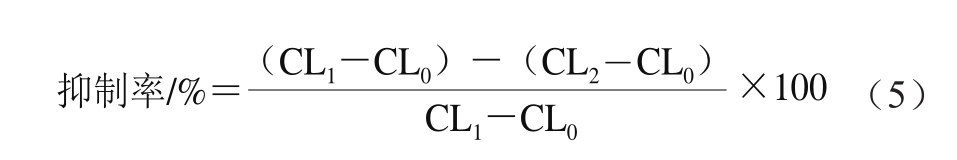
1.3.5.5 对UV诱导RBC溶血的影响
参照文献[14-15]的方法并略作改动,分别取质量分数2%绵羊RBC悬液4 mL,再按梯度质量浓度分别加入0.625、1.250、2.500、5.000、10.000 mg/mL高良姜油、高良姜油-HP-β-CD包合物以及高良姜油与HP-β-CD的物理混合物,用生理盐水补加至同等体积,空白管以生理盐水代替样品补足,各管溶液最终体积为8 mL,同时设VE作为阳性对照组。混匀后置于37 ℃水浴保温10 min,然后用30 W UV灯照射30 min,置于4 ℃冰箱中放置24 h,2 500 r/min离心5 min取上清液,在540 nm波长处测吸光度,对UV诱导RBC溶血的影响以溶血抑制率表示,按公式(6)计算。
式中:A0为空白组吸光度;A1为样品吸光度。
1.3.6 对阻断亚硝胺合成的影响
参考文献[16-17]的方法并略作改动,在100 mL质量分数2%氯化钠溶液中加入7 mL浓盐酸,再加入胃蛋白酶6.0 g,加去离子水定容至1 000 mL,混匀即获得人工模拟胃液。取1 mL模拟胃液,再加入质量浓度分别为0.5、1.0、2.0、4.0、8.0 mg/mL的高良姜油,高良姜油-HP-β-CD包合物以及高良姜油与HP-β-CD的物理混合物溶液20 μL,0.1 mL 0.07 mmol/L亚硝酸钠,0.1 mL 1 mmol/L二甲胺;用去离子水定容至2.5 mL,摇匀后置于37 ℃水浴1 h。取1 mL混合液,加入0.5 mL质量分数0.5% Na2CO3溶液于UV分析仪中照射15 min。再加入1.5 mL质量分数1%对氨基苯磺酸溶液、1.5 mL质量分数0.1% α-萘胺溶液、0.5 mL去离子水,摇匀后静置15 min。用UV-可见分光光度计测定在538 nm波长处的吸光度,按公式(7)计算对亚硝胺合成的阻断率。
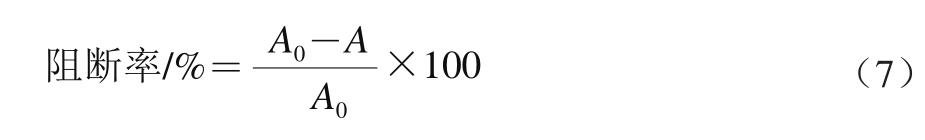
式中:A0为不加样品时的吸光度;A为加入样品后的吸光度。
实验中所有数据采用SPSS 10.0软件处理分析,以3 个平行样品的 ±s表示,各组间数据比较采用单因素方差分析,P<0.05时为差异显著。
±s表示,各组间数据比较采用单因素方差分析,P<0.05时为差异显著。
分别采用饱和水溶液法和超声法制备高良姜油-HP-β-CD包合物,结果显示饱和水溶液法制备的包合率为78.31%,得率为89.53%;超声法的包合率为72.64%,得率为83.27%。比较两种包合方法,饱和水溶液法制备的高良姜油-HP-β-CD包合率和得率均显著高于超声法(P<0.05),因此选用饱和水溶液法制备。
2.2.1 显微镜观察结果

图 1 HP-β-CD(a)与高良姜油-HP-β-CD包合物(b)的显微镜观察(16×10)
Fig. 1 Microscopic observation of HP-β-CD (a) and inclusion complex with the essential oil (b) (16 × 10)
由图1可看出,HP-β-CD呈透明状,高良姜油-HP-β-CD包合物内含黑色不透明物质,可初步判断高良姜油已包埋于HP-β-CD中。与郭涛等[18]大蒜油的包合物的显微镜观察结果一致。
2.2.2 TLC分析结果
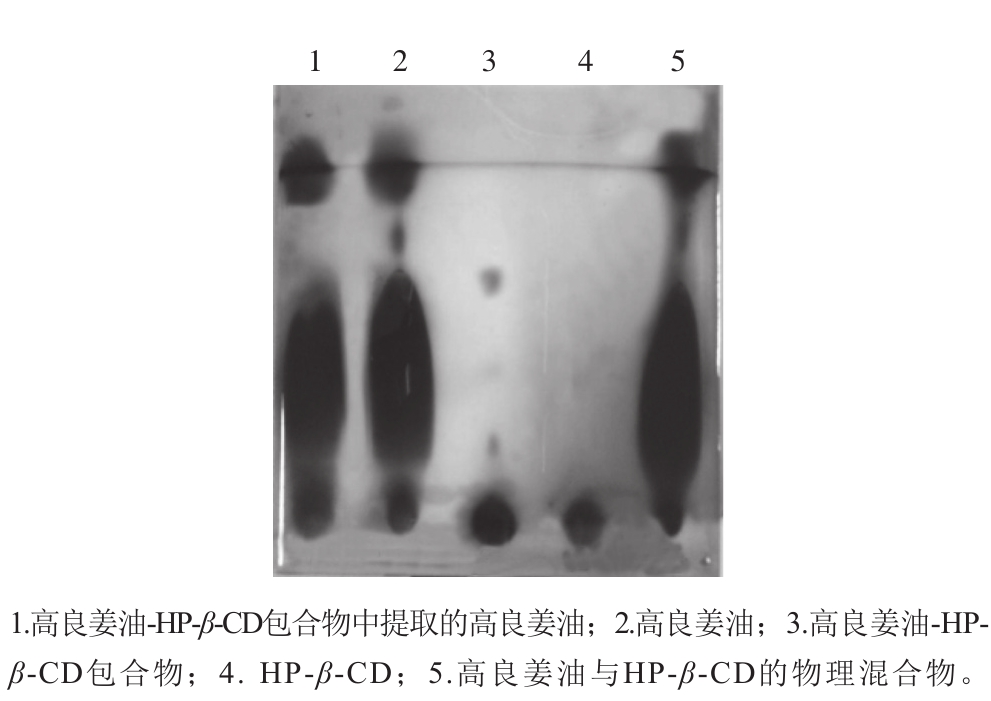
图 2 高良姜油-HP-β-CD包合物及其组分的TLC图谱
Fig. 2 TLC analysis of the essential oil, HP-β-CD, and their inclusion complex and physical mixture
由图2可知,样品1、2、5在相同位置显现的斑点几乎一致,样品3、4几乎无相应斑点。从样品1、2的鉴定结果可以看出包合前后高良姜油的TLC图谱基本一致,说明其成分几乎无变化;样品2、3、5的TLC鉴定结果表明,包合过程与简单的物理混合有所不同,包合物形成了一种新的物相,且形成的高良姜油-HP-β-CD包合物较稳定。
2.2.3 FT-IR分析结果

图 3 高良姜油-HP-β-CD包合物及其组分的FT-IR光谱
Fig. 3 FT-IR spectra of the essential oil, HP-β-CD, and their inclusion complex and physical mixture
从图3中可以看出,高良姜油在1 745 cm-1附近有一个特征吸收峰,高良姜油与HP-β-CD的物理混合物在该处也有特征吸收峰,而HP-β-CD和高良姜油-HP-β-CD包合物在该处没有吸收[19];包合后高良姜油在756、1 162、1 456、1 745、2 926 cm-1处的特征吸收峰被HP-β-CD的吸收峰掩盖了,而且高良姜油与HP-β-CD的物理混合物与高良姜油-HP-β-CD包合物的FT-IR光谱图也有不同,这表明包合不是简单的混合,而是有了新物相的形成。高良姜油-HP-β-CD包合物在2 934 cm-1处的缔合羟基峰与未包合的高良姜油相比更宽更强,说明高良姜油与HP-β-CD形成了氢键,从而增强了高良姜油的水溶性。
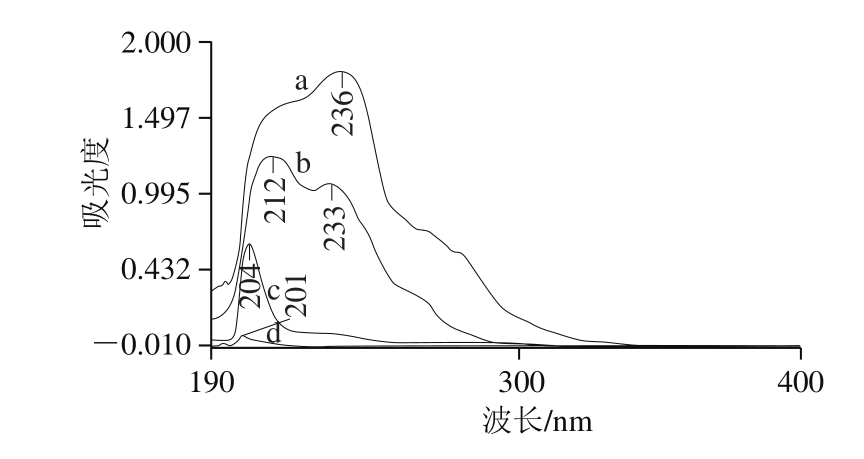
图 4 高良姜油-HP-β-CD包合物及其组分的UV光谱
Fig. 4 UV absorption spectra of the essential oil, HP-β-CD, and their inclusion complex and physical mixture
2.2.4 UV分析结果由图4可看出,高良姜油、高良姜油和HP-β-CD的物理混合物在波长190~400 nm范围内均有吸收,但是后者的波长发生蓝移,这可能是受到HP-β-CD的影响[20],但是两者的光谱行为大体相同。而高良姜油-HP-β-CD包合物与高良姜油及其与HP-β-CD的物理混合物的图谱有明显的区别,而与HP-β-CD相似,这说明包合过程不是简单的物理混合,而是有了新物相的形成。

图 5 包合前后高良姜油水溶性对比
Fig. 5 Water solubility of the essential oil before and after inclusion
从图5可以看出,包合前高良姜油漂浮在水面,不溶于水;而包合后高良姜油被均匀地分散在水溶液中,包合作用使高良姜油的水溶性大幅提高。
2.4.1 DPPH自由基清除能力分析
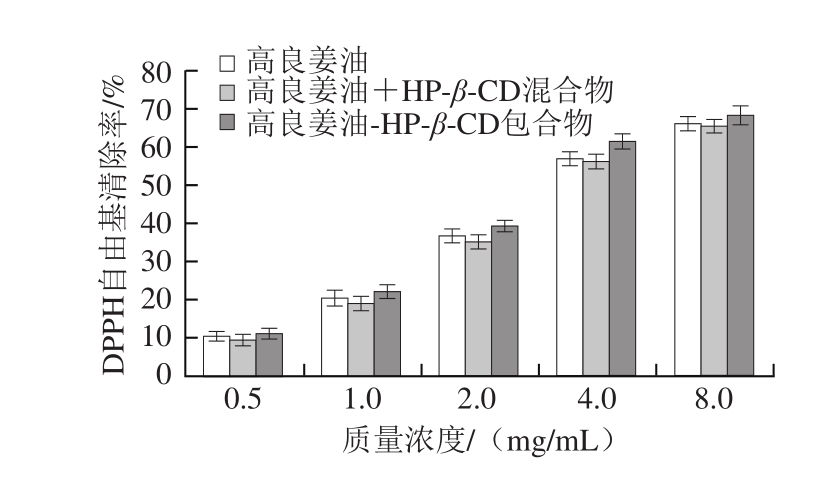
图 6 包合后高良姜油DPPH自由基清除能力的变化
Fig. 6 DPPH radical scavenging capacity of the essential oil and its inclusion complex
由图6可知,在实验质量浓度范围(0.5~8.0 mg/mL)内,高良姜油、高良姜油与HP-β-CD的物理混合物及高良姜油-HP-β-CD包合物均具有一定的清除DPPH自由基的能力,并且呈剂量依赖性,随着质量浓度的升高,其清除能力升高。当浓质量度为8.0 mg/mL时,三者DPPH自由基清除率分别达65.8%、65.2%和68.3%,可以看出包合后清除DPPH自由基的能力略有上升,但差异不显著(P>0.05)。
2.4.2 ·OH清除能力分析
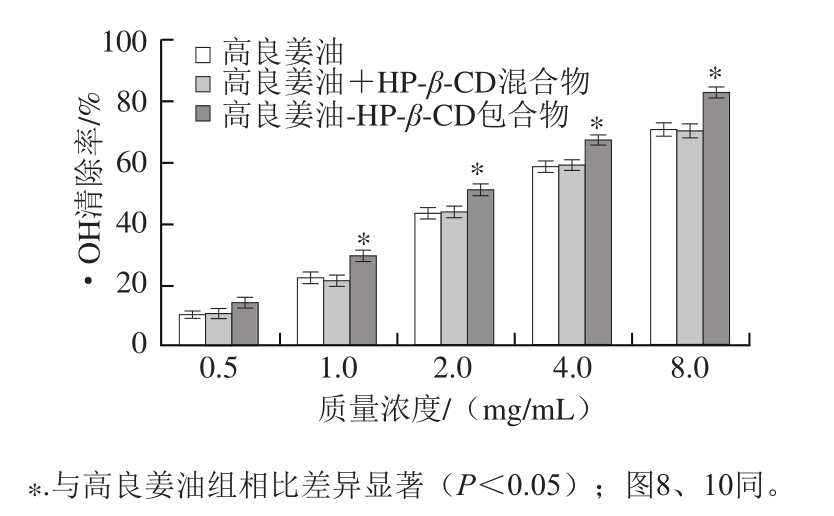
图 7 包合前后高良姜油·OH清除能力的变化
Fig. 7 Hydroxyl radical scavenging capacity of the essential oil and its inclusion complex
如图7所示,在实验质量浓度范围(0.5~8.0 mg/mL)内,高良姜油、高良姜油与HP-β-CD的物理混合物及高良姜油-HP-β-CD包合物均具有一定的清除·OH的能力,并且呈剂量依赖性,随着质量浓度的升高,其清除能力升高。当质量浓度为8.0 mg/mL时,三者·OH清除率分别达70.8%和70.2%和82.3%,包合后清除·OH的能力显著提高(P<0.05),在实验质量浓度范围内提高幅度达16.2%~40.7%。
2.4.3 还原能力分析
测定物质的还原能力是确定其抗氧化活性的一种方法,物质的还原能力通常与抗氧化活性之间存在显著的正相关,还原能力可以一定程度上反映抗氧化活性[21-22]。铁氰化物中的Fe3+被抗氧化物质还原成Fe2+,溶液颜色变绿。根据所测吸光度评价还原能力。

图 8 包合前后高良姜油还原能力的变化
Fig. 8 Reducing power of the essential oil and its inclusion complex
从图8可看出,随着高良姜油质量浓度的增加,吸光度也随之增加,并且高良姜油-HP-β-CD包合物的吸光度显著高于未经包合的高良姜油(P<0.05),在测定质量浓度范围内增幅达16.67%~61.63%,表明高良姜油-HP-β-CD包合物的还原能力得到显著提升。
2.4.4 对DNA氧化损伤的保护作用分析
在CuSO4-Phen-VC-H2O2-DNA化学发光体系中,利用Cu2+与VC发生Fenton反应,生成具有强氧化性的·OH,同时Phen在金属离子的催化下与H2O2作用生成·OH,当·OH离DNA作用位点很近并且浓度相对集中时将对DNA造成损伤[23-24]。
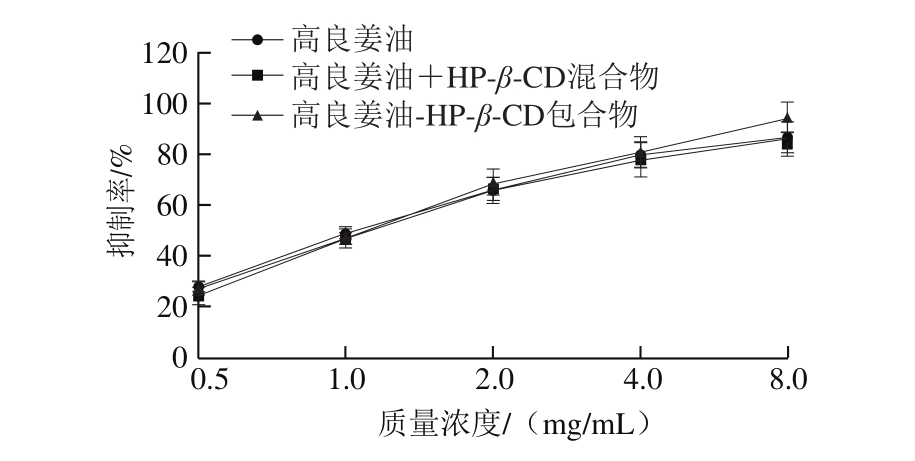
图 9 高良姜油及其HP-β-CD包合物对DNA氧化损伤的保护作用
Fig. 9 Protective effect of the essential oil and its inclusion complex on DNA damage
从图9可以看出,在此体系内,高良姜油-HP-β-CD包合物对DNA损伤的保护作用略大于未包合的高良姜油,但差异不显著(P>0.05),8.0 mg/mL的包合物对DNA氧化损伤的抑制率达94.1%。
2.4.5 对UV诱导RBC溶血的影响
表 2 高良姜油及其HP-β-CD包合物对UV诱导的RBC溶血的影响
Table 2 Inhibitory effect of the essential oil and its inclusion complex on UV-induced hemolysis of RBC

注:*.同一质量浓度,与高良姜油组比较差异显著(P<0.05)。
由表2可知,高良姜油、高良姜油-HP-β-CD包合物及VE均具有一定的抗UV诱导的RBC溶血的能力,并且均呈浓度依赖性,质量浓度越高,抑制率越大。虽然在相同质量浓度下,高良姜油及高良姜油-HP-β-CD包合物的抗RBC溶血能力弱于阳性对照VE,但高良姜油-HP-β-CD包合物的抗RBC溶血能力显著高于未包合的高良姜油(P<0.05)。RBC溶血实验是评价生物抗氧化活性的常用方法之一[25-27]。RBC膜富含对自由基非常敏感的多不饱和脂肪酸,UV照射RBC悬液,激发产生的·OH攻击RBC膜上的多不饱和脂肪酸,导致脂质过氧化,致使膜通透性增加,引起血红蛋白渗出导致溶血[28]。高良姜油及其包合物能抑制UV导致的RBC溶血作用,说明其能抑制RBC膜的·OH氧化损伤。结果表明,包合后高良姜油的抗RBC溶血作用得到显著提升。
亚硝胺是一种典型的强致癌物,能引起人和动物胃、肝脏等多种器官的恶性肿瘤[29]。在胃内酸性条件下,胺类物质和亚硝酸盐很容易结合产生亚硝胺,利用天然化合物阻断这一反应过程,可在一定程度上预防亚硝胺对人体带来的潜在危害[30]。
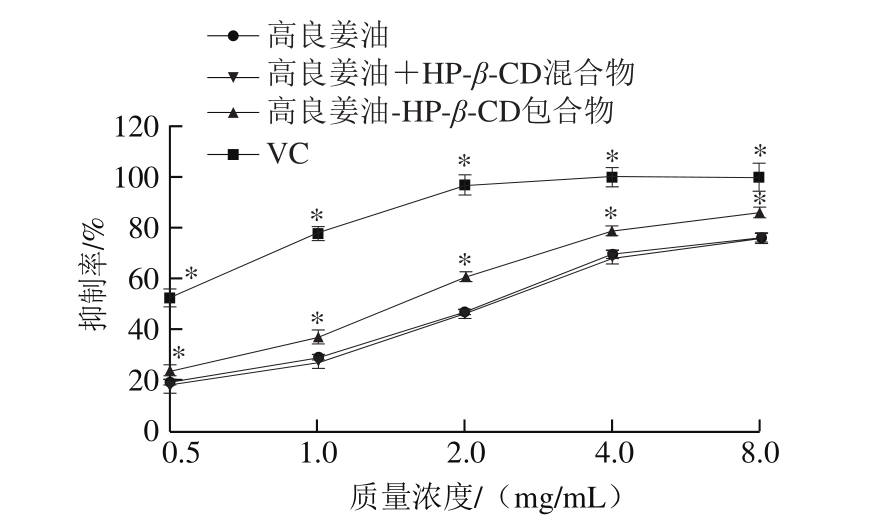
图 10 高良姜油及其HP-β-CD包合物对抑制亚硝胺合成的影响
Fig. 10 Inhibitory effect of the essential oil and its inclusion complex on nitrosamine synthesis
图10显示,在0.5~8.0 mg/mL范围内,随着高良姜油质量浓度的增加,对亚硝胺合成的阻断率均逐渐升高,表明高良姜油及高良姜油-HP-β-CD包合物均可有效地阻断亚硝胺的合成。在同等质量浓度下,包合物对亚硝胺合成的阻断率显著大于未包合的高良姜油(P<0.05)。结果表明,包合后高良姜油抑制亚硝胺合成的能力显著提升。
采用饱和水溶液法制备高良姜油-HP-β-CD包合物优于超声法制备。通过显微镜观察、TLC法、FT-IR法、UV光谱法等分析手段鉴定了高良姜油-HP-β-CD包合物的形态,表明高良姜油被成功包合,包合前后高良姜油的组成几乎无变化,不仅很好地保留了高良姜油的主要特征成分,并可通过冷冻干燥把难溶于水的液态状的高良姜油转化为易溶于水的固体粉末,很大程度上改善了高良姜油的水溶性和稳定性,并能掩盖其气味,减少刺激性。为开发高良姜油新产品并进一步将其制成药片、冲剂、泡腾片、饮料等产品以及拓宽其用途提供了依据。
通过测定和分析高良姜油及高良姜油-HP-β-CD包合物对·OH、DPPH自由基的清除能力和还原能力、对DNA氧化损伤的保护作用、对UV诱导的RBC溶血的影响以及在模拟胃液条件下其阻断亚硝胺合成作用的变化,表明高良姜油及高良姜油-HP-β-CD包合物具有较好的·OH、DPPH自由基清除能力和较高的还原能力,对DNA氧化损伤具有保护作用,并且能有效抑制亚硝胺的合成;包合后高良姜油的抗氧化活性及抑制亚硝胺合成的能力得到显著提升。
参考文献:
[1] 国家卫生计生委办公厅. 按照传统既是食品又是中药材物质目录管理办法(征求意见稿): 国卫办食品函[2014]975号[A/OL]. (2014-11-06) [2017-06-15]. http://www.nhfpc.gov.cn/sps/s3585/201411/67ac 54fb05ed46929adc63f2db31d4bf.shtmL.
[2] 周景春, 吴金昱. 主产于雷州半岛的高良姜[J]. 首都医药, 2014,21(19): 51. DOI:10.3969/j.issn.1005-8257.2014.19.031.
[3] 黄慧珍, 杨丹. 高良姜的化学成分及其药理活性研究进展[J]. 广东化工, 2009, 36(1): 77-80. DOI:10.3969/j.issn.1007-1865.2009.01.027.
[4] 文震, 刘波, 郑宗坤, 等. 玫瑰精油β-环糊精包合物的制备与表征[J]. 食品科学, 2009, 30(10): 29-32. DOI:10.3321/j.issn:1002-6630.2009.10.001.
[5] 郭艳云, 蔡莹, 曹国轩, 等. 梅片树叶挥发油/β-环糊精包合物的制备研究[J]. 现代食品科技, 2013, 29(1): 138-140; 161. DOI:10.13982/j.mfst.1673-9078.2013.01.013.
[6] 国家药典委员. 中华人民共和国药典[M]. 北京: 化学工业出版社,2005: 附录58.
[7] 薛菲, 尹寿玉. 杜香油β-环糊精包合物的制备及验证[J]. 中药材,2009, 32(12): 1898-1902. DOI:10.3321/j.issn:1001-4454.2009.12.035.
[8] 朱缨, 俞迪佳, 吉文亮. 豆蔻挥发油羟丙基-β-环糊精包合物的制备工艺的研究[J]. 世界科学技术-中医药现代化, 2013, 15(2): 317-321.DOI:10.11842/wst.2013.02.032.
[9] 贾秀稳, 张立华, 李先如, 等. 石榴花精油成分分析及清除自由基能力评价[J]. 食品科学, 2015, 36(24): 152-155. DOI:10.7506/spkx1002-6630-201524027.
[10] OLIVEIRA G K F, TORMIN T F, SOUSA R M F, et al. Batchinjection analysis with amperometric detection of the DPPH radical for evaluation of antioxidant capacity[J]. Food Chemistry, 2016, 192: 691-697. DOI:10.1016/j.foodchem.2015.07.064.
[11] 冯雪, 姜子涛, 李荣. 调味香料草果挥发油的抗氧化性能及清除自由基能力[J]. 中国调味品, 2010, 35(3): 48-50; 54. DOI:10.3969/j.issn.1000-9973.2010.03.008.
[12] SU W T, TANG S Z, XIE C C, et al. Antioxidant and DNA damage protection activities of duck gizzard peptides by chemiluminescence method[J]. International Journal of Food Properties, 2016, 19(4): 760-767. DOI:10.1080/10942912.2015.1043605.
[13] HE Z Y, LAN M B, LU D Y, et al. Antioxidant activity of 50 traditional chinese medicinal materials varies with total phenolics[J].Chinese Medicine, 2013, 4(4): 148-156. DOI:10.4236/cm.2013.44018.
[14] CAVALLINI G, DACHÀ M, POTENZA L, et al. Use of red blood cell membranes to evaluate the antioxidant potential of plant extracts[J].Plant Foods for Human Nutrition, 2014, 69(2): 108-114. DOI:10.1007/s11130-014-0414-0.
[15] ZBIKOWSKA H M, ANTOSIK A, SZEJK M, et al. Does quercetin protect human red blood cell membranes against γ-irradiation?[J].Redox Report, 2014, 19(2): 65-71. DOI:10.1179/135100021 3Y.0000000074.
[16] HIROTA S, TAKAHAMA U. Reactions of polyphenols in masticated apple fruit with nitrite under stomach simulating conditions: formation of nitroso compounds and thiocyanate conjugates[J]. Food Research International, 2015, 75: 20-26. DOI:10.1016/j.foodres.2015.05.018.
[17] ZHANG O, ZOU X, LI Q H, et al. Experimental and theoretical investigation of effects of ethanol and acetic acid on carcinogenic NDMA formation in simulated gastric fluid[J]. The Journal of Physical Chemistry A, 2016, 120(26): 4505-4513. DOI:10.1021/acs.jpca.6b02582.
[18] 郭涛, 王志远, 宋洪涛, 等. 大蒜油2-羟丙基-β-环糊精包合物的制备与鉴定[J]. 解放军药学学报, 2006, 22(2): 91-94. DOI:10.3969/j.issn.1008-9926.2006.02.004.
[19] 徐才兵, 贾运涛, 田睿, 等. 和厚朴酚羟丙基-β-环糊精包合物制备及验证[J]. 中国药学杂志, 2013, 48(16): 1385-1388. DOI:10.11669/cpj.2013.16.012.
[20] 吴波, 任静, 杨妍, 等. 薄荷油-羟丙基-β-环糊精包合物的制备与验证[J]. 中国实验方剂学杂志, 2013, 19(11): 25-27. DOI:10.11653/syfj2013110025.
[21] RAJA G, SHAKER I A, SWAMINATHAN R, et al. Phytochemical screening and reducing power assay of nut extracts of Juglans regia L.[J]. International Journal of Chemical and Life Sciences, 2017, 1(1): 1026-1032.
[22] POURMORTAZAVI S M, TAGHDIRI M, MAKARI V, et al.Reducing power of Eucalyptus oleosa leaf extracts and green synthesis of gold nanoparticles using the extract[J]. International Journal of Food Properties, 2017, 20(5): 1097-1103. DOI:10.1080/10942912.201 6.1203334.
[23] GUO S, DENG Q, XIAO J, et al. Evaluation of antioxidant activity and preventing DNA damage effect of pomegranate extracts by chemiluminescence method[J]. Journal of Agricultural and Food Chemistry, 2007, 55(8): 3134-3140. DOI:10.1021/jf063443g.
[24] CHEN W, ZHU Q, XIA Q, et al. Reactive oxygen species scavenging activity and DNA protecting effect of fresh and naturally fermented coconut sap[J]. Journal of Food Biochemistry, 2011, 35(5): 1381-1388. DOI:10.1111/j.1745-4514.2010.00506.x.
[25] BULUS T, DAVID S I, BILBIS L S, et al. In vitro antioxidant activity of n-butanol extract of Curcuma longa and its potential to protect erythrocytes membrane against osmotic-induced haemolysis[J].Science World Journal, 2017, 12(1): 13-17.
[26] ALVAREZ-SUAREZ J M, GIAMPIERI F, GONZÁLEZPARAMÁS A M, et al. Phenolics from monofloral honeys protect human erythrocyte membranes against oxidative damage[J]. Food and Chemical Toxicology, 2012, 50(5): 1508-1516. DOI:10.1016/j.fct.2012.01.042.
[27] LEE M, NARAYANAN S, MCGEER E G, et al. Aurin tricarboxylic acid protects against red blood cell hemolysis in patients with paroxysmal nocturnal hemoglobinemia[J]. PLoS ONE, 2014, 9(1):e87316. DOI:10.1371/journal.pone.0087316.
[28] CHOI J, KANG H J, KIM S Z, et al. Antioxidant effect of astragalin isolated from the leaves of Morus alba L. against free radicalinduced oxidative hemolysis of human red blood cells[J]. Archives of Pharmacal Research, 2013, 36(7): 912-917. DOI:10.1007/s12272-013-0090-x.
[29] KIM J D, LEE O H, LEE J S, et al. Safety effects against nitrite and nitrosamine as well as anti-mutagenic potentials of kale and Angelica keiskei vegetable juices[J]. Journal of the Korean Society of Food Science and Nutrition, 2014, 43(8): 1207-1216. DOI:10.3746/jkfn.2014.43.8.1207.
[30] ZHANG C, WANG Y, WU G, et al. Study on scavenging and disconnecting effects of nitrosation reaction by extracts of tetradium ruticarpum and glycyrrhizae[J]. Agricultural Science & Technology,2014, 15(6): 970-976. DOI:10.16175/j.cnki.1009-4229.2014.06.023.
Antioxidant Activity and Nitrosamine Synthesis-Inhibiting Effect of Inclusion Complex of Essential Oil from Alpinia oきcinarum Hance with Hydroxypropyl-β-cyclodextrin
ZHONG Saiyi, LIU Shouchun, CHEN Jianping, SU Weiming, CHEN Suhua, LIU Hai, QIN Xiaoming
(Guangdong Provincial Modern Agricultural Science and Technology Innovation Center for Subtropical Fruit and Vegetable Processing,College of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524088)
Abstract:In this study, we compared the saturated water solution and ultrasonic methods for the preparation of inclusion complexes of essential oil from Alpinia officinarum Hance with hydroxypropyl-β-cyclodextrin (HP-β-CD). The two methods were evaluated in terms of inclusion eきciency and yield. The inclusion complexes were structurally characterized by microscopy, thin layer chromatography, Fourier transform infrared spectroscopy and ultraviolet (UV) spectroscopy.The hydroxyl radical and 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity and reducing power were determined as well as the inhibitory effect on DNA damage, UV-induced hemolysis of red blood cell (RBC) and nitrosamine synthesis. The results showed that the saturated water solution method was considered superior to the ultrasound method,effectively including essential oil into HP-β-CD with little change in chemical constituents. The essential oil and its inclusion complexes had signif i cant hydroxyl and DPPH radical scavenging capacity and high reducing power and were able to protect against DNA damage and inhibit UV-induced hemolysis of RBC and nitrosamine synthesis. The antioxidant ability and the inhibitory effect on nitrosamine synthesis of the essential oil were improved signif i cantly after inclusion (P < 0.05).
Keywords:essential oil of Alpinia officinarum Hance; hydroxypropyl-β-cyclodextrin; inclusion complex; antioxidant activity; inhibition of nitrosamine synthesis
ZHONG Saiyi, LIU Shouchun, CHEN Jianping, et al. Antioxidant activity and nitrosamine synthesis-inhibiting effect of inclusion complex of essential oil from Alpinia oきcinarum Hance with hydroxypropyl-β-cyclodextrin[J]. Food Science, 2018,39(19): 120-127. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819019. http://www.spkx.net.cn
钟赛意, 刘寿春, 陈建平, 等. 高良姜油-羟丙基-β-环糊精包合物的抗氧化活性及抑制亚硝胺合成作用[J]. 食品科学,2018, 39(19): 120-127. DOI:10.7506/spkx1002-6630-201819019. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0120-08
文献标志码:A
中图分类号:TS201.2
DOI:10.7506/spkx1002-6630-201819019
第一作者简介:钟赛意(1979—),男,副教授,博士,主要从事食品功能因子的研究与开发。E-mail:zsylxc@126.com
广东省高等教育“创新强校工程”科研项目(GDOU2013050214;GDOU2013050244)
基金项目:广东省公益研究与能力建设专项(2015A020209166;2015A020209165);
收稿日期:2017-08-11