表 1 qPCR引物
Table 1 Primer sequences used for qPCR
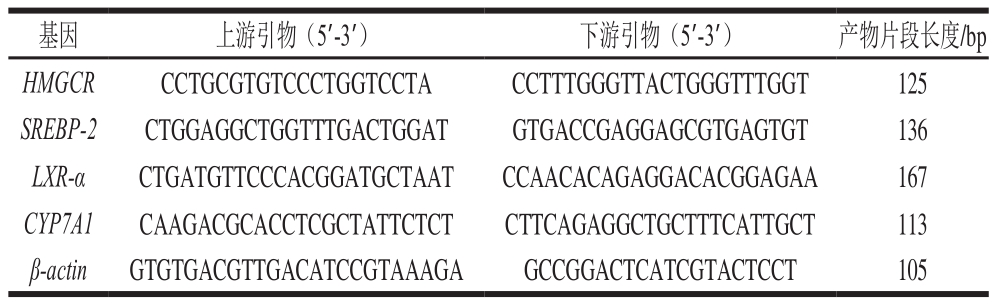
注:HMGCR.羟甲基戊二酸单酰辅酶A还原酶(hydroxymethylglutaryl CoA reductase);SREBP-2.胆固醇调节结合蛋白(sterol-regulatory element binding protein)2;LXR-α.肝脏X受体α(liver X receptor α);CYP7A1.胆固醇7α羟化酶(cholesterol 7α-hydroxylase)。
葛 建,林 芳,张永勇,邓同乐,胡华军,刘 军
(中国计量大学生命科学学院,浙江 杭州 310018)
摘 要:目的:探讨表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)对大鼠胆固醇代谢的影响及相关机制。方法:在建立Caco-2细胞和大鼠肝细胞培养以及Wistar大鼠高脂模型基础上,研究胆汁酸跨膜转运抑制、胆固醇摄取和外排、血清胆固醇水平变化以及胆固醇代谢相关基因表达水平,探讨EGCG对大鼠胆固醇代谢可能的调节机制。结果:EGCG显著抑制甘氨胆酸钠和牛磺胆酸钠在Caco-2细胞内的跨膜转运(P<0.05);显著干预Caco-2细胞对胆固醇的摄取(P<0.05),同时增强胆固醇在大鼠肝细胞中的外排。动物实验结果表明:EGCG组大鼠血清中总胆固醇、甘油三酯及低密度脂蛋白胆固醇浓度与模型组相比显著下降(P<0.05),高密度脂蛋白胆固醇浓度明显升高(P<0.05);肝脏苏木精-伊红染色显示EGCG组大鼠肝细胞脂肪变性程度降低;与模型组相比,EGCG组大鼠肝脏中羟甲基戊二酸单酰辅酶A还原酶表达水平较低;胆固醇调节结合蛋白2、肝脏X受体α和胆固醇7α羟化酶基因表达水平显著升高(P<0.05)。结论:EGCG对体内胆固醇代谢的调节机制与其抑制肠道胆汁酸重吸收、干扰胆固醇摄取、增强肝脏胆固醇外排以及调控相关基因表达有关,EGCG对胆固醇代谢具有综合调节功能。
关键词:表没食子儿茶素没食子酸酯;胆汁酸重吸收;胆固醇摄取;胆固醇外排;调节机制
植物多酚是多羟基酚类化合物的总称,是广泛存在于植物体内的植物次生代谢物质,具有抗肿瘤、降血脂、清除自由基、降血糖等一系列重要的药理功能[1]。茶多酚为茶叶中含量最多的一类活性成分,约占茶叶干质量的20%,而其中又以表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)含量最高,约占儿茶素总量的50%~60%[2]。
关于EGCG调控脂质代谢机制方面的研究,国内外学者从不同角度对非华人分别进行了探索。Kobayashi[3]、Raederstorff[4]和Wu[5]等分别从EGCG影响胃肠道中胆固醇微粒溶解性、抑制食物中脂质成分吸收以及EGCG与低密度脂蛋白(low-density lipoprotein,LDL)结合角度探索了EGCG对胆固醇代谢的调控机理。王玮[6]、刘智伟[7]等分别从绿茶多酚(主要成分为EGCG)对肠道双歧杆菌和人源化小鼠肠道菌群影响的角度探讨了绿茶多酚对机体脂质代谢的调节机制。本课题组前期从EGCG对胆汁酸体外吸附角度探索了其降血脂活性[8],但是相关机制未进一步阐明。由于大剂量腹腔注射EGCG能够导致肝损伤[9],本研究以人结肠癌细胞(Caco-2)模型和动物灌胃途径,从体外胆汁酸重吸收和胆固醇摄取以及体内相关基因表达角度,探索EGCG调控血脂的机制。
机体内胆酸盐是胆固醇的主要去路,EGCG通过与胆汁酸吸附,阻止胆酸盐的重吸收,促使肝脏中的胆固醇转化为胆汁酸,从而达到降血脂的目的[10]。Kahlon等于2004—2007年持续开展了不同水果、蔬菜在体外吸附胆酸盐能力的研究[11-13]。胡凯[14]、邓雪[15]等探讨了不同茶叶粉末、茶叶水提液以及茶多酚等对胆酸盐的结合能力。但是此类研究只是从体外胆汁酸吸附的角度来探索调血脂机制,而关于EGCG通过干预胆汁酸重吸收和胆固醇跨膜转运调控脂质代谢机制的研究还鲜见报道。因此,本研究在前期研究基础上开展深入探索,从而探讨EGCG对胆固醇代谢的调控机制。
SPF级Wistar雄性大鼠,体质量(181±10)g,购于浙江省医学科学院实验动物中心,许可证号:SCXK(浙)20140001,于杭州师范大学实验动物中心饲养。
EGCG(纯度98%以上) 杭州和田生物技术有限公司;牛磺胆酸钠(sodium taurocholic,STC)、甘氨胆酸钠(sodium glycocholate,SGC)标准品(纯度98%以上) 杭州邦易化工有限公司;甲醇、乙腈(色谱纯) 杭州米克化工有限公司;Caco-2细胞、大鼠肝细胞(BRL) 中国科学院上海细胞典藏委员会;高糖DMEM细胞培养液(含1%非必需氨基酸、1%L-谷氨酰胺、1%双抗和10%胎牛血清) 海克隆生物化学制品(北京)有限公司;荧光标记胆固醇(NBD-胆固醇) 阿拉丁(上海)生物试剂有限公司;实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,qPCR)试剂盒 上海生工生物工程有限公司;包埋石蜡 德国徕卡公司;BCA定量试剂盒 上海碧云天生物技术有限公司;总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglycerides,TG)试剂盒、LDL胆固醇(LDL-cholesterol,LDL-C)试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒 南京建成生物工程研究所;化学发光显色(electro-chemi-luminescence,ECL)试剂盒 美国GE公司。
LC-20ATvp高效液相色谱系统 日本岛津公司;细胞培养箱 德国Binder公司;Trans-well小室 美国Corning公司;MK-3台式荧光检测仪 荷兰雷勃生物医学有限公司;倒置显微镜 日本尼康公司。
1.3.1 EGCG对SGC和STC在Caco-2细胞跨膜转运中的影响
1.3.1.1 标准曲线的绘制
根据文献[16]略作修改,本实验采用空白HBSS(Hank’s balanced salt solution)缓冲液分别配制浓度为0.05~1.20 mmol/L的SGC和STC的混合溶液。将不同浓度的STC和SGC采用高效液相色谱检测,相应标准曲线方程分别为Y=380 726X+803和Y=630 372X-1 171。STC与SGC的峰面积与浓度之间的线性相关系数分别为0.999 7、0.999 8,说明线性关系良好。日内和日间相对标准偏差均低于10%,说明精密度较好。
1.3.1.2 Caco-2细胞的培养
Caco-2细胞于充有5%二氧化碳的培养箱中培养,待细胞长势良好,取出无菌Trans-well小室(聚碳酸酯膜,孔径0.4 μm)置于6 孔培养板的中间部位并做好标记。取出细胞,加适量消化液,倒置生物显微镜下观察细胞形态,加适量新鲜培养基,用灭菌后的胶头滴管吹打培养瓶,将细胞吹打至培养基中,混匀,调整密度为1×105个/mL。
每个小室细胞单层膜顶端(apical side,AP)侧加1.5 mL细胞悬液,基底端(basolateral side,BL)侧加2.5 mL空白培养液,十字晃动后放入培养箱中。隔一天换液1 次,1 周后每天更换培养液,21 d后待细胞基本汇合,检测其电阻值、苯酚红渗漏性以及小室AP和BL侧碱性磷酸酶活力,以此判断Caco-2单层细胞完整性、苯酚红渗透率以及细胞极性[16]。
1.3.1.3 样品收集和检测
取跨膜电阻值200 Ω/cm2以上、苯酚红渗透率10%以上以及AP侧碱性磷酸酶活性10 倍于BL侧的Trans-well小室细胞模型,实验前用预热的HBSS缓冲液清洗细胞3 次,最后1 次于培养箱中孵育0.5 h,轻轻吸去缓冲液,洗去Caco-2细胞表面杂质。重吸收实验设立3 组,分别为空白对照组(只加空白HBSS缓冲液)、胆酸盐+HBSS组(加入用HBSS缓冲液稀释的胆酸盐溶液)和胆酸盐+EGCG组(加入胆酸盐溶液和EGCG溶液混合液)。将EGCG用HBSS缓冲液配成2 mg/mL的溶液;用HBSS缓冲液配制2 种含胆酸盐的混合溶液,浓度分别为5.0 mmol/L和0.5 mmol/L。按体积比1∶1将上述EGCG溶液和胆酸盐溶液混合,使最终EGCG质量浓度为1 mg/mL、胆酸盐浓度分别为2.5 mmol/L和0.25 mmol/L。分别吸取1.5 mL HBSS缓冲液/胆酸盐混合液/EGCG+胆酸盐混合液加入AP侧作为供给侧,同时BL侧加入2.5 mL HBSS缓冲液作为受体侧。将细胞培养板置于37 ℃、50 r/min的恒温振荡器中孵育。分别于0、2、4 h和8 h吸取BL侧100 μL溶液于已标记离心管中,同时补充相同体积的HBSS缓冲液。按照1.3.1.1节方法利用高效液相色谱分析,将所得胆酸盐峰面积代入相应标准曲线方程,得出培养液中胆酸盐浓度,以培养液中胆酸盐浓度乘以培养液体积计算不同时间内胆酸盐的渗透量。
1.3.2 EGCG对胆固醇在细胞内摄取和外排的影响
根据文献[17-18]的方法略有修改,将1×105个/mL的Caco-2细胞和BRL细胞悬液3 mL分别加入相应6 孔培养板中,在37 ℃、5% CO2培养箱中用浓度为0、40 μmol/L的EGCG的10%胎牛血清培养液干预24 h后换液,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗后用10%胎牛血清培养液(含5 μmol/L NBD-胆固醇)孵育4 h,再用含浓度为0、40 μmol/L的EGCG的10%胎牛血清培养液培养4 h。孵育结束后,用PBS清洗3 遍,然后用0.1% Triton X-100裂解细胞,吸取200 μL细胞裂解液于黑色酶标板中,采用荧光酶标仪在激发波长469 nm、发射波长537 nm处测定荧光强度。同时测定细胞裂解液中蛋白质含量,以蛋白质含量校正裂解液中荧光强度,荧光强度与胆固醇含量成正比,根据荧光强度判断胆固醇的摄取和外排。
1.3.3 EGCG对高脂模型大鼠胆固醇代谢的影响
1.3.3.1 大鼠分组及血脂水平测定
将18 只大鼠随机分为3 组:正常组、高脂模型组、EGCG干预组,适应性养殖1 周后,除对照组继续饲喂普通饲料外,余下2 组饲喂高脂饲料(配方(以质量分数计):74%基础饲料、15%猪油、10%蛋黄粉、1%胆固醇)。同时,EGCG组以200 mg/kg剂量EGCG灌胃,对照组和高脂模型组以相应体积的生理盐水灌胃,1 次/d,连续6 周。分别于第0、3、6周眼静脉丛取血,采用试剂盒检测不同时间段血清中TC、TG、LDL-C和HDL-C浓度。
1.3.3.2 大鼠体质量和肝脏指数测定
不同实验组大鼠每周称质量一次,第6周处死后剥离大鼠肝脏,吸干表面血迹,同时立即称质量。分离大鼠血清置于-80 ℃冰箱保存,分别用于血脂和胆汁酸含量测定,部分肝脏于液氮保存,用于基因表达水平检测。肝脏指数为肝脏质量与体质量之比。
1.3.3.3 大鼠肝脏细胞结构变化观察
将大鼠肝脏切除左侧叶边缘部分,于体积分数10%福尔马林溶液中固定48 h,然后依次经85%(体积分数,下同)乙醇(1 次)、95%乙醇(4 次)、100%乙醇(2 次)、二甲苯(2 次)、石蜡(3 次)脱水,石蜡包埋、切片,制备5 μm厚石蜡切片,脱蜡水化,苏木精-伊红(hematoxylin and eosin,HE)染色后光学显微镜下观察细胞结构变化。
1.3.3.4 大鼠肝脏胆固醇代谢相关基因及蛋白的表达
利用试剂盒进行大鼠肝脏总RNA的提取,采用RNA逆转录酶试剂盒进行mRNA逆转录实验,严格按照说明书操作。相关基因和内参基因引物见表1,采用20 μL体系:cDNA 1.0 μL、引物1 0.5 μL、引物2 0.5 μL、SYBR Green Master Mix 10 μL、超纯水8 μL。程序为:95 ℃、1 min;95 ℃、15 s,63 ℃、25 s,40 个循环。收集荧光,每个样品重复3 次,各个基因的相对表达量以2(Ct(内参基因)-Ct(目的基因))进行计算,分析实验组与对照组肝脏中相关胆固醇代谢基因的表达差异。
表 1 qPCR引物
Table 1 Primer sequences used for qPCR

注:HMGCR.羟甲基戊二酸单酰辅酶A还原酶(hydroxymethylglutaryl CoA reductase);SREBP-2.胆固醇调节结合蛋白(sterol-regulatory element binding protein)2;LXR-α.肝脏X受体α(liver X receptor α);CYP7A1.胆固醇7α羟化酶(cholesterol 7α-hydroxylase)。
将肝脏组织剪碎、裂解后,高速冷冻离心,分离上清液于超低温冰箱保存。按照BCA定量试剂盒说明书方法建立标准曲线,并计算样品中总蛋白质量浓度。分别进行聚丙烯酰胺凝胶电泳、转膜、封闭、一抗孵育、洗膜、二抗孵育、洗膜后采用ECL试剂盒反应,移入凝胶成像分析仪中,化学光敏模式曝光显影。
所有检测数据结果采用 ±s表示,采用SPSS 11.5软件进行单因素方差分析(One-way ANOVA),P<0.05表示差异显著。
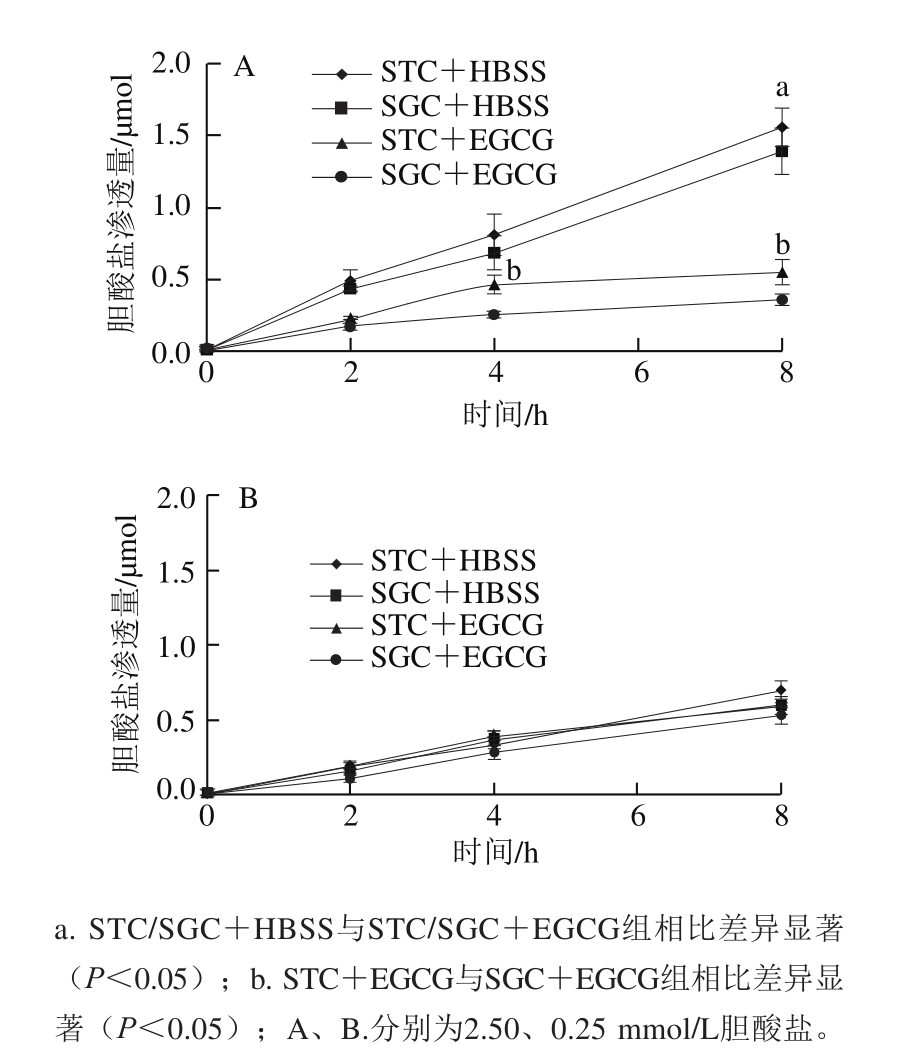
图 1 EGCG对胆酸盐SGC和STC在Caco-2细胞跨膜转运的影响
Fig. 1 Effect of EGCG on transport of SGC and STC across Caco-2 cells
如图1所示,胆汁酸高浓度(2.50 mmol/L)组EGCG能够显著抑制SGC和STC从Trans-well小室AP侧进入BL侧(P<0.05);同时,在4 h和8 h时,EGCG对SGC的抑制水平显著强于对STC的抑制(P<0.05);而胆汁酸低浓度(0.25 mmol/L)组EGCG对胆汁酸重吸收影响不显著(P>0.05)。
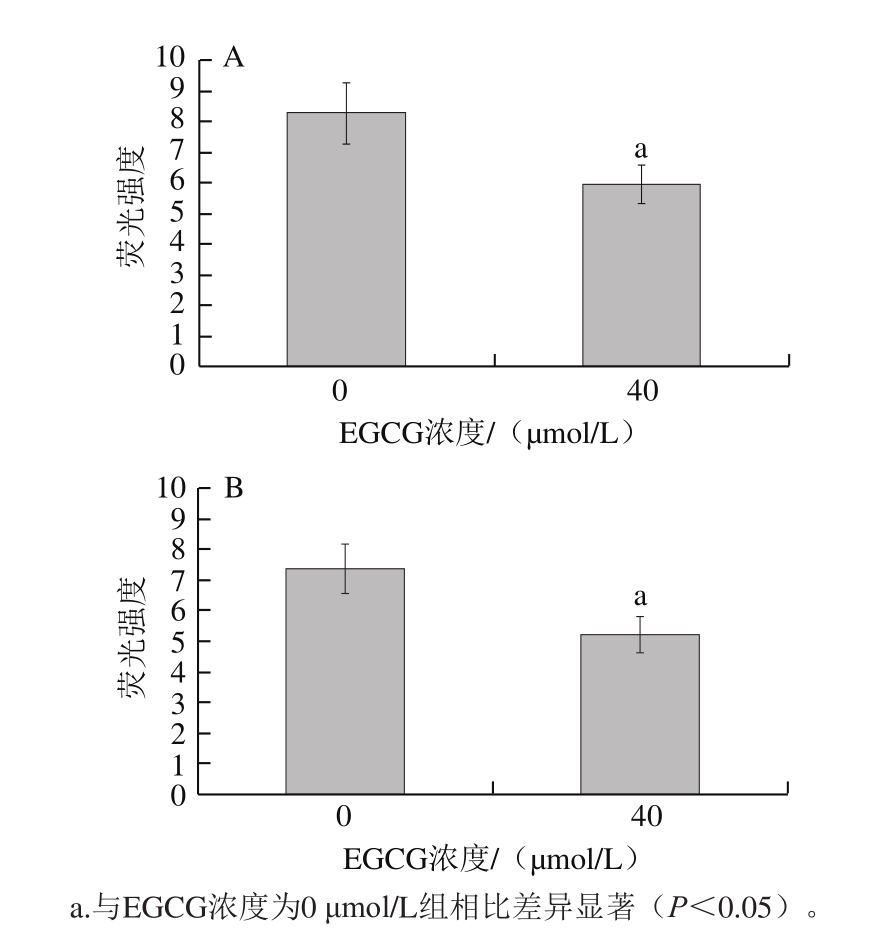
图 2 EGCG对胆固醇在Caco-2细胞(A)和BRL细胞(B)中内流和外排的影响
Fig. 2 Effect of EGCG on cholesterol inf l ux in Caco-2 cells (A) and cholesterol eff l ux from BRL cells (B)
由图2A可见,在Caco-2细胞内,与EGCG浓度为0 μmol/L组相比,EGCG浓度为40 μmol/L组细胞裂解液中荧光强度显著降低(P<0.05),说明EGCG能够显著抑制Caco-2细胞对胆固醇的摄取。由图2B可见,BRL细胞内,与EGCG浓度为0 μmol/L组相比,EGCG浓度为40 μmol/L组荧光强度显著降低(P<0.05),说明EGCG能够显著抑制BRL细胞对胆固醇的摄取。
2.3.1 EGCG对大鼠体质量和肝脏指数的影响分析
表 2 大鼠体质量、肝质量和肝脏指数
Table 2 Mean body mass, liver mass and liver index in rats

注:a.与正常组相比差异显著(P<0.05);b.与高脂模型组相比差异显著(P<0.05)。表3、4同。
由表2可见,第3、6周高脂模型组大鼠体质量显著高于正常组,而EGCG组体质量显著下降。肝质量测定结果显示,模型组大鼠肝质量高于正常组,EGCG组大鼠肝质量有所下降,但各组间差异不显著。模型组大鼠肝脏指数高于正常组,但差异不显著。
2.3.2 EGCG对大鼠血脂水平影响分析
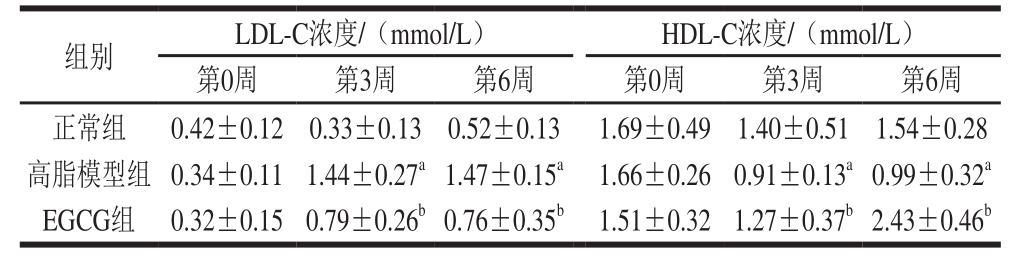
与高脂模型组相比,第6周EGCG组大鼠血清中TC、LDL-C、TG浓度显著降低,HDL-C浓度显著升高(P<0.05),结果见表3、4。
表 3 大鼠血清中TC和TG浓度
Table 3 Serum levels of TC and TG in rats
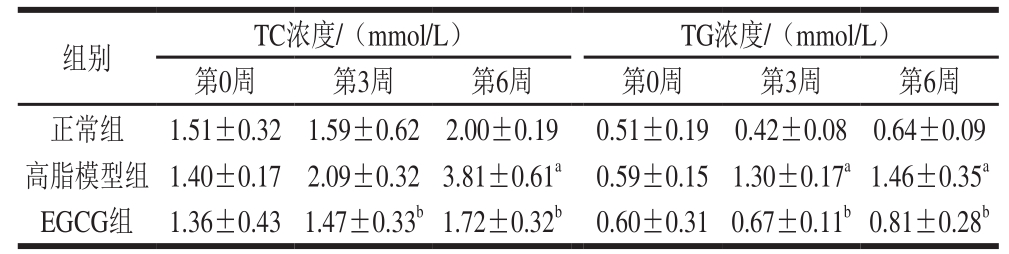
表 4 大鼠血清中LDL-C和HDL-C浓度
Table 4 Serum levels of LDL-C and HDL-C in rats
2.3.3 大鼠肝脏细胞结构变化观察结果
HE染色结果显示,正常组大鼠肝小叶结构完整,肝细胞呈现条索状排列,细胞结构清晰(图3A)。高脂模型组肝细胞内有脂质染色,肝小叶轮廓模糊,肝细胞排列紊乱(图3B)。EGCG组肝小叶与高脂模型组相比结构相对完整,肝细胞清晰,细胞内脂质减少(图3C)。
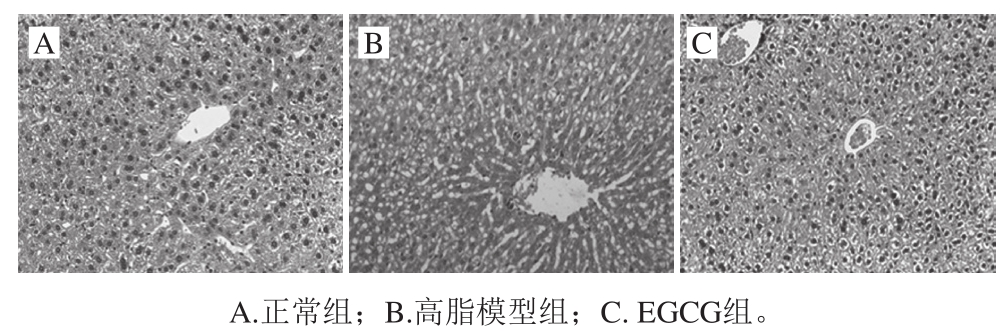
图 3 不同处理组肝脏HE染色
Fig. 3 Hematoxylin and eosin staining of liver tissues from different groups
2.3.4 EGCG对大鼠胆固醇代谢相关基因表达的影响分析
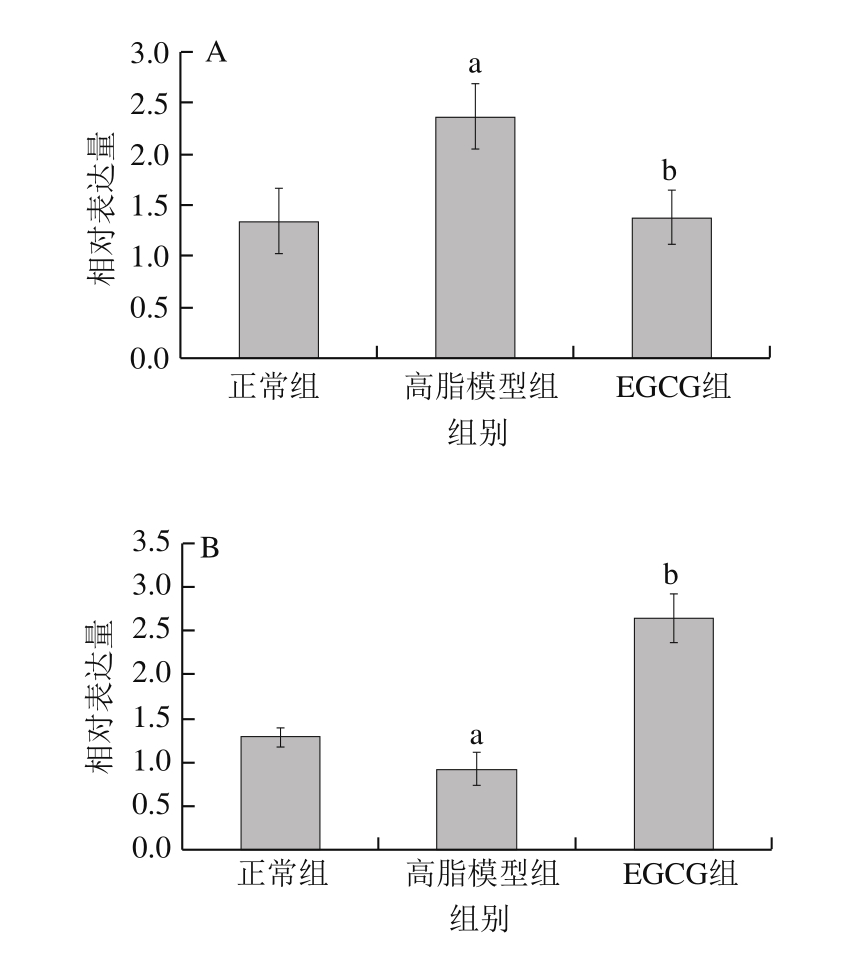
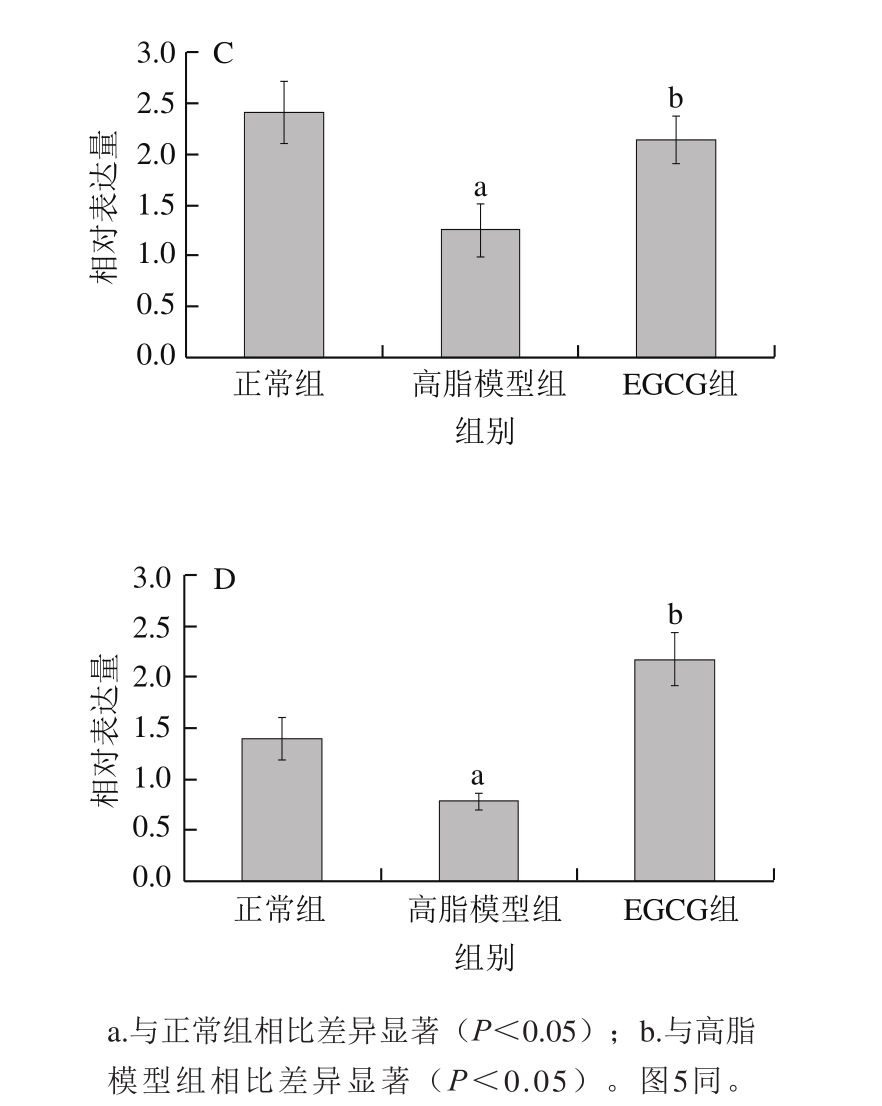
图 4 EGCG对胆固醇代谢基因HMGCR(A)、SREBP-2(B)、LXR-α(C)和CYP7A1(D)mRNA表达水平的影响
Fig. 4 Effect of EGCG on mRNA expression levels of HMGCR (A),SREBP-2 (B), LXR-α (C) and CYP7A1 (D)
由图4可知,与正常组相比,高脂模型组HMGCR表达明显升高,SREBP-2、LXR-α及CYP7A1表达则显著下降(P<0.05);与高脂模型组相比,EGCG组HMGCR表达显著降低,SREBP-2、LXR-α及CYP7A1表达显著升高(P<0.05)。如图5所示,不同处理组大鼠上述4 种基因的蛋白水平变化趋势与qPCR结果相同。

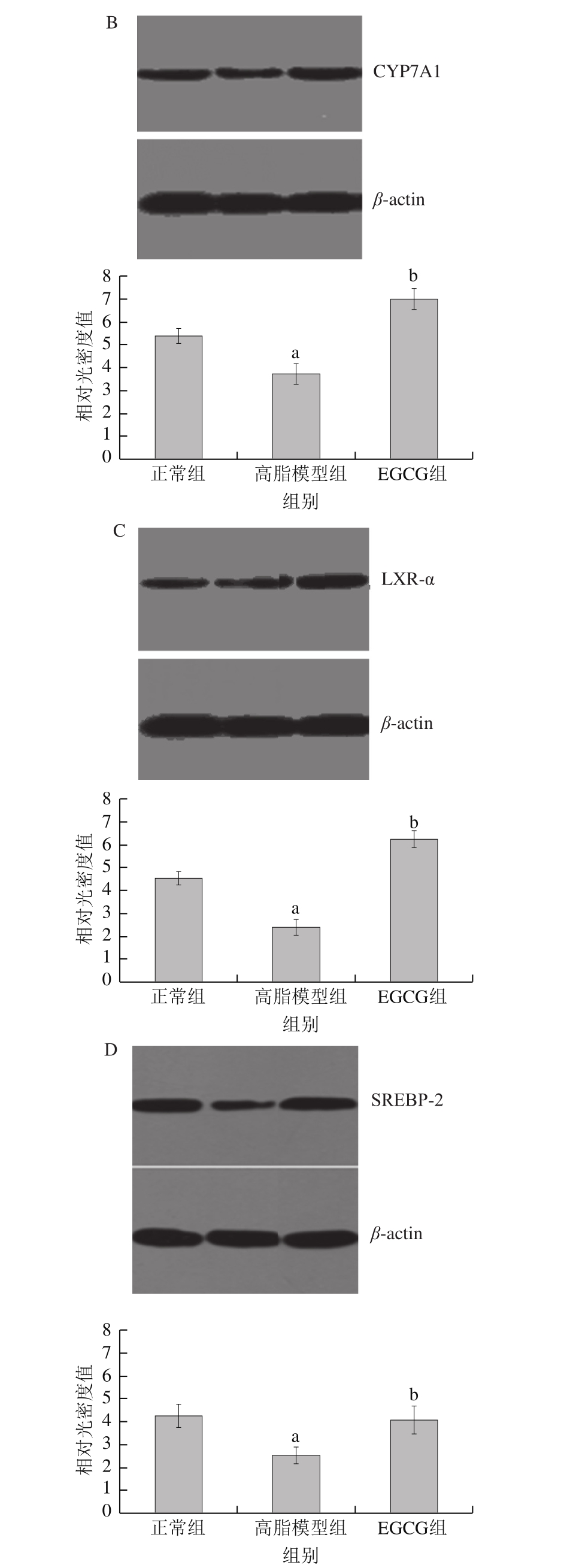
图 5 EGCG对胆固醇代谢基因HMGCR(A)、CYP7A1(B)、LXR-α(C)和SREBP-2(D)蛋白表达的影响
Fig. 5 Effect of EGCG on protein expression levels of HMGCR (A),CYP7A1 (B), LXR-α (C) receptor and SREBP-2 (D)
本实验利用Caco-2细胞模型研究了EGCG对SGC和STC跨膜转运的影响,通过体外细胞模型探索了EGCG调血脂的可能机制。根据胆汁酸的肠肝循环机制,胆汁酸在十二指肠分泌后,在空肠中通过被动扩散重吸收,在回肠通过载体蛋白进行主动重吸收,通过肝门静脉重新回到肝脏中。如果此环节受阻,将会反馈性加速胆汁酸分泌,进而增强肝脏中胆固醇向胆汁酸的转变,起到降胆固醇的作用[19]。本研究结果显示EGCG能够显著抑制高浓度(2.50 mmol/L)胆酸盐跨膜转运,而其对低浓度(0.25 mmol/L)胆酸盐跨膜转运抑制效果不显著,说明胆汁酸在Caco-2细胞中既有被动吸收又有主动吸收。胆酸盐浓度较高时,胆汁酸转运蛋白被饱和,EGCG主要通过与胆汁酸的氢键结合影响其被动转运过程;胆酸盐浓度较低时,胆汁酸转运蛋白未饱和,EGCG与胆汁酸氢键结合对主动转运影响较弱,此时胆汁酸以主动转运为主。这或许可以解释高脂饮食条件下EGCG能够显著抑制胆汁酸重吸收,而正常或低脂饮食条件下EGCG对血脂影响并不显著的原因。
NBD-胆固醇在Caco-2细胞内摄取和BRL细胞中外排结果显示,EGCG显著抑制了Caco-2细胞对NBD-胆固醇的摄取,使得细胞裂解液中荧光强度显著降低。BRL细胞对胆固醇既有摄取功能又有外排作用,BRL细胞表面LDL受体(LDL receptor,LDL-R)对LDL-C内流摄取,从而加速总胆固醇含量的降低。本研究结果表明EGCG组肝细胞裂解液中荧光强度明显下降,可能是肝细胞对游离胆固醇(NBD-胆固醇)摄取能力减弱或者外排能力增强造成的。
本研究对大鼠肝脏与胆固醇代谢相关的基因表达水平进行检测,结果显示EGCG对肝脏中SREBP-2和CYP7A1以及核受体LXR-α基因表达具有显著增强作用,对HMGCR表达具有显著抑制功能。HMGCR是内源性胆固醇生成限速酶,HMGCR基因的表达降低可以抑制胆固醇合成;CYP7A1为胆固醇向胆汁酸转运的限速酶,而核受体LXR-α对于调控胆固醇ATP结合盒(ATP-binding cassette,ABC)转运子(ABCA1、ABCG5和ABCG8)具有显著作用[20-22],这与BRL细胞对NBD-胆固醇外排能力增强的结果一致。血清LDL-C含量受肝细胞表面LDL-R调控,而LDL-R又受SREBP-2调控,SREBP-2使LDL-R表达增多,因此SREBP-2表达的提高能够引起肝细胞对胆固醇摄取的增加,降低体内LDL-C含量,从而发挥降血脂活性[23]。
有文献报道绿茶多酚和高脂饮食对机体肠道菌群均具有显著影响[6-7,24-25],机体肠道菌群的改变能够影响胆汁酸代谢过程,而体内胆汁酸含量的改变反过来又能够影响肠道菌群结构,因此,肠道菌群与机体脂质代谢紧密相关[26]。本研究虽然对EGCG调控胆固醇代谢方面进行了探索,但尚有一些问题难以解释,比如EGCG对小肠上皮细胞中胆汁酸转运体影响如何,以及EGCG通过何种途径干预胆汁酸跨膜转运,尚需进一步研究。此外,由于EGCG体内生物利用度较低和易于代谢[27-29],其对大鼠肝脏中胆固醇代谢相关基因表达的影响是通过何种途径或机制发挥作用,以及胆汁酸和肠道菌群在降血脂过程中是否与EGCG发挥协同作用,尚需更加深入的探索。
参考文献:
[1] 王旗, 刘恩岐. 植物多酚的研究现状[J]. 山西农业科学, 2009, 36(1):92-94. DOI:10.3969/j.issn.1002-2481.2009.01.025.
[2] 陈义, 汪小钢, 宛晓春. 没食子儿茶素没食子酸酯制备新工艺的研究[J]. 安徽农业大学学报, 2007, 34(3): 364-368. DOI:10.3969/j.issn.1672-352X.2007.03.012.
[3] KOBAYASHI M, NISHIZAWA M, INOUE N, et al. Epigallocatechin gallate decreases the micellar solubility of cholesterol via specific interaction with phosphatidylcholine[J]. Jounal of Agricultral and Food Chemisty, 2014, 62: 2881-2890. DOI:10.1021/jf405591g.
[4] RAEDERSTORFF D G, SCHLACHTER M F, ELSTE V, et al. Effect of EGCG on lipid absorption and plasma lipid levels in rats[J]. Journal of Nutritional Biochemistry, 2003, 14(6): 326-332. DOI:10.1016/S0955-2863(03)00054-8.
[5] WU C H, YEH C T, YEN G C. Epigallocatechin gallate (EGCG)binds to low-density lipoproteins (LDL) and protects them from oxidation and glycation under high-glucose conditions mimicking diabetes[J]. Food Chemistry, 2010, 121(3): 639-644. DOI:10.1016/j.foodchem.2010.02.008.
[6] 王玮, 曾本华, 李桂花, 等. 茶多酚对ApoE-/-小鼠脂类代谢和肠道双歧杆菌的影响[J]. 食品与机械, 2012, 28(4): 106-109.DOI:10.3969/j.issn.1003-5788.2012.04.029.
[7] 刘智伟, 曾本华, 张晓婧, 等. 茶多酚饮食对HFA小鼠肠道菌群和脂肪代谢的影响[J]. 中国食品学报, 2015, 15(6): 26-31. DOI:10.16429/j.1009-7848.2015.06.003.
[8] 王玉洁, 葛建, 杨斌英, 等. 儿茶素EGCG对胆汁酸的结合及调控脂质代谢研究[J]. 食品科技, 2016, 41(2): 228-232.
[9] 葛建, 刘洋, 王梦馨, 等. 表没食子儿茶精的小鼠急性肝损伤和代谢动力学的性别差异[J]. 中国药理学与毒理学杂志, 2014, 28(1): 74-80. DOI:10.3867/j.issn.1000-3002.2014.01.012.
[10] 张久聪, 聂青和. 胆汁酸代谢及相关进展[J]. 胃肠病学和肝病学杂志, 2008, 17(11): 953-956. DOI:10.3969/j.issn.1006-5709.2008.11.027.
[11] KAHLON T S, SMITH G E. In vitro binding of bile acids by blueberries (Vaccinium spp.), plums (Prunus spp.), prunes (Prunus spp.), strawberries (Fragaria Xananassa), cherries (Malpighia punicifolia), cranberries (Vaccinium macrocarpon) and apples(Malus sylvestris)[J]. Food Chemistry, 2007, 100(3): 1182-1187.DOI:10.1016/j.foodchem.2005.10.066.
[12] KAHLON T S, SHAO Q. In vitro binding of bile acids by soy bean(Glycine max), black eye bean (Vigna unguiculata), garbanzo (Cicer arietinum) and lima bean (Phaseolus lunatus)[J]. Food Chemistry,2004, 86(3): 435-440. DOI:10.1016/j.foodchem.2003.09.018.
[13] KAHLON T S, CHAPMAN M H, SMITH G E. In vitro binding of bile acids by spinach, kale, brussels sprouts, broccoli, mustard greens,green bell pepper, cabbage and collards[J]. Food Chemistry, 2007,100(4): 1531-1536. DOI:10.1016/j.foodchem.2005.12.020.
[14] 胡凯. 茶叶功能性成分体外降血脂的机理研究[D]. 广州: 华南理工大学, 2011: 34-43.
[15] 邓雪, 黄惠华. 茶花浸提物及其功能性成分结合胆酸盐的效果探讨[J].食品科技, 2013, 38(1): 199-205.
[16] 来丽华, 葛建. 葡萄籽原花青素对胆汁酸盐在结肠腺细胞Caco-2中转运的影响[J]. 中国药房, 2017, 28(10): 1323-1325. DOI:10.6039/j.issn.1001-0408.2017.10.07.
[17] SONG W, WANG W, WANG Y, et al. Characterization of fl uorescent NBD-cholesterol eff l ux in THP-1-derived macrophages[J].Molecular Medicine Reports, 2015, 12(4): 5989-5996. DOI:10.3892/mmr.2015.4154.
[18] 宋玮, 王伟, 王雨, 等. 荧光标记胆固醇用于测量人巨噬细胞脂质外流新方法[J]. 中国动脉硬化杂志, 2012, 20(8): 749-754.
[19] 查龙应, 许梓荣, 王敏奇. Caco-2细胞模型及其在营养素小肠吸收机理研究中的应用[J]. 动物营养学报, 2006, 18(3): 215-222.DOI:10.3969/j.issn.1006-267X.2006.03.013.
[20] LIANG Y T, WONG W T, GUAN L, et al. Effect of phytosterols and their oxidation products on lipoprotein prof i les and vascular function in hamster fed a high cholesterol diet[J]. Atherosclerosis, 2011, 219:124-133. DOI:10.1016/j.atherosclerosis.2011.06.004.
[21] 丁琳, 王丹, 薛勇, 等. 无斑鹞鲼蛋白质对大鼠胆固醇代谢的影响[J]. 食品科学, 2016, 37(1): 189-193. DOI:10.7506/spkx1002-6630-201601033.
[22] 王蕾, 蔡劬, 蒋兆彦, 等. 肝脏X受体α对肝细胞HepG2胆固醇代谢基因表达的调控[J]. 内科理论与实践, 2010, 5(2): 165-169.
[23] WEBER L W, BOLL M, STAMPFL A. Maintaining cholesterol homeostasis: sterol regulatory element-binding proteins[J]. World Journal of Gastroenterology, 2004, 10(21): 3081-3087. DOI:10.3748/wjg.v10.i21.3081.
[24] 陈杏云, 曾本华, 魏泓, 等. 高脂饮食对菌群人源化小鼠肠道菌群结构的影响[J]. 食品科学, 2013, 34(17): 278-283. DOI:10.7506/spkx1002-6630-201317059.
[25] 张鑫, 马丽苹, 张芸, 等. 茶叶儿茶素对肠道微生态的调节作用[J].食品科学, 2013, 34(5): 232-237.
[26] VELAGAPUDI V R, HEZAVEH R, REIGSTAD C S, et al. The gut microbiota modulates host energy and lipid metabolism in mice[J]. Journal of Lipid Research, 2010, 51(5): 1101-1112. DOI:10.1194/jlr.M002774.
[27] LIN L C, WANG M N, TSENG T Y, et al. Pharmacokinetics of(−)-epigallocatechin-3-gallate in conscious and freely moving rats and its brain regional distribution[J]. Journal of Agricultural and Food Chemistry, 2007, 55(4): 1517-1524. DOI:10.1021/jf062816a.
[28] LI C, MENG X F, WINNIK B, et al. Analysis of urinary metabolites of tea catechins by liquid chromatography/electrospray ionization mass spectrometry[J]. Chemical Research in Toxicology, 2001, 14(6): 702-707. DOI:10.1021/tx0002536.
[29] 付婷, 韩国柱. 茶多酚的药动学研究进展[J]. 中草药, 2010, 41(12):2102-2106.
In Vivo and in Vitro Investigation of the Mechanism by Which Epigallocatechin Gallate Regulates Cholesterol Metabolism in Rats
GE Jian, LIN Fang, ZHANG Yongyong, DENG Tongle, HU Huajun, LIU Jun
(College of Life Sciences, China Jiliang University, Hangzhou 310018, China)
Abstract:Objective: This study aimed to clarify the regulatory effect and the mechanism of action of epigallocatechin gallate (EGCG) on cholesterol metabolism in rats. Methods: In vitro cell culture models (Caco-2 cells and BRL hepatocytes)and hyperglycemic rat model were established. In order to determine the possible mechanism for the regulation of cholesterol metabolism in rats by EGCG, the inhibition of bile acids across Caco-2 cell monolayers, the inf l ux and eff l ux of cholesterol, serum cholesterol level and the expression of lipid metabolism-related genes were evaluated. Results: The transport of sodium glycocholate and sodium taurocholate across Caco-2 cell monolayers was significantly inhibited by EGCG (P < 0.05). EGCG also inhibited the inf l ux of cholesterol in Caco-2 and increased the eff l ux of cholesterol from rat hepatocytes. The results of animal tests revealed that serum total cholesterol, triglyceride and low-density lipoprotein cholesterol levels were significantly lower in the EGCG-treated group than in the high-fat diet model group (P < 0.05),while high-density lipoprotein cholesterol levels were signif i cantly higher (P < 0.05). Hematoxylin and eosin staining of the rat liver showed that liver steatosis was signif i cantly attenuated by EGCG (P < 0.05). At the molecular level, the mRNA and protein expression of hydroxy methylglutaryl-CoA reductase were signif i cantly decreased in the EGCG-treated group when compared with the model group, while the mRNA and protein expression levels of sterol regulatory element-binding protein-2, liver X receptor α and cholesterol 7α hydroxylase were signif i cantly increased (P < 0.05). Conclusion: EGCG had multiple regulatory effects on cholesterol metabolism, and the underlying mechanism was attributed to the inhibition of bile acid re-absorption, the blocking of cholesterol inf l ux, and the enhancement of cholesterol eff l ux as well as the regulation of the expression of cholesterol metabolism-related genes.
Keywords:epigallocatechin gallate; reabsorption of bile acid; cholesterol uptake; cholesterol eff l ux; regulation mechanism
DOI:10.7506/spkx1002-6630-201819021. http://www.spkx.net.cn
GE Jian, LIN Fang, ZHANG Yongyong, et al. In vivo and in vitro investigation of the mechanism by which epigallocatechin gallate regulates cholesterol metabolism in rats[J]. Food Science, 2018, 39(19): 134-140. (in Chinese with English abstract)
葛建, 林芳, 张永勇, 等. 表没食子儿茶素没食子酸酯体内外调节大鼠胆固醇代谢的机制[J]. 食品科学, 2018, 39(19):134-140. DOI:10.7506/spkx1002-6630-201819021. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0134-07
文献标志码:A
中图分类号:TS201.4
DOI:10.7506/spkx1002-6630-201819021
第一作者简介:葛建(1979—),男,副教授,博士,研究方向为天然产物及其功能。E-mail:gejian16888@163.com
基金项目:国家自然科学基金青年科学基金项目(31100499);中国博士后科学基金项目(2014M561766)
收稿日期:2017-08-03