 ±s表示,采用SPSS 17.0统计软件进行单因素方差分析,P<0.05表示差异显著具有统计学意义。
±s表示,采用SPSS 17.0统计软件进行单因素方差分析,P<0.05表示差异显著具有统计学意义。刘 想1,付王威2,牛晓琴2,颜雨新1,张贤益2,李文娟2,*
(1.南昌大学医学院,江西 南昌 330008;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:目的:观察黑灵芝多糖对脂多糖(lipopolysaccharide,LPS)诱导小鼠腹腔巨噬细胞M1/M2表型转化的影响。方法:中性红检测巨噬细胞吞噬;流式细胞仪检测细胞活性氧(reactive oxygen species,ROS)和甘露糖受体(mannose receptor,MR)水平;Griess法测定NO水平;酶联免疫吸附实验测定细胞因子白细胞介素(interleukin,IL)-1β和IL-10水平。结果:与LPS组相比,黑灵芝多糖可显著降低巨噬细胞吞噬能力并抑制IL-1β、NO和ROS的生成,提示黑灵芝多糖可抑制巨噬细胞向M1表型极化。同时,黑灵芝多糖可上调LPS处理的巨噬细胞MR表达和IL-10水平,促进巨噬细胞向M2表型极化。在黑灵芝多糖+LPS组中加入MR抑制剂,发现黑灵芝多糖抗LPS介导的炎症反应有所减弱。结论:黑灵芝多糖对LPS致炎巨噬细胞极化表型具有调控作用,且其可通过MR抑制巨噬细胞向M1表型极化而促进向M2表型极化。
关键词:黑灵芝多糖;巨噬细胞极化;甘露糖受体;调控作用;炎症反应
巨噬细胞是全身或局部炎症反应的关键效应细胞。炎症状态下,外周血单核细胞进入组织分化形成巨噬细胞,其可通过分泌细胞因子及抗原提呈等作用影响并调控免疫炎症反应的进程[1-2]。在不同激活方式的刺激下,巨噬细胞可表现出不同的免疫表型及功能,主要包括经典活化型巨噬细胞(M1型)和替代活化型巨噬细胞(M2型)两类。M1和M2型巨噬细胞可动态调节免疫炎症反应过程中的天然免疫应答[3]。在炎症反应初期,多介质诱导M1型巨噬细胞数量增加,有利于病原微生物的清除;随着炎症反应进展,M2型巨噬细胞比例逐渐增加,促进炎症损伤的修复[4]。
脂多糖(lipopolysaccharide,LPS)是全身炎症反应综合征的一种重要致病因子。其通过与各种免疫细胞表面相应的模式识别受体相结合而进入细胞,继而激活多条炎症通路,产生一系列促炎因子,引起机体严重的炎症反应[5-6]。有趣的是,LPS所介导的炎症反应中存在M1/M2型巨噬细胞分化的失衡,表现为促炎型M1型细胞增多,而抗炎型M2型细胞减少[7]。由此,通过调控炎症型M1型巨噬细胞向抗炎型M2型巨噬细胞的转化有助于改善LPS介导的炎症反应,可为炎症的防治提供新思路。
黑灵芝(Ganoderma atrum)是我国江西省赣南地区的一种特色资源,其作为药物和功能食品已有两千余年的应用历史,但迄今为止,有关其活性组分的研究国内外鲜有报道[8]。本实验室前期对黑灵芝的活性组分——多糖进行了分离纯化,得到的一种水溶性多糖,命名为PSG-1。活性功能研究证实黑灵芝多糖具有免疫调节、抗衰老和抗肿瘤等多种生物学活性[9]。同时,研究发现在LPS致炎巨噬细胞中,黑灵芝多糖可显著抑制LPS介导的NO和白细胞介素(interleukin,IL)-1β的过度释放,具有抗炎作用[10]。然而,黑灵芝多糖是否可调控促炎型M1型巨噬细胞转向抗炎型M2型巨噬细胞,并由此途径改善LPS介导的炎症反应,仍需进一步阐明。
清洁级别的昆明小鼠,雌雄不限,体质量(20.00±2.00)g,购自江西中医药大学实验动物科技中心,生产许可证号:SCXK(赣)2006-0001,动物合格证号:SCXK(赣)2005-0001,所购昆明小鼠饲养于南昌大学医学院实验动科部(使用许可证:SCXK(赣)2015-0001)。
黑灵芝多糖为本实验室自行制备[9]。
DMEM 美国GIBCO公司;胎牛血清 杭州四季青生物工程有限公司;中性红 国药集团化学试剂有限公司;FITC-大鼠抗小鼠甘露糖受体(mannose receptor,MR:CD206) 英国AbDSerotec公司;抗MR抗体 美国Abcam公司;细胞因子IL-1β试剂盒上海申雄科技实业有限公司;细胞因子IL-10试剂盒武汉博士德生物工程有限公司;活性氧(reactive oxygen species,ROS)检测试剂盒、二喹啉甲酸蛋白浓度测定试剂盒和NO试剂盒 碧云天生物技术研究所。
超净工作台 苏州净化设备厂;二氧化碳培养箱日本TOSHIBA公司;倒置显微镜 日本OLYMPUS公司;752紫外分光光度计、MD-200-3型电子天平 上海第三分析仪器厂;3K15-高速冷冻离心机 美国Sigma公司;FACSCaliburTM流式细胞仪 美国Becton Dickinson公司。
1.3.1 小鼠腹腔来源巨噬细胞的分离培养
小鼠颈椎脱臼处死后,立即浸泡于碘伏中并迅速移入细胞培养超净台,保持无菌状态静置5 min;随后将小鼠浸入体积分数75%乙醇3 min,用眼科弯镊取出小鼠并放置于医用搪瓷弯盘中;止血钳钝性分离小鼠腹部皮肤,暴露腹壁并向腹腔内注入4~5 mL磷酸盐缓冲液(phosphate buffered saline,PBS),轻揉小鼠腹部2 min左右;用眼科剪于小鼠侧腹壁下方(左右均可)剪一约3 mm左右的小口,注射器吸取腹腔液并移入离心管中。合并腹腔液,1 000×g离心8 min并弃上清液,收集细胞沉淀并采用含血清DMEM完全培养基重悬。台盼蓝拒染法计数活细胞比例大于95%的前提下,应用完全培养基调整细胞浓度并分别接种于96 孔培养板和6 孔培养板中,最后将培养板放置于二氧化碳细胞培养箱中,4 h后取出培养板,换液并弃去未贴壁的细胞,即得到小鼠腹腔巨噬细胞。
1.3.2 LPS诱导小鼠腹腔巨噬细胞炎症模型的建立与实验分组
原代培养纯化的小鼠腹腔巨噬细胞,随机分为4 组,每个处理组设置4 个复孔。1)对照组:腹腔巨噬细胞中给予等体积的含血清完全培养基;2)LPS组:腹腔巨噬细胞中给予相同体积的完全培养基,24 h后给予LPS(1 μg/mL)刺激24 h;3)PSG-1(40、80、160 µg/mL)+LPS组:本实验室PSG-1的剂量选择40、80、160 µg/mL预处理腹腔巨噬细胞24 h后,加入LPS(1 μg/mL)刺激24 h,全程给予PSG-1;4)抗MR抗体+LPS+PSG-1:加入抗MR抗体(10 µg/mL)孵育巨噬细胞30 min后,再加入PSG-1(160 µg/mL)处理24 h,最后加入LPS(1 μg/mL)刺激24 h,全程给予PSG-1和抗MR抗体。
1.3.3 中性红检测巨噬细胞吞噬活性
按组分别收集小鼠腹腔巨噬细胞,3 000 r/min离心3 min后吸去上清液,PBS洗涤沉淀细胞2 次。收集细胞接种于培养孔中,加入中性红溶液培养4 h,离心去除上清液并用PBS洗涤3 次。在每孔中加入1 mL细胞裂解液,在室温下放置2~3 h以完全裂解细胞。在多功能酶标仪上测定540 nm波长处的吸光度(A540nm)[11]。
1.3.4 流式细胞仪检测细胞内ROS水平
按组分别收集小鼠腹腔巨噬细胞,3 000 r/min离心3 min后吸去上清液,PBS洗涤沉淀细胞2 次。加入0.5 mL DCFH-DA溶液(10 µmol/L)重悬细胞,避光37 ℃孵育20 min后,3 000 r/min离心3 min,弃上清液,PBS洗涤2 次,用流式细胞仪检测细胞内7’-二氯荧光素(7’-dichlorofluorescein,DCF)的荧光强度,以DCF的荧光强度来反映细胞内ROS的含量[12]。
1.3.5 Griess法测定NO的生成
按组分别收集小鼠腹腔巨噬细胞培养上清液。按照NO检测试剂盒方法检测小鼠腹腔巨噬细胞培养上清液中的NO含量。
1.3.6 ELISA法测定细胞因子生成
采用酶联免疫吸附测定法(e nzyme-l i nke d immunosorbent assay,ELISA)检测细胞培养上清液中细胞因子(IL-1β和IL-10)质量浓度。应用多功能酶标仪在492 nm波长处测定吸光度(A492nm),根据标准曲线计算出实验样本中细胞因子的质量浓度。
1.3.7 流式细胞仪检测巨噬细胞MR表达
按组分别收集小鼠腹腔巨噬细胞,3 000 r/min离心3 min后吸去上清液,PBS洗涤沉淀细胞2 次后加100 µL PBS重悬细胞;加入10 µL FITC标记的大鼠抗小鼠CD206抗体检测巨噬细胞MR的表达,同型对照管加入10 µL对照试剂FITC-IgG2a。4 ℃条件下避光培养30 min后,PBS洗涤2 次以去除未结合的抗体;重悬细胞液定量至0.5 mL左右,应用流式细胞仪检测并记录各组MR的荧光强度[13]。
实验数据均以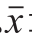 ±s表示,采用SPSS 17.0统计软件进行单因素方差分析,P<0.05表示差异显著具有统计学意义。
±s表示,采用SPSS 17.0统计软件进行单因素方差分析,P<0.05表示差异显著具有统计学意义。
图 1 PSG-1对LPS诱导的巨噬细胞吞噬中性红能力的影响
Fig. 1 Effect of PSG-1 on neutral red phagocytosis by LPS-induced macrophages
小鼠腹腔巨噬细胞吞噬中性红实验结果(图1)表明,与对照组相比,LPS对正常小鼠腹腔巨噬细胞吞噬活性有明显的增强作用。在细胞培养液中加入不同质量浓度的PSG-1后,与LPS组相比,小鼠腹腔巨噬细胞吞噬活性显著下降,实验结果表明PSG-1能显著抑制LPS诱导小鼠腹腔巨噬细胞吞噬能力增强。

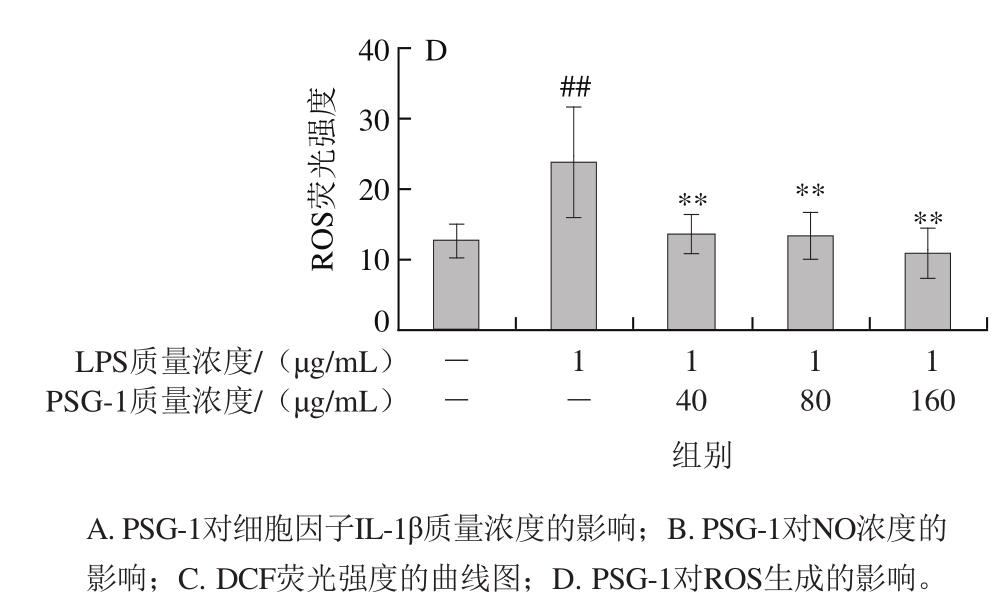
图 2 PSG-1对LPS处理的小鼠腹腔巨噬细胞向M1表型极化的影响
Fig. 2 Effect of PSG-1 on M1 polarization of LPS-induced mouse peritoneal macrophages
M1型巨噬细胞可高分泌细胞因子IL-1β和NO等,并可促进ROS的产生,参与炎症反应及病菌清除,体内产生过量促炎因子时即导致有害的炎症损伤发生[14]。本实验发现,与对照组相比,LPS组中的小鼠腹腔巨噬细胞培养液中IL-1β(图2A)和NO(图2B)的水平显著增加,腹腔巨噬细胞中ROS(图2C、D)的生成量亦显著升高。实验结果表明LPS可诱导小鼠腹腔巨噬细胞向M1型极化。而与LPS组相比,在细胞培养液中加入不同质量浓度的PSG-1后,小鼠腹腔巨噬细胞中IL-1β、NO和ROS的水平显著下降,表明PSG-1能抑制LPS对小鼠腹腔巨噬细胞向M1型极化的诱导。


图 3 PSG-1对LPS处理的小鼠腹腔巨噬细胞向M2表型极化的影响
Fig. 3 Effect of PSG-1 on M2 polarization of LPS-induced mouse peritoneal macrophages
IL-10和MR作为M2型巨噬细胞的特征性参数,常用于M2型巨噬细胞极化的研究中。M2型巨噬细胞可表现为IL-10的高分泌和MR的高表达[15]。本实验结果表明,与对照组相比,LPS组小鼠腹腔巨噬细胞培养上清液中IL-10的水平显著增加(图3A);荧光探针FITC-MR标记小鼠腹腔巨噬细胞,可发现MR的荧光强度显著下降(图3B、C)。与LPS组相比,PSG-1处理可显著性上调LPS诱导的巨噬细胞中MR的表达与IL-10的水平。这些数据提示PSG-1在抑制LPS诱导的小鼠腹腔巨噬细胞向M1型极化的同时,促进巨噬细胞向M2型极化。


图 4 PSG-1通过MR调控LPS诱导的巨噬细胞M1/M2表型转化
Fig. 4 Effect of PSG-1 on M1/M2 polarization of mouse peritoneal macrophages via MR
将中性红溶液加入小鼠巨噬细胞培养上清液中,通过检测培养液的吸光度来反映巨噬细胞的吞噬活性。吞噬结果发现(图4A),应用抗MR抗体预处理后,与LPS+PSG-1组相比,巨噬细胞的吞噬能力有所上升,即PSG-1对于LPS所介导的巨噬细胞吞噬增强的抑制作用显著下降,表明PSG-1是通过MR显著抑制LPS激活的小鼠腹腔巨噬细胞的吞噬功能。同时,抗MR抗体处理也可阻断PSG-1对小鼠腹腔巨噬细胞的M1/M2炎症表型分化的调控。如图4B~F所示,与LPS+PSG-1组相比,抗MR抗体可显著上调NO、IL-1β和ROS的生成,由此阻断PSG-1对巨噬细胞M1表型极化的抑制。观察抗MR抗体对IL-10的分泌的影响可以发现(图4D),与LPS+PSG-1组相比,抗MR抗体预处理组中IL-10的分泌显著下降,由此提示抗MR抗体可抑制巨噬细胞的M2型极化。
巨噬细胞是机体重要的免疫细胞,其极化模式的调控对维系健康十分重要,相关研究也已成为新的热点[16]。本实验应用LPS建立体外炎症模型,研究PSG-1对LPS介导巨噬细胞极化模式的影响。实验结果表明PSG-1具有抗炎作用,其机理与PSG-1通过促进LPS诱导的小鼠腹腔巨噬细胞中MR的表达,进而抑制巨噬细胞的M1型极化而促进巨噬细胞的M2型极化密切相关。
在多种炎性疾病的发生发展过程中均存在着巨噬细胞的极化现象。基于巨噬细胞较高的可塑性和异质性,在不同的组织微环境下,巨噬细胞可向M1和M2两种类型极化[17]。M1型巨噬细胞表现为高分泌IL-1β和NO等炎性细胞因子,并促进ROS的产生[14]。IL-1β是一种由活化的巨噬细胞所产生的细胞因子,在刺激免疫细胞增殖、分化中起重要作用。过量的IL-1β可诱导炎症反应发生并促进炎性细胞因子的释放,导致多种脏器发生损伤。NO是一种重要的活性介质,炎症反应过程分泌的IL-1β可诱导其过量产生,从而进一步加重炎症反应[18]。ROS是细胞有氧代谢的副产物,主要包括过氧化物和氧自由基。在炎症反应中,炎症细胞发生呼吸爆发产生大量氧自由基,导致组织细胞坏死凋亡,加重炎性反应[19]。本实验结果显示,小鼠腹腔巨噬细胞给予LPS后,与对照组相比,LPS组的小鼠腹腔巨噬细胞培养液中IL-1β和NO的水平显著增加,ROS生成亦显著升高,表明LPS诱导的巨噬细胞呈现出M1表型极化。与LPS组相比,PSG-1组小鼠腹腔巨噬细胞中IL-1β、NO和ROS的水平显著下降,由此表明PSG-1可抑制LPS介导的巨噬细胞向M1型极化。研究证实,IL-10的高分泌和MR的高表达常常被用于M2型巨噬细胞极化研究[15]。IL-10是一种抗炎细胞因子,其在控制炎症反应的发展中有着至关重要的作用[18]。本实验结果显示,与LPS组相比,PSG-1显著性上调LPS诱导的巨噬细胞中IL-10的水平,因此推测PSG-1可促进LPS诱导的腹腔巨噬细胞向M2型极化。巨噬细胞的极化方向可有效反映机体局部组织的炎症状态。对巨噬细胞极性分化的深入探索,并通过调控炎性疾病中的极化失衡状态将有望开拓新的免疫相关疾病的治疗方法[20]。
此外,本实验结果还发现PSG-1在发挥调控LPS诱导的巨噬细胞M1/M2表型转化作用的同时,还可促进MR的表达。MR是最早在巨噬细胞上被发现的一类非Toll样模式识别受体,是一种分子质量为175 kD的糖蛋白,属于C型植物凝集素家族[21]。作为先天性免疫和后天性免疫的桥梁,MR在巨噬细胞极化过程中发挥重要作用。研究发现,在M2型巨噬细胞中MR呈现特征性上调,因而被作为M2型巨噬细胞的标记物[22]。本实验发现PSG-1在发挥抗炎作用的同时,能显著增加MR的表达。应用抗MR抗体处理后,PSG-1对LPS诱导的巨噬细胞极化模式调控作用减弱,抗炎作用显著降低。这些实验数据均提示PSG-1抑制LPS介导巨噬细胞向M1极化与MR有关。
近年来,越来越多的研究证实多糖激活免疫细胞发挥免疫调节作用主要是通过与细胞表面的模式识别受体(包括MR)相结合而介导的[23-24]。MR胞外段结构包括富含半胱氨酸区域,II型纤连蛋白重复区和8~10 个C型凝集素样糖类识别域。MR结构中的糖类识别区域,可识别并结合以D-甘露糖、L-岩藻糖和N-乙酰葡萄糖胺等糖残基为末端的糖类物质[25-27]。在免疫研究中,MR无疑是一个新的设计靶标,并以此推动以甘露糖为结构基础的多糖免疫调节研究[28]。有趣的是,黑灵芝多糖的结构表征数据显示甘露糖是黑灵芝多糖的主要单糖组分[29]。因此本实验结果提示PSG-1对LPS诱导巨噬细胞M1/M2表型极化的调控与其结构密切相关,可能与PSG-1结构中甘露糖单糖组成有关。黑灵芝多糖与MR之间结构与生物活性的关联,可为黑灵芝多糖研究确立新的分子靶点。此外,在以后的研究中,将从巨噬细胞极化出发,进一步探讨黑灵芝多糖对极化相关信号通路的调控及机制。
参考文献:
[1] 刘娜娜, 欧希龙, 郑中伟, 等. 外源性巨噬细胞对小鼠细菌性腹膜炎的治疗作用[J]. 世界华人消化杂志, 2016, 24(7): 1076-1081.
[2] KINDT N, JOURNE F, LAURENT G, et al. Involvement of macrophage migration inhibitory factor in cancer and novel therapeutic targets (review)[J]. Oncology Letters, 2016, 12(4): 2247-2253.DOI:10.3892/ol.2016.4929.
[3] HSIEH J Y, SMITH T D, MELI V S, et al. Differential regulation of macrophage inf l ammatory activation by fibrin and fibrinogen[J]. Acta Biomaterialia, 2017, 47: 14-24. DOI:10.1016/j.actbio.2016.09.024.
[4] MURRAY P J. Macrophage polarization[J]. Annual Review of Physiology, 2017, 79: 541-566. DOI:10.1146/annurevphysiol-022516-034339.
[5] RUEDA C M, PRESICCE P, JACKSON C M, et al.Lipopolysaccharide-induced chorioamnionitis promotes IL-1-dependent inflammatory FOXP3+ CD4+ T cells in the fetal rhesus macaque[J]. The Journal of Immunology, 2016, 196(9): 3706-3715.DOI:10.4049/jimmunol.1502613.
[6] ALI I, MANZOOR Z, KOO J E, et al. Monoolein, isolated from Ishige sinicola, inhibits lipopolysaccharide-induced inflammatory response by attenuating mitogen-activated protein kinase and NF-κB pathways[J]. Food Science and Biotechnology, 2017, 26(2): 507-511.DOI:10.1007/s10068-017-0070-x.
[7] SCHUCH K, WANKO B, AMBROZ K, et al. Osteopontin affects macrophage polarization promoting endocytic but not inflammatory properties[J]. Obesity, 2016, 24(7): 1489-1498. DOI:10.1002/oby.21510.
[8] 张路路, 石婷, 朱梦婷, 等. 黑灵芝多糖对丙烯酰胺诱导小肠上皮细胞氧化损伤的保护作用[J]. 食品科学, 2017, 38(3): 170-175.DOI:10.7506/spkx1002-6630-201703028.
[9] CHEN Y, XIE M Y, NIE S P, et al. Purif i cation, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry, 2008, 107(1): 231-241.DOI:10.1016/j.foodchem.2007.08.021.
[10] 朱科学, 聂少平, 李文娟, 等. 黑灵芝多糖对小鼠脾淋巴细胞增殖及诱生细胞因子的影响[J]. 食品科学, 2010, 31(19): 351-354.
[11] SHU Y, LIU X B, MA X H, et al. Immune response mechanism of mouse monocytes/macrophages treated with κ-carrageenan polysaccharide[J]. Environmental Toxicology and Pharmacology,2017, 53: 191-198. DOI:10.1016/j.etap.2017.06.010.
[12] DOHERTY E, PERL A. Measurement of mitochondrial mass by fl ow cytometry during oxidative stress[J]. Reactive Oxygen Species, 2017,4(10): 275-283. DOI:10.1016/j.bbagen.2016.09.031.
[13] IZUMI G, KOGA K, TAKAMURA M, et al. Mannose receptor is highly expressed by peritoneal dendritic cells in endometriosis[J].Fertility and Sterility, 2017, 107(1): 167-173. DOI:10.1016/j.fertnstert.2016.09.036.
[14] O’NEILL L A J, PEARCE E J. Immunometabolism governs dendritic cell and macrophage function[J]. Journal of Experimental Medicine,2016, 213(1): 15-23. DOI:10.1084/jem.20151570.
[15] 帅小雪, 李文娟, 刘丹凤, 等. 黑灵芝多糖对小鼠腹腔巨噬细胞甘露糖受体的影响[J]. 食品科学, 2014, 35(23): 262-267. DOI:10.7506/spkx1002-6630-201423051.
[16] MELTON D W, LEI X F, GELFOND J A L, et al. Dynamic macrophage polarization-specific miRNA patterns reveal increased soluble VEGF receptor 1 by miR-125a-5p inhibition[J].Physiological Genomics, 2016, 48(5): 345-360. DOI:10.1152/physiolgenomics.00098.2015.
[17] DEY A, ALLEN J, HANKEY-GIBLIN P A. Ontogeny and polarization of macrophages in inf l ammation: blood monocytes versus tissue macrophages[J]. Frontiers in Immunology, 2015, 5: 1-15.DOI:10.3389/f i mmu.2014.00683.
[18] 徐荔, 何小鹃, 柴旺, 等. 黄芪多糖对内毒素诱导巨噬细胞产生TNF-α, IL-1β及NO的影响[J]. 中国中医基础医学杂志, 2011, 17(5):503-504.
[19] FANG J, YIN H Z, LIAO L, et al. Water soluble PEG-conjugate of xanthine oxidase inhibitor, PEG-AHPP micelles, as a novel therapeutic for ROS related inf l ammatory bowel diseases[J]. Journal of Controlled Release, 2016, 223: 188-196. DOI:10.1016/j.jconrel.2015.12.049.
[20] 祝甜甜, 段菊, 张刘强, 等. 巨噬细胞极化在动脉粥样硬化中的作用和药物靶标[J]. 中国药理学通报, 2014, 30(6): 748-751.
[21] 张妍淞,李文娟, 汤小芳, 等. 黑灵芝多糖体内抗炎活性及对甘露糖受体表达的影响[J] 食品科学, 2017, 38(13): 167-173. DOI:10.7506/spkx1002-6630-201713028.
[22] MANTOVANI A, SOZZANI S, LOCATI M, et al. Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes[J]. Trends in Immunology,2002, 23(11): 549-555. DOI:S1471-4906(02)02302-5.
[23] 宫存杞, 张君, 谢建新. 多糖免疫调节作用的受体研究进展[J]. 西部医学, 2007, 19(2): 290-292.
[24] SCHUETTE V, EMBGENBROICH M, ULAS T, et al. Mannose receptor induces T-cell tolerance via inhibition of CD45 and upregulation of CTLA-4[J]. Proceedings of the National Academy of Sciences, 2016, 113(38): 10649-10654. DOI:10.1073/pnas.1605885113.
[25] SHEN J S, BUSCH A, DAY T S, et al. Mannose receptor-mediated delivery of moss-made α-galactosidase A eff i ciently corrects enzyme def i ciency in Fabry mice[J]. Journal of Inherited Metabolic Disease,2016, 39(2): 293-303. DOI:10.1007/s10545-015-9886-9.
[26] FERNÁNDEZ N, ALONSO S, VALERA I, et al. Mannose-containing molecular patterns are strong inducers of cyclooxygenase-2 expression and prostaglandin E2 production in human macrophages[J]. The Journal of Immunology, 2005, 174(12): 8154-8162. DOI:10.4049/jimmunol.174.12.8154.
[27] 刘双, 李纾. 模式识别受体和病原体相关分子模式及其在牙周病防御中的作用[J]. 国际口腔医学杂志, 2016, 43(2): 212-215.
[28] ALDRIDGE A, O’NEILL S M. Fasciola hepatica tegumental antigens induce anergic-like T cells via dendritic cells in a mannose receptordependent manner[J]. European Journal of Immunology, 2016, 46(5):1180-1192. DOI:10.1002/eji.201545905.
[29] ZHANG H, LI W J, NIE S P, et al. Structural characterisation of a novel bioactive polysaccharide from Ganoderma atrum[J].Carbohydrate Polymers, 2012, 88(3): 1047-1054. DOI:10.1016/j.carbpol.2012.01.061.
Effect of Ganoderma atrum Polysaccharide on M1/M2 Polarization in Lipopolysaccharide (LPS)-Stimulated Macrophages
LIU Xiang1, FU Wangwei2, NIU Xiaoqin2, YAN Yuxin1, ZHANG Xianyi2, LI Wenjuan2,*
(1. Medical College, Nanchang University, Nanchang 330008, China;2. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract:Objective: The aim of this study was to explore the regulatory effect of Ganoderma atrum polysaccharide(PSG-1) on M1/M2 polarization in lipopolysaccharide (LPS)-simulated mouse macrophages. Methods: Neutral red assay was used to detect macrophage phagocytosis, and fl ow cytometry analysis was used to determine the level of reactive oxygen species (ROS) and the expression of mannose receptor (MR). Nitric oxide (NO) was analyzed by the Griess method and the levels of interleukin-1β (IL-1β) and IL-10 were determined by enzyme-linked immunosorbent assay (ELISA). Results:Compared to the LPS group, PSG-1 could remarkably reduce macrophage phagocytosis, and inhibit the secretion of IL-1β and NO, but down-regulate the generation of ROS, suggesting that PSG-1 could inhibit LPS-caused macrophage polarization into M1. Meanwhile, signif i cant elevations of MR expression and IL-10 level were observed in the PSG-1 + LPS group compared to LPS group, indicating that PSG-1 promoted macrophage polarization into M2. Further results showed that the inhibitory effect of PSG-1 against LPS-induced inf l ammatory response was decreased evidently in macrophages by the treatment of anti-MR antibody. Conclusion: PSG-1 has a distinct regulatory effect on LPS-mediated macrophage polarization via inhibiting polarization into M1 and enhancing polarization into M2. Its molecular mechanism may be closely related to the regulation of MR expression on the surface of macrophages.
Keywords:Ganoderma atrum polysaccharide; macrophage polarization; mannose receptor; regulatory effect;inf l ammatory response
LIU Xiang, FU Wangwei, NIU Xiaoqin, et al. Effect of Ganoderma atrum polysaccharide on M1/M2 polarization in lipopolysaccharide (LPS)-stimulated macrophages[J]. Food Science, 2018, 39(19): 141-146. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819022. http://www.spkx.net.cn
刘想, 付王威, 牛晓琴, 等. 黑灵芝多糖对脂多糖诱导巨噬细胞M1/M2表型转化的影响[J]. 食品科学, 2018, 39(19):141-146. DOI:10.7506/spkx1002-6630-201819022. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0141-06
文献标志码:A
中图分类号:TS201.4
DOI:10.7506/spkx1002-6630-201819022
*通信作者简介:李文娟(1982—),女,副教授,博士,研究方向为食品安全与营养。E-mail:wenjuanli@ncu.edu.cn
第一作者简介:刘想(1995—),女,本科生,研究方向为天然产物活性与开发。E-mail:1764769482@qq.com
食品科学与技术国家重点实验室青年研究基金项目(SKLF-QN-201509)
基金项目:国家自然科学基金地区科学基金项目(31560460);江西省科技厅自然科学基金项目(20151512041185);
收稿日期:2017-05-16