 ±s。使用单因素方差分析(One-way ANOVA)进行统计分析,通过t检验确定差异性,以P<0.05表示差异显著。
±s。使用单因素方差分析(One-way ANOVA)进行统计分析,通过t检验确定差异性,以P<0.05表示差异显著。宋林珍1,朱丽云2,*,高永生1,3,李素芳1,张拥军1
(1.中国计量大学 海洋食品加工质量控制技术与仪器国家地方联合工程实验室,浙江 杭州 310018;2.中国计量大学现代科技学院,浙江 杭州 310018;3.安徽汉芳生物科技有限公司,安徽 淮北 235000)
摘 要:探讨茶多糖的结构特征与抗糖尿病机制,为多糖的应用与糖尿病天然药物的开发提供理论依据。从粗老茶叶中分离茶多糖并纯化,分析了其单糖组成、分子质量、紫外与红外吸收特征。以四氧嘧啶诱导小鼠非肥胖型糖尿病,茶多糖以100 mg/(kg·d)剂量灌胃治疗糖尿病小鼠42 d,以格列本脲为阳性药物对照,测定血清和肝脏中的空腹血糖浓度、血清胰岛素含量和总抗氧化状态,苏木精-伊红染色法观察胰岛、肝脏组织变化。结果表明,从粗老茶叶中分离的茶多糖分子质量为119 600 Da,由D-葡萄糖醛酸、鼠李糖、D-岩藻糖、L-阿拉伯糖、D-木糖、D-甘露糖、D-葡萄糖和D-半乳糖8 种单糖组成,其物质的量比为32.61∶1.00∶5.46∶8.13∶3.84∶2.37∶15.36∶7.52,紫外与红外光谱扫描结果推测其可能为一种不含蛋白、核酸的吡喃型酸性杂多糖。茶多糖药物组小鼠肝糖原含量显著升高,血糖浓度从18.98 mmol/L降至正常水平,其血浆和胰脏中胰岛素含量与正常组无显著差异(P>0.05),血清与肝脏中超氧化物歧化酶活力显著高于四氧嘧啶模型组(P<0.05),而肝脏中一氧化氮合酶活力和丙二醛含量接近阴性组水平,一氧化氮含量显著低于模型组(P<0.05),其作用效果与格列本脲相近。病理组织形态学结果显示,茶多糖药物组小鼠胰岛β细胞得到修复,肝脏组织病理形态恢复正常。本研究表明茶多糖通过改善胰岛素分泌、胰岛β细胞功能和抗氧化状态发挥抗糖尿病作用。
关键词:茶多糖;结构特征;抗氧化活性;降血糖活性;胰岛素分泌;胰岛β细胞功能
糖尿病是一种常见的、多病因的、有遗传倾向的内分泌代谢紊乱性疾病[1-2],已成为当今威胁人类健康的第三大疾病。目前糖尿病临床治疗主要是注射胰岛素、口服磺酰脲类和双胍类降血糖药物,从而达到降低血糖的目的。这类药物作用强、见效快,但都存在不同程度的毒副作用[3],无法从根本上阻止胰岛细胞的进一步坏死,且往往导致胰岛素依赖。口服降糖药物导致低血糖,甚至因为严重低血糖昏迷而遗留脑功能不全后遗症或死亡是降糖药物的不良反应之一,而且其危险性随着年龄的增长呈指数性增加。在中国及日本民间常用粗老茶治疗糖尿病[4-5]。茶多糖是茶叶中一类水溶性复合多糖,以茶叶细胞壁的结构成分形式存在,已有研究表明茶多糖具有抗氧化[6-7]、抗癌[8]、免疫调节[9]和降血糖[10]等作用。Nie Shaoping等[11]的小鼠实验中,茶多糖饮食显著降低了小鼠的空腹血糖指数和糖基化血清蛋白含量。Zhou Xiaoling等[12]通过高效凝胶渗透色谱分析茶多糖的分子质量分布和组成成分,发现100~120 kDa级组分有降血糖活性,并推测可溶性茶多糖是茶中主要的降血糖因子。绿茶、乌龙茶、红茶的茶多糖均具有降血糖活性[13],且在低剂量下半发酵乌龙茶和发酵红茶降血糖活性优于非发酵绿茶,茶叶产地、种类、工艺等对降血糖作用的发挥存在影响,可能是茶多糖结构的复杂性使降血糖功能存在差异。本研究选择浙江龙井茶叶为原料,提取并探讨了茶多糖的结构及其降糖功能特性,从动物体内抗氧化活性、胰岛β细胞损伤修复及其胰岛素分泌功能变化等角度分析茶多糖的降糖机制。
ICR小鼠20 只,雄性,体质量(20.0±1.1)g,由杭州师范学院动物中心提供。实验动物生产许可证:SCXK(沪)2012-0002,饲养房温度(23±1)℃,相对湿度(55±2)%。遵循国家及提供实验动物单位的实验动物福利规则和制度。
龙井茶叶购自杭州梅家坞;单糖标准品:鼠李糖、L-阿拉伯糖、D-葡萄糖、D-木糖、D-甘露糖、D-半乳糖、D-岩藻糖、D-葡萄糖醛酸、四氧嘧啶(alloxan,ALX)、格列本脲 美国Sigma公司;葡聚糖标准品(分子质量分别为158 100、31 200、20 100、4 300、505、180 Da) 阿拉丁试剂(上海)有限公司;乙醇、氯化钠、溴化钾、硫酸、波恩试剂、石蜡、盐酸、碳酸锂、苏木精、伊红 杭州米克化工有限责任公司;胰岛素定量检测试剂盒 上海裕平生物科技有限公司;血糖测定试剂盒 北京中生生物工程技术公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽还原酶(glutathione reductase,GR)、过氧化氢酶(catalase,CAT)、丙二醛(malonaldehyde,MDA)、一氧化氮(nitric oxide,NO)、一氧化氮合酶(nitricoxide synthase,NOS)检测试剂盒 南京建成生物工程研究所。
159型高效液相色谱仪、2014C气相色谱仪 日本岛津公司;I3型紫外(ultraviolet,UV)-可见分光光度计 济南海能仪器股份有限公司;YXQ-LS-50G型立式压力蒸汽灭菌器 上海博讯实业有限公司;DL-5M型离心机 湖南星科科学仪器有限公司;血糖监测仪强生(上海)医疗器械有限公司。
1.3.1 茶多糖的制备与纯化
将龙井粗老茶叶粉碎,将茶粉与水以1∶20的料液比混合,80~90 ℃下恒温水浴振荡1~2 h,离心收集上清液,滤渣重新水提2~3 次,离心合并上清液并真空浓缩,以1∶4的体积比用乙醇溶液醇沉过夜,取沉淀干燥得粗茶多糖。取一定粗茶多糖,采用Sevag法(溶剂为氯仿-正丁醇(体积比5∶1))除去蛋白质,重复3~5 次,直至溶液振荡后水层上方不再有白色泡沫为止。将经脱蛋白后的茶多糖溶解于水中,透析,经Sephadex-G 100凝胶色谱柱分离纯化后得到茶多糖溶液,50 ℃下真空旋转蒸发浓缩后冷冻干燥得到纯化的茶多糖。
1.3.2 茶多糖分子质量的测定
分子质量的测定参考陈萍等[14]的高效凝胶渗透色谱法,选用TSK-GEL G4000(7.8 mm×300 mm)凝胶色谱柱,示差折光检测器检测,流动相为蒸馏水,洗脱流速为0.4 mL/min,柱温35 ℃,压强60.1 MPa,进样量20 μL,样品溶液用0.45 μm的滤膜过滤,洗脱液经超声脱气处理。先后测定分子质量为158 100、31 200、20 100、4 300、505、180 Da的葡聚糖,以保留时间与分子质量的对数绘制标准曲线。茶多糖的分子质量以保留时间对照标准曲线计算。
1.3.3 茶多糖的单糖组成分析
取茶多糖20 mg溶于3 mL 2 mol/L HCl溶液,105 ℃水解4 h,55 ℃真空浓缩。衍生化处理:加入0.5 mL吡啶和10 mg盐酸羟胺,90 ℃保温反应30 min,然后加入0.5 mL乙酸酐,90 ℃保温30 min,待样品冷却后取上清液进行气相色谱分析。标准单糖烘干至质量恒定,分别取10 mg经衍生化处理后进行气相色谱分析,以标准单糖的保留时间对茶多糖中的单糖进行定性,将标准单糖配成不同浓度进样,以标准单糖浓度与峰面积作标准曲线对茶多糖中的单糖进行定量。
气相色谱条件:O V-1 7 0 1中等极性色谱柱(30 m×0.53 mm,1.0 μm),氢火焰检测器,程序升温:150 ℃(7 ℃/min)→190 ℃(15 ℃/min)→250 ℃保持7 min;进样量:0.1 μL,载气流速:1.5 mL/min。
1.3.4 光谱分析
UV光谱的检测:称取样品各3 mg,用蒸馏水配制成一定质量浓度的溶液,在200~400 nm波长范围内进行全扫描。
红外(infrared,IR)光谱分析:取茶多糖样品1~2 mg,KBr压片进行IR光谱分析。光谱测定范围4 000~400 cm-l。
1.3.5 小鼠糖尿病模型(ALX模型)的建立与分组
小鼠适应性饲养3 d,第4天禁食不禁水12 h,用质量分数1% ALX-生理盐水溶液对ALX模型组、阳性组和药物组小鼠进行腹腔注射,注射剂量为200 mg/kg,阴性组注射等量生理盐水。72 h后测血糖,以血糖浓度在11.1~25.0 mmol/L之间的小鼠为成功的ALX模型小鼠。根据小鼠血糖浓度与体质量随机分为4 组(阴性组、模型组、药物组和阳性组,每组5 只),以苦味酸为标记物,药物组对ALX模型小鼠每日茶多糖灌胃100 mg/kg,连续6 周,阴性组和模型组以等剂量生理盐水灌胃,阳性组以20 mg/kg格列本脲灌胃[9,15]。每天观察小鼠体征,如采食、饮水、精神状态、毛色等。
1.3.6 生理指标测定
药物作用6 周后,断颈脱臼法处死小鼠,解剖取胰、肾和肝,称质量。分别取各组小鼠血浆、肝脏和胰脏进行血糖浓度、肝糖原含量、胰岛素水平等生化指标的测定,实验设两组平行。给药后8.0 h尾静脉采血,使用血糖监测仪测定小鼠的血糖浓度。肝糖原含量采用苯酚-硫酸法测定。胰岛素水平参照小鼠胰岛素定量检测试剂盒说明书进行测定。
1.3.7 体内抗氧化指标测定
测定血清与肝脏的抗氧化相关指标。SOD、GR、CAT、NOS活力和MDA、NO含量均按照试剂盒说明书的方法检测。
1.3.8 胰岛、肝脏组织切片观察
分别取各组小鼠新鲜胰脏、肝脏浸泡于波恩试液中固定24 h,经乙醇梯度脱水、二甲苯透明、预融的石蜡包埋、修块、切片、固定、苏木精-伊红(hematoxylin and eosin,HE)染色后显微镜下观察。
采用SPSS 19.0统计学软件对实验数据进行统计分析,所有结果表示为 ±s。使用单因素方差分析(One-way ANOVA)进行统计分析,通过t检验确定差异性,以P<0.05表示差异显著。
±s。使用单因素方差分析(One-way ANOVA)进行统计分析,通过t检验确定差异性,以P<0.05表示差异显著。

图 1 茶多糖分子质量测定结果
Fig. 1 Molecular mass determination of the polysaccharide by high performance liquid chromatography
采用凝胶色谱分析不同分子质量的葡聚糖,以保留时间为横坐标,以分子质量的对数为纵坐标,得到标准曲线y=-0.258 4x+7.831 4,线性相关系数为0.963 9,线性良好,可满足分子质量测定要求。凝胶渗透法和高效液相色谱法的测定结果表明,从粗老茶叶中分离得到的水溶性多糖为均一多糖,根据保留时间(t=10.599 3 min)从回归方程中求得茶多糖的分子质量为119 600 Da。

图 2 标准单糖的气相色谱测定结果
Fig. 2 Gas chromatogram of monosaccharides in standard sample
如图2所示,混标中各单糖的出峰顺序依次为D-葡萄糖醛酸、鼠李糖、D-岩藻糖、L-阿拉伯糖、D-木糖、D-甘露糖、D-葡萄糖和D-半乳糖。混标进样6 次,得到其出峰时间及面积相对标准偏差均小于5%,表明该乙酰化方法可行。将各单糖稀释成不同的浓度进样,得到峰面积y与浓度x的标准曲线如下:D-葡萄糖醛酸:y=4 207.80x-528.77,R2=0.997 4;鼠李糖:y=56 047.0x+5 347.6,R2=0.998 5;D-岩藻糖:y=88 196.0x-6 171.4,R2=0.997 4;L-阿拉伯糖:y=46 820.0x+2 713.9,R2=0.999 0;D-木糖:y=55 832.0x-2 590.0,R2=0.996 4;D-甘露糖:y=84 690.0x-2 731.0,R2=0.999 9;D-葡萄糖:y=90 347x-12 953,R2=0.995 7;D-半乳糖:y=82 177x-10 792,R2=0.995 9。根据标准曲线计算得到D-葡萄糖醛酸、鼠李糖、D-岩藻糖、L-阿拉伯糖、D-木糖、D-甘露糖、D-葡萄糖和D-半乳糖的浓度分别为2.915、0.089、0.488、0.727、0.343、0.212、1.373、0.672 mmol/mL。
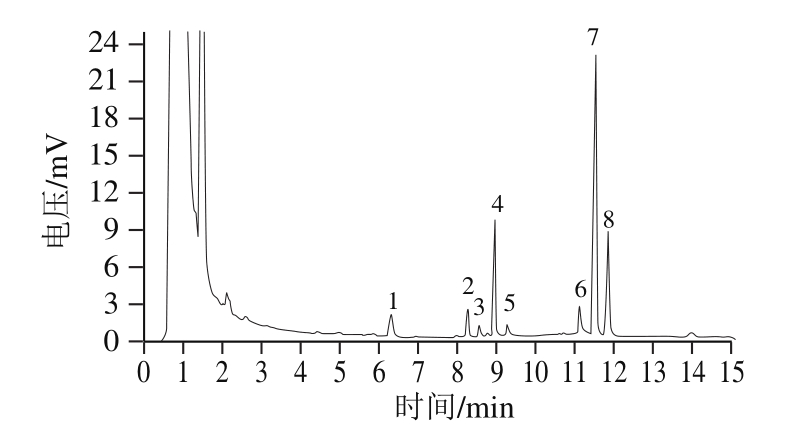
图 3 茶多糖的单糖组成气相色谱测定结果
Fig. 3 Gas chromatogram of monosaceharides in the polysaccharide
如图3所示,根据各峰保留时间对应各单糖标准品,可知茶多糖由D-葡萄糖醛酸、鼠李糖、D-岩藻糖、L-阿拉伯糖、D-木糖、D-甘露糖、D-葡萄糖和D-半乳糖8 种单糖组成,根据各单糖的标准曲线计算得到各单糖的物质的量比为32.61∶1.00∶5.46∶8.13∶3.84∶2.37∶15.36∶7.52。

图 4 茶多糖的UV光谱扫描结果
Fig. 4 UV absorption spectrum of the polysaccharide
由图4可知,在220~400 nm波长范围内,多糖溶液的吸光度呈下降趋势。在280 nm和260 nm波长处基本没有吸收峰,说明本实验分离得到的茶多糖不含蛋白质和核酸。

图 5 茶多糖的IR扫描结果
Fig. 5 IR spectrum of the polysaccharide
样品在4 000~400 cm-1区具有多糖类物质的一般特征峰(图5),在3 423.36、2 939.52、2 345.44、1 737.86、1 622.13、1 431.18、1 247.94、1 085.00、1 022.99 cm-1处均有特征吸收。3 423 cm-1附近的强宽谱带是多糖分子中羟基的伸缩振动吸收峰;2 345 cm-1处为CO2气体的伸缩振动引起的杂峰;2 939 cm-1附近的吸收峰是甲基或亚甲基的C—H伸缩振动峰;在1 622 cm-1处的宽带与吸收的水相关,表明茶多糖对水分子具有较强的亲和力;在1 450~1 200 cm-1之间的峰是C—H的变角振动,与C—H的伸缩振动构成了糖环的特征吸收;1 075 cm-1处为主链上的半乳糖吡喃环的伸缩振动;1 025 cm-1处为侧链阿拉伯呋喃环;1 730 cm-1附近为糖醛酸的特征吸收峰。IR测定结果与糖醛酸气相色谱测定结果一致,表明茶多糖很可能为一种酸性杂多糖。
由表1可知,造模后小鼠出现了多饮、多食、多尿的状况,饲养6 周后体质量没有明显增加,并有反应相对迟钝、被毛杂乱无光等症状,在给予200 mg/(kg·d)茶多糖治疗后小鼠以上症状得到改善,且血糖浓度降为正常水平。阴性组小鼠体质量增加显著,并呈现肥胖状态,饲养6 周后血糖浓度有所增加。阴性组、模型组和药物组小鼠经6 周饲养后肝脏质量无显著差异性(P>0.05),而药物组小鼠肝糖原含量显著升高(P<0.05),达到41.62 mg/g肝质量,表明茶多糖在降低糖尿病小鼠血糖浓度的同时促进葡萄糖转变为肝糖原。模型组小鼠胰脏质量与阴性组、药物组小鼠无显著差异,但血浆中胰岛素水平均显著低于阴性组和药物组小鼠(P<0.05),可能是ALX在体内能选择性地作用于小鼠的胰岛β细胞,所产生的过量自由基能破坏β细胞的结构,导致小鼠的胰腺肿胀肥大、损伤和坏死,使胰岛素水平降低,而药物组茶多糖可能对胰脏存在保护作用。
表 1 各组小鼠生化指标测定结果
Table 1 Biochemical parameters of mice from different groups

注:同一指标小写字母不同表示差异显著(P<0.05),下同。
表 2 茶多糖对糖尿病小鼠血清及肝脏中抗氧化指标的影响
Table 2 Effect of the polysaccharide on antioxidant indexes in serum and liver of diabetic mice

如表2所示,药物组和阳性组小鼠血清中GR、SOD和CAT活力均高于模型组,与模型组相比,药物组和阳性组的SOD活力显著升高(P<0.05),且与阴性组无显著差异。而GR和CAT活力各组间均无显著差异。
肝脏是动物和人体内最重要的器官,它是糖类、脂肪、蛋白等代谢的最主要的场所之一。肝脏能促进糖原合成、利用葡萄糖,对糖异生等途径有抑制作用,从而使血糖降低,还能清除体内毒素及促进分泌性蛋白质合成。
GR、SOD和CAT是肝脏中主要的抗氧化活性酶,从表2中可知,茶多糖药物组小鼠肝脏中GR、CAT和SOD活力均显著高于模型组及阴性组(P<0.05)。NOS活力的升高将导致NO含量的增加。NO和MDA是肝脏中主要的有毒氧化产物,这两个指标在模型组中达到最高,说明模型组小鼠在ALX作用下可能引起肝损伤,影响肝脏功能。而经过茶多糖或阳性药物治疗的小鼠肝脏中NOS活力和MDA含量接近正常组水平,且NO含量显著低于模型组(P<0.05),说明茶多糖和阳性药物发挥了抗氧化的作用,可能与GR、SOD和CAT活力的升高有关。由实验结果可知,茶多糖药物组和阳性组小鼠均具有较好的体内抗氧化效果。
ALX进入机体内可迅速被β细胞摄取,产生氧自由基,选择性地损伤多种动物的胰岛β细胞,引起实验性糖尿病。糖尿病小鼠胰岛结构被明显破坏,胰岛细胞明显减少,胰岛β细胞的细胞器明显受损、分泌颗粒明显减少,胰岛素分泌降低。
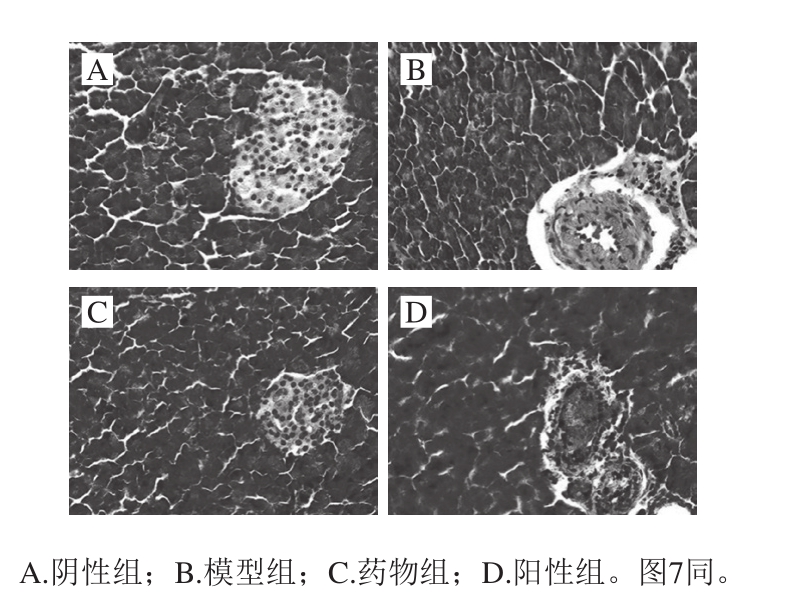
图 6 茶多糖对小鼠胰岛组织形态的影响(×100)
Fig. 6 Effect of the polysaccharide on pancreatic islet morphology in mice (× 100)
胰岛细胞为胰腺的内分泌细胞,分布于腺泡之间,HE染色切片中胰岛色浅,为球形的细胞团,细胞间毛细血管丰富。阴性组胰岛组织学检查显示外分泌腺中腺泡细胞的结构正常,内分泌区域的胰岛外观完整,胰岛细胞内的小深蓝紫色颗粒和少量粉红色颗粒分布一致(图6A)。模型组与阳性组胰岛细胞结构不清,胰腺具有许多不规则的腺泡细胞,出现空泡化和细胞坏死(图6B、D)。药物组胰岛细胞排列成团状,细胞圆润饱满,从图6C中可看出已得到修复。

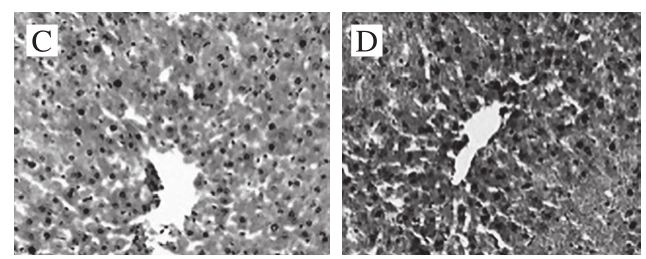
图 7 茶多糖对小鼠肝脏组织形态的影响(×100)
Fig. 7 Effect of the polysaccharide on liver tissue morphology in mice (× 100)
如图7所示,正常组与药物组肝细胞体积大、胞质丰富、HE染色较红,胞质内含有粒状或小块状的嗜碱性物质。而模型组肝细胞呈现碎片状,有部分坏死现象。
多糖结构与功能的研究中,一般结构上从多糖分子质量范围、单糖组成、糖链中糖苷键连接类型和连接顺序等一级结构着手,进一步分析单糖残基类型、主链和支链组成与连接位点、重复单元等多糖结构[16-17]。Wang Yuanfeng等[18]发现茶叶多糖分子质量分布范围分别为3.67×103~7.58×105Da,与本研究所测茶多糖分子质量约为119 600 Da基本一致。倪德江等[19]认为乌龙茶多糖是富含糖醛酸和少量蛋白质的三元糖复合物,相对分子质量为8.877×104,糖基由半乳糖、葡萄糖、阿拉伯糖、岩藻糖和鼠李糖组成,与本研究中茶多糖的单糖组成存在差异性,可能为原料来源和提取方法不同所致。多糖的相对分子质量、单糖组成等基本理化参数对多糖的结构起基础性决定作用,与其生物活性紧密相关[20],即使同一来源原料后续纯化方法不同,也会获得理化特性各异的茶多糖(组分),从而造成其生物活性的差异,这是茶多糖纯化及生物活性研究中探索其组效关系和构效关系方面值得注意的环节。
ALX在体内能选择性地作用于小鼠胰岛β细胞,所产生的过量自由基能破坏β细胞的结构,导致小鼠的胰腺损伤和坏死,胰岛素水平降低,出现糖尿病症状[21]。根据文献[15,22]报道,多糖的降糖主要作用机制为降低肝糖原含量、刺激胰岛素分泌、调节机体代谢相关酶活力(如与抑制葡萄糖运转载体竞争;使α-淀粉酶、蔗糖酶活力降低;α-葡萄糖苷酶对糖原异生与分解的调节[23];6-磷酸葡萄糖苷酶体系的作用等),或者通过减弱氧化应激等方面来发挥有益作用。
本研究从龙井粗老茶叶中提取、纯化获得的茶多糖通过灌胃给药取得了较好的降糖效果,经过42 d作用后,药物组小鼠血糖浓度从18.98 mmol/L降为5.80 mmol/L,达到正常范围(3.90~6.20 mmol/L),与阴性组无显著差异(P>0.05),表现出茶多糖极好的降血糖活性,与江和源等[24]的研究结果相似。Niedowicz等[25]报道糖尿病患者和实验动物模型均显示持续性和慢性高血糖症引起高氧化应激,使抗氧化防御系统活性下降并促进自由基产生。抗氧化剂被认为通过抑制过氧化反应链来减轻β细胞的破坏[26],与本研究中茶多糖具有促进ALX糖尿病小鼠胰岛β细胞的修复、胰岛素分泌增加、肝脏SOD、CAT和GR活力提高、保护肝脏组织免受ALX引起的氧化损伤的功能的研究结果一致。胰岛β细胞功能异常和凋亡是糖尿病发病过程中的关键步骤[27-29],改善β细胞功能、促进β细胞再生应是糖尿病治疗的重点。从胰岛组织切片结果观察,茶多糖药物组胰岛细胞排列成团状,细胞圆润饱满,显著修复了模型组胰岛β细胞结构不清、胰腺具有许多不规则的腺泡细胞、出现空泡化和细胞坏死等病理形态,预示茶多糖对胰岛细胞的修复及胰岛素分泌具有积极的作用。
茶多糖在体内的降血糖活性受到许多因素的影响,包括化学成分、分子质量、糖苷键的配置和位置、分支点和单糖序列[30],以及剂量、用药时间和作用途径等,茶多糖的吸收方式及降糖作用靶点等有待于进一步研究。
参考文献:
[1] 张高帆, 苏东洋, 张拥军, 等. 南瓜多糖对不同糖尿病模型小鼠的降糖作用[J]. 中国食品学报, 2014, 14(2): 23-27. DOI:10.16429/j.1009-7848.2014.02.008.
[2] SEINO Y, NANJO K, TAJIMA N, et al. Report of the committee on the classif i cation and diagnostic criteria of diabetes mellitus[J]. Journal of Diabetes Investigation, 2010, 1(5): 212-218. DOI:10.1111/j.2040-1124.2010.00074.x.
[3] MAY L D, LEFKOWITCH J H, KRAM M T, et al. Mixed hepatocellular-cholestatic liver injury after pioglitazone therapy[J]. Annals of Internal Medicine, 2002, 136(6): 449-452.DOI:10.7326/0003-4819-136-6-200203190-00008.
[4] ISIGAKI K, TAKAUWA T, TAKEO T. Anti-diabetes mellitus effect of water-soluble tea polysaccharide[C]// Proceedings of the International Symposium on Tea. Shizuoka: The Organizing Committee of ISTS, 1992: 240-242.
[5] ISO H, DATE C, WAKAI K, et al. The relationship between green tea and total caffeine intake and risk for self-reported type 2 diabetes among Japanese adults[J]. Annals of Internal Medicine, 2006, 144(8):554-562. DOI:10.7326/0003-4819-144-8-200604180-00005.
[6] CARLONI P, TIANO L, PADELLA L, et al. Antioxidant activity of white, green and black tea obtained from the same tea cultivar[J].Food Research International, 2013, 53(2): 900-908. DOI:10.1016/j.foodres.2012.07.057.
[7] CHEN H, ZHANG M, XIE B. Quantification of uronic acids in tea polysaccharide conjugates and their antioxidant properties[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3333-3336.DOI:10.1021/jf0349679.
[8] BELIVEAU R, GINGRAS D. Green tea: prevention and treatment of cancer by nutraceuticals[J]. The Lancet, 2004, 364: 1021-1022.DOI:10.1016/S0140-6736(04)17076-1.
[9] 李海珊, 刘丽乔, 聂少平. 茶多糖对小鼠肠道健康及免疫调节功能的影响[J]. 食品科学, 2017, 38(7): 187-192. DOI:10.7506/spkx1002-6630-201707030.
[10] PANAGIOTAKOS D B, LIONIS C, ZEIMBEKIS A, et al. Long-term tea intake is associated with reduced prevalence of (type 2) diabetes mellitus among elderly people from Mediterranean islands: MEDIS epidemiological study[J]. Yonsei Medical Journal, 2009, 50(1): 31-38.DOI:10.3349/ymj.2009.50.1.31.
[11] NIE Shaoping, XIE Mingyong. A review on the isolation and structure of tea polysaccharides and their bioactivities[J]. Food Hydrocolloids,2012, 25(2): 144-149. DOI:10.1016/j.foodhyd.2010.04.010.
[12] ZHOU Xiaoling, WANG Dongfeng, SUN Pingnan, et al. Effects of soluble tea polysaccharides on hyperglycemia in alloxan-diabetic mice[J]. Journal of Agricultural and Food Chemistry, 2007, 55(14):5523-5528. DOI:10.1021/jf070699t.
[13] NI D J, CHEN Y J, XIE B J, et al. Studies on composition,antioxidation and hypoglycemic effects of polysaccharides from green tea, oolong tea and black tea[J]. Acta Nutrimenta Sinica, 2004, 26(1):57-60.
[14] 陈萍, 张拥军, 朱丽云, 等. 人工胃液作用抗氧化龙井茶多糖的体外模拟研究[J]. 中国食品学报, 2014, 14(10): 35-41. DOI:10.16429/j.1009-7848.2014.10.006.
[15] HUI H X, TANG G, GO V L W. Hypoglycemic herbs and their action mechanisms[J]. Chinese Medicine, 2009, 4(11): 1-11.DOI:10.1186/1749-8546-4-11.
[16] 范嘉龙, 马丽苹, 叶红, 等. 苦丁冬青苦丁茶多糖的单糖组成分析[J].食品科学, 2013, 34(11): 72-76. DOI:10.7506/spkx1002-6630-201311017.
[17] LU X S, ZHAO Y, SUN Y F, et al. Characterisation of polysaccharides from green tea of Huangshan Maofeng with antioxidant and hepatoprotective effects[J]. Food Chemistry, 2013, 141(4): 3415-3423.DOI:10.1016/j.foodchem.2013.06.058.
[18] WANG Yuanfeng, MAO Fangfang, WEI Xinlin. Characterization and antioxidant activities of polysaccharides from leaves, fl owers and seeds of green tea[J]. Carbohydrate Polymers, 2012, 88(1): 146-153.DOI:10.1016/j.carbpol.2011.11.083.
[19] 倪德江, 陈玉琼, 谢笔钧, 等. 乌龙茶多糖OTPS 2-1的光谱特性、形貌特征及热特性研究[J]. 高等学校化学学报, 2004, 25(12): 2263-2268. DOI:10.3321/j.issn:0251-0790.2004.12.010.
[20] 陈小强, 叶阳, 成浩, 等. 不同方法提制的茶叶粗多糖的光谱分析[J].光谱学与光谱分析, 2009, 29(4): 1083-1087. DOI:10.3964/j.issn.1000-0593(2009)04-1083-05.
[21] RAHIMI R, NIKFAR S, LARIJANI B, et al. A review on the role of antioxidants in the management of diabetes and its complications[J].Biomedicine and Pharmacotherapy, 2005, 59(7): 365-373.DOI:10.1016/j.biopha.2005.07.002.
[22] 陈建国, 来伟旗, 江月仙, 等. 茶多糖对糖尿病小鼠糖代谢、组织形态学及胰岛β细胞超微结构的影响[J]. 营养学报, 2010, 32(1):64-67. DOI:10.13325/j.cnki.acta.nutr.sin.2010.01.031.
[23] BHANDARI M R, JONG A N, HONG G, et al. α-Glucosidase and α-amylase inhibitory activities of Nepalese medicinal herb Pakhanbhed(Bergenia ciliata Haw.)[J]. Food Chemistry, 2008, 106(1): 247-252.DOI:10.1016/j.foodchem.2007.05.077.
[24] 江和源, 郑高利. 茶多糖降小鼠血糖功能的实验研究[J]. 食品科学,2004, 25(6): 166-169. DOI:10.3321/j.issn:1002-6630.2004.06.043.
[25] NIEDOWICZ D M, DALEKE D L. The role of oxidative stress in diabetic complications[J]. Cell Biochemistry & Biophysics, 2005,43(2): 289-330. DOI:10.1093/hmg/11.20.2435.
[26] MURTHY V K, SHIPP J C, HANSON C, et al. Delayed onset and decreased incidence of diabetes in BB rats fed free radical scavengers[J]. Diabetes Research and Clinical Practice, 1992, 18(1):11-16. DOI:10.1016/0168-8227(92)90049-W.
[27] YOON K H, KO S H, CHO J H, et al. Selective beta-cell loss and alpha-cell expansion in patients with type 2 diabetes mellitus in Korea[J]. The Journal of Clinical Endocrinology and Metabolism,2003, 88(5): 2300-2308. DOI:10.1210/jc.2002-020735.
[28] POUWELS M J J, TACK C J, HERMUS A R, et al. Treatment with intravenous insulin followed by continuous subcutaneous insulin infusion improves glycaemic control in severely resistant type 2 diabetic patients[J]. Diabetic Medicine, 2003, 20(1): 76-79.DOI:10.1046/j.1464-5491.2003.00848.x.
[29] GASTALDELLI A, FERRANNINI E, MIYAZAKI Y, et al. Betacell dysfunction and glucose intolerance: results from the San Antonio metabolism (SAM) study[J]. Diabetologia, 2004, 47(1): 31-39.DOI:10.1007/s00125-003-1263-9.
[30] ZHANG M, CUI S W, CHEUNG P C K, et al. Antitumor polysaccharides from mushrooms: a review on their isolation process, structural characteristics and antitumor activity[J]. Trends in Food Science & Technology, 2007, 18(1): 4-19. DOI:10.1016/j.tifs.2006.07.013.
Structural Characteristics and Hypoglycemic Activity of Polysaccharides from Green Tea Leaves
SONG Linzhen1, ZHU Liyun2,*, GAO Yongsheng1,3, LI Sufang1, ZHANG Yongjun1
(1. National & Local United Engineering Laboratory of Quality Controlling Technology and Instrumentation for Marine Food,China Jiliang University, Hangzhou 310018, China; 2. College of Modern Science and Technology, China Jiliang University,Hangzhou 310018, China; 3. Anhui Hanfang Bio-technology Co. Ltd., Huaibei 235000, China)
Abstract:The aim of this study was to evaluate the structural characteristics and anti-diabetic mechanism of tea polysaccharides, dietary ingredients used for the management of diabetes. A water-soluble polysaccharide was isolated and purified from mature tea leaves, and its monosaccharide composition and molecular mass were measured. Also, its structural characteristics were analyzed by ultraviolet (UV) and infrared (IR) spectroscopy were. Alloxan was injected into ICR mice to induce non-obese type diabetes. The diabetic rats were treated with the polysaccharide (100 mg/(kg·d)) or glibenclamide (positive control) for 42 days. The fasting blood glucose, serum insulin and total antioxidant parameters in serum and liver were determined. The pancreas was examined by haematoxylineosin staining and β-cells were observed using a microscope. The results showed that the molecular mass of the polysaccharide was 119 600 Da, which was composed of glucuronic acid, rhamnose, fucose, arabinose, xylose, mannose, glucose and galactose with a molar ratio of 32.61:1.00:5.46:8.13:3.84:2.37:15.36:7.52. Based on the UV and IR spectra, it seemed likely that the polysaccharide was a non-protein-bound pyran-type heteropolysaccharide. The treatment of the diabetic rats with the polysaccharide signif i cantly elevated liver glycogen content, and decreased blood glucose to normal from 18.98 mmol/L, but exhibited no signif i cant difference in pancreatic and plasma insulin levels compared with the normal group (P > 0.05). Moreover, treatment with the polysaccharide signif i cantly increased superoxide dismutase activity compared with the model group (P < 0.05), but showed nitricoxide synthase activity and malonaldehyde content in liver close to those of the negative group; however, a signif i cant decrease in nitric oxide in liver was found in comparison with the model group (P < 0.05). The effect of the polysaccharide was similar to that of glibenclamide. Histopathological and morphological results demonstrated that pancreatic β-cells and liver tissue morphology in the polysaccharide treated group were restored to normal. Thus, this study suggests that the tea polysaccharide exerts anti-diabetic effects by improving insulin secretion, β-cell function, and antioxidant status.
Keywords:tea polysaccharides; structural characteristics; antioxidant activity; hypoglycemic activity; insulin secretion;β-cell function
SONG Linzhen, ZHU Liyun, GAO Yongsheng, et al. Structural characteristics and hypoglycemic activity of polysaccharides from green tea leaves[J]. Food Science, 2018, 39(19): 162-168. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819025. http://www.spkx.net.cn
宋林珍, 朱丽云, 高永生, 等. 茶多糖的结构特征与降血糖活性[J]. 食品科学, 2018, 39(19): 162-168. DOI:10.7506/spkx1002-6630-201819025. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0162-07
文献标志码:A
中图分类号:TS201.4
DOI:10.7506/spkx1002-6630-201819025
*通信作者简介:朱丽云(1976—),女,副教授,博士,研究方向为天然产物功能。E-mail:zly@cjlu.edu.cn
第一作者简介:宋林珍(1994—),女,硕士研究生,研究方向为食品化学与营养。E-mail:1059443655@qq.com
基金项目:国家自然科学基金面上项目(31371765);浙江省重点科技创新团队项目(2010R50028)
收稿日期:2017-07-28