表 1 qPCR引物设计
Table 1 Primer design for qPCR
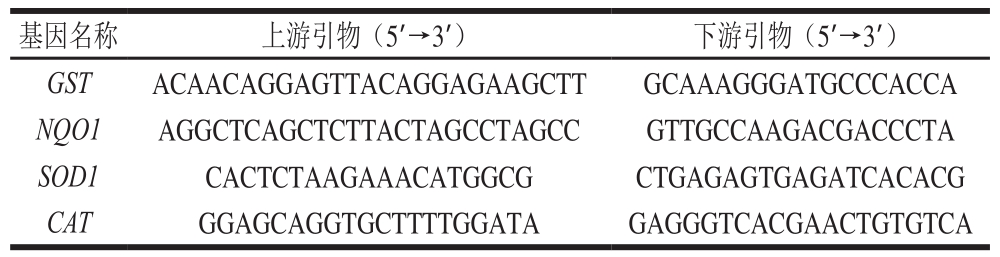
注:GST.谷胱甘肽巯基转移酶(glutathione S-transferase);NQO1.醌氧化还原酶1(quinone oxidoreductase 1);SOD1.超氧化物歧化酶 1(superoxide dismutase 1);CAT.过氧化氢酶(catalase enzymes)。
王 帅,刘剑利,霍雅鹏,阎 笑,田思琪,贺 音,曹向宇*
(辽宁大学生命科学院,辽宁 沈阳 110036)
摘 要:本研究利用Sephadex G-25和DEAE-32对小米抗氧化肽进行纯化,利用醋酸纤维素薄膜电泳法测定小米抗氧化肽的纯度,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、超氧阴离子自由基、羟自由基清除实验考察纯化的小米抗氧化肽对自由基的清除能力。在细胞水平研究小米抗氧化肽对胰岛细胞的保护作用,利用H2O2进行大鼠胰岛素瘤细胞(INS-1)氧化应激造模,采用2’,7’-二氯二氢荧光素二乙酸酯荧光探针法检测细胞内活性氧(reactive oxygenspecies,ROS)水平,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐法检测细胞活力,采用流式细胞技术检测细胞凋亡率,采用实时荧光定量聚合酶链式反应检测抗氧化酶的表达水平。结果表明:经过Sephadex G-25和DEAE-32两次层析,小米抗氧化肽达到了电泳纯;50 μg/mL小米抗氧化肽对超氧阴离子自由基、羟自由基和DPPH自由基的清除率分别为(62.71±3.86)%、(73.56±4.51)%和(82.62±5.25)%;小米抗氧化肽能显著提升H2O2损伤后细胞活力,降低细胞内ROS水平,抑制H2O2诱导损伤的INS-1细胞的凋亡(P<0.05),其可能的机制与超氧化物歧化酶1、过氧化氢酶、谷胱甘肽巯基转移酶、醌氧化还原酶1等抗氧化酶系的表达上调有关。结论:小米抗氧化肽对H2O2诱导损伤的INS-1细胞氧化应激具有一定的保护作用。
关键词:小米抗氧化肽;氧化应激;胰岛细胞;凋亡
抗氧化肽是一类具有抗氧化作用的生物活性肽,由于其具有较小的分子质量和较高的活性而被广泛研究[1]。目前,研究者已经从玉米、小麦、大豆、花生等多种谷物及油料作物种子蛋白中制备和纯化了抗氧化肽,多数研究通过体外实验评价多肽的抗氧化能力[2-5],而对于多肽在细胞及动物水平的抗氧化作用研究较少。通过细胞水平的抗氧化研究可以确定抗氧化肽的生物学功能,为其进一步的应用提供依据。
氧化应激是机体自由基产生和清除动态平衡被破坏,或外源性氧化活性物质过量摄入导致活性氧簇(reactive oxygen species,ROS)在体内堆积而产生的细胞毒性作用[6-7]。过多的自由基会损伤细胞内的蛋白、脂质和DNA,还会诱发细胞凋亡等细胞损伤作用[8]。氧化应激与2型糖尿病的发生、发展密切相关[9]。研究表明,糖尿病患者体内高血糖、高血脂病理条件下,细胞代谢过程中会产生大量ROS,导致ROS的积累[10]。由于胰岛素瘤细胞的抗氧化酶系表达水平较低,胰岛β细胞对ROS敏感,容易受到氧化损伤[11]。因此,胰岛素瘤细胞是良好的验证多肽体内抗氧化活性的细胞模型。目前,利用各种天然抗氧化剂保护胰岛β细胞免于氧化应激损伤从而预防和治疗糖尿病受到人们的广泛重视,成为研究的热点[12]。
本课题组前期的研究中制备了小米抗氧化肽,并进行了体外抗氧化活性的检测,结果表明小米抗氧化肽具有良好的自由基清除能力和体外抗氧化活性[13]。本研究利用凝胶过滤与离子交换层析相结合的方法对小米抗氧化肽进行分离纯化,利用还原力测定不同组分的抗氧化能力,利用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、超氧阴离子自由基和羟自由基清除能力实验检测其对自由基清除能力。利用H2O2模拟细胞内氧化应激状态,利用大鼠胰岛素瘤细胞(INS-1)进行小米抗氧化肽抑制细胞氧化应激作用研究,以期为小米抗氧化肽抑制胰岛细胞氧化应激和功能减退作用提供实验依据,为使其更广泛地应用于食品和保健品提供依据。
小米抗氧化肽由辽宁大学生命科学院实验室制备;INS-1细胞由辽宁大学生命科学院实验室保存;2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorofluorescein diacetate,DCFH-DA)、DPPH、Sephadex G-25 美国西格玛奥德里奇公司;DEAE-32纤维素 英国沃特曼有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 上海起发实验试剂有限公司;DMEM培养基 美国海克隆公司;实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,qPCR)试剂盒、反转录试剂盒 宝生物工程(大连)有限公司;Annexin-V/FITC凋亡检测试剂盒 凯基生物技术有限公司;其他试剂均为国产分析纯。
BS223S电子分析天平 德国赛多利斯仪器系统有限公司;JW-3021HR高速冷冻离心机 安徽嘉文仪器装备有限公司;DP73荧光倒置显微镜 日本OLYMPUS公司;721N可见分光光度计 上海精密科学仪器有限公司;SW-CJ-2FD超净工作台 苏州净化设备有限公司;Sunrise全自动酶标仪 瑞士帝肯公司;FACS Calibur流式细胞仪 伯乐生命医学产品(美国)有限公司。
1.3.1 小米抗氧化肽的制备
小米抗氧化肽参照课题组前期研究的方法进行制备[13]。冷冻干燥后配制成1 mg/mL溶液,用于进一步分离纯化。1.3.2 小米抗氧化肽的分离纯化
1.3.2.1 Sephadex G-25柱层析
采取自然沉降法装柱,柱床体积3 cm×70 cm,用50 mmol/L pH 8.0的磷酸盐缓冲液(phosphate buffer saline,PBS)平衡后上样2 mL,流速为0.5 mL/min,280 nm波长处检测吸光度,每管2 mL收集洗脱液,分别根据还原力测定各组分的抗氧化活性,收集活性组分,浓缩后用于进一步纯化。
1.3.2.2 离子交换层析
将处理好的DEAE-32悬浮于50 mmol/L、pH 8.0 PBS中,自然沉降法装柱,柱床体积为3 cm×50 cm,平衡后备用。将Sephadex G-25柱层析收集的活性组分上样,上样量2 mL,用含0.1 mol/L NaCl和0.5 mol/L NaCl的平衡缓冲液进行分段洗脱,流速为0.5 mL/min,280 nm波长处检测吸光度,分管收集,每管2 mL,根据还原力测定各组分的抗氧化活性,收集活性峰,冷冻干燥,-20 ℃保存。
1.3.3 纯度鉴定
采用醋酸纤维素薄膜电泳法进行纯度鉴定[14]。
1.3.4 还原力测定
还原力参考文献[15]的方法进行测定,于700 nm波长处测定吸光度,反应物的吸光度越大表明还原力越强。
1.3.5 自由基清除能力测定
DPPH自由基、超氧阴离子自由基、羟自由基清除率参照参考文献[16-17]进行测定。
1.3.6 细胞培养
INS-1细胞于37 ℃含5%的CO2培养箱中,使用含10%胎牛血清的DMEM培养基进行培养。
1.3.7 小米抗氧化肽对H2O2诱导损伤的INS-1细胞存活率的影响
将INS-1细胞接种到96 孔板中,每孔200 μL,向其中加入纯化后的小米抗氧化肽(质量浓度依次为10、20、30、40、50 μg/mL)预处理1 h,再加入终浓度0.5 mmol/L的H2O2,对照组不作任何处理,H2O2组仅加入0.5 mmol/L H2O2,继续培养24 h,MTT法检测细胞存活率。
1.3.8 小米抗氧化肽对H2O2诱导损伤的INS-1细胞内ROS的影响
参考刘晓等[18]的方法。将INS-1细胞进行种板,贴壁后使用终质量浓度50 μg/mL小米抗氧化肽预处理1 h,再加入终浓度0.5 mmol/L的H2O2处理,同时设置对照组(不作任何处理)和H2O2组(仅加入0.5 mmol/L H2O2),培养24 h后除去细胞培养液,PBS清洗1 次,加入20 μmol/L的DCFH-DA,37 ℃温育30 min后,再次用PBS清洗1 次,加入多聚赖氨酸固定30 min,PBS洗清3 次,进行封片观察,并利用Image J软件对相对荧光强度进行分析。检测小米抗氧化肽对H2O2诱导损伤的INS-1细胞内ROS的清除作用。
1.3.9 小米抗氧化肽对H2O2诱导损伤的INS-1细胞凋亡的影响
将INS-1细胞进行种板,贴壁培养后用质量浓度50 μg/mL小米抗氧化肽预处理1 h,再加入终浓度0.5 mmol/L的H2O2处理,同时设置对照组(不作任何处理)和H2O2组(仅加入0.5 mmol/L H2O2),培养24 h,参考Annexin-V/FITC凋亡检测试剂盒说明书进行实验,利用流式细胞仪检测细胞凋亡情况。
1.3.10 qPCR分析相关抗氧化酶基因表达
细胞处理同1.3.7节方法。培养24 h,弃去培养液,利用TRIzol方法提取RNA,利用反转录试剂盒进行cDNA合成。利用表1引物采用SYBR Green方法进行qPCR,反应体系20 μL,数据分析采用2-ΔΔCt法。
表 1 qPCR引物设计
Table 1 Primer design for qPCR

注:GST.谷胱甘肽巯基转移酶(glutathione S-transferase);NQO1.醌氧化还原酶1(quinone oxidoreductase 1);SOD1.超氧化物歧化酶 1(superoxide dismutase 1);CAT.过氧化氢酶(catalase enzymes)。
实验重复3 次,结果表示为 ±s,并用SPSS 22.0软件对数据进行单因素方差分析,比较组间差异。
±s,并用SPSS 22.0软件对数据进行单因素方差分析,比较组间差异。
还原能力的强弱可以反映物质的潜在抗氧化活性,是体外抗氧化活性的一个重要指标。抗氧化剂的还原力与其抗氧化活性之间存在一定的关系,还原力越强,抗氧化活性越强。因此,可通过还原力来表示其抗氧化活性的大小。
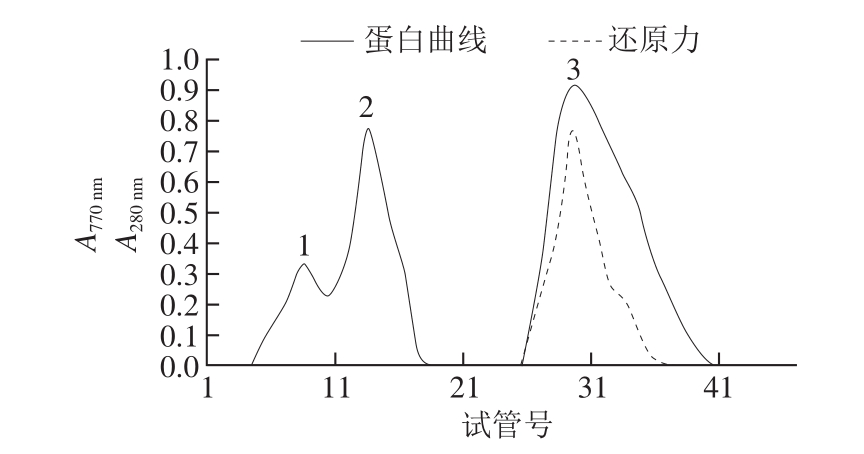
图 1 Sephadex G-25纯化小米抗氧化肽的层析及还原力结果
Fig. 1 Elution prof i le and reducing power detection of peptides on Sephadex G-25 column
小米抗氧化肽粗提液经过Sephadex G-25柱层析后,得到3 个洗脱峰,由图1可知,其中第3个峰组分具有很强的抗氧化活性,而第1个峰组分和第2个峰组分有部分重叠,抗氧化活性很弱,在基线水平。
收集第3个峰组分浓缩后经DEAE-32纤维素离子交换层析进一步分离纯化,结果如图2所示,第2个峰组分抗氧化活性最强,其余组分的抗氧化活性在基线水平。因此,收集第2个峰组分进行下一步实验。

图 2 DEAE-32纯化小米抗氧化肽的层析及还原力结果
Fig. 2 Elution prof i le and reducing power detection of peptides on DEAE-32 column
利用凝胶过滤和离子交换层析的方法分步进行多肽的纯化是一种纯化效率较高的方法,相比于单个类型的柱层析而言,能够得到更高的纯度。王双玉等[19]通过Sephadex G-25柱层析和离子交换层析的方法从玉米酶解物中分离纯化得到抗氧化肽。
为鉴定经Sephadex G-25柱层析和DEAE-32纤维素离子交换层析纯化后的小米抗氧化肽的纯度,以便为进一步的化学实验和细胞实验提供良好的实验材料,采用醋酸纤维素薄膜电泳进行小米抗氧化肽纯度的鉴定。

图 3 小米抗氧化肽醋酸纤维素薄膜电泳图
Fig. 3 Cellulose acetate electrophoresis pattern of purif i ed peptides
由图3可知,其醋酸纤维素薄膜电泳图谱仅显示单一条带,说明小米抗氧化肽基本上得到了纯化,达到电泳纯。
超氧阴离子自由基不仅本身有毒性,其经一系列反应生成的羟自由基也会对生物体有所损害。因此,寻找对自由基,特别是超氧阴离子自由基和羟自由基具有较强清除作用的天然抗氧化剂或清除剂,已成为一个非常重要的研究领域[20]。DPPH自由基是一种很稳定的氮中心的自由基,通常作为检验自由基清除能力的标准物质[21]。
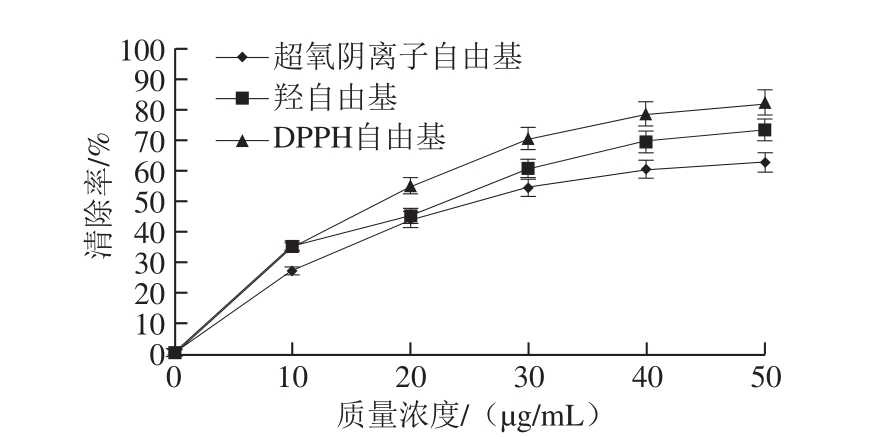
图 4 小米抗氧化肽对自由基清除率的影响
Fig. 4 Free radical scavenging effect of antioxidant peptides
由图4可知,经Sephadex G-25和DEAE-32纤维素分离纯化的小米抗氧化肽对超氧阴离子自由基、羟自由基和DPPH自由基的清除率随着小米抗氧化肽质量浓度升高而上升,当小米抗氧化肽质量浓度为50 μg/mL时,对这3 种自由基的清除率分别为(62.71±3.86)%、(73.56±4.51)%和(82.62±5.25)%,说明分离纯化的小米抗氧化肽具有较高的清除自由基的能力。相比于实验室前期制备的未纯化小米抗氧化肽,其自由基清除能力更强[13]。
胰岛细胞对ROS敏感,容易受到ROS的损伤,研究表明氧化应激参与了糖尿病的发生和发展[22],利用天然抗氧化物质进行胰岛细胞保护从而保持其细胞活力是一种保护胰岛细胞的有效方法[23]。
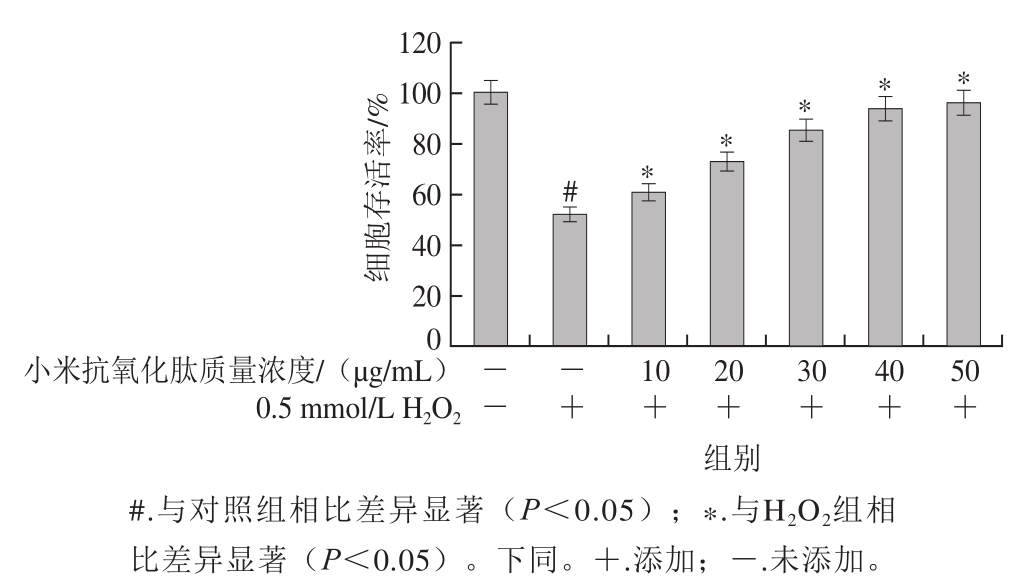
图 5 小米抗氧化肽对H2O2诱导损伤的INS-1细胞存活率影响
Fig. 5 Effect of antioxidant peptides on the viability of INS-1 cells subjected to oxidative stress induced by H2O2
由图5可见,H2O2组I N S-1细胞存活率为(52.30±3.96)%,当加入不同质量浓度的小米抗氧化肽后,随着小米抗氧化肽质量浓度的增加,INS-1细胞存活率上升,用50 μg/mL小米抗氧化肽处理时细胞的存活率达到(96.30±5.21)%。结果表明小米抗氧化肽对细胞存在保护作用。
ROS是生物有氧代谢过程中的一种副产物,它化学反应活性极强,在细胞信号转导和保持机体稳定性方面起着重要作用[24]。
当只用H2O2处理INS-1细胞时(图6B),细胞内ROS水平明显高于对照组(图6A),加入终质量浓度50 μg/mL小米抗氧化肽保护时,细胞内ROS的产生明显减少(图6C),说明小米抗氧化肽能够减少INS-1细胞内ROS的产生,缓解INS-1细胞氧化应激。
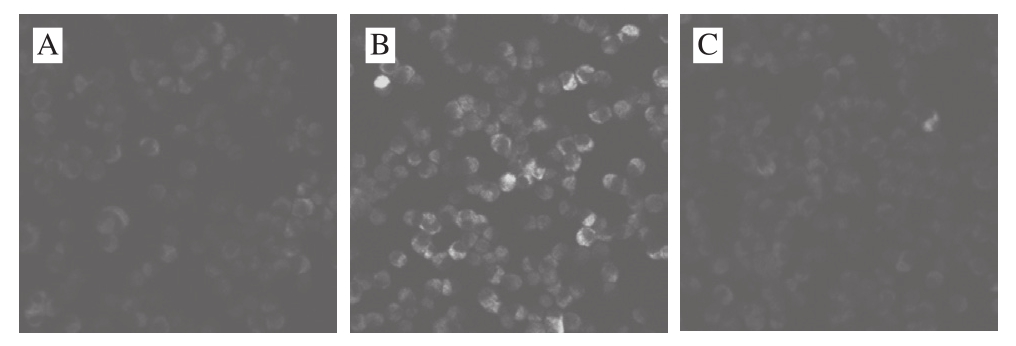
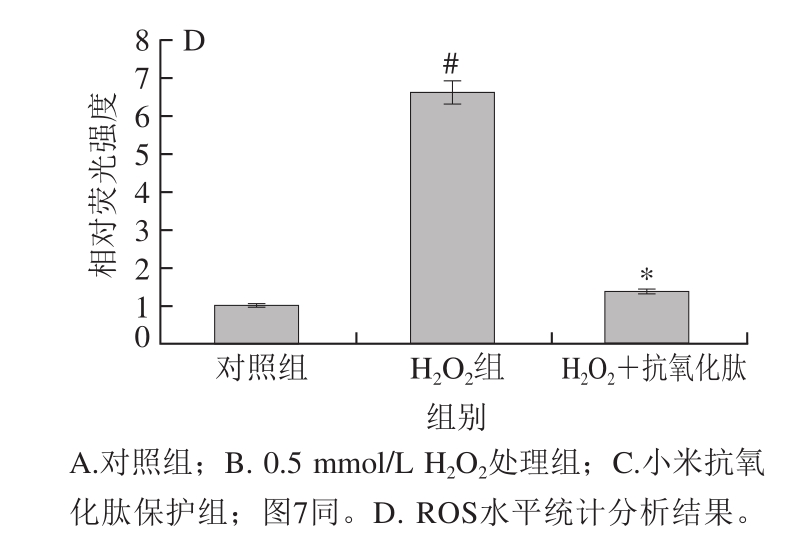
图 6 小米抗氧化肽对H2O2诱导损伤的INS-1细胞内ROS的影响
Fig. 6 Effect of antioxidant peptides on ROS activity in INS-1 cells
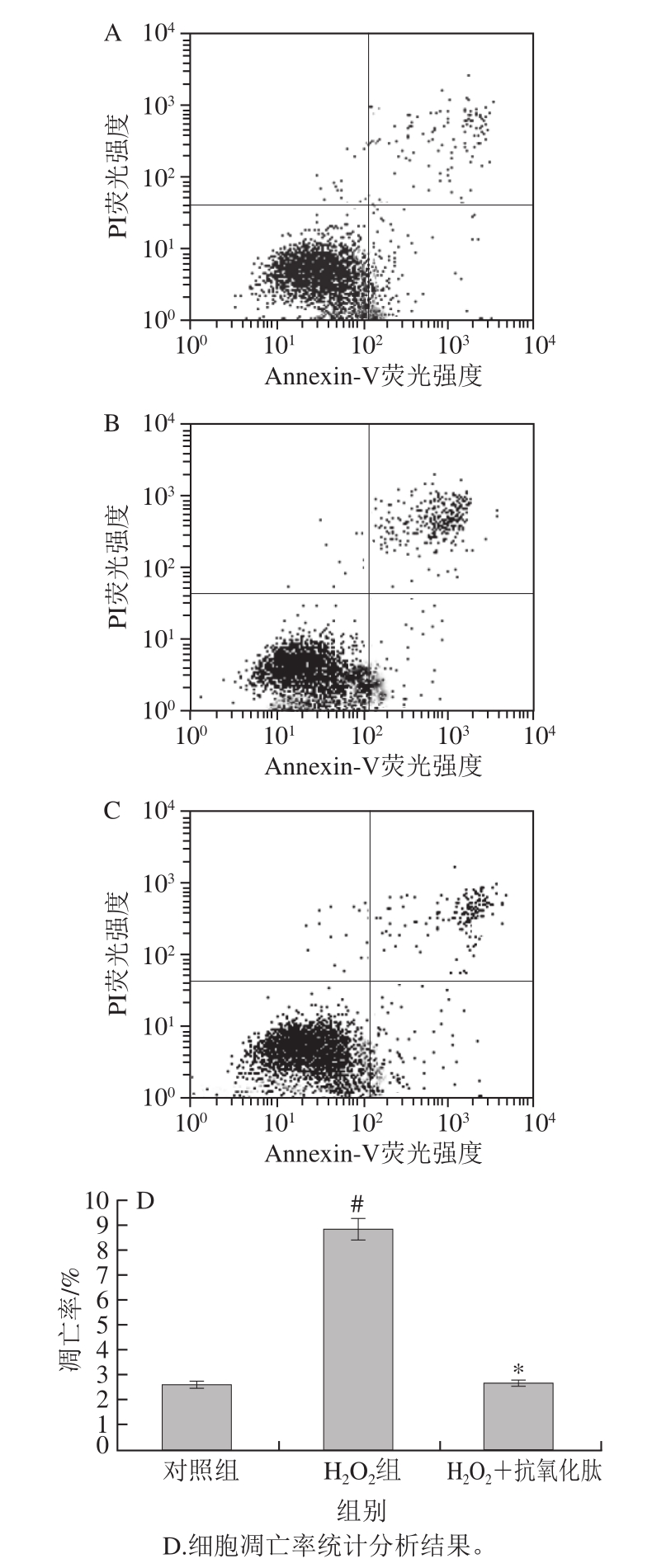
图 7 小米抗氧化肽对H2O2诱导损伤的INS-1细胞凋亡率的影响
Fig. 7 Effect of antioxidant peptides on cell apoptosis in INS-1 cells subjected to oxidative stress induced by H2O2
胰岛细胞凋亡是其功能退化的主要机制之一,抑制胰岛细胞凋亡可在一定程度上维持胰岛功能[25]。王婧茹等[26]利用番石榴酸对INS-1细胞氧化应激损伤及细胞凋亡的抑制作用进行了研究。
由图7可知,对照组、H2O2组、小米抗氧化肽保护组细胞凋亡率分别为(2.61±0.13)%、(8.82±0.26)%、(2.76±0.39)%。H2O2组细胞凋亡率显著高于对照组(P<0.05);50 μg/mL小米抗氧化肽+H2O2组INS-1细胞凋亡率显著低于H2O2组(P<0.05)。本实验说明H2O2导致细胞发生凋亡,小米抗氧化肽对其具有保护作用。
NF-E2相关因子2(NF-E2-related factor 2,Nrf2)/抗氧化元件(antioxidant response element,ARE)是细胞内重要的抗氧化信号通路[27]。Nrf2与胞质接头蛋白(cytoplasmic linker protein,Keap1)结合定位于细胞质,当受到调节后,Keap1释放Nrf2入核,Nrf2入核后与抗氧化元件ARE结合,使NQO1、GST等II相抗氧化酶的表达升高[28-29]。有研究表明,H2O2能够诱导抗氧化酶的表达,是细胞对ROS的应激反应[30],而天然抗氧化物能够通过诱导NQO1等的表达上调,起到抑制H2O2诱导的细胞损伤的作用[31]。
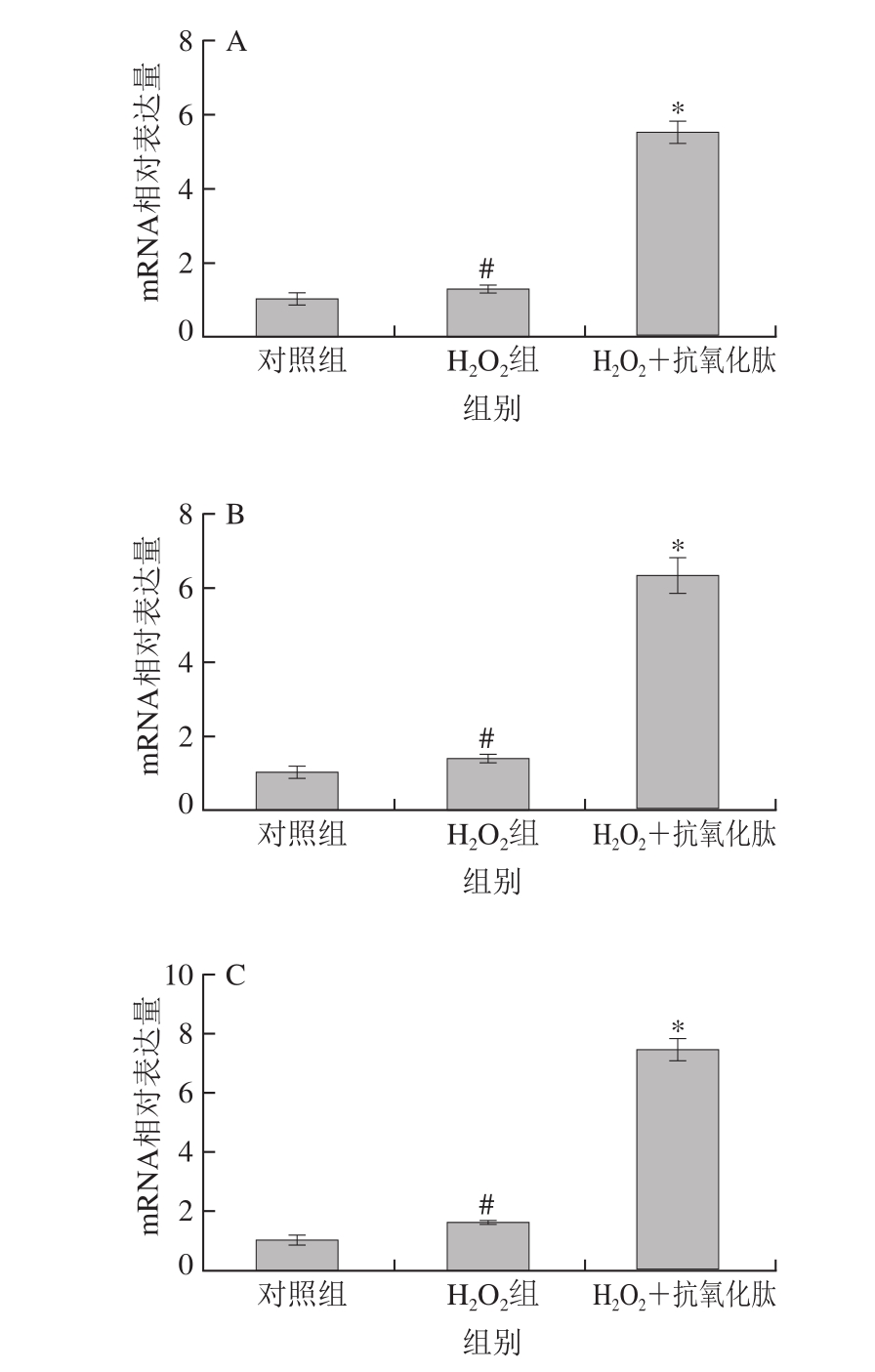
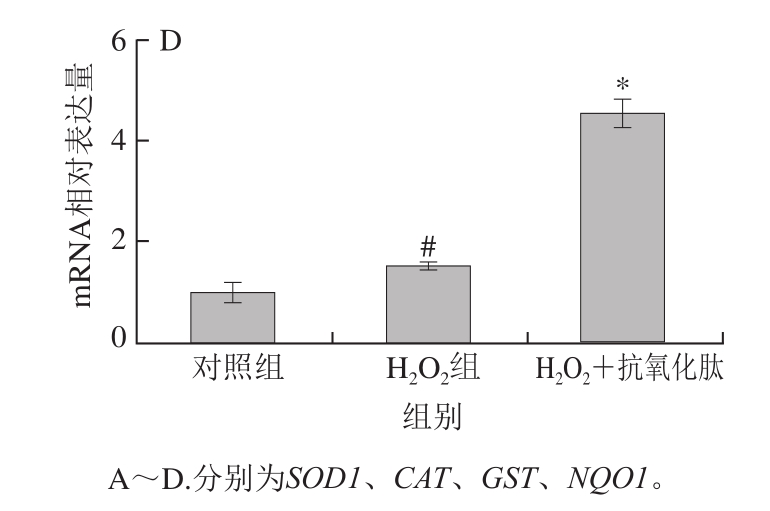
图 8 小米抗氧化肽对H2O2诱导损伤的INS-1细胞mRNA表达的影响
Fig. 8 Effect of antioxidant peptides on mRNA expression antioxidant enzymes in INS-1 cells subjected to oxidative stress induced by H2O2
如图8所示,小米抗氧化肽能够影响SOD1、CAT、GST、NQO1 mRNA表达水平,用H2O2处理INS-1细胞时,4 种抗氧化酶mRNA表达升高(P<0.05);添加小米抗氧化肽保护时,mRNA的表达水平显著升高(P<0.05),说明小米抗氧化肽能够激活Nrf2信号通路,上调相关抗氧化酶的表达,这可能是小米抗氧化肽抑制细胞氧化应激的作用机制。
本研究在前期酶解法制备获得小米抗氧化肽的基础上,并通过Sephadex G-25柱层析和DEAE-32纤维素离子交换层析的方法分离纯化,通过DCFH-DA荧光实验、MTT实验和流式细胞技术证明小米抗氧化肽能够抑制H2O2诱导损伤的INS-1细胞凋亡。同时,利用qPCR技术初步探索了小米抗氧化肽对细胞保护的作用机制。以上结果表明,小米抗氧化肽对H2O2诱导的细胞损伤具有较好的保护作用。本实验采用INS-1细胞进行细胞水平的实验,小米抗氧化肽是否在动物体内具有相关活性和其作用机制还有待进一步研究。
参考文献:
[1] 李振华, 龚吉军, 赵延华, 等. 抗氧化肽的研究进展[J]. 食品研究与开发, 2011, 32(6): 157-161. DOI:10.3969/j.issn.1005-6521.2011.06.046.
[2] 张强, 阚国仕, 陈红漫, 等. 酶解玉米蛋白粉制备抗氧化肽[J]. 食品工业科技, 2005, 26(6): 109-111. DOI:10.3969/j.issn.1002-0306.2005.06.030.
[3] 刘振家, 朱科学, 周惠明. 超声波辅助酶解脱脂小麦胚芽制备抗氧化肽的研究[J]. 中国油脂, 2009, 34(5): 38-41. DOI:10.3321/j.issn:1003-7969.2009.05.011.
[4] LIN S, WANG J, ZHAO P, et al. Optimized antioxidant peptides fractions preparation and secondary structure analysis by MIR[J].International Journal of Biological Macromolecules, 2013, 59(8): 151-157. DOI:10.1016/j.ijbiomac.2013.04.008.
[5] 高明侠, 苗敬芝, 吕兆启, 等. 超滤技术分离花生抗氧化肽及其性能研究[J]. 食品科学, 2009, 30(18): 54-57. DOI:10.3321/j.issn:1002-6630.2009.18.007.
[6] 冉茂良, 高环, 尹杰, 等. 氧化应激与DNA损伤[J]. 动物营养学报,2013, 25(10): 2238-2245. DOI:10.3969/j.issn.1006-267x.2013.10.007.
[7] REUTER S, GUPTA S C, CHATURVEDI M M, et al. Oxidative stress, inf l ammation, and cancer: how are they linked?[J]. Free Radical Biology and Medicine, 2010, 49(11): 1603-1616. DOI:10.1016/j.freeradbiomed.2010.09.006.
[8] 廖永晖, 汤雨, 千年松, 等. 氧化应激与细胞凋亡[J]. 新乡医学院学报, 2011, 28(1): 110-113.
[9] WU Y Q, REECE E A, ZHONG J X, et al. Type 2 diabetes mellitus induces congenital heart defects in murine embryos by increasing oxidative stress, endoplasmic reticulum stress, and apoptosis[J].American Journal of Obstetrics and Gynecology, 2016, 215(3): 1-10.DOI:10.1016/j.ajog.2016.03.036.
[10] 李爱琴, 陆环, 徐文静, 等. 氧化应激与2型糖尿病的研究进展[J]. 现代生物医学进展, 2010, 10(12): 2371-2372; 2378.
[11] 田利民, 刘静. 胰岛β细胞的氧化损伤[J]. 国际内分泌代谢杂志,2005, 25(1): 25-27. DOI:10.3760/cma.j.issn.1673-4157.2005.01.009.
[12] HO E, QUAN N, TSAI Y H, et al. Dietary zinc supplementation inhibits NFκB activation and protects against chemically induced diabetes in CD1 mice[J]. Experimental Biology and Medicine, 2001,226(2): 103-111. DOI:10.1177/153537020122600207.
[13] 刘剑利, 曹向宇. 小米多肽的制备及其抗氧化功能研究[J]. 食品科学, 2009, 30(8): 64-67. DOI:10.3321/j.issn:1002-6630.2009.08.010.
[14] 曹向宇, 刘剑利, 侯萧, 等. 麦麸多肽的分离纯化及体外抗氧化功能研究[J]. 食品科学, 2009, 30(5): 257-259. DOI:10.3321/j.issn:1002-6630.2009.05.059.
[15] 于丽娜, 高俊安, 杨庆利, 等. 不同处理条件对花生抗氧化肽抗氧化活性的影响[J]. 食品科学, 2012, 33(11): 104-110.
[16] 曹炜, 卢珂, 陈卫军, 等. 不同种类蜂蜜抗氧化活性的研究[J]. 食品科学, 2005, 26(8): 352-356. DOI:10.3321/j.issn:1002-6630.2005.08.091.
[17] 郭利娜, 朱玉, 刁明明, 等. 枯草芽孢杆菌发酵小米糠对其抗氧化肽含量与抗氧化活性的影响[J]. 食品科学, 2015, 36(13): 196-201.DOI:10.7506/spkx1002-6630-201513036.
[18] 刘剑利, 刘晓, 曹向宇, 等. 稠李花色苷的纯化及体外抗氧化活性[J].食品科学, 2015, 36(15): 5-10. DOI:10.7506/spkx1002-6630-201515002.
[19] 王双玉, 李坤, 阚国仕, 等. 玉米抗氧化肽的制备及其对小鼠急性酒精性肝损伤的保护作用[J]. 食品研究与开发, 2007, 28(3): 29-33.DOI:10.3969/j.issn.1005-6521.2007.03.009.
[20] MORITA M, NAITO Y, NIKI E, et al. Antioxidant action of fermented grain food supplement: scavenging of peroxyl radicals and inhibition of plasma lipid oxidation induced by multiple oxidants[J].Food Chemistry, 2017, 237(15): 574-580. DOI:10.1039/c6fo00275g.
[21] 郑铁松, 张敏. 莲子心提取液对超氧阴离子和羟自由基的清除作用[J]. 食品科学, 2005, 26(8): 357-361. DOI:10.3321/j.issn:1002-6630.2005.08.092.
[22] RAINS J L, JAIN S K. Oxidative stress, insulin signaling, and diabetes[J]. Free Radical Biology and Medicine, 2011, 50(5): 567-575.DOI:10.1016/j.freeradbiomed.2010.12.006.
[23] MCCABE C, SAMALI A, O’BRIEN T. β Cell cytoprotective strategies: establishing the relative roles for iNOS and ROS[J].Biochemical and Biophysical Research Communications, 2006,342(4): 1240-1248. DOI:10.1016/j.bbrc.2006.02.092.
[24] 楚广品, 邱平, 胡岳, 等. ROS介导的炎症反应与中枢神经系统疾病[J]. 中国组织化学与细胞化学杂志, 2016, 25(3): 285-290.DOI:10.16705/j.cnki.1004-1850.2016.03.017.
[25] KANETO H, NAKATANI Y, KAWAMORI D, et al. Role of oxidative stress, endoplasmic reticulum stress, and c-Jun N-terminal kinase in pancreatic β-cell dysfunction and insulin resistance[J]. The International Journal of Biochemistry & Cell Biology, 2006, 38(5/6):782-793. DOI:10.1016/j.biocel.2006.01.004.
[26] 王婧茹, 叶开和, 吕艳青, 等. 番石榴酸抗H2O2诱导的INS-1胰岛β细胞氧化损伤作用及其机制分析[J]. 中国药学杂志, 2015, 50(3): 233-238.
[27] UNGVARI Z, BAILEY-DOWNS L, GAUTAM T, et al. Adaptive induction of NF-E2-related factor-2-driven antioxidant genes in endothelial cells in response to hyperglycemia[J]. American Journal of Physiology-Heart and Circulatory Physiology, 2011, 300(4): 1133-1140. DOI:10.1152/ajpheart.00402.2010.
[28] YOSUKE T, KAZUTOSHI M, AYA U, et al. Antioxidant properties of 5-hydroxy-4-phenyl-butenolide via activation of Nrf2/ARE signaling pathway [J]. Food and Chemical Toxicology, 2017, 107:129-137. DOI:10.1016/j.fct.2017.06.039.
[29] ZHU C, DONG Y, LIU H, et al. Hesperetin protects against H2O2-triggered oxidative damage via upregulation of the Keap1-Nrf2/HO-1 signal pathway in ARPE-19 cells[J]. Biomedicine & Pharmacotherapy,2017, 88: 124-133. DOI:10.1016/j.biopha.2016.11.089.
[30] MA T J, CHEN T J, LI P, et al. Heme oxygenase-1 (HO-1) protects human lens epithelial cells (SRA01/04) against hydrogen peroxide(H2O2)-induced oxidative stress and apoptosis[J]. Experimental Eye Research, 2016, 146: 318-329. DOI:10.1016/j.exer.2016.02.013.
[31] KIM J, LEE S, SHIM J, et al. Caffeinated coffee, decaffeinated coffee,and the phenolic phytochemical chlorogenic acid up-regulate NQO1 expression and prevent H2O2-induced apoptosis in primary cortical neurons[J]. Neurochemistry International, 2012, 60(5): 466-474.DOI:10.1016/j.neuint.2012.02.004.
Purif i cation of Antioxidant Peptide from Millet and Its Protective Effect against Oxidative Stress Induced by H2O2in INS-1 Cells
WANG Shuai, LIU Jianli, HUO Yapeng, YAN Xiao, TIAN Siqi, HE Yin, CAO Xiangyu*
(School of Life Science, Liaoning University, Shenyang 110036, China)
Abstract:Antioxidant peptides were purif i ed from millet protein hydrolysate by sequential column chromatographies on Sephadex G-25 and DEAE-32. Cellulose acetate electrophoresis was used to determine the purity of the purif i ed peptides.The antioxidant effect was investigated by detecting radical scavenging activity against superoxide anion, hydroxyl and 1,1-diphenyl-2-picrylhydrazyl (DPPH) radicals. In order to investigate the protective effect of the antioxidant peptides on islet cells, an INS-1 cell model of oxidative stress induced by H2O2was used. The 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide method was applied to detect the cell viability, fl ow cytometry was used to detect the cell apoptosis,and real-time polymerase chain reaction was employed to analyze the gene expression of antioxidant enzymes. The results showed that the peptides were purif i ed to electrophoretic homogeneity. The percentage scavenging of superoxide anion,hydroxyl and DPPH radicals by the peptides were (62.71 ± 3.86)%, (73.56 ± 4.51)% and (82.62 ± 5.25)%, respectively.The peptides could significantly promote cell viability, reduce the level of cellular reactive oxygen species, and inhibit cell apoptosis (P < 0.05). The mechanism may be related to the up-regulated expression of antioxidant enzymes including superoxide dismutase 1, catalase enzymes, glutathione S-transferases, and quinone oxidoreductase 1. This study conclusively demonstrated that the antioxidant peptides from millet showed a signif i cant protection against oxidative stress induced by H2O2in INS-1 cells.
Keywords:antioxidant peptides from millet; oxidative stress; islet cell; apoptosis
DOI:10.7506/spkx1002-6630-201819026. http://www.spkx.net.cn
WANG Shuai, LIU Jianli, HUO Yapeng, et al. Purif i cation of antioxidant peptide from millet and its protective effect against oxidative stress induced by H2O2in INS-1 cells[J]. Food Science, 2018, 39(19): 169-174. (in Chinese with English abstract)
王帅, 刘剑利, 霍雅鹏, 等. 小米抗氧化肽的纯化及其抑制H2O2诱导损伤的胰岛素瘤细胞氧化应激作用[J]. 食品科学,2018, 39(19): 169-174. DOI:10.7506/spkx1002-6630-201819026. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0169-06
文献标志码:A
中图分类号:TS201.2
DOI:10.7506/spkx1002-6630-201819026
*通信作者简介:曹向宇(1980—),男,教授,博士,研究方向为食品生物技术。E-mail:xycaolnu@163.com
第一作者简介:王帅(1993—),男,硕士研究生,研究方向为食品生物技术。E-mail:2677022481@qq.com
辽宁省高等学校科学研究一般项目(L2014007)
辽宁省博士科研启动基金项目(20170520258);辽宁省高等学校优秀人才支持计划项目(LJQ2013002);
基金项目:国家自然科学基金面上项目(31770017);辽宁省农业领域青年科技创新人才培养资助计划项目(2015013);
收稿日期:2017-08-02