
张 健1,2,3,王共明1,刘少伟2,*,张 毅3,赵云苹1,李振铎1,井月欣1,刘 芳1
(1.山东省海洋资源与环境研究院,山东 烟台 264006;2.华东理工大学生物工程学院,生物反应器工程国家重点实验室,上海 200237;3.中国科学院上海生命科学研究院,上海 200233)
摘 要:以仿刺参卵和体壁为原料制备多肽,测定其基本营养成分和分子质量分布,并研究其对淋巴细胞增殖作用和小鼠免疫功能的影响。采用生物酶解技术和切向流超滤技术分离和制备仿刺参卵和体壁多肽,磺酰罗丹明B比色分析法测定了多肽质量浓度(10、50、100、500 μg/mL)对小鼠淋巴细胞增殖(spleen lymphocyte proliferation,SLP)能力的影响,设定水对照组和多肽低、中、高(日剂量83.3、166.7、500.0 mg/kg)剂量组进行30 d小鼠灌胃实验,检测了小鼠脏器/体质量、迟发型变态反应能力、伴刀豆球蛋白A诱导的小鼠脾淋巴细胞转化能力、抗体生成细胞数、小鼠血清溶血素水平、小鼠碳廓清能力、小鼠腹腔巨噬细胞吞噬鸡红细胞能力及自然杀伤细胞活力等指标。结果表明,仿刺参卵和体壁1~10 kDa多肽(EP1和BWP1)在500 μg/mL时均对SLP具有显著的促进作用,其粗蛋白含量分别为64.74、70.25 g/100 g,氨基酸总量分别为45.69、63.26 g/100 g,分子质量分别分布在130~1 600 Da及130~2 500 Da之间。经口服灌胃给予小鼠不同剂量的多肽30 d,EP1可提高小鼠的细胞免疫功能和单核-巨噬细胞吞噬功能,BWP1可提高小鼠的体液免疫功能和单核-巨噬细胞吞噬功能。结果提示EP1和BWP1均具有增强免疫力的功能,可开发为新的免疫调节产品。
关键词:仿刺参卵;多肽;分子质量;免疫功能;小鼠
海参自古以来就是我国的名贵滋补品,素有“海中人参”之称,是一种高蛋白低胆固醇的营养品[1]。海参不仅营养成分丰富,而且已发现其含有许多具有生物活性的物质,如胶原蛋白[2]、海参多糖[3]、海参皂苷[4]及多肽[5-6]等。目前对于海参活性肽的研究越来越多,主要集中在抗氧化[7]、抗疲劳[8]、抗菌[9]、降血压[10]及抗肿瘤[11]等方面,在免疫调节方面报道还较少。
免疫调节肽是指具有增强免疫功能作用的一类生物活性肽,通过调节细胞因子的产生、增强体内巨噬细胞吞噬功能以及促进淋巴细胞的增殖来起作用。有研究发现,免疫调节肽具有增强机体抵抗外界病毒感染的能力,以此降低发病率,保持机体的健康状态[12]。海参肽无抗原性,吸收快且易被机体利用,在人体代谢方面显示出重要的生物活性。
仿刺参卵是仿刺参加工的副产物,研究发现仿刺参卵营养均衡,是优质的多肽来源之一[13]。本研究以仿刺参卵和体壁为原料,提取制备多肽,比较了多肽对小鼠淋巴细胞增殖(spleen lymphocyte proliferation,SLP)能力的影响,测定了分子质量在1~10 kDa的多肽的营养成分、氨基酸组成和分子质量分布,并对其对小鼠免疫作用的影响进行了研究。
雌性SPF昆明种小鼠由山东大学动物实验中心提供,生产许可证号为SCXK(鲁)20130009。
鲜仿刺参、仿刺参卵 烟台山水海产有限公司;木瓜蛋白酶(100万 U/g) 南宁庞博生物工程有限公司;绵羊红细胞(SRBC)、补体(豚鼠血清)、小鼠淋巴瘤(YAC-1)细胞、磺酰罗丹明B(sulforhodamine B,SRB) 中国医学科学院;印度墨汁 青岛海博生物技术有限公司;细胞色素C(Mr12 500)、抑肽酶(Mr6 500)、杆菌酶(Mr1 450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mr451)、乙氨酸-乙氨酸-乙氨酸(Mr189)、硝基氯化四氮唑、吩嗪二甲酯磷酸盐、氧化型辅酶I、伴刀豆球蛋白A(concanavalin A,ConA)、二甲基亚砜(dimethyl sulfoxide,DMSO)、四甲基偶氮唑蓝(thiazolyl blue tetrazolium bromide,MTT)、RPMI 1640培养液 美国Sigma公司。
1200型高效液相色谱(high performance liquid chromatography,HPLC)仪、Eclipse-AAA HPLC柱(4.6 mm×150 mm,5 μm) 美国Agilent公司;TSK-gel G2000SWXL色谱柱(7.8 mm×300 mm,5 μm) 日本TOSOH公司;TGL-16M台式高速冷冻离心机 湖南湘仪仪器有限公司;CO2培养箱、1510型酶标仪 美国Thermo Fisher Scientific公司;CKX41倒置显微镜、SZ61解剖镜 日本OLYMPUS公司。
1.3.1 仿刺参卵和体壁梯级肽的制备
取新鲜仿刺参卵和体壁,匀浆后按照文献[14]酶解工艺条件,制备得到一定量的仿刺参卵和体壁酶解液。先后过普通滤纸、0.45 μm和0.22 μm的微孔滤膜,再使用超滤系统和截留分子质量为10 kDa和1 kDa的切向流膜包,分离得到分子质量在1~10 kDa的卵多肽(EP1)、小于1 kDa的卵多肽(EP2)和1~10 kDa的体壁多肽(BWP1)、小于1 kDa的体壁多肽BWP2。使用截留分子质量为100 Da的透析袋对组分进行脱盐处理。
1.3.2 多肽对小鼠SLP能力的影响
SLP实验采用SRB比色分析法[15]。在无菌环境中制备脾淋巴细胞悬液,稀释成2×106个/mL,向培养板每孔中移入100 μL淋巴细胞悬液,实验组添加质量浓度分别为10、50、100、500 μg/mL的仿刺参卵多肽(EP1、EP2)和体壁多肽(BWP1、BWP2),对照组加入同体积的RPMI 1640完全培养液。实验重复6 次,在5% CO2、37 ℃条件下培养48 h,利用三氯乙酸固定细胞。添加SRB染液100 μL反应30 min,用体积分数1%乙酸溶液冲洗后干燥。最后加入10 mmol/L Tris缓冲液100 μL溶解5 min,检测515 nm波长处OD值。
1.3.3 营养成分及分子质量分布测定
水分含量按照GB/T 5009.3—2016《食品安全国家标准 食品中水分的测定》测定;灰分含量按照GB/T 5009.4—2016《食品安全国家标准 食品中灰分的测定》测定;蛋白质含量根据GB/T 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法测定;多糖含量测定采用苯酚-硫酸法[16];氨基酸组成测定采用邻苯二甲醛柱前衍生法[13];分子质量分布的测定采用高效凝胶过滤色谱法[17]。
1.3.4 体内免疫实验的剂量与分组
EP1和BWP1实验各选用18~22 g的雌性SPF昆明种小鼠120 只,随机平均分成3 个大组(分别为免疫一组、免疫二组和免疫三组,每组40 只),每大组又分为水对照组和低、中、高剂量组(每组10 只)。按相当于人体推荐量(1.0 g/(人·d),体质量按60 kg计)的5、10、30 倍确定小鼠的低(83.3 mg/kg)、中(166.7 mg/kg)、高(500.0 mg/kg)剂量。经口服灌胃给予小鼠不同剂量的多肽30 d后,免疫一组用于迟发型变态反应(delayed-type hypersensitivity,DTH)能力、小鼠血清溶血素(serum hemolysin formation,CSH)水平及抗体生成细胞数(number of antibody-forming cells,NAC)的测定;免疫二组用于小鼠碳廓清(carbon clearance capability,MCC)能力的测定;免疫三组用于小鼠腹腔巨噬细胞吞噬鸡红细胞(chicken red blood cell phagocytosis ability of macrophages,MCR)能力、小鼠脾淋巴细胞转化(spleen lymphocyte transformation,SLT)能力和自然杀伤细胞(natural killer cell cytoactive,NKC)活力的测定。
1.3.5 小鼠脏器/体质量的测定
称量小鼠原始状态时的体质量,连续给予样品30 d后处死,取出胸腺和脾脏,清理干净后称质量,计算小鼠脏器/体质量。
1.3.6 DTH能力的测定
DTH能力测定采用足跖增厚法[18]。实验组小鼠经腹腔注射生理盐水配制的体积分数2%压积SRBC溶液0.2 mL,4 d后测量左后足跖部厚度,在测量处皮下注射体积分数20%压积SRBC溶液20 μL,24 h后再次测定,以两次测定的足跖厚度的变化即足跖肿胀度表示DTH能力。
1.3.7 SLT能力的测定
SLT能力的测定采用MTT法[18]。在无菌环境中制备脾淋巴细胞悬液,用RPMI 1640完全培养液稀释成3×106个/mL,加入24 孔培养板中两个孔各1 mL,一孔移取75 μL 7.5 μg/mL ConA溶液作为实验孔,另一孔作为对照,在5% CO2、37 ℃条件下培养68 h后从上清液中吸取0.7 mL液体,再加入同体积的RPMI 1640培养液(不含有小牛血清),此时两孔均加入50 μL MTT(5 mg/mL),5% CO2、37 ℃下再培养4 h。向每孔中加入酸性异丙醇1 mL,反复吹打使紫色结晶全部溶解,测定570 nm波长处OD值。以实验孔与对照孔OD值之差表示SLT能力。
1.3.8 NAC的测定
NAC的测定采用Jerne改良玻片法[18]。在小鼠腹腔位置注射体积分数2%压积SRBC溶液(生理盐水配制)0.2 mL,反应5 d后将小鼠处死取脾脏,在无菌环境中处理成细胞悬液。将10 g/L琼脂糖和等量双倍Hank’s液混合后移入多个小管,每管0.5 mL,添加体积分数10%压积SRBC溶液(SA缓冲液配制)50 μL及脾细胞悬液20 μL,移到提前准备好的琼脂糖薄层玻片上,放入CO2培养箱反应1.5 h,在玻片架凹槽中补充补体(SA缓冲液体积比1∶8稀释),再培养1.5 h后用解剖镜对溶血空斑数进行计数。
1.3.9 CSH水平的测定
在小鼠腹腔位置注射体积分数2%压积SRBC溶液(生理盐水配制)0.2 mL,反应5 d后眼球取血,血液移入离心管中,静置后2 000 r/min离心10 min取血清。把不同稀释度血清(生理盐水对倍稀释)加入微量血凝板各100 μL,同时移取体积分数0.5% SRBC悬液(生理盐水配制)100 μL,混合均匀后湿润环境37 ℃孵育3 h,观察血球凝集程度,以血清对倍稀释指数与凝集度乘积之和计算抗体积数[19]。
1.3.10 MCC能力的测定
在小鼠尾静脉处注射一定体积1∶5(V/V)稀释的印度墨汁,注射后开始计时,分别在2 min和10 min时在内眦静脉丛位置取血20 μL与2 mL 1 g/L Na2CO3溶液反应。测定600 nm波长处OD值,用Na2CO3溶液作为对照。之后把小鼠处死,取肝及脾并称质量,依照式(1)、(2)计算吞噬指数a[19]。

式中:k为碳廓清指数;OD1、OD2分别为t1和t2时血标本OD值;t1、t2分别为2 min和10 min。
1.3.11 MCR能力的测定
MCR能力的测定采用半体内法[20]。在小鼠腹腔位置注射体积分数20%压积SRBC溶液(生理盐水配制)1 mL,0.5 h后注入腹腔生理盐水2 mL,轻揉小鼠腹部1 min,取腹腔液1 mL,滴于载玻片上,平放于湿盒内,在37 ℃培养箱温育30 min。使用配好的丙酮-甲醇溶液(体积比1∶1)固定,体积分数4% Giemsa-磷酸盐缓冲液染色,蒸馏水漂洗晾干。油镜下计数,每片计数100 个巨噬细胞,以式(3)、(4)计算吞噬率和吞噬率指数。

1.3.12 NKC活力的测定
NKC活力的测定采用乳酸脱氢酶测定法[20]。取YAC-1传代24 h后的细胞,用RPMI 1640完全培养液稀释细胞,使其数量为4×105个/mL,作为靶细胞。无菌取脾制备脾细胞悬液,Hank’s液洗3 次后离心,用含体积分数10%小牛血清的RPMI 1640完全培养液重悬,稀释细胞总数至2×107个/mL,作为效应细胞。取靶细胞和效应细胞(数量比1∶50)各100 μL,加入96 孔培养板中,靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和体积分数1% NP40各100 μL,实验重复6 次,在37 ℃、5% CO2条件下培养4 h,离心后吸取每孔上清液100 μL,再加入乳酸脱氢酶基质液100 μL反应10 min,使用30 μL 1 mol/L HCl溶液终止反应,490 nm波长处测定OD值。按式(5)计算NKC活力。
采用Excel 2010软件整理数据,数据表示为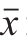 ±s,采用SPSS 22.0软件进行统计学分析,组间比较采用Student’s t检验,以P<0.05表示差异显著。
±s,采用SPSS 22.0软件进行统计学分析,组间比较采用Student’s t检验,以P<0.05表示差异显著。
表 1 EP1、EP2、BWP1、BWP2对SLP能力的影响
Table 1 Effect of EP1, EP2, BWP1, and BWP2 on SLP
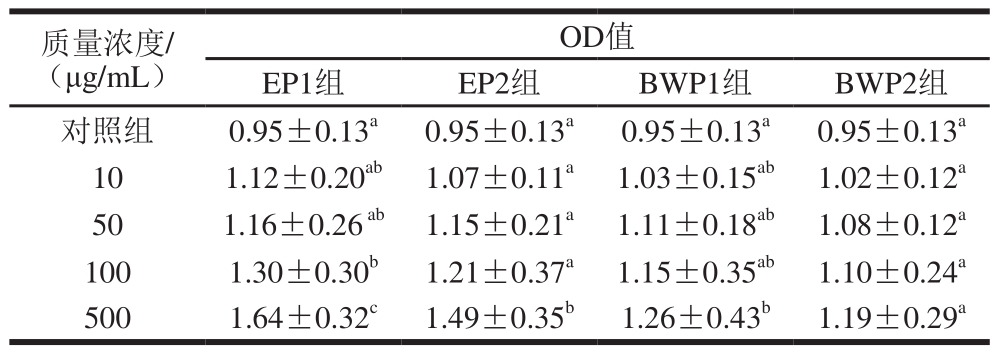
注:同列肩标不同小写字母表示差异显著(P<0.05),表4~15同。
由表1可见,EP1、EP2和BWP1在500 μg/mL时,与对照组相比均有显著性差异(P<0.05),即对SLP具有显著的促进作用。仿刺参卵多肽作用能力强于仿刺参体壁多肽,同时两种多肽1~10 kDa组分均比小于1 kDa组分能力强,因此选择EP1和BWP1进行营养成分及分子质量分布测定,并进一步探索其在小鼠体内的免疫作用。
表 2 EP1和BWP1的基本营养成分
Table 2 Nutritional components of EP1 and BWP1 g/100 g

由表2可知,EP1粗蛋白含量为65 g/100 g左右,高于已报道的仿刺参卵原料(51.80 g/100 g),且粗多糖含量相比仿刺参卵原料(26.98 g/100 g)降低了15 g/100 g左右[13],说明超滤处理使多肽得到了进一步分离纯化。BWP1粗蛋白含量略高于EP1,达到了70 g/100 g左右,比已报道的仿刺参体壁粗蛋白含量(57.10 g/100 g)提高了13 g/100 g左右,而灰分含量也有所降低[21]。
表 3 EP1和BWP1的氨基酸组成
Table 3 Amino acid compositions of EP1 and BWP1

由表3可知,在检出的所有氨基酸中,EP1氨基酸总量达到了45.69 g/100 g,鲜味氨基酸总量为20.62 g/100 g(占氨基酸总量的45.1%),均低于BWP1(氨基酸总量63.26 g/100 g,鲜味氨基酸总量35.52 g/100 g(占氨基酸总量的56.1%)),但EP1必需氨基酸总量为17.27 g/100 g(占氨基酸总量的37.8%),高于BWP1(15.49 g/100 g,占氨基酸总量的24.5%)。
天冬氨酸、谷氨酸和甘氨酸等鲜味氨基酸含量在EP1和BWP1中占比均较高,说明两种多肽均保留着浓郁的海鲜风味。另外EP1中含量较高的还有蛋氨酸、赖氨酸和苏氨酸,BWP1中含量较高的还有精氨酸、脯氨酸和丝氨酸。有研究发现较高含量的天冬氨酸、谷氨酸和甘氨酸对促进免疫细胞增殖等方面具有重要的作用[22]。
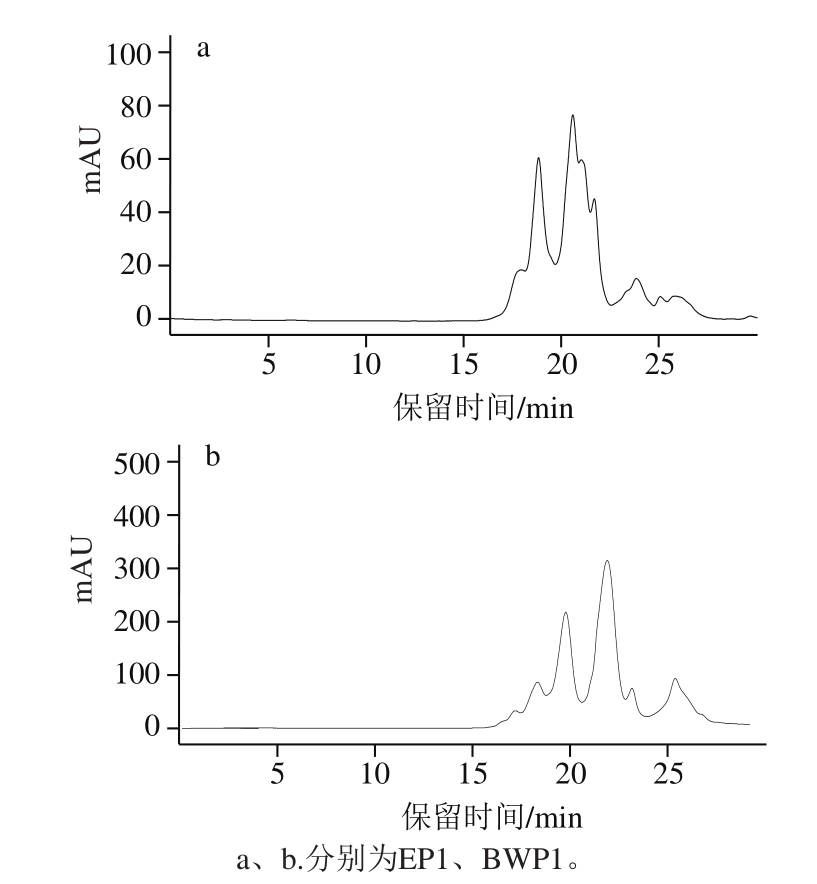
图 1 EP1和BWP1的凝胶色谱图
Fig. 1 Gel filtration chromatography of EP1 and BWP1
由标准品分子质量和保留时间可以计算得到标准曲线,将样品的保留时间带入方程即可换算得到样品分子质量。以分子质量的对数和保留时间作图得到分子质量校正曲线,方程为y=-0.220x+6.942,R2=0.993,线性关系良好,可以较准确地测定多肽分子质量分布。经计算得出,EP1分子质量分布在130~1 600 Da之间,BWP1分子质量分布在130~2 500 Da之间。
有研究报道海参肽一般由3~10 个氨基酸组成,主要是分子质量2 000 Da以下的小肽[23-24]。海参酶解液的多肽分子质量主要在5 000 Da以下,1 500 Da以下的多肽占60%[25]。也有学者发现,对于不同的酶解工艺条件和酶解方式,得到的多肽分子质量也不同[26]。
表 4 EP1对小鼠体质量的影响
Table 4 Effect of EP1 on body mass of mice g
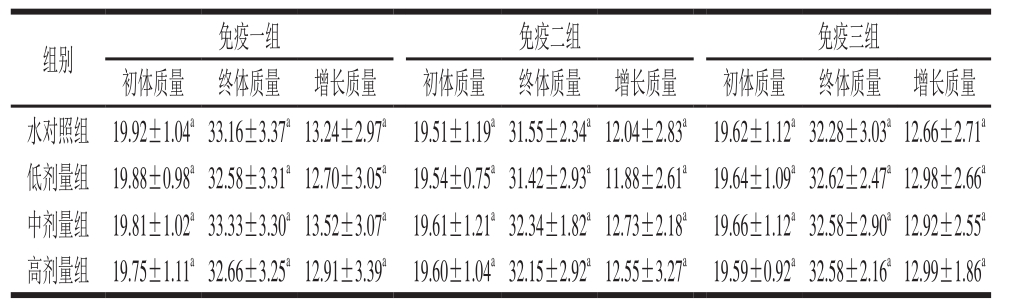
表 5 BWP1对小鼠体质量的影响
Table 5 Effect of BWP1 on body mass of mice g
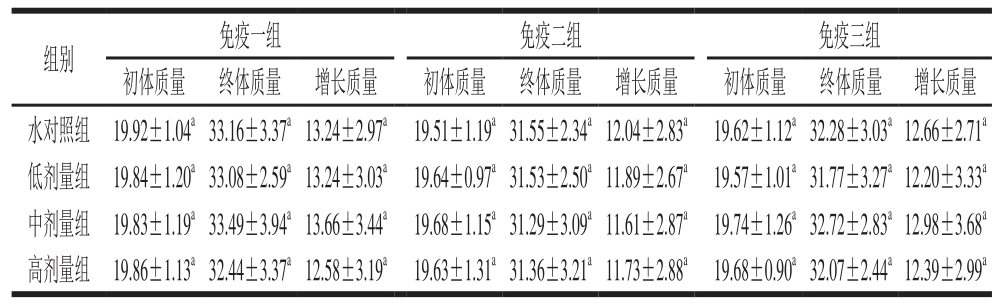
由表4、5可见,小鼠初体质量在各剂量组间无显著性差异(P>0.05),即小鼠的初体质量在各组间较为均衡。EP1和BWP1各剂量组样品实验结果表明,体质量增长差异不显著(P>0.05),因此认为EP1和BWP1均对小鼠体质量无影响。
表 6 EP1和BWP1对小鼠脾脏/体质量的影响
Table 6 Effect of EP1 and BWP1 on spleen/body mass ratio
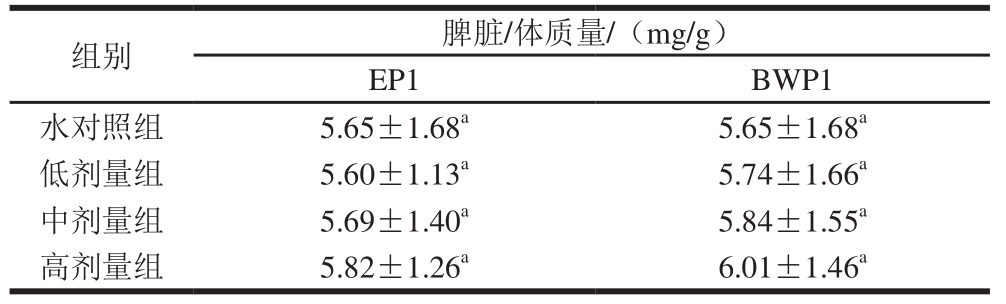
由表6可见,EP1和BWP1各剂量组样品实验结果表明,其脾脏/体质量在各剂量组间均无显著性差异(P>0.05),因此认为EP1和BWP1对小鼠脾脏/体质量无影响。
表 7 EP1和BWP1对小鼠胸腺/体质量的影响
Table 7 Effect of EP1 and BWP1 on thymus/body mass ratio

由表7可见,EP1和BWP1各剂量组样品实验结果表明,其胸腺/体质量在各剂量组间均无显著性差异(P>0.05),因此认为EP1和BWP1对小鼠胸腺/体质量无影响。
2.5.1 EP1和BWP1对小鼠DTH能力的影响
表 8 EP1和BWP1对小鼠DTH能力的影响
Table 8 Effects of EP1 and BWP1 on DTH
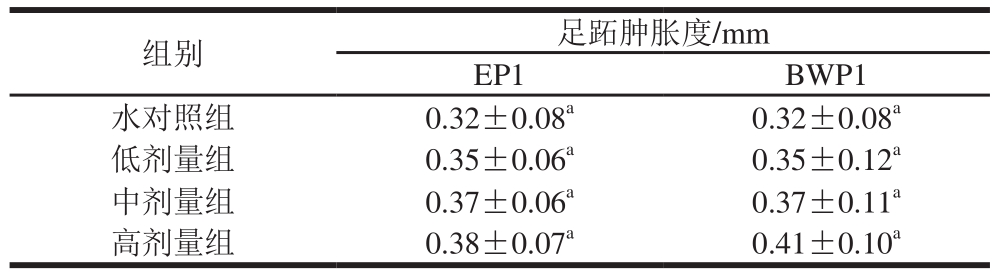
由表8可见,EP1和BWP1各剂量组样品实验结果表明,其足跖肿胀度在各组间均无显著性差异(P>0.05),因此认为EP1和BWP1对小鼠DTH能力无影响。
2.5.2 EP1和BWP1对小鼠SLT能力的影响
SLT实验是测定免疫细胞功能的常用方法[27]。当淋巴细胞受到各种因子刺激时会发生细胞增殖。此时细胞代谢旺盛,需要大量的能量来合成各种大分子物质和完成分裂过程,Mosmann根据细胞能量代谢的水平与细胞增殖之间的关系首创了MTT比色分析方法[28]。
表 9 EP1和BWP1对小鼠SLT能力的影响
Table 9 Effects of EP1 and BWP1 on SLT

由表9可见,EP1各剂量组样品实验结果表明,中、高剂量组与水对照组比较均差异显著(P<0.05),即中、高剂量EP1可增强SLT能力。另外,EP1中含量较高的蛋氨酸、赖氨酸和苏氨酸都是限制性氨基酸,有研究发现蛋氨酸和赖氨酸对脾脏、胰脏及淋巴的生长有促进作用,缺乏苏氨酸会抑制免疫球蛋白、T淋巴细胞和B淋巴细胞的产生,进而影响免疫功能[29]。BWP1各剂量组样品实验结果表明,其SLT能力在各组间均无显著性差异(P>0.05),因此认为BWP1对SLT能力无影响。
2.6.1 EP1和BWP1对小鼠NAC的影响
表 10 EP1和BWP1对小鼠NAC的影响
Table 10 Effects of EP1 and BWP1 on NAC

由表10可见,EP1各剂量组样品实验结果表明,其NAC在各组间无显著性差异(P>0.05),可认为EP1可对NAC无影响。BWP1各剂量组样品实验结果表明,中、高剂量组与水对照组相比均差异显著(P<0.05),因此判定BWP1具有提高小鼠NAC的作用。
2.6.2 EP1和BWP1对小鼠CSH水平的影响
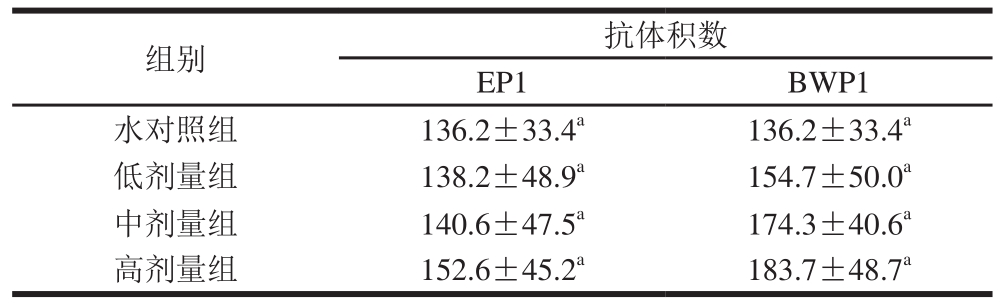
由表11可见,EP1和BWP1各剂量组样品实验结果表明,其抗体积数在各组间均无显著性差异(P>0.05),因此认为EP1和BWP1对小鼠CSH水平无影响。
表 11 EP1和BWP1对小鼠CSH水平的影响
Table 11 Effects of EP1 and BWP1 on CSH
2.7.1 EP1和BWP1对小鼠MCC能力的影响
表 12 EP1和BWP1对小鼠MCC能力的影响
Table 12 Effects of EP1 and BWP1 on MCC

由表12可见,EP1和BWP1各剂量组样品实验结果表明,其MCC能力在各组间均无显著性差异(P>0.05),因此认为EP1和BWP1对MCC无影响。
2.7.2 EP1和BWP1对小鼠MCR能力的影响
表 13 EP1和BWP1对小鼠MCR吞噬率的影响
Table 13 Effects of EP1 and BWP1 on MCR rate

表 14 EP1和BWP1对小鼠MCR吞噬率指数的影响
Table 14 Effects of EP1 and BWP1 on MCR index

由表13、14可见,EP1和BWP1各剂量组样品实验结果表明,其MCR吞噬率在各组间均无显著性差异(P>0.05),但吞噬率指数在中、高剂量组与水对照组间比较差异均显著(P<0.05),因此认为中、高剂量EP1和BWP1均可增强MCR能力。
巨噬细胞作为机体免疫系统的重要组成成分,在体液免疫和细胞免疫中发挥着重要的作用,其通过直接吞噬外来异物和衰老的自身细胞,或者分泌白介素等细胞因子来发挥抗病毒、抗肿瘤的作用[30]。EP1和BWP1中都含有的精氨酸、脯氨酸和丝氨酸,相关研究发现这些氨基酸具有增强单核-巨噬细胞吞噬作用的能力[31]。
表 15 EP1和BWP1对小鼠NKC活力的影响
Table 15 Effects of EP1 and BWP1 on NKC activity

由表15可见,EP1和BWP1各剂量组样品实验结果表明,其NKC活力在各组间均无显著性差异(P>0.05),因此认为EP1和BWP1对小鼠NKC活力无影响。
近年来,无论是海参整体还是分离得到的生理活性物质,都已被发现具有调节免疫力的功效。李晓林等[32]发现海参整体能提高免疫低下模型小鼠的体液免疫、细胞免疫以及非特异性免疫能力。袁文鹏等[33]认为仿刺参酶解提取物在一定剂量下能提高小鼠的细胞免疫、体液免疫能力以及NKC活力。王静凤等[34]的研究发现,革皮氏海参皂苷能显著提高小鼠的细胞免疫和非特异性免疫功能,提示革皮氏海参皂苷对小鼠具有显著的免疫调节作用。
本研究以仿刺参体壁和加工副产物仿刺参卵为原料制备多肽,结果表明:EP1和BWP1粗蛋白含量较高,均高于仿刺参卵和体壁原料中的含量,且粗多糖与灰分含量也有所降低,说明酶解工艺与超滤工艺使多肽组分得到了一定程度的分离和纯化。BWP1的粗蛋白、氨基酸总量和鲜味氨基酸含量(占氨基酸总量的56.1%)均较高,EP1氨基酸种类与BWP1相同,但必需氨基酸含量相对较高(占氨基酸总量的37.8%)。EP1和BWP1的分子质量分别在130~1 600 Da及130~2 500 Da之间,两者均属于小肽,无抗原性且相比于蛋白质更易被吸收。
SLP实验发现,EP1和BWP1对小鼠SLP均具有显著的促进作用,小鼠体内免疫实验也发现两者均具有增强小鼠免疫力的功能,提示仿刺参卵和体壁多肽具有成为良好的免疫调节剂的潜力,可为海参加工副产物的开发利用提供依据,也为市场开发新的免疫调节产品提供参考。
免疫活性肽对增强机体免疫具有重要的意义,但目前其作用机理尚不清楚。有学者认为活性肽的氨基酸组成、数量以及氨基酸排列均影响其免疫活性,具有较大占比的疏水性氨基酸通过与细胞膜的相互作用增强跨越细胞膜稳定性来增强免疫活性,当N-端为疏水性氨基酸时可提高肽段的抗氧化能力,进而影响其免疫活性[12]。也有研究认为免疫活性肽通过激活体内酶系、促进中间代谢及膜的通透性或影响特定蛋白质的合成,作用于神经、免疫系统及免疫细胞进而发挥免疫活性[35]。对于免疫活性肽的确切结构和作用机制有待于更深入的研究。
参考文献:
[1] 肖枫, 曾名勇, 董士远, 等. 海参胶原蛋白的研究进展[J]. 水产科学,2005, 24(6): 39-41. DOI:10.3969/j.issn.1003-1111.2005.06.013.
[2] THURMOND F A, KOOB T J, BOWNESS J M, et al. Partial biochemical and immunologic characterization of fibrillin microf i brils from sea cucumber dermis[J]. Connective Tissue Research, 1997,36(3): 211-222. DOI:10.3109/03008209709160221.
[3] CHEN S, XUE C, YIN L, et al. Comparison of structures and anticoagulant activities of fucosylated chondroitin sulfates from different sea cucumbers[J]. Carbohydrate Polymers, 2011, 83(2): 688-696. DOI:10.1016/j.carbpol.2010.08.040.
[4] POPOV A M. A comparative study of the hemolytic and cytotoxic activities of triterpenoids isolated from ginseng and sea cucumbers[J].Biology Bulletin of the Russian Academy of Sciences, 2002, 29(2):120-128.
[5] ZHOU X Q, WANG C H, JIANG A L. Antioxidant peptides isolated from sea cucumber Stichopus japonicus[J]. European Food Research and Technology, 2012, 234(3): 441-447. DOI:10.1007/s00217-011-1610-x.
[6] TAKASHI H, NOBUHIRO Z, KYOKO Y, et al. Recent advances in researches on physiologically active substances in holothurians[J].Journal of Ocean University of China, 2005, 4(3): 193-197.DOI:10.1007/s11802-005-0031-5.
[7] 陈卉卉, 于平, 励建荣. 东海海参胶原蛋白多肽的制备及清除自由基功能研究[J]. 中国食品学报, 2010, 10(1): 19-25. DOI:10.3969/j.issn.1009-7848.2010.01.003.
[8] 王洪涛, 尹花仙, 金海珠, 等. 海参肽对小鼠抗疲劳作用的研究[J]. 食品与机械, 2007, 23(3): 89-91. DOI:10.3969/j.issn.1003-5788.2007.03.025.
[9] HAUG T, KJUUL A K, STYRVOLD O B, et al. Antibacterial activity in Strongylocentrotus droebachiensis (Echinoidea), Cucumaria frondosa (Holothuroidea), and Asterias rubens (Asteroidea)[J]. Journal of Invertebrate Pathology, 2002, 81(2): 94-102. DOI:10.1016/S0022-2011(02)00153-2.
[10] ZHAO Y H, LI B F, LIU Z Y, et al. Antihypertensive effect and purif i cation of an ACE inhibitory peptide from sea cucumber gelatin hydrolysate[J]. Process Biochemistry, 2007, 42(12): 1586-1591.
[11] 逄龙. 海参主要活性物质对血管内皮细胞的保护作用及抗肿瘤活性的研究[D]. 青岛: 中国海洋大学, 2007: 73-86.
[12] 邓志程. 马氏珠母贝全脏器免疫活性肽的制备及其免疫活性的研究[D]. 湛江: 广东海洋大学, 2015: 51-62.
[13] 张健, 王茂剑, 马晶晶, 等. 仿刺参生殖腺营养成分分析[J]. 食品科学, 2013, 34(14): 232-236. DOI:10.7506/spkx1002-6630-201314047.
[14] 王共明, 张健, 王茂剑, 等. 仿刺参卵酶解工艺条件优化[J]. 食品科学, 2012, 33(23): 193-198.
[15] 刘宸铄, 刘芳, 杨鸣琦, 等. SRB法检测鸡外周血T淋巴细胞增殖试验最佳条件的筛选[J]. 西北农林科技大学学报(自然科学版), 2013,41(7): 15-18; 24.
[16] 徐光域, 颜军, 郭晓强, 等. 硫酸-苯酚定糖法的改进与初步应用[J]. 食品科学, 2005, 26(8): 342-346. DOI:10.3321/j.issn:1002-6630.2005.08.088.
[17] 蒋腾川, 宋新波, 张丽娟. 凝胶过滤色谱法测定3 种不同来源多肽的相对分子质量分布[J]. 食品科学, 2014, 35(24): 312-315.DOI:10.7506/spkx1002-6630-201424060.
[18] 戴晓丰. 铁皮石斛片安全性和功能性评价研究[D]. 南京: 南京农业大学, 2015: 25-29.
[19] 刘臻, 刘冬英, 胡志航, 等. 铁皮石斛粉对小鼠免疫功能影响的研究[J].中国卫生检验杂志, 2016, 26(21): 3041-3044.
[20] 赵晓燕, 张超, 马越, 等. 紫玉米花色苷对小鼠免疫功能的影响[J]. 湖北农业科学, 2010, 49(8): 1933-1936. DOI:10.3969/j.issn.0439-8114.2010.08.045.
[21] SUN W H, LENG K L, LIN H, et al. Analysis and evaluation of chief nutrient composition in different parts of Stichopus japonicus[J].Chinese Journal of Animal Nutrition, 2010, 22(1): 212-220.DOI:10.3969/j.issn.1006-267x.2010.01.033.
[22] 程镇燕, 陈韶阳, 乔秀亭. 鱼类功能性氨基酸营养免疫研究进展[J].饲料研究, 2014(9): 53-57.
[23] 赵兴坤. 海参肽的功能特性及其应用[J]. 中国食物与营养, 2003,9(12): 31-33. DOI:10.3969/j.issn.1006-9577.2003.12.011.
[24] 张君慧, 张晖, 王兴国, 等. 抗氧化活性肽的研究进展[J]. 中国粮油学报, 2008, 23(6): 227-233.
[25] 王静. 海参多肽的酶法制备及体外抗氧化性能研究[D]. 烟台: 烟台大学, 2010: 27-36. DOI:10.7666/d.d083633.
[26] 秦洪. 海参(Stichopus japonicus)内脏多肽和多糖提取纯化及活性研究[D]. 厦门: 华侨大学, 2016: 19-31.
[27] 朱立平. 免疫学常用实验方法[M]. 北京: 人民军医出版社, 2000:175-185.
[28] 陈炅然, 胡庭俊, 程富胜, 等. 蕨麻多糖对小鼠淋巴细胞增殖和一氧化氮分泌的影响[J]. 中国兽医科技, 2005, 35(9): 735-738.DOI:10.3969/j.issn.1673-4696.2005.09.015.
[29] 刘波, 章世元, 姜德兴, 等. 蛋白质氨基酸营养免疫研究[J].动物科学与动物医学, 2002, 19(8): 38-41. DOI:10.3969/j.issn.1673-5358.2002.08.015.
[30] 郭志廷, 伊鹏霏, 王鲁, 等. 经分子修饰后的人参皂苷-Rh2对小鼠免疫功能的影响[J]. 中兽医医药杂志, 2007, 26(1): 13-16.DOI:10.3969/j.issn.1000-6354.2007.01.005.
[31] 郭长江, 顾景范. 氨基酸对免疫功能影响[J]. 氨基酸杂志, 1988(3):21-24; 26.
[32] 李晓林, 王静凤, 田守生, 等. 海参和鱼翅的营养成分以及对免疫功能调节作用的比较[J]. 中国海洋大学学报(自然科学版), 2011,41(增刊1): 65-70. DOI:10.3969/j.issn.1672-5174.2011.01.010.
[33] 袁文鹏, 张绵松, 胡炜, 等. 仿刺参酶解提取物营养成分分析及其对小鼠免疫功能的影响[J]. 现代食品科技, 2015, 31(11): 45-50.DOI:10.13982/j.mfst.1673-9078.2015.11.008.
[34] 王静凤, 傅佳, 王玉明, 等. 革皮氏海参皂苷对小鼠免疫功能的调节作用[J]. 中国海洋大学学报(自然科学版), 2010, 40(2): 28-32.DOI:10.3969/j.issn.1672-5174.2010.02.003.
[35] LÓPEZ-ZABALZA M J, MARTÍNEZ-LAUSÍN S, BENGOECHEAALONSO M T, et a1. Signaling pathway triggered by a short immunomodulating peptide on human monocytes[J]. Archives of Biochemistry and Biophysics, 1997, 338(2): 136-142. DOI:10.1006/abbi.1996.9832.
Preparation of Peptides from Eggs and Body Wall of Apostichopus japonicus and Their Immunoenhancing Effect
ZHANG Jian1,2,3, WANG Gongming1, LIU Shaowei2,*, ZHANG Yi3, ZHAO Yunping1, LI Zhenduo1, JING Yuexin1, LIU Fang1
(1. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China; 2. State Key Laboratory of Bioreactor Engineering, School of Biotechnology, East China University of Science and Technology, Shanghai 200237, China;3. Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 200233, China)
Abstract:The nutritional components and molecular mass distribution of the peptides prepared from the eggs and body wall of Apostichopus japonicus were detected, and then their effects on spleen lymphopoiesis and immune function in mice were evaluated. Four peptides from the eggs and body wall of sea cucumber were prepared by enzymatic hydrolysis and crossflow ultrafiltration. Mouse spleen lymphocyte proliferation (SLP) in vitro in the presence of each of the peptides (10, 50, 100 and 500 μg/mL) was measured by the sulforhodamine B colorimetric method. Furthermore,mice were subjected to oral gavage with each of the four peptides at low, middle and high dosages (83.3, 166.7 and 500.0 mg/kg) for 30 consecutive days. Those given water were used as a control group. After the experiments, organ/body mass ratio, delayed-type hypersensitivity, T lymphocyte proliferation induced by concanavalin A, the number of antibodyforming cells, serum hemolysin formation, carbon clearance capability, chicken red blood cell phagocytosis by mouse macrophages and natural killer cell activity were measured. The results showed that EP1 and BWP1 (1—10 kDa) at 500 μg/mL had a signif i cant effect on SLP. The crude protein contents of EP1 and BWP1 were 64.74 and 70.25 g/100 g,the total amino acids were 45.69 and 63.26 g/100 g, and the molecular mass distribution was 130—1 600 and 130—2 500 Da,respectively. After the mice were orally administered with different doses of the peptides for 30 days, both EP1 and BWP1 enhanced monocyte-derived macrophage phagocytosis; EP1 improved cellular immune function while BWP1 augmented humoral immune function. In summary, EP1 and BWP1 from the eggs and body wall from Apostichopus japonicus had immunoenhancing effects and could be developed as new immunomodulatory products.
Keywords:Apostichopus japonicus eggs; peptide; molecular mass; immune function; mice
DOI:10.7506/spkx1002-6630-201819029. http://www.spkx.net.cn
ZHANG Jian, WANG Gongming, LIU Shaowei, et al. Preparation of peptides from eggs and body wall of Apostichopus japonicus and their immunoenhancing effect[J]. Food Science, 2018, 39(19): 188-195. (in Chinese with English abstract)
张健, 王共明, 刘少伟, 等. 仿刺参卵和体壁多肽的制备及免疫活性[J]. 食品科学, 2018, 39(19): 188-195. DOI:10.7506/spkx1002-6630-201819029. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0188-08
文献标志码:A
中图分类号:TS254.1
DOI:10.7506/spkx1002-6630-201819029
E-mail:swliu@ecust.edu.cn
刘少伟(1972—),男,教授,博士,研究方向为生物化学与分子生物学、食品科学与工程。
*通信作者简介:
E-mail:zjsd408@163.com
张健(1980—),男,副研究员,博士,研究方向为生物化学与分子生物学、食品科学与工程。
第一作者简介:
基金项目:山东省现代农业产业技术体系刺参产业创新团队建设项目(SDAIT-22-07);山东省重点研发计划项目(2016GSF115034;2016YYSP007;2016ZDJQ0205);烟台市科技发展计划项目(2014ZH081)
收稿日期:2017-08-03