
胡 苗,李佳颖,饶景萍*
(西北农林科技大学园艺学院,陕西 杨凌 712100)
摘 要:采后‘华优’猕猴桃(Actinidia Chinensis ‘Huayou’)果实经0(对照)、0.05、0.10、0.20、0.50 mmol/L褪黑素分别浸泡10 min后,置于(0.0±0.5)℃、相对湿度90%~95%的低温条件下贮藏 90 d。结果表明:0.10 mmol/L褪黑素处理较其他浓度处理更明显地延缓了猕猴桃果实硬度和色泽L*值的下降,有效地降低了呼吸速率和乙烯释放速率,且在贮藏结束后保持了较低的质量损失率和腐烂率。与对照相比,0.10 mmol/L褪黑素处理降低了淀粉酶活力,延缓了淀粉质量分数的下降,维持了较高的超氧化物歧化酶、抗坏血酸过氧化物酶和谷胱甘肽还原酶活力,提高了过氧化氢酶活力峰值,显著提高了抗坏血酸和谷胱甘肽的含量。这表明0.10 mmol/L褪黑素处理能在低温贮藏条件下延缓猕猴桃果实的后熟衰老进程。
关键词:褪黑素;后熟衰老;低温贮藏;猕猴桃
猕猴桃果实是皮薄汁多的浆果,对乙烯敏感,常温下易变软腐烂[1]。低温冷藏可降低猕猴桃采后的呼吸作用和内源乙烯的生成,有利于保持生理代谢及营养物质的相对稳定,从而延缓猕猴桃果实的后熟和衰老进程,延长贮藏保鲜期[2]。但是仅低温贮藏对猕猴桃后熟软化速度的控制效果有限,特别是中华系列品种,贮藏期和货架期都比美味猕猴桃短,贮藏过程中更容易出现果实腐烂现象[3]。
褪黑素(melatonin,MT)是在动植物体内广泛存在的一种小分子的神经内分泌激素,主要由松果体分泌,很长一段时间内人们都认为MT是动物专有的一种神经激素[4],1995年MT首次在植物中被发现[5-6]。近年来的研究表明MT具有清除植物自由基、抗氧化、抗低温胁迫、延缓植物衰老等功能[7-9]。例如MT可以帮助黄瓜种子和幼苗清除自由基,增强抗氧化能力[10]。外源MT处理菘蓝种子[11]和番茄幼苗[12]能降低膜脂过氧化水平,提高抗氧化酶的活力,减轻冷胁迫对幼苗生长过程中的氧化损伤。Wang Ping等[13-14]发现外源MT能通过保护叶绿素、保护光系统Ⅱ、抑制衰老相关基因表达和提高抗氧化能力等,延缓黑暗诱导的离体叶片衰老和干旱诱导的苹果叶片衰老。MT在植物根、种子、幼苗、叶片上的应用较广泛,但目前MT处理对采后果实的研究甚少,对采后低温贮藏猕猴桃果实生理及品质影响的研究还鲜见报道。
本实验以‘华优’猕猴桃为试材,系统地研究不同浓度MT处理对低温贮藏条件下采后猕猴桃果实成熟衰老进程的影响,筛选出适宜浓度,以期为探索低温贮藏条件下猕猴桃品质变化控制的有效途径提供科学依据。
‘华优’猕猴桃果实(可溶性固形物质量分数为6.5%~7.5%)于2016年10月8日采自陕西省周至县一个管理良好的猕猴桃园。采收后运回西北农林科技大学园艺学院采后实验室,常温下自然放置3 h散去田间热。挑选大小、成熟度一致,且无病虫害、无机械损伤的果实作试材。
MT 西安热默尔公司;其他试剂均为分析纯。
3K15型高速冷冻离心机 美国Sigma公司;PAL-1手持式糖度计 日本Atago公司;7001型CO2分析仪美国Telaire公司;UV-1800型紫外-可见分光光度计科大中佳公司;BCD-236DT型海尔冰箱 青岛海尔股份有限公司;Trace GC Ultra型气相色谱仪 美国Thermo Scientif i c公司;FT-327型硬度计 意大利TR公司。
1.3.1 样品处理及测定指标
将挑选后的果实随机分成5 组,分别用0(对照)、0.05、0.10、0.20、0.50 mmol/L的MT浸泡10 min,每处理3 次重复,每重复用200 个果,然后在室温下自然晾干,放入(0.0±0.5)℃、相对湿度(90±5)%冷库中。在处理前随机取45 个果进行初值测定;之后在对照和处理组果实中每重复固定15 个果实用于测定呼吸速率和乙烯释放速率;之后每10 d从冷库每重复中取10 个果用于硬度和色泽的测定,同时取样用液氮速冻后保存于-80 ℃的超低温冰箱中;贮藏90 d后随机取100 个果实用于统计质量损失率和腐烂率,根据以上数据筛选出延缓果实衰老的适宜MT浓度,然后进行淀粉质量分数和淀粉酶、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、谷胱甘肽还原酶(glutathione reductase,GR)活力及抗坏血酸(ascorbic acid,AsA)、谷胱甘肽(glutathione,GSH)含量的测定;以上每项指标重复测定3 次。
1.3.2 指标的测定
1.3.2.1 硬度的测定
将果实赤道间隔90°的3 点去皮后,用FT-327型硬度计测定,探头直径为11 mm,单位为N。
1.3.2.2 色泽的测定
内果皮色度用CR-400型色差计测定,将果实沿赤道横切后测内果皮色度,L*值代表果肉亮度,能反映果实褐变及成熟衰老程度[15]。
1.3.2.3 质量损失率和腐烂率的测定
质量损失率参照王玮[16]的方法测定,具体计算见式(1)。

腐烂率参考王玉萍等[17]的方法测定,具体计算见式(2)。

1.3.2.4 呼吸速率和乙烯释放率的测定
呼吸速率和乙烯释放速率的测定参照董晓庆等[18]的方法,分别使用7001型CO2分析仪和Trace GC Ultra型气相色谱仪测定,单位分别是mg/(kg·h)和μL/(kg·h)。
1.3.2.5 淀粉质量分数和淀粉酶活力的测定
淀粉质量分数和淀粉酶活力的测定方法均参考王强[19]的方法,淀粉酶活力以每15 min每克猕猴桃鲜样中酶催化作用下产生的麦芽糖质量表示,单位为mg/(g·15 min)。
1.3.2.6 SOD、CAT、APX、GR活力和AsA、GSH含量的测定
SOD活力和AsA、GSH含量测定参考曹建康等[20]的方法,以每克果肉1 min的OD560nm值变化反应体系对氮蓝四唑光化还原的50%为一个酶活力单位,单位为U/(g·min);AsA和GSH含量的单位分别为mg/g、(U·mol)/g;CAT活力的测定参照Gao Hui等[21]的方法,以每克果肉1 min OD240nm值变化0.01 为一个酶活力单位,单位为U/(g·min)。
APX活力参照Nakano等[22]的方法并修改,以每分钟反应体系在290 nm波长处吸光度减少0.01所需酶量为1 个酶活力单位,单位为U/(g·min);GR活力的测定参照Halliwell等[23]的方法并修改,以每分钟反应体系在340 nm波长处吸光度减少0.01所需酶量为1 个酶活力单位,单位为U/(g·min)。
采用Excel 2007软件进行数据处理,并用SigmaPlot 12.5软件制图,用SPSS 20.0软件的单因素方差分析进行显著性比较,检验的显著性概率临界值为0.05。
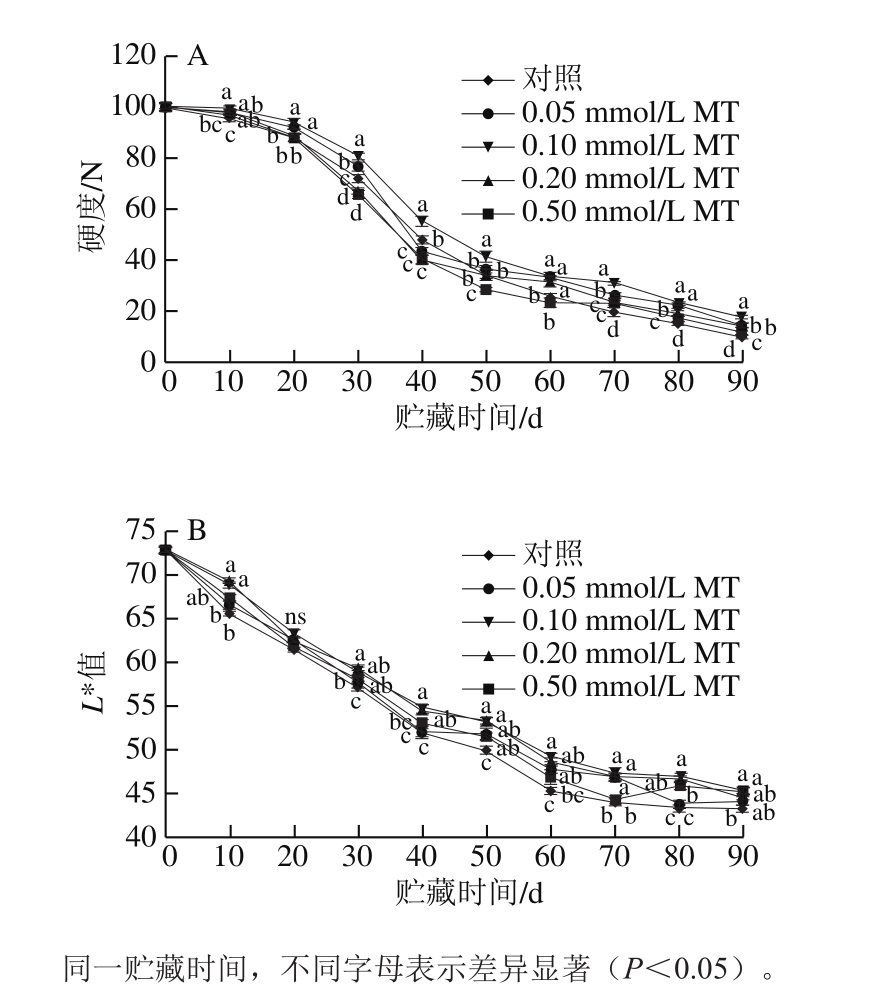
图 1 MT处理对猕猴桃果实冷藏期间硬度(A)和L*值(B)的影响
Fig. 1 Effect of melatonin treatment on firmness (A) and L* value (B)of kiwifruits during cold storage
由图1A可知,随着贮藏时间的延长,不同浓度MT处理组的猕猴桃果实硬度持续下降,果实硬度下降过程有两个明显阶段,前50 d呈现快速下降,在50 d后,硬度下降速度变缓。在前60 d时,0.50 mmol/L MT处理组的猕猴桃硬度最小,后30 d时对照组的最小,而在整个贮藏过程中,0.10 mmol/L MT处理组的猕猴桃硬度下降最缓慢;贮藏90 d时,对照组的果实硬度显著低于MT处理组(P<0.05),且0.10 mmol/L MT处理组显著高于其他浓度处理组。
L*值的下降可以直观地反映果实在贮藏过程中由于色素聚集或是酶促褐变所引起的果肉变暗的程度,L*值越低,代表褐变越严重,果实衰老进程越快。如图1B所示,在不同处理条件下,L*值都随贮藏时间的延长而持续下降,由此可见,猕猴桃果肉褐变情况随贮藏时间的延长而加重。在贮藏后期,对照组L*值显著低于0.10 mmol/L和0.20 mmol/L处理组(P<0.05);所以,0.10 mmol/L和0.20 mmol/L MT处理对果肉褐变的抑制作用最明显。

图 2 MT处理对猕猴桃果实冷藏90 d后的质量损失率(A)和腐烂率(B)的影响
Fig. 2 Effect of melatonin treatment on mass loss percentage (A) and decay incidence (B) of kiwifruits after cold storage for 90 days
猕猴桃果实采收后,失水、物质代谢会使其质量减少,且贮藏过程中果实的失水情况直接关系到果实的新鲜度。由图2A可见,在贮藏90 d时,对照组的质量损失率最高,达到1.65%,而0.05、0.10、0.20、0.50 mmol/L MT处理组的质量损失率分别比对照组果实降低了24.8%、34.5%、18.1%、12.7%。由图2B可知,贮藏90 d后对照组果实的腐烂率为8.64%,而0.05、0.10、0.20、0.50 mmol/L MT处理组的腐烂率分别为4.58%、3.36%、5.69%和7.31%,与对照组差异显著(P<0.05)。所以,0.10 mmol/L MT处理更有效地抑制了果实水分的散失和腐烂,较好地保持了果实的品质,延缓了果实衰老。
由图3A可以看出,低温贮藏能够很好控制果实呼吸强度,从常温移入冷库后,在贮藏前10 d的过程中,猕猴桃呼吸强度迅速下降,对照组和0.05、0.10、0.20、0.50 mmol/L MT处理组的呼吸强度分别降低了8.9%、14.5%、19.9%、21.3%、22.7%。此后,不同处理组的呼吸强度变化趋势相似,呈现贮藏10~20 d时快速上升,20 d后平缓下降,呼吸高峰出现在贮藏20 d左右,MT处理组果实呼吸速率峰值显著低于对照组(P<0.05)。除0.05 mmol/L MT处理之外,其他3 个浓度处理对呼吸速率抑制均比较明显,但差异不显著。
由图3B可以看出,猕猴桃果实在低温条件下,初期乙烯释放很少,大约到贮藏30 d 时,对照组出现明显乙烯高峰,之后迅速下降;MT处理组果实乙烯释放速率与对照组呈现相同趋势,但是乙烯高峰出现比对照组推迟了10 d左右,且乙烯峰值低于对照组20%~60%,这表明MT处理抑制了果实乙烯的生成。各处理中,0.10 mmol/L MT处理对乙烯释放的抑制效果最显著(P<0.05),在整个贮藏过程中乙烯释放率最低。
由以上所示结果可见,相比其他浓度M T,0.10 mmol/L对延缓猕猴桃果实衰老进程的效果最好,因此,以下的实验结果,均以0.10 mmol/L MT处理组与对照组进行比较。

图 3 MT处理对猕猴桃果实冷藏期间呼吸速率(A)和乙烯释放速率(B)的影响
Fig. 3 Effect of melatonin treatment on respiration rate (A) and ethylene production rate (B) of kiwifruits during cold storage
果实的淀粉质量分数在冷藏期间持续下降,在0~50 d下降速率较快,之后变化缓慢,后期稳定在较低水平,而在整个贮藏过程中对照组果实淀粉质量分数显著低于处理组果实(图4A)。由图4B可看出,对照组和MT处理组的淀粉酶活力在贮藏0~10 d时均下降,10 d后总体均呈先升高后降低的趋势。对照组和MT处理组淀粉酶活力分别在贮藏30 d和40 d时达到高峰,但处理组的峰值比对照组降低了15.5%;且在整个贮藏期间MT处理组的酶活力显著低于对照组(P<0.05)。
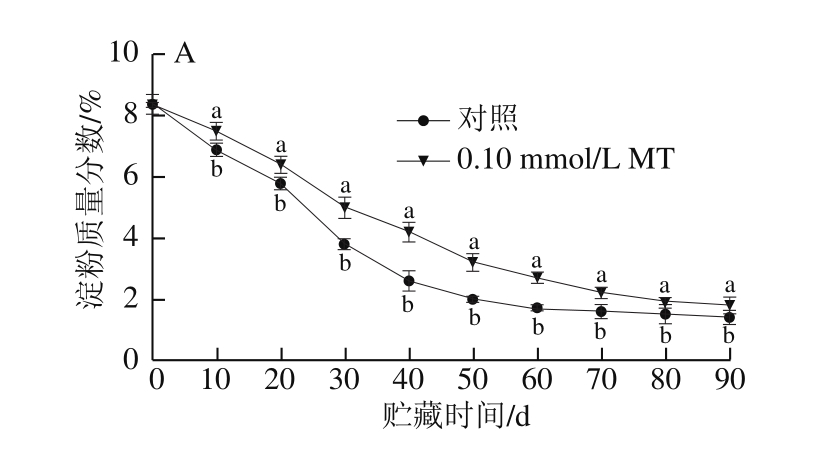

图 4 MT处理对猕猴桃果实冷藏期间淀粉质量分数(A)和淀粉酶活力(B)的影响
Fig. 4 Effect of melatonin treatment on starch content (A) and amylase activity (B) of kiwifruits during cold storage

图 5 MT处理对猕猴桃果实冷藏期间SOD(A)和CAT(B)活力的影响
Fig. 5 Effect of melatonin treatment on SOD (A) and CAT (B) activity of kiwifruits during cold storage
从图5A中可以看出,MT处理组与对照组果实SOD活力的变化趋势基本一致,刚入冷库时活力处于较低水平,之后呈迅速上升的趋势,处理组和对照组均在贮藏40 d时达到高峰,然后下降,但处理组果实的SOD活力高峰比对照组高13.05%,且贮藏10 d后,MT处理组果实SOD活力一直显著高于对照组(P<0.05)。图5B显示,猕猴桃果实的CAT活力在开始时较低,随着贮藏时间的延长逐渐上升,MT处理组和对照组果实在采后第40天CAT活力均达到高峰,之后又下降,但处理组的CAT活力峰值高于对照组17.6%,二者差异显著(P<0.05)。
如图6A所示,对照组和MT处理组猕猴桃果实的AsA含量在贮藏期间呈先下降后上升再下降的趋势,且在贮藏10 d后,处理组果实的AsA含量一直显著高于对照组(P<0.05)。由图6B可看出,对照组和MT处理组果实的GSH含量在贮藏期间变化趋势基本一致,即在贮后不断上升,于40 d时达到高峰,而后开始下降,且在整个贮藏过程中,与对照组相比,MT处理显著提高了猕猴桃果实的GSH含量(P<0.05)。
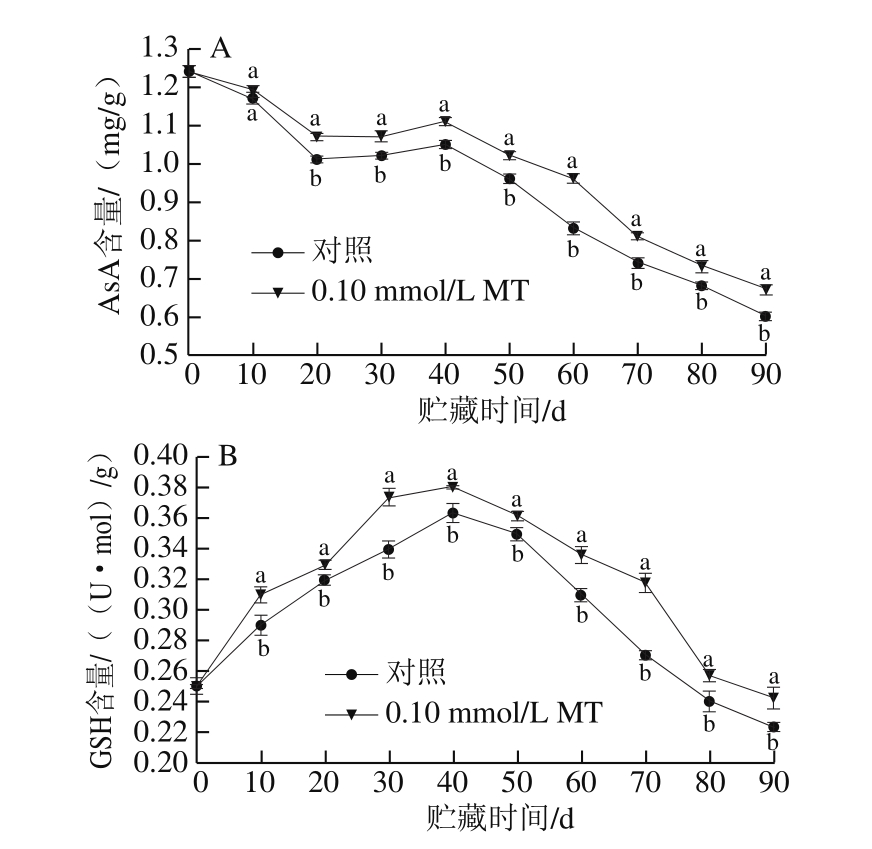
图 6 MT处理对猕猴桃果实冷藏期间AsA(A)和GSH(B)含量的影响
Fig. 6 Effect of melatonin treatment on the contents of AsA (A) and GSH (B) content in kiwifruits during cold storage

图 7 MT处理对猕猴桃果实冷藏期间APX(A)和GR(B)活力的影响
Fig. 7 Effect of melatonin treatment on APX (A) and GR (B) activity of kiwifruits during cold storage
如图7A所示,对照组和MT处理组猕猴桃果实的APX活力在贮藏后急剧升高并在第20天达到高峰,此时MT处理组果实APX活力比对照组高7.2%;且在此后MT处理组果实的APX活力也一直显著高于对照组(P<0.05)。由图7B可看出,对照组和MT处理组果实的GR活力在贮藏期间变化趋势基本一致,即在贮后前期不断上升,于40 d时达到高峰,而后开始下降。自30 d后,整个贮藏期间MT处理显著提高了猕猴桃果实的GR的活力(P<0.05)。
蔡慧[24]、郭叶[25]、李盼盼[26]、康孟利[27]等研究表明,在低温贮藏条件下,猕猴桃果实衰老伴随着果实硬度和色度的下降,质量损失率和腐烂率的上升,以及呼吸高峰和乙烯释放高峰的出现。在本实验中发现,在对照组与处理组的乙烯释放增加时期,果实硬度迅速下降,因此乙烯的释放加速了果实软化;与对照相比,0.10 mmol/L MT处理延缓了乙烯释放高峰的出现,并降低了其和呼吸高峰的峰值,更有效地延缓了硬度和色度的下降,降低了质量损失率和腐烂率的发生。这些结果表明0.10 mmol/L MT处理延缓了猕猴桃果实的衰老,提高了果实的品质。MT是松果体中产生的一种吲哚胺类分子,具有调节睡眠、延缓衰老、调节免疫、抑制肿瘤等多项生理功能,被认为是一种具有广泛应用前景的生物激素,已被美国食品药物管理局批准,可作为膳食补充剂使用,我国卫生部也批准MT可应用于保健品中[28];因此,在猕猴桃上使用限定浓度的MT处理也是安全健康的。MT在植物体内可能起到类似于生长调节剂的生理功能,低浓度促进植物生长,高浓度抑制生长。Murch[29]、Sarropoulou[30]等研究表明改变植物体内的MT浓度会对根的生长发育产生影响,低浓度可以促进侧根以及不定根的生长,高浓度则抑制。Posmyk等[31]研究发现低浓度的MT溶液可以明显提高种子萌发率,高浓度则是抑制效果。包宇[32]以番茄幼苗为对象进行实验时,发现以100~150 μmol/L MT处理的低温保护效果较好;而在250 μmol/L时,各项生长生理指标都显著低于对照组,说明高浓度的处理反而加重低温伤害。本实验中,0.10 mmol/L MT起到的促进作用更好,0.05 mmol/L和0.20 mmol/L MT起到的促进作用非常接近,次于0.10 mmol/L,而0.50 mmol/L MT的促进作用不显著。因此,在对采后猕猴桃进行处理实验时,MT浓度的选择很重要。现阶段MT在植物种子、幼苗上的研究较多,在果实上的研究却鲜有报道,其中在植物油菜叶片[33]、水稻叶片[34]、拟南芥叶片[35]上,也证明了MT具有延缓衰老的作用;在果实中,Gao Hui等[21]研究表明0.1 mmo/L MT处理具有延缓桃果实衰老的作用。而在孙倩倩[36]的研究中发现外源MT处理绿熟期番茄果实后,能够促进番茄果实的成熟,并能提高其品质,这可能与不同成熟期的不同物种所受MT影响不同有关。
淀粉酶催化淀粉水解,有学者研究猕猴桃果实软化衰老时发现,淀粉的降解是猕猴桃果实软化衰老的主要原因之一[37]。本实验0.1 mmol/L MT处理降低了淀粉酶活力,从而减少了淀粉的降解,延缓了果实的衰老。Wang Ping等[38]研究表明MT可以通过提高植物叶片的淀粉、蔗糖等光合产物的代谢变化延缓植物衰老。研究表明,衰老的猕猴桃伴随着自由基水平的升高[39];而果实体内可以通过SOD、CAT和AsA-GSH循环系统的作用降低活性氧对自身的伤害作用[40]。AsA-GSH是果实体内直接清除活性氧的酶促系统,APX和GR是此系统的关键酶,可以保持果实体内抗氧化物质AsA和GSH的平衡[41];而MT是一个自由基清除剂和广谱的抗氧化剂[42]。Wang Ping等[43]通过研究不仅发现MT显著提高了SOD和CAT活力,其研究结果也表明了MT是参与调控AsA-GSH循环系统的关键酶,如提高APX活力和GR活力。
综上所述,0.1 mmol/L MT处理可以降低乙烯释放速率和呼吸强度,推迟乙烯释放高峰,降低淀粉酶活力,提高抗氧化酶SOD、APX、GR等的活力,提高CAT活力峰值,提高AsA和GSH的含量,延缓淀粉的降解和果实硬度下降,从而延缓了猕猴桃果实的后熟衰老进程。
参考文献:
[1] 杨青珍. 猕猴桃果实采后冷害发生生理机制及调控作用[D]. 杨凌:西北农林科技大学, 2013: 1.
[2] 马秋诗. 温度预处理对采后‘红阳’猕猴桃果实冷害及其冷诱导转录因子CBF表达的影响[D]. 杨凌: 西北农林科技大学, 2014: 1-10.
[3] 张创峰, 朱艳丽, 刘淑兰, 等. ‘华优’猕猴桃栽培存在的问题及其对策[J]. 西北园艺(果树), 2012(3): 24.
[4] 赵燕, 王东华, 赵曦阳. 植物中褪黑素的研究进展[J]. 西北植物学报,2014, 34(1): 196-205. DOI:10.7606/j.issn.1000-4025.2014.01.0196.
[5] HATTORI A, MIGITAKA H, IIGO M, et al. Identification of melatonin in plants and its effects on plasma melatonin levels and binding to melatonin receptors in vertebrates[J]. Biochemistry and Molecular Biology International, 1995, 35(3): 627-634.
[6] DUBBELS R, REITER R J, KLENKE E, et al. Melatonin in edible plants identif i ed by radioimmunoassay and by high performance liquid chromatography-mass spectrometry[J]. Journal of Pineal Research,1995, 18(1): 28-31.
[7] TAN D X, MANCHESTER L C, REITER R J, et al. Melatonin directly scavenges hydrogen peroxide: a potentially new metabolic pathway of melatonin biotransformation[J]. Free Radical Biology & Medicine,2000, 29(11): 1177-1185. DOI:10.1016/S0891-5849(00)00435-4.
[8] LEI X Y, ZHU R Y, ZHANG G Y, et al. Attenuation of cold-induced apoptosis by exogenous melatonin in carrot suspension cells: the possible involvement of polyamines[J]. Journal of Pineal Research,2004, 36(2): 126-131.
[9] ARNAO M B, HERNÁNDEZ-RUIZ J. Protective effect of melatonin against chlorophyll degradation during the senescence of barley leaves[J]. Journal of Pineal Research, 2009, 46(1): 58-63.DOI:10.1111/j.1600-079X.2008.00625.x.
[10] MARTA B, SZAFRAŃSKA K, POSMYK M M. Exogenous melatonin improves antioxidant defense in cucumber seeds (Cucumis sativus L. )germinated under chilling stress[J]. Frontiers in Plant Science, 2016, 7: 5-6.
[11] 潘红艳, 张晓庆, 李婕, 等. 褪黑素对低温胁迫后菘蓝种子苗抗氧化性影响[J]. 西北大学学报(自然科学版), 2013, 43(2): 238-242.
[12] 包宇, 罗庆熙, 黄娟, 等. 外源褪黑素对低温胁迫下番茄幼苗生理指标的影响[J]. 西南师范大学学报(自然科学版), 2013, 38(10): 57-61.
[13] WANG Ping, SUN Xun, LI Chao, et al. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple[J]. Journal of Pineal Research, 2013, 54(3): 292-302.DOI:10.1111/jpi.12017.
[14] WANG Ping, SUN Xun, XIE Yinping, et al. Melatonin regulates proteomic changes during leaf senescence in Malus hupehensis[J]. Journal of Pineal Research, 2014, 57(3): 291-307. DOI:10.1111/jpi.12169.
[15] 张伟. 不同化学处理对黄花梨和猕猴桃果实的保鲜效果研究[D].杭州: 浙江工商大学, 2014: 12.
[16] 王玮. CPPU处理对采后猕猴桃品质及贮藏性的影响[D]. 杨凌: 西北农林科技大学, 2016: 11.
[17] 王玉萍, 饶景萍, 李萌, 等. 1-MCP对 ‘徐香’猕猴桃冷藏期间冷害与果实品质的影响[J]. 西北农林科技大学学报(自然科学版), 2013,41(11): 93-99.
[18] 董晓庆, 饶景萍, 田改妮, 等. 草酸复合清洗剂对红富士苹果贮藏品质的影响[J]. 园艺学报, 2009, 36(4): 577-582. DOI:10.3321/j.issn:0513-353X.2009.04.018.
[19] 王强. 1-MCP保持猕猴桃品质和果实硬度的机理研究[D]. 合肥: 安徽农业大学, 2010: 9-10.
[20] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 116-120; 154-155.
[21] GAO Hui, ZHANG Kezheng, CHAI Hongkang, et al. Melatonin treatment delays postharvest senescence and regulates reactive oxygen species metabolism in peach fruit[J]. Postharvest Biology & Technology, 2016, 118: 103-110. DOI:10.1016/j.postharvbio.2016.03.006.
[22] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specif i c peroxidase in spinach chloroplasts[J]. Plant & Cell Physiology, 1981, 22(5): 867-880.
[23] HALLIWELL B, FOYER C H. Properties and physiological function of a glutathione reductase purified from spinach leaves by affinity chromatography[J]. Planta, 1978, 139(1): 9-17. DOI:10.1007/BF00390803.
[24] 蔡慧. 不同处理对软枣猕猴桃采后生理生化变化的影响[D]. 长春:吉林农业大学, 2012: 43.
[25] 郭叶, 王亚萍, 费学谦, 等. 1-甲基环丙烯处理对‘徐香’猕猴桃储藏保鲜效果的影响[J]. 浙江农林大学学报, 2013, 30(3): 364-371.
[26] 李盼盼. 美味猕猴桃 ‘布鲁诺’果实常温低温贮藏条件下品质风味的变化研究[D]. 杭州: 浙江工商大学, 2015: 51.
[27] 康孟利, 尚海涛, 凌建刚, 等. 1-MCP+MA处理对‘红阳’猕猴桃软化调控效果的影响[J]. 食品研究与开发, 2016, 37(4): 176-179.
[28] 刘哲宇, 孙铮. 褪黑素代谢模式的研究进展[J]. 生命科学, 2017,29(2): 209-214.
[29] MURCH S J, SAXENA P K, SAXENA P K. The role of serotonin and melatonin in plant morphogenesis: regulation of auxin-induced root organogenesis in in vitro-cultured explants of st. John’s Wort(Hypericum perforatum L.)[J]. In Vitro Cellular & Developmental Biology-Plant, 2001, 37(6): 786-793. DOI:10.1007/s11627-001-0130-y.
[30] SARROPOULOU V N, DIMASSI-THERIOU K N. Melatonin promotes adventitious root regeneration in in vitro shoot tip explants of the commercial sweet cherry rootstocks CAB-6P (Pruns cerasus L.),Gisela 6 (P. cerasus × P. canescens), and M × M 60 (P. avium ×P. mahaleb)[J]. Journal of Pineal Research, 2012, 52(1): 38-46.DOI:10.1111/j.1600-079X.2011.00914.x.
[31] POSMYK M M, KURAN H, MARCINIAK K, et al. Presowing seed treatment with melatonin protects red cabbage seedlings against toxic copper ion concentrations[J]. Journal of Pineal Research, 2008, 45(1):24-31. DOI:10.1111/j.1600-079X.2007.00552.x.
[32] 包宇. 外源褪黑素对低温胁迫下番茄幼苗生理指标的影响[D].重庆: 西南大学, 2014: 20-44.
[33] 冯梁杰. 植物生长调节物质对油菜萌发出苗及生长发育的影响[D].武汉: 华中农业大学, 2015: 19-22.
[34] LIANG C Z, ZHENG G Y, LI W Z, et al. Melatonin delays leaf senescence and enhances salt stress tolerance in rice[J]. Journal of Pineal Research, 2015, 59(1): 91-101. DOI:10.1111/jpi.12243.
[35] SHI H T, REITER R J, TAN D X, et al. Indole-3-acetic acid inducible 17 positively modulates natural leaf senescence through melatoninmediated pathway in Arabidopsis[J]. Journal of Pineal Research, 2015,58(1): 26-33. DOI:10.1111/jpi.12188.
[36] 孙倩倩. 外源褪黑素对番茄果实采后成熟的影响[D]. 北京: 中国农业大学, 2016: 12-19.
[37] 王绍美, 赵讲芬. 茶多酚对采后猕猴桃果实生理生化变化的影响[J]. 果树科学, 2000, 17(4): 273-276. DOI:10.3969/j.issn.1009-9980.2000.04.008.
[38] WANG Ping, SUN Xun, CHANG Cong, et al. Delay in leaf senescence of Malus hupehensis by long-term melatonin application is associated with its regulation of metabolic status and protein degradation[J].Journal of Pineal Research, 2013, 55(4): 424-434. DOI:10.1111/jpi.12091.
[39] 张玉, 陈昆松, 张上隆. 乙酰水杨酸处理对猕猴桃果实成熟衰老的影响及其作用机理[J]. 植物生理与分子生物学学报, 2002, 28(6):425-432. DOI:10.3321/j.issn:1671-3877.2002.06.003.
[40] XIA Y X, CHEN T, QIN G Z, et al. Synergistic action of antioxidative systems contributes to the alleviation of senescence in kiwifruit[J].Postharvest Biology & Technology, 2016, 111: 15-24. DOI:10.1016/j.postharvbio.2015.07.026.
[41] TORRES M A, JONES J D G, DANG J L. Reactive oxygen species signaling in response to pathogens[J]. Plant Physiology, 2006, 141(2):373-378. DOI:10.1104/pp.106.079467.
[42] SHIGENAGA T, YAMAUCHI N, FUNAMOTO Y, et al. Effects of heat treatment on an ascorbate-glutathione cycle in stored broccoli(Brassica oleracea L.) fl orets[J]. Postharvest Biology and Technology,2005, 38(2): 152-159. DOI:10.1016/j.postharvbio.2005.02.016.
[43] WANG Ping, YIN Lihua, LIANG Dong, et al. Delayed senescence of apple leaves by exogenous melatonin treatment: toward regulating the ascorbate-glutathione cycle[J]. Journal of Pineal Research, 2012,53(1): 11-20. DOI:10.1111/j.1600-079X.2011.00966.x.
Effect of Melatonin on Ripening and Senescence of Postharvest Kiwifruits
HU Miao, LI Jiaying, RAO Jingping*
(College of Horticulture, Northwest A & F University, Yangling 712100, China)
Abstract:Postharvest kiwifruits (Actinidia chinensis) ‘Huayou’ were grouped and dipped in 0, 0.05, 0.10, 0.20 or 0.50 mmol/L melatonin (MT) solution for 10 min at room temperature, and then stored at (0.0 ± 0.5) ℃ (90%–95% relative humidity)for 90 d. The results showed that compared with other treatment groups, 0.10 mmol/L MT apparently delayed the decline of kiwifruit firmness and color L* value, effectively reduced the respiration rate and ethylene production rate and kept lower mass loss rate and decay incidence during storage. Compared with the control, 0.10 mmol/L MT reduced the activity of amylase, delayed the decline of starch contents, maintained higher superoxide dismutase, ascorbate peroxidase and glutathione reductase activity, increased the peak of catalase, and signif i cantly increased the contents of ascorbic acid and glutathione. These results suggested that pre-storage application with 0.10 mmol/L MT retarded the ripening and senescence of kiwifruits under low temperature storage conditions.
Keywords:melatonin; ripening and senescence; low temperature storage; kiwifruit
HU Miao, LI Jiaying, RAO Jingping. Effect of melatonin on ripening and senescence of postharvest kiwifruits[J]. Food Science,2018, 39(19): 226-232. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819035. http://www.spkx.net.cn
DOI:10.7506/spkx1002-6630-201819035. http://www.spkx.net.cn
胡苗, 李佳颖, 饶景萍. 褪黑素处理对采后猕猴桃果实后熟衰老的影响[J]. 食品科学, 2018, 39(19): 226-232.
引文格式:
文章编号:1002-6630(2018)19-0226-07
文献标志码:A
中图分类号:TS255.36
DOI:10.7506/spkx1002-6630-201819035
*通信作者简介:饶景萍(1957—),女,教授,硕士,研究方向为采后生理及贮藏保鲜。E-mail:dqr0723@163.com
第一作者简介:胡苗(1992—),女,硕士研究生,研究方向为采后生理及贮藏保鲜。E-mail:1261599716@qq.com
基金项目:“十二五”国家科技支撑计划项目(2015BAD16B03)
收稿日期:2017-07-22