果酒酵母菌混合发酵的研究进展
张文文,白梦洋,吴祖芳*,翁佩芳,苗英杰
(宁波大学海洋学院,浙江 宁波 315211)
摘 要:果酒是一种经过酵母菌发酵的低度饮料酒,酵母菌的选择直接影响到所酿果酒的口感和风味。由于酵母菌的多样性及代谢特性等的差别,在果酒发酵中进行多菌种混合发酵受到越来越广泛的关注。然而,在混合发酵条件下,酵母菌之间的相互作用会影响各菌株的生长和代谢产物的产生,进而影响到酒的品质。本文概述了果酒酵母菌的种类和功能,着重论述了国内外关于环境胁迫对酵母混合发酵的影响及混合发酵时酵母菌之间相互作用的研究进展,为酵母菌混合发酵果酒提供参考,以达到提高果酒质量的目的。
关键词:果酒;酵母菌;混合发酵;相互影响
传统果酒发酵是一个复杂的多种微生物共同作用的过程,酵母在其中起着重要的作用,其中酿酒酵母(Saccharomyces cerevisiae)主要进行乙醇发酵,发酵速度快、发酵力强,而非酿酒酵母(non-Saccharomyces)能将原料中的前体物质转化为风味物质,如酯、酸、高级醇等产物,并合成多种酶,对果酒的色泽、风味的形成具有重要的作用[1-2]。与单独发酵相比,酵母的混菌发酵能表现出更好的特性,如酒中甘油含量增加及乙酸含量降低,以及产生酯类、挥发性酚类等特殊风味物质,能够改善成品酒整体质量和品质,增强果酒风味多样性[3-5]。
本文对果酒发酵酵母菌的种类和功能进行了概述,着重论述了国内外有关环境胁迫对酵母菌混合发酵的影响及混菌发酵时酵母菌之间相互作用的研究进展,旨在为酵母菌混合发酵果酒提供理论依据。
1 果酒酵母菌
1.1 果酒生产相关酵母菌的种类
果酒发酵过程中有很多微生物参与其中,这些微生物中起主要作用的是酵母菌。果酒酵母菌的筛选多来自成熟果实的表皮、自然腐烂发酵的果肉、果汁以及果园的土壤[6]。
目前,人们在果实浆果和发酵醪中共筛选出18 个属的酵母菌,它们都能参与果酒发酵,分别是酵母属(Saccharomyces)、类酵母属(Saccharomycodes)、毕赤酵母属(Pichia)、汉逊酵母属(Hansenual)、有孢汉逊酵母属(Hanseniaspora)、假丝酵母属(Candida)、红酵母属(Rhodotorula)、酒香酵母属(Brettanomyces)、德克酵母属(Dekkera)、梅氏酵母属(Metschnikowia)、克勒克酵母属(Kloeckera)、裂殖酵母属(Schizosaccharomyces)、有孢圆酵母属(Torulaspora)、德巴利酵母属(Debaryomyces)、克鲁维酵母属(Kluyveromyces)、隐球酵母属(Cryptococcus)、接合酵母属(Zygosaccharomyces)、拟威尔酵母属(Williopsis)[7-8]。其中,毕赤酵母属、有孢汉逊酵母属、接合囊酵母属、假丝酵母属、耶氏酵母属等非酿酒酵母与酿酒酵母菌最大的区别是能产生多种胞外水解酶如蛋白酶、果胶酶、β-葡聚糖酶、木聚糖酶和β-葡萄糖苷酶,这些酶有助于酒的澄清、色素的浸提以及芳香化合物的释放[9]。而葡萄和酿酒葡萄汁中的非酿酒酵母主要是细尖酵母[10],这些酵母通常有中等发酵能力,同时还能产生挥发性芳香物质,这些非酿酒酵母有柠檬形克勒克酵母(K. apiculata)/葡萄汁有孢汉逊酵母(H. uvarum)、埃皮斯克勒克酵母(K. apis)/季也蒙有孢汉逊酵母(H. guillermondii)、非洲克勒克酵母(K. africana)/葡萄酒有孢汉生酵母(H. vineae)、皮质克勒克酵母(K. corticis)/嗜高压有孢汉生酵母(H.osmophila)和日本克勒克酵母(K. javanica)/罕见有孢汉逊酵母(H. occidentalis)[11]。
WL(Wallerstein laboratory nutrient agar)培养基鉴定法是一种新兴的、较快的鉴定方法,用于检测果酒发酵过程中的微生物种群,其现有的酵母菌鉴定表中含有13 类酵母菌的鉴定指标(表1)。
目前,果酒酿造工业生产技术不断进步,已经从最初的葡萄汁有孢汉逊酵母单一介导的果酒自然发酵,渐渐发展成由酿酒酵母主导的发酵。在发酵过程中,人们还同时检测到梅奇酵母、假丝酵母、戴尔有孢圆酵母、拜耳接合酵母、克鲁维毕赤酵母等非酿酒酵母[13]。与非酿酒酵母菌相比,酿酒酵母菌的明显生态优势主要在于发酵过程中能产生大量的乙醇和热量。发酵过程中特定酵母菌的生长会受到其他酵母菌的影响,而果酒发酵作为一个复杂的微生物反应过程,其中酵母菌相互作用将共同影响果酒最终酒体的品质[3]。
表 1 WL培养基上果酒相关酵母菌鉴定结果[12]
Table 1 Characteristics of strains different yeast genera cultured in WL medium[12]

(Saccharomyces cerevisiae) 带有淡绿的奶油色 表面光滑不透明,有球形突起,呈奶油状克鲁维毕赤酵母菌种 菌落颜色 菌落形态酿酒酵母(Pichia kluyveri) 带有淡绿的白色 呈火山状突起,四周扁平,表面粗糙褶皱膜醭毕赤酵母(P. membranifaciens) 带有淡蓝色的灰绿色 突起较高,有褶皱,呈面粉状葡萄汁有孢汉逊酵母(H. uvarum) 深绿色 表面扁平光滑不透明,呈黄油状(R. species) 深红色 表面光滑黏稠,中央突起,呈黄油状粟酒裂殖酵母(Schizosaccharomyces pombe)假丝酵母(C. species) 边缘白色,中间奶油色 光滑不透明,四周扁平状美极梅奇酵母(Metschnikowia pulcherrima) 带有淡红棕的奶油色 中间突起,边沿扁平,呈面粉状异常汉逊氏酵母(H. anomala) 带有蓝灰的奶油色 表面光滑,边沿扁平,呈奶油状红酵母(Brettanomyces intermedius) 奶油色 表面光滑,中央屋顶突起,呈奶油状路氏类酵母(Zygosaccharomyces bailii) 奶油色 表面光滑,中央屋顶突起,呈奶油状中间型酒香酵母深绿色 表面光滑扁平,不透明,呈黄油状拜耳接合酵母(Saccharomycodes ludwigii) 亮绿色 表面光滑,中央球形突起,呈不透明的奶油状戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)带有淡绿的奶油色 表面光滑,有突起,呈球形的奶油状
1.2 果酒酵母菌混合发酵的优势
果酒发酵是一个繁杂的多种微生物共同作用的过程,酵母菌尤为重要,酿酒酵母主要完成乙醇发酵,其发酵速度快、发酵力强;而非酿酒酵母能将原料中的前体物质转化为风味物质,如酯、酸和高级醇等产物,并合成多种酶,对果酒色泽、风味的形成具有重要作用[2]。已发现的非酿酒酵母中,毕赤类酵母是主要的产酯酵母,限氧条件下还能进行乙醇发酵,激活发酵途径中的关键酶,还能增加乙醇、甘油、乙酸乙酯等代谢物的含量[14]。与单一菌发酵果酒相比,酵母混菌发酵能表现出更好的特性,如增加酒体中甘油的含量,降低乙酸的含量,产生酯类、挥发性酚类等特殊风味物质,改善成品酒整体品质,丰富果酒产品风味的多样性[3-4]。酵母的混菌发酵还能减缓酒样的褪色程度[15]。然而,据文献报道,在混菌发酵时,酵母菌在其生长过程中会受到毒性代谢物介导的抑制作用,酿酒酵母在发酵过程中产生除乙醇外的代谢产物,如中长链脂肪酸、寡聚肽、环化高级醇等会抑制其他菌种的生长[16]。混菌发酵过程菌种相互作用的影响因素较为复杂,不同酵母之间的作用也具有很大差异,对于其相互之间影响的本质,国内外至今没有统一的定论。
2 环境胁迫对酵母混合培养的影响
酵母菌在生长发酵过程中,随着发酵的进行,环境条件往往会产生变化,有些条件对酵母细胞的生长代谢有益,有些条件则会阻碍酵母细胞的整体生长。影响细胞生存或者影响其最佳生存条件而对细胞产生不利影响的环境因素,即为酵母菌的胁迫条件,而酵母菌在胁迫条件下往往还会产生一定的耐受性,以适应不良环境带来的危害[17]。有研究表明,酵母菌在发酵过程中会受到多种环境因素的影响,如高浓度糖导致的高渗透、pH值降低和营养物质消耗等。在果酒发酵过程中,酵母细胞在接种后会面临高糖浓度(高渗透压)和较低的pH值(通常在4以下)胁迫。随着发酵的进行,在酵母细胞适应不良环境条件后,会逐渐进入迟滞期,酵母细胞开始快速分裂,并将葡萄糖转化为二氧化碳和乙醇,此时产生乙醇胁迫。在旺盛的发酵过程中,温度还会不断变化,前期不断上升,然后大幅下降;因此要进行控温处理,否则还会产生温度胁迫。当酵母细胞进入稳定期后,呼吸功能下降会导致氧化胁迫,此时营养物质变得有限或者消耗殆尽,产生营养胁迫;此外,酵母细胞还可能暴露于培养基成分(如重金属)和为控制微生物污染所加硫(如SO2)中[18]。
2.1 高糖胁迫
浓醪发酵是果酒产业的新趋势,采取浓醪发酵生产果酒,能够节约相当用量的水,降低能源成本;同时这种发酵工艺所生成的乙醇浓度较高,醪液中的糖度也较高,能够大幅提高产出,具有很好的应用价值[19]。然而,在采用浓醪发酵过程中,尤其是在发酵初期,发酵醪的渗透压较高,含糖量达180~260 g/L,容易引起酵母细胞内水分活度、细胞质构成发生变化,造成酵母细胞皱缩失水,破坏细胞膜的双层结构,阻碍细胞膜上的一些蛋白质的活性和离子通道,还会使大分子聚集,改变其构象,从而影响生物大分子的活性[20]。Park等研究了酵母菌在高渗条件下的耐受性,发现酵母菌本身存在对高渗透压的调节系统,同时还存在多种信号传导途径和分子应答机制[21]。de Kock发现,在高渗透压下,酿酒酵母倾向于产生甘油作为渗透保护剂,即在糖酵解产生的磷酸二羟丙酮转化为甘油的过程中NADH氧化生成NAD+,而甘油的产生往往导致乙酸的增加[22]。实际上,酿酒酵母产生乙酸为的是减少甘油形成期间产生的NAD+[23]。而非酿酒酵母则相反,产生较低浓度的乙酸,其乙酸的产生与甘油不具有相关性。而当酿酒酵母和非酿酒酵母混合发酵时,与纯种发酵相比,甘油浓度更高,乙酸浓度更低[22]。目前,关于浓醪发酵条件下酵母的生态行为变化多集中在单一菌种发酵方面,实际生产中,往往采用酿酒酵母和非酿酒酵母混合进行发酵,从而提高甘油和乙醇浓度,增加酒体风味,而在高糖胁迫下进行多菌种混合发酵,由于酵母渗透压调节系统的表达方式和强弱程度有差异,耐渗性也各有不同,国内外至今没有统一的定论。
2.2 低pH值胁迫
在果酒发酵过程中,酵母菌还会受到低pH值造成的胁迫。维持细胞内正常pH值对保证机体正常生理功能至关重要,例如蛋白质构象的稳定、氧化还原状态的变化以及酶反应的进行等。多数酵母在pH 2.50~8.50之间能够生长,在微酸性的条件下,其最适生长pH值为4.5~5.0[24]。
随着环境中酸胁迫的进行,培养液中的pH值将影响到酵母质膜所带的电荷,导致其质膜对一些离子渗透性产生变化,进而影响酵母细胞吸收营养的能力、相关酶的合成及代谢通路的某些生化反应的进行。过高和过低的pH值都会破坏酵母蛋白,引起细胞死亡[25]。果酒酿造时所控制的pH值在3.0~3.6之间,将产生环境低pH值胁迫,而在乙醇发酵的后期,随着醋酸、乳酸等有机酸的产生,也可能产生低pH值胁迫,导致细胞酸化,从而影响酵母菌的正常生长代谢。
2.3 乙醇胁迫
随着果酒发酵的进行,由于乙醇的大量积累,高浓度的乙醇会严重影响酵母细胞的生长。一般认为,乙醇对酵母细胞的胁迫主要是影响其细胞形态和正常生理活动,主要表现在使酵母细胞骨架变得松散,细胞变大,破坏其细胞膜结构,影响酵母对葡萄糖、矿物质等营养物质的吸收,使生物大分子合成和代谢受阻。此外,乙醇胁迫还会改变酵母相关酶酶活性。聂妤等研究了在不同乙醇浓度时酵母细胞的酶活力,选取三羧酸循环和糖酵解途径的关键代谢节点,发现葡萄糖-6-磷酸脱氢酶、异柠檬酸裂解酶和苹果酸脱氢酶对乙醇有良好的耐受性,而异柠檬酸脱氢酶、丙酮酸激酶和乙醇脱氢酶对乙醇的耐受性较差[26]。
混菌发酵过程中,不同酵母菌在生长过程中通过产生各种毒性化合物进行多种生化反应,或为了竞争养分而相互作用,其中酿酒酵母代谢产生乙醇来抑制其他菌群生长所产生的影响最为深远。研究证实,由高浓度的醇类产生的乙醇胁迫是酿酒酵母相对非于酿酒酵母形成优势地位的主要因素[27]。
2.4 营养胁迫
酵母菌的生长需要各种营养物质。在发酵初期,各种营养物质丰富,随着发酵的不断进行,氮源和碳源等营养成分逐渐消耗殆尽,酵母菌缺乏必需的营养素,进入特定的非繁殖阶段,生长逐步停滞[28]。而在混菌发酵后期,不同酵母菌的数量有所不同,对环境的应激反应有差异,而营养物质的缺乏进一步造成酵母菌之间生长状态的差异。Medina等发现,在混合培养中,非酿酒酵母的生长会消耗大量营养物质,使其后接种的酿酒酵母生长所需的营养匮乏,最终导致发酵缓慢或发酵不完全;与按顺序接种非酿酒酵母和酿酒酵母相比,同时接种非酿酒酵母和酿酒酵母,果酒发酵速度更慢,在添加氮源和维生素后,酿酒酵母所占比例有显著提高[29]。而酵母提取物[30]或20 种氨基酸混合物[31]的添加则能大幅提高非酿酒酵母非洲克勒克氏酵母的发酵效率。相比非酿酒酵母,酿酒酵母能更快速有效地利用氮源,这可能是其在工业发酵中成功应用的关键因素之一,尤其是以氮源为明显限制因素的发酵液中如葡萄汁[32]。
2.5 其他胁迫
果酒发酵过程中,除了常见的高糖、高浓度乙醇、低pH值和营养胁迫等之外,酵母细胞还会暴露于其他胁迫条件下,如温度胁迫、氧化胁迫、重金属胁迫和硫胁迫等。
不同酵母对温度的耐受性不同,葡萄汁酵母(S. uvarum)、库德里阿兹威酵母(S. kudriavzevii)、贝优酵母(S. eubayanus)及奇异酵母(S. paradoxus)在低温下表现出良好的发酵能力,尤其是葡萄汁酵母,在12 ℃下能代替酿酒酵母成为优势菌[33]。酵母菌适宜的生长温度是22~30 ℃,不采取降温措施容易造成温度过高,破坏生物分子间的疏水键和氢键,导致核酸及蛋白质变性,还会使细胞失水皱缩,从而引起细胞死亡[34]。高温和高浓度乙醇还可以诱导酵母细胞产生大量的活性氧,而活性氧过多聚集在细胞中,会造成蛋白质、脂类和DNA等大分子被破坏,细胞结构和功能损失,引起酵母细胞膜结构降解,迫使细胞死亡[35]。不同酵母菌对氧气的耐受性不同,美极梅奇酵母菌在有氧环境甚至高曝气条件下生长得更好,而当厌氧发酵时,美极梅奇酵母菌的优势地位则被酿酒酵母所取代,使得乙醇含量有所增加[36]。在实际生产中,SO2作为主要的杀菌剂和抗氧化剂被广泛使用,但近年来研究发现,高浓度SO2会使发酵的延迟期延长,影响某些酵母的生长,从而延缓果酒的发酵启动[37],这也是胁迫因素之一。SO2的添加对酿酒酵母的生长有积极作用,不影响假丝酵母最大菌群数,但对葡萄汁有孢汉逊酵母和戴尔凯氏有孢圆酵母有负面影响[38]。
3 混合培养条件下酵母菌相互作用的影响
多菌种果酒发酵是一个复杂的多种微生物共同作用的过程,不同酵母菌所起的作用也各不相同。其中酵母菌的相互作用会影响各菌种的生长和发酵产物的特性,对最终酒体的性状形成也起着重要的作用。不同酵母之间的相互作用非常复杂,包括细胞间接触抑制、致死因子和代谢物的影响(如乙醇、脂肪酸、致死蛋白、寡聚肽等),以及一些良性协同效应,控制酸败微生物的生长等[39-40](图1)。
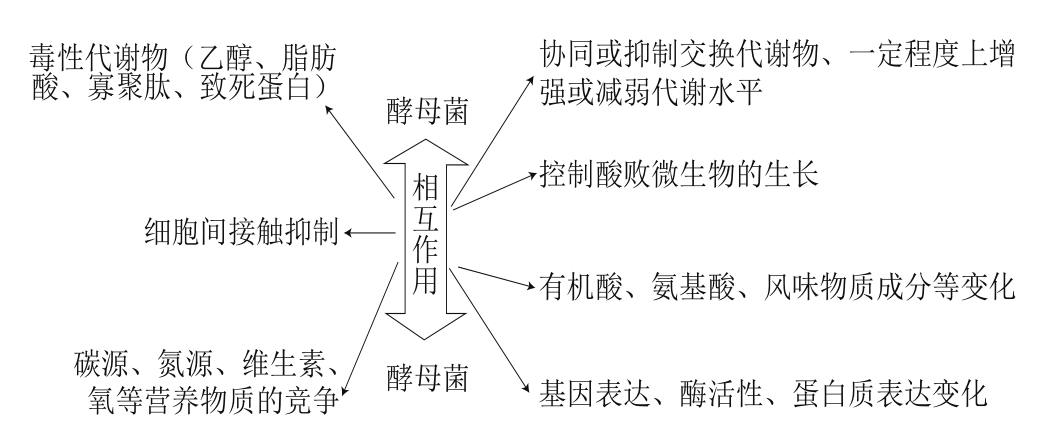
图 1 果酒混菌发酵中酵母菌的相互作用关系
Fig. 1 Yeast interactions in mixed culture fermentation of wine
3.1 酵母细胞间的接触抑制
接触抑制是指多种细胞一旦彼此接触汇合,即停止移动和生长的现象,细胞增殖到一定程度,也就是互相挨在一起的时候,糖蛋白识别这种信息,就会使细胞停止继续繁殖[41]。果酒发酵过程中,由于多种酵母菌共同培养和生长,它们之间会分泌某种或多种自诱导剂来判断菌群密度和周围的环境变化情况,当周围的菌群数量达到一个阈值后,菌体的基因和蛋白表达会发生改变,以此来调控菌体数量的群体行为[42]。Renault等研究了混合发酵体系中戴尔凯氏有孢圆酵母和酿酒酵母的生长变化,发现酵母细胞之间的接触汇合以及某些致死分子的释放似乎造成了戴尔凯氏有孢圆酵母的早期死亡[43]。酵母菌形态发生转变,从丝状到菌丝体,这也是群体感应现象的表现,因此细胞接触后群体感应活性分子的识别和对基因、蛋白表达方面的影响将是揭开混合发酵体系中酵母相互作用的有效途径。Mains等研究发现,在混合发酵中,受另一菌种高细胞密度的影响,两种菌种的生物量都无法达到纯培养时的水平[44]。
3.2 混合菌培养代谢物对相互作用的影响
研究表明,蛋白质代谢物的产生对混合发酵酵母菌的生长状态有显著的影响,酿酒酵母会产生一种阳离子多肽,被鉴定为甘油醛磷酸脱氢酶的一个片段,它能够对耐热克鲁维酵母(K. thermotolerans)、马克斯克鲁维酵母(K. marxianus)、戴尔凯氏有孢圆酵母、季也蒙有孢汉逊酵母等产生有物种针对性的抗微生物效果[16]。酿酒酵母会产生嗜杀因子,杀灭其他某些特定的酵母菌,但它只有较窄的杀菌谱,而非酿酒酵母则具有广谱的抗菌能力,美极梅奇酵母对腐败酵母菌如酒香酵母/德克酵母、汉逊酵母及毕赤酵母等有广泛的杀菌能力,但它的抗菌活性对酿酒酵母的生长没有影响[45]。Villalba等研究发现,戴尔凯氏有孢圆酵母因为能产生一种30 kDa的含有葡聚糖酶和几丁质酶活性的嗜杀因子,从而能作用于布鲁塞尔酒香酵母(Brettanomyces bruxellensis)、膜璞毕赤酵母、季也蒙毕赤酵母(P. guilliermondii)及盔形毕赤酵母(P. manshurica)等腐败酵母菌的细胞壁,达到抑制其生长的目的[46]。翟明昌等发现,溶氧、乙醇、pH值、氮源及生存空间的竞争并不是非酿酒酵母提前衰亡的主要原因,酿酒酵母分泌的分子质量小于10 kDa的代谢产物和一些分子质量超过10 kDa的蛋白类物质对克鲁维酵母等非酿酒酵母的衰亡具有诱导作用[47]。颜兵等研究得到酵母代谢物对酿酒酵母的生长没有明显的抑制作用,而异常汉逊酵母在酿酒酵母和混菌发酵滤液中,其生长都出现了明显的抑制作用,且混菌发酵滤液中的抑制作用更强[48]。目前,研究证实以蛋白化合物、寡聚肽、环化高级醇和脂肪酸等为代表的生物活性物质在混菌发酵体系中起着重要作用,而这些化合物中,有一些被分离出来并确定了其特征(表2)。
表 2 混菌发酵过程中产生的致死因子和抑菌活性物质
Table 2 Killer toxins and other antimicrobial compounds produced during multi-starter fermentation

致死酵母 致死(Saccharomyces paradoxus) K1 酿酒酵母 W48(S. cerevisiae W48) 最适温度:18 ℃和28 ℃(K1、K2、K3)最适pH 4.8(K1、K3);4.0(K2)毒素 敏感酵母 致死毒素生化特性 参考文献奇异酵母酿酒酵母(S. cerevisiae) K2[49]好望角酵母(Saccharomyces capensis) K3(P. anomala CBS 1982) K8 禾本红酵母(Rhodotorula graminis)异常毕赤酵母 CBS 1982在培养2 h和20 h后,致死毒素(K8、K4、K7)发挥显著效果异常毕赤酵母 CBS 5759[50](P. membranifaciens CBS 7373) K7 粟酒裂殖酵母 DSM 70576(S. pombe DSM 70576)假丝酵母(C. pyralidae) CpKT1 布鲁塞尔酒香酵母(B. bruxellensis)(P. anomala CBS 5759) K4 黏质红酵母(Rhodotorula mucilaginosa)膜醭毕赤酵母 CBS 7373适宜温度:15~25 ℃适宜pH 3.5~4.5 [51]CpKT2
脂肪酸是酵母菌细胞成分中的重要组成部分,有助于维护细胞膜的完整性和流动性。脂肪酸作为酵母细胞中含量丰富且稳定的一种化学组分,在不同的酵母中分布有所差异,一般而言,酵母脂肪酸多由C16脂肪酸和C18脂肪酸组成,其中主要的饱和脂肪酸是棕榈酸,不饱和脂肪酸是棕榈油酸和油酸,与细胞膜的流动性和完整性密切相关。有研究表明,中长链脂肪酸、乙酸、蛋白化合物为代表的生物活性物质在酵母共发酵体系中发挥着重要作用,可能在相互之间产生不利影响[52]。Redón等研究表明,向基质中加入棕榈油酸,可以降低酵母细胞内的脂肪酸肽链长度,加强酵母细胞的生物活性,促进酵母生长繁殖并缩短发酵时间。混合发酵中细胞产生的不饱和脂肪酸可用于维持细胞膜的完整性和流动性,促进发酵[53]。另有文献报道,酵母细胞产生的风味物质中,长链脂肪酸如十二烷酸、亚油酸、亚麻酸等的积累释放会对不同种属的酵母生长产生抑制作用[54]。
3.3 混菌发酵对果酒风味的影响
与单一菌发酵相比,酵母菌的混合发酵能表现出更好的特性,Ribeiro等研究表明,由卡利比克毕赤酵母(P. caribbica)和酿酒酵母混合发酵,对酒中乙醇含量分析,发现其数量增加,而有机酸中乙酸含量降低,改善了成品酒整体质量和品质[55]。在甜葡萄酒混合发酵体系中,假丝酵母的存在减少了酿酒酵母产生乙酸的量[56]。但Englezos等采用假丝酵母和酿酒酵母混合发酵,相比酿酒酵母纯种发酵,甘油质量浓度略有增加(8.8~9.8 g/L),乙酸质量浓度高达0.4 g/L[57]。多菌株混合发酵还能产生更加特别的香气特征[58],据文献报道,耐热克鲁维酵母与酿酒酵母混合发酵产生的协同作用可增加甘油和2-苯乙醇的含量[59]。Garcia等研究发现,采用酵母菌混合发酵72 h后,β-葡萄糖苷酶酶活力是对照葡萄酒的2 倍,且混合培养发酵液中的几种酸、醇、酯和萜烯醇的浓度大大提高,使果酒的风味得以增强和改善[60]。
接种方式的差异也会影响到果酒风味,假丝酵母和酿酒酵母连续接种发酵的酒中化学组分与假丝酵母纯种发酵酒相似,而混合菌种共发酵酒中化学组分与酿酒酵母纯种发酵酒相似[57]。贾言言等发现,非酿酒酵母梅奇酵母先于酿酒酵母接种,比同时接种和后接种,菠萝酒风味物质种类及合成的羧酸酯类物质更多,也更好地保留菠萝原果香[61]。此外,有研究表明,采用粗糙型菌落的酵母菌和光滑型菌落的酵母菌对甘蔗汁进行混合发酵,得到的乙醇含量要比粗糙型菌落的酵母菌单一发酵高,但比光滑型菌落的酵母菌单一发酵低;共发酵时的耗糖量也比光滑型菌落的酵母菌单一发酵的少,可能由于光滑菌株能有效水解蔗糖,释放葡萄糖和果糖等还原糖,被粗糙菌株以较慢的速率利用[62]。
3.4 混菌发酵对基因表达和蛋白分泌的影响
丙酮酸在丙酮酸脱羧酶的作用下脱羧生成乙醛,乙醛在乙醇脱氢酶作用下还原生成乙醇,该系列步骤是酵母菌乙醇发酵的限速步骤,分别由基因PDC和ADH表达调控。酿酒酵母和球拟假丝酵母(Starmerella bombicola)混合发酵使得发酵速率增加,葡萄糖和果糖能够被快速利用,发酵结束后,甘油、正丙醇、乙酸乙酯的含量提高,乙醇和乙酸的含量降低。混菌发酵中,PDC1活力变低,而ADH1则呈相反趋势。发酵结束后,PDC1在混菌发酵中表达水平高于纯种发酵,而ADH1基本不变[63]。Mostert等用两种能产生胞外酶的非酿酒酵母(即美极梅奇酵母菌和耐热克鲁维酵母)分别和酿酒酵母共发酵,在单菌种和复合菌种发酵中,Ecm33p、Gas1p、Bgl2p和Exg1p等4 种蛋白质始终存在,表明它们参与了细胞壁的合成,它们的合成和分泌也没有受到酵母菌相互作用的影响,在酵母菌的生物学研究中具有关键作用[64]。Maturano等研究得到高浓度的糖不影响胞外酶(β-葡萄糖苷酶、果胶酶、蛋白酶、淀粉酶及木聚糖酶)的活性,发现β-葡萄糖苷酶和果胶酶的活性受到乙醇的抑制,酶活性随发酵时间的延长而降低;戴尔凯氏有孢圆酵母BTd259纯种发酵或与酿酒酵母BSc562混合发酵(99%戴尔凯氏有孢圆酵母)中,除β-葡萄糖苷酶外,其他胞外酶的产量都达到最高[65]。本课题组通过转录组测序(RNA-seq)技术研究了乙醇(体积分数在5%~12%)胁迫条件对酿酒酵母菌Sc 131与东方伊萨酵母(Issatchenkia orientalis,Io166)或弗比恩毕赤酵母(Pichia fabianii,Pf 65)混合发酵供试菌基因表达的影响,再利用SYBR Green实时荧光定量PCR验证RNA-seq筛选得到的差异基因的可靠性;从差异表达基因分析结果,再利用蛋白相邻类的聚簇(cluster of orthologous groups of proteins,COG)数据库对其中之一菌株Io166基因产物进行直系同源分类,解释细胞生理功能与代谢(如氨基酸转运与代谢、能量代谢与细胞保护功能等)在发酵过程中的分配(比例)情况。另外,从转录组与蛋白质组学角度解释在环境胁迫条件下酵母菌相关细胞结构、代谢通路及生理功能等的变化,从而来分析酵母菌发酵行为的影响机制,该研究在进一步进行之中。
4 结 语
利用酵母菌混合发酵来提高果酒品质和感官特性已经在酿酒业广泛应用。酵母菌混合发酵的大量研究侧重于对酒体风味成分的影响,也有部分通过不同接种方式来研究代谢物产生的差异,但对于混合发酵过程中的酵母菌之间相互作用机制及环境胁迫对酵母菌共发酵的影响尚未深入了解;通过对酵母菌相互作用及环境对混合酵母菌作用的认识,有助于对发酵过程中非目标酵母菌和目标酵母菌进行控制和管理,获得满足人们需求的高品质果酒。另外,随着蛋白质组学和转录组学的兴起,已有部分学者从纯种和混菌发酵过程中蛋白质分泌和基因表达差异性方面来揭示混合共发酵体系中不同酵母菌之间的关系和协同作用机制,通过以上研究,酵母菌多菌种发酵的代谢机理将会得到更加深入和全面的阐述。
参考文献:
[1] LIU P T, LU L, DUAN C Q, et al. The contribution of indigenous non-Saccharomyces, wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J]. LWT-Food Science and Technology, 2016, 71: 356-363. DOI:10.1016/j.lwt.2016.04.031.
[2] ASSIS M O, SANTOS A P C, ROSA C A. Impact of a non-yeast isolated in the equatorial region in the acceptance of wine aroma[J].Food and Nutrition Sciences, 2014, 5(9): 759-769. DOI:10.4236/fns.2014.59086.
[3] JOLLY N P, VARELA C, PRETORIUS I S. Not your ordinary yeast:non-Saccharomyces, yeasts in wine production uncovered[J]. FEMS Yeast Research, 2014, 14(2): 215-237. DOI:10.1111/1567-1364.12111.
[4] CONTRERAS A, HIDALGO C, HENSCHKE P A, et al. Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J]. Applied and Environmental Microbiology, 2014, 80(5): 1670-1678. DOI:10.1128/AEM.03780-13
[5] GOBBI M, DE VERO L, SOLIERI L, et al. Fermentative aptitude of Saccharomyces wine yeast for reduction in the ethanol content in wine[J]. European Food Research and Technology, 2014, 239(1): 41-48. DOI:10.1007/s00217-014-2187-y.
[6] 刘永衡, 华惠敏, 吴桂君, 等. 果酒酵母选育及酵母对香气成分影响的研究进展[J]. 中国酿造, 2013, 32(10): 5-8. DOI:10.3969/j.issn.0254-5071.2013.10.002.
[7] 王会会. 烟台干红葡萄酒发酵过程酵母菌群研究[D]. 济南: 山东轻工业学院, 2011: 1.
[8] LEE P R, LI X, YU B, et al. Non-Saccharomyces yeasts and wine ine[M]//PEETERS A S. Wine types production and health. Hauppauge:Nova Science Publishers, 2012: 319-333.
[9] 徐亚男. 非酿酒酵母菌的筛选及产酶研究[D]. 石河子: 石河子大学,2016: 46-47.
[10] JOLLY N P, AUGUSTYN O P H, PRETORIUS I S. The role and use of non-Saccharomyces yeasts in wine production[J]. South African Journal of Enology & Viticulture, 2006, 27(10): 15-39.DOI:10.1111/1567-1364.12111.
[11] VIANA F, BELLOCH C, VALLÉS S, et al. Monitoring a mixed starter of Hanseniaspora vineae-Saccharomyces cerevisiae, in natural must: impact on 2-phenylethyl acetate production[J]. International Journal of Food Microbiology, 2011, 151(2): 235-240. DOI: 10.1016/j.ijfoodmicro.2011.09.005.
[12] 杨雪峰, 苏龙, 刘树文. 利用WL营养培养基鉴定葡萄酒中的相关酵母菌[J]. 中外葡萄与葡萄酒, 2006, 31(4): 4-7.
[13] CRAY J A, BELL A N W, BHAGANNA P, et al. The biology of habitat dominance; can microbes behave as weeds?[J]. Microbial Biotechnology, 2013, 6(5): 453-492. DOI:10.1111/1751-7915.12027.
[14] COMITINI F, GOBBI M, DOMIZIO P, et al. Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J]. Food Microbiology, 2011, 28(5):873-882. DOI:10.1016/j.fm.2010.12.001.
[15] AVICOR M N, SAALIA F K, DJAMEH C, et al. The fermentation characteristics of single and mixed yeast cultures during pito wort fermentation[J]. International Food Research Journal, 2015, 22(1):102-109. DOI:10.3390/toxins4111024.
[16] BRANCO P, FRANCISCO D, CHAMBON C, et al. Identification of novel GAPDH-derived antimicrobial peptides secreted by Saccharomyces cerevisiae, and involved in wine microbial interactions[J]. Applied Microbiology and Biotechnology, 2014, 98(2):843-853. DOI:10.1007/s00253-013-5411-y.
[17] GALAFASSI S, TOSCANO M, VIGENTINI I, et al. Osmotic stress response in the wine yeast Dekkera bruxellensis[J]. Food Microbiology, 2013, 36(2): 316-319. DOI:10.1016/j.fm.2013.06.011.
[18] HEINISCH J J, RODICIO R. Physical and chemical stress factors in yeast[M]// KÖNIG H, UNDEN G, FRÖHLICH J. Biology of microorganisms on grapes, in must and in wine. Berlin Heidelberg:Springer, 2009: 275-291. DOI:10.1007/978-3-540-85463-0_15.
[19] 张强, 韩德明, 李明堂. 乙醇浓醪发酵技术研究进展[J]. 化工进展,2014, 33(3): 724-729. DOI:10.3969/j.issn.1000-6613.2014.03.035.
[20] TAMÁS M J, KARLGREN S, BILL R M, et al. A short regulatory domain restricts glycerol transport through yeast Fps1p[J]. Journal of Biological Chemistry, 2003, 278(8): 6337-6345. DOI:10.1074/jbc.M209792200.
[21] PARK Y K, KOO M H, OLIVEIRA I M D A. Biochemical characteristics of osmophilic yeasts isolated from pollens and honey[J].Bioscience Biotechnology and Biochemistry, 1996, 60(11): 1872-1873.DOI:10.1271/bbb.60.1872.
[22] DE KOCK M C. Investigating osmotic stress in mixed yeast cultures and its effects on wine composition[D]. Stellenbosch: Stellenbosch University, 2015: 46-50.
[23] REMIZE F, ROUSTAN J L, SABLAYROLLES J M, et al. Glycerol overproduction by engineered Saccharomyces cerevisiae, wine yeast strains leads to substantial changes in, by-product formation and to a stimulation of fermentation rate in stationary phase[J]. Applied &Environmental Microbiology, 1999, 65(1): 143-149.
[24] CARMELO V, BOGAERTS P, SÁCORREIA I. Activity of plasma membrane H+-ATPase and expression of PMA1 and PMA2 genes in Saccharomyces cerevisiae cells grown at optimal and low pH[J]. Archives of Microbiology, 1996, 166(5): 315-320. DOI:10.1007/s002030050389.
[25] ORIJ R, BRUL S, SMITS G J. Intracellular pH is a tightly controlled signal in yeast[J]. Biochimica at Biophysica, 2011, 1810(10): 933-944.DOI:10.1016/j.bbagen.2011.03.011.
[26] 聂妤, 董亮, 侯德文, 等. 酿酒酵母胞内代谢关键酶对乙醇的耐受性[J]. 大连工业大学学报, 2011, 30(5): 318-321. DOI:10.3969/j.issn.1674-1404.2011.05.002.
[27] SALVADÓ Z, ARROYO-LÓPEZ F N, BARRIO E, et al. Quantifying the individual effects of ethanol and temperature on the fitness advantage of Saccharomyces cerevisiae[J]. Food Microbiology, 2011,28(6): 1155-1161. DOI:10.1016/j.fm.2011.03.008.
[28] WINDERICKX J, HOLSBEEKS I, LAGATIE O, et al. From feast to famine adaptation to nutrient availabty in yeast[M]// HOHMANN S,MAGER W H. Yeast stress responses. Berlin: Springer, 2003, 1:305-386. DOI:10.1007/3-540-45611-2_7.
[29] MEDINA K, BOIDO E, DELLACASSA E, et al. Growth of non-Saccharomyces yeasts affects nutrient availability for Saccharomyces cerevisiae during wine fermentation[J]. International Journal of Food Microbiology, 2012, 157(2): 245-250. DOI:10.1016/j.ijfoodmicro.2012.05.012.
[30] DÍAZ-MONTAÑO D M, FAVELA-TORRES E, CÓRDOVA J.Improvement of growth, fermentative eきciency and ethanol tolerance of Kloeckera africana during the fermentation of agave tequilana juice by addition of yeast extract[J]. Journal of the Science of Food and Agriculture, 2010, 90(2): 321-328. DOI:10.1002/jsfa.3820.
[31] VALLE-RODRÍGUEZ J O, HERNÁNDEZ-CORTÉS G, CÓRDOVA J, et al. Fermentation of agave tequilana juice by Kloeckera africana: influence of amino-acid supplementations[J]. Antonie van Leeuwenhoek, 2012, 101(2): 195-204. DOI:10.1007/s10482-011-9622-x.
[32] ANDORRÀ I, BERRADRE M, MAS A, et al. Effect of mixed culture fermentations on yeast populations and aroma profile[J]. LWTFood Science and Technology, 2012, 49(1): 8-13. DOI:10.1016/j.lwt.2012.04.008.
[33] ALONSODELREAL J, LAIRÓNPERIS M, BARRIO E, et al.Effect of temperature on the prevalence of Saccharomyces non cerevisiae species against a S. cerevisiae wine strain in wine fermentation: competition, physiological fitness, and influence in final wine composition[J]. Frontiers in Microbiology, 2017, 8: 1-15.DOI:10.1007/s10482-011-9622-x.
[34] BISSON L F. Stuck and sluggish fermentations[J]. American Journal of Enology and Viticulture, 1999, 50(1): 107-119.
[35] 孙明娣, 史锋, 王小元. 酿酒酵母NAD(H)激酶Pos5p在细胞抵抗氧化胁迫中的作用[J]. 微生物学通报, 2010, 37(12): 1740-1746.
[36] MORALES P, ROJAS V, QUIRÓS M, et al. The impact of oxygen on the final alcohol content of wine fermented by a mixed starter culture[J]. Applied Microbiology and Biotechnology, 2015, 99(9):3993-4003. DOI:10.1007/s00253-014-6321-3.
[37] 张洁, 董文宾, 张大为. 果酒行业中减少或替代二氧化硫方法的研究进展[J]. 酿酒科技, 2010, 31(3): 96-102.
[38] ALBERTIN W, MIOT-SERTIER C, BELY M, et al. Oenological prefermentation practices strongly impact yeast population dynamics and alcoholic fermentation kinetics in chardonnay grape must[J].International Journal of Food Microbiology, 2014, 178: 87-97.DOI:10.1016/j.ijfoodmicro.2014.03.009.
[39] MATURANO Y P, NALLY M C, TORO M E, et al. Monitoring of killer yeast populations in mixed cultures: influence of incubation temperature of microvinifications samples[J]. World Journal of Microbiology and Biotechnology, 2012, 28(11): 3135-3142.DOI:10.1007/s11274-012-1123-1.
[40] 关雅静, 程永芳, 张岩, 等. 葡萄酒共发酵体系中不同酵母菌种的相互影响[J]. 北方园艺, 2016(2): 193-197. DOI:10.11937/bfyy.201602051.
[41] 陶金莉, 迟莉丽, 沈亚领, 等. 细菌的群体行为调控机制-Quorum sensing[J]. 微生物学通报, 2004, 31(4): 106-110. DOI:10.3969/j.issn.0253-2654.2004.04.025.
[42] PETER N, DENNIS N, NILS A. Viable Saccharomyces cerevisiae cells at high concentrations cause early growth arrest of non-Saccharomyces yeasts in mixed cultures by a cell-cell contact-mediated mechanism[J].Yeast, 2003, 20(4): 331-341. DOI:10.1002/yea.965.
[43] RENAULT P E, ALBERTIN W, BELY M. An innovative tool reveals interaction mechanisms among yeast populations under oenological conditions[J]. Applied Microbiology and Biotechnology, 2013, 97(9):4105-4119. DOI:10.1007/s00253-012-4660-5.
[44] MAINS A O. Evaluating the impact of yeast co-inoculation on individual yeast metabolism and wine composition[D]. Stellenbosch:Stellenbosch University, 2014: 35-38.
[45] ORO L, CIANI M, COMITINI F. Antimicrobial activity of Metschnikowia pulcherrima on wine yeasts[J]. Journal of Applied Microbiology, 2014, 116(5): 1209-1217. DOI:10.1111/jam.12446.
[46] VILLALBA M L, SUSANA S J, DEL M S, et al. TdKT, a new killer toxin produced by Torulaspora delbrueckii effective against wine spoilage yeasts[J]. International Journal of Food Microbiology, 2016,217: 94-100. DOI:10.1016/j.ijfoodmicro.2015.10.006.
[47] 翟明昌, 朴永哲, 王祥余, 等. 葡萄酒发酵过程中酵母菌之间相互抑制作用的研究[J]. 中国微生态学杂志, 2011, 23(1): 18-21.
[48] 颜兵, 江月, 梁若楠, 等. 酿酒酵母和异常汉逊酵母在酿酒过程中的相互作用[J]. 安徽农业科学, 2016, 44(2): 107-109. DOI:10.3969/j.issn.0517-6611.2016.02.038.
[49] SATORA P, CIOCH M, TARKO T, et al. Killer strains of Saccharomyces: application for apple wine production[J]. Journal of the Institute of Brewing, 2016, 122(3): 412-421. DOI:10.1002/jib.338.
[50] URSZULA B, PAWEL S, PAWEL S. The influence of Pichia killer toxins on the wine spoilage yeasts[J]. Potravinarstvo, 2015, 9(1): 284-287. DOI:10.5219/481.
[51] MEHLOMAKULU N N, SETATI M E, DIVOL B. Characterization of novel killer toxins secreted by wine-related non-Saccharomyces yeasts and their action on Brettanomyces spp.[J]. International Journal of Food Microbiology, 2014, 188(10): 83-91. DOI:10.1016/j.ijfoodmicro.2014.07.015.
[52] COMITINI F, GOBBI M, DOMIZIO P, et al. Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J]. Food Microbiology, 2011, 28(5):873-882. DOI:10.1016/j.fm.2010.12.001.
[53] REDÓN M, GUILLAMÓN J M, MAS A, et al. Effect of lipid supplementation upon Saccharomyces cerevisiae lipid composition and fermentation performance at low temperature[J]. European Food Research and Technology, 2009, 228(5): 833-840. DOI:10.1007/s00217-008-0996-6.
[54] EDWARDS C G, BEELMAN R B, BARTLEY C E, et al. Production of decanoic acid and other volatile compounds and the growth of yeast and malolactic bacteria during vinification[J]. American Journal of Enology & Viticulture, 1990, 93(1): 37-38.
[55] RIBEIRO L S, DUARTE W F, DIAS D R, et al. Fermented sugarcane and pineapple beverage produced using Saccharomyces cerevisiae and non-Saccharomyces yeast[J]. Journal of the Institute of Brewing, 2015,121(2): 262-272. DOI:10.1002/jib.218.
[56] RANTSIOU K, DOLCI P, GIACOSA S, et al. Candida zemplinina can reduce acetic acid produced by Saccharomyces cerevisiae in sweet wine fermentations[J]. Applied and Environmental Microbiology,2012, 78(6): 1987-1994. DOI:10.1128/AEM.06768-11.
[57] ENGLEZOS V, TORCHIO F, CRAVERO F, et al. Aroma profile and composition of barbera wines obtained by mixed fermentations of Starmerella bacillaris, (synonym Candida zemplinina) and Saccharomyces cerevisiae[J]. LWT-Food Science and Technology,2016, 73: 567-575. DOI:10.1016/j.lwt.2016.06.063.
[58] LI X, YU B, CURRAN P, et al. Impact of two Williopsis, yeast strains on the volatile composition of mango wine[J]. International Journal of Food Science & Technology, 2012, 47(4): 808-815. DOI:10.1111/j.1365-2621.2011.02912.x.
[59] GOBBI M, COMITINI F, DOMIZIO P, et al. Lachancea thermotolerans and Saccharomyces cerevisiae in simultaneous and sequential co-fermentation: a strategy to enhance acidity and improve the overall quality of wine[J]. Food Microbiology, 2013, 33(2): 271-281. DOI:10.1016/j.fm.2012.10.004.
[60] GARCIA A, CARCEL C, DULAU L, et al. Influence of a mixed culture with Debaryomyces vanriji and Saccharomyces cerevisiae on the volatiles of a muscat wine[J]. Journal of Food Science, 2002,67(3): 1138-1143. DOI:10.1111/j.1365-2621.2002.tb09466.x.
[61] 贾言言, 刘四新, 李卓婷, 等. 非酵母属酵母的接种顺序对混合发酵菠萝酒香气成分的影响[J]. 食品科学, 2015, 36(17): 152-157.DOI:10.7506/spkx1002-6630-201517029.
[62] SADOUDI M, TOURDOT-MARECHAL R, ROUSSEAUX S, et al.Yeast-yeast interactions revealed by aromatic profile analysis of sauvignon blanc wine fermented by single or co-culture of non-Saccharomyces, and Saccharomyces, yeasts[J]. Food Microbiology,2012, 32(2): 243-253. DOI:10.1016/j.fm.2012.06.006.
[63] MILANOVIC V, CIANI M, ORO L, et al. Starmerella bombicola influences the metabolism of Saccharomyces cerevisiae at pyruvate decarboxylase and alcohol dehydrogenase level during mixed wine fermentation[J]. Microbial Cell Factories, 2012, 11(1): 1-11.DOI:10.1186/1475-2859-11-18.
[64] MOSTERT T T, DIVOL B. Investigating the proteins released by yeasts in synthetic wine fermentations[J]. International Journal of Food Microbiology, 2014, 171(5): 108-118. DOI:10.1016/j.ijfoodmicro.2013.11.010.
[65] MATURANO Y P, ASSAF L A R, TORO M E, et al. Multi-enzyme production by pure and mixed cultures of Saccharomyces, and non-Saccharomyces, yeasts during wine fermentation[J]. International Journal of Food Microbiology, 2012, 155(1/2): 43-50. DOI:10.1016/j.ijfoodmicro.2012.01.015.
Research Progression in Mixed Culture Fermentation of Fruit Wine with Yeasts
ZHANG Wenwen, BAI Mengyang, WU Zufang*, WENG Peifang, MIAO Yingjie
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Abstract:Fruit wine is a yeast-fermented low alcohol beverage, whose taste and fl avor are directly affected by the selection of yeasts. Due to the diversity and differential metabolic characteristics of yeasts, the fermentation of fruit wine with mixed strains has aroused widespread concern. However, the interaction of yeasts during mixed culture fermentation affects their growth and metabolite production, and further affects wine quality. In this paper, the types and functions of fruit wine yeasts are summarized. The focus is on reviewing recent advances in the effect of environmental stress on the mixed culture fermentation and the interaction of fruit wine yeasts. This article aims to provide theoretical support for mixed culture fermentation of fruit wine with yeasts so as to improve the quality of fruit wine.
Keywords:fruit wine; yeast; mixed culture fermentation; interaction
ZHANG Wenwen, BAI Mengyang, WU Zufang, et al. Research progression in mixed culture fermentation of fruit wine with yeasts[J]. Food Science, 2018, 39(19): 252-259. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201819039.http://www.spkx.net.cn
张文文, 白梦洋, 吴祖芳, 等. 果酒酵母菌混合发酵的研究进展[J]. 食品科学, 2018, 39(19): 252-259. DOI:10.7506/spkx1002-6630-201819039. http://www.spkx.net.cn
引文格式:
文章编号:1002-6630(2018)19-0252-08
文献标志码:A
中图分类号:TS261.1
DOI:10.7506/spkx1002-6630-201819039
*通信作者简介:吴祖芳(1963—),男,教授,博士,主要从事食品生物技术研究。E-mail:wzfwpf@163.com
第一作者简介:张文文(1994—),女,硕士研究生,主要从事食品生物技术研究。E-mail:327342468@qq.com
基金项目:国家自然科学基金面上项目(31471709)
收稿日期:2017-05-30


