李婉竹,梁 琪*,张 炎,文鹏程
(甘肃农业大学食品科学与工程学院,甘肃省功能乳品工程实验室,甘肃 兰州 730070)
摘 要:探讨不同冻融次数下牦牛肉中的蛋白质氧化对其保水性的影响。选取3 岁左右的甘南牦牛背最长肌,经过7 次冻融循环,分别测定样品的pH值、解冻损失率、蒸煮损失率、加压失水率、羰基含量、巯基含量以及蛋白质溶解度。结果表明,随着冻融次数的增加,pH值显著降低(P<0.05),解冻损失率、加压失水率和蒸煮损失率反映的保水性也显著降低(P<0.05),羰基、巯基含量反映的蛋白质氧化程度显著增加(P<0.05),蛋白质溶解度中全蛋白、肌原纤维蛋白以及肌浆蛋白均呈现显著下降(P<0.05)。pH值、保水性和蛋白质氧化之间相关性显著(P<0.05),在7 次冻融过程中,pH值下降速率趋势与保水性下降速率趋势一致,并且后期保水性下降速率减缓的同时蛋白质氧化速率上升。表明多次冻融循环会引起牦牛肉蛋白质氧化程度显著升高,造成保水性显著下降,贮运体系中通过有效地控制蛋白质氧化可以更好地提高牦牛肉品质。
关键词:牦牛肉;冻融;保水性;蛋白质氧化
在全球肉类出口市场中,冷冻是肉类贮运优先选择的方法[1]。牦牛放牧于海拔3 000 m以上的青藏高原高寒草地,由于交通及环境因素的制约,对于胴体的运输,冷冻技术被应用最为广泛,然而,在运输、贮藏及销售过程中的温度波动会导致牦牛肉发生反复的冷冻和解冻,影响其肉的品质。
国内外研究人员已经注意到多次冻融对肌肉品质会产生不利的影响,造成持水性降低,而低持水性是引起产品品质下降的主要因素。Kim等[2]研究表明肌肉经反复冻融,形成的冰晶引起水分渗透和机械损伤,造成色泽、嫩度等肌肉品质的下降等。在冻融循环过程中环境中的氧气加速了脂肪和蛋白质的氧化,Jeong等[3]研究发现新鲜牛肉中的硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)(0.387 mg/kg)显著低于5 次冻融循环。此前关于冻融大多数集中在用不同浓度的氧化剂迫使肌肉发生氧化反应,对于了解实际机制存在局限性,而蛋白质氧化对肌肉汁液流失与品质劣变的影响机制不完全清楚[4]。
目前针对牦牛肉冷冻贮藏特性的研究极少,关于牦牛肉在冻融过程期间的蛋白质氧化特性的研究鲜见报道。基于以上研究,本实验着重探讨甘南牦牛肉在不同冻融次数条件下发生的蛋白质氧化对保水性的影响,通过多次冻融揭示蛋白质氧化与保水性的相关性,了解冻融次数对牦牛肉品质劣变的影响机制,以期为产业化有效提高牦牛肉的品质提供理论依据。
牦牛背最长肌采自甘肃甘南藏族自治州玛曲县的3 岁左右健康放牧牦牛20 头。
乙二醇双(2-氨基乙醚)四乙酸(ethylene glycol bis(2-aminoethyl ether) tetraacetic acid,EGTA)、二硝基苯肼 上海中秦化学试剂有限公司;盐酸胍 天津市光复精细化工研究所;尿素 烟台市双化工有限公司;二硝基苯甲酸(5,5’-dithio bis (2-nitrobenzoic acid),DTNB) 上海源叶生物科技有限公司;其他所用试剂均为国产分析纯。
TGL-20M高速台式冷冻离心机 上海谦科仪器有限公司;XHF-D高速分散器(内切式匀浆机) 宁波新芝生物科技股份有限公司;754PC型紫外-可见分光光度计上海光谱仪器有限公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司;QL-866旋涡混合器 海门市其林贝尔仪器制造有限公司;YYW-2型应变控制试无侧限压力仪 南京土壤仪器有限公司。
1.3.1 样品处理
牦牛屠宰后立即取其背最长肌,剔除肉表面的筋、腱、膜及脂肪后,将肉样切成质量100 g左右的肉块,用聚乙烯食品保鲜袋包装,装入放有冰袋的保温盒中运回实验室。样品随机分为8 组,每组3 份平行,分别为冻融0、1、2、3、4、5、6、7 次。样品循环冻融条件为在-18 ℃冷冻,4 ℃解冻12 h,每周冻融1 次。
1.3.2 pH值
将解冻后的肉样用便携式pH计进行测定,将探头插入到肉样中,使其电极与肌肉组织充分接触,待pH计读数稳定后记录,每个肉样测定3 次,取平均值。
1.3.3 解冻损失率的测定
肉样分别在解冻前、后用吸水纸擦去表面渗出汁液并准确称量质量。解冻损失率计算公式如下:
式中:m1为解冻前肌肉质量;m2为解冻后肌肉质量。
1.3.4 蒸煮损失率的测定[5]
将准确称质量后的肉样(2 cm×2 cm×3 cm)装入蒸煮袋中封好,在恒温水浴中加热至肉样的中心温度达到75 ℃,取出冷却至室温,再用吸水纸吸干表面汁液后进行称量质量,蒸煮损失率计算公式如下:
式中:m3为蒸煮前肌肉质量;m4为蒸煮后肌肉质量。
1.3.5 加压失水率
采用Farouk等[6]的方法。测定肉样在35 kg压力下保持5 min的水分损失量,加压前后分别称量质量,加压条件下的保水性可以用加压失水率表示,加压失水率计算公式如下:
式中:m5为加压前肌肉质量;m6为加压后肌肉质量。
1.3.6 肌原纤维蛋白的制备
参照Park等[7]的方法。将切碎的肉块与4 倍体积的分离缓冲液(0.1 mol/L NaCl、10 mmol/L Na3PO4、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0)混合匀浆后离心(4 ℃、2 000×g、15 min),所得沉淀重复洗涤,离心2 次。随后再按上述操作用4 倍体积0.1 mol/L NaCl 溶液洗涤,离心2 次,并在最后1 次离心前用3 层纱布过滤,再用0.1 mol/L HCl溶液将其pH值调至6.0,得到肌原纤维蛋白于-20 ℃冷冻储藏。用考马斯亮蓝法对肌原纤维蛋白浓度进行测定,采用牛血清蛋白作为标准蛋白。
1.3.7 羰基含量测定
参照Levine等[8]的方法在1.5 mL的离心管中,加入0.1 mL的蛋白液与0.5 mL 0.02 mol/L 2,4-二硝基苯肼的2 mol/L HCl溶液,在25 ℃反应40 min,空白样品中加入0.5 mL不含2,4-二硝基苯肼的2 mol/L HCl溶液。然后在上述反应液中分别加入0.5 mL质量分数为20%的三氯乙酸,振荡后离心(4 ℃、11 000×g、5 min)弃上清液,蛋白质沉淀用1 mL的乙醇-乙酸乙酯溶液(1∶1,V/V)洗涤3 次,挥发完溶剂后将蛋白质悬浮于1 mL 6 mol/L盐酸胍溶液中,在37 ℃条件下水浴30 min。以空白为对照于λ370nm波长下测吸光度,每组样品测量3 个平行,结果取平均值。羰基含量计算公式如下:
式中:A为370 nm波长处的吸光度;n为稀释倍数;ε为摩尔吸光系数22 000/(L/(mol·cm));ρ为蛋白质质量浓度/(mg/mL)。
1.3.8 总巯基含量测定
根据Srinivasan等[9]的方法,将蛋白液稀释至2 mg/mL,与尿素缓冲液按1∶1比例溶解,孵育后用加入0.5 mL DTNB试剂,在室温反应15 min,在λ412nm处测吸光度。空白组加入0.5 mL不含DTNB的缓冲液,每组样品测量3 个平行,结果取平均值。巯基含量计算公式如下:
式中:A为412 nm波长处的吸光度;n为稀释倍数;ε为摩尔吸光系数11 400/(L/(mol·cm));ρ为蛋白质质量浓度/(mg/mL)。
1.3.9 蛋白质溶解度
根据Joo等[10]的方法,肌浆蛋白:2.5 g肉样加50 mL冰预冷的0.025 mol/L的磷酸钾缓冲溶液(pH 7.3),匀浆(6 500 r/min)20 s×3 次,4 ℃摇匀12 h。5 700×g离心10 min,取上清液,用考马斯亮蓝测定蛋白浓度。溶解度表示为mg/g肉。
总蛋白溶解度:2.5 g肉样加50 mL冰预冷的1.1 mol/L碘化钾的0.1 mol/L磷酸钾缓冲液溶液(pH 7.3),匀浆(6 5 0 0 r/m i n)2 0 s×3 次,4 ℃摇匀12 h。 5 700×g离心10 min,取上清液,用考马斯亮蓝测定蛋白浓度。溶解度表示为mg/g肉。肌原纤维蛋白溶解度计算公式如下:
肌原纤维蛋白溶解度=总蛋白溶解度-肌浆蛋白溶解度 (6)
数据采用Origin 8.0与SPSS 19.0软件进行处理。采用方差分析,采用邓肯氏多重比较方法进行显著性分析。

图1 冻融次数对牦牛肉pH值的影响
Fig. 1 Effects of freeze-thaw cycles on pH of yak meat
肌肉中的pH值主要依赖于肌肉中肌糖原的存在,是影响肉品持水性的主要因素之一。肌肉最初的pH值增加或是降低和氧化速率、滴水损失等有关[11]。由图1可以看出,随着冻融次数的增加,pH值显著降低(P<0.05)。肉样中pH值呈现持续降低的趋势,这是由于pH值会影响蛋白质分子的离子化作用和净电荷值,从而影响蛋白分子间的吸引力和排斥力以及蛋白分子与水分子的结合能力[12]。在反复冻融过程中,解冻使得糖酵解增加和磷酸化酶的激活而导致pH值降低[13]。同时得出,前期3次冻融,pH值下降了6.97%,后期冻融过程中pH值下降了2.07%,说明在后期冻融过程中,pH值的下降速率逐渐降低,当pH值下降到肌原纤维蛋白质等电点附近的时候,肌肉蛋白质所带的正负电荷大致相等,净电荷为零,肌肉蛋白质对水分的吸引力最低,导致水分大量流失[14],后期水分流失达到饱和,溶质浓度不再增加,使得pH值下降不显著(P>0.05),基本保持一致[15],pH值的变化过程是复杂的,其具体机制有待深入研究。在解冻过程中,水溶性蛋白质的析出,微生物代谢产物的变化,都可能对肉品pH值产生影响。
随着冻融次数的增加,肉中的细胞液从组织内部不断渗出,不仅影响其外观,而且使肌肉中的营养成分流失和汁液流失增加。从表1可以看出,随着冻融次数的增加,pH值显著降低(P<0.05),解冻损失率、加压失水率和蒸煮损失率反映的保水性也显著降低(P<0.05)。在前3 次冻融循环中,解冻损失率、蒸煮损失率和加压失水率分别增加了67.89%、23.51%和53.24%,而在后4 次冻融循环中分别增加了23.90%、20.76%和10.38%,说明在后期冻融过程中,保水性的下降速率有所变慢。这可能是因为肌肉被冷冻后水分在冻结过程中体积的增加使肌细胞的细胞膜冻裂[16],而后由于在解冻时细胞中的汁液渗漏较多。导致较高的解冻失水率,而在反复冻融次数增多时水分丢失达到饱和[17]。杨巧能等[18]研究发现牦牛肉在成熟过程中蒸煮损失率和失水率同样呈先上升后下降的趋势,说明肌肉保水性与pH值有关。
Wang Hang等[19]研究表明肌肉不断的进行冻结-解冻过程,会引起冰晶不断再形成、对肌肉细胞膜和细胞器造成机械损伤,肌肉的持水能力下降,肌肉的蒸煮损失率、解冻损失随着冻融次数的增加而增大。Rahman[11]和Leygonie[20]等报道滴水损失和蒸煮损失率都会受到冻融循环的影响,这与本研究结果一致。本研究发现,结果表明肌肉的保水性与宰后pH值的下降速率度密切相关,宰后pH值下降速率越快,保水性下降速率就会越大,并且冻融前期下降速率明显高于后期,随着冻融次数的增加,肉品质急剧下降。
表1 冻融次数对牦牛肉保水性的影响
Table 1 Effects of freeze-thaw cycles on water holding capacity of yak meat
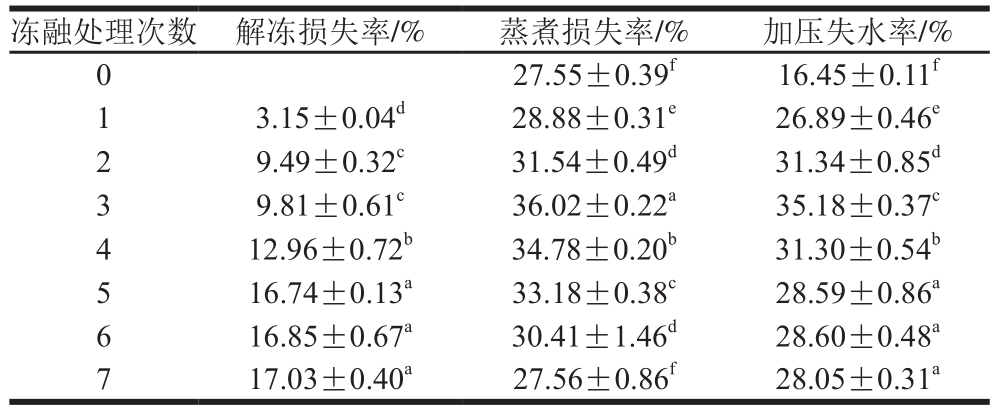
注:同列字母不同表示差异显著(P<0.05)。

图2 冻融次数对牦牛肉羰基含量的影响
Fig. 2 Effects of freeze-thaw cycles on carbonyl group content of yak meat
蛋白质氧化导致不同蛋白质产物的形成,比如氨基酸侧链的芳香烃羟基化,硫醇氧化以及羰基化合物的形成,后来被广泛作为不同肉制品中蛋白质氧化的一个通用标记[21],因此,蛋白质氧化的程度可以通过羰基的量化来评估[22]。由于蛋白质肽链上带有NH—及NH2—基团,其氨基酸侧链受到自由基的攻击,使其断裂形成羰基,从而导致羰基含量的增加,羰基值越大蛋白质氧化程度越大[23-24]。通过分析牦牛肉在冻融过程中羰基含量变化,可以反映牦牛肉在冻融条件下蛋白质氧化程度及其品质变化。从图2可以看出,随着冻融次数的增加,牦牛肉蛋白质羰基含量显著增加(P<0.05)。第7次冻融后,羰基含量高达9.48 nmol/mg,与第0次冻融的6.04 nmol/mg有明显差异(P<0.05)。表明反复冻融会产生大量的活性氧自由基,使牦牛肉蛋白质的氨基酸侧链NH—或NH2—基团部分转化为羰基基团。同时发现,冻融3 次后,羰基含量增加了17.37%,后4 次冻融过程中,羰基含量增加了18.35%,该结果说明,虽然后期保水性下降速率有所降低,但是氧化速率在不断增加。
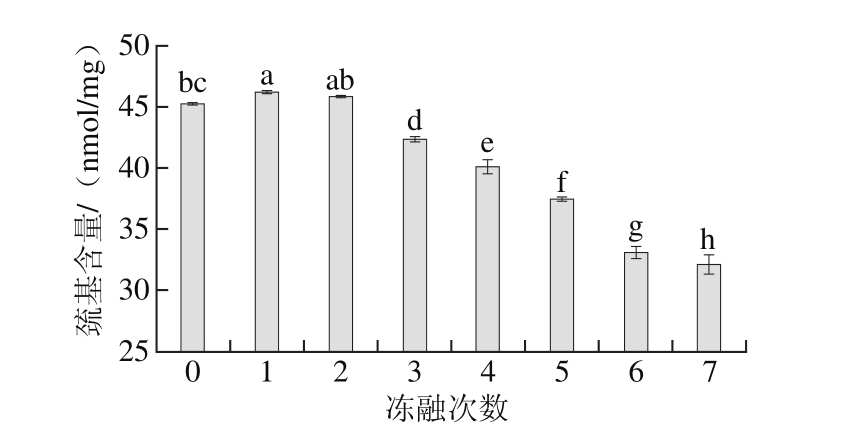
图3 冻融次数对牦牛肉巯基含量的影响
Fig. 3 Effects of freeze-thaw cycles on sulfydryl group content of yak meat
肌肉蛋白质的变性和聚集与二硫键的形成有关,在早期蛋白质氧化过程中,巯基转变成二硫键或其他氧化产物[24]。由图3可知,牦牛肉中蛋白质巯基含量随冻融次数的增加显著降低(P<0.05),经7 次冻融后,牦牛肉蛋白质巯基含量降低至32.12 nmol/mg。通常蛋白质氧化程度越高总巯基含量越低。羟自由基诱导的蛋白质氧化,使细胞遭到破坏,导致蛋白质中巯基转化成二硫键,从而造成蛋白质巯基含量下降[25]。巯基对于稳定肌原纤维蛋白完整的空间结构具有十分重要的意义,因此蛋白质空间结构的伸展同样会造成巯基含量的显著降低[26-27],从而直观地反映出蛋白质的氧化程度。因此,分析巯基含量的变化可以从另一个方面反映在冻融条件下的蛋白质氧化效应。同时从本实验结果可以看出,经过3 次冻融的牦牛肉巯基含量降低了6.38%,后期冻融过程中,巯基含量降低了20.03%,表明前期冻融循环巯基含量明显低于后期,说明冻融循环后期的氧化速率高于前期氧化速率。
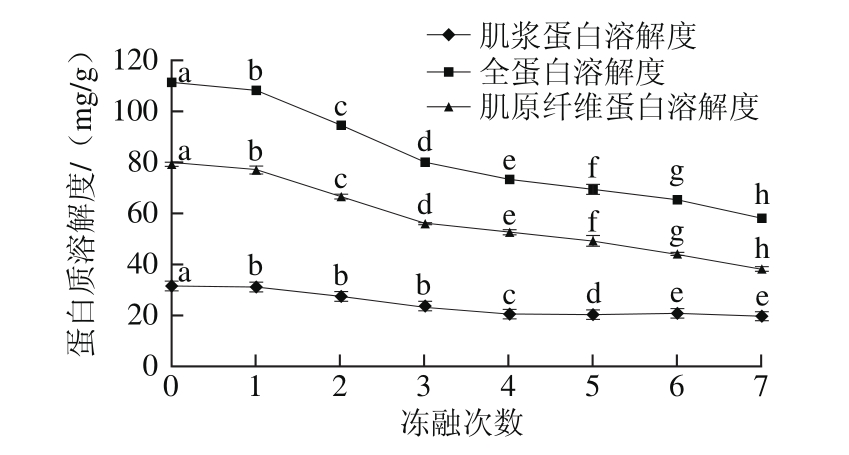
图4 冻融次数对牦牛肉蛋白质溶解度的影响
Fig. 4 Effects of freeze-thaw cycles on protein solubility
从图4可以看出,随着冻融次数的增加,全蛋白溶解度从新鲜的111.51 mg/g经过7 次冻融后降低到58.11 mg/g,降低了53.4 mg/g,表明增加冻融次数会使全蛋白质溶解度显著下降(P<0.05)。同时从图5可以发现,冻融3 次后,全蛋白溶解度降低了28.12%,后4 次冻融过程中,降低了31.65%,即后期冻融过程中的全蛋白溶解度下降速率高于前期下降速率。另外,冷冻储藏过程中肌原纤维蛋白的减少是蛋白质变性的一个主要指标,肌原纤维蛋白溶解度从新鲜的79.88 mg/g经过7 次冻融后降低到38.35 mg/g,这是由于肌原纤维蛋白部分结合水形成冰晶,使得肌动球蛋白分子之间可以相互形成非共价键(疏水键和氢键),进而形成超大分子的不溶性凝集体,导致在反复冻融过程中其溶出量不断下降所致。肌肉蛋白质的溶解性会随着冻藏过程中蛋白质的变性而降低,表现在蛋白质的可提取性降低。而与全蛋白和肌原纤维蛋白溶解度变化相比,肌浆蛋白的溶解度呈现出相对平缓的下降趋势,这可能是由于肌肉在解冻过程中渗出液的流失所致[28]。Leygonie等[20]研究表明,随着冻融次数的增加,蛋白质发生氧化,引起蛋白聚合,肽断裂,从而使得基质蛋白类不稳定,导致蛋白质溶解度降低,保水性下降等。因此随着冻融次数的增加,蛋白质溶解度基本显示出显著性降低(P<0.05),即肉样的保水性随之显著下降的规律。
表2 牦牛肉各品质指标相关性分析
Table 2 Correlation analysis among various quality parameters of yak meat

注:*.相关性显著(P<0.05);**.相关性极显著(P<0.01)。
由表2可知,冻融次数与保水性呈现较高的相关性,其中冻融次数与pH值、解冻损失率均呈现极显著相关(P<0.01),同时,pH值与解冻损失率、失水率呈极显著负相关(P<0.01),与蒸煮损失率呈显著负相关(P<0.05),表明随着冻融次数的增加,pH值降低,肌肉蛋白质静电荷减少,蛋白质之间排斥力减小使得蛋白质分子相互靠近,分子之间空间缩小而将分布在其中的水分挤出,从而使得保水性也逐渐下降。同时由表2可看出,冻融次数与蛋白质氧化也呈现极显著相关性(P<0.01),说明冻融次数的增加引起肌原纤维以及基质中多数蛋白氧化变性,同时,pH值和解冻损失率与羰基和巯基以及蛋白质溶解度相关性极显著(P<0.01),表明随着机械组织的破坏,细胞膜的破裂,能溶解于肌肉汁液中的全蛋白也会随之流失,也就说明了随着冻融次数的增加蛋白质溶解度的降低导致了肌肉的保水性削弱,同时蛋白质氧化造成的交联、降解及变性都会导致肌肉持水性的降低而影响肌肉的品质[29-30]。因此可以得出随着冻融次数的增加,保水性与蛋白质氧化相关性极显著(P<0.01)。
反复冻融导致牦牛肉保水性显著削弱,随着冻融次数的增加,解冻损失率、蒸煮损失率和加压失水率显著降低(P<0.05),肌肉中水分的流失,使得肌肉溶质浓度的增加,从而导致pH值下降。同时宰后pH值下降速率越快,保水性下降速率就会越大,因此有效的控制pH值可以提高牦牛肉保水性。反复冻融循环促进了牦牛肉蛋白质氧化,并且随着冻融次数的增加,蛋白质氧化程度显著升高(P<0.05),并且后期冻融过程中保水性下降速率变慢的同时氧化速率加快。冻融次数与保水性、蛋白质氧化呈现极显著相关性(P<0.01),其中羰基、巯基、蛋白质溶解度等蛋白质氧化相关指标与pH值、解冻损失率、蒸煮损失率等保水性相关指标相关性显著(P<0.05),说明随着冻融次数的增加,牦牛肉蛋白质氧化程度与保水性下降呈显著相关性,在牦牛肉生产加工过程中控制蛋白质氧化速率对提高保水性有重要作用。
参考文献:
[1] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2):93-98. DOI:10.1016/j.meatsci.2012.01.013.
[2] KIM G D, JUNG E Y, LIM H J, et al. Inf l uence of meat exudates on the quality characteristics of fresh and freeze-thawed pork[J]. Meat Science, 2013, 95(2): 323-329. DOI:10.1016/j.meatsci.2013.05.007.
[3] JEONG J Y, KIM G D, YANG H S, et al. Effect of freeze-thaw cycles on physicochemical properties and color stability of beef semimembranosus muscle[J]. Food Research International, 2011,44(10): 3222-3228.
[4] TRAORE S, AUBRY L, GATELLIER P, et al. Higher drip loss is associated with protein oxidation[J]. Meat Science, 2012, 90(4): 917-924. DOI:10.1016/j.meatsci.2011.11.033.
[5] 田甲春, 韩玲, 刘昕, 等. 牦牛肉宰后成熟机理与肉用品质研究[J]. 农业机械学报, 2012, 43(12): 146-150. DOI:10.6041/j.issn.1000-1298.2012.12.027.
[6] FAROUK M M, WIELICZKO K J, MERTS I. Ultra-fast freezing and low storage temperatures are not necessary to maintain the functional properties of manufacturing beef[J]. Meat Science, 2004, 66(1): 171-179. DOI:10.1016/S0309-1740(03)00081-0.
[7] PARK D, XIONG Y L. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2007, 103(2): 607-616. DOI:10.1016/j.foodchem.2006.09.004.
[8] LEVINE R L, WILLIAMS J A, STADTMAN E R, et al. Carbonyl assays for determination of oxidatively modified proteins[J].Method in Enzymology, 1994, 233: 346-357. DOI:10.1016/0076-6879(90)86141-H.
[9] SRINIVASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radicalgenerating system[J]. Journal of Agricultural and Food Chemistry,1997, 45(2): 310-320. DOI:10.1021/jf960367g.
[10] JOO S T, KAUFFMAN R G, KIM B C, et al. The relationship of sarcoplasmic and myofibrillar protein solubility to color and waterholding capacity in porcine longissimus muscle[J]. Meat Science,1999, 52(3): 291-297. DOI:10.1016/S0309-1740(99)00005-4.
[11] RAHMAN M H, HOSSAIN M M, RAHMAN S M E, et al. Evaluation of physicochemical deterioration and lipid oxidation of beef muscle affected by freeze-thaw cycles[J]. Korean Journal for Food Science of Animal Resources, 2015, 35(6): 772-782. DOI:10.5851/kosfa.2015.35.6.772.
[12] OFFER G. Modelling of the formation of pale, soft and exudative meat: effects of chilling regime and rate and extent of glycolysis[J].Meat Science, 1991, 30(2): 157-184. DOI:10.1016/0309-1740(91)90005-b.
[13] LEYGONIE C, BRITZ T J, HOFFMAN L C. Oxidative stability of previously frozen ostrich Muscularis iliofibularis packaged under different modif i ed atmospheric conditions[J]. International Journal of Food Science & Technology, 2011, 46(6): 1171-1178. DOI:10.1111/j.1365-2621.2011.02603.x.
[14] 张玉伟, 罗海玲, 贾慧娜, 等. 肌肉系水力的影响因素及其可能机制[J].动物营养学报, 2012, 24(8): 1389-1396. DOI:10.3969/j.issn.1006-267x.2012.08.001.
[15] AROEIRA C N, TORRES FILHO R A, FONTES P R, et al. Freezing,thawing and aging effects on beef tenderness from Bos indicus and Bos taurus cattle[J]. Meat Science, 2016, 116: 118-125. DOI:10.1016/j.meatsci.2016.02.006.
[16] 郭建凤, 武英, 呼红梅, 等. 不同储存温度, 时间对长白猪肌肉pH及失水率的影响[J]. 西北农业学报, 2009, 18(1): 33-36.
[17] 蔡勇, 阿依木古丽, 徐红伟, 等. 冻融对兰州大尾羊肉品质, 营养成分及超微结构的影响[J]. 畜牧兽医学报, 2014, 45(2): 243-248.DOI:10.11843/j.issn.0366-6964.2014.02.
[18] 杨巧能, 梁琪, 文鹏程, 等. 宰后成熟时间对不同年龄牦牛肉用品质的影响[J]. 食品科学, 2015, 36(18): 237-241. DOI:10.7506/spkx1002-6630-201518044.
[19] WANG H, LUO Y K, SHI C, et al. Effect of different thawing methods and multiple freeze-thaw cycles on the quality of common carp(Cyprinus carpio)[J]. Journal of Aquatic Food Product Technology, 2015,24(2): 153-162. DOI:10.1080/10498850.2013.763884.
[20] LEYGONIE C, BRITZ T J, HOFFMAN L C. Meat quality comparison between fresh and frozen/thawed ostrich M. iliofibularis[J]. Meat Science, 2012, 91(3): 364-368. DOI:10.1016/j.meatsci.2012.02.020.
[21] SOGLIA F, PETRACCI M, ERTBJERG P. Novel DNPH-based method for determination of protein carbonylation in muscle and meat[J]. Food Chemistry, 2016, 197: 670-675. DOI:10.1016/j.foodchem.2015.11.038.
[22] CHEN Q Q, HUANG J C, HUANG F, et al. Influence of oxidation on the susceptibility of purif i ed desmin to degradation by μ-calpain,caspase-3 and-6[J]. Food Chemistry, 2014, 150: 220-226.DOI:10.1016/j.foodchem.2013.10.149.
[23] LI Y, LI X, WANG J Z, et al. Effects of oxidation on water distribution and physicochemical properties of porcine myofibrillar protein gel[J].Food Biophysics, 2014, 9(2): 169-178. DOI:10.1007/s11483-013-9329-9.
[24] XIA X F, KONG B H, LIU Q, et al. Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83(2): 239-245.DOI:10.1016/j.meatsci.2009.05.003.
[25] WANG Y S, XIONG Y L, RENTFROW G K, et al. Oxidation promotes cross-linking but impairs film-forming properties of whey proteins[J]. Journal of Food Engineering, 2013, 115(1): 11-19.DOI:10.1016/j.jfoodeng.2012.09.013.
[26] ALI S, ZHANG W, RAJPUT N, et al. Effect of multiple freeze-thaw cycles on the quality of chicken breast meat[J]. Food Chemistry, 2015,173: 808-814. DOI:10.1016/j.foodchem.2014.09.095.
[27] 李银, 李侠, 张春晖, 等. 羟自由基导致肉类肌原纤维蛋白氧化和凝胶性降低[J]. 农业工程学报, 2013, 29(12): 286-292. DOI:10.3969/j.issn.1002-6819.2013.12.036.
[28] QI J, LI C B, CHEN Y J, et al. Changes in meat quality of ovine longissimus dorsi muscle in response to repeated freeze and thaw[J].Meat Science, 2012, 92(4): 619-626. DOI:10.1111/j.1365-2621.1997.tb04381.x.
[29] 常海军, 牛晓影, 周文斌. 不同冻融次数对猪肉品质的影响[J]. 食品科学, 2014, 35(15): 43-48. DOI:10.7506/spkx1002-6630-201415009.
[30] 李银, 孙红梅, 张春晖, 等. 牛肉解冻过程中蛋白质氧化效应分析[J]. 中国农业科学, 2013, 46(7): 1426-1433. DOI:10.3864/j.issn.0578-1752.2013.07.013.
Relationship between Protein Oxidation and Water Holding Capacity of Yak Meat under Freeze-Thaw Cycles
LI Wanzhu, LIANG Qi*, ZHANG Yan, WEN Pengcheng
(Functional Dairy Product Engineering Laboratory of Gansu Province, College of Food Science and Engineering,Gansu Agricultural University, Lanzhou 730070, China)
Abstract:This study was designed to explore the effect of freeze-thaw cycles on the protein oxidation and water holding capacity of yak meat and also to investigate the relationship between the two parameters. Longissimus dorsi samples were collected from the carcass of 3-year-old Gannan yaks, and the changes in pH, thawing loss, cooking loss, pressurized water loss, carbonyl group and total sulfydryl group contents and protein solubility of repeatedly frozen-thawed yak meat were analyzed. The results showed that with an increase in the number of freeze-thaw cycles, pH was significantly decreased as well as water holding capacity (thawing loss, pressurized water loss and cooking loss) were significantly decreased (P < 0.05),the degree of protein oxidation (carbonyl group and total sulfydryl group contents) was significantly increased (P < 0.05),and total, myofibrillar and sarcoplasmic protein solubility were significantly decreased (P < 0.05). pH was significantly correlated with water holding capacity and protein oxidation (P < 0.05). During 7 freeze-thaw cycles, pH decreased at a rate similar to water holding capacity. Moreover, after the fourth cycle, the rate of decrease in water holding capacity was slowed down and the rate of protein oxidation was speeded up. All these results demonstrated that freeze-thaw cycles gave a rise to a significant rise in the degree of protein oxidation and caused a significant reduction of the water holding capacity of yak meat. Therefore, controlling protein oxidation during storage is effective in enhancing the quality of yak meat.
Keywords:yak meat; freeze-thaw cycles; water holding capacity; protein oxidation
DOI:10.7506/spkx1002-6630-201802003
中图分类号:TS211.7
文献标志码:A
文章编号:1002-6630(2018)02-0014-06
引文格式:李婉竹, 梁琪, 张炎, 等. 不同冻融次数下牦牛肉蛋白质氧化与保水性的关系[J]. 食品科学, 2018, 39(2): 14-19.
DOI:10.7506/spkx1002-6630-201802003. http://www.spkx.net.cn
LI Wanzhu, LIANG Qi, ZHANG Yan, et al. Relationship between protein oxidation and water holding capacity of yak meat under freeze-thaw cycles[J]. Food Science, 2018, 39(2): 14-19. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201802003. http://www.spkx.net.cn
收稿日期:2016-11-01
基金项目:“十二五”国家科技支撑计划项目(2012BAD28B01)
第一作者简介:李婉竹(1990—),女,硕士研究生,研究方向为畜产品加工。E-mail:544915072@qq.com
*通信作者简介:梁琪(1969—),女,教授,博士,研究方向为食品品质、食品科学。E-mail:liangqi@gsau.edu.cn