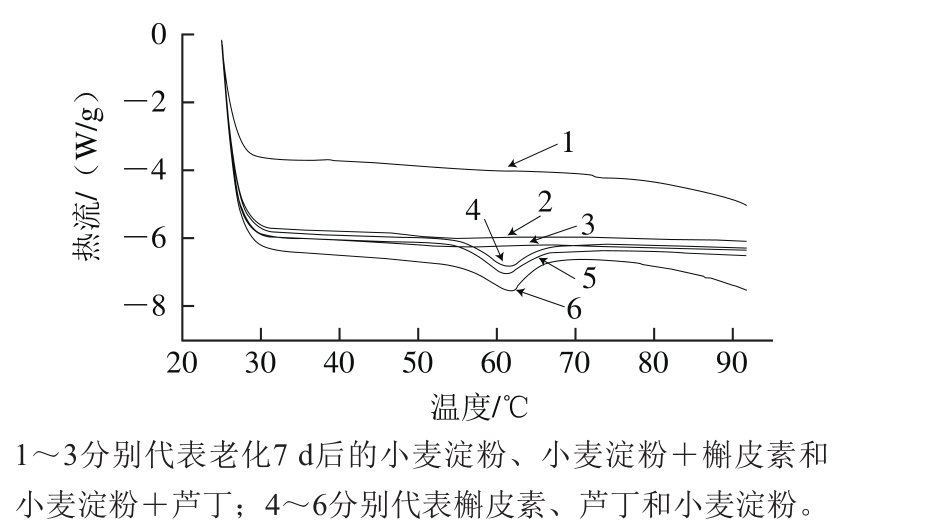
图1 添加0.25%芦丁或槲皮素的小麦淀粉混合物的差示扫描量热图
Fig. 1 DSC curves of wheat starch added with 0.25% rutin or quercetin
任顺成,孙晓莎
(河南工业大学粮油食品学院,小麦和玉米深加工国家工程实验室,河南 郑州 450001)
摘 要:在低质量分数芦丁和槲皮素存在条件下,研究小麦淀粉的热特性、微观结构、流变特性、糊化特性、质构的变化,以及芦丁和槲皮素对小麦淀粉-碘复合物的影响。结果表明:加入芦丁或槲皮素后,小麦淀粉的糊化初始温度、糊化峰值温度和糊化最终温度无显著变化,老化焓值分别增加85.71%和85.71%,老化度分别增加156.09%和93.24%;同时,电子显微镜结果也证明芦丁或槲皮素加快了老化进程;小麦淀粉的储存模量和损耗模量降低;淀粉黏度结果表明芦丁和槲皮素分别使小麦淀粉的峰值黏度减小5.56%和18.10%、最低黏度减小6.41%和21.32%、最终黏度减小3.28%和14.22%以及峰值时间减小1.93%和4.16%,回生值增加3.36%和0.52%,成糊温度升高0.63%和3.25%;芦丁和槲皮素分别使小麦淀粉的硬度降低44.60%和34.52%、黏性降低60.79%和30.95%、弹性降低2.94%和3.13%,黏聚性增加16.13%和16.13%;槲皮素能与小麦淀粉发生较强的相互作用,且能形成V型包合物。总体而言,芦丁和槲皮素能显著影响小麦淀粉的理化特性。
关键词:芦丁;槲皮素;小麦淀粉;理化特性
多酚普遍存于植物界,具有多种保健功能,在化学、医学和流行病学领域的研究愈加重视,如抗氧化、抗动脉硬化、抗癌、抗细菌和抗病毒活性[1]。黄酮作为多酚中的一大类化合物,种类众多,其中槲皮素是高抗氧化活性的类黄酮系列的代表性物质,在水果和蔬菜中较为常见[2],而芦丁(槲皮素-3-O-芸香糖苷)是苦荞中最主要的黄酮类化合物。
目前,国内外有关酚类化合物对淀粉特性影响的研究主要集中在茶多酚、阿魏酸和其他植物提取物,其中关于茶多酚对淀粉特性影响的报道较多,包括淀粉的流变、糊化、回生、凝胶特性和消化性等[3-4]。研究结果表明,多酚类物质可以与淀粉分子产生复杂的相互作用,由于生物小分子的作用特异性和生物大分子的结构复杂性,两者可以通过氢键、疏水键和静电力等发生相互作用,作用力强弱受各自的结构特征[5-8]以及反应体系中发生的物理、化学变化如水活度[8-9]、pH值和温度[9]等所影响,且这种相互作用会改变淀粉的热特性、微观结构、流变特性、糊化特性和质构参数等,进而影响淀粉类产品的质量。
有研究表明苦荞食品对糖尿病人具有良好的降血糖功效[10-11],作为苦荞功能特性的重要物质芦丁和槲皮素发挥了重要作用。通过研究小麦淀粉与芦丁及槲皮素之间的相互作用,对提高苦荞食品及相关淀粉类食品的加工特性和功能特性具有积极的指导意义,但该方面的研究鲜有报道。因此本实验以小麦淀粉为研究对象,添加一定质量分数的芦丁和槲皮素,借助差示扫描量热仪、扫描电子显微镜、流变仪、快速黏度分析仪和质构分析仪测定小麦淀粉理化性质的改变,探讨芦丁和槲皮素与小麦淀粉之间的相互作用,为弄清芦丁或槲皮素对淀粉类食品特性的影响,开发芦丁和槲皮素功能性食品提供一定的理论基础。
小麦淀粉 南京甘汁园糖业有限公司;芦丁、槲皮素(纯度95%) 上海源叶生物有限公司。
Pyris-1差示扫描量热仪 美国Perkin Elmer公司;su8010场发射扫描电子显微镜 江苏万科科教仪器有限公司;DHR-1流变仪 美国TA公司;Super4快速黏度检测仪 澳大利亚Newport Scientif i c有限公司;TA.XT.Plus质构仪 英国Stable Micro System公司;UV-752紫外-可见分光光度计 上海菁华科技仪器有限公司。
1.3.1 热力学特性
准确称取3.0 mg添加质量分数0.50%芦丁或槲皮素的小麦淀粉和7.5 µL的去离子水混合,密封压盖后放入4 ℃平衡12 h,用差示扫描量热仪进行升温测定,以空坩埚作参比。升温范围为25~95 ℃,升温速率为5 ℃/min。从热力学特性曲线可知糊化初始温度、糊化峰值温度、糊化最终温度、糊化焓值。将测完糊化参数后的坩埚取出,4 ℃放置7 d后测定其老化焓值和老化度等老化参数,操作过程同糊化过程。
1.3.2 微观结构的测定
准确称取3.0 g添加质量分数0.50%芦丁或槲皮素的小麦淀粉,与25 mL去离子水混合均匀,95 ℃恒温水浴中糊化20 min。冷却至室温后冻干、粉碎,过0.15 mm×0.15 mm的筛孔,采用扫描电子显微镜对芦丁或槲皮素与淀粉的复合物进行微观结构观察,将少量的粉末分散在载物台上的双面导电胶上,加速电压20 kV,真空条件下喷金处理后观察。
小麦淀粉和芦丁或槲皮素的混合物糊化过程同上,冷却至室温后在4 ℃放置7 d后冻干,测定复合物的微观结构。
1.3.3 动态流变特性
准确称取3.0 g添加质量分数0.50%芦丁或槲皮素的小麦淀粉,与25 mL去离子水混合均匀,95 ℃恒温水浴中糊化20 min。冷却至室温后立即测定样品储存模量和损耗模量随振荡频率的变化。动态黏弹性测定条件:在应变力0.5%条件下,25 mm平板,间隙1 mm,测试温度25 ℃,振荡频率0.1~10 Hz,对样品进行振荡扫描。
1.3.4 快速黏度分析
准确称取3.0 g分别添加质量分数0.50%芦丁或槲皮素的小麦淀粉,与25 mL去离子水混合均匀,进行淀粉黏度测定,过程参照GB/T 24853—2010《小麦、黑麦及其粉类和淀粉糊化特性测定 快速粘度仪法》进行测定。
1.3.5 凝胶强度和破裂距离
准确称取6.0 g分别添加质量分数0.15%、0.30%、0.45%、0.60%和0.75%芦丁或槲皮素的小麦淀粉,溶于55 mL去离子水中,搅拌均匀后95 ℃水浴10 min,放置至室温,采用P/5探头,测前速率1 mm/s,测中速率0.5 mm/s,测后速率10 mm/s,位移15 mm,对淀粉凝胶进行分析。
1.3.6 凝胶TPA特性
将质构仪设置为TPA模式,小麦淀粉凝胶处理方式同1.3.5节。第1次压缩时的最大峰值代表硬度,第1次压缩曲线达到零点到第2次压缩曲线开始之间的曲线的负面积代表黏性,2 次压缩所做正功之比为黏聚性,第2次压缩样品恢复高度和第1次的压缩变形量之比代表弹性。
1.3.7 芦丁和槲皮素对小麦淀粉-碘复合物形成的影响
将1.5 g KI溶解在12.5 mL蒸馏水中,再加入0.635 g I2,用蒸馏水定容至50 mL。将溶液在4 ℃条件下避光储存用作碘溶液。准确称取50 mg添加质量分数0.15%、0.30%、0.45%、0.60%和0.75%芦丁或槲皮素的小麦淀粉,滴入9.0 mL浓度为1.0 mol/L的NaOH溶液和体积分数95%乙醇溶液1.0 mL,定容至50 mL后放置30 min,分别取反应液1.0 mL和碘液3.0 mL混合,放置10 min,于波长620 nm处测吸光度。
每次实验均进行3 次平行,每个数据均为3 次平行实验的平均值,实验数据经过SPSS 16.0软件分析,芦丁和槲皮素对小麦淀粉特性的影响实验分析中采用最小显著差异(P≤0.05)的方法。数据以±s表示。

图1 添加0.25%芦丁或槲皮素的小麦淀粉混合物的差示扫描量热图
Fig. 1 DSC curves of wheat starch added with 0.25% rutin or quercetin
表1 添加0.25%芦丁或槲皮素的小麦淀粉混合物的差示扫描量热法分析结果
Table 1 Retrogradation and gelatinization properties of wheat starch added with 0.25% rutin or quercetin
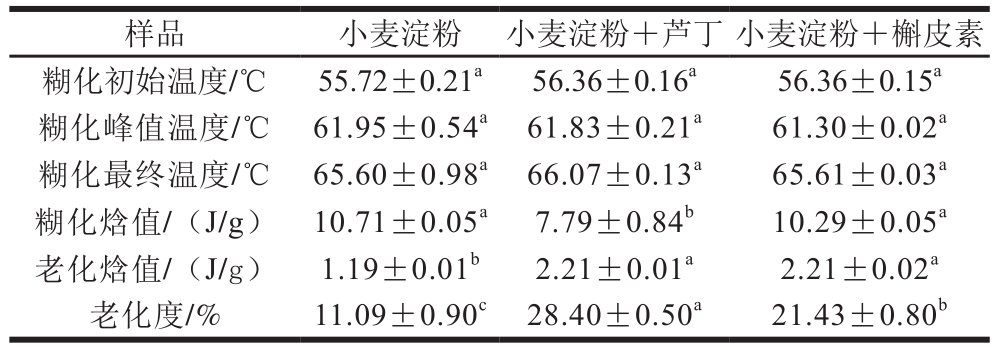
注:同行不同小写字母表示差异显著(P≤0.05)。表2~4同。
由表1可知,与对照组相比,在小麦淀粉中加入芦丁或槲皮素后,糊化初始温度、糊化峰值温度和糊化最终温度无显著变化;在淀粉糊放置7 d后的测试中,芦丁和槲皮素均显著增大了小麦淀粉的老化焓值(分别增加了85.71%和85.71%)和老化度(分别增加了156.09%和93.24%),且槲皮素组的老化度小于芦丁组。
淀粉在加入芦丁或槲皮素前后,糊化温度变化不显著,表明糊化难度并未改变;老化度增加显著,表明芦丁和槲皮素加快了淀粉的老化速度。Guzar[4]和Wu Yue[12]等指出,茶多酚富含的羰基和羟基,可与淀粉分子的羟基通过范德华力和氢键诱导淀粉分子聚集,因此多酚能增加淀粉链与链之间的空间位阻,使分子的有序性重排降低,以此干扰了淀粉微晶束氢键的形成,进一步延缓淀粉的老化。因此上述变化可能是芦丁或槲皮素和小麦淀粉分子相互作用,对溶液酸碱度的改变和水分的重新分配[13-14]等共同影响的结果。

图2 芦丁或槲皮素对小麦淀粉微观结构的影响
Fig. 2 Effect of rutin or quercetin on the microstructure of wheat starch
有研究表明,槲皮素在络合物中呈现的状态为无定形晶体[15-17],如图2a、b所示,芦丁呈现大小不一的粉状,而槲皮素呈现针状结晶。如图2c~h所示,淀粉分子表面未发现明显的粉状物或针状结晶,说明芦丁或槲皮素在和小麦淀粉共同糊化过程中可能发生了相互作用。相比于图2c~e中小麦淀粉不再呈完整的片状,而呈松散的絮状,连接不再紧密,说明芦丁和槲皮素可抑制小麦淀粉糊化过程中的聚合,使糊化进程减慢;且相比于图2e,图2d的片状更加松散,说明芦丁更易抑制糊化进程。相比于图2f,图2g和图2h中小麦淀粉的基质宽松度变差,硬块程度增大,干燥过程中形成的网孔结构更加不明显,说明实验组的小麦淀粉持水性变差,芦丁或槲皮素促进了小麦淀粉老化进程;且相比于图2h,图2g的硬块状更密实,说明芦丁更易加速回生进程。据报道,在储存期间,具有持水能力的植物化学物质分散在淀粉凝胶中,可抑制水的蒸发,进而控制凝胶萎缩并帮助保持微观结构[18],而芦丁和槲皮素的非亲水基团,导致小麦淀粉糊化更加困难且老化速度加快。
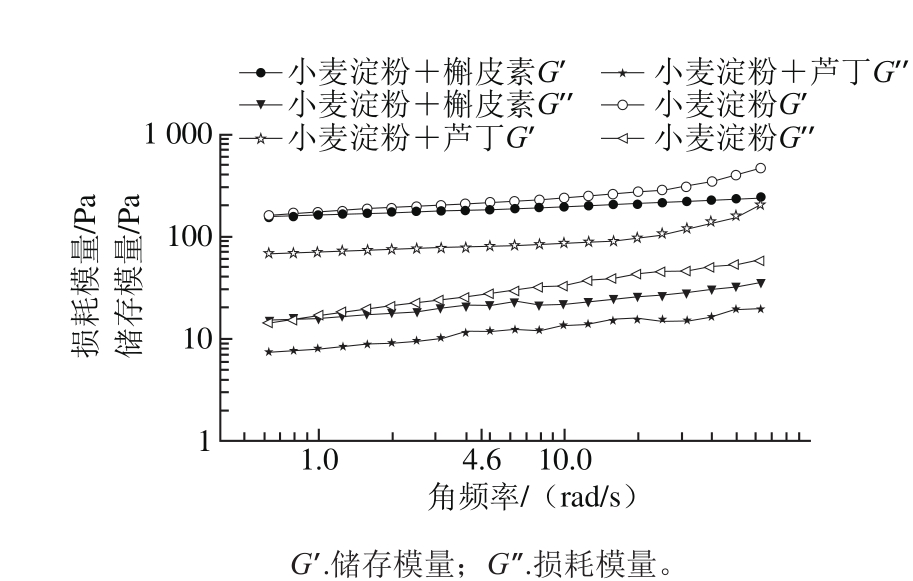
图3 添加0.50%芦丁或槲皮素的小麦淀粉混合物的动态流变扫描结果
Fig. 3 Dynamic rheological curves of wheat starch added with 0.50%rutin or quercetin
由图3可以看出,随着扫描频率的增加,添加芦丁或槲皮素使小麦淀粉的储存模量和损耗模量均降低,即弹性和黏性均降低,小麦凝胶体系变薄弱;且相比于芦丁添加组,槲皮素添加组的储存模量和损耗模量降低较少。储存模量表示材料中贮存的能量或者表示在一个形变周期内可恢复的能量,损耗模量指材料在发生形变时,由于不可逆的黏性形变而损耗的能量大小。由于黄酮的加入,小麦淀粉溶液电负性减弱,淀粉链之间的排斥作用减弱,进而使得淀粉凝胶的结构致密性、有序性降低[6,18];其次,槲皮素和芦丁由于其难溶于水的特性,可能与小麦淀粉中的直链淀粉或支链淀粉通过疏水作用结合到螺旋内腔中,导致淀粉链之间交联缠绕的机会减少,因此凝胶网络强度降低;最后,分散在水中的芦丁或槲皮素吸附在小麦淀粉表面进而抑制糊化过程中水分子进入淀粉螺旋分子内部[8]。
表2 添加不同质量分数芦丁或槲皮素的小麦淀粉的糊化特性
Table 2 Pasting properties of wheat starch added with different concentrations of rutin or quercetin
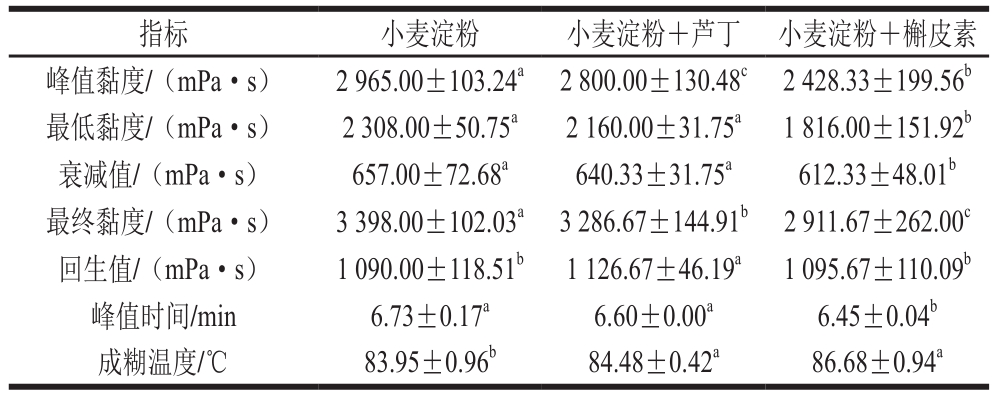
由表2可知,小麦淀粉和芦丁混合后,其峰值黏度、最低黏度、最终黏度和峰值时间分别降低5.56%、6.41%、3.28%和1.93%,回生值和成糊温度分别升高3.36%和0.63%;小麦淀粉与槲皮素混合后,其峰值黏度、最低黏度、最终黏度和峰值时间分别降低18.10%、21.32%、14.22%和4.16%,回生值和成糊温度分别升高0.52%和3.25%。这与文献[18]的结果一致:一些植物化学提取物能显著降低淀粉的最终黏度。峰值黏度反映小麦淀粉的分子间力,衰减值(即抗剪切和耐热性能)反映淀粉糊的稳定性,回生值则反映淀粉冷糊的稳定性和老化趋势[19],表明芦丁和槲皮素均减弱了小麦淀粉的分子间力,使淀粉糊稳定性降低。缪铭等[20]研究表明,禾谷类淀粉的衰减值和易消化淀粉呈正相关关系,因此槲皮素使得小麦易消化淀粉显著降低,对糖尿病人有利。由于植物多酚的浓度不同,化学组成不同,分子质量不同以及结构多样性等,对小麦淀粉的糊化特性的影响也不同。相比芦丁,槲皮素对小麦淀粉的峰值黏度、最低黏度、最终黏度、成糊温度和峰值时间影响更显著,芦丁和槲皮素对小麦淀粉特性的影响不同,可能原因:1)槲皮素和芦丁在淀粉链之间形成氢键的数量不同。与槲皮素相比,芦丁结构较大,平面性差,羟基较多,水溶性较强,因此芦丁或作为架桥基团,以氢键结合为主,在小麦淀粉链之间形成类似架桥的结构,使分子结构稳定性发生变化,进而影响小麦淀粉糊化老化等特性。而槲皮素分子更易进入直链淀粉的螺旋型结构中以疏水相互作用的方式存在。2)槲皮素和芦丁对小麦淀粉体系中水分的影响不同。黄酮的羟基基团与水分子作用形成少量氢键,阻碍了水分子运动,小麦淀粉链的活动也会受到挤压,芦丁分子上较槲皮素更多的羟基会对自由水影响更多。3)芦丁和槲皮素对小麦淀粉水溶液的酸碱度影响不同。芦丁和槲皮素分子结构中含有的酚羟基使溶液显弱酸性,使得小麦淀粉溶液的电负性降低[21-22],分子链之间排斥力降低,老化趋势增强。在某种程度上,淀粉的糊化特性呈现对pH值的依赖性[23],且Zhu Fan等[5,18]证明多酚类物质可以改变溶液的pH值和系统的离子强度。
淀粉凝胶是在温度升高时,淀粉颗粒逐渐溶胀、破裂,直链淀粉从颗粒中逸出,彼此相互交联而成。不同植物多酚通过与淀粉形成氢键、疏水键和范德华力,在不同程度上改变连续相的性质和直链淀粉间的交互作用,从而改变凝胶质构[18],其中凝胶质构可用凝胶强度和凝胶破裂距离表示。

图4 添加不同质量分数芦丁或槲皮素的小麦淀粉的凝胶强度和破裂距离
Fig. 4 Gel strength and rupture distance of wheat starch added with different concentrations of rutin or quercetin
由图4可知,芦丁使小麦淀粉凝胶强度增大(26.91%)显著,破裂距离减小(48.66%)显著;槲皮素使小麦淀粉凝胶强度增大(50.25%)显著,破裂距离减小(52.01%)显著。凝胶质构可以用淀粉凝胶受到压迫时会逐渐引起变形,随着压力渐增,凝胶会发生破裂,此时探头的下压距离被称为凝胶破裂距离,该指标反映凝胶的脆性和弹性,破裂距离越小,凝胶的弹性越差,脆性越好。小麦淀粉加入槲皮素和芦丁后,其凝胶破裂距离均显著减小,表示凝胶弹性变差。上述结果可归因于小麦淀粉分子内化学键、溶液酸碱性、自由水以及小麦淀粉分子粒径的变化[12-13,24]。
表3 添加不同质量分数芦丁的小麦淀粉凝胶质构分析
Table 3 Texture properties of wheat starch gels with different concentrations of rutin
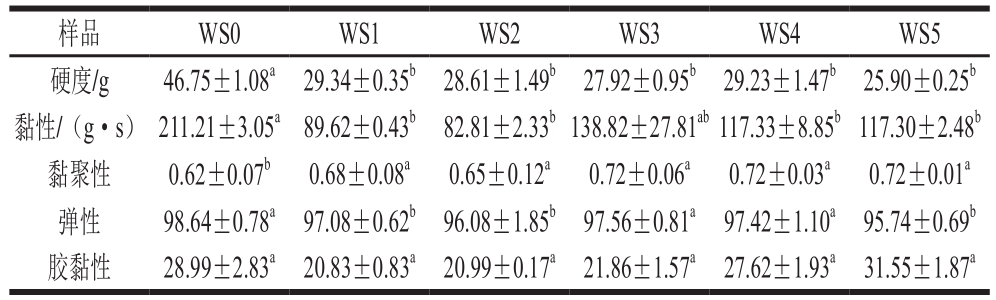
表4 添加不同质量分数槲皮素的小麦淀粉凝胶质构分析
Table 4 Texture properties of wheat starch gels with different concentrations of quercetin
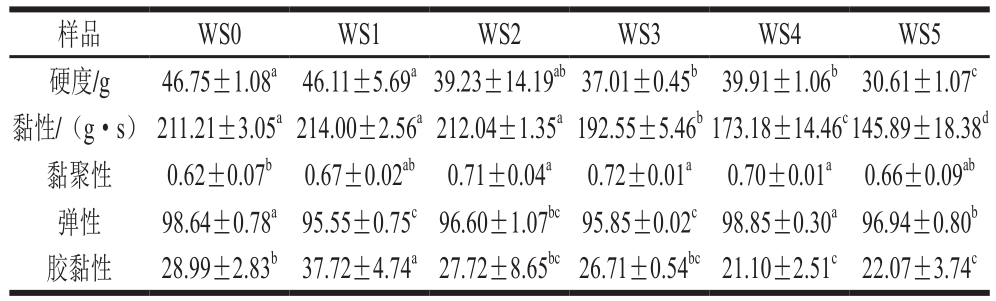
由表3可知,芦丁使小麦淀粉的硬度降低44.60%、黏性降低60.79%、弹性降低2.94%以及黏聚性增加16.13%;由表4可知,槲皮素使小麦淀粉的硬度降低34.52%、黏性降低30.95%、弹性降低3.13%以及黏聚性增加16.13%。小麦淀粉凝胶的硬度、黏性和弹性显著降低,黏聚性显著增大。表明芦丁或槲皮素的加入使得小麦淀粉凝胶口感更加柔软,咀嚼时“橡胶”感减弱,同时,淀粉凝胶之间相互作用更强。产生上述结果的原因可解释为:芦丁或槲皮素与淀粉的相互作用会促进淀粉分子聚集形成复合体,进而阻碍直链淀粉的重排以及缠绕成双螺旋结构的过程,使淀粉分子更易移动[25],而这种相互作用的主导因素之一可能与凝胶pH值的变化有关[26]。

图5 添加不同质量分数芦丁或槲皮素对小麦淀粉与碘形成复合物的影响
Fig. 5 Effects of different concentrations of rutin or quercetin on the formation of wheat starch-iodine complexes
如图5所示,芦丁对小麦淀粉-碘复合物的形成影响不显著,而槲皮素能显著抑制该复合物的形成,且抑制作用随质量分数增加而增加,当槲皮素质量分数为0.75%时,小麦淀粉、碘和槲皮素混合液在波长620 nm处的吸光度显著降低14.29%,说明槲皮素可能通过疏水相互作用,与小麦淀粉螺旋空腔结合,从而抑制淀粉-碘复合物的形成。
Wokadala等[27]指出:直链淀粉可与一系列小客体分子相互作用,可形成单一的、呈左手螺旋的V型直链淀粉包合物,且驱动力是螺旋空腔内的疏水性相互作用。据报道,芦丁无法与高直链淀粉玉米淀粉形成V型包合物[28],但Zhang Liming等[16]报道,槲皮素可与淀粉相互作用,形成新的晶体结构。多酚或黄酮与淀粉空腔形成包合物可能与其分子大小,疏水能力强弱或直链淀粉螺旋空腔的尺寸等有关,由于芦丁分子结构中羟基较槲皮素多,疏水性更弱,且分子体积较槲皮素大,因而无法与淀粉形成相应的包合物,抑制淀粉-碘复合物的形成的作用不显著。Cohen[29]和Yang Liqun[30]等研究表明,酚类化合物和直链淀粉螺旋的内部腔络合后具有耐洗涤特性,而那些未进入空腔的酚类则容易被洗掉,槲皮素进入小麦淀粉螺旋空腔后的耐洗涤性,对淀粉类食品品质可能会产生重要影响。
加入芦丁或槲皮素后,小麦淀粉的糊化初始温度、糊化峰值温度和糊化最终温度无显著变化,老化焓值分别增加85.71%和85.71%,老化度分别增加了156.09%和93.24%;芦丁或槲皮素加快了老化进程;添加芦丁或槲皮素使小麦淀粉的储存模量和损耗模量降低;芦丁和槲皮素分别使小麦淀粉的峰值黏度减小5.56%和18.10%、最低黏度减小6.41%和21.32%、最终黏度减小3.28%和14.22%以及峰值时间减小1.93%和4.16%,回生值升高3.36%和0.52%,成糊温度升高0.63%和3.25%;芦丁和槲皮素分别使小麦淀粉的硬度降低44.60%和34.52%、黏性降低60.79%和30.95%、弹性降低2.94%和3.13%,黏聚性增加16.13%和16.13%;槲皮素能与小麦淀粉发生较强的相互作用,且能形成V型包合物。因此,芦丁和槲皮素的加入能改善淀粉类产品的品质,也可作为一种提高抗性淀粉的物理改性方式。芦丁或槲皮素与淀粉相互作用方式还有待于深入研究。
参考文献:
[1] SHAHIDI F, HO C. Phenolic compounds in foods and natural health products[M]. Washington: American Chemical Society, 2005: 1-8.DOI:10.1021/bk-2005-0909.
[2] 吕霞, 叶发银, 刘嘉, 等. 膳食多酚对淀粉消化吸收的影响[J]. 中国粮油学报, 2015, 30(6): 134-137. DOI:10.3969/j.issn.1003-0174.2015.06.027.
[3] SHEN W, XU Y, LU Y H. Inhibitory effects of citrus flavonoids on starch digestion and anti hyperglycemic effects in HepG2 cells[J].Journal of Agricultural and Food Chemistry, 2012, 60(38): 9609-9619.DOI:10.1021/jf3032556.
[4] GUZAR I. Effect of starch-polyphenol interactions on starch hydrolysis[D]. Guelph: Guelph University, 2012: 11-13.
[5] ZHU F. Interactions between starch and phenolic compound[J]. Trends in Food Science and Technology, 2015, 43(2): 129-143. DOI:10.1016/j.tifs.2015.02.003.
[6] CHAI Y W, WANG M Z, ZHANG G Y. Interaction between amylase and tea polyphenols modulates the postprandial glycemicresponse to high-amylose maize starch[J]. Journal of Agricultural and Food Chemistry, 2013, 61(36): 8608-8615. DOI:10.1021/jf402821r.
[7] TAKAHAMA U, HIROTA S. Fatty acids, epicatechin-dimethylgallate,and rutin interact with buckwheat starch inhibiting its digestion by amylase: implications for the decrease in glycemic index by buckwheat flour[J]. Journal of Agricultural and Food Chemistry, 2010, 58(23):12431-12439. DOI:10.1021/jf102313b.
[8] ZHANG H H, SUN B H, ZHANG S K, et al. Inhibition of wheat starch retrogradation by tea derivatives[J]. Carbohydrate Polymers,2015, 134: 413-417. DOI:10.1016/j.carbpol.2015.08.018.
[9] ZHU F, SAKULNAK R, WANG S. Effect of black tea on antioxidant, textural, and sensory properties of Chinese steamed bread[J]. Food Chemistry, 2016, 194: 1217-1223. DOI:10.1016/j.foodchen.2015.08.110.
[10] ZHU F. Chemical composition and health effects of tartary buckwheat[J]. Food Chemistry, 2016, 203: 231-245. DOI:10.1016/j.foodchem.2016.02.050.
[11] JUAN A, GIMENEZ B, HENRYK Z. Buckwheat as a functional food and its effects on health[J]. Journal of Agricultural and Food Chemistry, 2015, 63(36): 7896-7913. DOI:10.1021/acs.jafc.5b02498.
[12] WU Y, LIN Q, CHEN Z, et al. The interaction between tea polyphenols and rice starch during gelatinization[J]. Food Science and Technology International, 2011, 17(6): 569-577. DOI:10.1177/1082013211399656.
[13] HAN H M, KOH B K. Effect of phenolic acids on the rheological properties and proteins of hard wheat flour dough and bread[J]. Journal of the Science of Food and Agriculture, 2011, 91(13): 2495-2499.DOI:10.1002/jsfa.4499.
[14] ZHU F, WANG Y J. Rheological and thermal properties of rice starch and rutin mixtures[J]. Food Research International, 2012, 49(2): 757-762. DOI:10.1016/j.foodres.2012.09.031.
[15] YANG Z G, AWUTI G, YI C, et al. Preparation and physicochemical characterization of quercetin-HP-β-CD inclusion complexes[J]. Journal of Chinese Pharmaceutical Sciences, 2006, 15(2): 69-75.
[16] ZHANG L M, YANG X, LI S, et al. Preparation, physicochemical characterization and in vitro digestibility on solid complex of maize starches with quercetin[J]. LWT-Food Science and Technology, 2011,44(3): 787-792. DOI:10.1016/j.lwt.2010.09.001.
[17] HUNG P V, PHAT N H, PHI N T L. Physicochemical properties and antioxidant capacity of debranched starch-ferulic acid complexes[J].Starch-Stärke, 2013, 65(5/6): 382-389. DOI:10.1002/star.201200168.
[18] ZHU F, CAI Y Z, SUN M, et al. Effect of phytochemical extracts on the pasting, thermal, and gelling properties of wheat starch[J]. Food Chemistry, 2009, 112(4): 919-923. DOI:10.1016/j.foodchem.2008.06.079.
[19] 李娜, 张英华. 用RVA仪分析玉米淀粉的糊化特性[J]. 中国粮油学报, 2011, 26(6): 20-24.
[20] 缪铭, 江波, 张涛. 淀粉的消化性能与RVA曲线特征值的相关性研究[J]. 食品科学, 2009, 30(5): 16-19. DOI:10.3321/j.issn:1002-6630.2009.05.002.
[21] GUNARATNE A, CORKE H. Influence of prior acid treatment on acetylation of wheat, potato and maize starches[J]. Food Chemistry,2007, 105(3): 917-925. DOI:10.1016/j.foodchem.2007.04.042.
[22] GUNARATNE A, RANAWEERA S, CORKE H. Thermal, pasting,and gelling properties of wheat and potato starches in the presence of sucrose, glucose, glycerol, and hydroxypropyl beta-cyclodextrin[J].Carbohydrate Polymers, 2007, 70(1): 112-122. DOI:10.1016/j.carbpol.2007.03.011.
[23] BAO J, CORKE H. Pasting properties of gamma-irradiated rice starches as affected by pH[J]. Journal of Agricultural and Food Chemistry, 2002, 50(2): 336-341. DOI:10.1021/jf010230c.
[24] 柴艳伟. 茶多酚对高直链淀玉米淀粉消化性的影响及机理[D].无锡: 江南大学, 2013.
[25] 何财安, 张珍, 刘航, 等. 苦荞多酚对苦荞淀粉和小麦淀粉理化特性的影响[J]. 食品科学, 2017, 38(9): 66-71. DOI:10.7506/spkx1002-6630-201709011.
[26] ZHU F, WANG Y. Rheological and thermal properties of rice starch and rutin mixtures[J]. Food Research International, 2012, 49(2): 757-762. DOI:10.1016/j.foodres.2012.09.031.
[27] WOKADALA C O, SUPRAKAS S R, MOHAMMAD N E. V-amylose Structural characteristics, methods of preparation, significance, and potential applications[J]. Food Reviews International, 2012, 28(4):412-438. DOI:10.1080/87559129.2012.660718.
[28] ZHU F, WANG Y J. Characterization of modified high-amylose maize starch-α-naphthol complexes and their influence on rheological properties of wheat starch[J]. Food Chemistry, 2013, 138(1): 256-262.DOI:10.1016/j.foodchem.2012.09.097.
[29] COHEN R, SCHWARTZ B, PERI I, et al. Improving bioavailability and stability of genistein by complexation with high-amylose corn starch[J]. Journal of Agricultural & Food Chemistry, 2011, 59(14):7932-7938. DOI:10.1021/jf2013277.
[30] YANG L Q, ZHANG B F, YI J Z, et al. Preparation, characterization,and properties of amylose-ibuprofen inclusion complexes[J]. Starch-Stärke, 2013, 65(7/8): 593-602. DOI:10.1002/star.201200161.
Effects of Rutin and Quercetin on the Physicochemical Properties of Wheat Starch
REN Shuncheng, SUN Xiaosha
(National Engineering Laboratory of Wheat & Corn Further Processing, School of Food Science and Technology,Henan University of Technology, Zhengzhou 450001, China)
Abstract:Changes in the thermal properties, microstructure, rheological properties, gelatinization properties and texture of wheat starch were examined in the presence of low-dose rutin or quercetin, as well as the effect of rutin and quercetin on wheat starch-iodine complex. It was found that the onset gelatinization temperature (T0), peak gelatinization temperature (TP)and gelatinization conclusion temperature (TC) of wheat starch did not change signif i cantly after adding rutin or quercetin.The retrogradation enthalpy (ΔH2) increased significantly by 85.71% and 85.71%, respectively, and the retrogradation degree (R) also increased signif i cantly by 156.09% and 93.24%, respectively. At the same time, electron microscopy showed that rutin and quercetin accelerated the retrogradation process, decreasing the storage modulus and loss modulus. Rapid visco analysis (RVA) results showed that rutin and quercetin decreased the peak viscosity of wheat starch by 5.56% and 18.10%, minimum viscosity by 6.41% and 21.32%, final viscosity by 3.28% and 14.22%, and peak time by 1.93% and 4.16%, and increased setback by 3.36% and 0.52%, and pasting temperature by 0.63% and 3.25%, respectively. Moreover,rutin and quercetin reduced the hardness of wheat starch by 44.60% and 34.52%, adhesiveness by 60.79% and 30.95%, and springiness by 2.94% and 3.13%, and increased cohesion by 16.13% and 16.13%, respectively. Quercetin could interact strongly with wheat starch, form V-type inclusion complex. In general, rutin and quercetin can signif i cantly inf l uence the physicochemical properties of wheat starch.
Keywords:rutin; quercetin; wheat starch; physicochemical properties
DOI:10.7506/spkx1002-6630-201802005
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2018)02-0025-06
引文格式:任顺成, 孙晓莎. 芦丁和槲皮素对小麦淀粉理化特性的影响[J]. 食品科学, 2018, 39(2): 25-30.
DOI:10.7506/spkx1002-6630-201802005. http://www.spkx.net.cn
REN Shuncheng, SUN Xiaosha. Effects of rutin and quercetin on the physicochemical properties of wheat starch[J]. Food Science,2018, 39(2): 25-30. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802005. http://www.spkx.net.cn
收稿日期:2016-11-23
基金项目:小麦和玉米深加工国家工程实验室开放课题(NL2016005)
第一作者简介:任顺成(1963—),男,教授,博士,研究方向为食品营养与功能食品。E-mail:scren@163.com