王 远,郑 雯,蔡珺珺,袁田青,宫兴文*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
摘 要:对辣木叶中黄酮类化合物的结构进行分析,并测定其对胰脂肪酶的抑制作用及抑制作用类型。以70%乙醇溶液为提取溶剂,用微波辅助提取法提取辣木叶黄酮,提取率达到(5.53±0.11)%;用聚酰胺层析柱对获得的粗提物进行纯化,冷冻干燥得到样品粉末,测定其总黄酮含量为(661.10±9.20)mg/g。借助超高效液相色谱-四极杆/静电场轨道阱质谱联用技术对纯化后的辣木叶黄酮结构进行分析,共鉴定出11 个黄酮类化合物。以对硝基苯丁酸酯为底物,测定了辣木叶黄酮对胰脂肪酶的抑制活性,结果表明纯化后的辣木叶黄酮对胰脂肪酶有较好的抑制作用,半数抑制浓度(IC50)为0.94 mg/mL,通过Lineweaver-Burk法测定出其抑制作用类型为非竞争性抑制。
关键词:辣木叶黄酮;超高效液相色谱-四极杆/静电场轨道阱质谱;胰脂肪酶;抑制作用
辣木(Moringa oleifera Lam.)又叫鼓槌树,为辣木科辣木属热带植物,起源于印度西北部的喜马拉雅山南麓,全世界共有14 个种[1]。辣木于20世纪60年代开始引入我国,目前已经在广东、广西、云南等西南省份成功种植并逐步实现产业化[2]。辣木作为一种功能性植物,不仅可以食用,而且具有巨大的药用价值。在印度和越南等东南亚国家,辣木的种子、叶、皮、根都是传统的民间药物,被用来治疗多种疾病,故被称作“神奇之树”[3]。辣木叶于2012年被我国卫生部门公布为新资源食品,其营养价值丰富,含有多种矿质元素、维生素以及蛋白质,而且含有黄酮类、多酚类、有机酸类等多种功能性成分[4]。黄酮类化合物是一类重要的植物次生代谢产物,普遍存在于植物各个部位,如根、心材、树皮、叶、果实、花等,种类繁多,具有抗氧化、抑菌、降血糖、抗肿瘤、降血脂等多种生理活性[5]。
随着人们生活水平的提高和饮食结构的变化,由能量过高摄入而引发的慢性疾病逐渐增多,比如肥胖、Ⅱ型糖尿病、高血脂、心血管疾病等,严重危害到人类的健康[6]。人体的胰脂肪酶是由胰脏分泌的降解体内甘油三酯的关键酶,利用胰脂肪酶抑制剂可以降低其活性,从而减少甘油三酯进入新陈代谢,是治疗肥胖症的有效策略[7-8]。奥利司他是目前市场上治疗肥胖最为畅销的药物之一,但是有较多的副作用,如油性斑点、便秘、腹泻等[9]。因此,从种类多样、低毒的天然产物中筛选胰脂肪酶抑制剂,成为目前人们研究的热点。
四极杆/静电场轨道阱高分辨质谱仪将四极杆离子选择和静电场轨道阱高分辨质谱离子扫描结合,可以对复杂物质中多种痕量组分进行分析鉴定、定性确认,全扫描模式下采集的数据可以反复调用,是分析复杂成分的有力工具之一[10]。本实验采用微波辅助提取、聚酰胺层析柱纯化辣木叶黄酮,借助超高效液相色谱-四极杆/静电场轨道阱质谱(ultra performance liquid chromatography-quadrupole/electrostatic field orbital trap mass spectrometry,UPLC-Q-Orbitrap MS)联用技术对纯化后的辣木叶黄酮的结构进行定性分析和鉴定,并且研究了其对胰脂肪酶的抑制作用,为开发预防和治疗肥胖的药物提供理论基础,也为相关保健食品的研究与开发提供了新的依据。
辣木叶采摘于云南省昆明市东川区,采摘时间为10月份。芦丁标准品 中国食品药品检定研究院;聚酰胺树脂(60~100 目) 浙江省台州市路桥四甲生化塑料厂;甲醇、乙腈、甲酸(色谱级) 阿拉丁生化科技股份有限公司;脂肪酶(猪胰腺) 美国Sigma-Aldrich公司;奥利司他 重庆华森制药制药有限公司;无水乙醇、石油醚、硝酸铝、亚硝酸钠、氢氧化钠、对硝基苯丁酸酯(p-nitrophenyl butyrate,PNPP)、对硝基苯酚(p-nitrophenol,PNP)、二甲基亚砜、N,N-二甲基甲酰胺等均为分析纯。
FW80万能粉碎机 天津泰斯特仪器有限公司;XH-300UL-2双频超声波微波紫外光组合催化合成仪北京祥鹄科技发展有限公司;UV-2550紫外-可见分光光度计 日本岛津公司;N-I 100旋转蒸发仪 上海爱朗仪器有限公司;FD-1C-50冷冻干燥机 博医康实验仪器有限公司;Dionex Ultimate 3000 UPLC仪、Q-Orbitrap MS仪 美国Thermo Fisher Scientific公司。
1.3.1 辣木叶黄酮的提取
预处理:称取干燥辣木叶粗粉末50 g于圆底烧瓶中,加入石油醚400 mL,磁力搅拌,70 ℃水浴回流8 h,以除去脂肪、色素等杂质。最后抽滤烘干,粉碎过筛,得到粒径为100~200 目的辣木叶粉末,备用。
微波辅助提取:称取5 g预处理过的辣木叶粉末置于三口烧瓶中,加入250 mL 70%乙醇溶液,于提取仪中进行微波提取,微波功率300 W、提取时间300 s、提取温度50 ℃,最后抽滤得到辣木叶黄酮提取液。
1.3.2 总黄酮含量的测定
芦丁标准曲线的绘制:采用显色法测定提取液中总黄酮含量[11]。称取芦丁标准品0.020 g,用70%乙醇溶液溶解,定容至100 mL,配成0.20 mg/mL的母液。分别取母液1.0、2.0、4.0、6.0、8.0 mL于25 mL具塞比色管中,加入1 mL 5%亚硝酸钠溶液,混匀放置6 min,加入1 mL 10%硝酸铝溶液,混匀放置6 min,再加入10 mL 1 mol/L的氢氧化钠溶液,最后加入70%乙醇溶液定容至25 mL,摇匀放置10 min。以70%乙醇溶液作空白参比,于506 nm波长处测定吸光度。以芦丁含量为横坐标,吸光度为纵坐标绘制标准曲线。得到回归方程为Y=0.012 04X-0.016 75,R2=0.999 4。
总黄酮提取率的测定:取适量辣木叶黄酮提取液于比色管中,按照上述显色法测定吸光度,对照芦丁标准曲线,计算总黄酮提取率如公式(1)所示:
式中:C为标准曲线计算出的提取液总黄酮质量浓度/(mg/mL);V为提取液的体积/mL;m为辣木叶的质量/g。
1.3.3 辣木叶黄酮的提取纯化
样品溶液的制备:用微波辅助提取辣木叶黄酮,重复3 次,取平均值。提取液经旋转蒸发去除乙醇,得到浓缩液,加蒸馏水稀释至所需的浓度,即为样品溶液。
聚酰胺层析柱纯化辣木叶黄酮:称取预处理过的聚酰胺树脂30 g(体积约为60 mL),以湿法装柱装入层析柱(20 mm×400 mm)。根据前期实验的结果,聚酰胺层析柱纯化辣木叶黄酮的最优条件为上样质量浓度为4 mg/mL,上样流速为1.5 BV/h(BV为床体积,下同),上样体积为1 BV,洗脱液为70%乙醇溶液,洗脱液流速为1.5 BV/h,洗脱液体积为3 BV。将纯化得到的洗脱液旋转蒸发去除乙醇,冷冻干燥得到辣木叶黄酮样品粉末。称取20 mg样品粉末用70%乙醇溶液溶解并定容至10 mL,然后测定其中黄酮浓度,并计算辣木叶黄酮的纯度。
1.3.4 辣木叶黄酮结构分析
样品溶液的制备:准确称取纯化后的辣木叶黄酮粉末0.100 g,用70%甲醇溶液溶解并定容于10 mL容量瓶,再过0.22 μm有机滤膜,备用。
色谱条件:色谱柱为Hypersil Gold C18(150 mm×2.1 mm,1.9 μm),样品盘温度设为5 ℃,色谱柱温度设为30 ℃,自动进样器在进样前后均用200 μL 70%甲醇溶液洗涤2 次。流动相:A相为乙腈,B相为0.1%甲酸溶液,进样体积为5 μL,流速为0.3 mL/min。洗脱程序为0~5 min,A:15%~50%;5~25 min,A:50%~95%;25~30 min,A:95%~5%。
质谱条件:离子源为电喷雾电离源,采用负离子扫描模式,电压为-3 kV;一级质谱分辨率设置为70 000,m/z 200;二级质谱分辨率设置为35 000,m/z 200;电探头蒸发器温度设定为250 ℃;扫描质量范围均为m/z 100~1 000;一级质谱阱填充时间设定为250 ms,自动增益控制设定为1×106;二级质谱阱填充时间设定为120 ms,自动增益控制设定为2×105。标准化碰撞能设定为25 eV;阶梯能量设定为40%;根据物质一级质谱的离子强度来进行一级质谱到二级质谱之间的切换。
1.3.5 对胰脂肪酶的抑制作用1.3.5.1 PNP标准曲线的绘制
精密称取0.070 g PNP用磷酸盐缓冲液(0.067 mol/L,pH 7.38,下同)溶解并定容至100 mL,得到5 mmol/L PNP母液,再稀释得到浓度分别为0.200、0.150、0.100、0.075、0.050 mmol/L的PNP溶液。取各个浓度的PNP溶液200 μL于96 孔板中,用酶标仪在405 nm波长下测定吸光度。以PNP浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到方程为Y=3.344 21X+0.018 77,R2=0.999 8。
1.3.5.2 胰脂肪酶抑制活性的测定
溶液的配制:称取辣木叶黄酮粉末,用缓冲液配成质量浓度为0.10、0.25、0.50、1.00、1.50 mg/mL的样品溶液;称取奥利司他用少量二甲基亚砜溶解,再加适量缓冲液超声,取上清液,制得质量浓度分别为0.03、0.06、0.12、0.18、0.24 mg/mL的奥利司他溶液,二甲基亚砜质量分数控制在1%以内;称取0.05 g胰脂肪酶用缓冲液溶解定容至50 mL,8 000 r/min离心10 min,取上清液稀释得0.25 mg/mL胰脂肪酶溶液;称取0.156 g PNPP溶解于0.25 mL N,N-二甲基甲酰胺,用缓冲液定容至100 mL,得到11.2 mmol/mL的底物溶液。
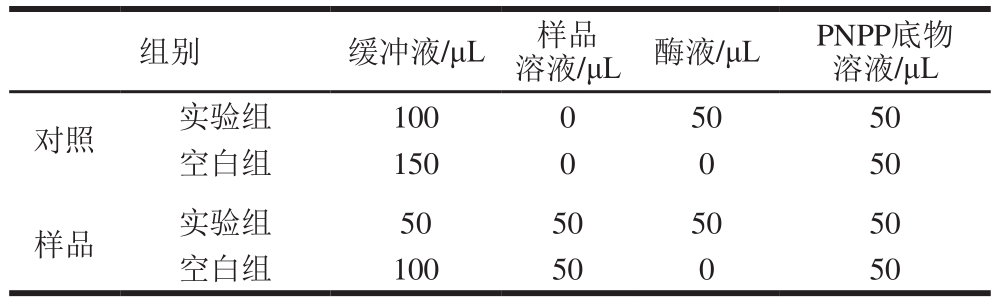
测定方法:参考Liang Linfu等[12]的方法,并加以修改。反应体系如表1所示,先将缓冲液、样品溶液和胰脂肪酶溶液加入96 孔板,37 ℃温育10 min,再加入PNPP底物溶液启动反应,37 ℃温育20 min后,用酶标仪在405 nm波长下测定吸光度。与抑制剂反应的胰脂肪酶活力降低,PNP的产生量减少,吸光度降低,再对照PNP标准曲线可求出样品对胰脂肪酶的抑制率,计算公式见式(2):
式中:A为对照实验组的吸光度;a为对照空白组的吸光度;B为样品实验组的吸光度;b为样品空白组的吸光度。
表1 胰脂肪酶反应体系
Table 1 Reaction systems for measuring the inhibition of pancreatic lipase activity
1.3.5.3 抑制作用类型的测定
用Lineweaver-Burk法来判断辣木叶黄酮对胰脂肪酶抑制作用的类型[13]。固定酶液质量浓度为0.25 mg/mL,纯化后的辣木叶黄酮溶液质量浓度为0、0.5、1.0 mg/mL,分别测定PNPP底物浓度为11.2、5.6、2.8、1.4 mmol/mL时的酶反应速率。反应条件和体系与1.3.5.2节相同。以底物浓度的倒数(1/[S])为X轴、以反应速率的倒数(1/v)为Y轴作图,拟合得到的直线在X、Y轴上的截距分别代表米氏常数Km和最大反应速率vm的倒数。Km值增大,vm值不变为竞争性抑制;Km值不变,vm值变小为非竞争性抑制;Km值变小,vm值变小,但Km/vm值不变为反竞争性抑制。
采用Xcalibur 2.2软件对质谱数据进行处理,通过高分辨质谱信息,推导化合物可能的结构式,结构式用ChemDraw Ultra 8.0绘制。用OriginPro 9.0对数据进行拟合,并绘图,用SPSS 19.0对数据的显著性进行分析。
用微波辅助提取辣木叶黄酮,提取液经旋转蒸发、冷冻干燥得到纯化前的辣木叶黄酮样品粉末,经计算辣木叶总黄酮提取率为(5.53±0.11)%,其纯度为(133.78±7.87)mg/g;聚酰胺层析柱纯化后,收集洗脱液旋转蒸发、冷冻干燥,得到纯化后的辣木叶黄酮样品粉末,其纯度为(661.10±9.20)mg/g,实验结果如表2所示,纯化后纯度提高了5 倍,说明纯化后除去了大部分杂质,样品主要成分为黄酮类化合物,为其结构分析及活性研究提供物质基础。
表2 辣木叶黄酮纯度
Table 2 Purity of crude and purified flavonoids from Moringa oleifera Lam. leaves

在设置的色谱和质谱条件下,将样品溶液注入液相色谱-质谱联用体系,得到实验数据,用Xcalibur 2.2软件进行分析处理,从中提取出总离子流图及各峰对应的一、二级质谱图。总离子流图如图1所示,结合高分辨质谱信息并参考相关文献进行分析,共鉴定出11 个黄酮类化合物。
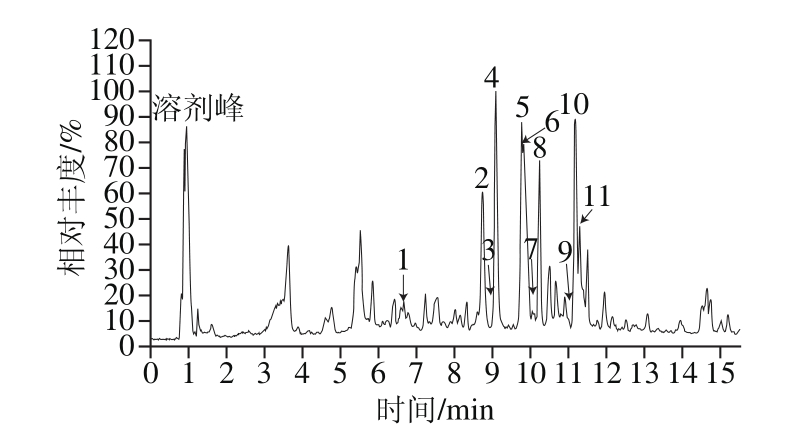
图1 辣木叶黄酮的总离子流图(负离子模式)
Fig. 1 Total ion chromatogram of flavonoids from Moringa oleifera Lam. leaves in the negative ion mode
由图1可知,负离子模式下,1号峰的一级质谱得到准分子离子峰m/z 593.168 6,二级质谱得到的碎片离子峰m/z 503、473、383、353与文献[14-15]报道一致,m/z 353离子峰由母离子峰m/z 593中异鼠李糖环破裂产生,推断该化合物为蔷薇苷B,其质谱信息如图2所示。2号峰的一级质谱得到准分子离子峰m/z 609.1636,二级质谱得到碎片离子峰m/z 301、271、255、179、151与参考文献[16-17]报道一致,推断该化合物为芦丁,母离子峰m/z 609失去质量数为308的葡萄糖基中性碎片生成槲皮素离子峰m/z 301;m/z 301离子峰丢失一分子H2O和一分子CO,生成离子峰m/z 255;m/z 301发生断裂转移2 个H,失去质量数为122的中性碎片,生成m/z 179离子峰;m/z 301发生逆狄尔斯-阿德尔反应生成m/z 151碎片离子峰,芦丁的质谱信息如图3所示。3号峰的一级质谱得到准分子离子峰m/z 431.110 8,二级质谱图得到碎片离子峰m/z 413、341、311与参考文献[14]报道一致,推断该化合物为牡荆素(芹黄素-8-C-葡萄糖苷),m/z 413离子峰由母离子峰m/z 431丢失一分子H2O产生,m/z 311离子峰由m/z 431葡萄糖基环破裂,失去C4H8O4中性基团并转移2 个H产生。4号峰的一级质谱图得到准分子离子峰m/z 463.1017,二级质谱得到碎片离子峰m/z 343、301、271、255、179、151与文献[18-19]报道一致,推断该化合物为槲皮素-3-O-葡萄糖苷,母离子峰m/z 463丢失质量数为162的葡萄糖基得到槲皮素苷元离子峰m/z 301,离子峰m/z 271、255、179、151由槲皮素苷元离子峰m/z 301生成,裂解规律和3号峰一致。5号峰的一级质谱图得到准分子离子峰m/z 549.104 6,二级质谱得到碎片离子峰m/z 505、463、301、300、271、255、179、151与文献[20]报道一致,推断该化合物为槲皮素-3-O-(6-丙二酰基葡萄糖苷),离子峰m/z 505由m/z 549母离子中的丙二酰基丢失一分子CO2产生的,m/z 549离子峰失去一个质量数为86的中性碎片丙二酰基,生成m/z 463离子峰,m/z 549母离子同时丢失质量数为248的丙二酰基葡萄糖中性碎片,生成槲皮素离子碎片m/z 301,离子峰m/z 271、255、179、151由槲皮素离子峰m/z 301产生,裂解规律和3号峰一致。6号峰的一级质谱图得到准分子离子峰m/z 607.148 4,二级质谱得到碎片离子峰m/z 545、505、463、301、179、151与文献[21]报道一致,推测该化合物为槲皮素-3-O-羟甲基戊二酰基半乳糖苷,母离子峰m/z 607丢失一个乙酰基生成m/z 545离子峰;母离子峰m/z 607同时失去中性碎片羟甲基戊二酰基产生m/z 463离子峰,再失去葡萄糖基生成槲皮素离子峰m/z 301。8号峰的一级质谱图得到准分子离子峰m/z 505.113 4,二级质谱得到碎片离子峰m/z 463、445、301、271、179、151与文献[21-22]报道一致,推断该化合物为槲皮素-3-O-乙酰基葡萄糖苷,母离子峰m/z 505失去中性分子乙酰基得到碎片离子峰m/z 463,m/z 463丢失葡萄糖基产生槲皮素苷元分子离子碎片m/z 301。7号峰的一级质谱图得到准分子离子峰m/z 623.180 2,二级质谱得到碎片离子峰m/z 357、315、300、151与文献[23-24]报道一致,推断为异鼠李素-3-O-芸香糖苷,母离子峰m/z 623中芸香糖基环破裂产生的碎片离子m/z 357,m/z 623母离子峰丢失芸香糖基生成离子峰m/z 315,接着失去一个CH3产生离子峰m/z 300,m/z 300碎片离子发生逆狄尔斯-阿德尔裂解生成m/z 151。9、10、11号峰均为山柰酚苷,由一级质谱图得到准分子离子峰分别为m/z 591.152 8、m/z 533.109 0、m/z 447.106 8;二级质谱得到碎片离子峰与文献[21]和[25-26]报道一致,推断为山柰酚-3-O-羟甲基戊二酰基己糖苷、山柰酚-3-O-丙二酰基己糖苷、山柰酚-3-O-葡萄糖苷;m/z 285离子峰为山柰酚苷元离子峰,9号峰中由m/z 591离子峰丢失羟甲基戊二酰基己糖分子产生的,10号峰中由m/z 489母离子丢失丙二酰基己糖产生,11号峰中由母离子峰m/z 447丢失葡萄糖基产生的。山柰酚-3-O-葡萄糖苷的质谱信息如图5所示。鉴定结果如表3所示,11 个黄酮类化合物均为黄酮苷,其中5 个为槲皮素苷,4 个为山柰酚苷,1 个为芹黄素苷,1 个为异鼠李素苷。这是因为天然黄酮类化合物多以苷类存在,黄酮苷元与单糖或者多糖结合,易容于水、甲醇、乙醇等极性较大的溶剂,糖链越长越易溶于水。
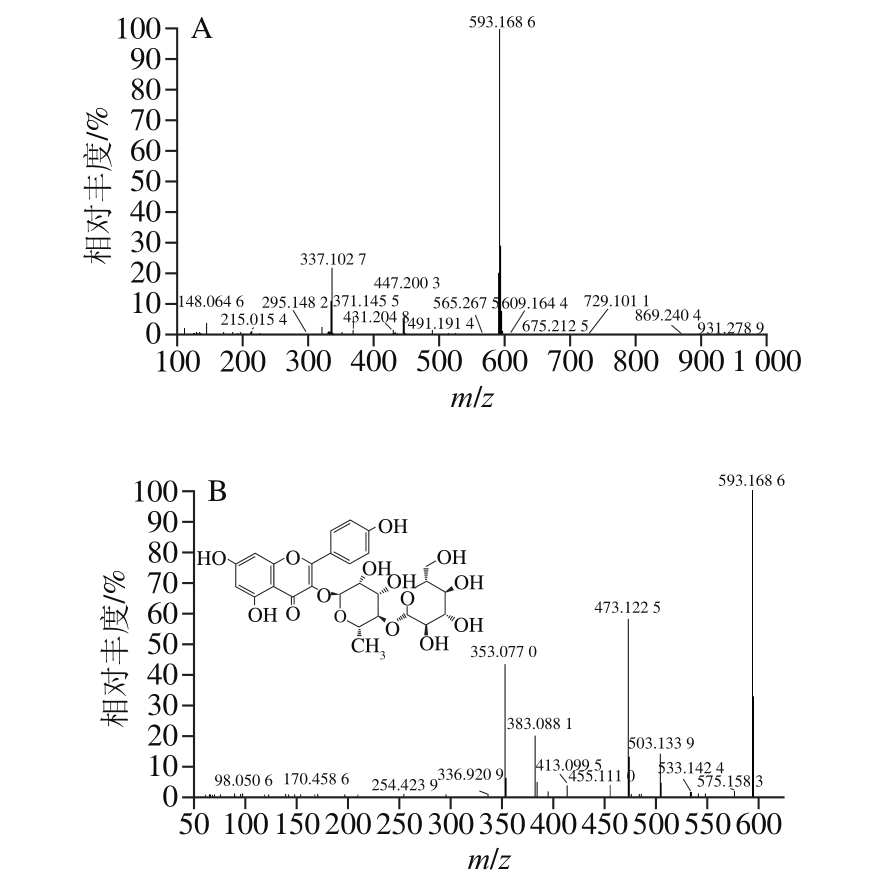
图2 蔷薇苷B一级质谱(A)与二级质谱(B)图
Fig. 2 Mass spectrum (A) and tandem mass spectrum (B) of multiflorin B
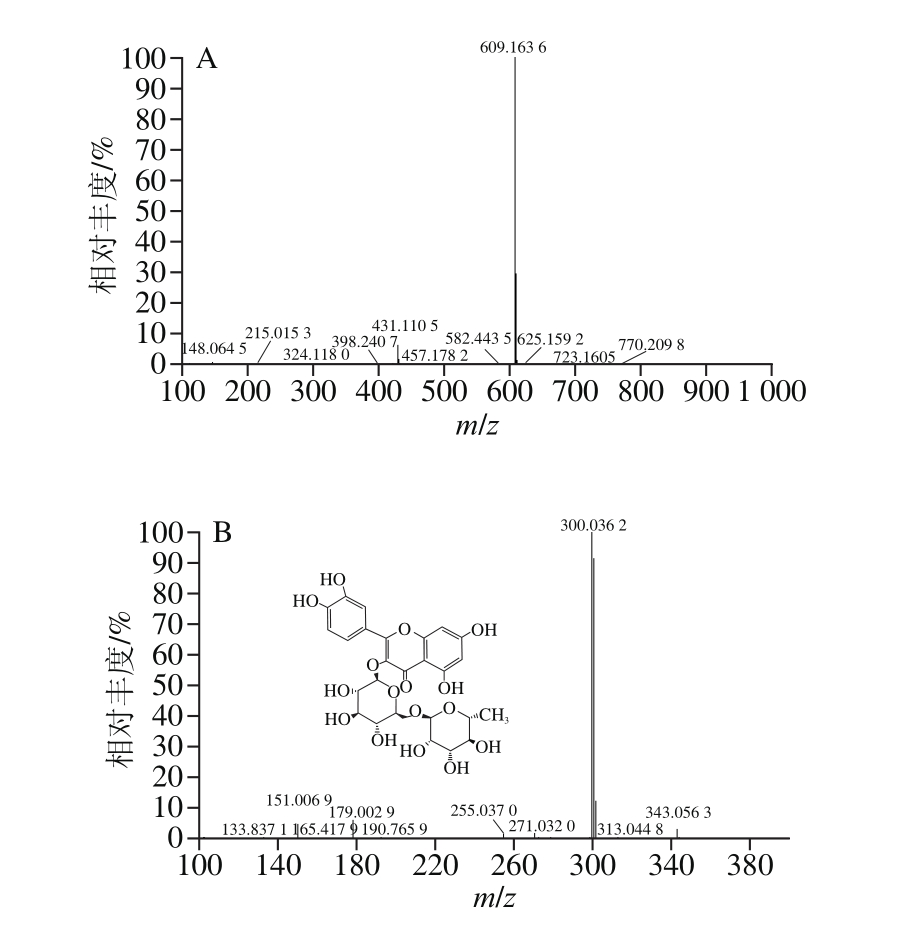
图3 芦丁一级质谱(A)与二级质谱(B)图
Fig. 3 Mass spectrum (A) and tandem mass spectrum (B) of rutin

图4 山柰酚-3-O-葡萄糖苷一级质谱(A)与二级质谱(B)图Fig. 4 Mass spectrum (A) and tandem mass spectrum (B) of kaempferol-3-O-glucoside
表3 辣木叶黄酮结构分析鉴定结果
Table 3 Identification and analysis of flavonoids from Moringa oleifera Lam. leaves



图5 辣木叶黄酮(A)和奥利司他(B)对胰脂肪酶的抑制率曲线图
Fig. 5 Concentration dependent inhibition of pancreatic lipase activity by flavonoids purified from Moringa oleifera Lam. leaves (A) and orlistat (B)
由图5可知,对实验数据进行拟合得到纯化的辣木叶黄酮对胰脂肪酶的半数抑制浓度(IC50)为0.94 mg/mL,对照组奥利司他的IC50为0.17 mg/mL。质量浓度为0.10~1.5 mg/mL时,纯化的辣木叶黄酮对胰脂肪酶的抑制率从20.12%增加到58.77%,未纯化的样品抑制率为0.78%~27.62%,且在各个质量浓度下,纯化样品的抑制率均高于未纯化的样品,差异显著(P<0.05),表明辣木叶黄酮对胰脂肪酶具有较好的抑制作用,且纯化富集之后抑制效果提高。
黄酮类化合物通过疏水作用、氢键等作用力与酶蛋白结合而对酶活性产生抑制,当其结合到酶的活性中心部位时,对酶的抑制表现为竞争性抑制;结合到酶蛋白的非活性部位时,对酶的抑制表现为非竞争性抑制[27-28]。酶抑制剂的分子结构和浓度、酶蛋白的氨基酸组成及其空间构型等,均会影响抑制剂对酶蛋白生理活性的抑制作用[29-30]。研究表明黄酮类化合物能够和酶蛋白结合,从而影响酶蛋白的理化特性及酶学性质。纯化的辣木叶黄酮对胰脂肪酶作用的Lineweaver-Burk结果如图6所示,当样品质量浓度为0~1 mg/L时,直线在X轴的截距不变,斜率变大,米氏常数Km不变,vm值变小,表明纯化的辣木叶黄酮对胰脂肪酶的抑制作用为典型的非竞争性抑制。非竞争性抑制的抑制程度仅仅取决于抑制剂的浓度,而底物浓度的增加并不影响抑制剂的抑制效果,这为有效地将辣木叶黄酮开发为胰脂肪酶抑制剂提供了理论基础。

图6 纯化的辣木叶黄酮对胰脂肪酶作用的Lineweaver-Burk双倒数曲线图
Fig. 6 Lineweaver-Burk plots of flavonoids purified from Moringa oleifera Lam. leaves against pancreatic lipase
用微波辅助提取法提取辣木叶黄酮,提取液经聚酰胺层析柱纯化后,辣木叶黄酮的纯度由纯化前的(133.78±7.87)mg/g提高到(661.10±9.20)mg/g,有较好的纯化效果。用UPLC-Q-Orbitrap MS技术对纯化后的辣木叶黄酮的结构进行分析,鉴定出11 个黄酮类化合物,分别为蔷薇苷、芦丁、牡荆素、槲皮素-3-O-葡萄糖苷、槲皮素-3-O-(6-丙二酰基葡萄糖苷)、槲皮素-3-O-羟甲基戊二酰基半乳糖苷、异鼠李素-3-O-芸香糖苷、槲皮素-3-O-乙酰基葡萄糖苷、山柰酚-3-O-羟甲基戊二酰基己糖苷、山柰酚-3-O-丙二酰基己糖苷、山柰酚-3-O-葡萄糖苷。辣木叶黄酮对胰脂肪酶具有较好的抑制作用,且纯化后的辣木叶黄酮抑制效果明显提高,IC50为0.94 mg/mL,用Lineweaver-Burk法判断出其抑制作用类型为非竞争性抑制。
参考文献:
[1] ZHENG Y, ZHANG Y, WU J. Yield and quality of Moringa oleifera under different planting densities and cutting heights in southwest China[J]. Industrial Crops & Products, 2016, 91(6): 88-96.DOI:10.1016/j.indcrop.2016.06.032.
[2] 盘李军, 刘小金. 辣木的栽培及开发利用研究进展[J]. 广东林业科技, 2010, 26(3): 71-77. DOI:10.3969/j.issn.1006-4427.2010.03.015.
[3] TEIXEIRA E M B, CARVALHO M R B, NEVES V A, et al.Chemical characteristics and fractionation of proteins from Moringa oleifera Lam. leaves[J]. Food Chemistry, 2014, 147(4): 51-54.DOI:10.1016/j.foodchem.2013.09.135.
[4] GOPALAKRISHNAN L, DORIYA K, KUMAR D S. Moringa oleifera: a review on nutritive importance and its medicinal application[J]. Food Science & Human Wellness, 2016, 5(2): 49-56.DOI:10.1016/j.fshw.2016.04.001.
[5] MORIMOTO M, TANIMOTO K, NAKANO S, et al. Insect antifeedant activity of flavones and chromones against Spodoptera litura[J]. Journal of Agricultural & Food Chemistry, 2003, 51(2): 389-393. DOI:10.1021/jf025627a.
[6] LIU S, LI D, HUANG B. Inhibition of pancreatic lipase, α-glucosidase,α-amylase, and hypolipidemic effects of the total flavonoids from Nelumbo nucifera leaves[J]. Journal of Ethnopharmacology, 2013,149(1): 263-269. DOI:10.1016/j.jep.2013.06.034.
[7] 杨鹏, 李艳琴. 荞麦黄酮和荞麦糖醇对胰脂肪酶的抑制作用[J]. 食品科学, 2015, 36(11): 60-63. DOI:10.7506/spkx1002-6630-201511012.
[8] AHN J H, LIU Q, LEE C, et al. A new pancreatic lipase inhibitor from Broussonetia kanzinoki[J]. Bioorganic & Medicinal Chemistry Letters,2012, 22(8): 2760-2763. DOI:10.1016/j.bmcl.2012.02.088.
[9] GUPTA M, SAXENA S, GOYAL D. Potential pancreatic lipase inhibitory activity of an endophytic Penicillium species[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2015, 30(1): 15-21.DOI:10.3109/14756366.2013.871007.
[10] 董红娇, 陈晓虎, 曾锐. UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱联用快速分析民族药小大黄的化学成分[J]. 中草药, 2016,47(14): 2428-2435.
[11] 马陶陶, 张群林, 李俊, 等. 三氯化铝比色法测定中药总黄酮方法的探讨[J]. 时珍国医国药, 2008, 19(1): 54-56.
[12] LIANG L F, WANG T, CAI Y S, et al. Brominated polyunsaturated lipids from the Chinese sponge Xestospongia testudinaria as a new class of pancreatic lipase inhibitors[J]. European Journal of Medicinal Chemistry, 2014, 79(8): 290-297. DOI:10.1016/j.ejmech.2014.04.003.
[13] EMADUDDIN M, TAKEUCHI H. Lineweaver-Burk analysis for the blocking effects of mammalian dopamine receptor antagonists on dopamine-induced currents in Achatina giant neurones[J]. General Pharmacology, 1996, 27(7): 1209-1213. DOI:10.1016/S0306-3623(96)00045-6.
[14] KARTHIVASHAN G, TANGESTANI F M, ARULSELVAN P,et al. Identification of bioactive candidate compounds responsible for oxidative challenge from hydro-ethanolic extract of Moringa oleifera leaves[J]. Journal of Food Science, 2013, 78(9): 1368-1375.DOI:10.1111/1750-3841.12233.
[15] KITE G C, PORTER E A, DENISON F C, et al. Data-directed scan sequence for the general assignment of C-glycosylflavone O-glycosides in plant extracts by liquid chromatography-ion trap mass spectrometry[J]. Journal of Chromatography A, 2006, 1104(1/2): 123-131. DOI:10.1016/j.chroma.2005.11.070.
[16] HVATTUM E. Determination of phenolic compounds in rose hip(Rosa canina) using liquid chromatography coupled to electrospray ionisation tandem mass spectrometry and diode-array detection[J].Rapid Communications in Mass Spectrometry, 2002, 16(7): 655-662.DOI:10.1002/rcm.622.
[17] 李自红, 魏悦, 范毅, 等. 芦丁的电喷雾离子阱质谱分析[J]. 分析试验室, 2015, 34(2): 186-189.
[18] SRISEADKA T, WONGPORNCHAI S, RAYANAKORN M.Quantification of flavonoids in black rice by liquid chromatographynegative electrospray ionization tandem mass spectrometry[J]. Journal of Agricultural & Food Chemistry, 2012, 60(47): 11723-11732.DOI:10.1021/jf303204s.
[19] ABLAJAN K, ABLIZ Z, SHANG X Y, et al. Structural characterization of flavonol 3,7-di-O-glycosides and determination of the glycosylation position by using negative ion electrospray ionization tandem mass spectrometry[J]. Journal of Mass Spectrometry, 2006, 41(3): 352-360.
[20] MAKITA C, CHIMUKA L, STEENKAMP P, et al. Comparative analyses of flavonoid content in Moringa oleifera and Moringa ovalifolia with the aid of UHPLC-qTOF-MS fingerprinting[J].South African Journal of Botany, 2016, 105: 116-122. DOI:10.1016/j.sajb.2015.12.007.
[21] RODRÍGUEZ-PÉREZ C, QUIRANTES-PINÉ R, FERNÁNDEZGUTIÉRREZ A, et al. Optimization of extraction method to obtain a phenolic compounds-rich extract from Moringa oleifera Lam. leaves[J]. Industrial Crops & Products, 2015, 66: 246-254.DOI:10.1016/j.indcrop.2015.01.002.
[22] NOUMAN W, ANWAR F, GULL T, et al. Profiling of polyphenolics,nutrients and antioxidant potential of germplasm’s leaves from seven cultivars of Moringa oleifera Lam.[J]. Industrial Crops & Products,2016, 83: 166-176. DOI:10.1016/j.indcrop.2015.12.032.
[23] GUTZEIT D, WRAY V, WINTERHALTER P, et al. Preparative isolation and purification of flavonoids and protocatechuic acid from sea buckthorn juice concentrate (Hippophaë rhamnoides L.ssp. rhamnoides) by high-speed counter-current chromatography[J].Chromatographia, 2006, 65(1): 1-7. DOI:10.1365/s10337-006-0105-6.
[24] 李坤平, 高崇凯, 李卫民. 牡荆苷和异鼠李素-3-O-β-D-芸香糖苷的电喷雾飞行时间质谱研究[J]. 中国中药杂志, 2011, 36(2): 180-184.
[25] AABY K, EKEBERG D, SKREDE G. Characterization of phenolic compounds in strawberry (Fragaria × ananassa) fruits by different HPLC detectors and contribution of individual compounds to total antioxidant capacity[J]. Journal of Agricultural & Food Chemistry,2007, 55(11): 4395-4406. DOI:10.1021/jf0702592.
[26] MARCH R E, LEWARS E G, STADEY C J, et al. A comparison of flavonoid glycosides by electrospray tandem mass spectrometry[J].International Journal of Mass Spectrometry, 2006, 248(1): 61-85.DOI:10.1016/j.ijms.2005.09.011.
[27] HE Q, LV Y, YAO K. Effects of tea polyphenols on the activities of α-amylase, pepsin, trypsin and lipase[J]. Food Chemistry, 2007,101(3): 1178-1182. DOI:10.1016/j.foodchem.2006.03.020
[28] 吴子健, 王吰, 郑俊清, 等. 葡萄籽浸提物对胰脂肪酶活性抑制的研究[J]. 食品研究与开发, 2009, 30(9): 83-86.
[29] SUI X, ZHANG Y, ZHOU W. In vitro and in silico studies of the inhibition activity of anthocyanins against porcine pancreatic α-amylase[J]. Journal of Functional Foods, 2016, 21(3): 50-57.DOI:10.1016/j.jff.2015.11.042.
[30] TAGLIAZUCCHI D, VERZELLONI E, CONTE A. Effect of some phenolic compounds and beverages on pepsin activity during simulated gastric digestion[J]. Journal of Agricultural & Food Chemistry, 2005,53(22): 8706-8713. DOI:10.1021/jf058074n.
Structural Analysis and Anti-Pancreatic Lipase Activity of Flavonoids from Moringa oleifera Lam. Leaves
WANG Yuan, ZHENG Wen, CAI Junjun, YUAN Tianqing, GONG Xingwen*
(College of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China)
Abstract:The structure of flavonoids from Moringa oleifera Lam. leaves (FML) was analyzed. Meanwhile, the inhibitory effect of FML on pancreatic lipase was determined and the type of inhibition was investigated. The extraction yield of flavonoids reached (5.53 ± 0.11)% with microwave-assisted extraction using 70% ethanol as the extraction solvent. The obtained crude extract was purified by polyamide column chromatography and freeze-dried to obtain a powder. The total flavonoid content of the powder was (661.10 ± 9.20) mg/g. A total of 11 flavonoids were identified from FML by ultra performance liquid chromatography-quadrupole/electrostatic field orbital trap mass spectrometry (UPLC-Q-Orbitrap MS).The inhibitory activity of FML on pancreatic lipase was determined with p-nitrophenyl butyrate as substrate. The results showed that the purified FML had a strong inhibitory effect on pancreatic lipase, with an IC50of 0.94 mg/mL, and the type of inhibition was determined as non-competitive inhibition by the Lineweaver-Burk double reciprocal plot method.
Keywords:flavonoids from Moringa oleifera Lam. leaves; UPLC-Q-Orbitrap MS; pancreatic lipase; inhibitory effect
DOI:10.7506/spkx1002-6630-201802006
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2018)02-0031-07
引文格式:王远, 郑雯, 蔡珺珺, 等. 辣木叶黄酮结构分析及其对胰脂肪酶的抑制作用[J]. 食品科学, 2018, 39(2): 31-37.
DOI:10.7506/spkx1002-6630-201802006. http://www.spkx.net.cn
WANG Yuan, ZHENG Wen, CAI Junjun, et al. Structural analysis and anti-pancreatic lipase activity of flavonoids from
Moringa oleifera Lam. leaves[J]. Food Science, 2018, 39(2): 31-37. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201802006. http://www.spkx.net.cn
收稿日期:2016-12-10
基金项目:浙江省自然科学基金项目(LY12C19011);食品科学与工程浙江省重中之重一级学科基金项目(JYTSP20141052)
第一作者简介:王远(1991—),男,硕士研究生,研究方向为食品生物技术。E-mail:wangyuan4617@163.com
*通信作者简介:宫兴文(1971—),男,副研究员,博士,研究方向为食品生物技术。E-mail:gongxingwen@163.com