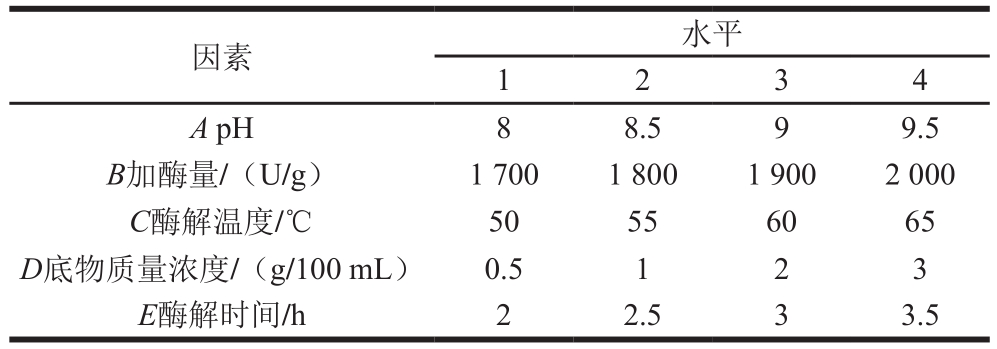
表1 正交试验因素与水平
Table 1 Levels of independent variables used in orthogonal array design
赵 聪,程 晨,尹诗语,李 云,朱 灿,黄晓伶,陈贵堂*
(中国药科大学工学院,江苏 南京 211198)
摘 要:以灰树花为原料,探究灰树花蛋白亚铁螯合肽的最佳制备条件,并对其抗氧化活性进行评价。从6 种蛋白酶中筛选出酶解最佳用酶,在此基础上,以亚铁螯合能力为响应值,进行单因素和正交试验,同时研究了灰树花蛋白亚铁螯合肽对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基的清除效果。结果表明,碱性蛋白酶酶解物的亚铁螯合能力最强,在pH 9、加酶量1 800 U/g、酶解温度55 ℃、底物质量浓度0.5 g/100 mL、酶解时间2.5 h的条件下,灰树花蛋白亚铁螯合肽的亚铁螯合能力最强,可达1.854 mg/g,此时水解度为6.14%。灰树花蛋白亚铁螯合肽对DPPH自由基和羟自由基有较强的清除效果,且与多肽质量浓度呈正相关。结果显示,灰树花蛋白亚铁螯合肽具有良好的亚铁螯合能力,并具有较好的抗氧化活性,有望发展为新型的膳食补充剂。
关键词:灰树花;酶解;多肽;亚铁螯合能力;抗氧化
灰树花(Grifola frondosa)属担子菌亚门、层菌纲、非褶菌目、多孔菌属中的一种大型食药两用真菌[1],又名贝叶多孔菌、栗子蘑、重菇等,俗称舞茸[2]。根据中国预防医学科学院营养与食品卫生研究所检测结果,灰树花干品碳水化合物质量分数49.69%、蛋白质质量分数31.5%、粗纤维质量分数10.7%以及少量其他营养成分[3]。研究表明,灰树花具有抗肿瘤[4-5]、抗病毒[6]、抗炎[7-8]、调节免疫[4-5]、调节血糖[9]等多种生物活性。但是对于灰树花的研究多停留在多糖提取及其生物学功能方面,而对蛋白质及其衍生物的研究鲜见报道。
铁是人体和其他动物体必需的微量元素,不仅是合成血红蛋白、肌红蛋白的主要原料,而且也是一系列在氧化还原反应过程中发挥重要作用酶的辅因子。此外它还参与氧的运输、细胞呼吸、核酸合成等重要的生理活动,因此,铁在维持机体健康中起着非常重要的作用。但由于食物含铁量通常不高,植酸盐等使铁较难被吸收等原因,导致目前全球大约有29%的非孕期妇女,38%的孕期妇女和43%的6~59个月龄的儿童缺铁[10]。根据2015年中国居民营养与慢性病状况报告显示,目前我国6 岁以上居民贫血率为9.7%,妇女特别是孕妇贫血率更高(孕妇贫血率为17.2%)。因此,改善铁营养状况,是迫切需要解决的问题。
大量研究表明[11-13],小分子肽具有良好的金属螯合活性,且具有抗氧化、抑菌等生物活性及易吸收、生物利用度高等特点。鱼肉[12-13]、大豆[14]、大米[11]等天然蛋白来源的小分子肽亚铁螯合物的制备及其生物活性也多有报道。实验证明利用灰树花子实体蛋白可控酶解制备抗氧化多肽时,发现灰树花多肽具有很强的螯合Fe(Ⅱ)作用。本实验对基于亚铁螯合能力的灰树花蛋白酶解工艺进行优化,并评价了酶解多肽清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基能力以及总还原能力,以期为今后灰树花多肽的研究开发提供一定理论依据。
灰树花子实体由河北省迁西县尚菌堂生物科技有限公司提供。
碱性蛋白酶(200 U/mg)、中性蛋白酶(14000 U/g)、胃蛋白酶(1∶15000)、复合蛋白酶(120 U/mg)、风味蛋白酶(20 U/mg)、菲啰嗪-钠盐 上海源叶生物有限公司;胰蛋白酶(2 500 U/g) 阿拉丁试剂公司;甲醛溶液 西陇科学股份有限公司;DPPH 阿法埃莎(中国)化学有限公司;氯化亚铁、硫酸铜、硫酸钾、邻苯二甲酸氢钾、30% H2O2溶液、铁氰化钾 南京化学试剂有限公司;氢氧化钠、醋酸钠、硫酸亚铁 国药集团化学试剂有限公司;无水乙醇 无锡市亚盛化工有限公司;无水碳酸钠、水杨酸 上海凌峰试剂有限公司;试剂均为分析纯。
ATX224分析天平 日本岛津公司;HH-42数显恒温搅拌循环水箱 常州国华电器有限公司;JJ-1A数显测速电动搅拌器 金坛市白塔新宝仪器厂;RE-5205旋转蒸发仪 上海亚荣生化仪器厂;DZF-6000系列电热真空干燥箱、GZX-9070 MBE电热鼓风干燥箱 上海博讯实业有限公司设备厂;KDN-08D凯氏定氮仪 上海新嘉电子有限公司;TU-1901双光束紫外-可见分光光度计北京普析通用仪器有限公司;LXJ-ⅡB型低速大容量多管离心机、TGL-16G型高速离心机 上海安亭科学仪器厂;PHS-3C型pH计 上海雷磁仪器厂。
1.3.1 原料处理
将干燥的灰树花子实体用超微粉碎机粉碎后经300目筛分,制成灰树花子实体超微粉。
1.3.2 灰树花子实体蛋白提取
称取90 g灰树花子实体粉,按照料液比为1∶50(g/mL)加入蒸馏水,搅拌均匀后用1 mol/L NaOH溶液调节pH值至9,放入70 ℃恒温水浴锅中搅拌提取3 h,期间用1 mol/L NaOH溶液保持体系pH值恒定。结束后,冷却至室温,4 000 r/min离心20 min。上清液旋转蒸发至原体积的1/2,用2 mol/L HCl溶液调pH值至3.5(灰树花蛋白等电点),低温静置过夜,4 000 r/min离心25 min,倾去上清液,沉淀用95%乙醇溶液洗涤一次,真空干燥。粉碎,过60目筛,即得灰树花子实体蛋白粉。经凯氏定氮法测定,该灰树花蛋白粉中蛋白质质量分数为83.1%。
1.3.3 蛋白酶筛选
选取风味酶、复合蛋白酶、胃蛋白酶、中性蛋白酶、碱性蛋白酶和胰蛋白酶6 种蛋白酶进行酶解反应,以亚铁螯合能力为指标筛选出水解灰树花蛋白的最佳酶种类。准确称取一定量灰树花蛋白粉,按比例加入蒸馏水,调节各个酶的最适pH值后于最适温度保温10 min。按照加酶量为1 800 U/g分别加入6 种蛋白酶,分别酶解0.5、1、2、3、4、5 h,期间保持体系pH值恒定,95 ℃灭酶10 min结束反应。水解液4 000 r/min离心25 min,上清液定容至250 mL,4 ℃保存。每组酶解反应做3 次平行实验,亚铁螯合能力和水解度测定实验平行进行3 次。
1.3.4 酶解条件优化试验
1.3.4.1 酶解条件单因素试验
对影响酶解反应的pH值、加酶量、酶解温度、底物质量浓度和酶解时间5 个因素按照1.3.3节所述方法分别进行探究,确定不同因素下酶解产物亚铁螯合能力的高低。
1.3.4.2 酶解条件正交试验
根据单因素试验结果,对5 个因素按照L16(45)正交表(表1)进行正交试验,以亚铁螯合能力为响应值,优化酶解工艺。
表1 正交试验因素与水平
Table 1 Levels of independent variables used in orthogonal array design

1.3.5 指标的测定
总氮含量参照凯氏定氮法[15]进行测定,氨基氮含量参照甲醛滴定法[16]进行测定,水解度[17]按公式(1)进行计算。
亚铁螯合能力测定参照Guo Lingdong[12]和段秀[18]等的方法略加修改。取1 mL酶解液,依次加入5 mL蒸馏水,0.5 mL醋酸-醋酸钠缓冲液(100 mmol/L,pH 5.5)和0.1 mL FeCl2溶液(2 mmol/L),混合均匀后30℃恒温静置30 min。再加入0.2 mL菲啰嗪-钠盐溶液(5 mmol/L),混匀,室温放置10 min后,于562 nm波长处测定吸光度。按公式(2)、(3)计算水解液的亚铁螯合能力。
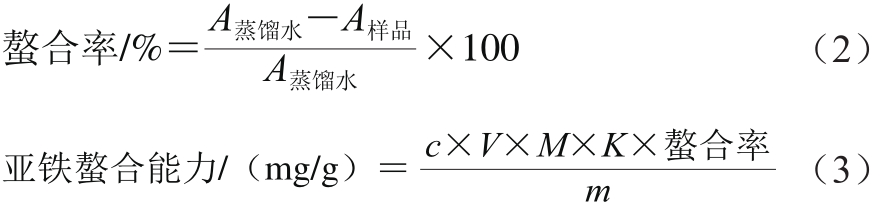
式中:A蒸馏水为空白的吸光度;A样品为样品的吸光度;c为氯化亚铁溶液浓度/(mmol/L);V为氯化亚铁体积/L;M为铁原子摩尔质量/(g/mol);K为稀释倍数;m为蛋白质量/g。
1.3.6 抗氧化活性实验
1.3.6.1 DPPH自由基清除效果测定
参照周琼飞[19]和Öztürk[20]等的方法略加修改。分别取2 mL 0.0、0.8、1.6、2.4、3.2、4.0 mg/mL的灰树花蛋白亚铁螯合肽溶液于10 mL离心管中,分别依次加入1 mL 0.2 mol/L 磷酸盐缓冲液(pH 6.6),2 mL 0.1 mmol/L的DPPH溶液,混合摇匀,室温下避光静置30 min。4 000 r/min离心10 min,取上清液于517 nm波长处测定吸光度,每个样品做3 个平行实验,蒸馏水作为空白对照。同时用0.0、0.2、0.4、0.6、0.8、1.0 mg/mL的VC溶液作阳性对照。DPPH自由基清除率按公式(4)进行计算。
式中:A0为样品或VC溶液+蒸馏水的吸光度;A1为样品或VC溶液+DPPH溶液的吸光度;A2为蒸馏水+DPPH溶液的吸光度。
1.3.6.2 羟自由基清除效果测定
参考刘立品[21]方法,分别取2 mL 0.0、0.8、1.6、2.4、3.2、4.0 mg/mL的灰树花蛋白亚铁螯合肽溶液于10 mL离心管中,依次加入3 mL蒸馏水、0.5 mL 6 mmol/L水杨酸溶液、0.5 mL 6 mmol/L FeSO4溶液、1 mL 6 mmol/L的H2O2溶液,混合摇匀,室温下避光静置30 min。8 000 r/min离心10 min,取上清液于510 nm波长处测定吸光度,每个样品做3 个平行实验,蒸馏水作为空白对照。同时用0.0、0.2、0.4、0.6、0.8、1.0 mg/mL的VC溶液作阳性对照。羟自由基清除率按公式(5)进行计算。
式中:A1为样品或VC溶液吸光度;A0为样品或VC溶液+蒸馏水的吸光度;A2为样品溶液换成等量蒸馏水的吸光度。
1.3.6.3 总还原力测定
参考王雪芹[22]和张敏等[23]方法,取1 mL 0、2、4、6、8、10 mg/mL的多肽溶液于4mL离心管中,分别加入1 mL1%铁氰化钾溶液,1 mL 0.2 mol/L磷酸盐缓冲液(pH 6.60),50 ℃水浴20 min,快速冷却,然后加入1 mL 10%三氯乙酸溶液终止反应,3 000 r/min离心10 min。取2 mL上清液,分别加入2 mL蒸馏水,1 mL 0.1%三氯化铁溶液,混匀,静置10 min,于700 nm波长处测定其吸光度,每个样品做3 个平行。同时用0.00、0.04、0.08、0.12、0.16、0.20 mg/mL的VC溶液作对照。以吸光度表示其总还原能力,按公式(6)进行计算。
式中:A0为空白对照测定值;A1为多肽样品或VC溶液测定值。
实验数据用Excel 2007进行数据处理,以 表示。用SPSS 22.0软件进行正交试验设计与显著性分析。
表示。用SPSS 22.0软件进行正交试验设计与显著性分析。
由图1可知,6 种蛋白酶中,碱性蛋白酶水解产物亚铁螯合能力最强,胃蛋白酶亚铁螯合能力最弱,因此,选用碱性蛋白酶作为水解用酶。碱性蛋白酶为非特异性蛋白酶,切割位点较为广泛,主要集中在Glu、Leu、Lys、Tyr、Met等氨基酸残基部位[24]。研究表明,Glu、Lys、Tyr、Cys和Asp等氨基酸具有较高金属螯合活性,因此,碱性蛋白酶酶切肽段中Glu、Lys、Tyr等氨基酸含量较多,因此具有较高的螯合活性[12,14,24]。由图2可见,在各个蛋白酶作用下,灰树花蛋白的水解度随酶解时间延长而增大。其中,中性蛋白酶和风味酶对灰树花蛋白水解度的影响明显大于其他4 种蛋白酶,水解度高达27.13%和15.12%,其他4 种酶对灰树花蛋白的水解度最大值均在5%~10%内。综合亚铁螯合能力和水解度趋势来看,亚铁螯合能力并不随水解度的增加而增加,水解度增大,生成的游离氨基酸增加,从而降低螯合活性。不同蛋白酶由于作用位点不同,产生的肽段分子质量、氨基酸组成、氨基酸序列均不相同,即使相同的水解度螯合能力也不尽相同。
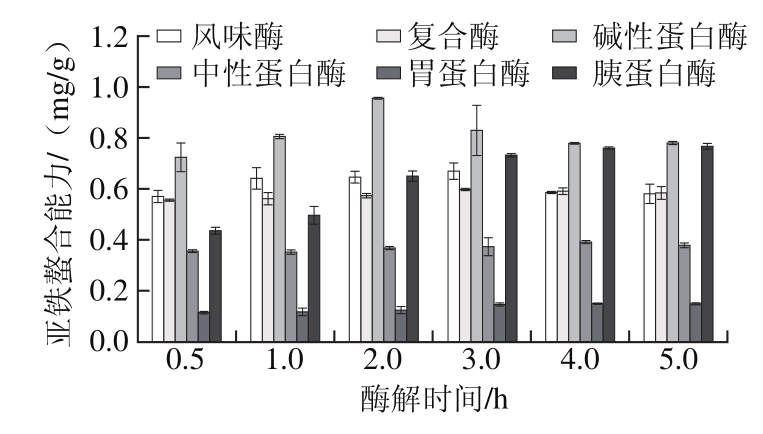
图1 6 种蛋白酶水解灰树花蛋白反应中亚铁螯合能力变化
Fig. 1 Change in iron-chelating ability during hydrolysis with six proteases

图2 6 种蛋白酶水解灰树花蛋白反应中水解度变化
Fig. 2 Change in degree of hydrolysis during hydrolysis with 6 proteases
2.2.1 pH值对酶解效果的影响
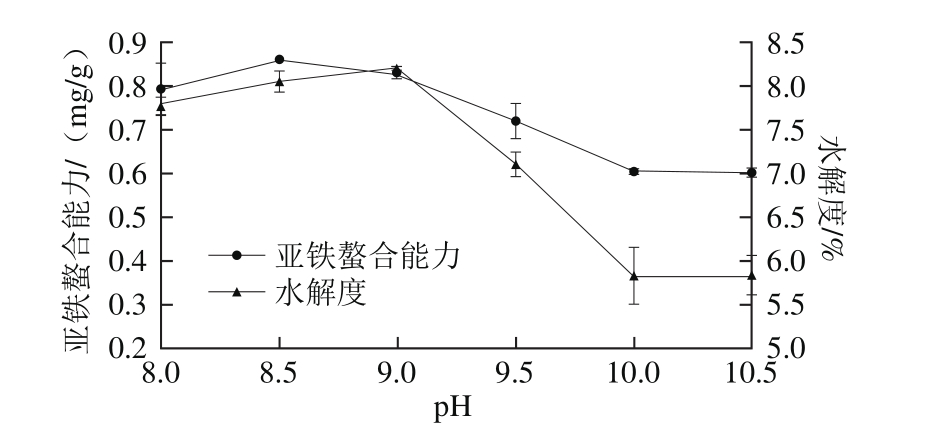
图3 pH值对亚铁螯合能力和水解度的影响
Fig. 3 Effect of pH value on iron-chelating ability and the degree of hydrolysis
由图3可见,亚铁螯合能力和水解度均随pH值增大而呈现先增加后降低趋势,最后在较高pH值下基本保持不变,二者具有一定的相关性。螯合能力在pH 8.5处达到最大值而水解度在pH 9时达到最大。较低的pH值会影响底物的解离状态,酶解反应受到抑制[25],水解度不高,不利于小分子活性肽的生成从而表现为较低的螯合活性。另一方面,碱性蛋白酶有其最适的pH值,过酸和过碱均会引起酶构象的改变,酶活力下降[26],造成水解度的大小变化,影响水解物的螯合活性。因此取pH 8.5作为最佳pH值条件。
2.2.2 加酶量对酶解效果的影响
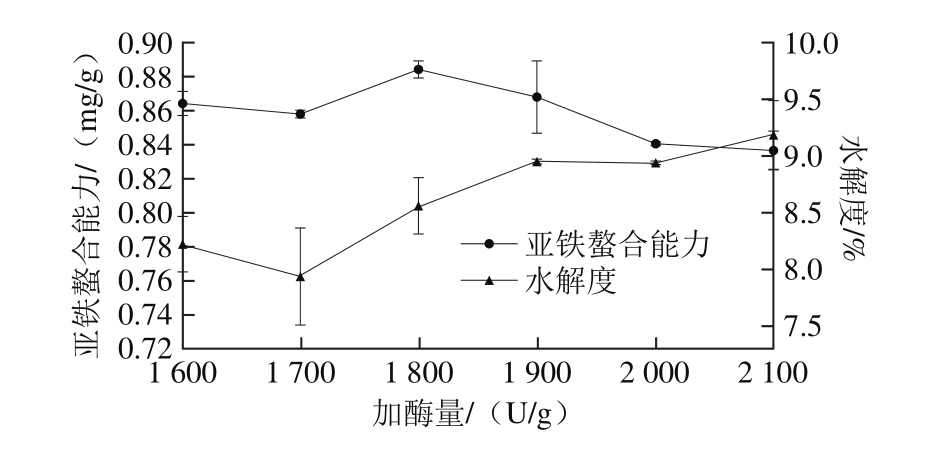
图4 加酶量对亚铁螯合能力和水解度的影响
Fig. 4 Effect of enzyme dose on iron-chelating ability and the degree of hydrolysis
由图4可知,随着加酶量的增加水解度在不断增大,而亚铁螯合能力先增加后降低,在加酶量为1 800 U/g时达到最大。随着酶量的增加,大分子灰树花蛋白迅速地分解成小分子多肽,水解度增加。但当加酶量过高时,会有更多的可溶性多肽被水解成游离氨基酸,导致螯合活性降低[18]。另一方面,增加加酶量也会增加生产成本,由此确定最佳加酶量为1 800 U/g。
2.2.3 酶解温度对酶解效果的影响
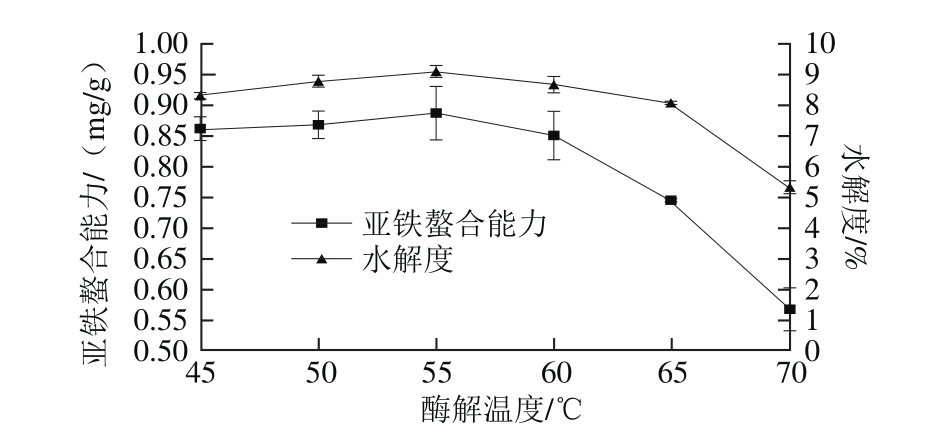
图5 酶解温度对亚铁螯合能力和水解度的影响
Fig. 5 Effect of temperature on iron-chelating ability and the degree of hydrolysis
由图5可知,在45~55 ℃温度范围内,亚铁螯合能力和水解度增加缓慢,当温度高于55 ℃后,螯合能力与水解度均随温度升高而降低。这是因为,在较低温度下随着温度升高反应速率加快,加快产物的生成,使得溶液中小分子肽含量增加,水解度和亚铁螯合能力均有所增加。但当温度高于碱性蛋白酶的最适温度后,温度升高造成酶的变性,使具有活力的酶数量减少[27],生成的小分子肽减少,水解度和亚铁螯合能力下降。因此选择55 ℃作为酶解的最佳温度条件。
2.2.4 底物质量浓度对酶解效果的影响
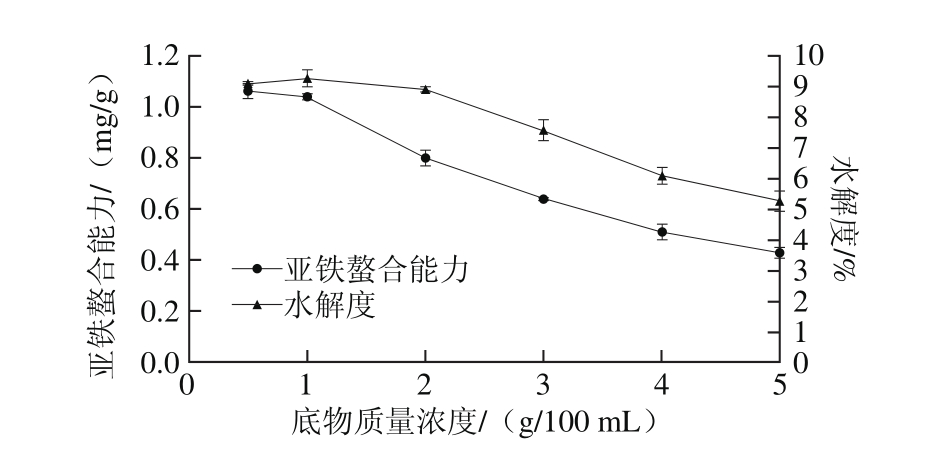
图6 底物质量浓度对亚铁螯合能力和水解度的影响
Fig. 6 Effect of substrate concentration on iron-chelating ability and the degree of hydrolysis
由图6可知,当底物质量浓度为0.5~1 g/100 mL时,水解度和亚铁螯合能力基本保持不变,当底物质量浓度高于1 g/100 mL时,随着底物质量浓度的增加水解度和亚铁螯合能力逐渐降低,以此选择1 g/100 mL作为酶解最佳底物质量浓度。底物质量浓度较低即固液比较大时,底物分散均匀,酶与底物充分接触,产物生成较快,水解度和亚铁螯合能力均保持在较高水平。增加底物质量浓度,水解液过于黏稠,不利于酶在水解液中的扩散,导致酶作用于相应位点受阻,造成水解度降低[28],生成物减少,亚铁螯合能力降低。
2.2.5 酶解时间对酶解效果的影响
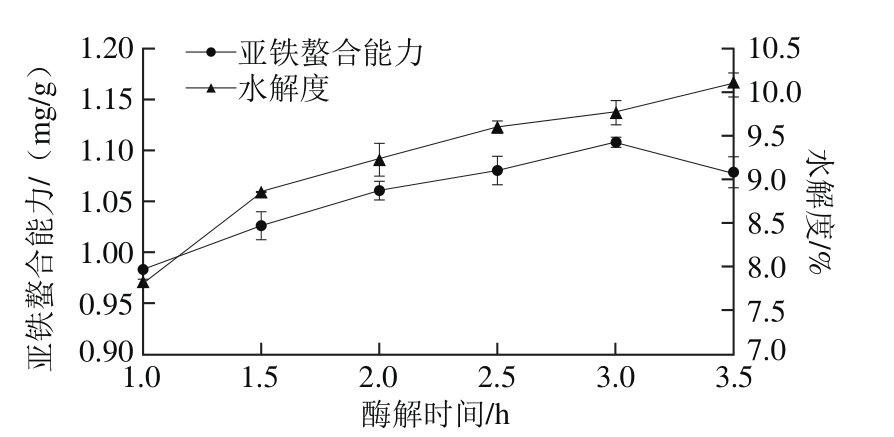
图7 酶解时间对亚铁螯合能力和水解度的影响
Fig. 7 Effect of hydrolysis time on iron-chelating ability and the degree of hydrolysis
由图7可知,亚铁螯合能力在1~1.5 h内随时间延长而呈线性增加,但超过3 h后,螯合能力下降。随着时间的延长,酶与底物接触时间增多,反应不断进行,水解度不断增加,使得小分子肽被进一步水解为游离氨基酸,亚铁螯合活性下降。因此,选择3 h作为酶解最佳时间。
2.2.6 酶解条件的确定
根据单因素试验结果,进行了L16(45)正交试验,正交试验极差分析见表2,方差分析见表3。由表2和表3可知,5 个因素对酶解效果的影响均显著。极差R值反应各因素对酶解反应的影响大小。各因素对碱性蛋白酶水解灰树花蛋白酶解效果的影响主次顺序为D>A>C>E>B,即底物质量浓度>pH值>酶解温度>酶解时间>加酶量,最佳酶解条件为A3B2C2D1E2,即碱性蛋白酶水解灰树花蛋白最佳工艺条件为pH 9、加酶量1 800 U/g、酶解温度55 ℃、底物质量浓度0.5 g/100 mL、酶解时间2.5 h。验证实验结果表明在最佳酶解条件下,亚铁螯合能力为(1.854±0.025)mg/g,水解度为(6.14±0.05)%。
表2 酶解正交试验设计及结果
Table 2 Orthogonal array design with experimental results
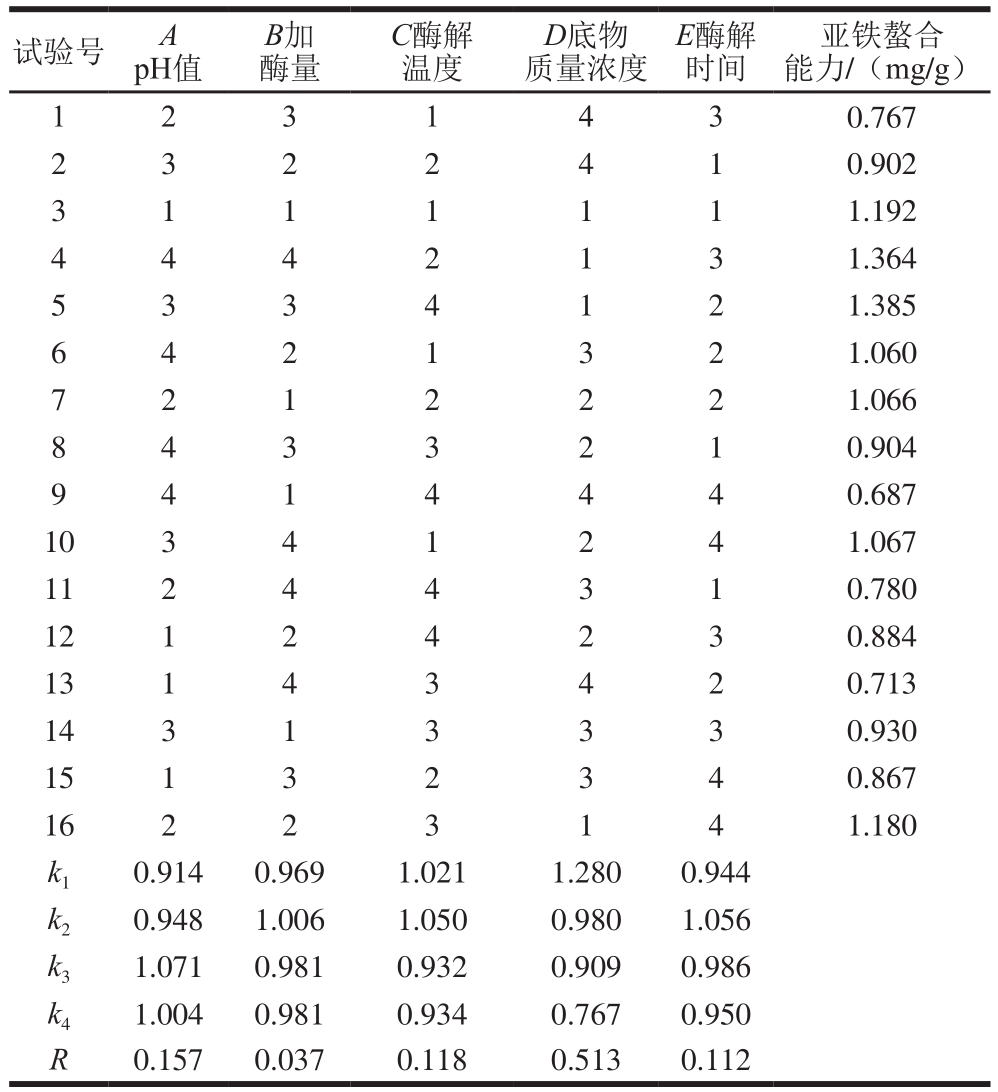
表3 方差分析结果
Table 3 Analysis of variance of regression model
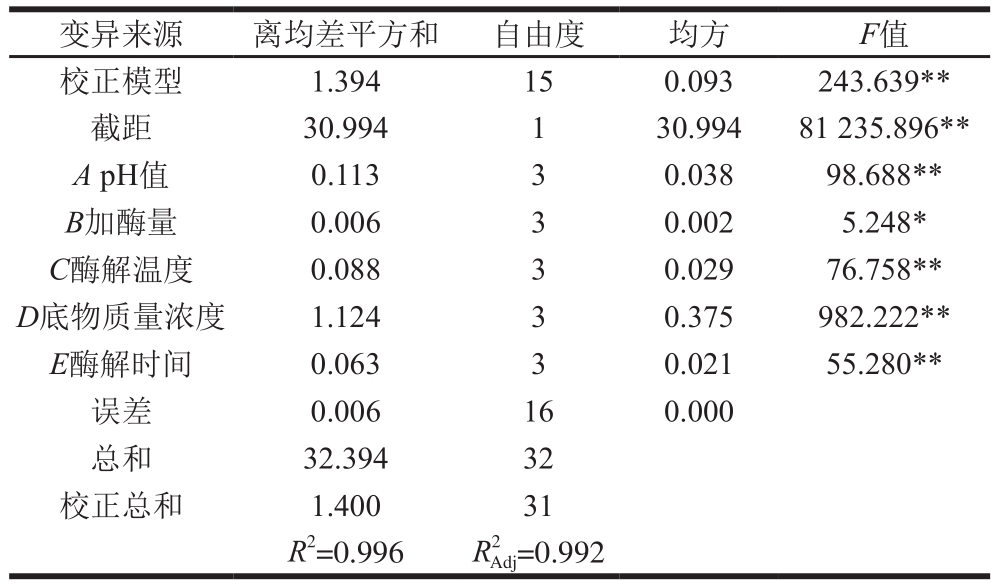
注:*.差异显著,P<0.05;**.差异极显著,P<0.01。
2.3.1 灰树花蛋白亚铁螯合肽对DPPH自由基清除效果
由图8可知,随着灰树花蛋白亚铁螯合肽质量浓度的增加,DPPH自由基清除率明显增加,在多肽质量浓度为4 mg/mL时,清除率达92%。VC溶液对DPPH自由基清除率在质量浓度为0.2 mg/mL时即可达到最大值77%,此后清除效果基本不变。当多肽质量浓度高于3.2 mg/mL后,其清除率已高于VC,显示出更好的清除DPPH自由基能力。
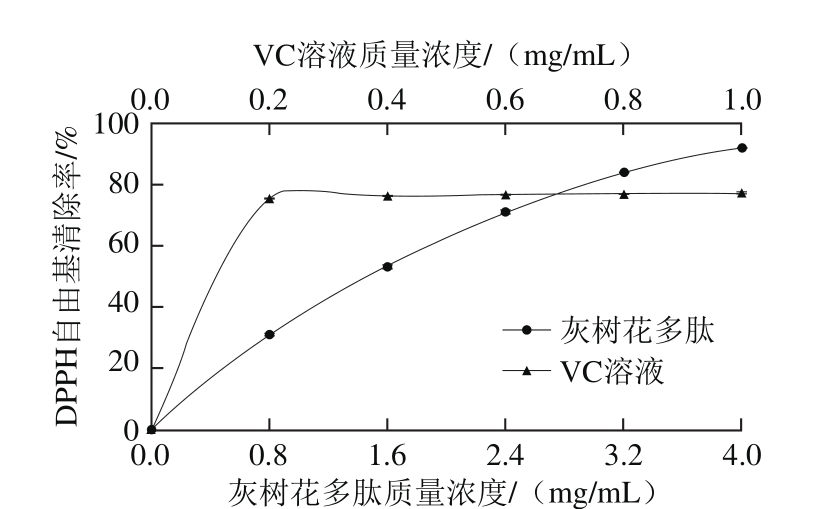
图8 灰树花蛋白亚铁螯合肽及VC溶液对DPPH自由基清除效果
Fig. 8 DPPH radical scavenging capacity of Grifola frondosa peptides and VC
2.3.2 灰树花蛋白亚铁螯合肽对羟自由基清除效果

图9 灰树花蛋白亚铁螯合肽及VC溶液对羟自由基清除效果
Fig. 9 Hydroxyl radical scavenging capacity of Grifola frondosa peptides and VC
由图9可知,灰树花多肽对羟自由基的清除率与质量浓度呈正相关,在4 mg/mL时清除率达到99.5%。虽然VC溶液在0.6 mg/mL时羟自由基清除率已达到99%,表现出更强的羟自由基清除效果,但4 mg/mL时灰树花多肽对羟自由基也具有较强的清除效果。
2.3.3 灰树花蛋白亚铁螯合肽总还原力的测定

图10 灰树花蛋白亚铁螯合肽及VC溶液对Fe3 还原能力
还原能力
Fig. 10 Fe3+reducing capacity of Grifola frondosa peptides and VC
研究表明[29]抗氧化物质一般通过自身的还原能力达到清除自由基的效果,还原能力强则样品的抗氧化活性也强。还原能力越强,生成的有色物质越多,吸光度越大。由图10可知,随着VC溶液或灰树花蛋白亚铁螯合肽质量浓度的增加,吸光度升高,还原能力不断增加。但VC溶液的还原能力较灰树花多肽强。
本实验先对6 种蛋白酶水解灰树花蛋白进行筛选,得到酶解灰树花蛋白最佳用酶为碱性蛋白酶。再通过单因素试验,初步确定了5 种因素对碱性蛋白酶水解灰树花蛋白水解度和亚铁螯合能力的影响,最后通过正交试验确定了以亚铁螯合能力为指标的碱性蛋白酶水解灰树花蛋白的最佳工艺条件为pH 9、加酶量1 800 U/g、酶解温度55 ℃、底物质量浓度0.5 g/100 mL、酶解时间2.5 h。在此最佳酶解条件下,亚铁螯合能力为(1.854±0.025)mg/g,水解度为(6.14±0.05)%,实验重复性良好。亚铁螯合能力与水解度呈现一定的相关性,当水解度为5%~10%范围内时,亚铁螯合能力普遍较高,水解度过高或过低均不利于与亚铁的螯合,因此获得一定分子大小的多肽具有显著意义。此外,体外抗氧化实验结果表明,灰树花多肽具有良好的DPPH自由基和羟自由基清除能力并具有一定的还原能力,有望开发成为功能性食品配料。但由于酶解反应的复杂性,其产物的具体组成、结构等尚未清楚,仍需对灰树花蛋白亚铁螯合肽进行进一步分离纯化和结构鉴定。
参考文献:
[1] 杨开, 方伦, 胡君荣, 等. 灰树花多糖提取副产物中蛋白的分离和理化性质研究[J]. 现代食品科技, 2015, 31(11): 68-73; 189.DOI:10.13982/j.mfst.1673-9078.2015.11.012.
[2] 金凌云, 华正根, 李晔, 等. 灰树花粗多糖的提取方法比较及其分离纯化[J]. 菌物研究, 2015, 13(1): 41-46. DOI:10.13341/j.jfr.2014.1022.
[3] 刘振伟, 史秀娟. 灰树花的研究开发现状[J]. 食用菌, 2001(4): 5-6.
[4] MAO G H, REN Y, LI Q, et al. Anti-tumor and immunomodulatory activity of selenium(Se)-polysaccharide from se-enriched Grifola frondosa[J]. International Journal of Biological Macromolecules,2016(82): 607-613. DOI:10.1016/j.ijbiomac.2015.10.083.
[5] MAO G H, REN Y, FENG W W, et al. Antitumor and immunomodulatory activity of a water-soluble polysaccharide from Grifola frondosa[J]. Carbohydrate Polymers, 2015, 134: 406-412.DOI:10.1016/j.carbpol.2015.08.020.
[6] ZHAO C, GAO L Y, WANG C Y, et al. Structural characterization and antiviral activity of a novelhetero polysaccharide isolated from Grifola frondosa against enterovirus 71[J]. Carbohydrate Polymers, 2015, 134:382-389. DOI:10.1016/j.carbpol.2015.12.005.
[7] LEE J S, PARK S Y, THAPA D, et al. Grifola frondosa water extract alleviates intestinal inflammation by suppressing TNF-α production and its signaling[J]. Experimental and Molecular Medicine, 2010,42(2): 143-154. DOI:10.3858/emm.2010.42.2.016.
[8] SU C H, LAI M N, NG L T. Effects of different extraction temperatures on the physicochemical properties of bioactive polysaccharides from Grifola frondosa[J]. Food Chemistry, 2016, 220:400-405. DOI:10.1016/j.foodchem.2016.09.181.
[9] PREUSS H G, ECHARD B, BAGCHI D, et al. Enhanced insulinhypoglycemic activity in rats consuming a specif i c glycoprotein extracted from maitakemushroom[J]. Molecular & Cellular Biochemistry, 2007,306(2): 105-113. DOI:10.1007/s11010-007-9559-6.
[10] STEVENS G A, FINUCANE M M, DEREGI L M, et al. Global,regional, and national trends in haemoglobin concentration and prevalence of total and severe anaemia in children and pregnant and non-pregnant women for 1995-2011: a systematic analysis of population-representative data[J]. The Lancet Global Health, 2013,1(1): 16-25. DOI:10.1016/S2214-109X(13)70001-9.
[11] 廉雯蕾. 脱酰胺-酶解法制备米蛋白肽及其亚铁螯合物的研究[D].无锡: 江南大学, 2015: 27-31; 33-36.
[12] GUO L D, HU H, LI B F, et al. Preparation, isolation and identif i cation of iron-chelating peptides derived from Alaska pollock skin[J].Process Biochemistry, 2013, 48(5/6): 988-993. DOI:10.1016/j.procbio.2013.04.013.
[13] LIN H M, DENG S G, HUANG S B. Antioxidant activities of ferrous-chelating peptides isolated from five low-value fish protein hydrolysates[J]. Journal of Food Biochemistry, 2014(38): 627-633.DOI:10.1111/jfbc.12103.
[14] 张墨楠. 酶促水解大豆分离蛋白制备铁螯合肽的研究[D]. 杭州: 中国计量学院, 2013: 13.
[15] 卫生部. 食品中蛋白质的测定: GB 5009.5—2010[S]. 北京: 中国标准出版社, 2010: 1-4.
[16] 卫生部, 国家标准化管理委员会. 酱油卫生标准的分析方法: GB/T 5009.39—2003[S]. 北京: 中国标准出版社, 2003: 17-20.
[17] 邓尚贵, 杨燊, 秦小明. 低值鱼蛋白多肽-铁(Ⅱ)螯合物的酶解制备及其抗氧化、抗菌活性[J]. 湛江海洋大学学报, 2006, 24(4): 54-58.
[18] 段秀. 罗非鱼皮胶原蛋白肽亚铁螯合修饰及生物活性研究[D].昆明: 昆明理工大学, 2014: 45-52.
[19] 陈贵堂, 周琼飞, 朱艳丽, 等. 采用美拉德反应提高灰树花多肽的抗氧化活性[J]. 食品科学, 2013, 34(14): 26-29. DOI:10.7506/spkx1002-6630-201314006.
[20] ÖZTÜRK M, AYDOĞMUS-ÖZTÜRK F, DURU M E, et al.Antioxidant activity of stem and root extracts of rhubarb (Rheum ribes): an edible medicinal plant[J]. Food Chemistry, 2007, 103(2):623-630. DOI:10.1016/j.foodchem.2006.09.005.
[21] 刘立品. 青稞蛋白结构和功能研究[D]. 杨凌: 西北农林科技大学,2015: 40-41.
[22] 王雪芹. 鲐鱼多肽的抗氧化活性与抗疲劳作用研究[D]. 青岛: 中国科学院大学, 2014: 60.
[23] 张敏, 周梅. 不同分子质量米糠多肽的抗氧化活性[J]. 食品科学,2013, 34(3): 1-6.
[24] 马涛, 张海欣, 马永庆, 等. 三文鱼小清蛋白定向酶解模型及致敏活性分析[J]. 食品工业, 2017, 38(2): 179-183.
[25] TANG C H, TEN Z, WANG X S, et al. Physicochemical and functional properties of hemp (Cannabis sativa L.) protein isolate[J].Journal of Agricultural and Food Chemistry, 2006, 54(23): 8945-8950.DOI:10.1021/jf0619176.
[26] 梁凯, 雷灼贵, 吴晖, 等. 火麻仁粕蛋白酶解工艺的优化[J]. 食品科技, 2014, 39(6): 174-181. DOI:10.13684/j.cnki.spkj.2014.06.039.
[27] 姜莉. 核桃渣制备核桃蛋白和多肽的研究[D]. 杨凌: 西北农林科技大学, 2007: 28.
[28] 吴蕾. 胶原蛋白肽螯合钙的制备研究[D]. 武汉: 武汉工业学院,2012: 25-26.
[29] 夏光华, 申铉日, 蔡锦红, 等. 三酶法制备罗非鱼鱼皮胶原蛋白抗氧化肽及活性研究[J]. 食品科学, 2012, 33(23): 175-179.
Optimization of Enzymatic Preparation of Protein Hydrolysate from Fruiting Bodies of Grifola frondosa for Improved Ferrous Chelating Ability and Its Antioxidant Activity
ZHAO Cong, CHENG Chen, YIN Shiyu, LI Yun, ZHU Can, HUANG Xiaoling, CHEN Guitang*
(School of Engineering, China Pharmaceutical University, Nanjing 211198, China)
Abstract:In this study, we optimized the conditions for the enzymatic preparation of iron-chelating peptides from the fruiting bodies of Grifola frondosa and evaluated their antioxidant capacities. Six commercial proteases were screened for their suitability to hydrolyze Grifola frondosa protein, which was evaluated according to iron-chelating activity. Onefactor-at-a-time and orthogonal array designs were employed to optimize the hydrolysis conditions based on iron-chelating activity. Meanwhile, the antioxidant capacity was studied using 1,1-diphenyl-2-picrylhydrazyl (DPPH) and hydroxyl radical scavenging assays. The results showed that peptides with the highest iron-chelating activity were obtained with alkaline protease. The optimal hydrolysis conditions were determined as follows: pH value, 9; alkaline protease dose, 1 800 U/g;temperature, 55 ℃; substrate concentration, 0.5 g/100 mL; and hydrolysis time, 2.5 h. Under these conditions, the ironchelating activity and the degree of hydrolysis were 1.854 mg/g and 6.14%, respectively. The prepared peptides showed scavenging activity against DPPH and hydroxyl radicals in a concentration-dependent manner. In addition, the peptides possessed good iron-chelating ability and antioxidant activities, and could thus hold promise as a novel dietary supplement.
Keywords:Grifola frondosa; hydrolisis; peptides; iron-chelating activity; antioxidant activity
DOI:10.7506/spkx1002-6630-201802012
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2018)02-0073-07
引文格式:赵聪, 程晨, 尹诗语, 等. 基于亚铁螯合能力的灰树花蛋白酶解工艺优化及其抗氧化活性[J]. 食品科学, 2018, 39(2):73-79.
DOI:10.7506/spkx1002-6630-201802012. http://www.spkx.net.cn
ZHAO Cong, CHENG Chen, YIN Shiyu, et al. Optimization of enzymatic preparation of protein hydrolysate from fruiting bodies of Grifola frondosa for improved ferrous chelating ability and its antioxidant activity[J]. Food Science, 2018, 39(2):73-79. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802012. http://www.spkx.net.cn
收稿日期:2017-03-14
基金项目:国家自然科学基金青年科学基金项目(31201344);中国药科大学中央高校基本科研业务费重点项目(2016ZZD001);中国药科大学药学基地科研训练及科研能力提高项目(J1310032)
第一作者简介:赵聪(1992—),女,硕士研究生,研究方向为食品药品分析。E-mail:873576548@qq.com
*通信作者简介:陈贵堂(1977—),男,副教授,博士,研究方向为营养与功能食品学。E-mail:caucgt@163.com