修艳辉1,2,郭全友1,*,韩承义3,陈庆荣4
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学食品学院,上海 201306;3.宁德市益丰水产有限公司,福建 宁德 352100;4.宁德市蕉城区水产技术推广站,福建 宁德 352100)
摘 要:为探究温度对鱼源腐败希瓦氏菌碳源利用的影响,利用多孔平板技术获得5、15、25 ℃和33 ℃条件下其生长动态,采用修正的Gompertz方程,构建动力学模型,获取动力学参数,结合孔平均颜色变化率及利用面积,探究其碳源利用效果。结果表明,25 ℃时最大比生长速率(μmax)最大,迟滞期(λ)最小,总体碳源利用能力和活性最强,15 ℃时次之,5 ℃时活性降至约25 ℃的1/6,33 ℃时最弱;5~25 ℃范围内,温度和 μ、 呈现良好的线性关系。5~33 ℃时糖类和羧酸类利用率较高,比例分别为30%、29%。糖类(糊精、D-麦芽糖、α-D-葡萄糖、D-阿拉伯醇、水苏糖)、羧酸类(L-苹果酸、L-乳酸、乙酰乙酸)、氨基酸类(L-丝氨酸、氨基乙酰-L-脯氨酸、L-天冬氨酸和L-谷氨酸)和胺/酰胺类、脂肪酸/脂类和其他类中(明胶、丙酮酸甲酯、吐温40、L-组胺)利用较好。通过对腐败希瓦氏菌碳源利用分析,通过对腐败希瓦氏菌碳源利用和动力学分析,可为深入其代谢活性与水产品营养相关性等提供理论依据。
关键词:腐败希瓦氏菌;碳源;生长动力学;多孔平板计数
水产品腐败与微生物代谢活动密切相关,鱼体表面、腮和内脏等附着大量的细菌,其中假单胞菌属(Pseudomonas spp.)、莫拉氏菌(Moraxella spp.)、不动杆菌属(Acinetobacter spp.)、黄杆菌属(Flavobacterium spp.)和希瓦氏菌属(Shewanella spp.)等是导致低温贮藏鱼类腐败的主要微生物,菌量达到107~109CFU/g时,会产生难闻的气味,失去食用价值,达到货架期[1]。腐败希瓦氏菌(Shewanella putrefaciens)作为低温贮藏海水鱼类的优势腐败菌,具有较强腐败能力[2],同时能黏附在食品表面并形成生物膜[3],增加致病潜力,可能引发腹膜炎、软组织感染等疾病[4]。改变外界因素(pH值、水分活度、NaCl、温度和保鲜剂等)可抑制腐败希瓦氏菌生长,例如高温(37 ℃)、低pH值(pH 4)或高盐分(12%)可抑制腐败希瓦氏菌生长[5],茶多酚等保鲜剂能较好抑制其生长[6]。同时,微生物在受到环境因子胁迫作用下,进行自我修复过程中,需要不断消耗能量来维持内部平衡,当能量耗尽时促使细菌代谢衰竭而失活甚至死亡,产生“自动杀菌”效应,这为微生物从生长状态转变为非生长状态的客观出现提供一种能量学解释[7],但目前鲜见关于腐败希瓦氏菌碳源利用及动力学代谢等相关研究。
基于氧化还原反应的多孔平板技术多用于微生物菌株鉴定和微生物群落分析,根据微生物种类和固有性质分析微生物对不同单一碳源的利用能力,如周丽英等[8]通过分析碳源平均颜色变化率(average well color development,AWCD)随时间的变化分析3 种假单胞菌碳源利用差异,柏中中等[9]利用Biolog分析两株凝结芽孢杆菌的乳酸发酵相关代谢能力,陈玉梅等[10]分析以培养基为基础的乳酸钠和葡萄糖对薛氏丙酸杆菌代谢物的抑制作用,刘文等[11]采用单碳源纯培养等技术研究纯菌株对碳源利用的选择性。分析微生物代谢情况常采用AWCD、曲线拟合面积、Shannon指数和Shannon均匀度等多样性指数[12],这些指标在微生物群落分析中均有较广泛应用,在比较不同碳源利用情况时具有一定局限性。
常采用Logistic、Gompertz或Richard等模型分析环境因素对菌株生长的影响[2],如Speranza等[13]采用修正的Gompertz模型拟合腐败希瓦氏菌等混合菌株生长数据,探究胁迫效应(如气调包装和天然抗菌剂)对其生长的影响。目前预测模型运用主要用于生长数据的拟合,亦可对其代谢产物等进行分析,如构建的大黄鱼腐败细菌PLFAs初级模型具有一定实际价值[14],但已有研究发现水解效应使得腐败希瓦氏菌等菌生长和酶数据建模无法实现[15]。
本实验以低温贮藏大黄鱼优势腐败菌(腐败希瓦氏菌)为对象,研究温度(5 、15、25 ℃和33 ℃)对腐败希瓦氏菌碳源利用的影响,采用修正的Gompertz模型进行数据拟合,求出动力学参数,并结合AWCD和积分面积等分析其利用能力及差异性,为高效抑制低温贮藏鱼类优势腐败菌生长,延长货架期等提供理论依据。
从腐败冷藏大黄鱼中分离出优势菌并经16S rRNA鉴定(KY859796),冻干保藏备用。
HCl标准溶液(0.01 mol/L) 深圳市博材达科技有限公司;营养琼脂、营养肉汤 国药集团化学试剂上海有限公司。
MIR-153/253低温培养箱 日本三洋公司;微生物生长自动鉴定仪 美国Biolog公司;SW-CJ-1FB型洁净工作台 上海博讯实业有限公司医疗设备厂。
1.3.1 Biolog实验
冻干腐败希瓦氏菌在营养肉汤中活化后,取一株菌于营养琼脂平板进行两代划线,然后从平板中取适量菌株接种到Biolog专业接种液(IF-A)中,调节透光率为95%~98%之间,使其光密度(OD)约为0.01。然后使用Biolog专用移液器,分别吸取200 μL菌悬液到GenⅢ 96 孔板中,分别置于5、15、25 ℃和33 ℃的培养箱中培养96 h,间隔适当时间经Biolog仪中的Microstation读数仪测定OD值。
1.3.2 腐败希瓦氏菌对碳源利用能力分析
将GenⅢ板中的71 种碳源分为6 类,分别为糖类(25 种)、羧酸类(17 种)、氨基酸类(10 种)、胺/酰胺类(6 种)、脂肪酸/脂类(6 种)和其他类(7 种)[16]。当腐败希瓦氏菌V稳(稳定时OD值,即C-R值)大于0.25时[17],判为可利用,V稳不大于0时,判为完全不能利用。
碳源利用能力可用孔AWCD、利用面积S和动力学参数(μmax和λ)进行描述,AWCD和S计算如式(1)和(2)所示:
式中:R为对照孔OD值;C为含有碳源孔的OD值;n为碳源孔数;Vi、Vi-1分别为i、i-1时刻的(C-R)值。
1.3.3 模型建立及评价
初级模型采用修正的Gompertz方程拟合Biolog数据[18],方程见式(3),平方根方程[19]可描述环境因子对动力学参数的影响,方程见(4)和(5):
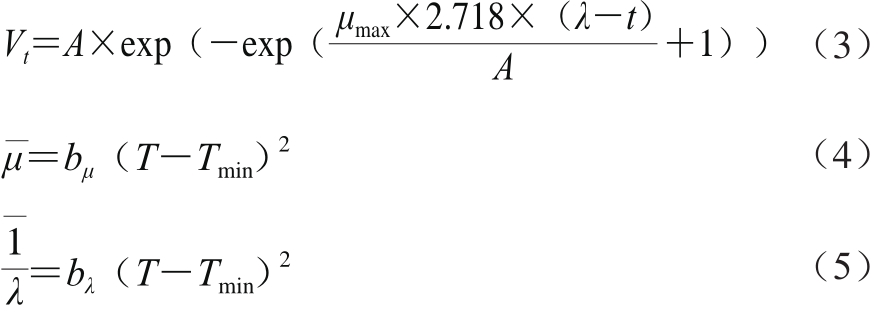
式中:t为时间/h;Vt为t时的(C-R)值;μmax为颜色变化最大速率/h-1;λ为迟滞期/h;A为颜色变化最大水平;T为温度/℃;Tmin为理论最小温度/℃;bμ、bλ为方程常数。
采用决定系数R2、准确度Af、精确度Bf对模型进行评价[20-21],R2接近1表明拟合较好,Af和Bf值越接近1,准确性或精确性较好[22]。
数据采用SPSS 19.0软件(美国IBM公司),采用最小二乘算法,进行非线性回归,求出动力学参数,采用Origin 8.0软件(美国OriginLab公司)作图。

图1 不同温度条件下腐败希瓦氏菌总体碳源利用状况
Fig. 1 Carbon utilization of S. putrefaciens at different temperatures
由图1可知,5~25 ℃时总体碳源利用曲线呈S型,25 ℃时μmax最大(0.064 h-1),λ最小(4.5 h),AWCD最大值为0.329,表明总体碳源利用能力和活性最强,15 ℃时次之,μmax降至25 ℃时的约1/2,λ增大约2 倍,AWCD最大值为0.216;5 ℃时μmax降至25 ℃时的约1/6,λ增至约5.6 倍,最大AWCD值为0.183;33 ℃时最弱,μmax接近0,λ长达61.4 h,AWCD最大值为0.091。结果表明,温度对腐败希瓦氏菌碳源利用影响较大,最大AWCD值随着温度升高而变小;λ随着温度升高先变小后变大,μmax则先变大后变小(表1)。
表1 不同温度条件下腐败希瓦氏菌动力学参数及AWCD值
Table 1 Growth kinetic parameters and AWCD values of S. putrefaciens at different temperatures

桂萌等[23]对0~20 ℃托盘包装冰藏鲟鱼中的优势腐败菌——腐败希瓦氏菌用修正的Gompertz方程拟合得到动力学参数,结果显示0~20 ℃条件下μmax逐渐变大,λ逐渐变小,最大菌数变化不大,在8.57~9.8(lg(CFU/mL))之间,与本研究中5~25 ℃时碳源μmax和λ变化规律相似。动力学参数(μmax和λ)通过拟合平方根模型如下:

其中R2分别为1和0.996,表明5~25 ℃范围内,温度和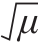 、
、 呈现良好的线性关系,但5~33 ℃时拟合效果较差,表明腐败希瓦氏菌最适温度在25 ℃,故在5~25 ℃内温度可与
呈现良好的线性关系,但5~33 ℃时拟合效果较差,表明腐败希瓦氏菌最适温度在25 ℃,故在5~25 ℃内温度可与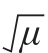 、
、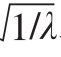 呈现良好的线性关系。本研究中拟合的模型R2为0.991±0.004,Af为0.998±0.025,Bf为1.013±0.033,表明模型能较好拟合5~33 ℃范围内腐败希瓦氏菌碳源利用情况。
呈现良好的线性关系。本研究中拟合的模型R2为0.991±0.004,Af为0.998±0.025,Bf为1.013±0.033,表明模型能较好拟合5~33 ℃范围内腐败希瓦氏菌碳源利用情况。

图2 温度对腐败希瓦氏菌各类碳源利用的影响
Fig. 2 Effect of temperature on the utilization of different carbon sources by S. putrefaciens
由图2可知,5~25 ℃内,腐败希瓦氏菌对各类碳源(除糖类)的μmax随着温度升高而增大,λ呈现相反的规律,如5~25 ℃时羧酸类μmax分别为0.012、0.025 h-1和0.067 h-1,λ分别为24.6、9.3 h和4.3 h。5~25 ℃时各类碳源中脂肪酸/脂类利用速率最快,如25 ℃时脂肪酸/脂类利用速率为0.106 h-1,糖类速率为0.05 h-1。33℃时羧酸类、氨基酸类和脂肪酸类基本不利用。相同温度下各类碳源λ变化不明显,但μmax变化明显。
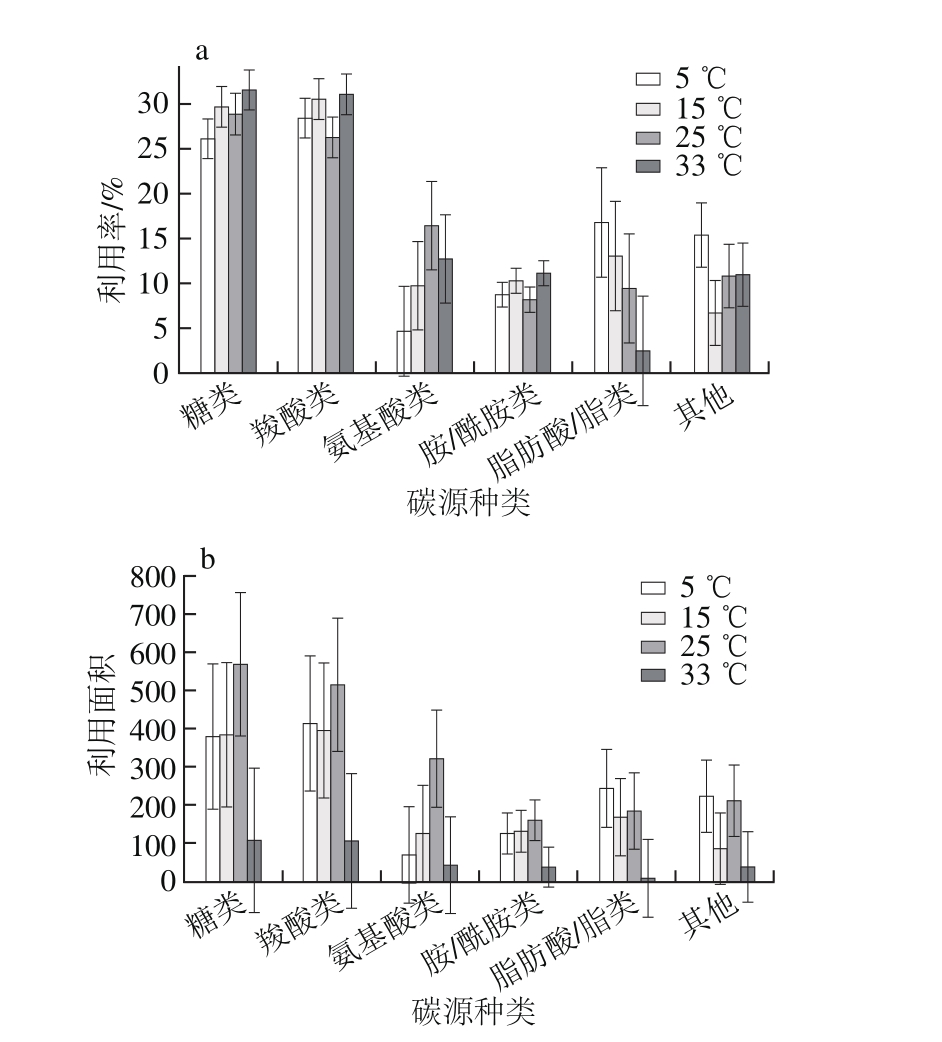
图3 温度对腐败希瓦氏菌6类碳源利用率(a)及利用面积(b)的影响
Fig. 3 Utilization rates and areas of six carbon sources of S. putrefaciens at different temperatures
由图3a可知,5~33 ℃时糖类和羧酸类利用率较高,平均值分别为(30±1.4)%、(29±2.7)%,且温度对其影响不大;氨基酸类、脂肪酸/脂类和其他碳源利用比例受温度影响较大,如5 ℃时氨基酸类利用率为4.7%,25 ℃时增至16.4 %,而33 ℃降至12.7%。由图3b可知,温度对腐败希瓦氏菌利用不同类型碳源的能力有较大影响,如5 ℃和15 ℃时糖类以及羧酸类利用面积变化不大,分别约为380和400,但33 ℃时分别降至107和106。温度对碳源利用情况受微生物种类、外界环境及碳源种类的影响,如有研究表明小麦及玉米秸秆腐解微生物对供试碳源的利用随着温度升高而降低,而且秸秆腐解微生物利用糖类、脂类和醇类能力较强,利用氨基酸和酸类能力较弱[24]。也有研究表明15 ℃时腐败希瓦氏菌的脱色能力明显低于在25 ℃和35 ℃[25]。刘文等[11]研究表明相似碳链长度碳源所培养出的微生物种类组成相似,潜在地说明碳链长度可能影响微生物对有机碳的利用,而微生物对碳链长度选择的主要原因可能是由于其生理代谢功能限制。腐败希瓦氏菌生长的细胞内代谢物在污水中的组成比较复杂,不同生长基质中代谢产物差异较大,作为限制碳源的甲酸盐在污水中浓度降低[26]。
2.2.1 不同温度条件下腐败希瓦氏菌糖类的代谢利用分析
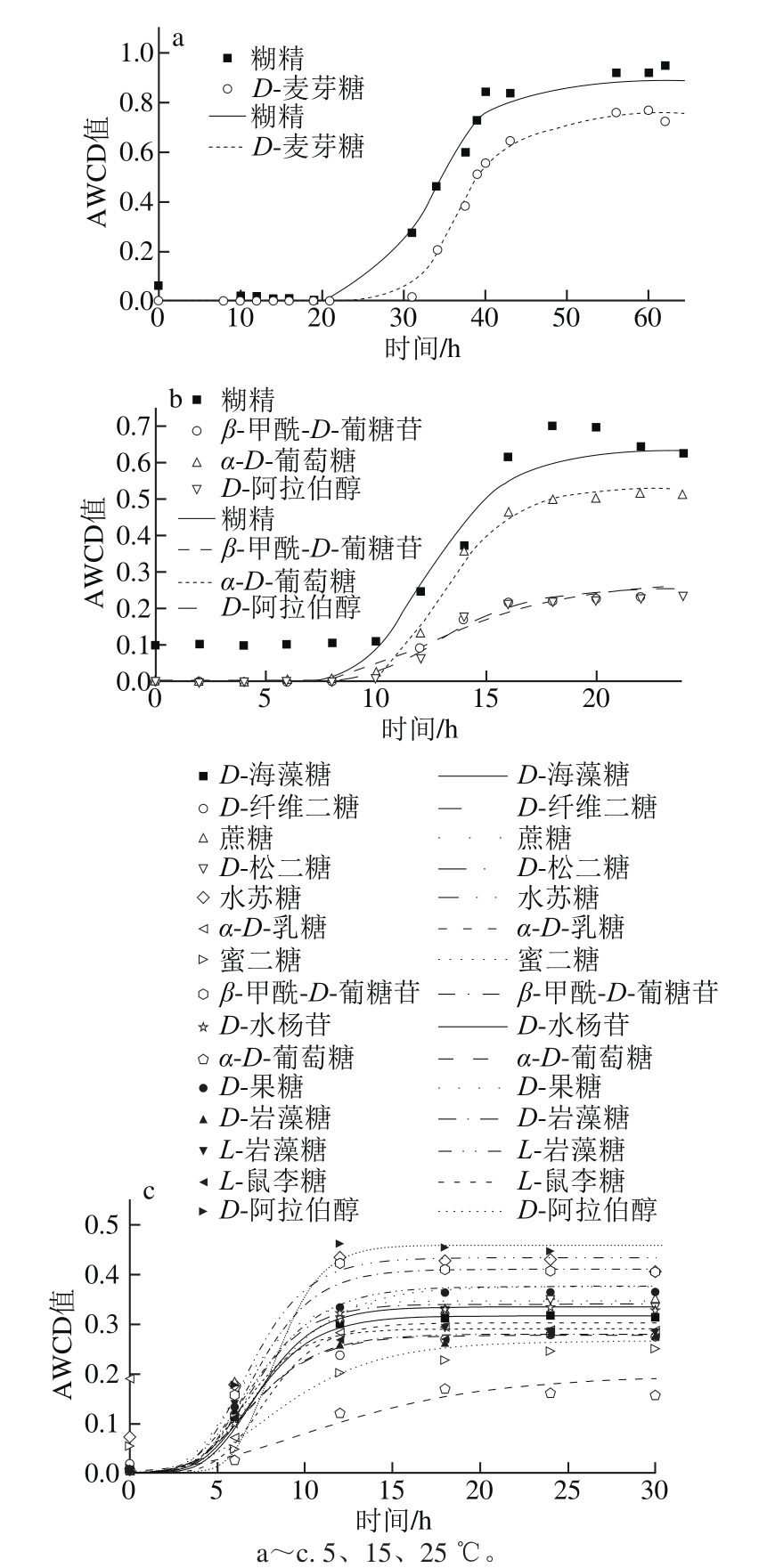
图4 不同温度条件下糖类AWCD随培养时间的变化
Fig. 4 Changes in AWCD of carbohydrates during incubation at different temperatures
如图4所示,5~25 ℃内腐败希瓦氏菌对糖类的利用整体上呈“S”型,且温度越高,代谢反应越强烈,延滞期越短,达到稳定期的时间越短。5 ℃时μmax为(0.051±0.061)h-1,¯λ为(24.5±9.8)h;15 ℃时μmax为(0.071±0.043)h-1,¯λ为(9.1±0.8)h;25 ℃时μmax为(0.084±0.024)h-1,¯λ为(5.0±0.7)h;33 ℃时皆不可利用。不同温度达到稳定期的时间也不同,顺序依次为25 ℃(12 h)<15 ℃(15 h)<5 ℃(17 h以上)。5℃时利用糊精和D-麦芽糖较好,μmax分别为0.032 h-1和0.069 h-1,λ分别为17.6 h和31.4 h。15 ℃时糊精和α-D-葡萄糖利用较好,μmax分别为0.111、0.106 h-1,β-甲酰-D-葡糖苷和D-阿拉伯醇利用较差,μmax分别为0.028、0.040 h-1;其λ在8.7~10.7 h之间,差异不大(P>0.05)。25 ℃时D-阿拉伯醇、水苏糖利用较好,μmax分别为0.111 h-1和0.08 h-1,其次是β-甲酰-D-葡糖苷、D-松二糖和蔗糖,μmax分别为0.075、0.066 h-1和0.065 h-1;而这15 种糖类λ与¯λ((5.0±0.6)h)之间没有显著差异(P>0.05)。说明腐败希瓦氏菌对糖类的代谢能力受培养温度的影响较大。
本研究中糖类共有25 种(糊精、D-麦芽糖、D-海藻糖、D-纤维二糖、龙胆二糖、蔗糖、D-松二糖、水苏糖、蜜三糖、α-D-乳糖、蜜二糖、β-甲酰-D-葡糖苷、D-水杨苷、α-D-葡糖糖、D-甘露糖、D-果糖、D-半乳糖、3-甲酰葡糖、D-岩藻糖、L-岩藻糖、L-鼠李糖、D-山梨醇、D-甘露醇、D-阿拉伯醇和果胶),温度对糖类μmax影响较大,进而影响可利用碳源种类,如25 ℃可利用糖类种类远大于15 ℃(15/4),而33 ℃时可利用碳源种类为0 种,可见25 ℃糖类碳源利用种类更好。但也有部分碳源反而随着温度升高利用变差,如糊精在5~33 ℃范围内V稳值依次为0.795、0.534、0.247和0。此外,15 ℃时只有3-甲酰葡糖完全不能利用,25 ℃时D-麦芽糖和D-山梨醇完全不能利用,33 ℃糊精和D-麦芽糖完全不能利用。
有研究表明腐败希瓦氏菌能利用葡萄糖、蔗糖作为碳源,而无法利用乳糖和山梨醇,利用甘露醇时利用速度较慢[25],与本研究中腐败希瓦氏菌可利用葡萄糖和蔗糖作为碳源、不能利用山梨醇及利用甘露醇较慢(V稳=0.18)相一致,但本研究中腐败希瓦氏菌可利用α-D-乳糖,且在25 ℃时μmax达到0.06 h-1,λ为5.3 h,这可能是由于33 ℃时温度过高导致分解乳糖的相关酶失活。有人研究中与腐败希瓦氏菌ATCC8071T的16S rDNA序列相似值为97%的中国希瓦氏菌(Shewanella cinica)D14T,可利用D-半乳糖、D-葡萄糖、蔗糖等多种有机物为碳源[27],与本研究中结果类似,只是对半乳糖的利用较差(V稳<0.25)。从能量角度考虑,小分子碳源物质更容易被利用且能耗低,但对于某些微生物类群来说,二糖或低聚糖比单糖更容易利用[11]。
2.2.2 不同温度条件下腐败希瓦氏菌羧酸类的代谢利用分析


图5 不同温度条件下羧酸类AWCD随培养时间的变化
Fig. 5 Changes in AWCD of carboxylic acids during incubation at different temperatures
由图5可知,曲线皆呈现“S”型,5 ℃时μmax为(0.067±0.038)h-1,λ为(29.1±6.0)h;15 ℃时μmax为(0.072±0.020)h-1,λ为(11.6±3.7)h;25 ℃时μmax为(0.087±0.033)h-1,λ为(4.5±1.0)h;33 ℃时只能利用L-苹果酸,μmax为0.02 h-1,λ为7.2 h,5~25 ℃下达到稳定期的时间顺序为25 ℃(15 h)<15 ℃(30 h)<5 ℃(40 h以上)。
5 ℃时能较好利用L-苹果酸和L-乳酸,μmax分别为0.092 h-1和0.085 h-1,λ分别为29.8 h和21.2 h;其次为乙酸和丙酸,μmax分别为0.079 h-1和0.082 h-1,λ为25.2 h和38.6 h;D-苹果酸利用较差,μmax为0.007 h-1,λ为32.5 h。15 ℃时丙酸和乙酸利用较好,μmax分别为0.066 h-1和0.063 h-1,λ为10.1 h和8.5 h;此外,α-酮-丁酸和乙酰乙酸μmax最大(0.121、0.076 h-1),但是其最大AWCD值最小,λ长(18.7、12.4 h),其利用情况不如丙酸和乙酸。25 ℃时,能利用较好丙酸、乙酰乙酸和D-苹果酸,μmax分别为0.121、0.108 h-1和0.085 h-1,λ差异不大,均值为(3.9±0.5)h,最大AWCD值为0.65~0.8;此外利用较好的有α-酮-丁酸和L-苹果酸,μmax分别为0.073 h-1和0.146 h-1,λ为5.1 h和4.9 h;虽然L-苹果酸μmax最大,但其最大AWCD值较小,利用面积较小,所以丙酸等利用情况更好,葡糖酸和糖质酸(0.139、0.077 h-1)与之类似;D-糖醛酸和黏酸利用较差,μmax最大,AWCD值皆较小,导致利用面积较小,利用情况较差。33 ℃时只有L-苹果酸利用较好,μmax为0.02 h-1,λ为7.5 h,虽然其最大AWCD值与25 ℃时L-苹果酸接近,但是其对数期明显较长,导致其利用速率降低。
对17 种羧酸类(D-半乳糖醛酸、D-葡糖酸、D-葡糖醛酸、黏酸、奎宁酸、糖质酸、p-羟基苯乙酸、L-乳酸、柠檬酸、α-酮-戊二酸、D-苹果酸、L-苹果酸、α-酮-丁酸、乙酰乙酸、丙酸、乙酸和甲酸)利用进行分析。5 ℃时p-羟基-苯乙酸和甲酸完全不能利用,15 ℃时黏酸、p-羟基-苯乙酸、柠檬酸和甲酸完全不能利用,25 ℃时D-半乳糖醛酸、p-羟基-苯乙酸、L-乳酸和甲酸完全不能利用,33 ℃时p-羟基-苯乙酸、L-乳酸、α-酮-丁酸、丙酸和甲酸完全不能利用。乐毅全等[25]关于腐败希瓦氏菌的脱色实验表明乙酸、丙酸和丁酸是该菌较理想的碳源,而草酸、柠檬酸和戊酸则不能被该菌用于降解染料,本研究中乙酸和丙酸在5~25 ℃利用较好,而柠檬酸仅在25 ℃时利用较好。本研究结果与上述研究中报道的腐败希瓦氏菌对碳源的利用类似。
2.2.3 不同温度条件下腐败希瓦氏菌氨基酸类的代谢利用分析

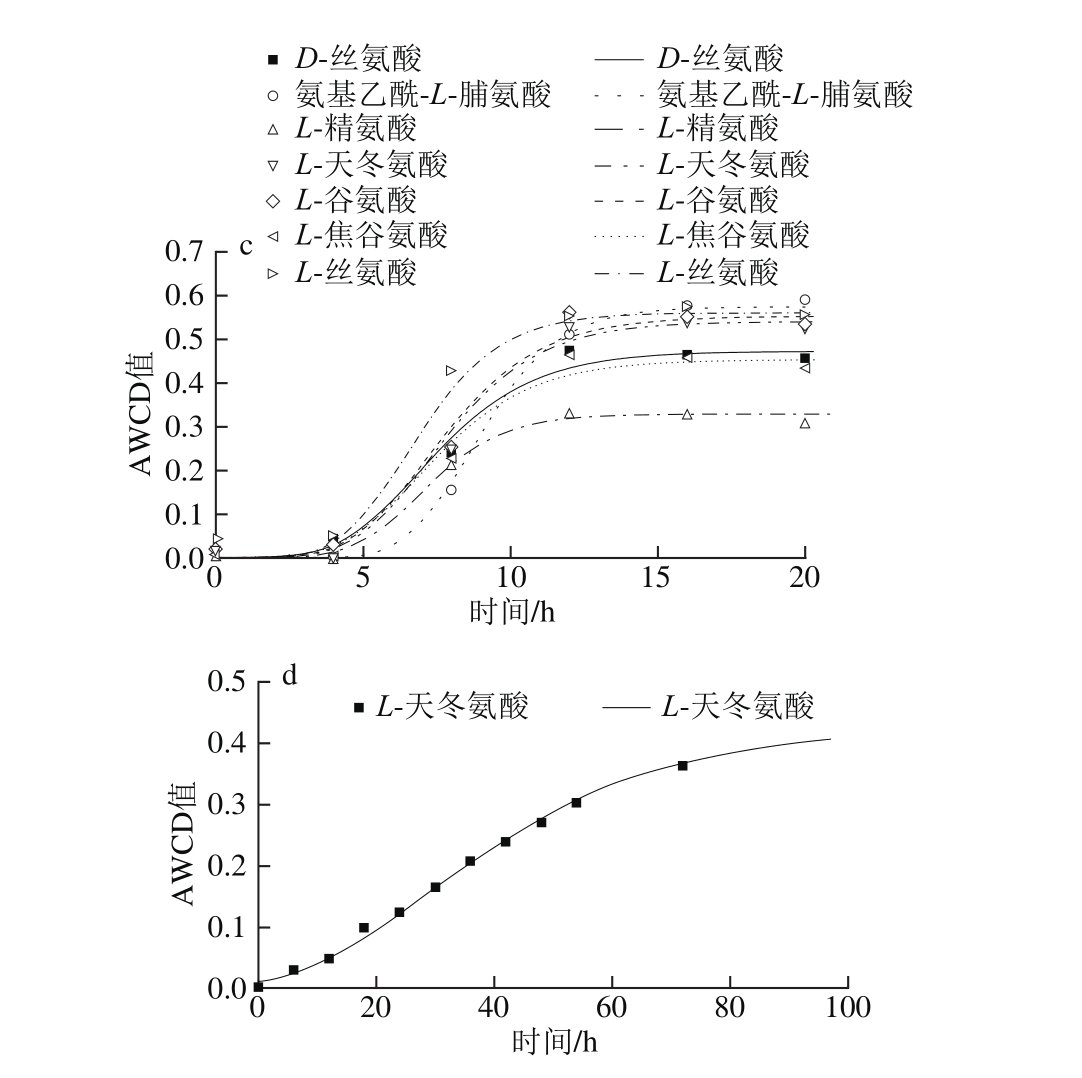
图6 不同温度条件下氨基酸类AWCD随培养时间的变化
Fig. 6 Changes in AWCD of amino acids during incubation at different temperatures
由图6可知,曲线皆呈现“S”型。5 ℃时只有L-丝氨酸利用较好,μmax为0.109 h-1,λ为29.0 h;15 ℃时L-丝氨酸和氨基乙酰-L-脯氨酸利用较好,μmax分别为0.142 h-1和0.005 h-1,λ分别为11.2 h和1.2 h,但两者达到平稳期的时间差距较大,L-丝氨酸在20 h左右达到稳定期,氨基乙酰-L-脯氨酸在70 h左右达到平稳期。25 ℃时利用较好的有氨基乙酰-L-脯氨酸、L-丝氨酸、L-天冬氨酸和L-谷氨酸,其μmax分别为0.144、0.13、0.103 h-1和0.102 h-1,λ分别为6.9、4.6、5.1 h和4.9 h;其次利用较好的有L-焦谷氨酸和D-丝氨酸,μmax分别为0.085 h-1和0.082 h-1,λ皆为4.6 h。33 ℃仅有L-天冬氨酸利用较好,μmax为0.007 h-1,λ为7.1 h,对数期很长,约90 h达到平稳期。
对10 种氨基酸(D-天冬氨酸、D-丝氨酸、氨基乙酰-L-脯氨酸、L-丙氨酸、L-精氨酸、L-天冬氨酸、L-谷氨酸、L-焦谷氨酸、L-丝氨酸、γ-氨基-丁酸)利用分析表明,腐败希瓦氏菌只在5~15 ℃时完全不能利用天冬氨酸和D-丝氨酸,33 ℃时氨基乙酰-L-脯氨酸、L-丙氨酸、L-天冬氨酸和L-丝氨酸完全不能利用。丙氨酸利用较差(AWCD<0.25),天冬氨酸在25~33 ℃利用较好。研究显示,腐败希瓦氏菌是变形细菌γ紫色家族的第一个利用丝氨酸途径的成员,在其适应厌氧环境的能力起重要作用[26]。
2.2.4 不同温度条件下腐败希瓦氏菌脂肪酸/脂类、胺/酰胺类及其他的代谢利用分析
由图7可知,曲线皆呈现“S”型,5 ℃和33 ℃时λ比较接近,均值为(26.1±2.3)h(除5 ℃溴-丁二酸λ为40.2 h外),但5 ℃ μmax(0.114±0.070)h-1远大于33 ℃时(μmax≤0.04 h-1)。15 ℃和25 ℃时平均μmax比较接近,分别为(0.120±0.063)h-1和(0.101±0.039)h-1,但15 ℃¯λ约为25 ℃时的2 倍,分别为(11.0±1.2)h和(6.3±2.4)h。且不同温度下达到平稳期的时间也不同,顺序依次为25 ℃(12 h)<15 ℃(15 h)<5 ℃(35 h)<33 ℃(40 h以上)。

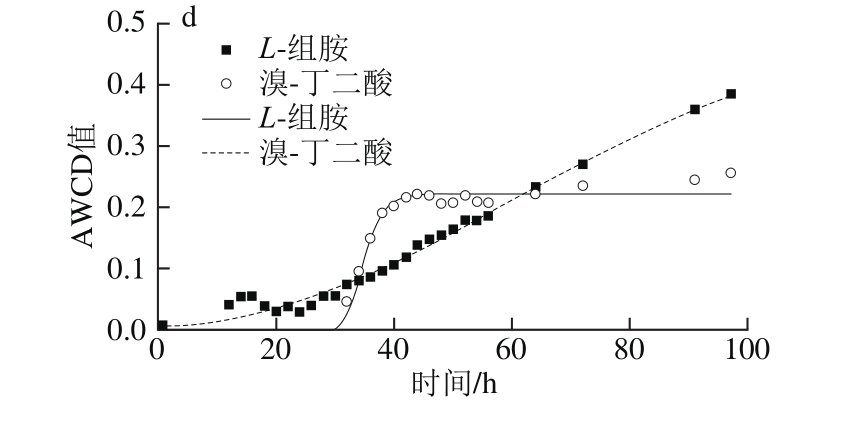
图7 不同温度条件下脂肪酸/脂类、胺/酰胺类及其他AWCD随培养时间的变化
Fig. 7 Changes in AWCD of fatty acids/lipids, amines/amides and other substances during incubation at different temperatures
5 ℃时能较好利用明胶和肌苷,μmax为0.234 h-1和0.19 h-1,λ分别为28.0 h和27.7 h;15 ℃时利用较好的为明胶和丙酮酸甲酯,μmax为0.212 h-1和0.208 h-1,λ为11.8 h和12.2 h,其次为N-乙酰-β-D-甘露糖胺、D-乳酸甲酯和吐温40,μmax分别为0.113、0.123 h-1和0.116 h-1,λ分别为10.9、9.5 h和12.5 h;25 ℃时利用较好的有吐温40和肌醇,μmax为0.188、0.163 h-1和0.131 h-1,λ为6.0 h和7.4 h,此外D-果糖-6-磷酸μmax较大(0.163 h-1),但λ较长(16.6 h),故利用差于吐温40和肌醇。33 ℃只可利用L-组胺和溴-丁二酸,μmax小,λ长。
对6 种胺/酰胺类(N-乙酰-D-葡糖胺、N-乙酰-β-D-甘露糖胺、N-乙酰-D-半乳糖胺、N-乙酰神经氨酸、L-组胺和葡糖醛酰胺),6种脂肪酸/脂类(丙酮酸甲酯、吐温40、α-羟基-丁酸、β-羟基-D,L丁酸、L-半乳糖醛酸内酯和D-乳酸甲酯),7种其他类(甘油、D-葡萄糖-6-磷酸、D-果糖-6-磷酸、明胶、溴-丁二酸、肌苷和肌醇)利用分析表明,5~15 ℃时,甘油、D-果糖-6-磷酸、葡糖醛酰胺和β-羟基-D,L丁酸完全不能利用,33 ℃时N-乙酰-D-葡糖胺、肌苷、明胶、葡糖醛酰胺、丙酮酸甲酯、D-乳酸甲酯和吐温40完全不能利用。α-羟基-丁酸在低温(5 ℃)和高温时(33 ℃)都不能利用,溴-丁二酸只在15 ℃不能利用,L-半乳糖醛酸内酯在高温(33 ℃)时可轻微利用(AWCD<0.25)。研究表明希瓦氏菌能够分解明胶,利用吐温40、肌苷和甘油等[28-29],明胶和壳聚糖等常作成复合膜用于水产品保鲜。同时,希瓦氏菌属代谢产生较多脂肪酶,使用微生物分泌的脂肪酶有专一性强、活性高、副产物少、成本低和环保等优点[30]。因此,探究腐败希瓦氏菌对明胶等物质的利用情况,可为进深入探究其代谢机理及环境保护等提供理论依据。
本研究利用多孔平板技术探究了5、15、25 ℃和33 ℃条件下,腐败希瓦氏菌对71 种碳源的利用能力及不同温度下其生长动力学,为深入研究腐败希瓦菌能量代谢及作用机制提供一定理论支持。
25 ℃时总体碳源利用能力和活性最强,15 ℃时次之,5 ℃时活性降至约25 ℃的 1/6,33 ℃时活性最弱,5~25 ℃范围内,温度和
1/6,33 ℃时活性最弱,5~25 ℃范围内,温度和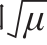 、 呈现良好的线性关系。
、 呈现良好的线性关系。
5~33 ℃时糖类和羧酸类利用率较高,平均值分别为(30±1.4)%、(29±2.7)%。5~33 ℃氨基酸类、脂肪酸/脂类和其他类碳源利用比例随温度变化影响较大。温度对腐败希瓦氏菌不同类型碳源的利用情况有较大影响:相同温度下各类碳源λ变化不明显,但μmax变化明显。
腐败希瓦氏菌碳源代谢情况为:糖类中,5℃时糊精和D-麦芽糖利用较好;15 ℃时糊精和α-D-葡萄糖利用较好;25℃时D-阿拉伯醇、水苏糖利用较好;33 ℃普遍利用较差。羧酸类中,5 ℃时L-苹果酸和L-乳酸利用较好;15 ℃时丙酸和乙酸利用较好;25 ℃时丙酸、乙酰乙酸和D-苹果酸利用较好;33 ℃时L-苹果酸利用较好。氨基酸类中,5 ℃时L-丝氨酸利用较好;15 ℃时L-丝氨酸和氨基乙酰-L-脯氨酸利用较好;25 ℃时氨基乙酰-L-脯氨酸、L-丝氨酸、L-天冬氨酸和L-谷氨酸利用较好;33 ℃时L-天冬氨酸利用较好。脂肪酸/脂类、胺/酰胺类及其他类中,5 ℃时明胶和肌苷利用较好;15 ℃时明胶、丙酮酸甲酯利用较好;25 ℃时吐温40和肌醇利用较好;33 ℃时L-组胺和溴-丁二酸利用较好。
参考文献:
[1] SCHELEGUEDA L I, ZALAZAR A L, GLIEMMO M F, et al.Inhibitory effect and cell damage on bacterial flora of fish caused by chitosan, nisin and sodium lactate[J]. International Journal of Biological Macromolecules, 2016, 83: 396-402. DOI:10.1016/j.ijbiomac.2015.11.033.
[2] 郭全友, 修艳辉, 姜朝军, 等. 环境因子对大黄鱼腐败希瓦氏菌生长影响的计数法分析[J]. 农业机械学报, 2016, 47(10): 250-257; 317.DOI:10.6041/j.issn.1000-1298.2016.10.031.
[3] ZHAO A, ZHU J, YE X, et al. Inhibition of biof i lm development and spoilage potential of Shewanella baltica by quorum sensing signal in cell-free supernatant from Pseudomonas fl uorescens[J]. International Journal of Food Microbiology, 2016, 230: 73-80. DOI:10.1016/j.ijfoodmicro.2016.04.015.
[4] LÓPEZ A C, BOSH B E, CHAMORRO B I, et al. Peritonitis by Shewanella putrefaciens: apropos of a case[J]. Nefrologia, 2016, 36(4):444-445. DOI:10.1016/j.nefroe.2016.06.008.
[5] 修艳辉, 郭全友, 姜朝军. pH、水分活度和NaCl对腐败希瓦氏菌生长/非生长界限及生长动力学参数的影响[J]. 现代食品科技,2016(6): 156-162. DOI:10.13982/j.mfst.1673-9078.2016.6.025.
[6] 王慧敏, 朱军莉, 陆海霞, 等. 茶多酚抑制腐败希瓦氏菌机理研究[J]. 茶叶科学, 2014, 34(2): 149-155. DOI:10.3969/j.issn.1000-369X.2014.02.009.
[7] NYSTR M T, GUSTAVSSON N. Maintenance energy requirement:what is required for stasis survival of Escherichia coli?[J]. Biochimica et Biophysica Acta, 1998, 1365(1/2): 225-231. DOI:10.1016/S0005-2728(98)00072-3.
[8] 周丽英, 林素兰, 李艺, 等. 水稻根际耐镉细菌碳源代谢功能分析[J]. 中国生态农业学报, 2012, 20(8): 1083-1087. DOI:10.3724/SP.J.1011.2012.01083.
[9] 柏中中, 许婷婷, 何小丹, 等. 利用Biolog系统进行乳酸生产菌代谢能力的快速分析[J]. 食品与生物技术学报, 2009, 28(3): 347-351.DOI:10.3321/j.issn:1673-1689.2009.03.013.
[10] 陈玉梅, 常忠义, 王疆元, 等. 乳酸钠和葡萄糖对薛氏丙酸杆菌生长及代谢物抑菌活性的影响[J]. 西北农林科技大学学报(自然科学版),2007, 35(2): 178-182. DOI:10.3321/j.issn:1671-9387.2007.02.036.
[11] 刘文, 杨渐, 吴耿, 等. 青藏高原北部湖泊沉积物中基于不同碳源可培养细菌多样性[J]. 盐湖研究, 2016(2): 92-101.
[12] 曹永昌, 谭向平, 和文祥, 等. 秦岭地区不同林分土壤微生物群落代谢特征[J]. 生态学报, 2016(10): 2978-2986. DOI:10.5846/stxb201411222316.
[13] SPERANZA B, BEVILACQUA A, CONTE A, et al. Use of desirability approach to predict the inhibition of Pseudomonas fluorescens, Shewanella putrefaciens and Photobacterium phosphoreum in fi sh fi llets through natural antimicrobials and modif i ed atmosphere packaging[J]. Food and Bioprocess Technology, 2012,6(9): 2319-2330. DOI:10.1016/j.ajic.2003.10.004.
[14] 郭全友, 何木, 李保国, 等. 大黄鱼腐败细菌鉴定及PLFAs初级模型的建立[J]. 现代食品科技, 2015, 31(12): 227-234. DOI:10.13982/j.mfst.1673-9078.2015.12.034.
[15] BRAUN P, SUTHERLAND J P. Predictive modelling of growth and enzyme production and activity by a cocktail of Pseudomonas spp.,Shewanella putrefaciens and Acinetobacter sp.[J]. International Journal of Food Microbiology, 2003, 86(3): 271-282. DOI:10.1016/S0168-1605(02)00564-0.
[16] 郑华, 陈法霖, 欧阳志云, 等. 不同森林土壤微生物群落对Biolog-GN板碳源的利用[J]. 环境科学, 2007, 1(5): 1126-1130. DOI:10.3321/j.issn:0250-3301.2007.05.034.
[17] 李志斐, 王广军, 谢骏, 等. 草鱼养殖池塘生物膜固着微生物群落碳代谢Biolog分析[J]. 水产学报, 2014, 38(12): 1985-1995. DOI:10.3724 1231.2014.49435.
[18] VERSCHUERE L, FIEVEZ V, VOOREN L V, et al. The contribution of individual populations to the Biolog pattern of model microbial communities[J]. Fems Microbiology Ecology, 1997, 24(4): 353-362.DOI:10.1016/s0168-6496(97)00076-7.
[19] 王凯, 叶可萍, 白红武, 等. 冷却猪肉中单增李斯特菌的定量暴露评估[J]. 食品科学, 2016, 37(11): 79-83. DOI:10.7506/spkx1002-6630-201611014.
[20] 周晏, 周国燕, 徐斐, 等. 单增李斯特菌在生食鱼片中生长模型的建立[J]. 食品科学, 2015, 36(15): 157-162. DOI:10.7506/spkx1002-6630-201515029.
[21] 刘亚兵, 何腊平, 高泽鑫, 等. 基于假单胞菌生长模型预测冷却牛肉的货架期[J]. 中国酿造, 2017, 36(8): 114-119. DOI:10.11882/j.issn.0254-5071.2017.08.025.
[22] 黄丹阳, 曹慧, 徐斐, 等. 米饭中蜡样芽孢杆菌生长模型的建立[J]. 上海预防医学, 2017, 29(6): 431-434. DOI:10.19428/j.cnki.sjpm.2017.06.004.
[23] 桂萌, 章志超, 刘恩歧, 等. 托盘包装鲟鱼中腐败希瓦氏菌和总菌的生长动力学及货架期预测[J]. 食品工业科技, 2016, 37(20): 331-335;40. DOI:10.13386/j.issn1002-0306.2016.20.057.
[24] 周桂香, 陈林, 张丛志, 等. 温度水分对秸秆降解微生物群落功能多样性影响[J]. 土壤, 2015, 47(5): 911-918. DOI:10.13758/j.cnki.tr.2015.05.016.
[25] 乐毅全, 王士芬, 朱核光. 脱色菌腐败希瓦氏菌的分离及其脱色性能研究[J]. 环境科学与技术, 2004, 27(3): 14-15. DOI:10.3969/j.issn.1003-6504.2004.03.006.
[26] XU J, HE W, WANG Z, et al. A comparison of molecular biology mechanism of Shewanella putrefaciens between fresh and terrestrial sewage waste water[J]. Frontiers in Bioengineering and Biotechnology,2016, 4: 86. DOI:10.3389/fbioe.2016.00086.
[27] 许玫英, 郭俊, 钟小燕, 等. 一个降解染料的希瓦氏菌新种: 中国希瓦氏菌[J]. 微生物学报, 2004, 44(5): 561-566. DOI:10.3321/j.issn:0001-6209.2004.05.001.
[28] IVANOVA E P, NEDASHKOVSKAYA O I, ZHUKOVA N V,et al. Shewanella waksmanii sp. nov., isolated from a sipuncula(Phascolosoma japonicum)[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(Pt 5): 1471-1477. DOI:10.1099/ijs.0.02630-0.
[29] IVANOVA E P, SAWABE T, HAYASHI K, et al. Shewanella fi delis sp.nov., isolated from sediments and sea water[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(Pt 2): 577-582.DOI:10.1099/ijs.0.02198-0.
[30] 卜蒙蒙. 我国近海海藻表面附着细菌的多样性及其产酶、抑菌能力研究[D]. 青岛: 青岛科技大学, 2015.
Carbon Utilization Prof i le and Growth Kinetics of Shewanella putrefaciens Isolated from Spoiling Fish
XIU Yanhui1,2, GUO Quanyou1,*, HAN Chengyi3, CHEN Qingrong4
(1. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;3. Ningde Yifeng Aquatic Product Co. Ltd., Ningde 352100, China;4. Ningde Jiaocheng Aquatic Product Technology Promotion Department, Ningde 352100, China)
Abstract:In order to investigate the carbon source utilization pro fi le of Shewanella putrefaciens at different temperatures,a kinetic model describing the growth of S. putrefaciens in multi-well plates at 5, 15, 25 and 33 ℃ was developed using modified Gompertz equation and the kinetic parameters maximum specific growth rate (μmax) and lag phase duration (λ)were obtained. Moreover, based on average well color development (AWCD) and utilization area, the carbon utilization rate of S. putrefaciens was analyzed. The results showed that S. putrefaciens presented the highest μmaxand lowest λ at 25 ℃.Moreover, at this temperature, the highest carbon utilization and cell viability were observed followed by growth at 15 ℃;the cell viability at 5 ℃ was one-sixth of that at 25 ℃, and the lowest cell viability was found at 33 ℃. Temperature in the range of 5–25 ℃ exhibited a good linear relationship with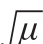 and
and The utilization rates of of carbohydrates and carboxylic acids were 30% and 29% at 5–33 ℃, respectively. Carbohydrates (dextrin, D-maltose, α-D-glucose, D-arabinol and stachyose), carboxylic acids (L-malic acid, L-lactic acid and acetoacetic acid), amino acids (L-serine, amino-acetyl-L-proline, L-aspartic acid and L-glutamic acid), fatty acids/lipids, amines/amides and other substances (gelatin, methyl pyruvate, Tween 40 and L-histamine) could be better utilized by the strain.
The utilization rates of of carbohydrates and carboxylic acids were 30% and 29% at 5–33 ℃, respectively. Carbohydrates (dextrin, D-maltose, α-D-glucose, D-arabinol and stachyose), carboxylic acids (L-malic acid, L-lactic acid and acetoacetic acid), amino acids (L-serine, amino-acetyl-L-proline, L-aspartic acid and L-glutamic acid), fatty acids/lipids, amines/amides and other substances (gelatin, methyl pyruvate, Tween 40 and L-histamine) could be better utilized by the strain.
Keywords:Shewanella putrefaciens; carbon; growth kinetics; multi-well plate
DOI:10.7506/spkx1002-6630-201802013
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2018)02-0080-08
引文格式:修艳辉, 郭全友, 韩承义, 等. 鱼源腐败希瓦氏菌碳源利用及动力学分析[J]. 食品科学, 2018, 39(2): 80-87.
DOI:10.7506/spkx1002-6630-201802013. http://www.spkx.net.cn
收稿日期:2017-01-17
基金项目:国家自然科学基金面上项目(31371867);上海市自然科学基金项目(16ZR1444900);
中国水产科学研究院东海水产研究所基本科研业务费项目(2014G02;2011M04)
第一作者简介:修艳辉(1990—),女,硕士研究生,研究方向为水产品加工与安全保障。E-mail:xiuyanhui2014@163.com*通信作者简介:郭全友(1974—),男,副研究员,博士,研究方向为水产品加工与安全保障。E-mail:dhsguoqy@163.com
XIU Yanhui, GUO Quanyou, HAN Chengyi, et al. Carbon utilization prof i le and growth kinetics of Shewanella putrefaciens isolated from spoiling fi sh[J]. Food Science, 2018, 39(2): 80-87. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802013. http://www.spkx.net.cn