表1 Plackett-Burman试验设计因素与水平
Table 1 Coded levels and corresponding actual levels of factors used in Plackett-Burman design

王 灿,莫湘涛,张 峰,吴柳娟,李 躺,夏立秋*
(湖南师范大学生命科学学院,微生物分子生物学湖南省重点实验室,淡水鱼类发育生物学国家重点实验室,湖南 长沙 410081)
摘 要:为获得侵袭性抗肿瘤靶向工程菌株EcNA高菌体浓度的培养基配方,在单因素试验的基础上,通过Plackett-Burman试验筛选出对菌体浓度影响最显著的因素为酵母抽提物、K2HPO4用量,对显著影响因素进行中心组合试验响应面分析。结果表明最佳培养基成分为:可溶性淀粉2 g/L、酵母抽提物50.3 g/L、K2HPO414.26 g/L、KH2PO43 g/L、MgSO40.3 g/L、微量元素母液2 mL/L、接种量3%。发酵后溶液中菌体OD600nm达到7.602,菌体生物量达到2.96×109CFU/mL,比优化前提高了78.3%。以冻干保护剂在冷冻干燥过程中对工程菌株的保护效果为研究对象,通过正交试验得到制成菌粉的最佳保护剂配方为脱脂乳14.25 g/100 mL、蔗糖3 g/100 mL、抗坏血酸钠3 g/100 mL,优化后菌体冻干粉存活率可达86.32%,利于制成延长贮存期的口服菌粉胶囊。
关键词:抗肿瘤靶向工程菌;高密度发酵;响应面分析法;冻干保护剂;菌粉制剂
近年来,细菌靶向治疗肿瘤已成为国际研究的热点,利用沙门菌工程菌进行肿瘤治疗[1]、双歧杆菌作为靶向治疗载体[2]、产气荚膜梭菌肠毒素作为潜在肿瘤靶向药物[3]等细菌靶向治疗肿瘤的研究都有相关报道。大肠杆菌Nissle 1917(Escherichia coli Nissle 1917,EcN)作为肠道益生菌而被广泛使用[4-5],具有治疗传染性腹泻尤其是婴幼儿腹泻[6]、防止新生儿消化道内病原菌定殖[7-8]、缓解炎症性肠炎[9-10]、调节免疫[11]等功能。通过绿色荧光蛋白追踪技术,发现EcN对实体肿瘤具有很好的靶向性[12],EcN不仅可以在肿瘤富集区聚集,还可以在肿瘤低氧区和坏死区定植,受肿瘤大小及肿瘤微环境等因素的限制较小。EcN进行遗传改造得到的EcNA菌株,对B16黑色素瘤细胞和4T1乳腺癌细胞具有很好的侵袭活性,其表达的天青蛋白对B16黑色素瘤细胞、4T1乳腺癌细胞和HCT-116结肠癌细胞具有很强的靶向性抑制作用,因此EcNA具有显著的靶向抗肿瘤效果[13]。基于上述特性,本室构建的能分泌天清蛋白的抗肿瘤靶向工程菌株EcNA,呈现出潜在的临床应用价值[14]。
本研究采用响应面法优化EcNA菌株的培养基配方,既有利于菌株的高密度发酵、提高工程菌菌体浓度,又能推迟菌体老化时间、延缓抗肿瘤靶向工程菌株的功能,同时还能减少培养体积,缩短生产周期,减少设备投资从而降低生产成本。工程菌EcNA在原始发酵液状态下不宜直接服用,同时需要解决短存放期与货架期等问题。采用真空冷冻干燥技术将工程菌制成固体菌粉,后续加工制成口服胶囊剂,有利于其运输及货架期的延长。在冷冻干燥过程中添加保护剂,可以有效改变冷冻干燥时菌体细胞所处的物理、化学环境,以此减轻或防止冷冻干燥对菌体细胞的损害,使工程菌最大程度保持原有的理化特性和生物活性,从而利于保持抗肿瘤菌体药物的功能作用。研究表明,单一保护剂保护效果有限[15-17],致使其保护作用不理想,研制复合型保护剂是提高菌体存活率的重要方法[18]。本研究采用抗肿瘤靶向工程菌高密度发酵,并优化菌体粉剂保护剂配方,期望得到显著提高菌体功能及其存活率的复合型保护剂。
EcN工程菌EcNA为本实验室构建表达Azurin的工程菌[13],由本实验室保存。
K2HPO4、KH2PO4、MgSO4、NaCl、可溶性淀粉、蔗糖、甘露醇(均为分析纯)、葡聚糖(生化试剂)国药集团化学试剂有限公司;抗坏血酸钠(分析纯) 上海笛柏生物科技有限公司;海藻糖(分析纯) 美国Sigma公司;胰蛋白胨、酵母抽提物、琼脂粉 英国Oxoid公司;脱脂乳 内蒙古伊利实业集团股份有限公司。
Format 900 series超低温冰箱 美国Thermo公司;SmartspecTM3000分光光度计 美国Bio-Rad公司;ZWY-C2112培养振荡器 上海智城分析仪器制造有限公司;FD-1干燥机 北京德天佑科技发展有限公司。
1.3.1 种子复壮
取菌种保藏液10 μL,划线涂布于含有氯霉素和卡那霉素的LB平板上,置于37 ℃培养箱培养18 h。
1.3.2 种子培养
从复壮的LB平板上挑取单菌落接种于20 mL的LB液体培养基中,在37 ℃、170 r/min的恒温振荡器上培养10 h。
1.3.3 发酵培养
将种子液以3%(V/V)的接种量接入装有20 mL发酵培养基的三角瓶中,置于37 ℃恒温培养振荡器120 r/min振荡培养16 h。
1.3.4 菌体浓度的测定
采用光密度(optical density,OD)表征菌体浓度,即从培养瓶中取菌液稀释适当倍数后,用分光光度计在600 nm波长处测定其OD600nm,重复3 次。
1.3.5 菌粉的制备
将发酵液转移至离心管中,6 000 r/min离心10 min,收集菌体。加入等体积生理盐水洗涤,6 000 r/min离心10 min,收集菌体,重复洗涤3次。对洗涤后的菌体收集物,加入等体积保护剂并搅拌均匀,置于-80 ℃冰箱预冻2 h,随后立即转入超低温真空冷冻干燥机冻成干粉状。
1.3.6 菌体存活率的测定
向菌粉中加入与冻干前相等体积的生理盐水进行复水,再稀释涂布活菌计数,测定冻干存活率,重复3 次。
1.3.7 培养基组分及菌粉配方优化
1.3.7.1 发酵培养基组分单因素试验
分别加入4 g/L的可溶性淀粉、蔗糖、葡萄糖、麦芽糖和甘露醇至酵母抽提物15 g/L、MgSO40.25 g/L、K2HPO42.3 g/L、KH2PO41.5 g/L、微量元素母液2 mL/L、接种量2%的无碳源培养基中,筛选出较适发酵碳源;分别加入25 g/L的酵母抽提物、牛肉膏、胰蛋白胨、大豆蛋白胨和棉籽粉至可溶性淀粉4 g/L、MgSO40.25 g/L、K2HPO42.3 g/L、KH2PO41.5 g/L、微量元素母液2 mL/L、接种量2%的无氮源培养基中,筛选出较适氮源。参考重组大肠杆菌发酵条件优化的研究[19-21],选择磷酸盐、MgSO4、微量元素等作为初始发酵培养基组成部分,然后进行单因素试验确定各因素的较适范围。
1.3.7.2 Plackett-Burman试验设计
采用Plackett-Burman试验设计,从可溶性淀粉、酵母抽提物、K2HPO4、KH2PO4、MgSO4、微量元素母液用量、接种量中筛选出对工程菌生物量有显著性影响的因素,每个因素取高低两个水平(1,-1),以OD600nm作为目标值。Plackett-Burman试验设计的因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Coded levels and corresponding actual levels of factors used in Plackett-Burman design

1.3.7.3 中心组合试验设计
在Plackett-Burman试验结果的基础上,选择酵母抽提物和KH2PO4这两种培养基组分进行中心组合试验优化。中心组合试验设计因素与水平见表2。
表2 中心组合试验设计因素与水平
Table 2 Coded levels and corresponding actual levels of factors used in central composite design

1.3.7.4 冻干保护剂配方优化
根据文献[13-15],在菌粉制作的过程中,选取抗坏血酸钠、葡聚糖、海藻糖、甘露醇、脱脂乳、蔗糖6 种冻干保护剂进行单因素试验,得到各因素的较适质量浓度范围,试验设计如表3所示。
表3 冻干保护剂单因素试验设计
Table 3 Levels of factors used in one-factor-at-a-time design
根据单因素试验结果,选取抗坏血酸钠、脱脂乳和蔗糖作为复合冻干保护剂组分。为获得复合保护剂最佳保护效果,最后通过正交试验设计得到各组分的最适用量。
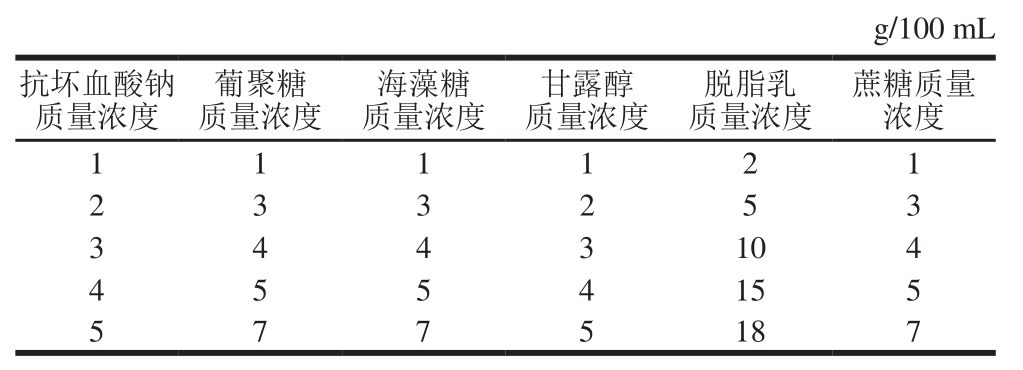
2.1.1 碳源及氮源的筛选结果
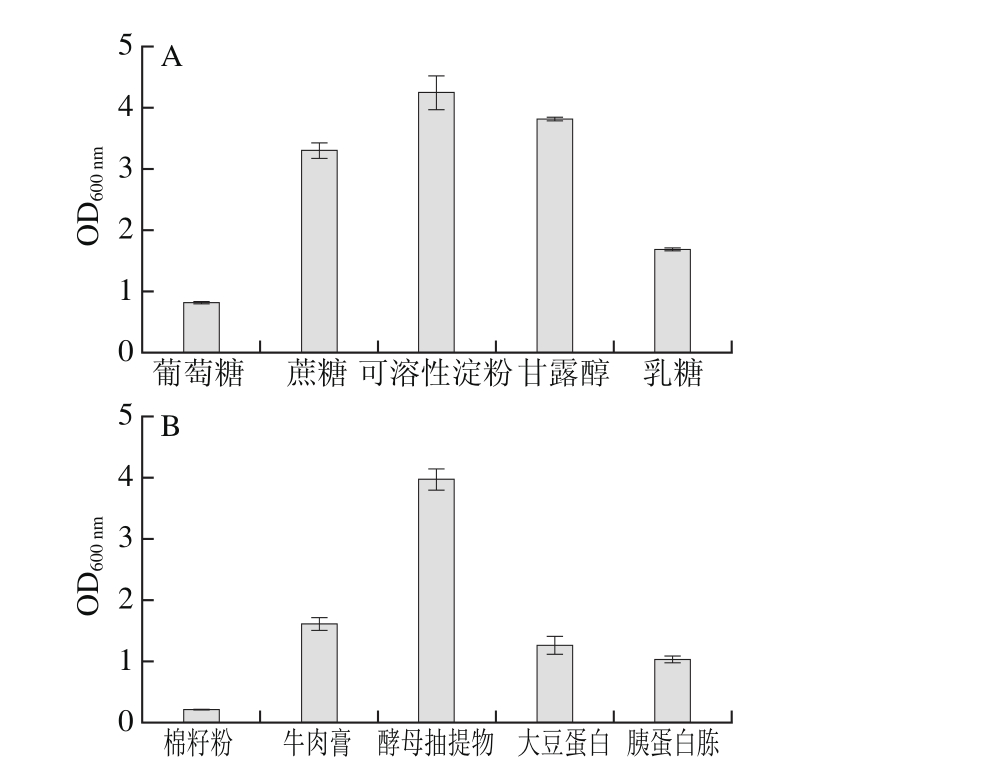
图1 不同碳源(A)及氮源(B)对工程菌EcNA菌体浓度的影响
Fig. 1 Effects of different carbon sources (A) and nitrogen sources (B)on EcNA concentration
由图1A可知,在发酵抗肿瘤靶向工程菌EcNA的过程中,培养基内加入可溶性淀粉对菌体浓度提高的效果最显著。从图1B可以看出,酵母抽提物是几种主要氮源中最适合EcNA发酵的氮源。故选择可溶性淀粉与酵母抽提物进行下一步的试验。
2.1.2 培养基组分单因素试验结果
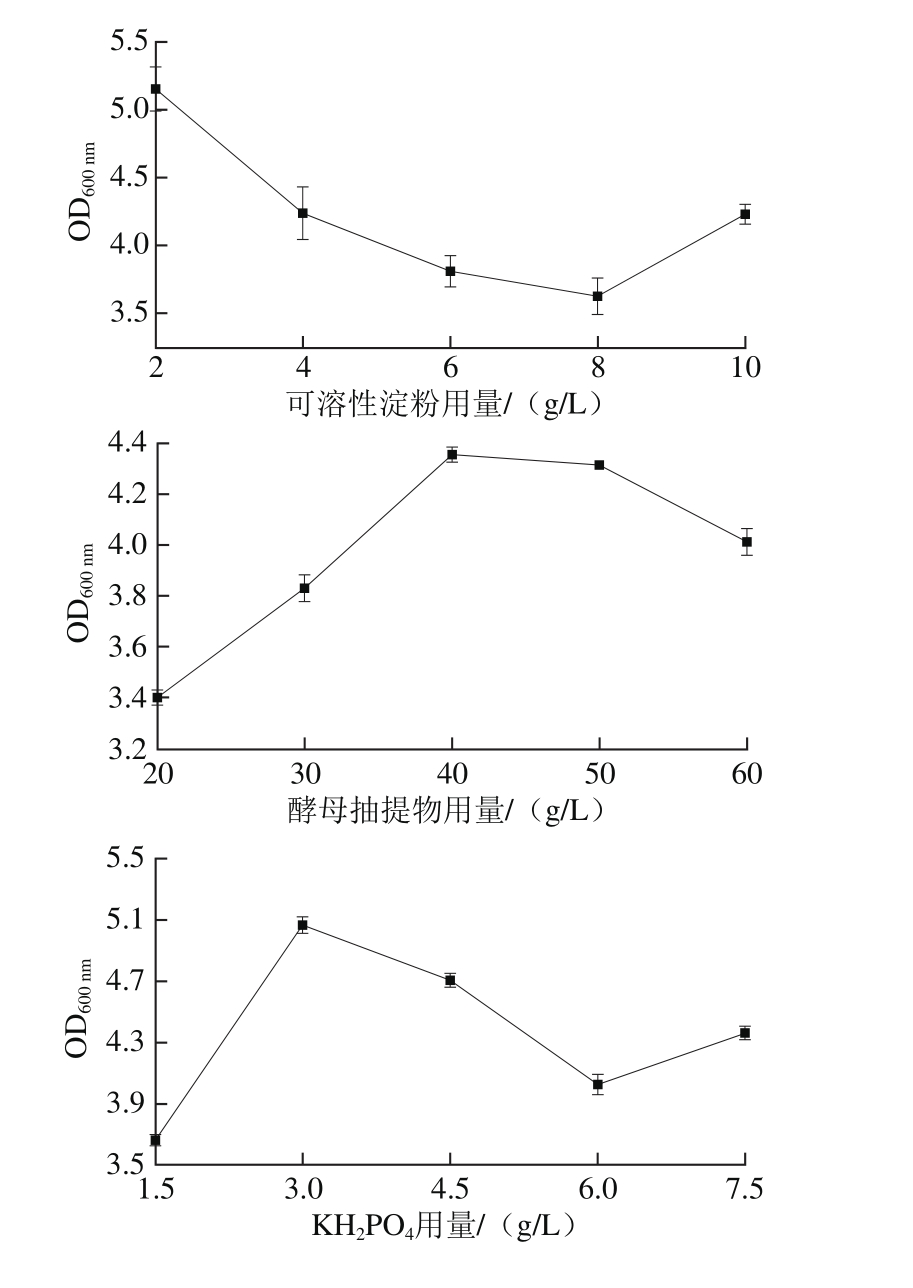
图2 培养基中各组分用量对工程菌EcNA菌体浓度的影响
Fig. 2 Effects of different medium components on EcNA concentration
由图2可知,随酵母抽提物、KH2PO4、K2HPO4、MgSO4、微量元素母液用量及接种量的升高,发酵后的菌体浓度均有上升。其中随着可溶性淀粉用量的升高,发酵后的菌体浓度呈下降趋势,当可溶性淀粉质量浓度超过8 g/L时,菌体浓度开始回升,但低于2 g/L时的菌体浓度,综合考虑发酵成本,选择2 g/L作为可溶性淀粉的较适质量浓度。
低质量浓度时,OD600nm随酵母抽提物、KH2PO4、K2HPO4、MgSO4、微量元素用量及接种量的升高而增加,用量过高后,OD600nm开始下降。加入高浓度的酵母抽提物,培养基的黏度增大,不利于工程菌的发酵。过量的磷酸盐会促进乙酸等发酵抑制物的生成,阻碍正常发酵。高质量浓度的MgSO4会使菌体内的渗透压升高,不利于工程菌的生长。而高浓度含重金属离子的微量元素会导致菌体损伤,影响高密度发酵。从图2可知,40 g/L酵母抽提物、3 g/L KH2PO4、12 g/L K2HPO4、0.3 g/L MgSO4、2 mL/L微量元素母液、3%接种量均能得到较高的OD600nm值。
表4 Plackett-Burman试验设计及结果
Table 4 Plackett-Burman design with experimental results

利用Design-Expert 8.06软件对表4的结果进行主效应分析,得到表5所示的Plackett-Burman试验中各因素回归分析结果。由表5可知,在试验设计的7 种考察因素中,酵母抽提物用量的P值小于0.01,对工程菌株OD600nm的影响是极显著的,且E为正值,说明酵母抽提物在高水平时对该菌株高密度发酵有利。K2HPO4的P值小于0.05,对工程菌株OD600nm的影响是显著的,其E为负值,说明K2HPO4用量在低水平时利于工程菌的发酵。酵母抽提物和K2HPO4用量为发酵培养基的两个重要影响因素。
表5 Plackett-Burman试验中各因素的回归分析
Table 5 Regression analysis of Plackett-Burman design
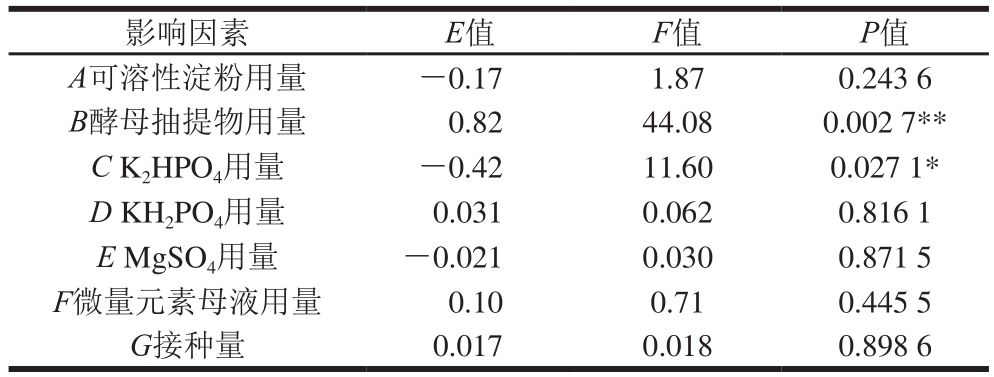
注:**. P<0.01,差异极显著;*. P<0.05,差异显著。下同。
根据Plackett-Burman试验筛选出来的显著影响因素酵母抽提物和K2HPO4用量,对这两个因素编码并进行中心组合试验,其设计如表6所示。以培养16 h后工程菌株发酵液的OD600nm为响应值。试验中各组均设置3 个平行,中心组合试验结果见表6。
通过方差分析,可得到二次多项式回归方程为:Y=7.46+0.07X1-0.16X2+0.4X1X2-2.08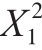 -1.07
-1.07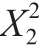 。由表7可知,该模型的F值为93.14,P值小于0.000 1,说明该模型是显著的。模型的失拟项不显著,表明该模型稳定性较好。模型的决定系数R2为0.985 2,说明模型对响应值的预测是准确的。相关调整系数
。由表7可知,该模型的F值为93.14,P值小于0.000 1,说明该模型是显著的。模型的失拟项不显著,表明该模型稳定性较好。模型的决定系数R2为0.985 2,说明模型对响应值的预测是准确的。相关调整系数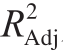 为0.974 6,说明97.46%的数据可以由这个方程解释。因此,该二次方程能够较好地拟合真实的响应面,可用来预测工程菌株菌体浓度的变化。
为0.974 6,说明97.46%的数据可以由这个方程解释。因此,该二次方程能够较好地拟合真实的响应面,可用来预测工程菌株菌体浓度的变化。
表6 中心组合试验设计及结果
Table 6 Central composite design with experimental results
表7 中心组合试验中各因素的回归分析
Table 7 Regression analysis of central composite design
等高线图中两因素作用构成的图形越椭圆,交互作用越强,由图3可知,酵母抽提物和K2HPO4在工程菌EcNA的发酵过程中存在交互作用。由响应面图可以看出,该模型存在极大值。对所得二次多项式回归方程取一阶偏导等于零,联立方程求解可得:当酵母抽提物用量50.3 g/L、K2HPO4用量14.26 g/L时,能得到OD600nm的预测极大值为7.467。按此配方进行发酵验证,测得OD600nm为7.602,与预测值接近,说明了该方程的拟合性好。采用梯度稀释平板计数法,测得该条件下工程菌株的实际浓度为2.96×109CFU/mL。
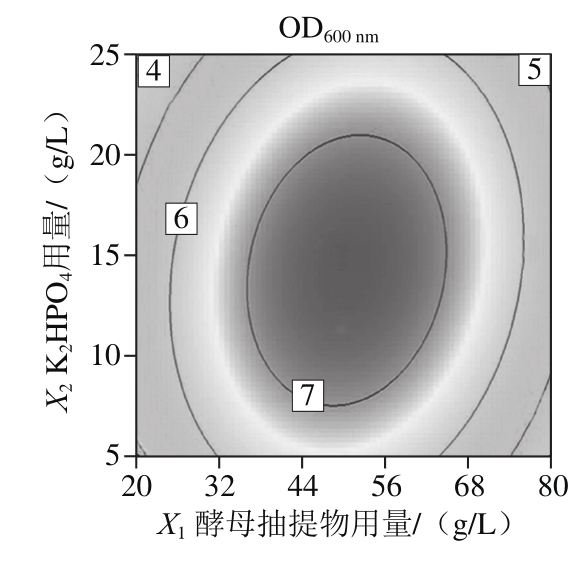
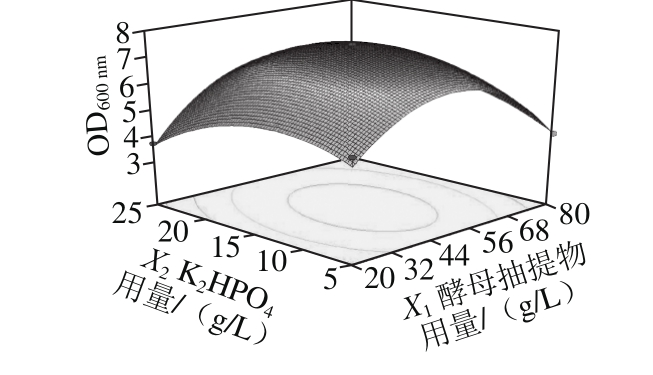
图3 酵母抽提物与K2HPO4用量对工程菌EcNA菌体浓度影响的等高线和响应面图
Fig. 3 Response surface and contour plots showing the interactive effects of yeast extract and dipotassium phosphate on EcNA concentration
2.4.1 冻干保护剂单因素试验结果
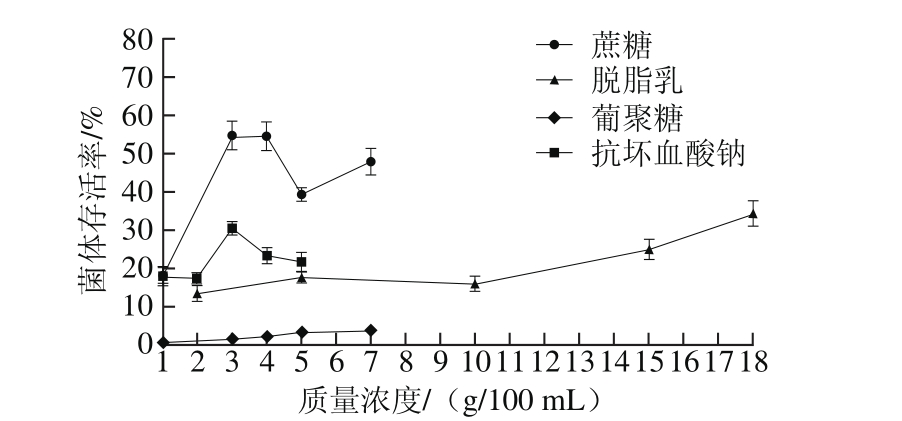
图4 4 种冻干保护剂对EcNA菌体存活率影响
Fig. 4 Effects of four cryoprotectants on survival rate of EcNA
海藻糖和甘露醇在各种质量浓度下,菌体冻干存活率均小于1%。脱脂乳、蔗糖、葡聚糖、抗坏血酸钠作为保护剂,菌体冻干存活率如图4所示,可看出运用蔗糖、抗坏血酸钠和脱脂乳作为冻干保护剂能得到较高的菌体存活率。故选择蔗糖、抗坏血酸钠和脱脂乳进行下一步的正交试验。
2.4.2 冻干保护剂正交试验及方差分析
表8 L9(34)正交试验结果与极差分析
Table 8 Experimental results and range analysis of L9(34) orthogonal array design
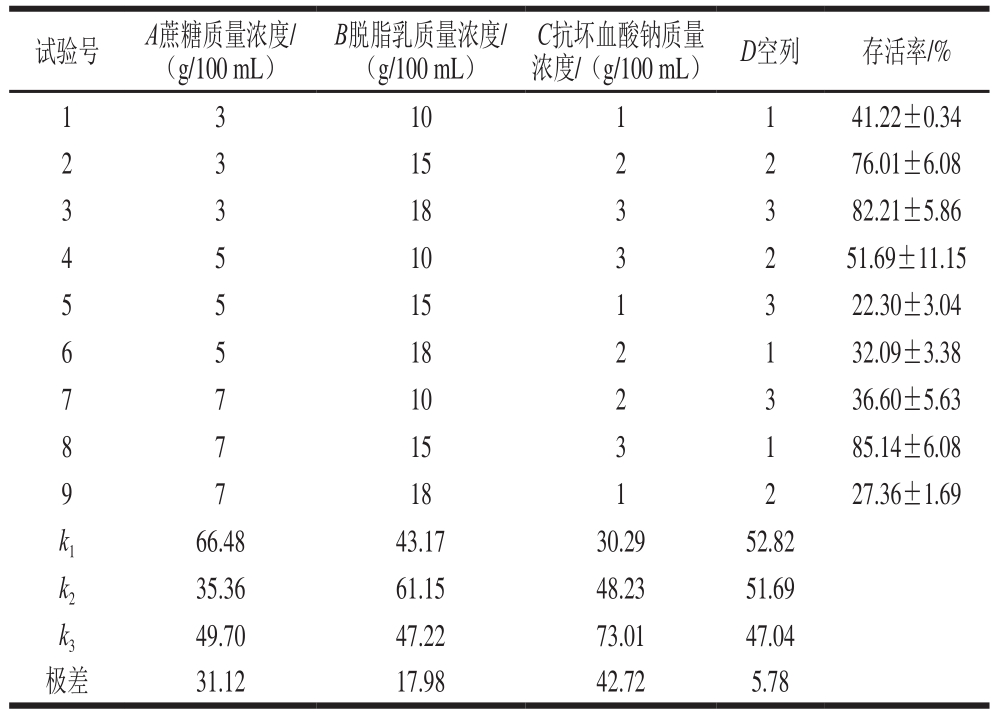
采用L9(34)正交表设计研究了冻干保护剂对抗肿瘤靶向工程菌体存活率的影响,正交试验结果及极差分析如表8所示,其方差分析结果如表9所示。对表8进行数学拟合可得方程:Y=-30.71-61.02A+29.34B+7.68C+5.68A2-1.03B2+3.42C2。由方程可知,当A=3、B=14.245 8、C=3时,Y取得极大值。这与正交试验极差分析得到的较优组合A1B2C3,即A=3、B=15、C=3吻合。由表9可知,蔗糖、脱脂乳、抗坏血酸钠均对冻干菌粉存活率有显著影响,且影响因素顺序为:抗坏血酸钠质量浓度>蔗糖质量浓度>脱脂乳质量浓度。
表9 正交试验方差分析
Table 9 Analysis of variance of the experimental results of orthogonal array design
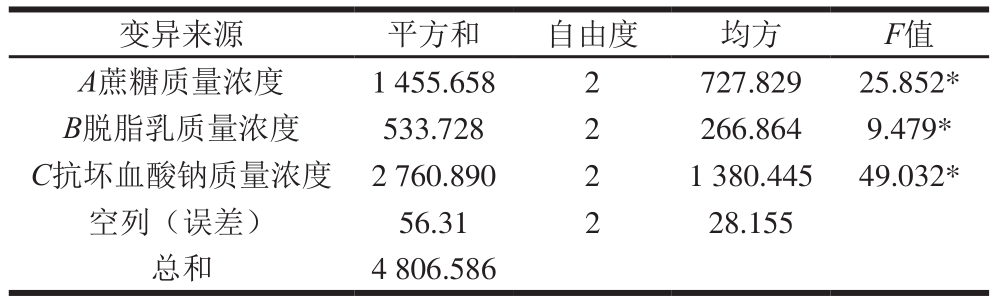
注:F0.01(2,2)=99.000,F0.05(2,2)=19.000。
根据正交试验结果,综合考虑称量误差,最终选定最优水平为蔗糖质量浓度3 g/100 mL、脱脂乳质量浓度14.25 g/100 mL、抗坏血酸钠质量浓度3 g/100 mL,并进行验证实验。此条件下,冻干菌粉的存活率达到(86.32±3.04)%。
合理的培养基组成是高密度发酵的前提,直接影响工程菌的生长增殖及目的基因的表达。本研究中,利用本室构建的抗肿瘤靶向工程菌株EcNA[13],采用Plackett-Burman试验设计,筛选出两种对工程菌株菌体浓度影响显著的成分为酵母抽提物、K2HPO4。酵母抽提物富含氨基酸、多肽、呈味核苷酸、B族维生素、生长因子和微量元素,被广泛用于微生物培养[22],是发酵工业的优质天然营养源[23-24]。K2HPO4等磷酸盐能调节工程菌的生长及产物代谢[25],是微生物生长代谢不可或缺的营养成分,对菌体内渗透压和微生物代谢酶系的活力[26]有重要影响,因此控制适宜的K2HPO4用量对高密度发酵具有极其重要的意义。
根据Plackett-Burman试验结果,选取酵母抽提物、K2HPO4进行中心组合试验,建立了二次拟合回归模型,根据模型得到了这两个成分的最佳比例为酵母抽提物50.3 g/L、K2HPO414.26 g/L,发酵后菌体浓度OD600nm达到7.602,生物量达到2.96×109CFU/mL,比优化前提高了78.3%。
菌粉制剂通过除去水分,降低了水分迁移对货架期的影响,有利于延长货架期[27],而真空冷冻干燥法是菌粉制作中最安全高效的方法之一[28]。实验完成对抗肿瘤靶向工程菌EcNA的发酵条件优化,显著提高菌体的生物量后,利用正交试验设计优化了工程菌冷冻干燥过程中保护剂的配比,研制了含有抗坏血酸钠、蔗糖、脱脂乳的复合保护剂。其中脱脂乳能稳定细胞膜,提供细胞保护衣以免细胞损伤[29]。蔗糖能干扰高度黏稠或玻璃态的盐以免细胞流体冻结[30]。抗坏血酸盐能减少环境中氧气对冻干菌粉的影响[31]。获得的最佳保护剂配方为脱脂乳14.25 g/100 mL、蔗糖3 g/100 mL、抗坏血酸钠3 g/100 mL,冻干后菌粉中菌体存活率可达86.32%。
本研究通过响应面优化法大幅提高了工程菌的产量,同时也提高天青蛋白的比生产率(单位体积单位时间内产物的产量)以及单位体积的抗肿瘤活性,通过菌粉的制备,简化了高活力菌体的保藏与运输条件,推动了靶向抗肿瘤药物的发展,有利于长货架期的抗肿瘤靶向活菌胶囊剂的研制。但该抗肿瘤工程菌粉药物的临床效果与安全性还需进一步研究。
参考文献:
[1] JIN H Z, MIN J J. Targeted cancer therapy using engineered Salmonella typhimurium[J]. Chonnam Medical Journal, 2016, 52(3):173-184. DOI:10.4068/cmj.2016.52.3.173.
[2] FUKIYA S, HIRAYAMA Y, SAKANAKA M, et al. Technological advances in bifidobacterial molecular genetics: application to functional genomics and medical treatments[J]. Bioscience of Microbiota Food and Health, 2012, 31(2): 15-25. DOI:10.12938/bmfh.31.15.
[3] GAO Z J, MCCLANE B A. Use of clostridium perfringens enterotoxin and the enterotoxin receptor-binding domain (C-CPE) for cancer treatment: opportunities and challenges[J]. Journal of Toxicology,2012: 981626. DOI:10.1155/2012/981626.
[4] GROZDANOV L, RAASCH C, CHULZE J, et al. Analysis of the genome structure of the nonpathogenic probiotic Escherichia coli strain Nissle 1917[J]. Journal of Bacteriology, 2004,186(16): 5432-5441. DOI:10.1128/JB.186.16.5432-5441.2004.
[5] 张允雷, 夏立秋, 张友明. 细菌靶向治疗肿瘤的研究进展[J]. 肿瘤防治研究, 2009, 36(7): 619-622. DOI:10.3971/j.issn.1000-8578.2009.07.024.
[6] MIRSEPASI-LAURIDSEN H C, HALKJAER S I, MORTENSEN E M, et al. Extraintestinal pathogenic Escherichia coli are associated with intestinal inflammation in patients with ulcerative colitis[J].Scientif i c Reports, 2016, 6: 31152. DOI:10.1038/srep31152.
[7] HENKER J, LAASS M W, BLOKHIN B M, et al. Probiotic Escherichia coli Nissle 1917 versus placebo for treating diarrhea of greater than 4 days duration in infants and toddlers[J]. Pediatric Infectious Disease Journal, 2008, 27(6): 494-499. DOI:10.1097/INF.0b013e318169034c.
[8] CHEN Q, ZHU Z, WANG J, et al. Probiotic E. coli Nissle 1917 biofilms on silicone substrates for bacterial interference against pathogen colonization[J]. Acta Biomaterialia, 2017, 50: 353-360.DOI:10.1016/j.actbio.2017.01.011.
[9] LODINOVÁ-ZÁDNÍKOVÁ R, PROKESOVÁ L, TLASKALOVÁ H,et al. Inf l uence of oral colonization with probiotic E. coli strain after birth on frequency of recurrent infections, allergy and development of some immunologic parameters. Long-term studies[J]. Ceska Gynekologie, 2004, 69 (Suppl 1): 91-97.
[10] CURRÒ D, IANIRO G, PECERE S, et al. Probiotics, fi ber and herbal medicinal products for functional and inf l ammatory bowel disorders[J].British Journal of Pharmacology, 2017, 174(11): 1426-1449.DOI:10.1111/bph.13632.
[11] HAFEZ M, HAYES K, GOLDRICK M, et al. The K5 capsule of Escherichia coli strain Nissle 1917 is important in stimulating expression of Toll-like receptor 5, CD14, MyD88, and TRIF together with the induction of interleukin-8 expression via the mitogenactivated protein kinase pathway in epitheli cells[J]. Infection and Immunity, 2010, 78(5): 2153-2162. DOI:10.1128/IAI.01406-09.
[12] ZHANG Y L, ZHANG Y M, XIA L Q, et al. Escherichia coli Nissle 1917 targets and restrains mouse B1 melanoma and 4T1 breast tumors through expression of azurin protein[J]. Applied and Environmental Microbiology,2012, 78(21): 7603-7610. DOI:10.1128/AEM.01390-12.
[13] 白利明, 唐斯佳, 文也, 等. 利用转座子构建靶向侵袭性抗肿瘤工程菌[J].中国科学, 2015, 45(2): 200-209. DOI:10.1360/N052014-00101.
[14] OU B, YANG Y, THAM W L, et al. Genetic engineering of probiotic Escherichia coli Nissle 1917 for clinical application[J].Applied Microbiology & Biotechnology, 2016, 100(20): 8693-8699.DOI:10.1007/s00253-016-7829-5.
[15] 陈贺佳, 牟光庆. 混合乳酸菌复合冻干保护剂的研究[J]. 食品研究与开发, 2013, 34(18): 133-136. DOI:10.3969/j.issn.1005-6521.2013.18.033.[16] 胥振国, 蔡玉华, 向敏, 等. 冻干高活力纳豆芽胞杆菌菌粉保护剂的筛选和优化[J]. 微生物学通报, 2013, 40(5): 822-828. DOI:10.13344/j.microbiol.china.2013.05.011.
[17] 田芬, 陈俊亮, 霍贵成. 益生菌冻干保护剂优化及菌粉保存稳定性研究[J].食品科技, 2012, 37(2): 15-19. DOI:10.13684/j.cnki.spkj.2012.02.001.
[18] CARVALHO A S, SILVA J, HO P, et al. Relevant factors for the preparation of freeze-dried lactic acid bacteria[J]. International Dairy Journal, 2004, 14(10): 835-847. DOI:10.1016/j.idairyj.2004.02.001.
[19] 张建新, 张吨, 胡文波, 等. 重组大肠杆菌高细胞密度发酵研究进展[J]. 中国酿造, 2011, 30(2): 5-8. DOI:10.3969/j.issn.0254-5071.2011.02.002.
[20] 张龙, 司海明, 倪晔, 等. 响应面法优化重组大肠杆菌产ADI酶发酵培养基[J]. 食品与生物技术学报, 2015, 34(5): 475-481.DOI:10.3969/j.issn.1673-1689.2015.05.005.
[21] 刘红娟, 王腾飞, 汤丹丹, 等. 响应面法优化大肠杆菌产海藻糖合酶发酵培养基[J]. 食品工业科技, 2015, 36(11): 181-187.DOI:10.13386/j.issn1002-0306.2015.11.028.
[22] ZHANG J, REDDY J, BUCKLAND B, et al. Toward consistent and productive complex media for industrial fermentations: studies on yeast extract for a recombinant yeast fermentation process[J]. Biotechnology and Bioengineering, 2003, 82(6): 640-652. DOI:10.1002/bit.10608.
[23] VASIEE A, BEHBAHANI B A, YAZDI F T, et al. Optimization of the production conditions of the lipase produced by Bacillus cereus,from rice fl our through plackett-burman design (PBD) and response surface methodology (RSM)[J]. Microbial Pathogenesis, 2016, 101:36-43. DOI:10.1016/j.micpath.2016.10.020.
[24] 黄翔峰, 王凯, 黎明霞, 等. 酵母提取物对葡萄糖发酵生产生物破乳菌Alcaligenes sp. S-XJ-1的影响[J]. 环境科学, 2013, 34(4): 1524-1530. DOI:10.13227/j.hjkx.2013.04.007.
[25] ZHANG L, ZHANG L, HAN X, et al. Enhancement of transglutaminase production in Streptomyces mobaraensis as achieved by treatment with excessive MgCl2[J]. Applid Microbiology and Biotechnology, 2012, 93(6): 2335-2343. DOI:10.1007/s00253-011-3790-5.
[26] MARTIN J F. Phosphate control of the biosynthesis of antibiotics and other secondary metabolites is mediated by the PhoR-PhoP system: an unf i nished story[J]. Journal of Bacteriology, 2004, 186(16): 5197-5201.DOI:10.1128/JB.186.16.5197-5201.2004.
[27] 史波林, 赵镭, 支瑞聪. 基于品质衰变理论的食品货架期预测模型及其应用研究进展[J]. 食品科学, 2012, 33(21): 345-350.
[28] 常金梅, 蔡芷荷, 吴清平, 等. 菌种冷冻干燥保藏的影响因素[J]. 微生物学通报, 2008, 35(6): 959-962. DOI:10.3969/j.issn.0253-2654.2008.06.024.
[29] CARVALHO A S, SILVA J, HO P, et al. Reevant factors for the preparation of freeze-dried lactic acid bacteria[J]. International Dairy Journal, 2004, 14(10): 835-847. DOI:10.1016/j.idairyj.2004.02.001.
[30] MOTTET C, MICHETTI P. Probiotics: wanted dead or alive[J].Digestive & Liver Disease, 2005, 37(1): 3-6. DOI:10.1016/j.dld.2004.09.010.
[31] KURTMANN L, CARLSEN C U, RISBO J, et al. Storage stability of freeze-dried Lactobacillus acidophilus (La-5) in relation to water activity and presence of oxygen and ascorbate[J]. Cryobiology, 2009,58(2): 175-180. DOI:10.1016/j.cryobiol.2008.12.001.
High Cell Density Fermentation of Tumor-Targeting Engineered Strain and Development of Lyoprotectant Formulation for Its Freeze-Drying
WANG Can, MO Xiangtao, ZHANG Feng, WU Liujuan, LI Tang, XIA Liqiu*
(Hunan Provincial Key Laboratory of Microbial Molecular Biology, State Key Laboratory of Developmental Biology of Freshwater Fish,College of Life Science, Hunan Normal University, Changsha 410081, China)
Abstract:The present study aimed to optimize the medium formulation for high cell density culture of an invasive tumortargeting engineered strain, EcNA. Using one-factor-at-a-time method and a Plackett-Burman design, yeast extract and dipotassium phosphate were found to be the most important factors affecting cell concentration. The optimal medium,as determined using central composite design and response surface methodology, was composed of soluble starch 2 g/L,yeast extract 50.3 g/L, K2HPO414.26 g/L, KH2PO43 g/L, MgSO40.3 g/L, and trace element stock solution 2 mL/L, and the inoculum amount was 3%. The optical density at 600 nm (OD600nm) of the bacterial culture obtained using the optimized medium reached 7.602 and the biomass was 2.96 × 109CFU/mL, which was 78.3% higher than that before optimization. Moreover,using orthogonal array design, a lyoprotectant formulation consisting of skim milk 14.25 g/100 mL, sucrose 3 g/100 mL, VC-Na 3 g/100 mL was found to be optimal for the freeze-drying of the strain. The survival rate of the engineered bacterium was up to 86.32% during freeze-drying using the lyoprotectant, being benef i cial for of prolonged storage life of oral capsules.
Keywords:tumor-targeting engineered strain; high cell density fermentation; response surface analysis; cryoprotectant;bacterial powder
DOI:10.7506/spkx1002-6630-201802017
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2018)02-0105-07
引文格式:王灿, 莫湘涛, 张峰, 等. 抗肿瘤靶向工程菌的高密度发酵及菌粉研制[J]. 食品科学, 2018, 39(2): 105-111.
DOI:10.7506/spkx1002-6630-201802017. http://www.spkx.net.cn
WANG Can, MO Xiangtao, ZHANG Feng, et al. High cell density fermentation of tumor-targeting engineered strain and development of lyoprotectant formulation for its freeze-drying[J]. Food Science, 2018, 39(2): 105-111. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802017. http://www.spkx.net.cn
收稿日期:2017-01-10
基金项目:国家重点基础研究发展计划(973计划)项目(2012CB722301);
湖南省生物发育工程及新产品研发协同创新中心项目(20134486)
第一作者简介:王灿(1992—),男,硕士研究生,研究方向为微生物新药发酵。E-mail:453519284@qq.com
*通信作者简介:夏立秋(1955—),男,教授,硕士,研究方向为微生物新药发酵。E-mail:xialq@hunnu.edu.cn