表1 卵黄抗体酶解条件的建立
Table 1 Enzymatic hydrolysis conditions of egg yolk antibody

钟欣欣,曹立民,林 洪,史佩玉,隋建新*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘 要:针对导致黑色素沉淀的酪氨酸酶,制备了特异性卵黄抗体Fab’片段,研究其对酶活力的抑制效果并从动力学角度进行分析。结果表明,胃蛋白酶法制备Fab’片段的最适条件为:pH 4.0、反应比(卵黄抗体-胃蛋白酶)1∶150(mg/U)、反应时间8 h。经免疫亲和柱纯化后可得理化性质稳定、纯度大于95%的Fab’片段;该片段通过非竞争性结合抑制酪氨酸酶活力,IC50为11.16 μmol/L,结合常数为5.79×105,抑制效果相比完整的卵黄抗体分子大大提高。本研究可为卵黄抗体Fab’片段作为潜在的酶活力抑制剂在食品、化妆品和医药等行业中应用提供理论参考。
关键词:酪氨酸酶;卵黄抗体;蛋白酶解;Fab’片段;活性抑制
酪氨酸酶是一种含铜的氧化还原酶,广泛存在于生物体中,是生物体合成黑色素的关键酶,通过调控其活性可以调控黑色素的生成量,过量的黑色素形成导致人的色素沉着性疾病(如褐斑、黄褐斑、雀斑等)、果蔬褐变及虾体黑变等,影响人的美观与食品的质量[1-2]。
卵黄抗体是蛋黄中存在的唯一的免疫球蛋白,具有高的特异性和针对性,其与抗原物质特异性结合后可有效抑制抗原物质的活性,根据此特性,卵黄抗体已被广泛应用于食品中控制病毒[3-4]、微生物[5-7]及生物酶[8-10]等。然而卵黄抗体分子质量较大,迁移速率慢,容易受到基质的影响,且常规提取方法得到的卵黄抗体中针对目标抗原的特异性抗体含量少,在实际应用中为达到有效抑制效果需要浓度较大的抗体[8-9]。另外卵黄抗体中Fc片段具有一定的免疫原性,对少数鸡蛋过敏人群存在一定风险[11-12],上述因素都在一定程度上限制了卵黄抗体在食品、化妆品和医药等行业的推广应用。国内外研究[13-19]表明,在适宜条件下,卵黄抗体可以被胃蛋白酶酶解生成Fab’片段,即抗原结合片段。Fab类抗体片段具有分子质量小、流动性及组织穿透能力较高、循环半衰期短、结合力高、免疫原性较低、可在原核表达系统中表达和基因工程操作简便等特点[20-21]。
本研究利用高效液相色谱检测方法确定胃蛋白酶酶解卵黄抗体制备Fab’片段的最适条件,并对酶解混合物进行免疫亲和分离纯化,得到高纯度的酪氨酸酶特异性卵黄抗体Fab’片段,同时对其理化性质以及从动力学角度对酪氨酸酶活力抑制作用进行探究,为制备特异性卵黄抗体Fab’片段提供有效方法,为抑制剂抑制酶活力效果、探究影响因素和寻求增效因子提供了思路,可作为新型天然抑制剂抑制酪氨酸酶活力从而抑制黑色素的产生,广泛用于食品、化妆品和医药等行业中提供了理论参考依据。
酪氨酸酶卵黄抗体由本实验室制备[22];胃蛋白酶(酶活力3 000 U/mg)、辣根酶标记兔抗鸡IgG 美国Sigma公司;L-多巴 上海源叶生物科技有限公司;1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)、N-羟基琥珀酰亚胺(N-hydroxy succinimide,NHS) 上海浩然生物技术有限公司;3-巯基丙酸(3-mercaptopropionic acid,MPA) 上海晶纯试剂有限公司;过氧化氢(30%) 天津百世化工有限公司;硫酸(纯度98%) 佳盟化学品有限公司。
TSK-GEL SEC分子排阻柱 东曹(上海)生物有限公司;1260高效液相色谱(配有紫外检测器) 美国Agilent公司;Multiskan MK3酶标仪 芬兰Labsystems公司;Biosuplar 400 SPR表面等离子体共振仪 天津德尚科技有限公司;0.22 μm水系滤膜 天津市津腾设备有限公司;酪氨酸酶免疫亲和柱由实验室自制。
1.3.1 胃蛋白酶酶解卵黄抗体条件的建立
从反应体系pH值、反应比(卵黄抗体-胃蛋白酶)、反应时间3 个因素[16-19]进行酶解条件的建立。卵黄抗体用50 mmol/L的乙酸钠缓冲液稀释为1 mg/mL,与胃蛋白酶溶液按表1条件在37 ℃水浴中反应,用pH 9.0的Tris溶液将体系pH值调整到7.5左右,以终止酶解反应,产物经0.22 μm无菌滤膜后进行高效液相色谱分析。
表1 卵黄抗体酶解条件的建立
Table 1 Enzymatic hydrolysis conditions of egg yolk antibody

1.3.2 高效液相色谱法检测酶解反应物
参照张茜等[23]的研究方法,具体条件如下:TSKgel G3000 SWXL凝胶色谱柱,流动相为20 mmol/L磷酸缓冲液(phosphate buffered saline,PBS,pH 7.0,含0.3 mol/L NaCl)。柱温25 ℃,流速0.8 mL/min,上样量20 μL,在紫外检测器280 nm波长处采集数据。
1.3.3 Fab’片段的纯化及纯度鉴定
参照实验室前期研究[24],采用免疫亲和柱纯化酶解后的Fab’片段:用10 mL 0.01 mol/L的PBS(pH 7.4)平衡柱填料体积为4.5 mL的免疫亲和柱,一次上样4 mL酶解液,10 mL 0.1 mol/L Tris-HCl(pH 7.5,含0.15 mol/L NaCl)洗涤,8 mL 0.2 mol/L甘氨酸溶液(pH 2.7,含0.5 mol/L NaCl)洗脱,收集洗脱液,超滤,经0.22 μm无菌滤器除杂进行高效液相色谱鉴定。1.3.4 Fab’片段的理化稳定性分析
研究酸碱稳定性时,分别用PBS(pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)稀释酪氨酸酶特异性卵黄抗体Fab’片段至1 mg/mL,室温放置10 min后,将各溶液pH值调至中性并稀释至1 μg/mL,间接酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法分析Fab’片段活性。研究热稳定性时,用pH 7.4的PBS稀释至1 μg/mL,水浴(温度25、30、40、50、60、70、80、90 ℃)孵育10 min,将各孵育溶液冷却至室温后,间接ELISA法[23]测定Fab’片段活性。
1.3.5 Fab’片段对酪氨酸酶活力抑制分析
酶活力测定参照Yi Wei等[25]方法并改进:将50 μL 0.15 mg/mL酪氨酸酶液和100 μL 0.2 mol/L的PBS(pH 6.8)加入到96 孔板中,加入50 μL 1 mmol/L的L-多巴,492 nm波长处测定其在第1、3分钟的吸光度。每1 mL酶液在1 min内吸光度升高0.01定义为1个酶活力单位(U)。
酶活力抑制率测定:0.15 mg/mL酪氨酸酶溶液和不同浓度抗体常温按照体积比1∶1混合10 min。将50 μL 0.2 mol/L的PBS(pH 6.8)和100 μL混合液加入到96 孔板中,如前述操作测定酪氨酸酶活力,阴性卵黄抗体作对照。抑制率计算公式如下:
为确定酪氨酸酶特异性卵黄抗体Fab’片段对酪氨酸酶的半抑制率(IC50),测定不同浓度特异性卵黄抗体Fab’片段(1.11、2.22、4.44、11.11、22.22 μmol/L)对酪氨酸酶的抑制活性,相同浓度的胰脂肪酶卵黄抗体作阴性对照,粗提卵黄抗体作阳性对照。分别计算特异性卵黄抗体Fab’片段和粗提卵黄抗体的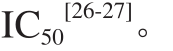
双倒数法作图分析酪氨酸酶特异性卵黄抗体Fab’片段对酪氨酸酶活力抑制的类型,不同质量浓度Fab’片段(0、0.2、0.5 mg/mL),在不同浓度L-多巴(0.062 5、0.125、0.25、0.5、1 mmol/L)条件下测定酪氨酸酶活力,以酶反应速率的倒数为纵坐标,底物浓度的倒数为横坐标作图[28]。
1.3.6 Fab’片段与酪氨酸酶的结合常数测定
采用表面等离子体共振技术测定Fab’片段与酪氨酸酶的结合常数[29],纯水清洗芯片,4 ℃置于0.01 mol/L MPA浸泡12 h,100%乙醇清洗,室温下置于EDC-NHS(0.1 mol/L EDC与0.025 mol/L NHS体积比1∶1)浸泡1 h,乙醇清洗晾干。
将经处理后的芯片固定于表面等离子体共振仪,以35 μL/min的流速通入PBS采集背景,信号稳定后,通入10 mg/mL酪氨酸酶,信号稳定后通入PBS,信号稳定后通入不同质量浓度Fab’片段(0.25、0.5、1.0 mg/mL),不同质量浓度粗提卵黄抗体(10、20、30 mg/mL)作对比,信号稳定后通入PBS溶液冲洗至信号达到稳定状态,记录信号变化情况。

图1 胃蛋白酶酶解卵黄抗体的动态变化图
Fig. 1 Dynamic changes of egg yolk IgY during pepsin digestion
如图1所示,在卵黄抗体与胃蛋白酶反应体系中,随着反应的进行,完整的卵黄抗体分子逐渐减少,而对应的Fab’片段逐渐增加,除主要的Fab’片段外,随着酶解的进行,一些分子质量更小的片段也开始出现。根据卵黄抗体峰面积的变化,可以定量计算卵黄抗体的酶解率,比传统的蛋白检测技术[16-19](如十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)具有分析速率快、灵敏度高、重复性高、稳定性好、结果准确等优点[30-31]。

图2 pH值(A)、反应比(B)、反应时间(C)对酶解产物中卵黄抗体酶解率的影响
Fig. 2 Effect of reaction conditions on the hydrolysis eff i ciency of egg yolk IgY
研究发现,卵黄抗体的酶解率随着pH值的升高而降低,在pH 3.0~4.0之间酶解率较高,pH值高于5.0后酶解反应不再进行(图2A),考虑到低pH值可能对卵黄抗体活性产生影响,选择pH 4.0作为最终反应体系的pH值;而反应比对酶解率的影响呈先增大后减小的趋势,反应比在1∶150时达到最大且维持不变,直到1∶600后酶解率迅速下降(图2B);整个反应在达到8 h后,所有的卵黄抗体几乎被完全水解(图2C)。
因此,本研究最终确定的酶解条件pH 4.0、反应比1∶150、反应时间8 h,这与Akita等[13]研究的缓冲液pH 4.2、酶解时间9 h基本一致;而与张茜等[23]胃蛋白酶与卵黄抗体的质量比1∶20、缓冲液pH 4.2、酶解时间6 h的条件略有差异,这可能主要是由于胃蛋白酶活力的不同所导致。
如图3所示,酶解完成后,反应体系中的卵黄抗体分子被完全分解成为不同分子质量的片段,经免疫亲和纯化后,许多出峰时间在12 min以后的小分子片段已经去除,仅得到保留时间在11.6 min的Fab’片段,通过对比峰面积,计算纯化后的Fab’片段纯度达到95%以上,相比于张茜等[23]经凝胶层析分离之后纯度达90%以上,邹强等[16]利用色谱分析达到91%的纯度,本研究采用亲和层析所得Fab’片段纯度有所提高。

图3 Fab’片段纯度测定的高效液相色谱图
Fig. 3 HPLC pro fi les of Fab’ fragment before and after puri fi cation
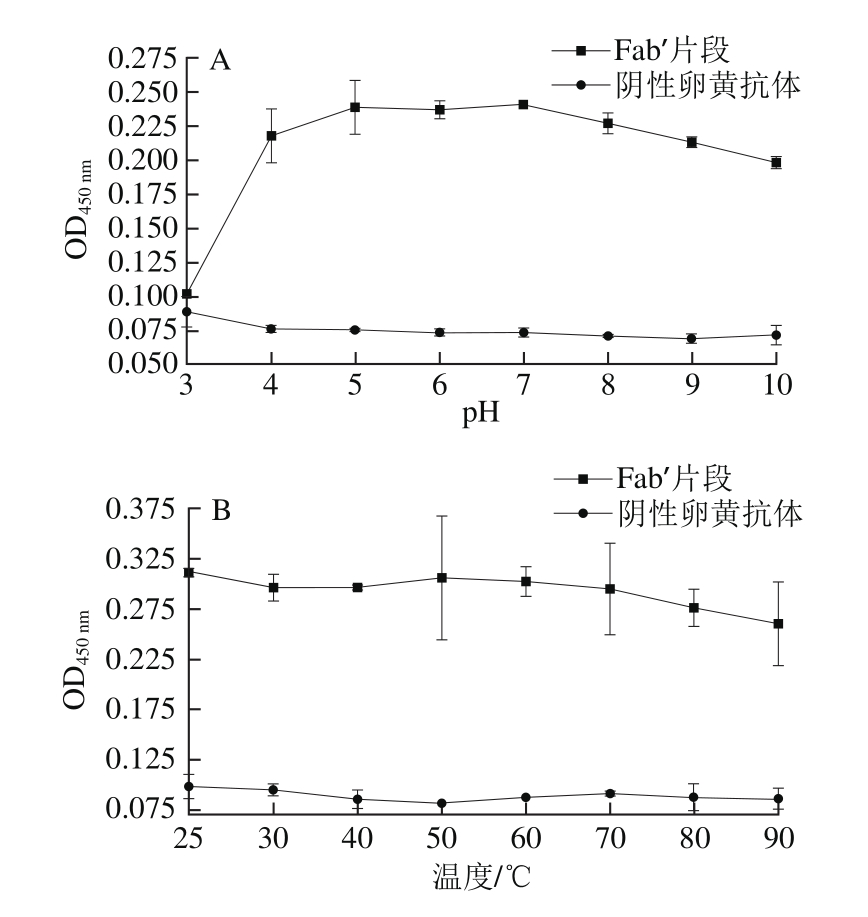
图4 pH值(A)和温度(B)对于Fab’片段免疫活性的影响
Fig. 4 Effect of pH (A) temperature (B) on immunological activity of Fab’ fragment
酸碱度和温度往往是限制蛋白质类生物制品应用的主要因素。pH值稳定性结果表明,酶解得到的酪氨酸酶特异性卵黄抗体Fab’片段在pH 4.0~8.0具有较高的免疫活性,但pH值低于3.0时免疫活性丧失,高于9.0时开始下降(图4A)。同时其在25~70 ℃温度范围内具有较高的免疫活性,当温度高于60 ℃时,免疫活性开始降低(图4B)。
Fab’片段和粗提卵黄抗体对酪氨酸酶活力的抑制表现出浓度依赖性且存在显著性差异(P<0.05),浓度增大,抑制率升高(图5),计算得其IC50分别为11.16、29.74 μmol/L。达到相同的抑制率,所需粗提卵黄抗体的量是Fab’片段的2.66 倍,Fab’片段对酪氨酸酶的抑制效果要显著优于粗提卵黄抗体,分析原因一是所得Fab’片段分子质量小、特异性强、穿透能力高,能够更好地与酶的结合位点相结合,从而起到显著的抑制作用;二是粗提卵黄抗体特异性抗体含量少,分子质量大,由于其自身结构和杂蛋白的存在一定程度上阻碍了其与酶结合位点的结合。

图5 卵黄抗体对酪氨酸酶活力抑制作用
Fig. 5 Inhibitory effect of egg yolk antibody on tyrosinase activity
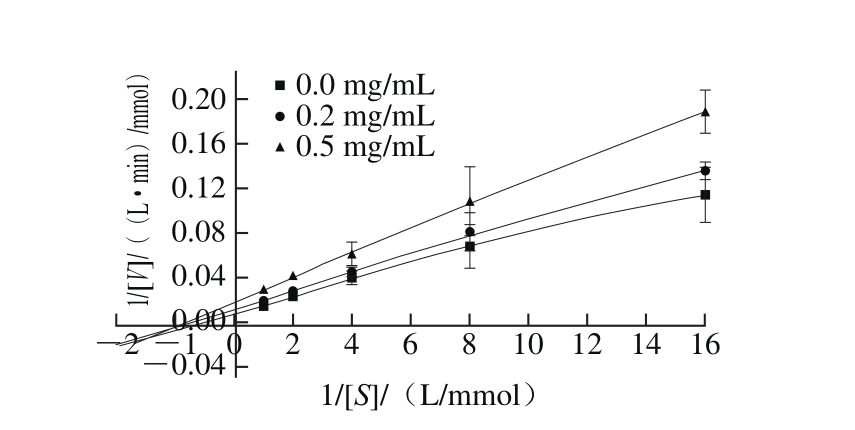
图6 Fab’片段对酪氨酸酶的抑制类型Lineweaver-Burk图
Fig. 6 Lineweaver-Burk plot showing non-competitive binding of Fab’to tyrosinase
酶反应动力学显示反应速率随着Fab’片段质量浓度的增加而减小,但Km不变(图6),说明Fab’片段对酪氨酸酶的抑制属于非竞争性抑制。在此类抑制中,酶与底物和抑制剂的结合位点不同,所以酶与抑制剂结合后还可以与底物结合,因此推断Fab’片段对酪氨酸酶的抑制作用机制可能是Fab’片段通过抗原抗体的特异性识别与酪氨酸酶结合,导致酪氨酸酶构象的改变或是在酶的底物结合中心附近形成空间位阻,影响了酶与底物的结合,从而降低酶的催化反应,发挥了抑制酶活力的效果。
表2 卵黄抗体结合常数
Table 2 Binding constants of egg yolk antibody and Fab’ fragment

表面等离子体共振技术技术相比于传统的ELISA方法[23],能更为直观地揭示抗原抗体的动态结合和解离过程,量化抗体对抗原的结合能力。由表2可看出,酶解后得到的特异性卵黄抗体Fab’片段与酪氨酸酶的结合常数KA比粗提卵黄抗体高1 个数量级,表明其与酪氨酸酶的结合能力要强于粗卵黄抗体,进一步显示了Fab’片段对酶活力抑制的优越性。
通过优化pH值、反应比和酶解时间建立了胃蛋白酶酶解卵黄抗体的最适条件:乙酸钠缓冲液pH 4.0、卵黄抗体与胃蛋白酶反应比1∶150(mg/U)、反应时间8 h;在此条件下水解卵黄抗体并结合免疫亲和柱纯化,可得到纯度为95%以上的Fab’片段;该片段可通过非竞争性结合抑制酪氨酸酶的活性,IC50为11.16 μmol/L,结合常数为5.79×105,且理化性质稳定。本研究结果为酪氨酸酶特异性Fab’片段的制备及其酶活力抑制性能研究提供了理论支持,期望下一步为将Fab’片段作为潜在酶活力抑制剂应用于食品、化妆品和医药等行业提供参考。
参考文献:
[1] 陈清西, 宋康康. 酪氨酸酶的研究进展[J]. 厦门大学学报(自然科学版), 2006, 45(5): 731-737. DOI:10.3321/j.issn:0438-0479.2006.05.033.
[2] 郭云集, 宋康康, 李智聪. 甘醇酸对蘑菇酪氨酸酶的抑制作用[J].厦门大学学报(自然科学版), 2008, 47(3): 383-386. DOI:10.3321/j.issn:0438-0479.2008.03.018.
[3] LU Y N, LIU J J, JIN L J, et al. Passive protection of shrimp against white spot syndrome virus (WSSV) using specific antibody from egg yolk of chickens immunized with inactivated virus or a WSSVDNA vaccine[J]. Fish & Shellf i sh Immunology, 2008, 25(5): 604-610.DOI:10.1016/j.fsi.2008.08.010.
[4] 韦嵩, 宋晓玲, 李海兵, 等. 白斑综合征病毒卵黄抗体对凡纳滨对虾免疫相关酶活力和抗病毒能力的影响[J]. 水产学报, 2009, 33(1):112-118. DOI:10.3321/j.issn:1000-0615.2009.01.015.
[5] KOLLBERG H, CARLANDER D, OLESEN H, et al. Oral administration of specific yolk antibodies (IgY) may prevent Pseudomonas aeruginosa infections in patients with cystic fibrosis:a phase I feasibility study[J]. Pediatric Puimonology, 2003, 35(6):433-440. DOI:10.1002/ppul.10290.
[6] XU Y F, LIN H, SUI J X, et al. Effects of specif i c egg yolk antibody(IgY) on the quality and shelf life of refrigerated Paralichthys olivaceus[J]. Journal of the Science of Food and Agriculture, 2012,92(6): 1267-1272. DOI:10.1002/jsfa.4693.
[7] ZHANG Q, LIN H , SUI J X, et al. Effects of Fab’ fragments of specif i c egg yolk antibody (IgY-Fab’) against Shewanella putrefaciens on the preservation of refrigerated turbot[J]. Journal of the Science of Food and Agriculture, 2015, 95(1): 136-140. DOI:10.1002/jsfa.6693.
[8] 党昕. 多酚氧化酶卵黄抗体的制备及其抑制虾类黑变效果研究[D].青岛: 中国海洋大学, 2013: 42-51.
[9] 张雪, 丁一民, 林洪, 等. 特异性卵黄抗体及其复配因子对南美白对虾的保鲜效果[J]. 中国渔业质量与标准, 2014, 4(2): 32-38.
[10] 刘帅, 曹立民, 林洪, 等. 胰脂肪酶特异性卵黄抗体对胰脂肪酶活性的抑制作用研究[J]. 食品工业科技, 2016, 37(11): 350-361.DOI:10.13386/j.issn1002-0306.2016.11.064.
[11] 陈代梅, 孙淑清. 抗流感病毒鸡卵黄免疫球蛋白IgY的制备和性质[J].化学工业与工程, 2007, 20(6): 448-452.
[12] WILMAR D D S, DENISE V T. IgY: a promising antibody for use in immunodiagnostic and inimmunotherapy[J]. Veterinary Immunology and Immunopatholog, 2010, 135: 173-180. DOI:10.1016/j.vetimm.2009.12.011.
[13] AKITA E M, NAKAI S. Production and purif i cation of Fab’ fragments from chicken egg yolk immunoglobulin Y (IgY)[J]. Immunol Methods,1993, 162(2): 155-164.
[14] SUN S Q, MO W J, JI Y P, et al. Preparation and mass spectrometric study of egg yolk antibody (IgY) against rabies virus[J]. Rapid Communications in Mass Spectrometry, 2001, 15(9): 708-712. DOI:10.1002/rcm.271.
[15] MA X H, SUN S Q, MA X M, et al. Polyclonal antibodies from hen egg yolk (IgY) with hydrolysis activity[J]. The Protein Journal, 2007,26(7): 499-505.
[16] 邹强, 李敏惠, 杨淑霞, 等. 鸡卵黄抗体Fab’的制备及鉴定[J]. 医学研究生学报, 2010, 23(2): 133-136. DOI:10.3969/j.issn:1008-8199.2010.02.005.
[17] 甄宇红, 郭洁, 金礼吉, 等. 抗金黄色葡萄球菌IgY的酶解稳定性及活性研究[J]. 现代生物医学进展, 2007, 7(10): 1510-1512.DOI:10.3969/j.issn:1673-6273.2007.10.022.
[18] 孙秀花. 特异性卵黄抗体活性片段的制备及性能研究[D]. 大连:大连理工大学, 2013: 13-35.
[19] 孙淑清, 段春燕, 胡彦涛, 等. 抗轮状病毒IgY和Fab’的分离与纯化[J]. 化学工业与工程, 2006, 23(4): 317-319. DOI:10.3969/j.issn:1004-9533.2006.04.009.
[20] 刘美君, 高向东, 徐晨. Fab类抗体的研究进展[J]. 国际药学研究杂志, 2014(3): 318-324. DOI:10.13220/j.cnki.jipr.2014.03.011.
[21] NELSON A L. Antibody fragments: hope and hype[J]. Mabs, 2010,2(1): 77. DOI:10.4161/mabs.2.1.10786.
[22] 隋建新, 林洪, 曹立民, 等. 单增李斯特菌(Listeria monocytogens)鸡卵黄抗体的制备及其抑菌活性研究[J]. 食品与发酵工业, 2009,35(2): 1-6. DOI:10.13995/j.cnki.11-1802/ts.2009.02001.
[23] 张茜, 林洪, 党昕, 等. 腐败希瓦氏菌卵黄抗体活性片段的制备及抑菌效果的分析[J]. 食品工业科技, 2013, 34(13): 75-78.DOI:10.13386/j.issn1002-0306.2013.13.086.
[24] 丁一民. 免疫亲和柱的制备及其对酪氨酸酶卵黄抗体的纯化[D].青岛: 中国海洋大学, 2015: 15-28.
[25] YI W, CAO R H, PENG W L, et al. Synthesis and biological evaluation of novel 4-hydroxybenzaldehyde derivatives as tyrosinase inhibitors[J]. European Journal of Medicinal Chemistry, 2010, 45(2):639-646.
[26] ABEL B O, ALIREZA R R, ELIZABETH A K. Electrostatic dependence of the thrombin-thrombomodulin interaction[J]. Molecular Biology, 2000, 296: 651-658.
[27] ASHRAF Z, RAFIQ M, SEO S Y, et al. Synthesis, kinetic mechanism and docking studies of vanillin derivatives as inhibitors of mushroom tyrosinase[J]. Bioorganic & Medicinal Chemistry, 2015, 23(17): 5870-5880.
[28] XING R, WANG F, DONG L, et al. Inhibitory effects of Na7PMo11CuO40on mushroom tyrosinase and melanin formation and its antimicrobial activities[J]. Food Chemistry, 2016, 197: 205-211.
[29] YAO Y, ZHENG Z, XU C, et al. Based on biotin-avidin system of surface plasmon resonance biosensor detection sulfamethoxazole interaction with bovine serum albumin[C]//International Conference on Remote Sensing, Environment and Transportation Engineering.IEEE, 2011: 6642-6645.
[30] 唐玲玲, 夏明. 高效液相色谱法在蛋白质分离检测中的应用[J]. 农产品加工: 学刊, 2009(1): 89-93. DOI:10.3969/j.issn:1671-9646-B.2009.01.026.
[31] OLIVA A, SANTOVEÑA A, LLABRES M, et al. Stability study of human serum albumin pharmaceutical preparations[J].Journal of Pharmacy & Pharmacology, 1999, 51(4): 385-392.DOI:10.1211/0022357991772574.
Production and Inhibitory Effect of Specif i c Egg Yolk Antibody Fab’ Fragment against Tyrosinase
ZHONG Xinxin, CAO Limin, LIN Hong, SHI Peiyu, SUI Jianxin*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract:The production of Fab’ fragment from specif i c egg yolk antibody against tyrosinase and its inhibitory activity on tyrosinase were investigated in this paper. The optimal conditions were obtained as follows: pH 4.0, ratio of egg yolk antibody to pepsin 1:150 (mg/U), and reaction time 8 h. Fab’ fragment purif i ed by immunoaff i nity column chromatography to a purity of over 95% exhibited good physicochemical stability. It was demonstrated as a non-competitive inhibitor with an IC50value of 11.16 μmol/L and a binding constant of 5.79 × 105, whose inhibitory effect was much higher than that of IgY. The results of this study can provide a theoretical basis for the application of egg yolk antibody Fab’ fragments in food,cosmetics and pharmaceutical industries as a potential enzyme inhibitor.
Keywords:tyrosinase; egg yolk antibody; enzymatic proteolysis; fragment antigen binding (Fab’ fragment); enzyme activity inhibition
DOI:10.7506/spkx1002-6630-201802019
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2018)02-0119-05
引文格式:钟欣欣, 曹立民, 林洪, 等. 酪氨酸酶特异性卵黄抗体Fab’片段的制备及其对酶活力的抑制性能[J]. 食品科学, 2018,39(2): 119-123.
DOI:10.7506/spkx1002-6630-201802019. http://www.spkx.net.cn
ZHONG Xinxin, CAO Limin, LIN Hong, et al. Production and inhibitory effect of specif i c egg yolk antibody Fab’ fragment against tyrosinase[J]. Food Science, 2018, 39(2): 119-123. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802019. http://www.spkx.net.cn
收稿日期:2016-12-04
基金项目:中央高校基本科研业务费专项(201413061);山东省农业应用创新专项
第一作者简介:钟欣欣(1989—),女,硕士研究生,研究方向为食品安全。E-mail:zhongxinxin2014@163.com
*通信作者简介:隋建新(1981—),男,副教授,博士,研究方向为食品安全。E-mail:suijianxin@ouc.edu.cn