三文鱼基质上单核细胞性李斯特菌毒力因子的表达
朱雅慧,朱洪日,王佳莹,张公亮,郝洪顺,侯红漫*
(大连工业大学 辽宁省水产品加工质量安全与控制重点实验室,辽宁 大连 116034)
摘 要:为了解单核细胞性李斯特菌(Listeria monocytogenes,Lm)污染食品基质后毒力因子表达的变化,本研究以Lm标准株ATCC 19115为研究对象,将其接种于三文鱼基质及胰酪胨大豆酵母浸膏琼脂(tryptic soy agar-yeast extract,TSA-YE)(对照组)上,于0、4、7 ℃贮藏条件下分别培养24 h和48 h后,收集菌体提取总RNA,采用反转录实时定量聚合酶链式反应(reverse transcript-quantitative polymerase chain reaction,RT-qPCR)对其4 个毒力因子hlyA、inlB、prfA、sigB的表达进行分析。结果表明,在0、4 ℃和7 ℃分别培养24 h和48 h后,4 个主要毒力因子在三文鱼基质上的表达量均高于平板对照,其中hlyA在贮藏4℃的三文鱼基质上表达上调的最为显著。此外,prfA和sigB在4 ℃贮藏条件下,表达量极显著高于7 ℃和0 ℃(P<0.01);在不同的温度贮藏24 h,inlB和hlyA的表达量均表现为7 ℃>4 ℃>0 ℃(P<0.01);且4 个主要毒力因子在三文鱼基质上的相对表达量均表现为48 h>24 h(P<0.01)。综上所述,本研究为该菌在食品基质上的风险评估和有效防控提供一定的理论依据。
关键词:单核细胞性李斯特菌;毒力因子;三文鱼基质
单核细胞性李斯特菌(Listeria monocytogenes,Lm)是国际公认的四大食源性致病菌之一[1],在自然环境中广泛存在,对于极端的环境胁迫均有一定的耐受力[2-3]。Lm在冷藏温度(0~4 ℃)条件下也可生长,零售商销售冷藏食品时的温度多为7 ℃。因此,该菌对冷藏即食食品的安全构成严重威胁[4-6]。作为主要冷藏食品之一的三文鱼,其食用安全性很大程度上受到Lm的影响[7-8]。欧盟一项调查显示,被Lm污染的生三文鱼的致病率通常在0%~10%[9-10]。在美国每年约有1 600 人因Lm而患病,约260 人死亡[11]。1990—2006年即食海鲜在即食食品中的召回率最高,且近年来,美国和加拿大发生多起被Lm污染的冰鲜和烟熏三文鱼被召回事件,而2015年在中国香港生产的一批三文鱼由于Lm污染而被召回[12]。
关于Lm毒力基因表达量的研究,多集中于将Lm接种于培养基中进行纯培养,然而培养基的成分与食品基质有一定差异,培养基无法完全模拟微生物在食品基质上的生长和毒力基因表达情况[13-15]。近年来,关于将Lm接种于食品基质上进行培养后,研究其生长和毒力的相关研究不断增加,这些报道多模拟肉制品、乳制品及蔬菜水果等基质[16-19]。然而,对于Lm在水产品基质上培养后,观察其毒力基因变化的相关报道仍相对较少[20]。
鉴于此,本研究以Lm标准菌株ATCC 19115为主要研究对象,将其接种于三文鱼基质上,于0、4、7 ℃贮藏条件下分别培养24 h和48 h,以Lm主要毒力因子inlB、hlyA、prfA、sigB为研究对象,利用反转录实时定量聚合酶链式反应(reverse transcript-quantitative polymerase chain reaction,RT-qPCR)的方法对inlB、hlyA、prfA、sigB的表达进行研究,有助于更好地了解食品基质和贮藏温度对于Lm毒力基因表达的影响,从而为进一步探究Lm致病机理和高效防控Lm提供相关的理论依据。
1 材料与方法
1.1 菌种、材料与试剂
Lm ATCC 19115购于中国普通微生物菌种保藏中心,该菌株为强毒株,致病型为脑膜炎等,血清型4b,人源;三文鱼块购自沃尔玛超市。
胰蛋白胨大豆肉汤培养基(trypticase soy broth,TSB)、酵母浸粉(yeast extract,YE)、琼脂粉大连博诺公司;Ex Taq Mixture、SYBR Premix Ex Taq、Random Primer、5×M-MLV Buffer、dNTP Mixture、RNase Inhibitor、RTase M-MLV(RNase H-) 宝生物工程(大连)有限公司;细菌DNA提取试剂盒、细菌总RNA提取试剂盒 天根生化科技(北京)有限公司;相关基因引物由生工生物工程(上海)股份有限公司合成;DNaseⅠ 美国Thermo Scientif i c公司。
1.2 仪器与设备
UV2102型紫外分光光度计 岛津(上海)仪器有限公司;Centrifuge 5418小型台式离心机 德国艾本德公司;Gel DocTMXR+凝胶成像仪、MaxygeneⅡPCR仪、MyiQTM2荧光定量PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 生鱼片的制备
用灭菌后的手术刀将三文鱼切割成10~15 g/块,灭菌PBS清洗鱼肉表面3 次,清除鱼肉上杂菌,备用。
1.3.2 菌种活化及菌液制备
取Lm ATCC 19115菌株-80 ℃冻存的菌液50 μL加入到5 mL TSB-0.6%YE中培养,将上述活化后的菌液划线于TSA-0.6%YE平板,37 ℃培养后,挑取单菌落至10 mL的TSB-0.6%YE中,37 ℃培养20 h(OD600nm约为1.0),该菌液作为种子菌液用于后续的实验。
取4 mL上述种子菌液离心,用200 μL PBS吹悬,吹悬后的菌液(109CFU/mL)接种于三文鱼鱼肉基质及TSA-YE平板上,分别置于0、4、7 ℃培养24 h和48 h,每个处理组3 个重复。
1.3.3 引物的设计及验证
利用Fast PCR软件进行hlyA引物的设计与评价,并利用NCBI BLAST对于设计的引物进行进一步的评价。选择的引物在18~27 个碱基;以G/C开头,GC百分比在45%~55%;Tm值在50~60 ℃之间,且上下游引物的Tm值相差不得超过3 ℃;不产生二级结构、发夹结构;Quality值大于90或95。其他3个毒力基因的引物来自参考文献,引物序列见表1。
表1 本研究所用引物序列
Table 1 Primers used in the present study

引物 序列(5’→3’) 片段大小/bp 参考文献hlyA-F GGTAACCTCGGAGACTTACG 205 bp 本研究hlyA-R CAACGTATCCTCCAGAGTGATC inlB-F TATGCAGCATGGCTTGTAACC 200 bp [21]inlB-R GTTCTTGCAGAGATGGCACG prfA-F CGGGAAGCTTGGCTCTATTTG 151 bp [22]prfA-R GCTAACAGCTGAGCTATGTGC sigB-F TCATCGGTGTCACGGAAGAA 310 bp [23]sigB-F TGACGTTGGATTCTAGACAC 16S-F TTAGCTAGTTGGTAGGGT 320 bp [24]16S-R AATCCGGACAACGCTTGC
1.3.4 DNA的提取及主要毒力因子的验证
取适量菌液按照细菌DNA提取试剂盒说明书步骤进行DNA的提取,以该DNA作为模板,使用4 个主要毒力因子inlB、prfA、hlyA和sigB的引物进行基因扩增。扩增体系为20 µL,Premix Taq 10 µL,上下游引物(10 µmol/L)各1 µL,DNA模板1µL,ddH2O 7 µL。反应条件为:94 ℃预变性4 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,扩增32个循环;72 ℃后延伸5 min。
1.3.5 RNA的提取及纯化
用10 mL PBS将Lm从三文鱼块上洗脱下来,洗脱下来的菌液按照细菌RNA提取试剂盒说明书步骤稍作改动后,进行RNA的提取,由于是在食品基质上进行Lm的培养,所以提取的RNA有明显的DNA污染,为减小DNA对于后续实验的影响,使用DNaseⅠ对提取的RNA进行处理,向提取的RNA 1 µg中加入1 U DNaseⅠ和1 µL buffer,37 ℃水浴30 min,再加入1 µL EDTA,65 ℃水浴10 min。
1.3.6 RT-qPCR分析
反转录采用两步法,第1步反转录体系为:RNA模板5 μL;Random Primers[pd(N)6] 1 μL;体系共计6 μL。反转录条件为:70 ℃ 10 min;4℃ 2 min;4 ℃ ∞。第2步反转录体系为:第1步RNA变性溶液6 μL;Reverse Transcriptase M-MLV(RNase H-)0.5 μL;5×M-MLV Buffer 2 μL;dNTP Mixture 0.5 μL;Recombinant RNase Inhibitor 0.25 μL;RNase-free Water 0.75 μL;体系共计10 μL。反转录条件为:42 ℃ 60 min;70 ℃ 15 min;4 ℃ 2 min;4 ℃ ∞。
荧光定量PCR体系(共25 µL):SYBR® Premix Ex TaqTM12.5 µL;引物(10 µmol/L)各0.5 µL;RNasefree Water 9.5 µL;cDNA模板 2 µL。反应参数:95 ℃30 min;95 ℃ 5 s,63.3 ℃ 25 s,72 ℃ 15 s,于80 ℃处停留15 s,收集荧光信号,反应40 个循环;并在60~95 ℃范围建立熔解曲线。根据得到的Ct值,采用2-ΔΔCt法[25]对于不同条件下毒力基因表达的差异进行计算和分析。
1.4 数据统计分析
每组实验需要进行显著性差异分析的,实验结果以3 个平行结果的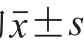 表示。用Excel统计数据,采用SPSS 20.0软件进行显著性分析。
表示。用Excel统计数据,采用SPSS 20.0软件进行显著性分析。
2 结果与分析
2.1 引物及主要毒力基因的验证
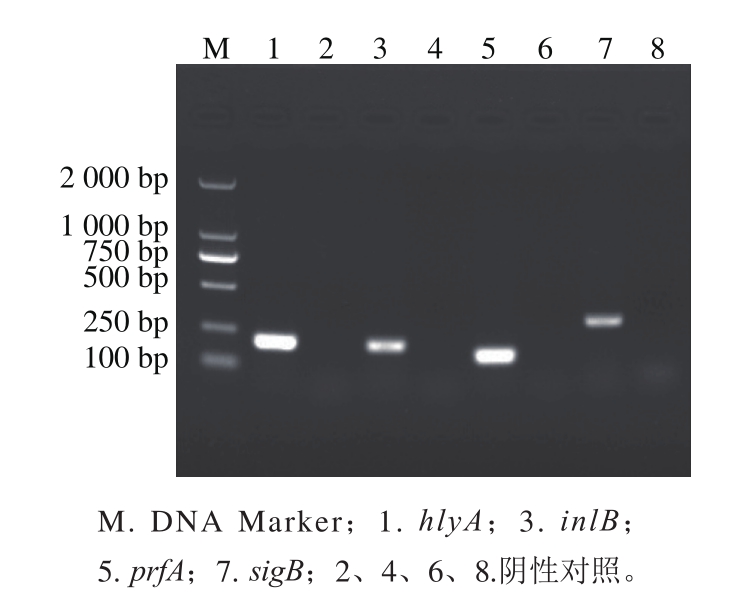
图1 Lm ATCC 19115主要毒力因子的PCR扩增产物
Fig. 1 PCR amplif i ed products of major virulence factors of Lm ATCC 19115
以Lm ATCC 19115的cDNA为模板,将合成的cDNA模板10 倍稀释成8 个梯度,进行荧光定量PCR扩增,系统自动生成的标准曲线方程为y=-3.621x+10.53,扩增效率为88.9%,回归相关系数r2为0.991,hlyA的溶解曲线只出现单一的信号峰,没有产生非特异性条带及引物二聚体,设计的hlyA引物可以用于进一步的实验。
对Lm ATCC 19115主要毒力因子的PCR检测结果如图1所示,PCR产物经1%的琼脂糖凝胶电泳后,hlyA、inlB、prfA和sigB均在预期大小的位置得到相应的条带,由此可知Lm ATCC 19115含有这4 种主要的毒力因子。
2.2 RNA的提取及纯化
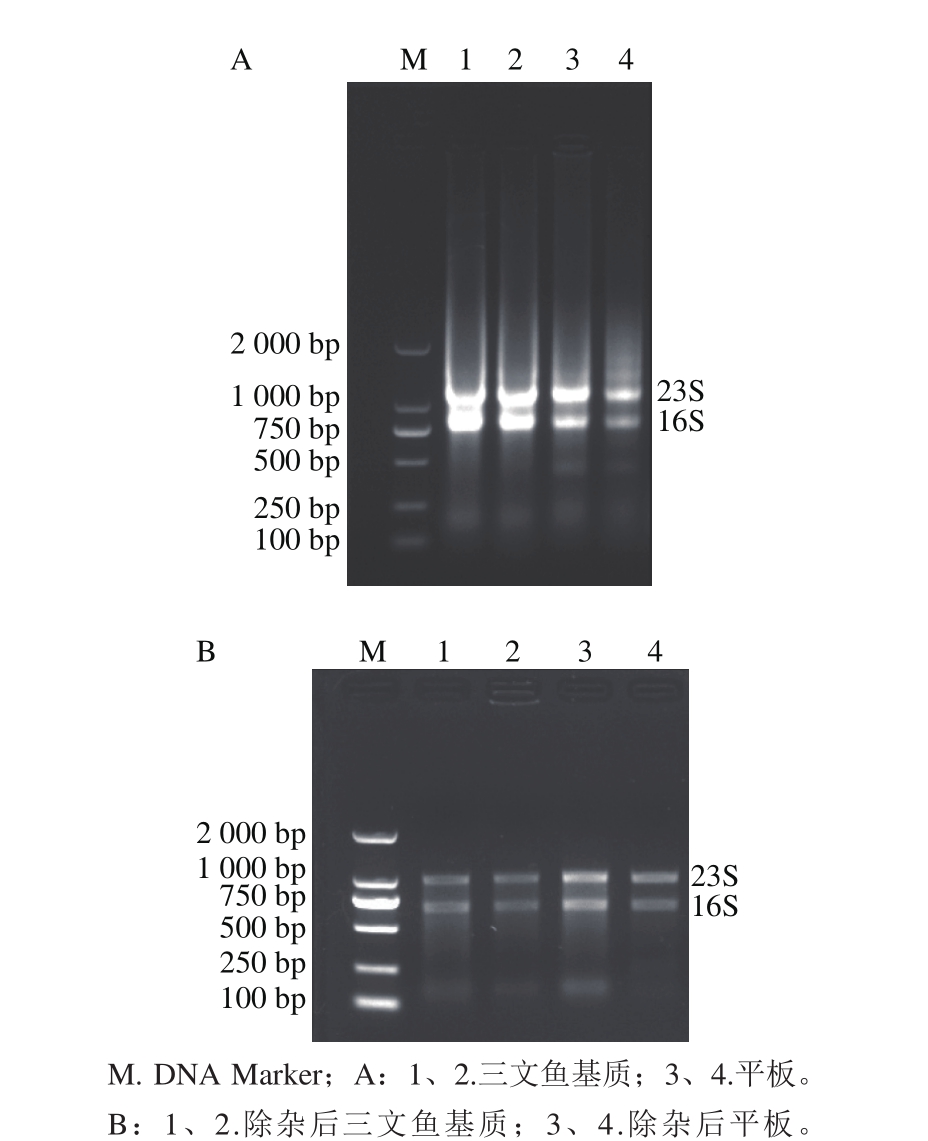
图2 纯化前(A)、后(B)Lm ATCC 19115 RNA提取及纯化
Fig. 2 Electrophoresis of crude and purif i ed RNA from Lm ATCC 19115
将三文鱼基质上和平板上的Lm冲洗下来提取的RNA,经1%琼脂凝胶电泳进行检测,结果如图2A所示,提取的总RNA、23S和16S rRNA条带较清晰,但有明显的拖尾现象,表明有DNA等杂质的污染。将上述样本用DNA酶纯化后,经1%琼脂凝胶电泳进行检测,结果见图2B,在RNA完整性保存良好的同时几乎不存在DNA污染,且OD260nm/OD280nm为1.8~2.1,RNA纯化处理成功,可以进行后续实验。
2.3 三文鱼基质上毒力因子的表达水平分析
如图3所示,Lm ATCC 19115在鱼肉基质上,0、4、7 ℃培养24 h和48 h,inlB、hlyA、prfA、sigB的相对表达量均上调。其中hlyA在贮藏48 h的三文鱼基质上的表达上调最为显著,由此可知,与平板相比,鱼肉基质能够一定程度地增加毒力因子inlB、hlyA、prfA、sigB的表达量。
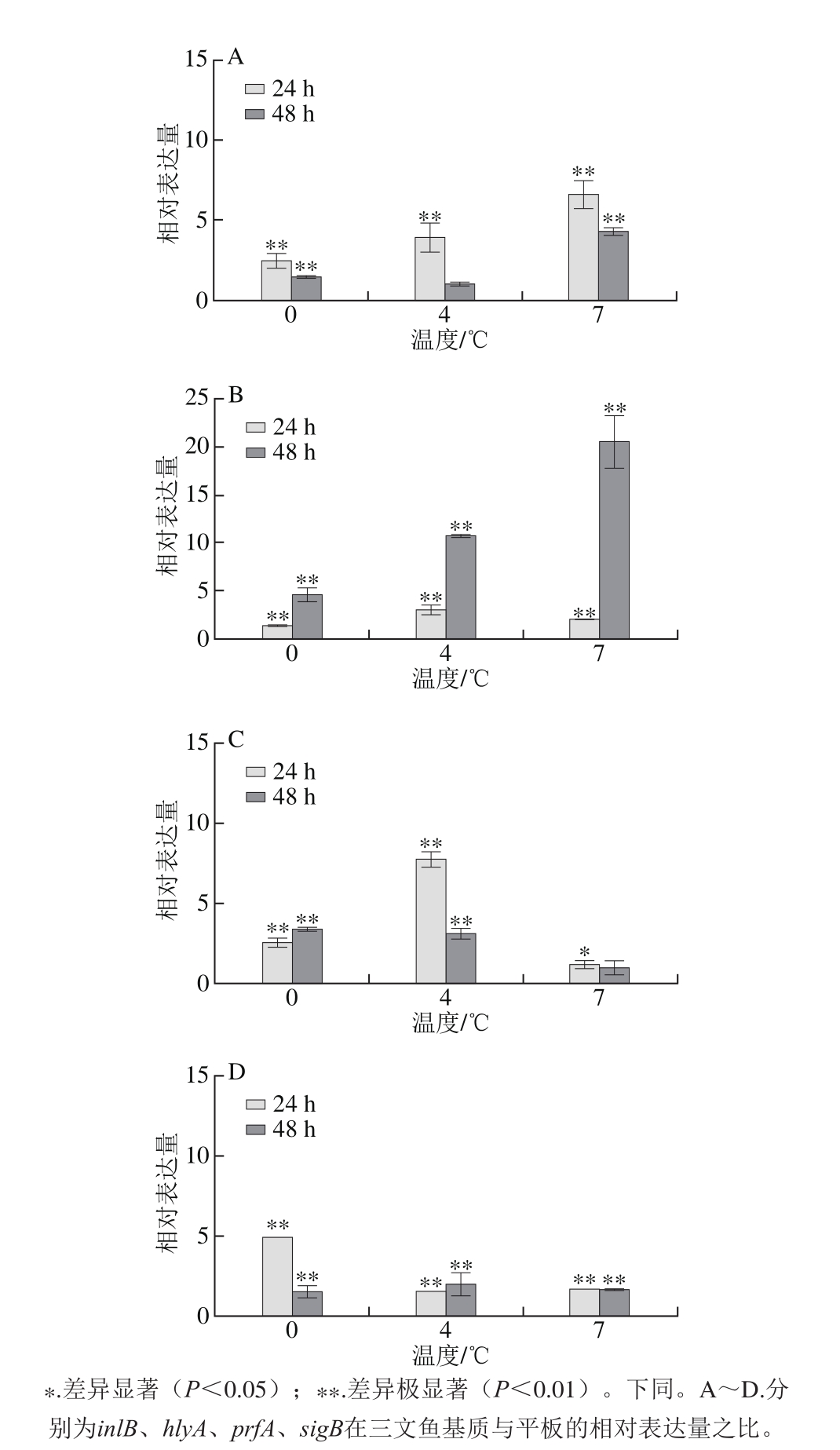
图3 三文鱼基质对Lm毒力基因表达的影响
Fig. 3 Inf l uence of salmon matrix on virulence genes expression of Lm

图4 温度对三文鱼基质上Lm毒力基因表达的影响
Fig. 4 Inf l uence of temperature on virulence genes expression of Lm grown in salmon matrix
如图4所示,在三文鱼基质上,随着温度的升高,inlB和hlyA这两个毒力因子相对表达量的变化趋势一致,24 h均表现为7 ℃>4 ℃>0 ℃(P<0.01),48 h两个基因均表现出4 ℃的相对表达量大于0 ℃和7 ℃的相对表达量;prfA在24 h和48 h毒力基因的相对表达量均为4 ℃最高,0 ℃的相对表达量最低。环境调控因子sigB 24 h的相对表达量呈现出一定的低温促进趋势,0 ℃和4 ℃的相对表达量均显著高于7 ℃的相对表达量(P<0.01),sigB 48 h的相对表达量与prfA的相对表达量变化趋势相同。
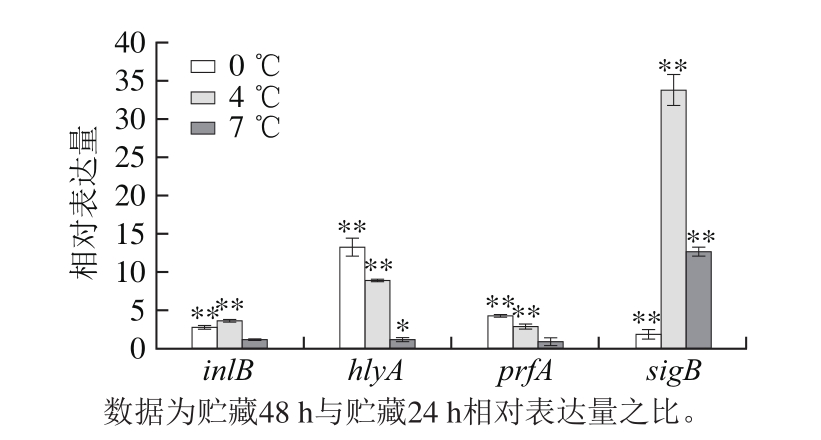
图5 培养时间对三文鱼基质上Lm毒力基因表达的影响
Fig. 5 Inf l uence of culture duration on virulence gene expression of Lm grown in salmon matrix
如图5所示,Lm ATCC19115菌株在三文鱼基质上,在0、4 ℃和7 ℃条件下培养,培养48 h后毒力因子inlB、hlyA、prfA、sigB的相对表达量较24 h均呈现出上调的趋势。由此可知,贮藏时间的延长,一定程度上可增加毒力因子inlB、hlyA、prfA、sigB的表达量。
3 讨 论
有研究表明,食品的成分、性质都会影响Lm的毒力,因此本研究将Lm标准株ATCC 19115接种于三文鱼基质上,不同温度培养,应用RT-qPCR技术对培养后主要毒力因子的表达量进行检测及分析。从结果来看,与平板相比,在不同贮藏温度(0、4、7 ℃)和不同贮藏时间(24、48 h)条件下,毒力因子inlB、hlyA、prfA、sigB的相对表达量均上调。Hadjilouka等[26]将Lm(LQC 15257)接种于香瓜、芝麻菜和肉汤中进行培养,也得到了相同的结果,与纯培养的肉汤相比,毒力因子inlB、hly的相对表达量均上调。Olesen等[27]的研究也表明,一些食品本身的性质会影响Lm(EGD-e、4140)的毒力基因表达,从而影响Lm的毒力。本研究中,三文鱼基质上,不同温度贮藏24 h,inlB和hlyA的相对表达量表现为7 ℃>4 ℃>0 ℃,温度的升高能够增加毒力因子inlB、hlyA的表达量;在三文鱼基质上,sigB则表现为4 ℃≈0 ℃>7 ℃。Alessandria等[28]将7 株Lm接种于奶酪上,4、12 ℃培养24 h和48 h,对于有些菌株来说,与4℃相比12 ℃也使hlyA的表达上调。Rantiou等[29]将3株Lm(分离自肉#3、来自实验室NCTC 10527、分离自奶酪#162)分别接种到发酵香肠、肉末、奶酪、高温瞬时灭菌牛乳中培养,其中两株Lm(#3、NCTC 10527)在肉沫中培养后,hlyA的表达量表现为12 ℃>4 ℃;两株Lm(#3,#162)在香肠中培养后,sigB的表达量表现为4 ℃>12 ℃,造成这种现象的原因可能是不同菌株的来源、血清型不同,且接种的食品基质本身的性质也不同,导致不同菌株的毒力基因在不同的基质上表达出现差异,没有得到相似的规律。Larsen等[30]将Lm(DSMZ 15675)接种于奶酪上培养24 h和48 h,发现在相同盐浓度条件下,hly和inlA在48 h的相对表达量大于24 h。在本研究中也得到相似的结果,与24 h相比,在三文鱼基质上不同温度贮藏(0、4、7 ℃)48 h,毒力因子inlB、hlyA、prfA、sigB的相对表达量均上调。但Duodu等[20]将2株Lm(CCUG 3998、442)接种于鲑鱼上,0、4、20 ℃培养24 h和48 h,发现在相同温度下,hlyA和inlA在24 h和48 h的相对表达量没有显著差异,造成这种现象的原因可能是菌株和实验条件方面的差异。
由此可见,影响Lm毒力基因表达的因素很多,除Lm本身调控因子对于毒力因子的调控外,还与贮藏温度、时间、培养基质、菌株的血清型、致病力、来源和环境适应能力有一定的相关性。若要更深入了解Lm毒力基因的表达,还需要进行进一步的探索和研究。综上,本研究对于Lm在三文鱼基质上培养后毒力因子和调控因子的表达进行了分析,通过毒力基因表达量间接推断毒力的变化,为进一步研究降低和抑制Lm的毒力提供了理论支持。
参考文献:
[1] GARNER D, KATHARIOU S. Fresh produce-associated listeriosis outbreaks, sources of concern, teachable moments, and insights[J].Journal of Food Protection, 2016, 79(2): 337-344. DOI:10.4315/0362-028X.JFP-15-387.
[2] 王福. 单核细胞增生李斯特菌研究进展[J]. 口岸卫生控制, 2011,16(5): 50-53. DOI:10.3969/j.issn.1008-5777.2011.05.015.
[3] 刘秀峰, 江建真, 林萍. 单核细胞增生李斯特菌研究进展[J]. 海峡预防医学杂志, 2010, 16(5): 23-25.
[4] 周小红, 李学英, 杨宪时, 等. 培养条件对单增李斯特菌生长的影响[J].食品工业科技, 2013, 34(15): 140-143.
[5] ARGUEDAS-VILLA C, STEPHAN R, TASARA T. Evaluation of cold growth and related gene transcription responses associated with Listeria monocytogenes strains of different origins[J]. Food Microbiology, 2010, 27(5): 653-660. DOI:10.1016/j.fm.2010.02.009.
[6] IVY R A, WIEDMANN M, BOOR K J. Listeria monocytogenes grown at 7 ℃ shows reduced acid survival and an altered transcriptional response to acid shock compared to L. monocytogenes grown at 37 ℃[J]. Applied and Environmental Microbiology, 2012, 78(11):3824-3835. DOI:10.1128/AEM.00051-12.
[7] TARAN S, REITEHAUG E, ECKNER K. Development of performance objectives for Listeria monocytogenes contaminated salmon (Salmo salar) intended used as sushi and sashimi based on analyses of naturally contaminated samples[J]. International Journal of Food Microbiology, 2014, 184: 8-13. DOI:10.1016/j.ijfoodmicro.2014.03.031.
[8] 周晏, 周国燕, 徐斐, 等. 单增李斯特菌在生食鱼片中生长模型的建立[J]. 食品科学, 2015, 36(15): 157-162. DOI:10.7506/spkx1002-6630-201515029.
[9] LEONG D, ALVAREZ-ORDONEZ A, ZAOUALI S, et al.Examination of Listeria monocytogenes in seafood processing facilities and smoked salmon in the Republic of Ireland[J]. Journal Food Protection, 2015, 78(12): 2184-2190. DOI:10.4315/0362-028X.JFP-15-233.
[10] European Food Safety Authority. Analysis of the baseline survey on the prevalence of Listeria monocytogenes in certain ready-to-eat foods in the EU, 2010–2011 part A: Listeria monocytogenes prevalence estimates[J]. EFSA Journal, 2013, 11(6): 3241. DOI:10.2903/j.efsa.2013.3241.
[11] CHENG C, ARRITT F, STEVENSON C. Controlling Listeria monocytogenes in cold smoked salmon with the antimicrobial peptide salmine[J]. Journal of Food Science, 2015, 80(6): 1314-1318.DOI:10.1111/1750-3841.12886.
[12] SHIROODIA S G, OVISSIPOURAB M, ROSS C F, et al. Efficacy of electrolyzed oxidizing water as a pretreatment method for reducing Listeria monocytogenes contamination in cold-smoked Atlantic salmon(Salmo salar)[J]. Food Control, 2016, 60: 401-407. DOI:10.1016/j.foodcont.2015.08.020.
[13] SHEARER A E H, NEETOO H S, CHEN H Q. Effect of growth and recovery temperatures on pressure resistance of Listeria monocytogenes[J]. International Journal of Food Microbiology, 2010,136(3): 359-363. DOI:10.1016/j.ijfoodmicro.2009.10.034.
[14] SUE D, FINK D, WIEDMANN M, et al. σB-Dependent gene induction and expression in Listeria monocytogenes during osmotic and acid stress conditions simulating the intestinal environment[J]. Microbiology, 2004,150(11): 3843-3855. DOI:10.1099/mic.0.27257-0.
[15] MAKARITIA I P, PRINTEZIA A, KAPETANAKOUA A E, et al.Investigating boundaries of survival, growth and expression of genes associated with stress and virulence of Listeria monocytogenes in response to acid and osmotic stress[J]. Food Microbiology, 2015, 45:231-244. DOI:10.1016/j.fm.2014.06.023.
[16] MATARAGAS M, ROVETTO F, BELLIO A, et al. Differential gene expression profiling of Listeria monocytogenes in Cacciatore and Felino salami to reveal potential stress resistance biomarkers[J]. Food Microbiology, 2015, 46: 408. DOI:10.1016/j.fm.2014.09.003.
[17] OLESEN I, THORSEN L, JESPERSEN L. Relative transcription of Listeria monocytogenes virulence genes in liver pâtés with varying NaCl content[J]. International Journal of Food Microbiology, 2010,141: s60-s68. DOI:10.1016/j.ijfoodmicro.2010.01.042.
[18] SCHRAMAL D, HELLIWELL N, NETO L, et al. Adaptation of Listeria monocytogenes in a simulated cheese medium: effects on virulence using the Galleria mellonella infection model[J]. Letters in Applied Microbiology, 2013, 56(6): 421-427. DOI:10.1111/lam.12064.
[19] BEIRNE O D, GOMEZ-LOPEZ V, TUDELA J A, et al. Effects of oxygen-depleted atmospheres on survival and growth of Listeria monocytogenes on fresh-cut iceberg lettuce stored at mild abuse commercial temperatures[J]. Food Microbiology, 2015, 48: 17-21.DOI:10.1016/j.fm.2014.11.012.
[20] DUODU S, HOLST-JENSE A, SKJERDAL T, et al. Influence of storage temperature on gene expression and virulence potential of Listeria monocytogenes strains grown in a salmon matrix[J]. Food Microbiology, 2010, 27(6): 795-801. DOI:10.1016/j.fm.2010.04.012.
[21] 桑雪, 朱耀磊, 朱雅慧, 等. 环境因素对单增李斯特菌inlB毒力基因表达的影响[J]. 食品工业科技, 2015, 36(20): 175-179.
[22] CHATTERIEE S S, HOSSAIN H, OTTEN S, et al. Intracellular gene expression profile of Listeria monocytogenes[J]. Infection and Immunity, 2006, 74(2): 1323-1338. DOI:10.13386/j.issn1002-0306.2015.20.028.
[23] BAE D, LIU C, ZHANG T, et al. Global gene expression of Listeria monocytogenes to salt stress[J]. Journal of Food Protection, 2012,75(5): 906-912. DOI:10.4315/0362-028X.JFP-11-282.
[24] FASER J A, KANSAGRAP C, KOTECKI C, et al. The modifier subunit of Drosophila glutamate-cysteine ligase regulates catalytic activity by covalent and noncovalent interactions and influences glutathione homeostasis in vivo[J]. Journal of Biological Chemistry,2003, 278(47): 46369-46377. DOI:10.1074/jbc.M308035200.
[25] HANNA S E, WANG H H. Assessment of environmental factors on Listeria monocytogenes Scott A inlA gene expression by relative quantitative taqman real-time reverse transcriptase PCR[J]. Journal of Food Protection, 2006, 69(11): 2754-2757. DOI:10.4315/0362-028X-69.11.2754.
[26] HADJILOUKA A, MOLFETA C, PANAGIOTOPOULOU O, et al.Expression of Listeria monocytogenes key virulence genes during growth in liquid medium, on rocket and melon at 4, 10 and 30 ℃[J].Food Microbiology, 2016, 55: 7-15. DOI:10.1016/j.fm.2015.11.008.
[27] OLESEN I, VOGENSEN F K, JESPERSEN L. Gene transcription and virulence potential of Listeria monocytogenes strains after exposure to acidic and NaCl stress[J]. Foodborne Pathogens & Disease, 2009, 6(6):669. DOI:10.1089=fpd.2008.0243.
[28] ALESSANDRIA V, RANTSIOU K, DOLCI P, et al. A comparison of gene expression of Listeria monocytogenes in vitro, and in the soft cheese Crescenza[J]. International Journal of Dairy Technology, 2013,66(1): 83-89. DOI:10.1111/1471-0307.12008.
[29] RANTSIOU K, MATARAGAS M, ALESSANDRIA V, et al.Expression of virulence genes of Listeria monocytogenes in food[J].Journal of Food Safety, 2012, 32(2): 161-168. DOI:10.1111/j.1745-4565.2011.00363.x.
[30] LARSEN N, JESPERSEN L. Expression of virulence-related genes in Listeria monocytogenes grown on danish hard cheese as affected by NaCl content[J]. Foodboren Pathogens and Disease, 2015, 12(6): 536-543. DOI:10.1089/fpd.2014.1930.
Virulence Gene Expression of Listeria monocytogenes Grown in Salmon Matrix
ZHU Yahui, ZHU Hongri, WANG Jiaying, ZHANG Gongliang, HAO Hongshun, HOU Hongman*
(Liaoning Key Lab for Aquatic Processing Quality and Safety, Dalian Polytechnic University, Dalian 116034, China)
Abstract:The aim of the present study was to assess the inf l uence of storage temperature on virulence gene expression of Listeria monocytogenes (Lm) grown in a food matrix. Lm ATCC 19115 was grown in a salmon matrix or tryptone soya agar containing 0.6% yeast extract (TSA-YE) (control) at different temperatures (0, 4 and 7 ℃) for 24 and 48 h, respectively.Then, the bacterial cells were collected by centrifugation for RNA extraction using a commercial kit (TianGen, Dalian),and the expression levels of hlyA, inlB, prfA and sigB were assessed by RT-qPCR. The RT-qPCR data showed that the expression of all four major virulence genes was up-regulated when the strain was grown in a salmon matrix compared to TSA-YE at each temperature. In addition, hlyA possessed the highest expression level among these four genes. The expression levels of prfA and sigB in Lm from salmon stored at 4 ℃ were signif i cantly higher than those at 0 and 7 ℃(P < 0.01). The expression levels of inlB and hlyA in salmon stored for 24 h at different temperatures were in the descending order of 7 ℃ > 4 ℃ > 0 ℃ (P < 0.01). In the salmon matrix, the expression levels of all four major virulence genes at 48 h were signif i cantly higher than those at 24 h (P < 0.01). The results of this study can provide basic information for risk assessment and control of Lm in food matrices.
Keywords:Listeria monocytogenes; virulence genes; salmon matrix
DOI:10.7506/spkx1002-6630-201802022
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2018)02-0138-06
引文格式:朱雅慧, 朱洪日, 王佳莹, 等. 三文鱼基质上单核细胞性李斯特菌毒力因子的表达[J]. 食品科学, 2018, 39(2): 138-143.
DOI:10.7506/spkx1002-6630-201802022. http://www.spkx.net.cn
ZHU Yahui, ZHU Hongri, WANG Jiaying, et al. Virulence gene expression of Listeria monocytogenes grown in salmon matrix[J]. Food Science, 2018, 39(2): 138-143. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802022.http://www.spkx.net.cn
收稿日期:2017-01-12
基金项目:辽宁省自然科学基金项目(201602049);“十二五”国家科技支撑计划项目(2015BAD17B00)
第一作者简介:朱雅慧(1991—),女,硕士研究生,研究方向为食品安全与检测。E-mail:15840684346@163.com
*通信作者简介:侯红漫(1964—),女,教授,博士,研究方向为食品生物技术。E-mail:houhongman@dlpu.edu.cn

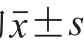 表示。用Excel统计数据,采用SPSS 20.0软件进行显著性分析。
表示。用Excel统计数据,采用SPSS 20.0软件进行显著性分析。




