1 株广谱抗菌活性菌株的筛选鉴定及其抗菌蛋白的分离纯化
赵圣明,赵岩岩,马汉军,何鸿举
(河南科技学院食品学院,河南 新乡 453003)
摘 要:从湖南传统腊肉中分离筛选得到1 株具有广谱抑菌活性的菌株HLR13,该菌株发酵液对蜡样芽孢杆菌、荧光假单胞菌、藤黄微球菌和肠炎沙门菌等食品中常见的致病菌具有较强的抑制活性。通过形态学特征、生理生化特征及16S rRNA序列分析,该菌株被鉴定为枯草芽孢杆菌斯皮兹仁亚种(Bacillus subtilis subsp. spizienii)。采用硫酸铵分级沉淀、离子交换层析(Q Sepharose FF)和凝胶过滤层析(Sephadex G-75)等方法对该菌株所产抗菌蛋白进行分离纯化,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳检测显示纯化后的蛋白为单一条带,通过基质辅助激光解吸电离飞行时间质谱分析和NCBI/nr蛋白数据库比对初步确定该抗菌蛋白分子质量为31 494 Da,是枯草芽孢杆菌产生的一种假定蛋白。本实验可为新型天然防腐剂的开发提供一定理论依据。
关键词:枯草芽孢杆菌斯皮兹仁亚种(Bacillus subtilis subsp. spizienii);抗菌蛋白;菌株鉴定;分离;纯化
枯草芽孢杆菌(Bacillus subtilis)是一种内生孢子的革兰氏阳性菌,具有较强的抗逆能力,也是目前环境中广泛存在的非致病性细菌,不产毒素,对人畜不产生危害,具有良好的发酵能力,能分泌多种酶类和抗菌活性物质等[1-2],在农业和食品领域已被广泛应用[3-4]。枯草芽孢杆菌可以生产多种抗菌肽,包括核糖体合成的subtilosin A[5]、sublancin[6]和mersacidi[7]等和非核糖体合成的iturin和fengycin等[8]。此外,枯草芽孢杆菌还能够产生多种抗菌蛋白,对常见的病原性细菌和真菌具有较好的抑制作用,尤其是在生物防治植物病虫害方面有着重要应用。Yang Chiyea等[9]从分离自台湾马铃薯种植园土壤中的枯草芽孢杆菌CHU26的发酵产物中获得了一种抗菌蛋白,该蛋白属于几丁质酶,对植物致病真菌立枯丝核菌具有明显的抑制作用。Zhao Jing等[10]从分离自白菜根际土壤中的枯草芽孢杆菌XF-1发酵产物中获得了抗菌蛋白,该蛋白对引起十字花科植物根肿病的甘蓝根肿菌具有较强的抑制作用。黄娜等[11]从分离自土壤的枯草芽孢杆菌发酵产物中获得了抗菌蛋白,此抗菌蛋白对苹果炭疽病菌具有较好的抑制作用。目前国内外关于抗菌蛋白的研究主要集中于农业生物防治方面,在食品防腐保鲜方面的应用研究尚较少[12-13]。然而还有许多枯草芽孢杆菌产的抗菌蛋白未被开发,筛选能够产生高效广谱抗菌蛋白并可应用于食品工业的微生物菌株,将为天然抗菌蛋白的应用开辟更广阔的前景。
本实验从中国传统发酵腊肉中分离获得1 株对食源性致病菌具有较强抑制活性的枯草芽孢杆菌菌株,采用硫酸铵分级沉淀、离子交换层析、凝胶过滤层析对抗菌蛋白进行分离纯化,并对其抑菌活性进行测定,为抗菌蛋白在食品防腐保鲜中的开发应用提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与试剂
湖南传统农家自制腊肉,样品取回后贮藏于4 ℃冰箱备用。
革兰氏染色试剂盒 杭州百思生物技术有限公司;细菌总DNA提取试剂盒 生工生物工程(上海)股份有限公司;10×Taq buffer、MgCl2、Taq DNA聚合酶、Gel Extraction Kit、DNA Ladder Marker 日本TaKaRa公司;Sephadex LH-20 美国Phamarcia公司;其他试剂均为国产分析纯。
1.1.2 指示菌与培养基
蜡样芽孢杆菌(A S 1.1 8 4 6)、大肠杆菌(ATCC25922)、荧光假单胞菌(AS1.1802)、肠炎沙门菌(CICC21527)、生孢梭菌(CICC10385)、藤黄微球菌(C M C C(B)2 8 0 0 1)、串珠镰刀菌(CCCCM30174)和黄曲霉(CICC2062)为本实验室保存。
LB培养基:胰蛋白胨10.0 g、酵母膏5.0 g、NaCl 10.0 g、pH 7.0,蒸馏水定容至1 L;121 ℃、20 min灭菌备用,固体培养基另加1.5%~2%的琼脂。
菌株鉴定用培养基:在菌株鉴定中所用到的营养琼脂半固体培养基、淀粉培养基、糖发酵培养基、葡萄糖蛋白胨水培养基、柠檬酸盐培养基、醋酸铅培养基等均参照东秀珠等[14]的《常见细菌系统鉴定手册》配制。
1.2 仪器与设备
Orion 3 STAR pH计 美国Thermo公司;Sartious电子精密天平 北京赛多利斯天平有限公司;TOMY-SX-700全自动高压灭菌锅 日本Tomy公司;Centrifuge 5804R冷冻高速离心机 德国Eppendorf公司;PTC-100TMPCR仪 美国MJ Research公司;PowPacTMHC164-5052高电流电泳仪、Mini Protein-II型垂直电泳仪美国Bio-Rad公司;JS-380C全自动数码凝胶成像分析仪上海培清科技有限公司;AKTA蛋白纯化系统、Hitrap QFF离子交换层析柱 美国GE Healthcare公司;恒温干燥箱、PYX-DHS-50X65隔水式电热恒温培养箱 上海跃进医疗器械厂;DBS-100电脑自动部分收集器 上海沪西分析仪器公司;基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight tandem mass spectrometry,MALDI-TOF-MS/MS) 德国Bruker公司。
1.3 方法
1.3.1 菌株的分离
在无菌条件下,用剪刀将腊肉样品剪成5 g的小块放入装有100 mL生理盐水和玻璃珠的250 mL三角瓶中,37 ℃、180 r/min振荡培养30 min。然后将样品进行梯度稀释,选择10-3、10-4、10-5、10-6CFU/mL 4 个浓度梯度各100 μL涂布于LB固体培养基上,37 ℃培养箱倒置培养24 h。随机挑取单菌落,在LB固体培养基上进行划线分离纯化,最后挑取形态单一的单菌落贮存备用。
1.3.2 产抗菌蛋白菌株的初筛
产抗菌蛋白菌株的初筛选用琼脂块抑菌法[15]。将分离得到的菌株分别划线于LB固体培养基平板上,37 ℃培养36 h后,使用灭菌打孔器于生长菌落旁取出直径为5 mm的琼脂块,然后将琼脂块分别摆放于混合有蜡样芽孢杆菌和荧光假单胞菌的指示菌琼脂平板表面,37 ℃培养12~16 h后测量抑菌圈直径。1.3.3 产抗菌蛋白菌株的复筛
将经初筛具有抗菌活性的菌株接种于100 mL LB液体培养基中,37 ℃、180 r/min发酵24 h。12 000 r/min离心10 min,上清液经0.22 µm孔径的细菌滤器过滤,采用琼脂孔扩散法进行抑菌活性测定。将100 mL LB固体培养基中混入1 mL指示菌(大肠杆菌、藤黄微球菌和肠炎沙门菌)培养液,平板倒好后用直径为5 mm的无菌打孔器在抑菌平板上打孔,然后取50 µL过滤后的发酵上清液注入琼脂孔中,指示细菌37 ℃培养12 h,观察并测量抑菌圈直径大小。
1.3.4 菌株鉴定
1.3.4.1 生理生化鉴定
主要从菌落形态及菌体观察、硝酸盐实验、柠檬酸盐实验、V-P实验、接触酶实验、淀粉水解实验、甲基红实验、吲哚实验、H2S产生实验和尿素实验等对菌株进行形态和生理生化鉴定,具体方法参照《伯杰细菌鉴定手册》(第八版)[16]和《常见细菌系统鉴定手册》[14]。
1.3.4.2 基于16S rDNA基因的分子生物学鉴定
目标菌株基因组DNA提取:将菌株以1%的接种量接种于LB培养基中,37 ℃培养12 h后,取5 mL菌液9 000 r/min离心2 min后弃上清液后收集菌体,利用TE缓冲液再离心洗涤2 次后,按照细菌基因组提取试剂盒说明书提取细菌总DNA。16S rDNA基因的PCR扩增和序列测定:采用原核生物16S rDNA扩增的通用引物(由上海生工生物公司合成),正向引物:fD1 5’-AGAGTTTGATCCTGGCTCAG-3’,反向引物:rP1 5’-GGTTACCTTGTTACGACTT-3’[17]。PCR反应体系:10×PCR buffer,5 μL;10 mmol/L MgCl2,3 μL;2.0 μmol/L dNTP,4 μL;10 μmol/L fD1,3 μL;10 μmol/L rP1,3 μL;1.0 μmol/L DNA模板,1 μL,5 U/μL TaqTMDNA聚合酶,1 μL;ddH2O,30 μL;总反应体系50 μL。PCR扩增得到的目的片段与T载体连接转化到大肠杆菌DH5α中,挑取转化子送南京金斯瑞生物公司测序,将得到的16S rDNA基因序列,在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)上的GenBank序列数据库进行分析,在基因数据库中进行同源性搜索比对。
1.3.5 系统发育树的构建
将菌株的16S rDNA基因序列和GenBank上的同源序列在应用BLAST程序比对的基础上,通过Clustal X1.85软件比对后利用MEGA 5.05软件以邻位相连法构建系统发育树,应用bootstrap程序分析,重复次数为1 000 次[18]。
1.3.6 抗菌蛋白的分离纯化
将发酵液4 ℃、12 000 r/min离心10 min,除去菌体,上清液加入硫酸铵粉末至饱和度分别为40%、50%、60%、70%、80%、90%,搅拌后置于4 ℃冰箱放置8 h,然后9 000 r/min离心10 min分别收集沉淀和上清液,沉淀经去离子水复溶后,用1 mol/L NaOH溶液调节pH值至6.5,分别检测抗菌活性确定硫酸铵盐析的最佳饱和度。将最终收集的沉淀经透析脱盐后,获得抗菌蛋白的粗提物利用QFF离子交换层析柱和AKTA蛋白纯化系统进行层析纯化。纯化条件为流速2 mL/min、最高柱压0.3 MPa、收集体积为1 mL,洗脱体积为5 个柱体积,平衡体积为5 个柱体积,进样体积2 mL。分别用0.10、0.25、0.40、1.00 mol/L NaCl溶液(pH 8.5的Tris-HCl作为缓冲液)进行梯度洗脱。280 nm波长处检测各蛋白洗脱组分的吸光度,经蒸馏水透析脱盐后检测其抑菌活性。收集得到的抑菌活性组分利用Sephadex G-75凝胶层析进行进一步纯化。Sephadex G-75凝胶溶胀后装柱(70 cm×2.6 cm),预先用0.5 mol/L Tris-HCl缓冲液(pH 9.0)平衡过夜。将透析脱盐后的抗菌蛋白粗溶液进行超滤浓缩,取2 mL浓缩样品上样,以相同的缓冲液洗脱,洗脱流速为0.3 mL/min,每管收集3 mL,280 nm波长处检测各个洗脱组分,PEG 20000浓缩后分别做抑菌实验,收集抑菌活性组分-20 ℃储存备用。
1.3.7 抗菌蛋白分子质量的测定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定菌株抗菌蛋白分子质量[19]。利用Mini Protein-II型垂直电泳仪电泳2 h。电泳结束后利用考马斯亮蓝染色过夜,7.5%冰醋酸固定后,置于脱色摇床振荡脱色30~60 min至背景干净,条带清晰。
1.3.8 MALDI-TOF-MS/MS分析
电泳检测为单一条带的样品经胰蛋白酶酶解后通过MALDI-TOF-MS/MS进行质谱分析获得该蛋白的肽指纹图谱,NCBI数据库检索和比对。质谱条件为紫外激光波长355 nm,加速电压为20 kV,采用正离子模式和自动获取数据的模式采集数据,将PMF强度最大的几个峰进行串联质谱分析;谱图用肌红蛋白酶解肽段进行外标校正,所获得图谱使用GPS V3.6软件进行分析,蛋白质质谱数据通过MASCOT 2.1软件进行蛋白质数据库检索并鉴定分离得到的蛋白质。
1.3.9 抗菌蛋白抑菌活性测定
采用经Sephadex G-75纯化获得的抗菌蛋白活性组分,利用琼脂孔扩散法测定抗菌蛋白的抑菌活性,指示菌株包括蜡样芽孢杆菌、大肠杆菌、荧光假单胞菌、肠炎沙门菌、藤黄微球菌、生孢梭菌、串珠镰刀菌和黄曲霉。
2 结果与分析
2.1 抗菌活性菌株的分离筛选结果
以湖南传统农家自制腊肉为筛选样品,通过琼脂块法进行初筛,共筛选获得79 株对蜡样芽孢杆菌和荧光假单胞菌具有较好抑制活性的菌株。通过琼脂扩散法进行抑菌活性的复筛,确定19 株菌具有较好的抑菌效果,对指示菌的抑菌效果见表1。其中菌株HLR13的抑菌效果最好,对5 株指示菌(蜡样芽孢杆菌、荧光假单胞菌、大肠杆菌、藤黄微球菌和肠炎沙门菌)均具有较好的抑制作用,对蜡样芽孢杆菌的抑菌圈直径达到了19 mm,如图1所示。因此本研究选取菌株HLR13为后续实验菌株。
表1 菌株发酵液对指示菌的抑菌作用
Table 1 Antibacterial activity of cell-free supernatant of 19 isolated strains
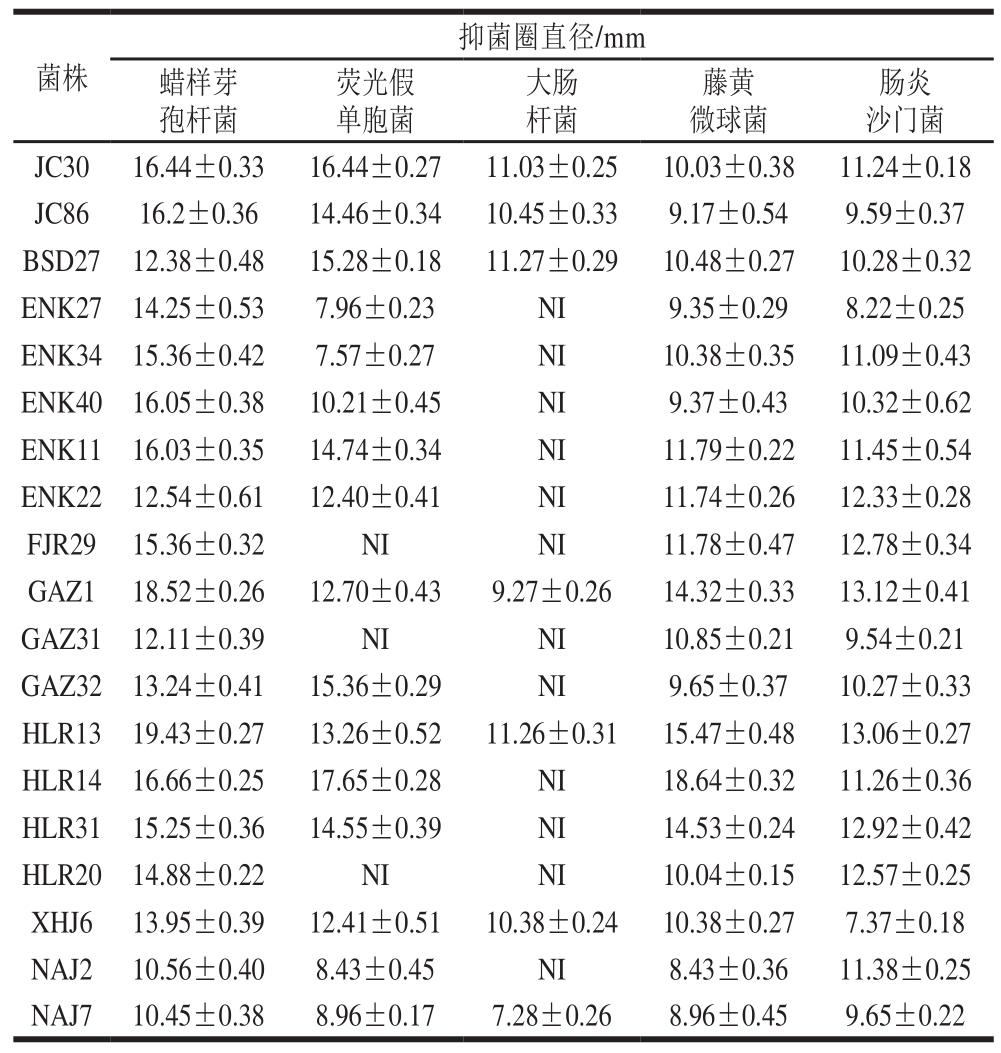
注:NI.无抑制作用。
肠炎沙门菌JC30 16.44±0.33 16.44±0.27 11.03±0.25 10.03±0.38 11.24±0.18 JC86 16.2±0.36 14.46±0.34 10.45±0.33 9.17±0.54 9.59±0.37 BSD27 12.38±0.48 15.28±0.18 11.27±0.29 10.48±0.27 10.28±0.32 ENK27 14.25±0.53 7.96±0.23 NI 9.35±0.29 8.22±0.25 ENK34 15.36±0.42 7.57±0.27 NI 10.38±0.35 11.09±0.43 ENK40 16.05±0.38 10.21±0.45 NI 9.37±0.43 10.32±0.62 ENK11 16.03±0.35 14.74±0.34 NI 11.79±0.22 11.45±0.54 ENK22 12.54±0.61 12.40±0.41 NI 11.74±0.26 12.33±0.28 FJR29 15.36±0.32 NI NI 11.78±0.47 12.78±0.34 GAZ1 18.52±0.26 12.70±0.43 9.27±0.26 14.32±0.33 13.12±0.41 GAZ31 12.11±0.39 NI NI 10.85±0.21 9.54±0.21 GAZ32 13.24±0.41 15.36±0.29 NI 9.65±0.37 10.27±0.33 HLR13 19.43±0.27 13.26±0.52 11.26±0.31 15.47±0.48 13.06±0.27 HLR14 16.66±0.25 17.65±0.28 NI 18.64±0.32 11.26±0.36 HLR31 15.25±0.36 14.55±0.39 NI 14.53±0.24 12.92±0.42 HLR20 14.88±0.22 NI NI 10.04±0.15 12.57±0.25 XHJ6 13.95±0.39 12.41±0.51 10.38±0.24 10.38±0.27 7.37±0.18 NAJ2 10.56±0.40 8.43±0.45 NI 8.43±0.36 11.38±0.25 NAJ7 10.45±0.38 8.96±0.17 7.28±0.26 8.96±0.45 9.65±0.22菌株抑菌圈直径/mm蜡样芽孢杆菌荧光假单胞菌大肠杆菌藤黄微球菌
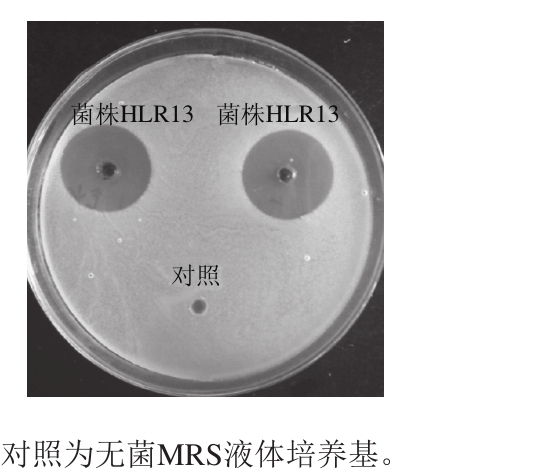
图1 菌株HLR13对蜡样芽孢杆菌的抑菌效果
Fig. 1 Inhibitory effect of strain HLR13 on Bacillus cereus
2.2 菌株生理生化和分子生物学鉴定结果
经革兰氏染色和镜检观察菌株形态确定该菌株为革兰氏阳性,菌体呈直杆状,两端钝圆,可形成卵圆形芽孢,芽孢孢囊膨大,中生至次端生。菌落在LB琼脂培养基上生长菌落大小直径约为0.3~0.5 mm,不产色素,菌落呈淡黄色,近圆形,表面光滑,无明显褶皱,边缘整齐,黏稠,微凸起,有光泽。菌株生理生化结果如表2所示,硝酸盐实验、柠檬酸盐实验、V-P实验、接触酶实验和淀粉水解实验等呈阳性,甲基红实验、吲哚实验、H2S实验和尿素实验呈阴性。结合以上菌落培养特征和生理生化特征,初步将菌株HLR13鉴定为枯草芽孢杆菌。
表2 菌株HLR13生理生化鉴定结果
Table 2 Physiological and biochemical identif i cation of strain HLR13

注:+.阳性;-.阴性。
特征 结果 特征 结果革兰氏染色 + H2S产生 -芽孢膨大 + D-葡萄糖 +需氧生长 + 鼠李糖 -厌氧生长 + D-木糖 +硝酸盐还原 + D-甘露醇 -柠檬酸盐利用 + 乳糖 +V-P实验 + 蔗糖 +甲基红实验 - 明胶液化 +接触酶实验 + 葡萄糖产气 +淀粉水解实验 + 最适生长温度 37 ℃吲哚产生 - 尿素利用 -
利用16S rDNA引物进行PCR扩增,PCR产物经琼脂糖凝胶电泳检测,得到一条约1 600 bp的特异性条带。将扩增产物回收后进行测序,菌株HLR13 16S rDNA序列长度为1 579 bp。将所测序列经校对和拼接后利用NCBI的BLAST程序与GenBank数据库中的核酸数据进行同源性比对,发现菌株HLR13与枯草芽孢杆菌的相似性达到99%。选择相似性较高的菌株及芽孢菌属内相关菌株的16S rDNA序列构建系统发育树,结果见图2。结合形态学特征、生理生化实验以及16S rDNA系统发育树结果最终确定菌株HLR13在细菌分类学上属于枯草芽孢杆菌斯皮兹仁亚种(B. subtilis subsp. spizienii)。
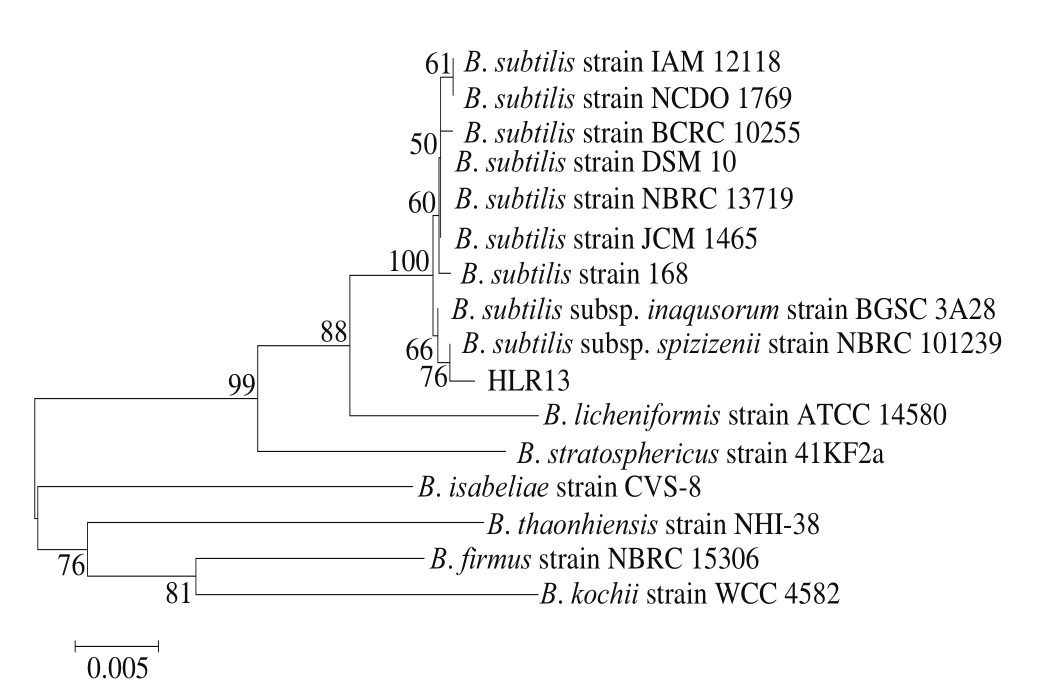
图2 菌株HLR13的系统发育树关系图
Fig. 2 Phylogenetic tree of strain HLR134 based on 16S rRNA sequence
2.3 抗菌蛋白的分离纯化
将发酵液经过高速冷冻离心后收集无细胞上清液,首先采用硫酸铵进行盐析。对盐析后的上清液和经透析脱盐、聚乙二醇浓缩后的抗菌粗蛋白分别测定抗菌活性。由表3可知,不同饱和度硫酸铵盐析后的抑菌活性差异较大,硫酸铵饱和度为80%时获得沉淀的抑菌活性最强,为了达到最佳盐析效果,选用饱和度为80%的硫酸铵溶液作为沉淀抗菌蛋白的最佳硫酸铵浓度。由图3可知,浓缩后的抗菌蛋白粗提液经QFF离子交换层析,得到2 个未被吸附的蛋白组分和4 个被吸附的蛋白洗脱组分(Ⅰ、Ⅱ、Ⅲ、Ⅳ),抑菌活性检测后发现,0.1 mol/L NaCl洗脱液洗脱下的组分Ⅰ具有抑菌活性,其余组分均无抑菌活性,说明采用该离子交换层析可以有效地将其他杂质和抗菌蛋白分开。合并收集抑菌活性组分Ⅰ,浓缩后采用Sephadex G-75凝胶层析进一步纯化。经洗脱后得到2 个蛋白洗脱组分S1和S2(图4)。经抑菌活性检测,发现S2蛋白洗脱峰具有抑菌活性,将S2抑菌活性组分浓缩后4 ℃保存用于下一步分析。
表3 枯草芽孢杆菌HLR13发酵上清液硫酸铵沉淀后抑菌活性
Table 3 Antibacterial activity of cell-free culture supernatant of strain HLR13 salted out with ammonium sulfate

注:同列不同小写字母表示差异显著(P<0.05)。
抑菌直径/mm沉淀 上清液40 6.36±0.21a14.55±0.54a50 8.43±0.14b13.86±0.33a60 9.72±0.45c13.17±0.36b70 12.35±0.16d10.24±0.78c80 14.69±0.25e8.24±0.22d90 11.08±0.61f7.12±0.19e硫酸铵饱和度/%
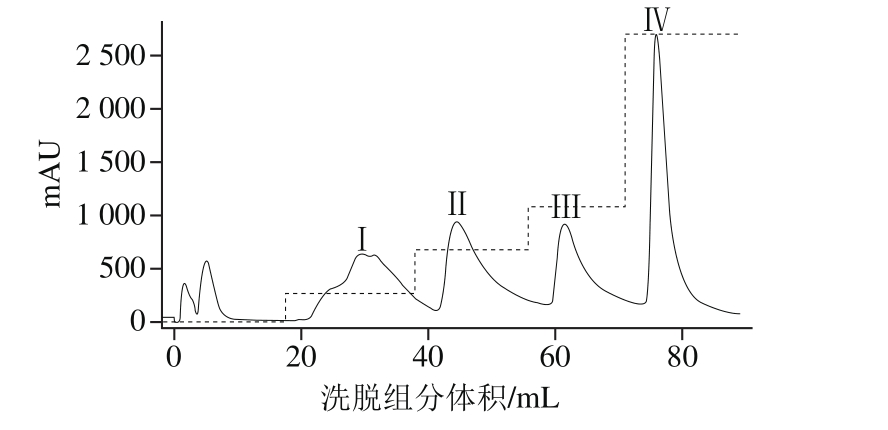
图3 枯草芽孢杆菌HLR13产抗菌蛋白的离子交换层析洗脱曲线
Fig. 3 Elution curve of antimicrobial protein from Bacillus subtilis HLR13 on Q Sepharose Fast Flow
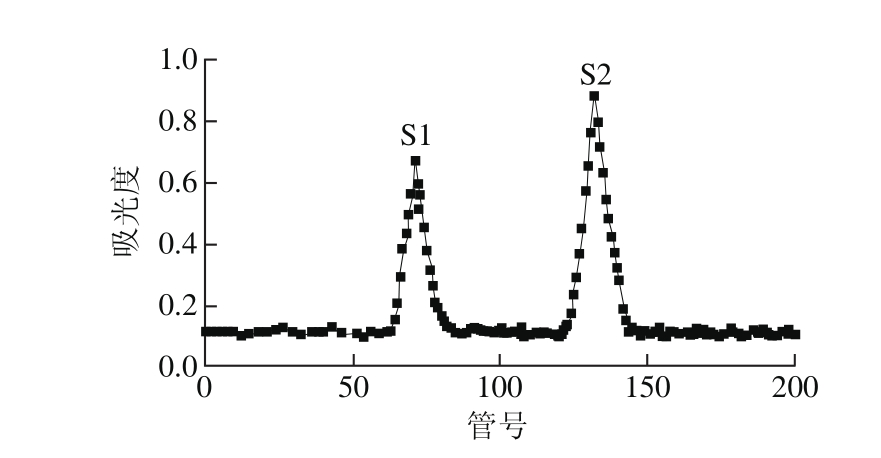
图4 枯草芽孢杆菌HLR13产抗菌蛋白的Sephadex G-75洗脱曲线
Fig. 4 Elution curve of the antimicrobial protein on Sephadex G-75 gel
2.4 分子质量测定结果
凝胶层析纯化后的抗菌蛋白SDS-PAGE检测结果,如图5所示,经凝胶层析纯化后,抗菌蛋白电泳显示为单一条带,表明抗菌蛋白的纯化达到电泳纯,根据标准分子质量蛋白可得到该抗菌蛋白的表观分子质量约为29.8 kDa。
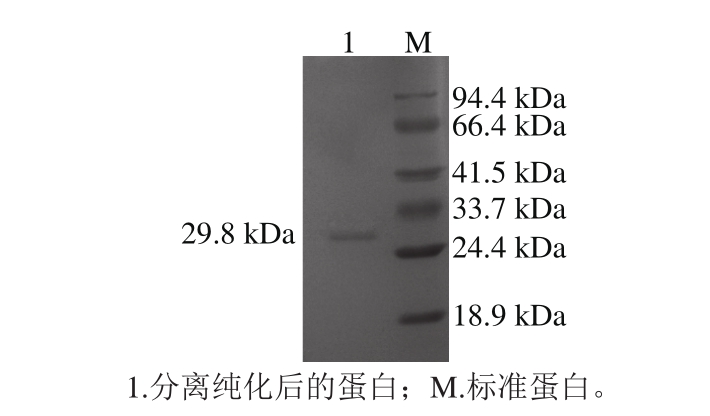
图5 枯草芽孢杆菌HLR13抗菌蛋白SDS-PAGE图谱
Fig. 5 SDS-PAGE pattern of the antimicrobial protein
2.5 MALDI-TOF-MS/MS分析结果
经SDS-PAGE得到的单一条带样品进行MALDI-TOFMS/MS质谱分析,结果见图6a,将其中信号较强的4 个分子质量为1 030、1 191、1 589 Da和1 685 Da的解离肽段进行二级质谱分析,结果见图6b~6e。将质谱测得的蛋白肽指纹图谱及解离肽段的二级质谱数据通过Mascot软件在线检索NCBI数据库得知,蛋白得分最高者为188 分,是一种枯草芽孢杆菌产的假定蛋白。经Mascot软件检索NCBI数据库细菌全库,通过计算得分超过78 分以上,检索结果具有显著性(P<0.05),且分数越高,说明蛋白的相似性及比对结果的可信度也更高。因此,根据比对结果可以初步确定该抗菌蛋白为枯草芽孢杆菌假定蛋白,可能为一种新抗菌蛋白,测得该蛋白的分子质量为31 494 Da,与纯化的蛋白条带在分子质量上较为相近。
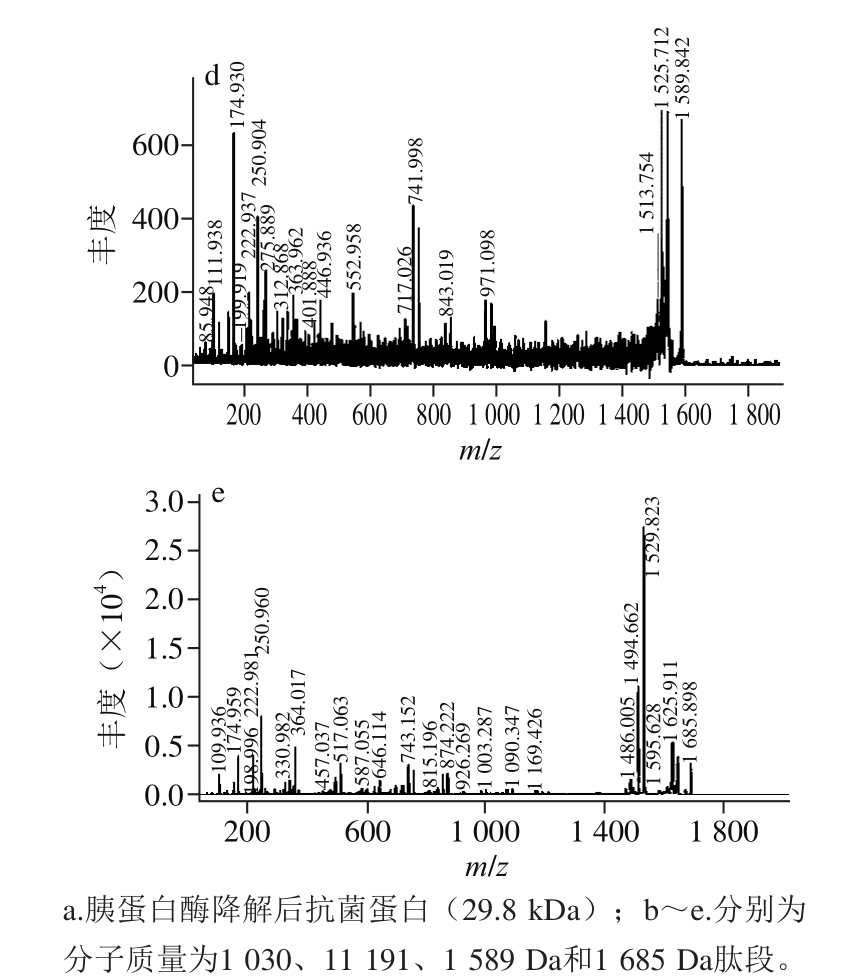
图6 抗菌蛋白的肽段质谱图
Fig. 6 MALDI-TOF-MS/MS of peptide fragments with different molecular weights from trypsin digestion of the antimicrobial protein
2.6 抗菌蛋白的抑菌活性
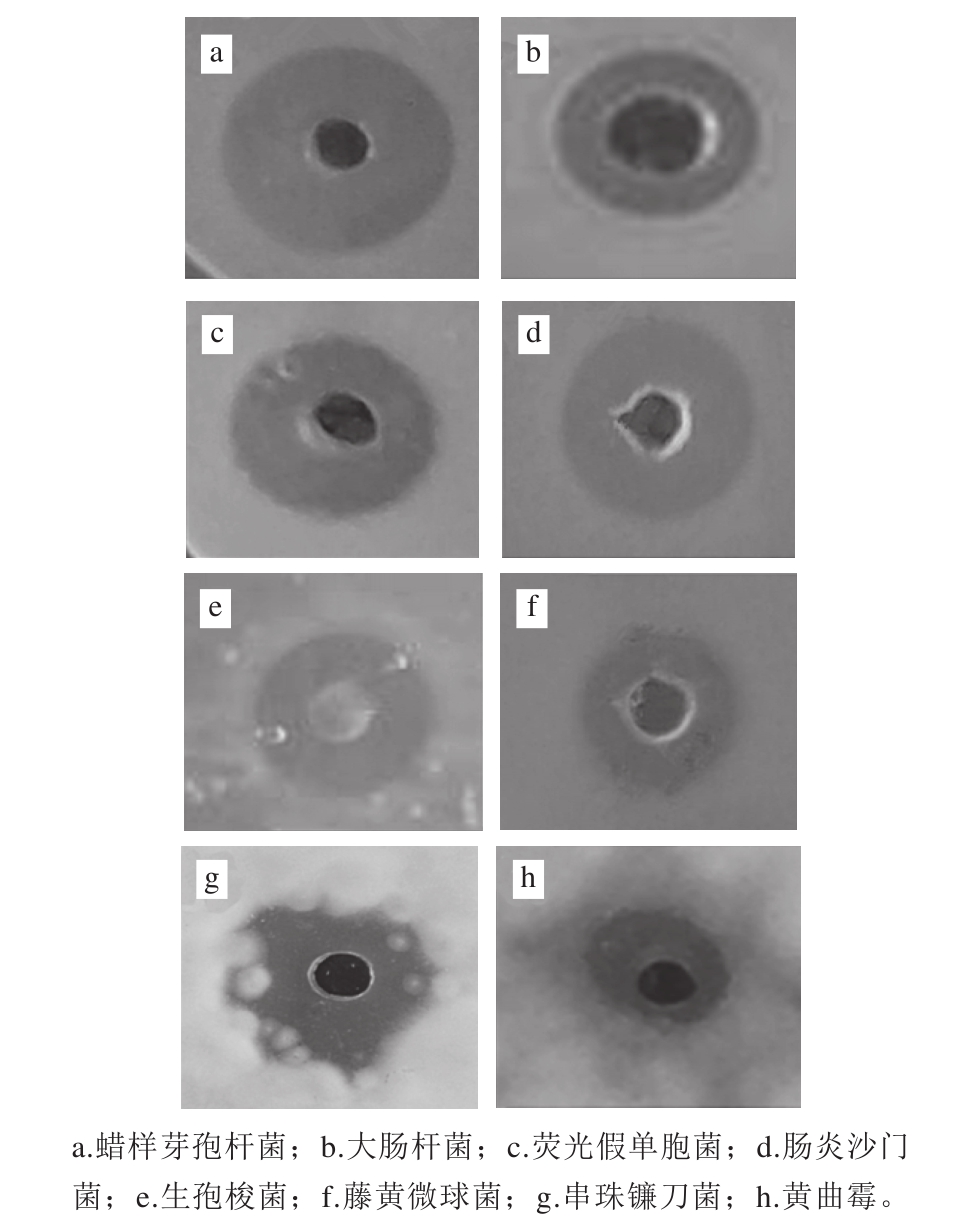
图7 枯草芽孢杆菌HLR-13产抗菌蛋白的抑菌活性
Fig. 7 Inhibitory activity of the antimicrobial protein
由图7可知,经Sephadex G-75凝胶层析纯化得到的抗菌蛋白对食品中常见的一些致病菌和腐败菌具有显著的抑制作用,包括蜡样芽孢杆菌、大肠杆菌、荧光假单胞菌、肠炎沙门菌、生孢梭菌、藤黄微球菌、串珠镰刀菌和黄曲霉。
3 讨 论
本实验从湖南传统农家腊肉中筛选得到1株具有较强抑菌活性的菌株,经过对菌株的生理生化鉴定和分子生物学鉴定,最终将该菌株确定为枯草芽孢杆菌。关于腊肉中筛选获得发酵性能优良的菌株的研究报道较多,如于华等[20]从四川腊肉中筛选鉴定得到1株产脂肪酶能力较强的团青霉;王海燕等[21]从湖南腊肉中筛选鉴定获得产香能力较强的模仿葡萄球菌S52;栗桂蓉等[22]从湖南腊肉中筛选鉴定得到高产丁二酮的地衣芽孢杆菌BCL-8。而从腊肉中筛选抗菌活性菌株的研究报道较少且都以乳酸菌为主,如鲁晶晶[23]从湖南湘西腊肉中筛选鉴定得到1株植物乳杆菌LJ-3,该菌株对大肠杆菌、沙门菌和枯草芽孢杆菌具有较好抑菌作用;胡逸敏等[24]从湖南腊肉中筛选鉴定得到对单核细胞性李斯特菌具有较好抑制作用的屎肠球菌。许多芽孢杆菌可以产生抗菌蛋白,但是以前研究报道的大部分产抗菌蛋白的芽孢杆菌菌株都分离自土壤中,且抗菌蛋白大多应用于农业生物防治中。例如刘刚等[25]从农田土壤中分离得到的枯草芽孢杆菌Loq18产的抗菌蛋白主要应用于采后草莓和葡萄灰霉病的防治;于杰等[26]从香蕉根部土壤分离得到的枯草芽孢杆菌B25产的抗菌蛋白对几种热带植物病原真菌具有较好的抑制作用;秦楠等[19]从玉米田土壤中分离得到的解淀粉芽孢杆菌HRH317产的抗菌蛋白对引起小麦赤霉病和玉米茎基腐病的禾谷镰孢菌具有较好的抑制作用;姚乌兰等[27]从水稻根际土壤中分离得到的多黏类芽孢杆菌WY110菌株产的抗菌蛋白对水稻稻瘟病菌具有较好的抑制作用。因此,从天然发酵食品中筛选获得抗菌蛋白的芽孢杆菌生产菌株,并将天然抗菌蛋白应用于食品防腐保鲜领域具有一定的科学研究意义。
微生物发酵液中一般含有多种次生代谢产物,为了对抗菌蛋白进行分离纯化,首先需要对发酵液进行粗提取。目前,粗提取的方法主要有硫酸铵沉淀和有机溶剂沉淀。后者容易引起蛋白质变性,前者成本低且不易引起蛋白质变性,因此芽孢杆菌所产的抗菌蛋白大多采用硫酸铵沉淀法进行粗提取,并与逐步层析等方法相结合进行进一步的分离纯化[28-30]。牛焕杰等[31]利用枯草芽孢杆菌E1R-j获得了分子质量为115 kDa且对苹果树腐烂病菌具有抑制活性的抗菌蛋白,杨丽荣等[32]利用解淀粉芽孢杆菌YN-1菌株获得了分子质量约为31 kDa且对黄瓜灰霉病菌具有抑制活性的抗菌蛋白,Zhao Jing等[10]利用枯草芽孢杆菌PBT1获得了分子质量约为25 kDa且对甘蓝根肿菌具有较强抑制活性的抗菌蛋白。本研究中枯草芽孢杆菌菌株HLR13发酵液经硫酸铵沉淀,Q Sepharose Fast Flow离子交换层析和Sephadex G-75凝胶层析纯化得到一种对食品中常见的腐败菌和致病菌具有较好抑制作用的抗菌蛋白,经过质谱鉴定和NCBI数据库比对,初步将其确定为一种枯草芽孢杆菌产的假定蛋白,分子质量为31 494 Da,此前未有研究报道该分子质量相同的蛋白具有抗菌活性,因此,该蛋白可能为枯草芽孢杆菌产生的一种新型蛋白类抗菌物质。由于本实验中抗菌物质的分离是根据蛋白质特性进行分离纯化的,且经过硫酸沉淀后上清液仍具有残留的抑菌活性,因此该菌株可能还同时产生其他种类的抗菌物质。因此可以采用薄层色谱法和高效液相色谱法等方法对该菌株可能产生的其他物质进行分离纯化,对该菌株进行充分的开发利用。
4 结 论
本研究从湖南传统腊肉中筛选鉴定得到1株枯草芽孢杆菌HLR13,从该菌株发酵液中分离纯化得到一种分子质量为31 494 Da的新型抗菌蛋白,其对食品中常见的一些致病菌和腐败菌具有显著的抑制作用。以后研究中可以选择不同地域的腊肉食品为筛选样品,期望获得更多不同种属的优良抗菌蛋白生产菌株。此外,鉴于本研究中枯草芽孢杆菌HLR13产的抗菌蛋白对食品中常见的腐败菌和致病菌具有较好抑制作用,下一步可以对抗菌蛋白的编码基因、表达调控及抑菌机理等方面进一步地进行分析,为开发新型的天然抗菌蛋白在食品工业中的应用提供理论依据和技术支撑。
参考文献:
[1] 刘颖, 张彬彬, 孙冰玉, 等. 枯草芽孢杆菌高产中性蛋白酶发酵条件的优化[J]. 食品科学, 2014, 35(13): 166-170. DOI:10.7506/spkx1002-6630-201413032.
[2] STEIN T. Bacillus subtilis antibiotics: structures, syntheses and specif i c functions[J]. Molecular Microbiology, 2005, 56(4): 845-857.DOI:10.1111/j.1365-2958.2005.04587.X.
[3] YÁNEZ-MENDIZÁBAL V, VINAS I, USALL J, et al. Formulation development of the biocontrol agent Bacillus subtilis strain CPA-8 by spray-drying[J]. Journal of Applied Microbiology, 2012, 112(5): 954-965. DOI:10.1111/j.1365-2672.2012.05258.X.
[4] 张杰, 葛武鹏, 陈瑛, 等. 纳豆激酶高产菌株的选育及固态发酵技术[J].食品科学, 2016, 37(3): 151-156. DOI:10.7506/spkx1002-6630-201603028.
[5] NIKIFOROVA O A, KLYKOV S, VOLSKI A, et al. Subtilosin A production by Bacillus subtilis KATMIRA1933 and colony morphology are inf l uenced by the growth medium[J]. Annals of Microbiology, 2016,66(2): 661-671. DOI:10.1007/s13213-015-1149-3.
[6] JI S, LI W, BALOCH A R, et al. Improved production of sublancin via introduction of three characteristic promoters into operon clusters responsible for this novel distinct glycopeptide biosynthesis[J]. Microbial Cell Factories, 2015, 14(1): 1-10. DOI:10.1186/s12934-015-0201-0.
[7] BRÖTZ H, BIERBAUM G, REYNOLDS P E, et al. The lantibiotic mersacidin inhibits peptidoglycan biosynthesis at the level of transglycosylation[J]. European Journal of Biochemistry, 1997, 246(1):193-199.
[8] LUO C, LIU X, ZHOU H, et al. Nonribosomal peptide synthase gene clusters for lipopeptide biosynthesis in Bacillus subtilis 916 and their phenotypic functions[J]. Applied & Environmental Microbiology,2015, 81(1): 422-431. DOI:10.1128/AEM.02921-14.
[9] YANG C, HO Y, PANG J, et al. Cloning and expression of an antifungal chitinase gene of a novel Bacillus subtilis isolate from Taiwan potato fi eld[J]. Bioresource Technology, 2009, 100(3): 1454-1458. DOI:10.1016/j.biortech.2008.07.039.
[10] ZHAO J, WU Y X, HO H H, et al. PBT1, a novel antimicrobial protein from the biocontrol agent Bacillus subtilis XF-1 against Plasmodiophora brassicae[J]. European Journal of Plant Pathology,2016, 145(3): 583-590. DOI:10.1007/s10658-016-0905-y.
[11] 黄娜, 周莉质, 费丹, 等. 枯草芽胞杆菌胞外抗菌蛋白的初步分离及性质的研究[J]. 植物保护, 2015(6): 49-54. DOI:10.3960/j.issn.0529-1542.2015.06.008.
[12] 樊陈, 高兆建, 陈宏伟, 等. 一株抗菌蛋白产生菌的筛选鉴定及其纯化[J]. 食品科学, 2013, 34(13): 213-217. DOI:10.7506/spkx1002-6630-201313045.
[13] 杨胜远, 韦锦, 李云, 等. 一株产抗菌活性物质解淀粉芽孢杆菌的筛选及鉴定[J]. 食品科学, 2010, 31(21): 208-212.
[14] 蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社,2001: 349-386.
[15] 贾锐, 陆兆新. 原桃胶中1 株芽孢杆菌的分离鉴定及其主要抗菌物质[J]. 食品科学, 2016, 37(21): 136-143. DOI:10.7506/spkx1002-6630-201621024.
[16] BUCHANAN R E, GIBBONS N E. 伯杰细菌鉴定手册[M]. 8版. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 北京:科学出版社, 1984: 729-736.
[17] DENG Y, LU Z, LU F, et al. Study on an antimicrobial protein produced by Paenibacillus polymyxa JSa-9 isolated from soil[J].World Journal of Microbiology and Biotechnology, 2011, 27(8): 1803-1807. DOI:10.1007/s11274-010-0638-6.
[18] MAO S, LU Z, ZHANG C, et al. Purification, characterization, and heterologous expression of a thermostable β-1,3-1,4-glucanase from Bacillus altitudinis YC-9[J]. Applied Biochemistry and Biotechnology,2013, 169(3): 960-975. DOI:10.1007/s12010-012-0064-3.
[19] 秦楠, 郝林, 李鑫. 解淀粉芽胞杆菌HRH317抗菌蛋白的分离纯化及其抗菌作用[J]. 植物保护学报, 2015, 42(5): 813-819. DOI:10.13802/j.cnki.zwbhxb.2015.05.017.
[20] 于华, 黄丹, 陈卓, 等. 四川腊肉中产脂肪酶霉菌筛选及产酶条件研究[J]. 中国食品添加剂, 2016(12): 78-83. DOI:10.3969/j.issn.1006-2513.2016.12.005.
[21] 王海燕, 马长伟, 李平兰. 传统湖南腊肉中产香葡萄球菌的筛选及鉴定[J]. 食品与发酵工业, 2006, 32(5): 45-49. DOI:10.13995/j.cnki.11-1802/ts.2006.05.012.
[22] 粟桂蓉, 周璐璐, 易浪波, 等. 一株高产丁二酮菌株的筛选与鉴定[J].吉首大学学报(自然科学版), 2016, 37(2): 38-42. DOI:10.3969/j.cnki.jdxb.2016.02.010.
[23] 鲁晶晶. 腊肉源广谱抑菌产生菌的分离及抑菌物质研究[D]. 长沙:湖南农业大学, 2014: 55-56.
[24] 胡逸敏, 林仲仪, 马静, 等. 产细菌素乳酸菌的筛选及鉴定[J]. 食品工业科技, 2013, 34(20): 212-215. DOI:10.13386/j.issn1002-0306.2013.20.064.
[25] 刘刚, 杨雪, 梅雪然, 等. 枯草芽孢杆菌Loq18抗菌蛋白的分离纯化及其对灰葡萄孢的抑制活性[J]. 四川师范大学学报(自然科学版),2015, 38(1): 119-125. DOI:10.3969/j.issn.1001-8395.2015.01.020.
[26] 于杰, 张荣意, 谭志琼, 等. 枯草芽孢杆菌B25抗真菌作用及抗菌蛋白的分离纯化[J]. 基因组学与应用生物学, 2016, 35(3): 629-634.DOI:10.13417/j.gab.035.000629.
[27] 姚乌兰, 王云山, 韩继刚, 等. 水稻生防菌株多粘类芽孢杆菌WY110抗菌蛋白的纯化及其基因克隆[J]. 遗传学报, 2004, 31(9): 878-887.
[28] LUO Y, SUN L, ZHU Z, et al. Identif i cation and characterization of an anti-fungi Fusarium oxysporum f. sp. cucumerium protease from the Bacillus subtilis strain N7[J]. Journal of Microbiology, 2013, 51(3):359-366. DOI:10.1007/s12275-013-2627-6.
[29] SENOL M, NADAROGLU H. Purification of chitinase enzymes from Bacillus subtilis bacteria TV-125, investigation of kinetic properties and antifungal activity against Fusarium culmorum[J].Annals of Clinical Microbiology and Antimicrobials, 2014, 13(1): 1-7.DOI:10.1186/s12941-014-0035-3.
[30] 陈夕军, 李娟, 孙启利, 等. 水稻内生枯草芽孢杆菌G87抗菌蛋白的分离纯化及理化特性[J]. 微生物学报, 2010, 50(10): 1353-1357.DOI:10.13343/j.cnki.wsxb.2010.10.014.
[31] 牛焕杰, 李辉, 王娜娜, 等. 苹果树腐烂病菌拮抗枯草芽孢杆菌E1R-j抗菌蛋白的分离纯化[J]. 西北农林科技大学学报(自然科学版),2016, 44(9): 135-142. DOI:10.13207/j.cnki.jnwafu.2016.09.018.
[32] 杨丽荣, 王正军, 薛保国, 等. 解淀粉芽孢杆菌YN-1抑菌蛋白TasA基因的克隆及原核表达[J]. 基因组学与应用生物学, 2010, 29(5):823-828. DOI:10.3969/gap.029.00823.
Screening and Identif i cation of a Strain with Broad-Spectrum Antimicrobial Activity and Isolation and Purif i cation of Antimicrobial Protein
ZHAO Shengming, ZHAO Yanyan, MA Hanjun, HE Hongju
(School of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China)
Abstract:A new strain with broad-spectrum antimicrobial activity, named as HLR-13, was isolated from traditional smoked bacon from Hunan province. The cell-free supernatant produced by the strain HLR-13 showed a high inhibitory activity towards many foodborne pathogenic bacteria and fungi such as Bacillus cereus, Pseudomonas fluorescens,Mirococcus luteus, and Salmonella enteritidis. Based on its morphological, physiological and biochemical characteristics as well as 16S rDNA sequence analysis, the strain HLR-13 was identified as Bacillus subtilis subsp. spizienii. Then the antimicrobial protein produced by the strain was isolated and purified through ammonium sulfate precipitation, ion exchange chromatography (Q Sepharose FF) and gel fi ltration chromatography (Sephadex G-75). Sodium dodecyl sulfatepolyacrylamide gel electrophoresis (SDS-PAGE) revealed a single band and the antimicrobial protein was preliminary identif i ed as a hypothetical protein with molecular weight of 31 494 Da by matrix-assisted laser desorption ionization timeof-f l ight tandem mass spectrometry (MALDI-TOF-MS/MS) analysis through comparison with NCBI non-redundant (NR)protein database. This research can provide a theoretical basis for developing new biological preservatives.
Keywords:Bacillus subtilis subsp. spizienii; antimicrobial protein; strain identif i cation; isolation; purif i cation
DOI:10.7506/spkx1002-6630-201802027
中图分类号:TS252.54
文献标志码:A
文章编号:1002-6630(2018)02-0170-07
引文格式:赵圣明, 赵岩岩, 马汉军, 等. 1 株广谱抗菌活性菌株的筛选鉴定及其抗菌蛋白的分离纯化[J]. 食品科学, 2018, 39(2):
170-176. DOI:10.7506/spkx1002-6630-201802027. http://www.spkx.net.cn
ZHAO Shengming, ZHAO Yanyan, MA Hanjun, et al. Screening and identification of a strain with broad-spectrumantimicrobial activity and isolation and purif i cation of antimicrobial protein[J]. Food Science, 2018, 39(2): 170-176. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201802027. http://www.spkx.net.cn
收稿日期:2017-02-16
基金项目:河南省重大科技专项(161100110600);河南省高等学校重点科研项目(17A550001);
河南科技学院高层次人才科研启动项目(2016018;2016019;2015015)
第一作者简介:赵圣明(1985—),男,讲师,博士,研究方向为食品微生物。E-mail:zhaoshengming2008@126.com










