表1 荧光定量PCR引物
Table 1 Primer sequences used for real-time PCR

白羽嘉,张培岭,黄 伟,冯作山,李 梦
(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
摘 要:以伽师瓜(抗病性强)和86-1甜瓜(抗病性一般)果实为实验材料,研究链格孢菌(Alternaria alternata)侵染后几丁质酶(chitinase,CHT)和β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)基因表达规律。甜瓜果实接种A. alternata,7 ℃贮藏,测定病斑大小,荧光定量聚合酶链式反应测定CmCht1、CmCht2和CmGlu相对表达量。结果表明:伽师瓜和86-1甜瓜接种A. alternata,在侵染9 d时出现病斑,9~24 d病斑直径不断扩大,86-1甜瓜病斑直径大于伽师瓜,侵染24 d时86-1甜瓜病斑直径是伽师瓜的1.12 倍,伽师瓜对A. alternata侵染的抵抗能力要强于86-1甜瓜。在侵染期间,伽师瓜和86-1甜瓜CmCht1、CmCht2和CmGlu相对表达量显著提高,呈先升高后降低的变化趋势,伽师瓜和86-1甜瓜CmCht1、CmCht2和CmGlu相对表达量最高峰出现时间分别相差3、6、3 d,伽师瓜CmCht1、CmCht2相对表达量始终高于86-1甜瓜,CmGlu相对表达量在侵染12~24 d高于86-1甜瓜。在侵染期间CmCht1、CmCht2和CmGlu表达规律存在差异,侵染前期CmCht1、CmCht2相对表达量较高,侵染中期和后期CmGlu相对表达量较高;A. alternata侵染前期主要诱导了CHT基因的表达,中期和后期主要诱导了GLU的基因表达,CHT和GLU的基因协同表达,起到抗病性的作用。伽师瓜抗病性强于86-1甜瓜与CHT和GLU的基因的表达密切相关。
关键词:甜瓜;链格孢菌;几丁质酶;β-1,3-葡聚糖酶;基因表达
新疆是国内优质甜瓜的原产地和主产区[1-2]。甜瓜在田间种植、采后贮运过程中始终遭受到病原菌的持续侵染,采后病害发生严重[3]。甜瓜采后微生物侵染引起的病害主要有黑斑病、白霉病、软腐病等[4-5]。由链格孢菌(Alternaria alternata)引起的黑斑病是甜瓜贮藏期危害性最大的病害[6-8]。病程相关蛋白(pathogenesis related proteins,PRs)是果实受生物或非生物胁迫诱导产生并积累的一类蛋白质总称,是果实防御体系的重要组成部分,表现出一定的抗菌作用[9]。PRs在植物体被病菌感染或诱导后迅速产生并积累,但在健康植物中不存在或表现微弱,因此PRs与植物受病原菌感染或抗病诱导密切相关[10-11]。目前果实采后PRs的研究主要集中在几丁质酶(chitinase,CHT)[12-13]和β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)上[14-15]。植物体受病原微生物侵染后,CHT、GLU等PRs被诱导合成,从而起到抗病性的作用[16]。已有相关研究从PRs基因调控及其编码的蛋白生物活性等方面揭示果实采后抗病性的机制[17-18]。
目前甜瓜采后主要采用各种保鲜技术及诱抗处理延长贮藏期,如气调保鲜[19]、水杨酸诱抗[20]、BTH诱抗[21]、壳聚糖处理[22]等,针对甜瓜贮运保鲜所采取的采前、采后等各种处理措施是外部措施,而甜瓜内源性抵御病原菌侵染的能力是抗病性的关键。与86-1甜瓜相比,伽师瓜耐贮藏性强,优良的抗病性是耐藏性重要支撑,伽师瓜应具备更强、有效抵抗病菌侵染的防御体系。
前期研究克隆了甜瓜CmCht1、CmCht2和CmGlu。CmCht1和CmCht2均编码Ⅱ型CHT;CmGlu编码GLU。几丁质和β-1,3-葡聚糖是真菌细胞壁的主要组成物质,CHT和GLU具有协同杀菌的作用,当二者协同表达时,可以水解病原真菌的细胞壁以抵御侵害[23]。实验以伽师瓜和86-1甜瓜为材料,采后接种A. alternata,采用荧光定量聚合酶链式反应(polymerase chain reaction,PCR)分析侵染期间果实CHT和GLU的基因表达规律,了解甜瓜采后抵抗病原菌侵染的内在机制,为进一步研究甜瓜采后抗病性调控技术提供理论依据。
伽师瓜,全生育期112 d,选择质量(4.0±0.25)kg、可溶性固形物质量分数不小于14%的果实采收。采收自新疆喀什地区伽师县八乡,采收3 d内运回实验室处理。
86-1甜瓜,全生育期98 d,选择质量(3.8±0.25)kg、可溶性固形物质量分数不小于16%的果实采收。采收自新疆喀什地区伽师县八乡,采收3 d内运回实验室处理。
A. alternata,2013年分离自伽师县八乡伽师瓜黑斑病中,保存于新疆农业大学食品科学与药学学院微生物实验室。
植物总RNA提取试剂盒(TransZol Plant,ET121)、cDNA反转录试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix,AT311-03) 北京全式金生物技术有限公司;定光定量PCR试剂盒(SYBR Select Master Mix,4472920) 美国ABI公司;琼脂糖 西班牙Biowest公司;Tris-Base、DEPC、4S Red Plus Nucleic Acid Stain(NB6695)、6× RNA Loading Dye(B548323) 生工生物工程(上海)股份有限公司;冰乙酸、EDTA-Na2、95%乙醇、异丙醇、氯仿(均为分析纯) 国药集团药业股份有限公司。
Biofuge Primo R高速冷冻离心机、Nanodrop 2000超微量分光光度计 美国赛默飞世尔科技公司;T-100梯度PCR仪、PowerPac Universal电泳仪、Sub Cell GT水平电泳槽 美国伯乐公司;Gene Genius Bio Image凝胶成像系统 英国SynGene公司;Stepone plus型荧光定量PCR仪 美国ABI公司;LDZX-50KBS高温灭菌锅上海申安医疗器械公司;JH-SCA净化工作台 上海鸿都电子科技有限公司;GL-88B旋涡混合器 海门市其林贝尔仪器制造有限公司。
1.3.1 甜瓜A. alternata侵染
甜瓜果实用2%的双氧水表面清洗30 s后用清水冲洗干净,晾干。用无菌打孔器在甜瓜果实中部等距离穿刺打孔6 个(直径3.5 mm,深度4.0 mm),每孔接入15 μL A. alternata孢子悬浮液(孢子数1×106个/mL,含0.05% Tween-20),对照接入等量无菌水。接种后的甜瓜果实置于(7.0±1.5)℃、相对湿度80%~85%冷库中贮藏。分别于0、3、6、9、12、15、18、21、24 d取样,收集甜瓜病斑周围0.50 cm处果肉组织,液氮速冻后,于-80 ℃的冰箱中保存。
1.3.2 甜瓜果实病斑大小的测定与计算
在接种A. alternata部位将甜瓜果实纵向剖开,游标卡尺测定病斑直径(测量果肉过敏反应组织),计算平均值。
1.3.3 荧光定量PCR引物设计
CmCht1-F/R参考甜瓜CHT基因序列(KT921405、KU18790),CmCht2-F/R参考甜瓜CHT基因序列(KT921406、KU236388),CmGlu-F/R参考甜瓜GLU基因序列(KT921408、KU356919),内参基因CmGAPDH-F/R参考甜瓜甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因序列(XM_008441195.2),具体引物见表1。
表1 荧光定量PCR引物
Table 1 Primer sequences used for real-time PCR

1.3.4 总RNA的提取
取甜瓜果肉液氮研磨,按照植物总RNA提取试剂盒(TransZol Plant,ET121)说明书提取总RNA。1.0%琼脂糖电泳检测完整性。Nanodrop 2000测定RNA的A260nm/A280nm、A260nm/230nm与浓度。
1.3.5 cDNA的合成
使用TransScript One-Step gDNA Removal And cDNA Synthesis Super Mix反转录试剂盒合成cDNA。总RNA 50 ng~5 μg、Primer(0.1 μg/μL)1 μL、2×TS Reaction Mix 10 μL、TransScript®RT/RI Enzyme Mix 1 μL、gDNA Remover 1 μL,RNase-free ddH2O补足至20 μL。轻轻混匀后,25 ℃ 10 min;42 ℃ 30 min;85 ℃ 5 s,反应结束后于-20 ℃保存。
1.3.6 荧光定量PCR
荧光定量PCR总体系20 μL,包括:SYBR Select Master Mix 10 μL、primer F 0.4 μL、primer R 0.4 μL、cDNA 1 μL、ddH2O 8.2 μL,混合均匀。反应程序为:50 ℃ 2 min;95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min(40 个循环)。以CmGAPDH为内参基因,采用2-ΔΔCt法计算甜瓜CmCht1、CmCht2和CmGlu的相对表达量[24]。
采用SPSS 20.0软件进行数据分析,OriginPro 8.5绘图。

图1 甜瓜果实接种A. alternata病斑直径
Fig. 1 Lesion diameter of 86-1 muskmelon inoculated with A. alternata
甜瓜果实接种A. alternata,每3 d测定甜瓜病斑大小(图1)。伽师瓜和86-1甜瓜在侵染前6 d没有出现过敏反应,在侵染9 d时出现病斑,9~24 d病斑直径不断扩大,且86-1甜瓜的病斑直径大于伽师瓜,差异显著(P<0.05)。侵染24 d时伽师瓜和86-1甜瓜病斑直径分别为2.86 cm和3.20 cm,86-1甜瓜病斑直径是伽师瓜的1.12 倍。伽师瓜对A. alternata侵染的抵抗能力要大于86-1甜瓜。
提取甜瓜果肉总RNA,电泳结果28S和18S rRNA条带清晰(图2),RNA完整性较好,RNA样品A260nm/A280nm比值为1.8~2.0之间。RNA的完整性较好,纯度高,可以用来进行反转录实验。

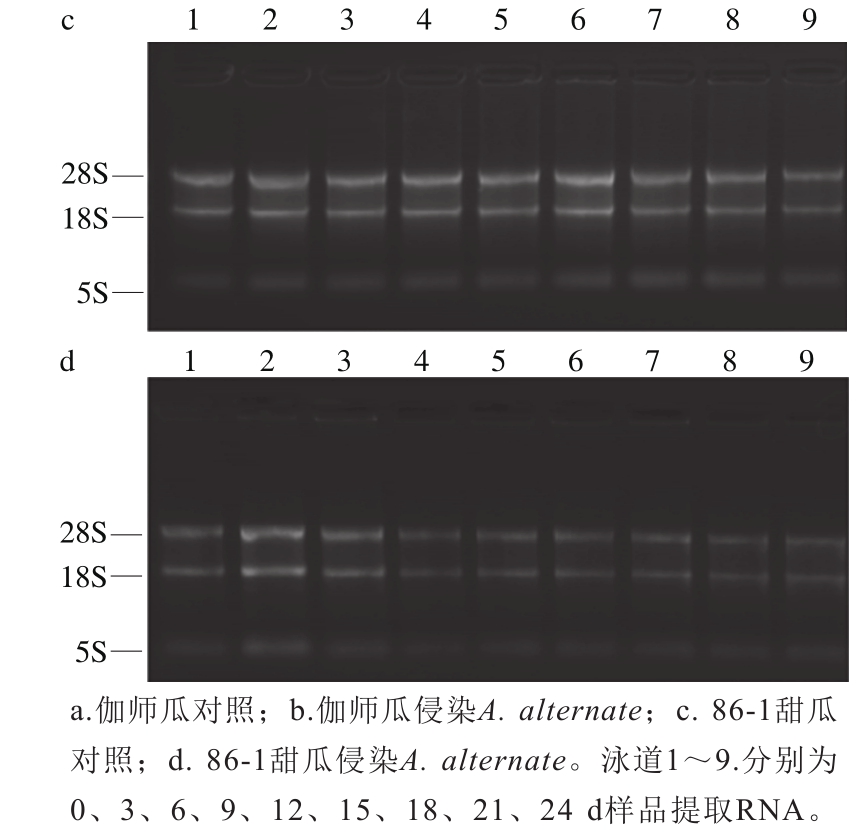
图2 甜瓜果肉RNA提取结果
Fig. 2 Agarose gel electrophoresis of RNA isolated from infected muskmelon
CmCht1-F/R、CmCht2-F/R、CmGlu-F/R和CmGAPDH-F/R的PCR结果显示扩增片段大小正确,无引物二聚体产生(图3)。
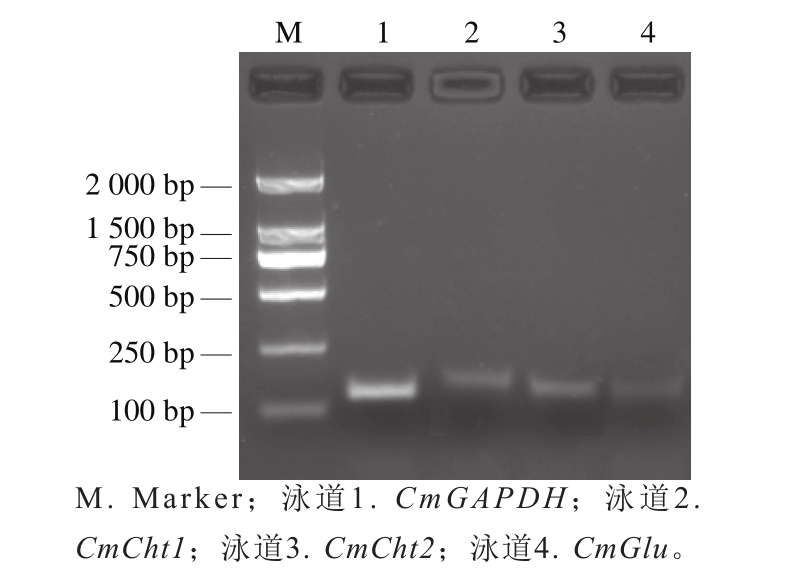
图3 荧光定量PCR引物扩增结果
Fig. 3 Real-time quantitative PCR detection
目的基因和内参基因的PCR扩增熔解曲线见图4。伽师瓜和86-1甜瓜的CmCht1、CmCht2、CmGlu和CmGAPDH的荧光信号随着温度的逐渐升高而增大,当温度接近退火温度(Tm)时,荧光信号突然变化加大,出现峰值,且只单一的熔点峰,无引物二聚体的形成,荧光定量PCR扩增产物专一,引物的特异性较强。

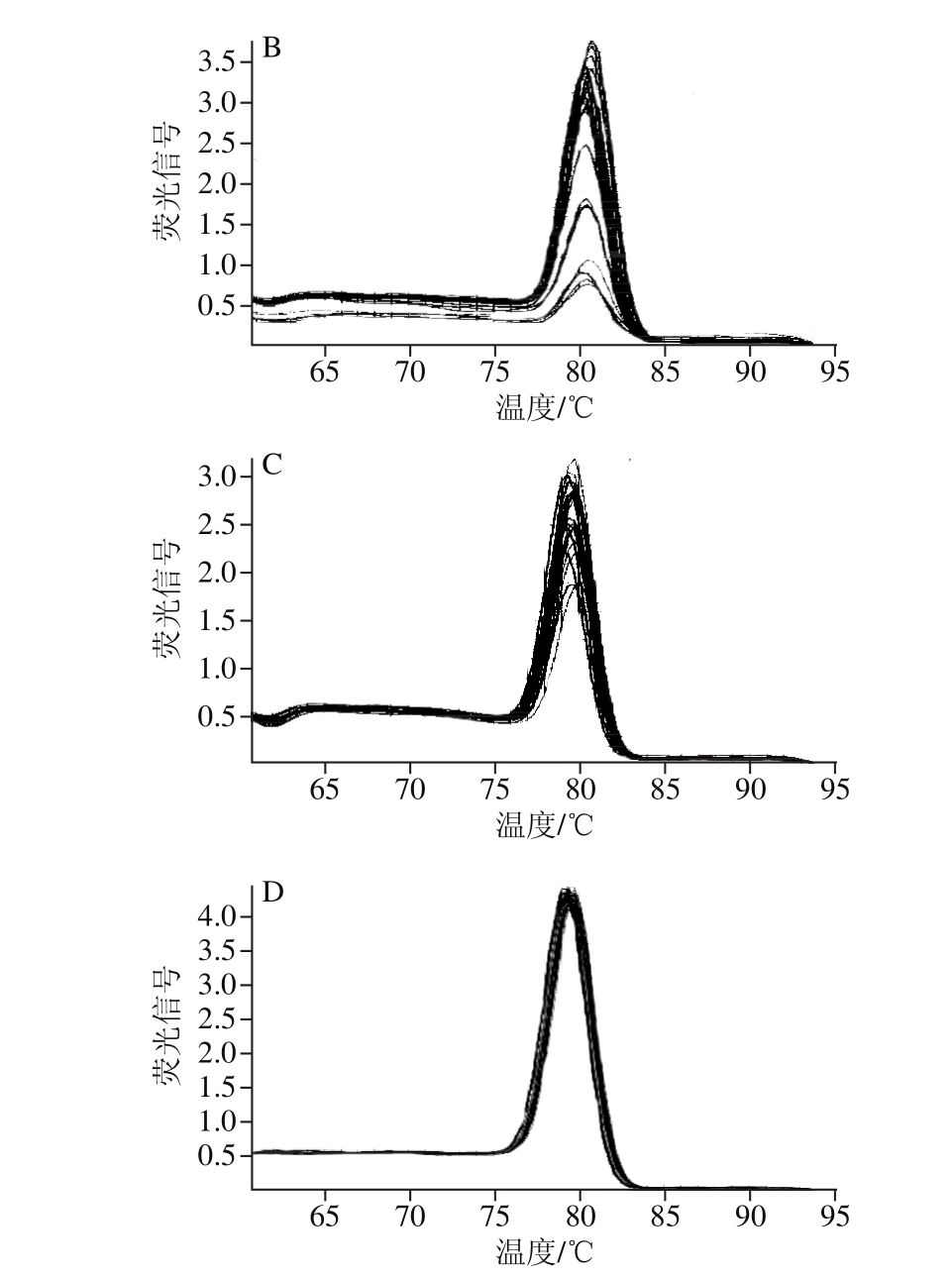
图4 CmCht1(A)、CmCht2(B)、CmGlu(C)和CmGAPDH(D)熔解曲线
Fig. 4 Melting curves for CmCht1, CmCht2, CmGlu, and CmGAPDH
2.4.1 A. alternata侵染甜瓜果实CmCht1基因表达变化
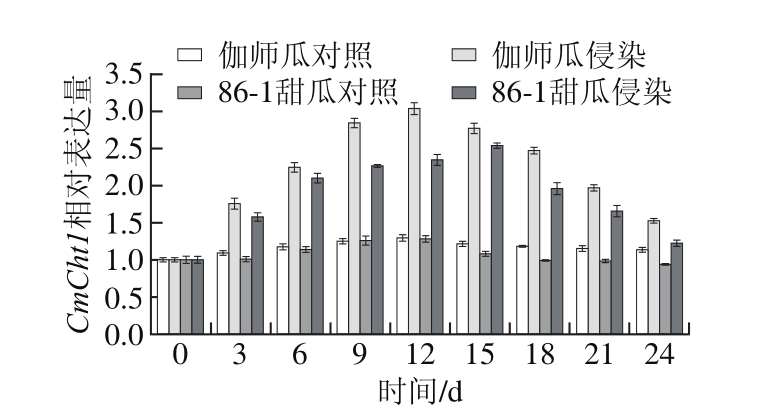
图5 A. alternata侵染甜瓜果实CmCht1基因表达量变化
Fig. 5 Change in CmCht1 expression in infected muskmelon during storage
如图5所示,与对照相比,伽师瓜接种A. alternata在侵染期间CmCht1基因相对表达量明显提高,呈先升高后降低的变化趋势,差异显著(P<0.05)。伽师瓜在侵染1~12 d CmCht1基因表达水平逐渐提高,侵染12 d时CmCht1基因相对表达量最高,为0 d的3.03 倍;侵染15~24 d CmCht1基因相对表达水平逐渐降低,侵染24 d时CmCht1基因相对表达量为0 d的1.52 倍。
与对照相比,86-1甜瓜接种A. alternata在侵染期间CmCht1基因相对表达量明显提高,呈先升高后降低的变化趋势,差异显著(P<0.05)。86-1在侵染1~15 d CmCht1基因表达水平逐渐提高,侵染15 d时CmCht1基因相对表达量最高,为0 d的2.54 倍;侵染18~24 d CmCht1基因表达水平逐渐降低,侵染24 d时基因相对表达量为0 d的1.22 倍。
A. alternata侵染甜瓜果实,伽师瓜和86-1甜瓜CmCht1基因表达最高峰出现的时间相差3 d,但伽师瓜中CmCht1基因相对表达量始终高于86-1甜瓜果实,且差异显著。
2.4.2 A. alternata侵染甜瓜果实CmCht2基因表达变化
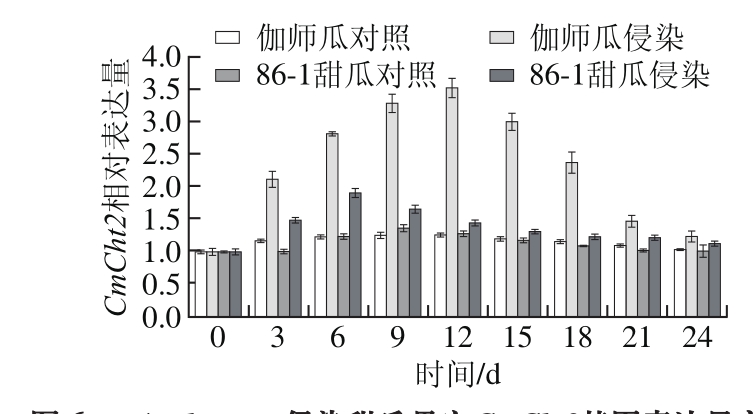
图6 A. alternata侵染甜瓜果实CmCht2基因表达量变化
Fig. 6 Change in CmCht2 expression in infected muskmelon during storage
如图6所示,与对照相比,伽师瓜接种A. alternata在侵染期间CmCht2基因相对表达量明显提高,呈现先升高后降低的变化趋势,差异显著(P<0.05)。伽师瓜在侵染1~12 d CmCht2基因表达水平逐渐提高,12 d时CmCht2基因相对表达量最高,为0 d的3.54 倍;侵染15~24 d CmCht2基因表达水平逐渐降低,侵染24 d时基因相对表达量为0 d的1.24 倍。
与对照相比,86-1甜瓜接种A. alternata在侵染期间CmCht2基因相对表达量明显提高,呈现先升高后降低的变化趋势,差异显著(P<0.05)。86-1甜瓜在侵染1~6 d CmCht2基因表达水平逐渐提高,6 d时CmCht2基因相对表达量最高,为0 d的1.91 倍;侵染9~24 d CmCht2基因相对表达水平逐渐降低,且18~24 d 基因相对表达量变化不显著(P>0.05),分别为0 d的1.43、1.22 倍和1.13 倍。
A. alternata侵染甜瓜果实后,伽师瓜CmCht2基因表达最高峰出现的时间比86-1甜瓜推迟6 d。伽师瓜CmCht2基因相对表达量始终高于86-1甜瓜,且在3~21 d相对表达量差异显著。
2.4.3 A. alternata侵染甜瓜果实CmGlu基因表达变化
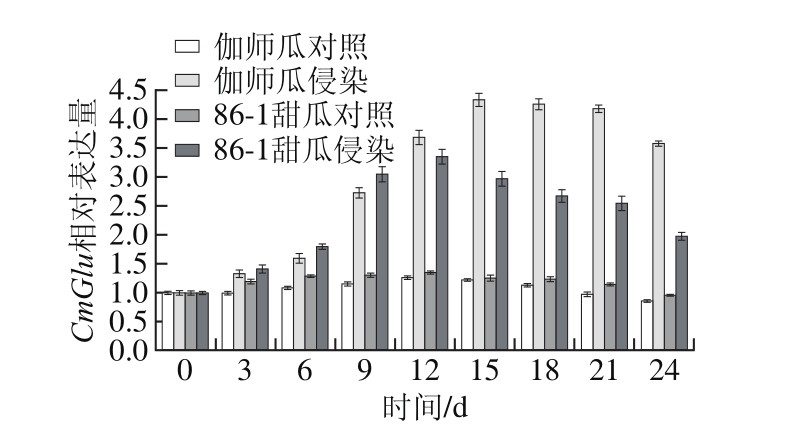
图7 A. alternata侵染甜瓜果实CmGlu基因表达量变化
Fig. 7 Change in CmGlu expression in infected muskmelon during storage
如图7所示,与对照相比,伽师瓜接种A. alternata在侵染期间CmGlu基因相对表达量明显提高,呈现先升高后降低的变化趋势,差异显著(P<0.05)。伽师瓜在侵染1~15 d CmGlu基因表达水平逐渐提高,15 d时CmGlu基因相对表达量最高,为0 d的4.33 倍;侵染18~24 d CmGlu基因表达水平逐渐降低,但其相对表达量仍维持在较高水平,分别为0 d的4.26、4.18 倍和3.57 倍。
与对照相比,86-1甜瓜接种A. alternata在侵染期间CmGlu基因相对表达量明显提高,呈现先升高后降低的变化趋势,差异显著(P<0.05)。86-1甜瓜在侵染1~12 d CmGlu基因表达水平逐渐提高,12 d时CmGlu基因相对表达量最高,为0 d的3.35倍;侵染15~24 d CmGlu基因表达水平逐渐降低,侵染24 d时基因相对表达量为0 d的1.97 倍。
A. alternata侵染甜瓜果实,0~9 d伽师瓜CmGlu基因相对表达量低于86-1甜瓜,12~24 d CmGlu基因相对表达量高于86-1甜瓜,差异显著。伽师瓜比86-1甜瓜CmGlu基因表达最高峰出现的时间推迟3 d。
2.4.4 A. alternata侵染伽师瓜果实CHT和GLU的基因表达规律
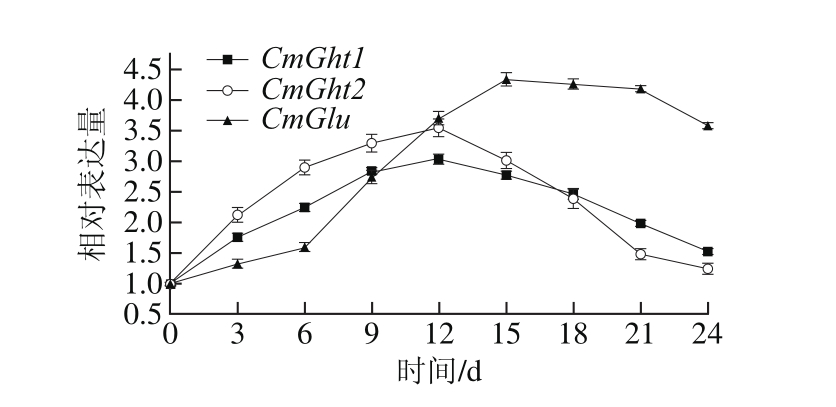
图8 A. alternata侵染伽师瓜CmCht1、CmCht2和CmGlu基因表达量变化
Fig. 8 Changes in CmCht1, CmCht2, and CmGlu expression in infected Jiashi muskmelon during storage
伽师瓜接种A. alternata,在侵染期间CmCht1、CmCht2和CmGlu相对表达量变化差异显著(P<0.05),均呈现先升高后降低的变化趋势(图8)。CmCht1和CmCht2在侵染0~12 d相对表达量升高,侵染15~24 d相对表达量降低;CmCht2在侵染3~15 d相对表达量高于CmCht1,18 d后CmCht1相对表达量高于CmCht2。CmGlu在侵染0~15 d相对表达量显著提高,18 d后出现降低趋势。CmGlu在侵染0~9 d相对表达量低于CmCht1与CmCht2,但在12 d后CmGlu相对表达量高于CmCht1与CmCht2。
A. alternata侵染伽师瓜后CmCht1、CmCht2和CmGlu表达模式不同,侵染前期CHT的基因大量表达,CHT起到主要的抗病性作用;而在侵染的中后期则是GLU的基因表达量较高,GLU起主要的抗病性作用。
2.4.5 A. alternata侵染86-1甜瓜果实CHT和GLU的基因表达规律
86-1甜瓜接种A. alternata,在侵染期间CmCht1、CmCht2和CmGlu相对表达量变化差异显著(P<0.05),均呈现先升高后降低的变化趋势(图9)。CmCht1在侵染0~15 d相对表达量逐渐升高,侵染18 d后相对表达量逐渐降低;CmCht2在侵染0~6 d相对表达量逐渐升高,侵染6 d后相对表达量逐渐降低,在整个侵染过程中CmCht1的相对表达量始终高于CmCht2。CmGlu在侵染0~12 d显著提高,15 d后出现降低趋势。CmGlu在侵染0~6 d相对表达量低于CmCht1与CmCht2,但在9 d后CmGlu相对表达量高于CmCht1与CmCht2。
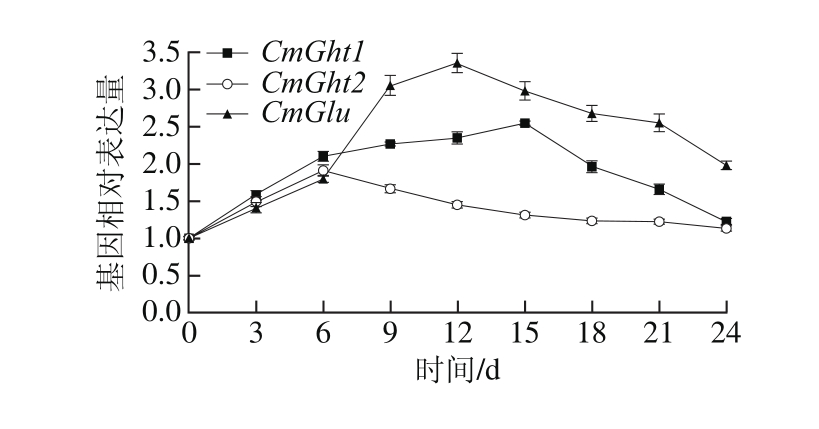
图9 A. alternata侵染86-1甜瓜CmCht1、CmCht2和CmGlu基因表达量变化
Fig. 9 Changes in CmCht1, CmCht2, and CmGlu expression in infected 86-1 muskmelon during storage
A. alternata侵染86-1甜瓜后CmCht1、CmCht2和CmGlu表达模式不同,侵染前期CHT的基因大量表达,CHT起到主要的抗病性作用;而在侵染中期和后期则是GLU的基因相对表达量较高,GLU起主要的抗病性作用。
伽师瓜和86-1甜瓜均在侵染9 d时出现病斑,9~24 d病斑直径不断扩大,且86-1甜瓜病斑直径大于伽师瓜。侵染24 d时86-1甜瓜病斑直径是伽师瓜的1.12 倍。因此,伽师瓜对A. alternata侵染的抵抗能力要大于86-1甜瓜。
伽师瓜和86-1甜瓜A. alternata侵染期间,CmCht1、CmCht2和CmGlu相对表达量明显提高,均表现出先升高后降低的变化趋势,伽师瓜CmCht1、CmCht2相对表达量始终高于86-1甜瓜,CmGlu在侵染后12 d开始相对表达量高于86-1甜瓜。伽师瓜和86-1甜瓜CmCht1、CmCht2和CmGlu表达最高峰出现的时间分别相差3、6、3 d。
伽师瓜和86-1甜瓜A. alternata侵染期间,CmCht1、CmCht2和CmGlu表达模式不同,贮藏前期CmCht1、CmCht2相对表达量较高,病原菌主要诱导了CHT基因的表达;贮藏中期和后期CmGlu相对表达量较高,此时病原菌主要诱导了GLU基因的表达。
与对照处理相比较(接入等量无菌水),A. alternata侵染处理CmCht1、CmCht2和CmGlu相对表达量显著提高。CHT和GLU是重要的PRs,与植物受病原菌侵染或抗病诱导密切相关,PRs在植物体被病菌侵染后迅速诱导表达,而在健康植物中不存在或表达微弱[10-11],甜瓜果实在A. alternata侵染期间CHT和GLU基因相对表达量显著提高,表明甜瓜组织对病原菌的侵染产生了响应,病原菌诱导了甜瓜抗病相关蛋白基因的表达,以抵御病原菌的侵染。
A. alternata侵染伽师瓜和86-1甜瓜后,CmCht1、CmCht2和CmGlu表达规律不同,前期CHT的基因相对表达量较高,推测CHT起主要的抗病性作用;中期和后期GLU基因的相对表达量较高,推测GLU起重要的抗病性作用。CHT和GLU基因协调表达、共同作用于真菌细胞壁中的多糖成分,破坏细胞结构,起到抗病性的作用。
伽师瓜和86-1甜瓜接种A. alternata,86-1甜瓜病斑直径始终大于伽师瓜,这表明伽师瓜对A. alternata侵染的抵抗能力要强于86-1甜瓜。伽师瓜CmCht1、CmCht2相对表达量始终高于86-1甜瓜,CmGlu相对表达量在侵染后12 d开始显著高于86-1甜瓜,CHT和GLU基因的大量表达,进一步促进CHT和GLU的积累,因此伽师瓜果实就具有更强的抗病性。
抗病性与耐藏性密切相关,甜瓜是否耐藏关键取决于甜瓜抵御病原菌侵染能力。伽师瓜每年7—8月收获,土法窖藏可以贮藏到第2年的3—4月,贮藏期最长可达5~6 个月,是新疆最耐贮藏的甜瓜品种;而86-1甜瓜在常温条件下,甜瓜采后不到1 周就开始陆续发生病害,腐烂率随后迅速上升,即使在冷藏条件下,1 个月开始发病腐烂,2 个月全部失去商品价值。相关研究发现,利用物理处理[25-26]、化学药剂[27-30]和生物药剂[31-33]处理甜瓜,能显著提高果实组织CHT和GLU活力,增强甜瓜的抗病性,延长果实贮藏期。伽师瓜抗病性、耐藏性强与CHT和GLU基因的表达密切相关。
参考文献:
[1] 林德佩. 新疆野生甜瓜的研究[J]. 新疆农业大学学报, 1984(1): 6.
[2] 林德佩. 中国栽培甜瓜植物的起源、分类及进化[J]. 中国瓜菜,2010, 23(4): 34-36. DOI:10.3969/j.issn.1673-2871.2010.04.012.
[3] 毕阳, 张维一. 果蔬采后病害与控制[M]. 北京: 中国农业出版社,1996: 156-158.
[4] 毕阳, 王春玲. 白兰瓜贮藏期的病害[J]. 中国果品研究, 1987(1): 22-24.
[5] 陈存坤, 王文生, 高元惠, 等. 新疆厚皮甜瓜采后病害及主要病原真菌的分离与鉴定[J]. 保鲜与加工, 2008, 8(6): 54-56. DOI:10.3969/j.issn.1009-6221.2008.06.017.
[6] 葛永红, 王毅, 毕阳. 柠檬酸处理对厚皮甜瓜黑斑病的抑制及苯丙烷代谢的作用[J]. 食品工业科技, 2013, 34(19): 308-312.DOI:10.13386/j.issn1002-0306.2013.19.022.
[7] 阿不都外力·阿不都热依木, 孙磊, 古丽斯玛依·艾拜都拉, 等. 冬季贮存甜瓜腐烂病原菌的分离与鉴定[J]. 食品科学, 2010, 31(17):250-253.
[8] ZHAO J, BAO S, MA G. Characterization of Alternaria species associated with muskmelon foliar diseases in Beijing municipality of China[J]. Journal of General Plant Pathology, 2016, 82(1): 29-32.DOI:10.1007/s10327-015-0631-x.
[9] 薛耀碧, 周雅涵, 邓丽莉, 等. 采后果实病程相关蛋白研究进展[J].食品工业科技, 2015, 36(6): 391-394. DOI:10.13386/j.issn1002-0306.2015.06.076.
[10] URITANI I. Protein changes in diseased plants[J]. Annual Review of Phytopathology, 1971, 9(1): 211-234. DOI:10.1146/annurev.py.09.090171.001235.
[11] 范青, 田世平, 刘海波, 等. 两种拮抗菌β-1,3-葡聚糖酶和几丁酶的产生及其抑菌的可能机理[J]. 科学通报, 2001, 46(20): 1713-1717.DOI:10.3321/j.issn:0023-074X.2001.20.011.
[12] SELS J, MATHYS J, DE CONINCK B M, et al. Plant pathogenesisrelated (PR) proteins: a focus on PR peptides[J]. Plant Physiology and Biochemistry, 2008, 46(11): 941-950. DOI:10.1016/j.plaphy.2008.06.011.
[13] PAVONCELLO D, LURIE S, DROBY S, et al. A hot water treatment induces resistance to Penicillium digitatum and promotes the accumulation of heat shock and pathogenesis-related proteins in grapefruit flavedo[J]. Physiologia Plantarum, 2001, 111(1): 17-22.DOI:10.1034/j.1399-3054.2001.1110103.x.
[14] 王合春, 陈新利, 隋炯明, 等. 花生β-1,3-葡聚糖酶基因启动子的克隆及功能分析[J]. 2013, 14(5): 864-870. DOI:10.13430/j.cnki.jpgr.2013.05.015.
[15] WARD E R, PAYNE G B, MOYER M B, et al. Differential regulation of β-1,3-glucanase messenger RNAs in response to pathogen infection[J]. Plant Physiology, 1991, 96(2): 390-397. DOI:10.1104/pp.96.2.390.
[16] 王义琴, 张利明, 李文彬, 等. 植物病原相关蛋白研究进展[J]. 生物工程进展, 2000, 20(5): 81-83. DOI:10.13523/j.cb.20000509.
[17] VAN LOON L C, VAN STRIEN E A. The families of pathogenesisrelated proteins, their activities, and comparative analysis of PR-1 type proteins[J]. Physiological and Molecular Plant Pathology, 1999, 55(2):85-97. DOI:10.1006/pmpp.1999.0213.
[18] FERREIRA R B, MONTEIRO S, FREITAS R, et al. The role of plant defence proteins in fungal pathogenesis[J]. Molecular Plant Pathology,2007, 8(5): 677-700. DOI:10.1111/j.1364-3703.2007.00419.x.
[19] 陈存坤, 高芙蓉, 薛文通, 等. 臭氧处理对新疆厚皮甜瓜贮藏品质和生理特性的影响[J]. 食品科学, 2016, 37(20): 215-220. DOI:10.7506/spkx1002-6630-201620037.
[20] 杨冬梅, 葛永红, 毕阳. 诱抗剂处理对“银帝”甜瓜采后粉霉病和黑斑病的抑制效果[J]. 食品科学, 2006, 27(1): 246-249. DOI:10.3321/j.issn:1002-6630.2006.01.059.
[21] 任亚琳, 毕阳, 葛永红, 等. BTH浸泡处理对厚皮甜瓜采后病害的控制及贮藏品质的影响[J]. 食品科学, 2013, 34(2): 267-272.
[22] 祁岩龙, 廖新福, 孙俪娜, 等. 壳聚糖涂膜对甜瓜采后生理及品质的影响[J]. 新疆农业科学, 2011, 48(1): 116-122. DOI:10.6048/j.issn.1001-4330.2011.01.022.
[23] VAN LOON L C. Induced resistance in plants and the role of pathogenesis-related proteins[J]. European Journal of Plant Pathology,1997, 103(9): 753-765. DOI:10.1023/A:1008638109140.
[24] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262.
[25] CHEN G, CHENL J, FENG Z, et al. Physiological responses and quality attributes of Jiashi muskmelon (Cucurbitaceae, Cucumis melo L.) following postharvest hydrogen peroxide treatment during storage[J]. European Journal of Horticultural Science, 2015, 80(6):288-295. DOI:10.17660/eJHS.2015/80.6.4.
[26] YUAN L, BI Y, GE Y, et al. Postharvest hot water dipping reduces decay by inducing disease resistance and maintaining firmness in muskmelon (Cucumis melo L.) fruit[J]. Scientia Horticulturae, 2013,161(2): 101-110. DOI:10.1016/j.scienta.2013.06.041
[27] 谢东锋, 毕阳, 邓建军. 采前壳聚糖处理对厚皮甜瓜果实相关防御性酶活性的影响[J]. 湖北农业科学, 2013, 52(19): 4679-4682.DOI:10.14088/j.cnki.issn0439-8114.2013.19.065.
[28] 张培岭, 白羽嘉, 黄伟, 等. 不同浓度外源水杨酸对甜瓜果实抗病相关酶活性的影响[J]. 食品科技, 2016, 41(7): 38-43. DOI:10.13684/j.cnki.spkj.2016.07.007.
[29] 魏娟, 张溪桐, 毕阳, 等. 采后硅酸钠处理对厚皮甜瓜防卫基因mRNA的诱导表达[J]. 食品工业科技, 2015, 36(19): 163-165.DOI:10.13386/j.issn1002-0306.2015.19.026.
[30] DENG J, BI Y, ZHANG Z, et al. Postharvest oxalic acid treatment induces resistance against pink rot by priming in muskmelon (Cucumis melo L.) fruit[J]. Postharvest Biology & Technology, 2015, 106: 53-61.DOI:10.1016/j.postharvbio.2015.04.005.
[31] 李冠, 薛应龙, 欧阳光察. 诱导免疫哈密瓜植株的苯丙烷类代谢酶活力及新蛋白质的出现[J]. 植物生理学报, 1989, 15(4): 360-364.DOI:10.3321/j.issn:1671-3877.1989.04.010.
[32] WANG J, BI Y, WANG Y, et al. Multiple preharvest treatments with harpin reduce postharvest disease and maintain quality in muskmelon fruit (cv. Huanghemi)[J]. Phytoparasitica, 2014, 42(2): 153-155.DOI:10.1007/s12600-013-0351-8.
[33] WANG J, BI Y, ZHANG Z, et al. Reduction of latent infection and enhancement of disease resistance in muskmelon by preharvest application of harpin[J]. Journal of Agricultural & Food Chemistry,2011, 59(23): 12527-12533. DOI:10.1021/jf203775q.
Analysis of Expression Prof i les of Chitinase and β-1,3-Glucanase Genes in Muskmelon Fruit Tissue Inoculated with Alternaria alternata
BAI Yujia, ZHANG Peiling, HUANG Wei, FENG Zuoshan, LI Meng
(College of Food Science and Pharmacy, Xinjiang Agricultural University, Ürümqi 830052, China)
Abstract:Two different disease resistance muskmelon cultivars (Jiashi and 86-1) were analyzed for the expression prof i les of chitinase (CHT) and β-1,3-glucanase (GLU) genes in fruit tissues inoculated with Alternaria alternata. Lesion size was measured and the expression levels of CmCht1, CmCht2 and CmGlu genes were investigated by fl uorescent quantitative PCR after subsequent storage at 7 ℃. The results revealed that lesion appeared on the 9thd after infection and expanded until the 24thday. Lesion size in 86-1 muskmelon was 1.12 times greater than in Jiashi muskmelon on the 24thday, illustrating that the latter was more resistant to infection with A. alternate than the former. During the storage period, the relative expression levels of CmCht1, CmCht2, and CmGlu genes were signif i cantly increased, initially rising and then declining.The peak expression levels of CmCht1, CmCht2, and CmGlu genes in the cultivars appeared at intervals of 3, 6 and 3 days,respectively. Moreover, the relative expression levels of CmCht1 and CmCht2 were higher in Jiashi muskmelon than in 86-1 muskmelon during the whole storage period, while the relative expression level of CmGlu was higher in Jiashi muskmelon than in 86-1 muskmelon during 12–24 days of storage. The expression prof i les of these three genes were different during the storage period. The relative expression levels of CmCht1 and CmCht2 were high during the early period suggesting that A. alternata induced CHT gene expression, whereas that of CmGlu gene was high during the middle and late period suggesting that A. alternata induced GLU gene expression. Disease resistance in muskmelon was due to the coordination of CHT and GLU expression. Therefore, Jiashi muskmelon revealed stronger disease resistance than 86-1 muskmelon, which was closely related to the expression of CHT and GLU.
Keywords:muskmelon; Alternaria alternata; chitinase; β-1,3-glucanase; gene expression
收稿日期:2016-11-30
基金项目:新疆农业大学校前期资助课题(XJAU201421)
第一作者简介:白羽嘉(1984—),男,副教授,博士,研究方向为农产品贮藏与加工、食品生物技术。E-mail:saintbyj@126.com
DOI:10.7506/spkx1002-6630-201802029
中图分类号:S652.1
文献标志码:A
文章编号:1002-6630(2018)02-0185-07
引文格式:白羽嘉, 张培岭, 黄伟, 等. 链格孢菌侵染采后甜瓜果实组织几丁质酶和β-1,3-葡聚糖酶基因表达分析[J]. 食品科学,2018, 39(2): 185-191.
DOI:10.7506/spkx1002-6630-201802029. http://www.spkx.net.cn
BAI Yujia, ZHANG Peiling, HUANG Wei, et al. Analysis of expression prof i les of chitinase and β-1,3-glucanase genes in muskmelon fruit tissue inoculated with Alternaria alternata[J]. Food Science, 2018, 39(2): 185-191. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802029. http://www.spkx.net.cn