赵天惠,张佰清*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:采用脉冲强光对枯草芽孢杆菌进行诱变处理,通过耐受性测试,在抗性菌株中筛选出优良耐受菌株,并与原始菌株对比分析产酶活力及遗传稳定性,以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳比较分析菌体蛋白质表达的差异。结果表明,在脉冲电压2 450 V,照射距离5 cm,脉冲40 次条件下,筛选出8 株抗性菌株;经初筛和复筛得到兼具高温耐受、强酸耐受和高浓度胆盐耐受性变异菌株B3和B7,产α-淀粉酶、蛋白酶、脂肪酶活力分别比原始菌株提高了67%和77%(P<0.01)、56%和71%(P<0.01)、34%和42%(P<0.05),变异菌株产酶稳定性较高(P>0.05),可遗传变异;诱变前后菌体蛋白表达出现差异;结果证明脉冲强光用于枯草芽孢杆菌的诱变具有可行性。
关键词:耐受性;枯草芽孢杆菌;脉冲强光;诱变筛选;产酶活力
枯草芽孢杆菌(Bacillus subtilis)是工业生产中重要的食品级益生菌,在发酵食品方面具有悠久历史[1-2]。人工诱变筛选出的优良枯草芽孢杆菌可以在加工贮藏中更好地耐受不良环境影响仍保持高活性,而且其发酵产酶水平高,因此诱变筛选优良菌株已然成为研究热点。常见的诱变方法(如化学诱变和紫外诱变等)对菌株的筛选均存在一定缺陷[3-5],因此,探索新型物理方法应用于枯草芽孢杆菌诱变育种已成为当前生产中急待解决的问题。近年来,国外Cregenzán-Alberti等[6]利用高温脉冲电场诱变处理枯草芽孢杆菌内生孢子,得到的突变株在123 ℃条件下更具耐热性;Ma Yingfang等[7]利用常压室温等离子体诱变筛选高产重组蛋白枯草芽孢杆菌突变株,获得的突变株WB600 mut-12#重组α-淀粉酶活力较野生菌株提高了35%。
脉冲强光诱变装置利用瞬间放电以脉冲的形式激发灯管中的惰性气体,发出与太阳光谱相近、强烈的闪光[8],进行诱变微生物。经脉冲强光处理过的菌体核酸结构受到影响,而细胞中的DNA修复机制不发生作用,因此该方法可以诱导微生物发生变异[9-10]。目前,国内张佰清[11]、赵春燕等[12]利用脉冲强光对啤酒酵母、乳酸乳球菌进行诱变处理,使菌株发酵性能有所提高。国外有人研究发现,脉冲强光会改变菌体细胞内蛋白质结构,从而引起细胞变异[13-14],并且证明,脉冲强光诱变微生物具有处理时间短、污染小、操作容易控制等优点,具有可行性。
本研究利用脉冲强光诱变筛选出具有良好耐高温、耐强酸、耐胆盐性的枯草芽孢杆菌株B3和B7,其产酶能力也高于原始菌株,该优良性状能够稳定遗传,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分析得出诱变前后菌体蛋白表达出现差异,证明了脉冲强光对枯草芽孢杆菌的诱变具有可行性,为工业微生物诱变育种开辟了新的途径,对促进酶制剂工业的发展具有现实意义。
枯草芽孢杆菌(B. subtilis)由沈阳农业大学土地与环境学院微生物实验室提供。
脉冲强光装置(脉冲宽度为2 0 μ s,波长为200~1 100 nm,输出最大电压为5 000 V,输入最大能量为644 J)由沈阳农业大学食品学院自行设计。HZQ-F160A恒温振荡器、PHS-3C型酸度计 上海仪电科学仪器股份有限公司;电热手提式高压蒸汽消毒锅 上海三申医疗器械有限公司;紫外-可见分光光度计 上海尤尼科仪器有限公司;3K15型离心机 美国Sigma公司;HH-6数显恒温水浴锅、旋涡混合器 海门市其林贝尔仪器制造有限公司;DYY-28A型垂直板电泳槽、DYY-8C型电泳仪电源 北京六一生物科技有限公司;Spectrophotometer1510酶标仪 美国Thermo公司。
1.3.1 培养基的配制
牛肉膏蛋白胨培养基、淀粉平板培养基、酪蛋白平板培养基参照郝林[15]的方法配制。三丁酸甘油脂平板培养基参照郭威[16]的方法配制。
发酵培养基:α-淀粉酶发酵培养基(1 L):可溶性淀粉12 g、蛋白胨8 g、牛肉膏2 g、MgSO4·7H2O 0.5 g、K2HPO41 g、pH 7.2;蛋白酶发酵培养基(1 L):可溶性淀粉5 g、牛肉膏5 g、蛋白胨5 g、酵母膏2.5 g、KH2PO40.3 g、NaCl 1 g、MgSO4·7H2O 0.5 g、pH 7.2;脂肪酶发酵培养基(1 L):蛋白胨20 g、葡萄糖5 g、(NH4)2SO41 g、MgSO4·7H2O 0.5 g、K2HPO41 g、橄榄油1.0 mL、pH 7.2。
1.3.2 菌株活化和菌悬液的制备
将枯草芽孢杆菌接种到固体斜面培养基上,放入恒温箱中于32 ℃培养24 h,即得到活化菌株。取活化好的菌株2环接种于装有牛肉膏蛋白胨液体培养基(30 mL/250 mL三角瓶)中,32 ℃ 150 r/min恒温振荡培养12 h,形成种子液。取2 mL种子液转接到另一个液体培养基(10 mL/100 mL三角瓶)中,相同条件下,培养6 h后形成处于对数生长期的培养液,配成浓度为106个/mL的菌悬液,于4 ℃冰箱保藏备用。
1.3.3 脉冲强光处理方法与诱变参数的确定
在无菌环境下,将放置在培养皿中的菌悬液放入脉冲装置处理室,使培养皿与氙灯垂直,进行脉冲强光处理。在预备实验的基础上,设定脉冲电压为2 450 V,照射距离为5 cm,脉冲次数分别为8、14、21、27、34、40 次和47 次。分别取出经脉冲强光处理后的菌悬液稀释至10-3个/mL,取0.1 mL涂布于固体平板培养基上,未处理的稀释菌悬液为对照,32 ℃暗处倒置培养36 h,利用平板菌落计数法测定菌落总数,计算不同处理条件下菌株的致死率,见公式(1):
1.3.4 菌株的抗性筛选
通常认为脉冲强光诱变时,菌株致死率达到90%以上,菌株具有抗性,最容易发生变异[11,17]。从脉冲强光处理后第1~5代致死率均达到90%以上的菌株中挑选菌落呈圆形或椭圆形,呈乳白色不透明,表面粗糙有褶皱,中央突起的抗性菌株8 株,接种至固体斜面培养基上备用。
1.3.5 菌株初筛
将供初筛的抗性菌株活化24 h后,分别对其进行耐受性测试[18-19],以菌株耐受效果作为初筛标准。
1.3.6 菌株复筛
将初筛得到的菌株活化24 h后配制成菌悬液,吸取0.1 mL菌悬液,分别均匀涂布于淀粉平板培养基、酪蛋白平板培养基上,32 ℃倒置培养48 h,测量单菌落周围形成透明水解圈直径与菌落直径的比值,与原始菌株相比,比值增加10%以上的菌株初步认为其发生了正突变,挑取至斜面保存[20]。产α-淀粉酶菌株的筛选方法参照游玟娟[21]的方法;产蛋白酶菌株的筛选方法参照Philip[22]的方法;产脂肪酶菌株的筛选方法参照郭威[16]的方法,分别测量直径比值A/a、P/p与Z/z。1.3.7 酶活力测定
1.3.7.1 粗酶液的制备
将复筛得到的菌株制成培养液,按照5%接种量分别接入50 mL液体α-淀粉酶、蛋白酶、脂肪酶发酵培养基中,于32 ℃、150 r/min恒温振荡培养48 h,得到发酵液。将发酵液于8 000 r/min离心10 min,弃菌体沉淀取上清液,于4 ℃冰箱保藏备用。
1.3.7.2 发酵产α-淀粉酶活力的测定
参照Yoo[23]改良法:在可溶性淀粉溶液中加入粗酶液(稀释10倍),55 ℃保温反应10 min,冷却后加入稀硫酸终止反应,加入稀碘液,显色20 min,660 nm波长处测定吸光度。以蒸馏水作空白,以煮沸失活的粗酶液为对照。酶活力单位定义为1 mL酶液在55 ℃、pH 6.0条件下,10 min内水解1 mg可溶性淀粉所需的酶量为一个酶活单位,以U/mL表示。酶活力根据公式(2)计算:
式中:E0、E分别为对照和反应液的吸光度;100为系数;稀释倍数为10。
1.3.7.3 发酵产蛋白酶活力的测定
L-酪氨酸标准曲线的绘制:配制质量浓度分别为0、20、40、60、80、100 μg/mL的L-酪氨酸标准溶液,用分光光度计分别测定其吸光度OD680nm。以吸光度为纵坐标,L-酪氨酸的质量浓度为横坐标,绘制标准曲线。
蛋白酶活力的测定方法:采用福林-酚法[24]。在酪蛋白溶液中加入粗酶液(稀释10倍),40 ℃保温反应10 min,加入三氯乙酸溶液,离心,取上清液,加入碳酸钠溶液和福林-酚试剂使用液,显色20 min,测定OD680nm值。测定空白对照时,先加三氯乙酸溶液,后加酪蛋白溶液。酶活力单位定义为1 mL酶液在40 ℃、pH 7.5条件下,1 min内水解干酪素产生1 μg酪氨酸所需的酶量为一个酶活单位,以U/mL表示。酶活力根据公式(3)计算:
式中:A为样品OD值(查标准曲线可得相对应的酪氨酸质量/μg);4为反应试剂总体积/mL;10为反应时间/min;N为粗酶液的稀释倍数。
1.3.7.4 发酵产脂肪酶活力的测定
采用橄榄油乳化法[25]。向底物溶液和磷酸缓冲液中加入待测粗酶液,40 ℃恒温反应15 min,加入乙醇终止反应,加入酚酞指示剂,加入NaOH标准溶液,滴定至出现微红色并保持30 s不褪色。测定空白对照时,先加乙醇溶液,后加待测粗酶液。酶活力单位定义为1 mL酶液于40 ℃,pH 7.5的条件下,每分钟水解脂肪产生1 μmol脂肪酸所需的酶量为一个酶活单位,以U/mL表示。酶活力根据公式(4)计算:
式中:V为样品消耗的NaOH 标准溶液的体积/mL;V0为空白消耗的NaOH标准溶液体积/mL;c为NaOH标准溶液的浓度/(mol/L);N为粗酶液的稀释倍数,取值为10;t为反应时间15 min。
1.3.8 菌株发酵产酶稳定性的分析
变异菌株进行遗传稳定性实验,将其接种到斜面上连续传代培养5 代,每代均接种到3 种酶的发酵培养基上进行发酵产酶实验,测定各代的α-淀粉酶、蛋白酶和脂肪酶活力。
1.3.9 菌株SDS-PAGE分析
参照石坡[26]的方法制备电泳蛋白样品;采用考马斯亮蓝G-250法测定菌体蛋白浓度,绘制蛋白浓度标准曲线,测定吸光度以计算蛋白浓度;配制电泳溶液和缓冲溶液,进行SDS-PAGE,在考马斯亮蓝染色的凝胶中观察分离的蛋白条带。
采用SPSS Version 17.0软件进行数据统计分析。数据均以 ±s表示(n=3)。
菌株在脉冲电压为2 450 V,照射距离为5 cm,脉冲次数分别为0、8、14、21、27、34、40 次和47次的处理后,菌株致死效果如图1所示。
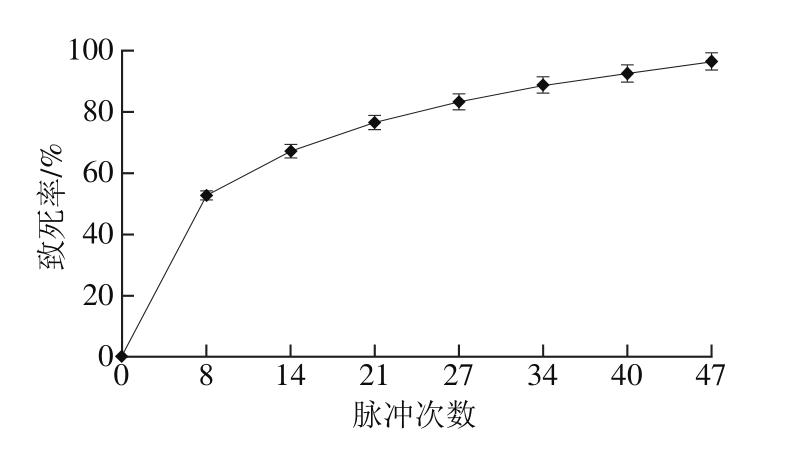
图1 脉冲次数对菌株致死效果的影响
Fig. 1 Effect of pulse number on mortality
由图1可知,菌株的致死率随脉冲次数增加而增大。当脉冲21 次时,致死率为76.4%;当脉冲40 次时,致死率达到92.5%;当脉冲次数大于47 次时,菌株几乎全部死亡。因此,选取菌株致死率高于90%并保证有一定数量存活菌株的诱变参数,此时菌株具有抗性,最容易发生变异,即选择脉冲电压2 450 V,照射距离5 cm,脉冲40 次,诱变效果良好。
表1 枯草芽孢杆菌对脉冲强光的抗性筛选结果
Table 1 Resistance of Bacillus subtilis to pulsed light
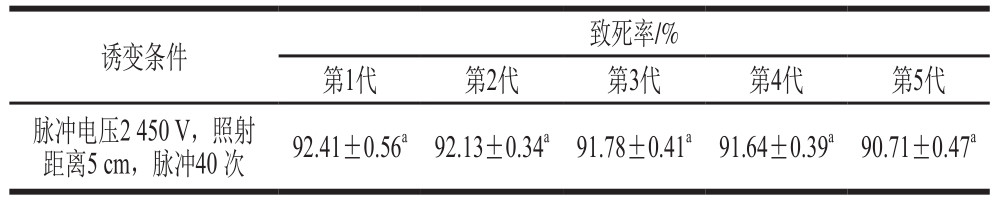
注:相同小写字母表示差异不显著(P>0.05),下同。
根据上述诱变参数处理菌株,选取存活菌种进行斜面培养基试管培养,反复处理至第5代,该菌株第1代到第5代的致死率均在90%以上,差异不显著(P>0.05),表现出一定的抗性。因此,从第5代存活的菌种进行筛选,得到编号分别为B1~B8的8 株菌株,并接种到斜面培养基试管中冷藏保存备用。
2.3.1 高温耐受性菌株筛选
枯草芽孢杆菌属于益生菌,通常被制成微生物饲料添加剂,饲料加工过程中的高温处理对菌种的存活率有影响,从而制约了动物对饲料营养的吸收利用。分别将原始菌株B0和B1~B8抗性菌株经60、70、80、90 ℃水浴处理10 min,菌株存活率在80%以上作为筛选指标。
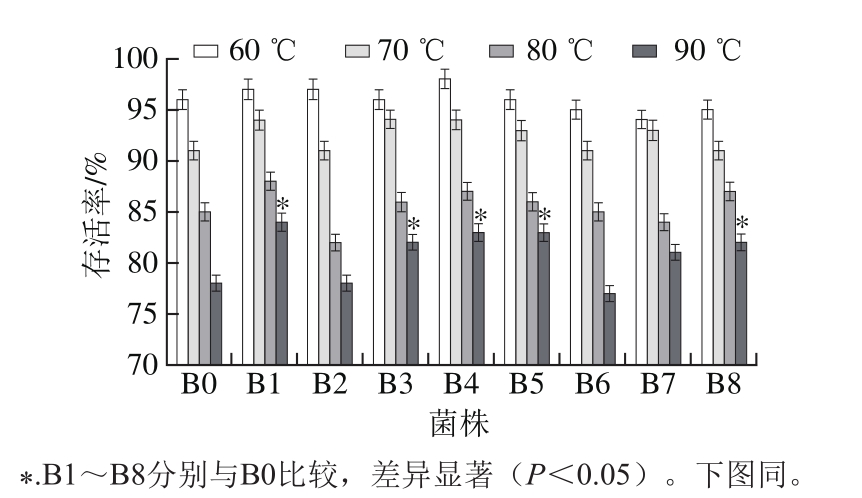
图2 温度对菌株存活率的影响
Fig. 2 Effect of temperature on survival rate of the original and mutant strains
由图2可知,抗性菌株B1、B3、B4、B5、B7、B8的存活率均高于原始菌株B0,大部分均在80%以上;B2、B6的耐高温能力较差,当温度达到90 ℃时,菌株存活率未达到80%,与原始菌株B0差异不显著(P>0.05)。因此,从8 株抗性菌株中筛选出B1、B3、B4、B5、B7、B8六株耐高温性的菌株进行下一步实验。
2.3.2 强酸耐受性菌株筛选
益生菌进入动物体内须经过胃酸环境才能到达肠道发挥作用,因此益生菌必须具有良好的耐酸能力。分别对原始菌株B0和B1、B3、B4、B5、B7、B8抗性菌株在pH 2、pH 3和pH 4的人工胃液中37 ℃作用3 h,以存活率不低于60%作为筛选标准。
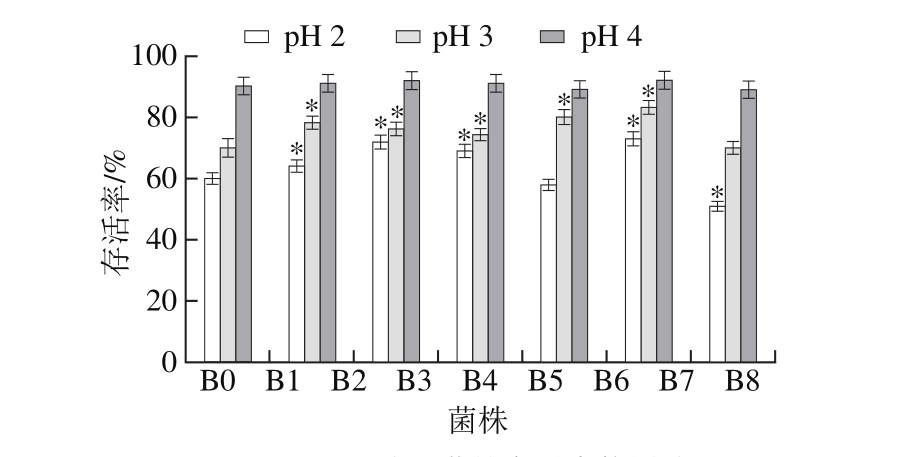
图3 人工胃液对菌株存活率的影响
Fig. 3 Survival rate of the original and mutant strains in different artif i cial gastric juices
由图3可知,抗性菌株B1、B3、B4和B7在3 个pH值梯度的人工胃液中的存活率均高于原始菌株B0,都高于60%;B5、B8在pH 2环境中存活率低于60%,且B8存活率显著低于B0(P<0.05)。因此,筛选得到B1、B3、B4和B7这4 株菌株继续实验。
2.3.3 胆盐耐受性菌株的筛选
十二指肠中的胆汁酸盐对益生菌具有抑制作用,菌体只有具备较高的胆盐耐受性,才能保持足够的活菌数,从而发挥益生作用。分别对原始菌株B0和B1、B3、B4、B7四株抗性菌株在胆盐质量浓度为0.1、0.2 g/100 mL和0.3 g/100 mL中处理180 min,筛选指标设定为存活率超过70%。
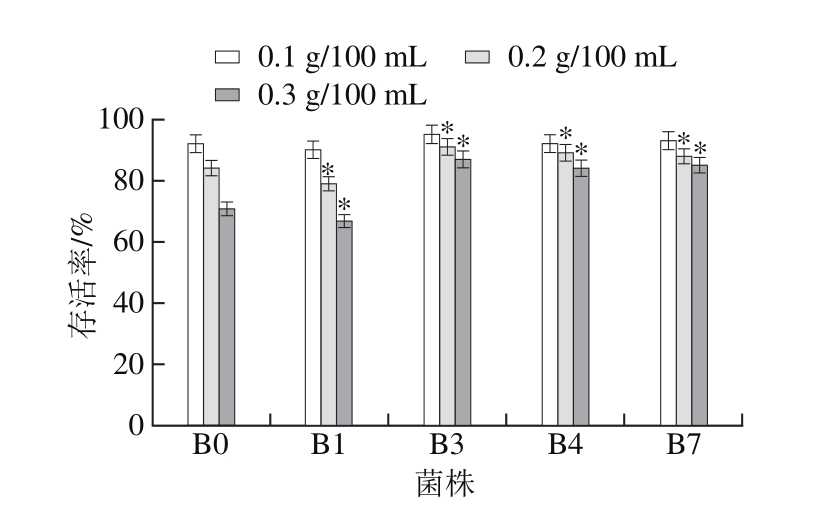
图4 胆盐对菌株存活率的影响
Fig. 4 Effect of bile salt concentration on survival rate
由图4可知,抗性菌株B3、B4和B7在不同胆盐质量浓度中的存活率均高于原始菌株B0,且都不低于70%;菌株B1在胆盐质量浓度为0.1 g/100 mL和0.2 g/100 mL时存活率较高,当质量浓度达到0.3 g/100 mL时,其耐受性较差,存活率不足70%,显著低于原始菌株B0(P<0.05)。因此,只有B3、B4和B7三株菌株符合耐胆盐性的标准。
由以上结果可知,脉冲强光可以筛选出具有耐高温性、耐强酸性和耐胆盐性的优越抗性菌株B3、B4和B7,将这3 株菌株接种斜面培养基保存,用于复筛。
表2 产α-淀粉酶、蛋白酶和脂肪酶菌株筛选结果
Table 2 α-Amylase, protease and lipase activity of selected mutants

注:*. B3、B4、B7分别与B0比较,差异显著(P<0.05)。
由表2可知,与原始菌株相比,经脉冲强光诱变的菌株产α-淀粉酶、蛋白酶和脂肪酶3 种酶周围形成透明水解圈直径与菌落直径的比值(A/a值、P/p值和Z/z值)更大,菌株B4的比值(A/a值、P/p值和Z/z值)比原始菌株增加量小于10%,只有菌株B3和B7的比值增加量远超过10%,差异显著(P<0.05),因此筛选出发生正突变的菌株B3和B7,其产酶能力有较大提高。
2.5.1 α-淀粉酶活力测定结果及菌株产酶稳定性分析
表3 菌株产α-淀粉酶活力的测定结果及遗传稳定性
Table 3 Genetic stability of mutants B3 and B7 for α-amylase production

注:*. B3、B7分别与B0比较,差异显著(P<0.05);**. B3、B7分别与B0比较,差异极显著(P<0.01);下同。
由表3可知,变异菌株B3和B7的α-淀粉酶活分别为(114.06±0.43)U/mL和(120.89±0.32) U/mL,是原始菌株B0酶活(68.3±0.14)U/mL的1.67倍和1.77倍,差异极显著(P<0.01)。将变异菌株B3、B7分别传代培养5 次,酶活变化幅度很小,差异不显著(P>0.05),说明变异菌株产酶能力稳定。
2.5.2 L-酪氨酸标准曲线
根据标准曲线的线性回归方程y=0.010x+0.002 5,R2=0.998 8,说明此方法在L-酪氨酸质量浓度为0~100 μg/mL时具有良好的线性关系。
2.5.3 蛋白酶活力测定结果及菌株产酶稳定性分析
表4 菌株产蛋白酶活力的测定结果及遗传稳定性
Table 4 Genetic stability of mutants B3 and B7 for protease production

由表4可知,变异菌株B3和B7的蛋白酶活分别为(88.3±0.35)U/mL和(96.79±0.26)U/mL,比原始菌株B0酶活(56.6±0.21)U/mL提高了56%和71%,差异极显著(P<0.01),经传代培养5 次,B3和B7的酶活力趋于稳定,差异不显著(P>0.05),因此,脉冲强光诱变处理得到的变异菌株产蛋白酶能力可良好稳定遗传。
2.5.4 脂肪酶活力测定结果及菌株产酶稳定性分析
表5 菌株产脂肪酶活力的测定结果及遗传稳定性
Table 5 Genetic stability of mutants B3 and B7 for lipase production

由表5可知,变异菌株B3和B7的脂肪酶活分别为(16.21±0.27)U/mL和(17.18±0.36)U/mL,是原始菌株B0酶活(12.1±0.15)U/mL的1.34 倍和1.42 倍,差异显著(P<0.05),传代培养5 次,B3、B7各代酶活力变化不大,差异不显著(P>0.05),因此,变异菌株B3、B7的产脂肪酶遗传性能很稳定。
将3 个菌体蛋白进行SDS-PAGE分析,经凝胶成像分析系统分析并拍照形成电泳图,如图6所示。
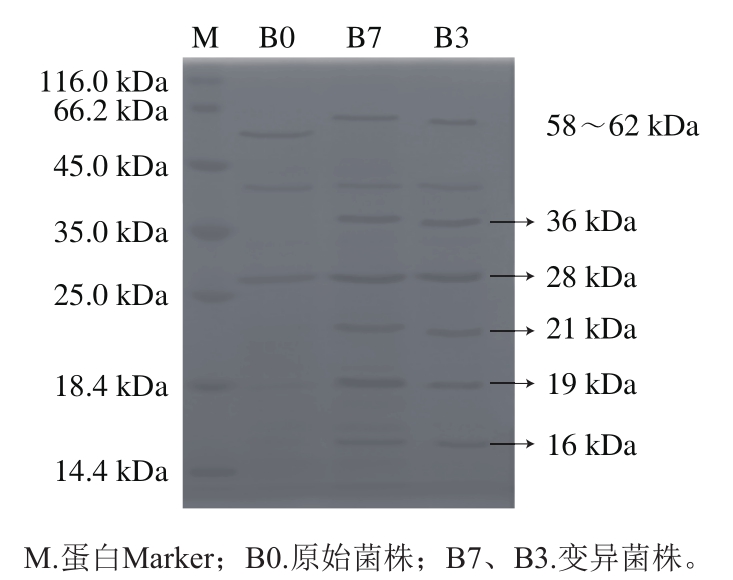
图5 各部分蛋白成分的比较
Fig. 5 Comparison of protein components of the original strains and mutants B3 and B7
由图5可知,原始菌株和变异菌株蛋白条带存在有无和明暗的差异。3 株菌株在分子质量大小约为28 kDa处均出现清晰的条带,但变异菌株B7、B3的条带比原始菌株B0颜色更深更明显;B7、B3比B0多出一条分子质量大小约为16 kDa的条带;B7在分子质量约为19 kDa的条带比B3更宽一些,B7蛋白表达更多;B3、B7在分子质量大小约为21、36 kDa处均出现条带,在相同两处B0却没有条带,说明原始菌株经诱变处理,促进了某些蛋白质的合成;3株菌株在分子质量大小为58~62 kDa之间出现明显的条带,B7、B3的蛋白表达量更高。以上结果说明,菌株经脉冲强光处理后蛋白发生改变,是因为脉冲强光处理菌株对其核酸造成影响,使某些基因的表达发生变化,改变了某些蛋白质的合成。
本研究采用脉冲强光对枯草芽孢杆菌进行诱变处理,在脉冲电压2 450 V、照射距离5 cm、脉冲40 次的条件下,筛选出兼具耐受高温、耐受强酸和耐受高浓度胆盐的变异菌株B3和B7,产α-淀粉酶、蛋白酶、脂肪酶活力分别是原始菌株的167%和177%(P<0.01)、156%和171%(P<0.01)、134%和142%(P<0.05),变异菌株产酶稳定性较高且可遗传变异,SDS-PAGE凝胶电泳显示菌体诱变前后蛋白表达出现差异性,该方法应用于枯草芽孢杆菌诱变育种领域具有可行性。
本实验诱变筛选出了高耐受性变异枯草芽孢杆菌,并且其α-淀粉酶、蛋白酶、脂肪酶的产生能力得到了显著提高。根据相关报道,以上耐受性和几种产酶能力的增强对菌株用于抵抗动物胃肠道内的不良环境[18]、肉类嫩化处理[28]、定向改变食品组分以提高特定营养成分的比例[29]等方面均具有积极作用。因此,脉冲强光处理枯草芽孢杆菌取得了良好的诱变效果,在枯草芽孢杆菌诱变育种领域发展潜力巨大,在微生物工业酶制剂中应用前景广阔。
参考文献:
[1] KIERS J L, VAN LAEKEN A E A, ROMBOUTS F M, et al. In vitro digestibility of bacillus fermented soya bean[J]. International Journal of Food Microbiology, 2000, 60: 163-169.
[2] COOLBEA T, DANIEL R M, MORGAN H W. The enzymes from extreme thermophiles: bacterial sources, thermostabilities and industrial relevance[J]. Advance in Biochemical Engineering-Biotechnology, 1992, 45: 57-98.
[3] 郑丽丽, 盛占武, 韩冰莹, 等. 不同诱变方法对黑曲霉产木聚糖酶能力的影响[J]. 生物技术通报, 2013(12): 146-150.
[4] 张莹, 郭琛琛, 黑东燕, 等. 复合诱变法选育谷氨酰胺转胺酶高产菌株[J]. 食品科学, 2014, 35(11): 139-142. DOI:10.7506/spkx1002-6630-201411028.
[5] 凌帅, 刘咏, 姚建铭, 等. 紫外线与N+注入复合诱变选育曲酸高产菌株[J]. 食品科学, 2013, 34(1): 234-238.
[6] CREGENZÁN-ALBERTI O, ARROYO C, DOROZKO A, et al.Thermal characterization of Bacillus subtilis endospores and a comparative study of their resistance to high temperature pulsed electric fi elds (HTPEF) and thermal-only treatments[J]. Food Control,2017, 73: 1490-1498. DOI:10.1016/j.foodcont.2016.11.012.
[7] MA Y F, YANG H Q, CHEN X Z, et al. Signif i cantly improving the yield of recombinant proteins in Bacillus subtilis by a novel powerful mutagenesis tool (ARTP): alkaline α-amylase as a case study[J].Protein Expression and Purif i cation, 2015, 114: 82-88. DOI:10.1016/j.pep.2015.06.016.
[8] 江天宝. 脉冲强光杀菌技术及其在食品中应用的研究[D]. 福州:福建农林大学, 2007: 22-23.
[9] 张佰清, 覃威铭. 脉冲强光对黑曲霉细胞膜损伤及胞内酶活性的影响[J]. 食品科学, 2012, 33(17): 212-215.
[10] ORCAJO J, LAVILLA M. Cow’s milk allergen β-lactoglobulin immunoreactivity affected by pulsed light treatment[J]. Clinical and Translational Allergy, 2015, 5: 50.
[11] 张佰清, 孙栏梦. 脉冲强光对啤酒酵母诱变效应[J]. 食品科学, 2015,36(7): 153-157. DOI:10.7506/spkx1002-6630-201507028.
[12] 赵春燕, 刘长江, 孟晓曦. 脉冲强光诱变选育Nisin高产菌株[J]. 食品科技, 2010, 35(8): 32-34.
[13] FINE F, GERVAIS P. Efficiency of pulsed UV light for microbial decontamination of food powders[J]. Journal of Food Protection, 2004,67: 787-792.
[14] WUYTACK E Y, PHUONG L D, AERTSTEN A, et al. Comparison of sublethal injury induced in Salmonella enterica servoar Typhimurium by heat and by different nonthermal treatments[J]. Journal of Food Protection, 2003, 66(1): 31-37.
[15] 郝林. 食品微生物学实验技术[M]. 北京: 中国农业出版社, 2001: 145.[16] 郭威. 产脂肪酶芽孢杆菌的分离及在鸡饲喂上的应用[D]. 保定:河北农业大学, 2014: 8-13.
[17] AFSHARMANESH H, AHMADZADEH M, JAVAN-NIKKHAH M,et al. Improvement in biocontrol activity of Bacillus subtilis UTB1 against Aspergillus fl avus using gamma-irradiation[J]. Crop Protection,2014, 60(2): 83-92.
[18] 张增卫. 饲用益生菌的选育及其培养条件研究[D]. 南昌: 南昌大学,2013: 2-21.
[19] 窦茂鑫, 赵迪, 王蕾, 等. 猪源枯草芽孢杆菌的分离鉴定及生物学特性研究[J]. 养殖与饲料, 2012(4): 11-14.
[20] 郭宏文, 王艳, 江成英, 等. 酸性α-淀粉酶菌种的诱变选育[J]. 江苏农业科学, 2016, 44(3): 356-357. DOI:10.15889/j.issn.1002-1302.2016.03.100.
[21] 游玟娟. 紫外线诱变选育酸性α-淀粉酶高产菌株[J]. 安徽农学通报,2010, 16(11): 70-71.
[22] PHILIPP G. 普通细菌学方法手册[M]. 厦门大学生物学系生物学教研室, 译. 福建: 厦门大学出版社, 1989.
[23] YOO Y J, HONG J, HATCH R T. Comparison of alpha-amylase activities from different assay methods[J]. Biotchnology and Bioengineering, 1987, 30: 147-151.
[24] 周晓云. 酶学原理与酶工程[M]. 北京: 中国轻工业出版社, 2005, 8:65-67.
[25] 夏宇, 周文化, 邓学良, 等. 脂肪酶高产菌株的筛选及产酶条件优化[J].中南林业科技大学学报, 2013, 33(9): 116-120. DOI:10.14067/j.cnki.1673-923x.2013.09.003.
[26] 石坡. 离子注入D-核糖产生菌的诱变效应及作用机理研究[D].石家庄: 河北师范大学, 2011: 27-31.
[27] 陈晓明, 张良, 张建国, 等. 枯草芽孢杆菌淀粉酶高产菌株的辐射诱变研究[J]. 辐射研究与辐射工艺学报, 2008, 26(3): 177-182.
[28] 祁丹丹. 产低温蛋白酶菌株的选育、产酶条件的优化及酶学性质研究[D]. 无锡: 江南大学, 2013: 6-18.
[29] 程雅韵, 郑琳, 李官浩, 等. 传统发酵黄豆酱中低营养菌株的筛选及产胞外酶特性分析[J]. 食品科学, 2016, 37(11): 97-102. DOI:10.7506/spkx1002-6630-201611017.
Pulsed Light Mutagenesis and Screening of Bacillus subtilis for Improved Tolerance and Extracellular Enzymatic Activities of Screened Mutants
ZHAO Tianhui, ZHANG Baiqing*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract:Pulsed light was applied to mutagenize Bacillus subtilis. The resulting mutants were screened for improved tolerance. The extracellular enzymatic activity and genetic stability of the selected mutants were analyzed and compared with those of the original strain and the differential protein expression of the original strain and the mutant strains was determined by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE). The results showed that 8 resistant mutant strains were generated under the conditions of pulse voltage of 2 450 V, distance of 5 cm and pulse number of 40.After primary and secondary screening, the mutant strains B3 and B7 with good tolerance to high temperature tolerance, acid and high concentration of bile salt were obtained. Their α-amylase activity, protease activity, lipase activity was increased by 67% and 77% (P < 0.01), 56% and 71% (P < 0.01), and 34% and 42% (P < 0.05), compared with those of the original strain,respectively. The enzymatic activity of the obtained mutants was stable (P > 0.05) and showed genetic variation. The protein expression level was different between before and after mutagenesis. These fi ndings proved the feasibility of application of pulsed light to mutagenize B. subtilis.
Keywords:tolerance; Bacillus subtilis; pulsed light; mutagenesis and screening; enzymatic activity
DOI:10.7506/spkx1002-6630-201802030
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2018)02-0192-06
引文格式:赵天惠, 张佰清. 耐受性枯草芽孢杆菌的脉冲强光诱变筛选及产酶活力分析[J]. 食品科学, 2018, 39(2): 192-197.
DOI:10.7506/spkx1002-6630-201802030. http://www.spkx.net.cn
ZHAO Tianhui, ZHANG Baiqing. Pulsed light mutagenesis and screening of Bacillus subtilis for improved tolerance and extracellular enzymatic activities of screened mutants[J]. Food Science, 2018, 39(2): 192-197. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802030. http://www.spkx.net.cn
收稿日期:2017-01-24
第一作者简介:赵天惠(1991—),女,硕士研究生,研究方向为食品非热加工技术。E-mail:1183412100@qq.com
*通信作者简介:张佰清(1966—),男,教授,博士,研究方向为食品工程技术的开发和应用。E-mail:sybaiqingxl@sina.com