
图1 去甲基化反应原理
Fig. 1 Reaction mechanism of demethylation of formononetin and biochanin A
张晓松,金 花,闫惠丽,张永忠,许 晶*
(东北农业大学理学院,黑龙江 哈尔滨 150030)
摘 要:以KBr-H3PO4或KI-H3PO4为反应介质,对芒柄花黄素和鸡豆黄素进行去甲基化反应转化成黄豆苷元和染料木黄酮,并对产物的抗氧化性进行分析。结果表明:以KBr-H3PO4为反应介质,制备黄豆苷元最佳条件为反应时间5 h、反应温度120 ℃、料液比1∶45(g/mL)、最佳饱和度75%,产率为89.42%;制备染料木黄酮最佳条件为反应时间5 h、反应温度120 ℃、料液比1∶45(g/mL)、最佳饱和度100%,产率为85.98%;以KI-H3PO4为反应介质,制备黄豆苷元最佳条件为反应时间4 h、反应温度100 ℃、料液比1∶15(g/mL)、最佳饱和度75%,产率可达87.03%;制备染料木黄酮最佳条件分别为反应时间5 h、反应温度100 ℃和料液比1∶45(g/mL)、最佳饱和度75%,产率可达88.51%。与已有合成方法相比,本实验方法具有反应过程简单、反应条件温和、反应时间较短、产率较高等优点。所制备黄豆苷元和染料木黄酮具有一定的1,1-二苯基-2-三硝基苯肼自由基和羟自由基清除能力,以及较强的抗亚油酸氧化能力,表现出较好的抗氧化性。
关键词:去甲基化;黄豆苷元;染料木黄酮;芒柄花黄素;鸡豆黄素
黄豆苷元和染料木黄酮最初在大豆中发现,属于大豆异黄酮苷元物质,也被称为植物雌激素,因其与雌二醇结构相似,具有活性基团二酚羟基,能够与雌激素靶细胞结合而发挥生物学功能[1]。大豆异黄酮不仅具有弱雌激素活性,还具有抗氧化性和抑菌性等功能,能够有效地起到预防和抑制中老年骨质疏松、乳腺癌、前列腺癌以及妇女更年期综合症等疾病的作用[2-4]。此外,国外伯克康奈尔医学研究所、密歇根大学医学院和匹兹堡大学医学院等多家科学研究机构通过对黄豆苷元的临床实验还表明,黄豆苷元具有保护神经元、促进神经元再生的作用[5]。但是,实际上一般大豆品种中异黄酮的总质量分数小于0.2%,而更具生物活性和功能的苷元形式异黄酮不足大豆异黄酮总量的3%,含量极低。于是人们将目光转向其他富含异黄酮类物质,例如天然三叶草类植物[6-7]。其中,红三叶草中异黄酮含量比大豆高10~30 倍,包括丰富的芒柄花黄素和鸡豆黄素等[8-9],而芒柄花黄素和鸡豆黄素的结构与黄豆苷元和染料木黄酮十分相近,是转化黄豆苷元和染料木黄酮的最佳原料。红三叶草可以有效避免用大豆提取异黄酮类物质而造成的粮食资源浪费的现象。
目前,黄豆苷元主要从植物中提取纯化后再经过水解和化学合成两种途径获得。其中水解法试剂成本较高、终产品纯化过程繁杂、环境污染严重,所以并不适于实际应用。另外,制备黄豆苷元的化学合成法主要为脱氧安息香路线[10-11],通过脱氧安息香中间体闭环制得异黄酮。此外,Li等[12]以4-苄氧基邻羟基苯甲醛的Wittig反应、氧烷基化反应、二次Wittig反应生成烯烃,烯烃再经Grubbs催化闭环、硼氢化、氧化脱水和去苄基、甲基化,从而最终获得黄豆苷元。Biegasiewicz等[13-14]则采用2,4-二羟基苯甲醛为起始物质,首先制得其烯胺化合物,然后烯胺化合物经碘化闭环、Suzuki偶联和去甲基化制得了较高产率的黄豆苷元产物。由此可见,化学合成法存在着明显反应步骤多(3步以上)、时间长的不足。
然而,鉴于芒柄花黄素和鸡豆黄素与黄豆苷元和染料木黄酮结构相近,可在催化剂作用下发生亲核取代反应,醚键断裂,实现去甲基化的化学反应过程,制备黄豆苷元和染料木黄酮。本实验以KBr/KI-H3PO4为催化剂,反应开始时,芒柄花黄素和鸡豆黄素先与质子结合形成烊盐,烊盐的生成使得C—O键变弱,因此,原本不易离去的基团—OR(强碱)变成了较易离去的基团HOR(弱碱),X-(Br-/I-)作为亲核试剂进攻烊盐底物的中心碳原子,而使醚键断裂,芳基醚水解生成酚羟基,通过一步反应得到黄豆苷元和染料木黄酮产物。具体反应原理如图1所示。本实验克服了已有方法的缺点,以芒柄花黄素和鸡豆黄素为起始原料,通过一步去甲基化反应转化成目标产物黄豆苷元和染料木黄酮,产率高达80%以上,并对其反应机理进行了讨论,分析总结了制备产物的抗氧化活性,为红三叶草异黄酮转化黄豆苷元和染料木黄酮的应用提供理论依据,具有一定现实参考意义。

图1 去甲基化反应原理
Fig. 1 Reaction mechanism of demethylation of formononetin and biochanin A
芒柄花黄素(纯度98.83%)、鸡豆黄素(纯度98%)陕西森弗生物有限责任公司;黄豆苷元(纯度98%)美国Fluka公司;染料木黄酮(纯度≥98%) 无锡高润杰科技有限公司;甲醇(光谱纯)、超纯水、硅胶GF254 美国Dikma公司;其他所用试剂均为分析纯。
ZFQ85A旋转蒸发仪 上海华岩仪器设备有限公司;FTIR-8400S红外光谱仪 日本岛津仪器公司;TU-1901双光束紫外-可见分光光度计 北京普析通用有限责任公司;1100 Series型高效液相色谱仪、色谱柱ZORBAX SB-C18(4.6 mm×150 mm,5 μm) 美国Agilent公司;KQ-500DV型数控超声波清洗器 昆山市超声仪器有限公司。
1.3.1 黄豆苷元和染料木黄酮的制备
准确称取一定质量的芒柄花黄素或鸡豆黄素于100 mL圆底烧瓶中,加入不同饱和度的KBr-H3PO4(按每毫升浓磷酸含1.5~3.0 g KBr溶液,每克原料加5 mL KBr-H3PO4),或加入不同饱和度的KI-H3PO4(按每毫升浓磷酸含2.5~3.5 g KI溶液,每克原料加15 mL的KI-H3PO4)溶液。将混合好的反应溶液置于超声波清洗器中,持续加热振荡,以溶解芒柄花黄素和鸡豆黄素。待其充分溶解之后,将反应物转移至油浴中加热回流,待反应结束后,将体系静置冷却,至室温。然后进行产物纯化,首先用乙酸乙酯萃取产物3~5 次。再用蒸馏水对其进行反向萃取3~5 次。将萃取后的上层溶液,转移至旋转蒸发仪中初步浓缩。冷冻干燥所得浓缩液,直至完全干燥。粗产物经硅胶柱层析进一步纯化,并应用高效液相色谱测定提纯产物中黄豆苷元和染料木黄酮的含量。
1.3.2 色谱条件
色谱柱:C18柱(4.6 mm×150 mm,5 μm);流动相为60% CH3OH溶液;柱温:常温;流速:1.0 L/min;进样量:5 μL;检测波长:260 nm。根据液相色谱图产物样品的保留时间对样品进行定性分析,并通过外标法对其定量分析,根据公式(1)计算产率。
式中:w为反应后的实际产量;w0为理论产量。
1.3.3 黄豆苷元和染料木黄酮制备的单因素试验
以黄豆苷元和染料木黄酮产率为评价指标,对反应温度、反应时间、KI/KBr在浓磷酸中的饱和度、料液比4 个因素进行单因素试验。确定各因素对产率的影响及各因素适宜范围。
黄豆苷元和染料木黄酮单因素试验条件范围:设定料液比1∶15(g/mL)、饱和度75%、反应时间4 h的条件下,改变反应温度为60、80、100、120、140 ℃进行试验;料液比1∶15(g/mL)、饱和度100%、反应温度120 ℃,改变反应时间为2、3、4、5、6 h进行试验;料液比1∶15(g/mL)、反应温度110 ℃、反应时间4 h的条件下,调整饱和度分别为50%、75%、100%、120%进行试验;反应温度110 ℃、反应时间4 h、饱和度100%,调整料液比分别为1∶2.5、1∶5、1∶9、1∶15、1∶45(g/mL)进行试验。试验重复3 次,取平均值。
1.3.4 黄豆苷元和染料木黄酮制备工艺正交试验
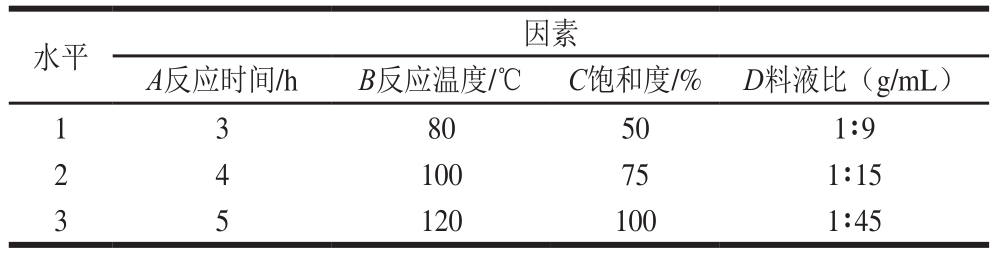
在单因素试验的基础上,以反应温度、反应时间、KI/KBr在浓磷酸中的饱和度、料液比4 个因素建立四因素三水平的正交试验,以黄豆苷元和染料木黄酮产率为评价指标,进一步选取最佳工艺条件。正交试验因素与水平见表1。
表1 正交试验因素与水平
Table 1 Coded levels for independent variables used for orthogonal array design
1.3.5 抗氧化性实验
1.3.5.1 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定
参照Chung等[15]的测定方法,将黄豆苷元标准品、制备产物黄豆苷元、染料木黄酮标准品和制备产物染料木黄酮配制成相同质量浓度梯度(0.074 2、0.247 2、0.370 8、0.500 0、0.718 0、1.000 0 mg/mL)的异黄酮样液,取样液0.3 mL,先加入0.1 mL Tris-HCl缓冲液(pH 7.9),再加100 μmol/L的DPPH-甲醇溶液0.6 mL,摇匀后室温避光静置30 min,测定517 nm波长处吸光度(A517nm),实验设置蒸馏水为空白组,测定空白组吸光度(Ablank),另设未添加异黄酮测试组为对照组,测定吸光度(Ac)。以VC、VE作为阳性对照。DPPH自由基清除率计算见公式(2)。
1.3.5.2 羟自由基清除能力测定
采用α-脱氧核糖氧化法进行测定[16]。分别配制4 种不同质量浓度梯度(1、5、10、20、25 μg/mL)的异黄酮样液,设置测定波长为532 nm,蒸馏水作参比,测定吸光度(As)。本实验设置对比组和空白组,分别测定吸光度Ac和A0,则羟自由基清除能力计算见公式(3)。
1.3.5.3 抗亚油酸氧化能力的测定
参照Yen等[17]报道的硫氰酸铁法测定。分别取0.5 mL配制好的4 个样液(100 μg/mL),37 ℃恒温避光保存,每12 h取液0.1 mL,然后向试液中加入9.7 mL 75%乙醇溶液和0.1 mL 30%硫氰酸胺溶液,混合均匀,再加入0.1 mL 20 mmol/L硫酸亚铁溶液,反应3 min。反应结束后,以蒸馏水为空白,测定500 nm波长处吸光度(A500nm)。
本实验所有数据均重复3 次,结果均以平均值表示。采用SPSS V20软件对数据进行统计分析。采用Excel 2007软件、Origin V8.0软件进行数据分析、图表处理及图谱分析处理。
2.1.1 反应时间对产率的影响结果
由图2可知,随着反应时间的延长,异黄酮产率快速升高。当反应时间为4 h时,黄豆苷元、染料木黄酮产率分别可达到87%和89%。之后继续延长反应时间,产率稍有下降。这可能是因为在高温条件下异黄酮不稳定,会分解成为其他物质,所以随着反应时间延长,异黄酮反应物和产物均会受到温度影响,使得产率下降[18]。因此,最佳反应时间为4 h。
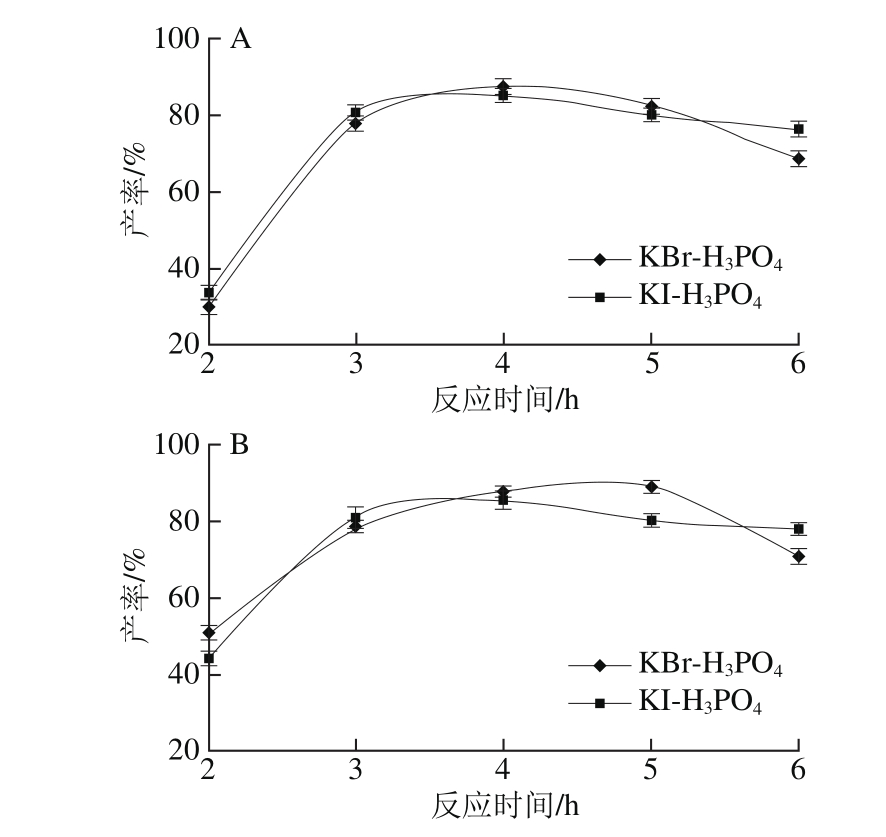
图2 反应时间对黄豆苷元(A)和染料木黄酮(B)产率的影响
Fig. 2 Effect of reaction time on the yield of daidzein (A) and genistein (B)
2.1.2 反应温度对产率的影响结果
由于异黄酮类物质对温度较为敏感,高温条件下易分解或发生结构改变,所以反应温度对异黄酮产率的影响也较为显著。如图3可知,在KBr-H3PO4和KI-H3PO4两种介质中,当温度低于100 ℃时,黄豆苷元和染料木黄酮的产率均随温度升高而快速增加。而超过100 ℃后,KBr-H3PO4介质中异黄酮产率下降,在KI-H3PO4介质中,120 ℃后产率也呈下降趋势。由此可知,反应温度不宜过高,综合考虑KBr-H3PO4为反应介质时,最佳反应温度为120 ℃,KI-H3PO4为反应介质时,最佳反应温度为100 ℃。

图3 反应温度对黄豆苷元(A)和染料木黄酮(B)产率的影响
Fig. 3 Effect of reaction temperature on the yield of daidzein (A) and genistein (B)
2.1.3 料液比对产率的影响
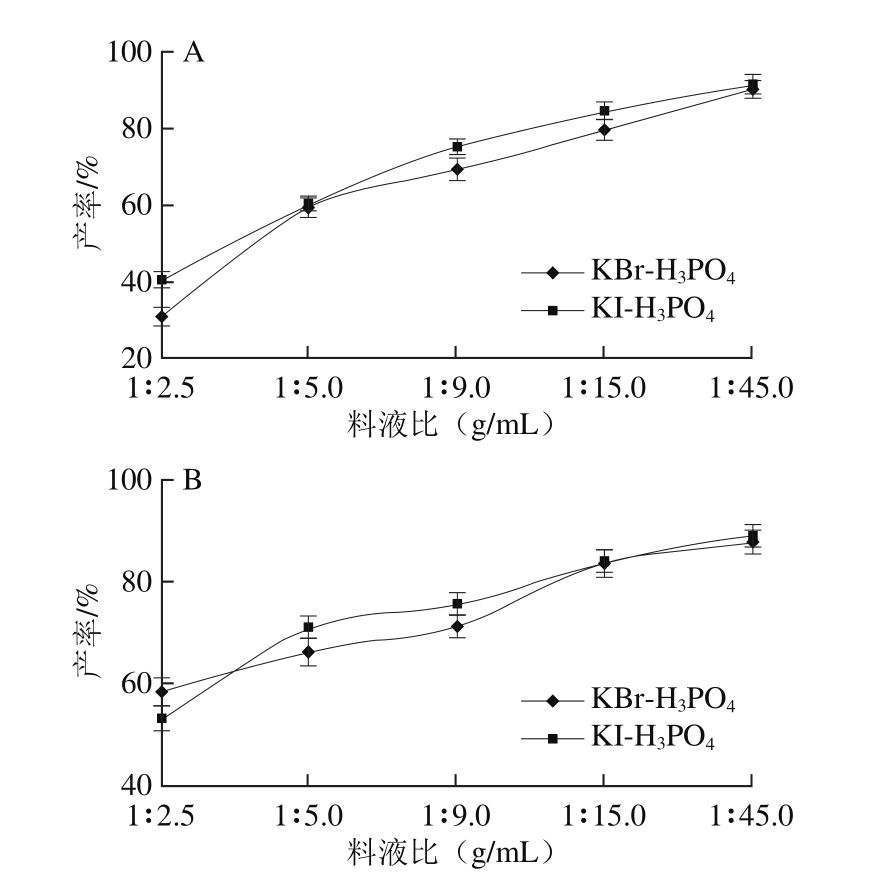
图4 料液比对黄豆苷元(A)和染料木黄酮(B)产率的影响
Fig. 4 Effect of solid-to-solvent ratio on the yield of daidzein (A) and genistein (B)
由图4可知,随着反应体系中提取溶剂用量的增大,产率逐渐升高,但升高趋势渐缓。这是因为增加提取溶剂用量,在亲核试剂HBr和HI浓度较低时,由于反应底物充足,体系中的HBr和HI数量增加,Br-/I-与中心碳原子的作用增强,利于亲核取代的发生,使得反应速率加快,反应进行更加充分,提高了反应物的转化率。但是,当提取溶剂用量增加到一定程度之后,反应底物提供的中心碳原子饱和,限制了亲核取代的进行,从而减缓了产率的提高。因此,当反应产率达到90%以上,增加过高的提取溶剂用量对提高反应产率的意义已经不大,反而会导致反应溶剂的浪费和环境的负担。所以,本实验选择料液比为1∶45(g/mL)。
2.1.4 饱和度对产率的影响
设计实验使体系中Br-/I-的物质的量超过芒柄花黄素和鸡豆黄素的物质的量,以保证反应物的转换率较高,因此,设定饱和度为50%、75%、100%和120%进行实验。由图5可知,改变KBr/KI-H3PO4介质的饱和度对异黄酮产率的影响相对较小。在反应介质KBr-H3PO4中,饱和度为100%时获得黄豆苷元和染料木黄酮最大产率,而KI-H3PO4为反应介质时,最大产率对应的饱和度为75%。


图5 饱和度对黄豆苷元(A)和染料木黄酮(B)产率的影响
Fig. 5 Effect of degree of saturation on the yield of daidzein (A) and genistein (B)
2.2.1 制备黄豆苷元正交试验优化结果
表2 黄豆苷元制备正交试验设计及结果(KBr-H3PO4介质)
Table 2 Orthogonal array design with experimental values of daidzein yield in KBr-H3PO4solution
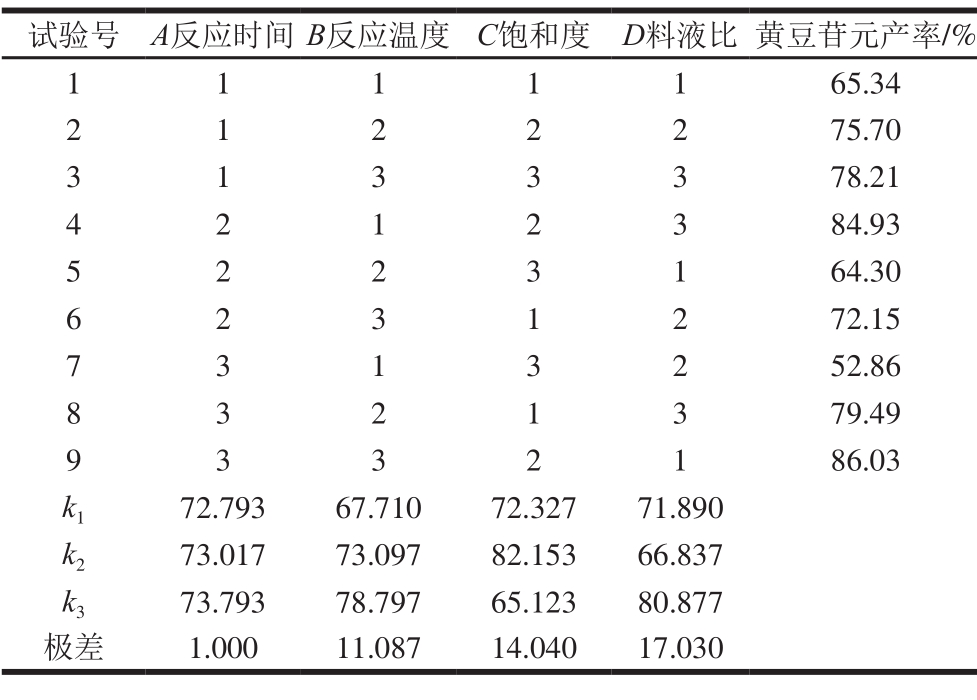
由表2可知,在KBr-H3PO4反应介质中,影响产率的最主要因素为D(料液比),其次是C(饱和度)和B(反应温度),A(反应时间)的影响最小,各因素对黄豆苷元产率影响的主次顺序为D>C>B>A,最优组合为A3B3C2D3,即反应时间5 h、反应温度120 ℃、饱和度75%、料液比1∶45(g/mL)。由表3可知,在KI-H3PO4反应介质中,影响产率的最主要因素同样也是D(料液比),各因素对黄豆苷元产率影响的主次顺序为D>B>A>C,最优组合为A2B2C2D2,即反应时间4 h、反应温度100 ℃、饱和度75%、料液比1∶15(g/mL)。
因以上2 个组合不在试验设计中,故需要按照以上条件平行进行3 次验证实验,结果表明,按照优选工艺A3B3C2D3和A2B2C2D2,在KBr-H3PO4和KI-H3PO4反应介质中黄豆苷元产率分别为89.42%和87.03%,均比设计试验的最佳条件结果要高。因此确定芒柄花黄素转化黄豆苷元的最优工艺条件为在KBr-H3PO4介质中,反应时间5 h、反应温度120 ℃、饱和度75%、料液比1∶45(g/mL);在KI-H3PO4介质中,反应时间4 h、反应温度100 ℃、饱和度75%、料液比1∶15(g/mL)。
表3 黄豆苷元制备正交试验设计及结果(KI-H3PO4介质)
Table 3 Orthogonal array design with experimental values of daidzein yield in KI-H3PO4solution

2.2.2 制备染料木黄酮正交试验优化结果
表4 染料木黄酮正交试验设计及结果(KBr-H3PO4介质)
Table 4 Orthogonal array design with experimental values of genistein yield in KBr-H3PO4solution
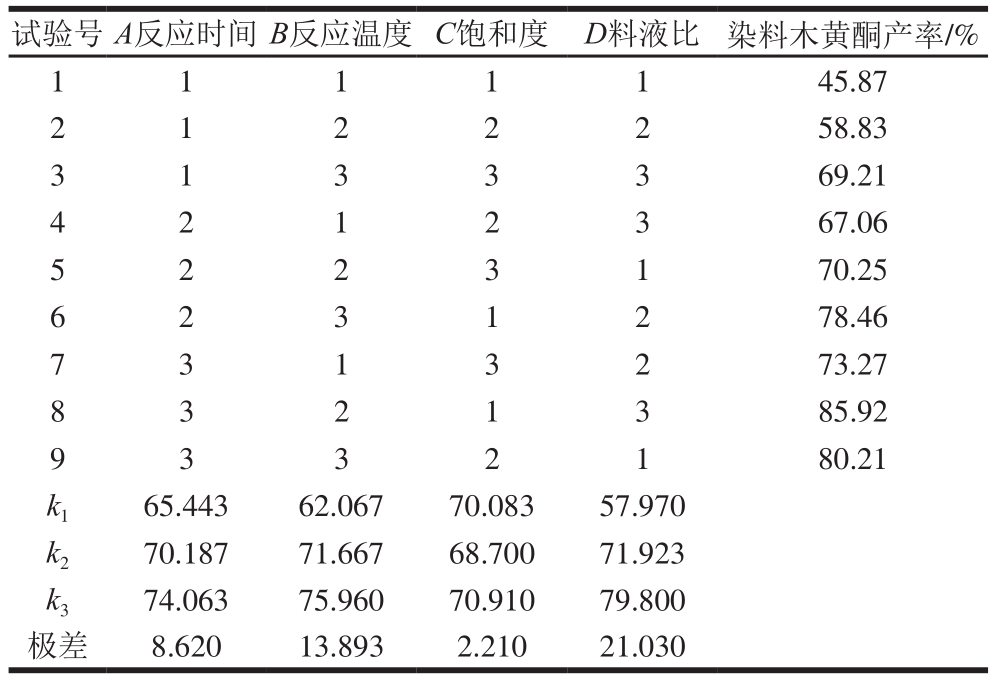
表5 染料木黄酮正交试验设计及结果(KI-H3PO4介质)
Table 5 Orthogonal array design with experimental values of genistein yield in KI-H3PO4solution
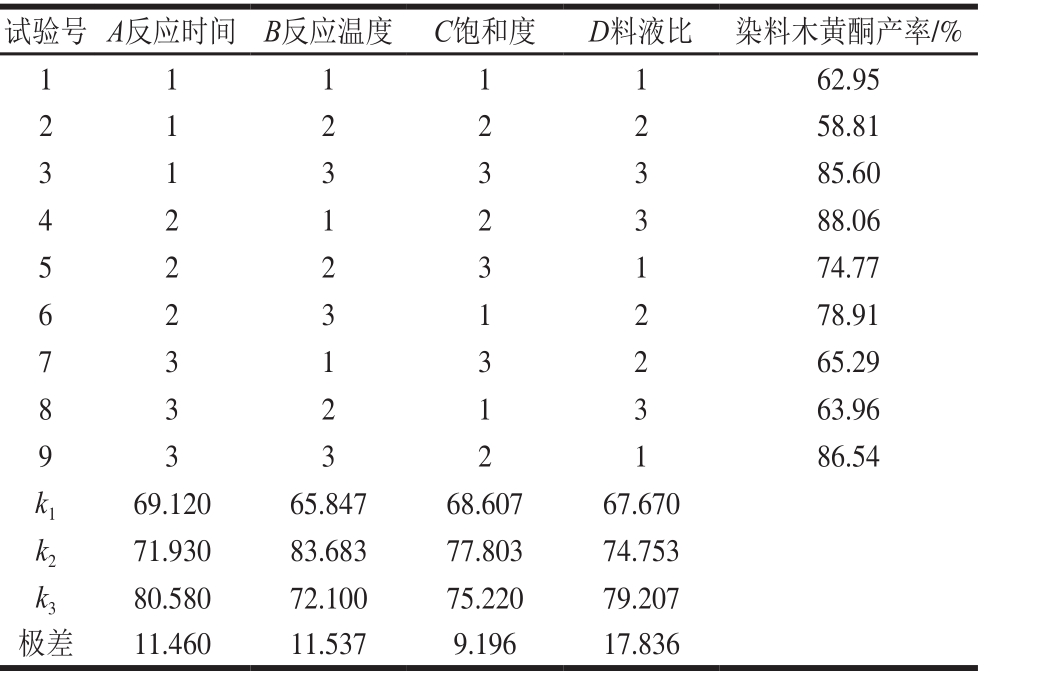
由表4和表5可知,通过极差分析,在KBr-H3PO4反应介质中,影响产率的最主要因素为D(料液比),其次是B(反应温度)和A(反应时间),C(饱和度)的影响最小。各因素对染料木黄酮产率影响的主次顺序为D>B>A>C,最优组合为A3B3C3D3。在KI-H3PO4反应介质中,各因素对染料木黄酮产率影响的主次顺序为D>B>A>C,最优组合为A3B2C2D3。因2 个组合均不在试验设计中,故按最优组合条件平行进行3 次验证实验,结果表明,按照优选工艺A3B3C3D3和A3B2C2D3,在KBr-H3PO4和KI-H3PO4反应介质中染料木黄酮产率分别为85.98%和88.51%,均比设计试验的最佳条件结果要高。因此确定鸡豆黄素转化染料木黄酮的最优工艺条件为在KBr-H3PO4介质中,反应时间5 h、反应温度120 ℃、饱和度100%、料液比1∶45(g/mL);在KI-H3PO4介质中,反应时间5 h、反应温度100 ℃、饱和度75%、料液比1∶45(g/mL)。
2.3.1 DPPH自由基清除能力结果
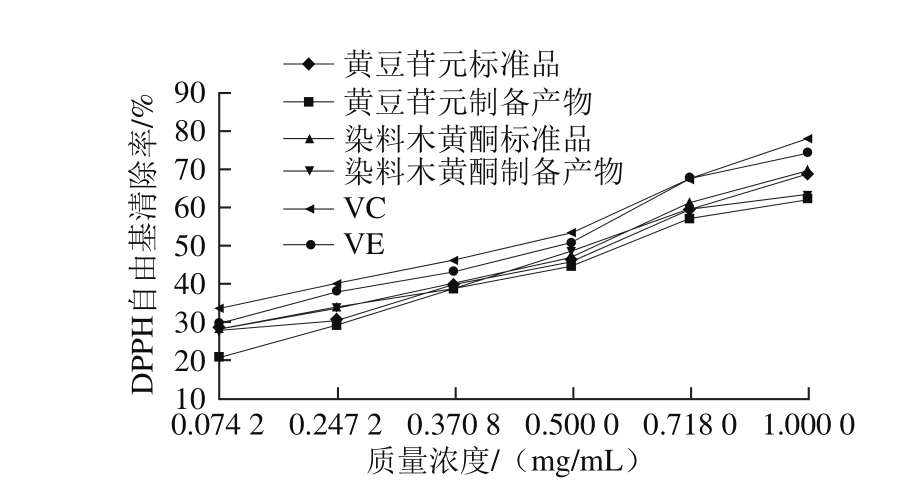
图6 黄豆苷元和染料木黄酮制备产物和标准品清除DPPH自由基能力
Fig. 6 DPPH radical scavenging capacities of daidzein and genistein
由图6可知,制备产物黄豆苷元和染料木黄酮对DPPH自由基均有一定的清除作用。并且,随着产物质量浓度的增加,制备产物的DPPH自由基清除能力逐渐增强。其中,染料木黄酮的DPPH自由基清除率比黄豆苷元稍高。这是由于酚羟基的数目和位置、单体结构的空间位阻都会对自由基清除能力产生影响,从而影响其抗氧化性[19-20]。刘科梅等[21]曾利用量子化学计算研究了黄豆苷元和染料木黄酮分子清除自由基的机理,发现异黄酮分子清除自由基能力与其各羟基位电子转移能力和脱氢能力有关,并且证明4’-OH是黄豆苷元和染料木黄酮最主要的羟基活性部位,通过对羟基位的量化参数计算结果进行比对,表明染料木黄酮具有比黄豆苷元稍强的抗氧化活性,这与本实验结果相符。但染料木黄酮和黄豆苷元的DPPH自由基清除能力都稍弱于阳性对照组VC和VE。
2.3.2 羟自由基清除能力
由图7可知,黄豆苷元和染料木黄酮均有一定的羟自由基清除能力,并且染料木黄酮的清除能力要比黄豆苷元稍强。另外,染料木黄酮的羟自由基清除能力受物质质量浓度影响较大,改变染料木黄酮质量浓度为1~20 μg/mL,其清除率由45%上升至65%,而黄豆苷元对羟自由基清除率变化则不明显。这一结果与文献报道[3]一致。但是当黄豆苷元和染料木黄酮质量浓度继续增加至25 μg/mL,黄豆苷元和染料木黄酮对羟自由基清除能力均发生下降,说明黄豆苷元和染料木黄酮的羟自由基清除能力与质量浓度不完全呈正相关关系[22]。

图7 黄豆苷元、染料木黄酮制备产物和标准品清除羟自由基能力
Fig. 7 Hydroxyl radical scavenging capacities of daidzein and genistein
2.3.3 抗亚油酸氧化能力
黄豆苷元和染料木黄酮中所含有的酚羟基作为供氧体能与自由基反应使之生成相应的离子或分子,终止油脂自由基的连锁反应,使之表现出抗油脂自动氧化的效果[23-24]。因此,可以通过对异黄酮物质的抗油脂氧化的测定,分析其抗氧化能力的强弱。由图8可知,黄豆苷元和染料木黄酮对亚油酸氧化的抑制作用较强。在反应的前7 d,曲线平稳上升趋势较弱,无出峰迹象,这说明前7 d亚油酸氧化基本被抑制。7 d之后,曲线上升明显,在第13天左右达到峰值。比较可知染料木黄酮的抗亚油酸氧化能力较黄豆苷元稍强。
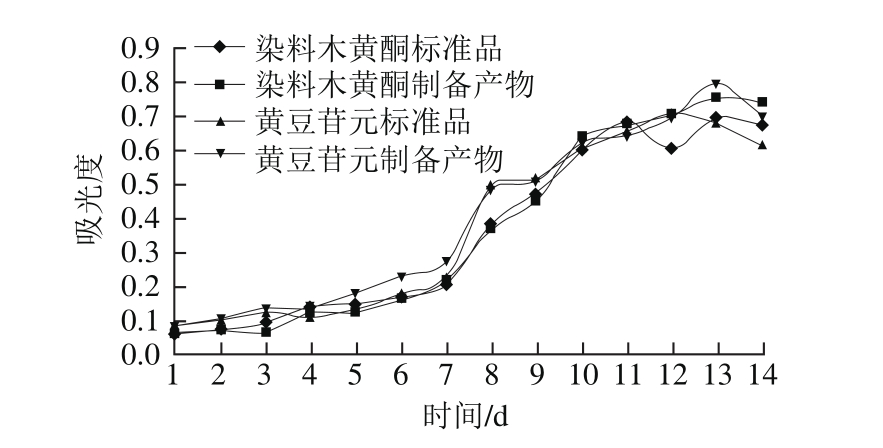
图8 黄豆苷元、染料木黄酮制备产物和标准品抗亚油酸氧化能力
Fig. 8 Inhibitory effects of daidzein and genistein on linoleic acid oxidation
以KBr/KI-H3PO4为反应介质对芒柄花黄素和鸡豆黄素进行去甲基化反应转化成黄豆苷元和染料木黄酮。在单因素试验的基础上,进行正交试验设计,确定最优试验条件。同时,对制备产物黄豆苷元和染料木黄酮的抗氧化活性进行分析,证明黄豆苷元和染料木黄酮具有一定的DPPH自由基和羟自由基清除能力,以及较强的抗亚油酸氧化能力。由于单体结构原因导致染料木黄酮的抗氧化性相对稍强。
红三叶草中含有丰富的芒柄花黄素和鸡豆黄素,也是异黄酮类物质的优质来源。目前,许多研究报道了对红三叶草异黄酮的抗氧化性和生理性能[25]。结果显示,红三叶草中的芒柄花黄素和鸡豆黄素类异黄酮物质能够保护神经元[26]、提高生物体生长性能[27]、增强机体免疫力[28]和降低炎症发生率[29]。可见,红三叶草异黄酮具有一定实际应用价值。但是,与芒柄花黄素和鸡豆黄素相比,黄豆苷元和染料木黄酮的抗氧化活性和生物功能要更高[30],所以能够有效地将芒柄花黄素和鸡豆黄素转化成为性能更加优异的黄豆苷元和染料木黄酮,将进一步提高其红三叶草异黄酮的应用效果和利用价值具有现实意义。因此,本实验对红三叶草及其他富含异黄酮作物的有效利用提供了一定的参考数据。
参考文献:
[1] LAMARTINIERE C A, MOORE J, HOLLAND M, et al. Neonatal genistein chemoprevents mammary cancer[J]. Proceedings of the Society for Experimental Biology and Medicine, 1995, 208(1): 120-123. DOI:10.3181/00379727-208-43843.
[2] TSAO R, PAPADOPOULOS Y, YANG R, et al. Isoflavone profiles of red clovers and their distribution in different parts harvested at different growing stages[J]. Journal of Agricultural and Food Chemistry, 2006, 54(16): 5797-5805. DOI:10.1021/jf0614589.
[3] RÜFER C E, KULLING S E. Antioxidant activity of isoflavones and their major metabolites using different in vitro assays[J]. Journal of Agricultural and Food Chemistry 2006, 54(8): 2926-2931.DOI:10.1021/jf053112o.
[4] 王晓炜, 程光宇, 吴京燕, 等. 大豆异黄酮和牛初乳复合制剂对去卵巢大鼠骨密度及子宫组织抗氧化作用的研究[J]. 食品科学, 2007,28(2): 297-302.
[5] MA T C, CAMPANA A, LANGE P S, et al. A large-scale chemical screen for regulators of the arginase 1 promoter identifies the soy isof l avone daidzein as a clinically approved small molecule that can promote neuronal protection or regeneration via a cAMP-Independent pathway[J]. The Journal Neuroscience, 2010, 30(2): 739-748.DOI:10.1523/JNEUROSCI.5266-09.2010.
[6] VISNEVSCHI-NECRASOV T, FARIA M A, CUNHA S C, et al. Isoflavone synthase (IFS) gene phylogeny in Trifolium species associated with plant isoflavone contents[J]. Plant Systematics and Evolution 2013, 299(2): 357-367. DOI:10.1007/s00606-012-0726-1.
[7] BUTKUTĚ B, LEMEŽIENÈ N, DABKEVIČIENÈ G, et al. Source of variation of isoflavone concentrations in perennial clover species[J].Pharmacognosy Magazine, 2014, 10(s1): 181-188. DOI:10.4103/0973-1296.127373.
[8] CAROLYN Q, BURDETTE R, KENNETH M. Determination of isoflavone content in soy, red clover, and Kudzu dietary supplement materials by liquid chromatography-particle beam/electron ionization mass spectrometry[J]. Journal of AOAC International, 2013, 96(5):925-932. DOI:10.5740/jaoacint.12-431.
[9] 常平, 张颍, 夏开元, 等. 红车轴草提取物中异黄酮成分的分析[J].食品科学, 2007, 28(9): 449-452.
[10] 张小林, 张海燕, 胡延雷. 染料木黄酮的合成研究进展[J]. 化工中间体, 2008(2): 31-33. DOI:10.3969/j.issn.1672-8114.2008.02.010.
[11] 戴立言, 王晓钟, 陈英奇. 异黄酮类化合物的合成新方法[J]. 有机化学, 2008, 28(12): 2126-2131.
[12] LI S R, CHEN P Y, CHEN L Y, et al. Synthesis of haginin E,equol, daidzein, and formononetin from resorcinol via an isoflavene intermediate[J]. Tetrahedron Letters, 2009, 50(18): 2121-2123.DOI:10.1016/j.tetlet.2009.02.159.
[13] BIEGASIEWICZ K F, JEFFREY D S D, VINCENT M C, et al.An efficient synthesis of daidzein, dimethyldaidzein, and isoformononetin[J]. Tetrahedron Letters, 2010, 51(33): 4408-4410.DOI:10.1016/j.tetlet.2010.06.078.
[14] BIEGASIEWICZ K F, GORDON J S, RODRIGUEZ D A, et al.Development of a general approach to the synthesis of a library of isoflavonoid derivatives[J]. Tetrahedron Letters, 2014, 55(37): 5210-5212. DOI:10.1016/j.tetlet.2014.07.110.
[15] CHUNG H L, LIN Y, JIN Z X, et al. Relative antioxidant activity of soybean isoflavones and their glycosides[J]. Food Chemistry, 2005,90(4): 735-741. DOI:10.1016/j.foodchem.2004.04.034.
[16] 井乐刚, 路芳, 张永忠. 大豆异黄酮的抗氧化活性[J]. 食品与发酵工业, 2004, 30(2): 62-65. DOI:10.3321/j.issn:0253-990X.2004.02.014.
[17] YEN G C, CHEN H Y, PENG H H. Antioxidant and pro-oxidant effects of various tea extracts[J]. Journal of Agricultural and Food Chemistry, 1997, 45(1): 30-34. DOI:10.1021/jf9603994.
[18] 胡卫新, 王晓磊, 张洁. 大豆异黄酮提取条件和大豆蛋白质分离工艺研究[J]. 大豆科学, 2005, 24(1): 26-29. DOI:10.3969/j.issn.1000-9841.2005.01.006.
[19] 孙艳梅, 徐雅琴, 杨林. 天然物质类黄酮的抗氧化活性的研究[J]. 中国油脂, 2003, 28(3): 54-57. DOI:10.3321/j.issn:1003-7969.2003.03.017.
[20] 张永忠, 陈学颖, 孙艳梅. 四种异黄酮抗氧化活性的比较研究[J]. 食品科学, 2008, 29(2): 383-386. DOI:10.3321/j.issn:1002-6630.2008.02.085.
[21] 刘科梅, 聂挺, 潘栋梁, 等. 4 种异黄酮抗氧化活性的构效关系[J]. 食品科学, 2016, 37(23): 1-6. DOI:10.7506/spkx1002-6630-201623001.
[22] 汪海波. 大豆异黄酮及大豆皂甙的抗氧化性研究[J]. 食品研究与开发, 2008, 29(3): 9-12. DOI:10.3969/j.issn.1005-6521.2008.03.003.
[23] 韩丽华, 王丽红, 范希. 大豆异黄酮抗氧化性的研究[J]. 中国油脂,2001, 26(6): 41-44. DOI:10.3321/j.issn:1003-7969.2001.06.014.
[24] 汪海波, 刘大川, 佘珠花, 等. 大豆异黄酮类物质的提取、抗氧化性及稳定性研究[J]. 食品科学, 2004, 25(1): 111-114. DOI:10.3321/j.issn:1002-6630.2004.01.026.
[25] 陈学颖, 张永忠, 况冲. 红三叶草异黄酮及其代谢研究进展[J]. 中草药, 2007, 38(11): 1741-1744. DOI:10.3321/j.issn:0253-2670.2007.11.050.
[26] 陈寒青, 金征宇. 鸡豆黄素A抑制小胶质细胞活化保护多巴胺能神经元[J]. 营养学报, 2007, 29(6): 605-613. DOI:10.3321/j.issn:0512-7955.2007.06.020.
[27] 张勇, 朱宇旌, 任慧玲, 等. 红三叶草异黄酮提取物对小鼠生长性能和免疫功能的影响[J]. 沈阳农业大学学报, 2008, 39(1): 104-107.DOI:10.3969/j.issn.1000-1700.2008.01.026.
[28] 孟翠红, 张福元. 红三叶草固态发酵物对肉仔公鸡免疫机能的影响[J]. 安徽农业科学, 2014, 42(36): 12915-12917. DOI:10.3969/j.issn.0517-6611.2014.36.045.
[29] 侯宁, 宁鸿珍, 高尚, 等. 红三叶草异黄酮对大鼠肝功能及炎症反应影响[J]. 中国公共卫生, 2013, 29(8): 1192-1195. DOI:10.11847/zgggws2013-29-08-31.
[30] ZHANG J H, DU F P, PENG B, et al. Structure, electronic properties, and radical scavenging mechanisms of daidzein, genistein,formononetin, and biochanin A: a density functional study[J]. Journal of Molecular Structure: Theochem, 2010, 95(1/2/3): 1-6. DOI:10.1016/j.theochem.2010.04.036.
Preparation of Daidzein and Genistein by Demethylation Reaction and Their Antioxidant Activity
ZHANG Xiaosong, JIN Hua, YAN Huili, ZHANG Yongzhong, XU Jing*
(College of Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:Daidzein and genistein were derived from the demethylation of formononetin and biochanin A in KBr-H3PO4or KI-H3PO4solution, respectively. The antioxidant activities of daidzein and genistein were also evaluated. The optimal conditions for preparing daidzein in KBr-H3PO4solution were determined as follows:reaction time 5 h, reaction temperature 120 ℃, ratio of solid to solvent 1:45 (g/mL), and degree of saturation 75%,providing maximum reaction yield of 89.42%, while those for preparing genistein were 5 h, 120 ℃, 1:45 (g/mL),and 100%, providing maximum reaction yield of 85.98%; the optimal conditions for preparing daidzein in KI-H3PO4solution were determined as 4 h, 100 ℃, 1:15 (g/mL) and 75% for reaction time, temperature, ratio of solid to solvent and degree of saturation, respectively, providing maximum reaction yield of 87.03%, while those for preparing genistein were 5 h, 100 ℃, 1:45 (g/mL) and 75%, respectively, providing maximum reaction yield of 88.51%. Compared with the traditional synthesis methods, the proposed method in this study had many advantages such as simpler reaction process,milder reaction conditions, shorter reaction time and higher yield. The daidzein and genistein had 1,1-diphenyl-2-picrylhydrazyl and hydroxyl radical scavenging ability and a potent inhibitory effect on linoleic acid oxidation suggesting good antioxidant activity.
Keywords:demethylation; daidzein; genistein; formononetin; biochanin A
DOI:10.7506/spkx1002-6630-201802038
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2018)02-0240-07
引文格式:张晓松, 金花, 闫惠丽, 等. 去甲基化法制备黄豆苷元和染料木黄酮及抗氧化性分析[J]. 食品科学, 2018, 39(2): 240-246.
DOI:10.7506/spkx1002-6630-201802038. http://www.spkx.net.cn
收稿日期:2017-03-16
基金项目:国家自然科学基金青年科学基金项目(31301600);中国博士后特别资助项目(2014T70306);
黑龙江省博士后启动基金项目(LBH-Q16012)
第一作者简介:张晓松(1982—),男,实验师,硕士,研究方向为天然生物活性物质提取及应用。E-mail:liuxing167@163.com
*通信作者简介:许晶(1979—),女,副教授,博士,研究方向为食品化学。E-mail:xujing@neau.edu.cn
ZHANG Xiaosong, JIN Hua, YAN Huili, et al. Preparation of daidzein and genistein by demethylation reaction and their antioxidant activity[J]. Food Science, 2018, 39(2): 240-246. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201802038. http://www.spkx.net.cn