邹 烨1,蔡盼盼1,2,王 立1,3,王道营1,*,周 涛2,徐为民1
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京师范大学金陵女子学院,江苏 南京 210097;3.扬州大学食品科学与工程学院,江苏 扬州 225127)
摘 要:以中华鳖裙边为原料,采用单因素试验探讨加酶量、超声时间、超声功率、料液比对胶原蛋白的影响,通过Box-Behnken响应面方法建立数学模型,求得最佳酶提工艺,比较常规酶提和超声辅助酶提胶原蛋白的热稳定性能。结果表明,在提取溶剂为乙酸(0.5 mol/L)、料液比1∶20(g/mL)的条件下,采用超声酶提胶原蛋白的最佳工艺参数为加酶量0.8%、超声时间43 min、超声功率176 W,此条件下胶原蛋白得率为74.50%;差示扫描量热实验结果表明,超声酶提胶原蛋白的热稳定性显著优于常规酶提胶原蛋白。该研究可为中华鳖裙边胶原蛋白的精深加工及其应用提供一定科学依据。
关键词:中华鳖裙边;超声辅助酶提优化;胶原蛋白;得率;热稳定性
胶原蛋白是动物组织中的一类结构蛋白,约占总蛋白量的三分之一,对动物机体和脏器有着支撑、保护、结合等作用,广泛分布于动物的皮肤、骨骼、软骨等[1-2]。胶原蛋白及其水解物具有很好的消化吸收特性,并具备抗氧化功能等作用[3-4],在食品、医学、材料等方面都已得到广泛应用[5-6]。胶原蛋白主要来源于牛、猪的皮肤、骨头等结缔组织[7],而某些地区由于宗教信仰等原因较排斥牲畜来源的胶原蛋白制品[8-9],因此,近年来以水产品为原料提取的胶原蛋白,由于安全性较高得到了世界的公认。
甲鱼(Pelodiscus sinensis)学名鳖,是一种卵生爬行动物,主要分布在亚洲、非洲、美洲的淡水和湖泊中。中国现有的甲鱼品种有中华鳖、山瑞鳖、斑鳖等,其中以中华鳖最为常见[10-11]。中华鳖肉质鲜美、营养丰富,属于典型的低脂高蛋白食品,此外,还含有多种矿物质元素和不饱和脂肪酸,能有效抑制肿瘤细胞生长和肝结缔组织增生,提高血浆蛋白水平[12-13]。中华鳖周围的结缔软组织俗称“裙边”,它含有丰富的胶原蛋白,目前以水产类为原料制备胶原蛋白的研究多集中在水产副产品上,大部分水产胶原蛋白的亚氨酸含量较低,所以其热稳定性较差,如真鳕鱼皮胶原蛋白的热变性温度仅为15 ℃[14-17]。近年来,中华鳖裙边产量逐渐增加,2013年中华鳖裙边年产量超过30 000 t[18]。
超声辅助提取法因为高效节能、绿色、环保近年来应用较多[19],但鲜见有关超声辅助提取甲鱼裙边胶原蛋白的研究报道,研究发现中华鳖裙边的胶原蛋白具有较高的热稳定性,有利于在食品加工和生物材料等领域的应用,因此,有必要对中华鳖裙边的胶原蛋白作进一步研究。本实验拟用超声辅助酶法提取胶原蛋白,利用响应面分析法确定最佳提取工艺,并对优化所得的胶原蛋白进行热稳定性研究,为胶原蛋白快速有效提取和精深加工的应用提供一定理论依据。
中华鳖于2016年9月份采于江苏宿迁宴王水产食品有限公司,数量16 只,体质量约600~700 g/只,活体解剖后取裙边部分,绞碎、混匀,真空袋密封后,-40 ℃冷冻备用;乙酸(分析纯)、氯化钠(分析纯)、碳酸钠(分析纯)、乙二胺四乙酸二钠盐(ethylenediamine tetraacetic acid disodium salt,EDTA-2Na,分析纯)、考马斯亮蓝 南京建成生物工程研究所;胃蛋白酶(酶活1∶30 000) 上海源叶生物技术有限公司。
T25DS25高速粉碎机 德国IKA公司;78-1磁力加热搅拌器、HH-8数显恒温水浴锅 国华电器有限公司;M124A电子天平 意大利贝尔仪器有限公司;UnCen MR台式冷冻离心机 德国Herolab公司;超声波细胞粉碎机 宁波新芝生物科技股份有限公司;真空冷冻干燥机 德国Christ公司;UV-6100型分光光度计上海美普达仪器有限公司;DGG-9023A电热恒温鼓风干燥箱 上海森信实验仪器有限公司。
1.3.1 工艺流程及操作要点
工艺流程:新鲜中华鳖裙边→切碎→去除非胶原蛋白成分→离心(4 000×g,15 min)→脱水干燥→称量→超声辅助酶法提取/常规酶法提取→离心(5 000×g,15 min)→提取上清液→在上清液中加入0.9 mol/L NaCl溶液→离心(5 000×g,15 min)→收集沉淀溶于0.5 mol/L乙酸溶液中→用0.1 mol/L乙酸溶液透析1 d,用蒸馏水透析2 d→测定羟脯氨酸含量→计算胶原蛋白含量→真空冷冻干燥(-48 ℃,40 h)→胶原蛋白酶溶性粗提物→计算胶原蛋白得率。
操作要点:非胶原蛋白成分的去除:称取40 g切碎后的中华鳖裙边,用2.0% NaCl溶液(料液比1∶20(g/mL),下同)于20 ℃条件下连续磁力搅拌8 h,去除水溶性及盐溶性杂蛋白,接着用0.5 mol/L Na2CO3溶液20 ℃连续磁力搅拌8 h,再用0.3 mol/L EDTA-2Na溶液20 ℃ 连续磁力搅拌8 h,用蒸馏水反复洗涤,充分沥干后再加入与NaCl溶液同体积的10%异丙醇溶液20 ℃浸泡24 h,以去除脂肪等杂质。超声辅助酶提:称取适量除杂后的中华鳖裙边,加入一定量的0.5 mol/L乙酸溶液和胃蛋白酶,置于超声波细胞粉碎机中提取。常规酶提取:称取适量除杂后的中华鳖裙边,加入一定量的0.5 mol/L乙酸溶液和胃蛋白酶,在室温下,置于磁力搅拌机上搅拌提取,提取24 h。羟脯氨酸的测定:根据GB/T 9696.23—2008《动植物油脂 水分和挥发物含量测定》中的方法测定样品中羟脯氨酸的含量。胶原蛋白得率的计算:用提取的上清液中羟脯氨酸含量乘以对应的胶原蛋白换算系数[20]得到胶原蛋白的含量,胶原蛋白得率由下式计算:
式中:ma为胶原蛋白质量/g;mb为中华鳖裙边质量/g。
1.3.2 单因素试验
根据提取胶原蛋白的工艺流程,设定提取试剂为0.5 mol/L乙酸溶液、加酶量1%、超声时间40 min、超声功率200 W、料液比1∶20(g/mL),固定其他条件,分别设置不同料液比(1∶5、1∶10、1∶30、1∶50、1∶70(g/mL))、超声功率(50、100、150、200、250、300 W)、超声时间(10、20、30、40、50 min)、加酶量(0.25%、0.50%、0.75%、1.00%、1.25%)条件下胶原蛋白得率,考察其对胶原蛋白得率的影响。
1.3.3 响应面法优化试验
根据单因素试验的结果可知,料液比对胶原蛋白得率的影响不显著,变化趋势平缓,故选取加酶量、超声时间、超声功率为影响超声辅助酶提中华鳖裙边胶原蛋白的主要因素,根据Box-Behnken试验设计原理,设计三因素三水平的响应面试验,总计进行17 次。试验因素与水平见表1。
表1 响应面试验因素与水平
Table 1 Factors and levels used for Box-Behnken design

1.3.4 氨基酸组成分析
釆用高效液相色谱进行胶原蛋白氨基酸组成测定,样品处理方法如下:称取一定量的胶原蛋白于水解管中,加入6.0 mol/L HCl溶液,密封水解管后,110 ℃水解24~36 h,在338 nm检测波长下测定胶原蛋白的氨基酸组成。
1.3.5 热稳定性分析
将胶原蛋白用差示扫描量热仪(differential scanning calorimeter,DSC)进行扫描[21],样品质量为4~5 mg,所有的测定都要在氮气环境下进行;程序升温:扫描温度为室温至20 ℃,扫描速率为5 ℃/min。最大变性温度(Tmax)用Ver 2.0N软件分析。
采用Excel 2007、Origin 8.0、Design-Expert 8.0.6对数据进行整理并作图,结果以 ±s表示,用SPSS 18.0进行不同处理组间显著性分析(P<0.05)。
2.1.1 料液比对胶原蛋白得率的影响
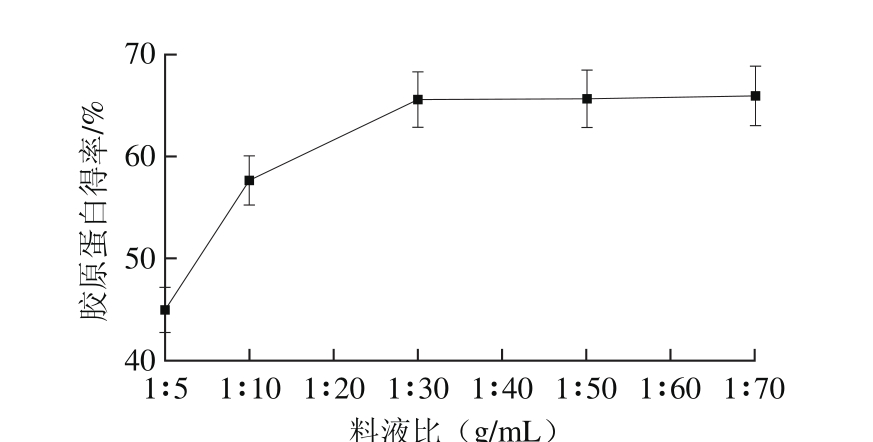
图1 料液比对胶原蛋白得率的影响
Fig. 1 Effect of solid-to-solvent ratio on the yield of collagen
由图1可知,胶原蛋白得率随提取液用量的增加而逐渐升高,当料液比为1∶20(g/mL)时增加趋势变缓,基本保持不变。这是因为溶剂剂量小时,溶液过分黏稠,且在超声过程中易形成泡沫,造成扩散速度较慢,不能保证裙边中的胶原蛋白全部转移到提取液中;而随着提取液用量的逐渐增大,中华鳖裙边中的酶溶性胶原蛋白得率逐渐增加直至基本提取完全,故胶原蛋白得率先增加后保持平稳不变,这与王珮等[22]结果相似。所以,选取料液比1∶20(g/mL)作为提取最适料液比。
2.1.2 超声功率对胶原蛋白得率的影响
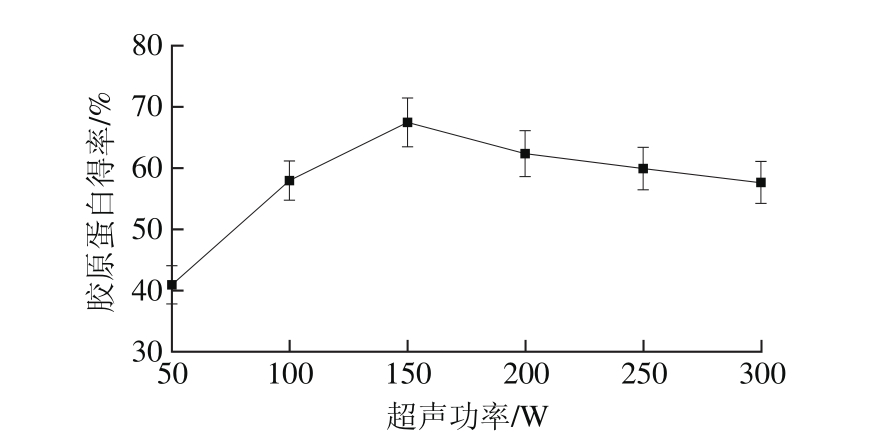
图2 超声功率对胶原蛋白得率的影响
Fig. 2 Effect of ultrasonic power on the yield of collagen
超声波可使细胞破碎,并且加快提取物的运动,促进有效成分的溶出,一般来说,加大超声功率会进一步加强这些效果。从图2可以看出,超声功率在50~150 W的范围内,胶原蛋白得率随着功率的增加而增大,在150 W处达到最大,表明超声的空化效应使得胶原蛋白更好的溶解于溶剂中[23]。而超过150 W后,胶原蛋白得率缓慢下降。这可能是因为超声功率增大会使得温度有一定的升高,加快了胶原蛋白的提取;而当温度过高时,高温使酶失活,降低了提取效率,而且超声功率过大会破坏胶原蛋白分子的结构,造成胶原蛋白分子的降解,因此选定150 W为最适超声功率。
2.1.3 超声时间对胶原蛋白得率的影响

图3 超声时间对胶原蛋白得率的影响
Fig. 3 Effect of ultrasonic time on the yield of collagen
根据图3可知,胶原蛋白得率随提取时间的延长而增加,到40 min时达到最大。而当时间继续延长,胶原蛋白得率反而开始下降。这可能是因为适当延长时间可给予酶与底物充分反应的机会,使得胶原蛋白充分溶解在提取液中;而当超过一定时间后,超声可能会使提取溶液的温度升高,造成酶失活,并且部分胶原蛋白分子也可能发生热降解或者破坏胶原蛋白的分子结构,致使胶原蛋白得率下降,所以提取最适超声时间可选为40 min。
2.1.4 加酶量对胶原蛋白得率的影响
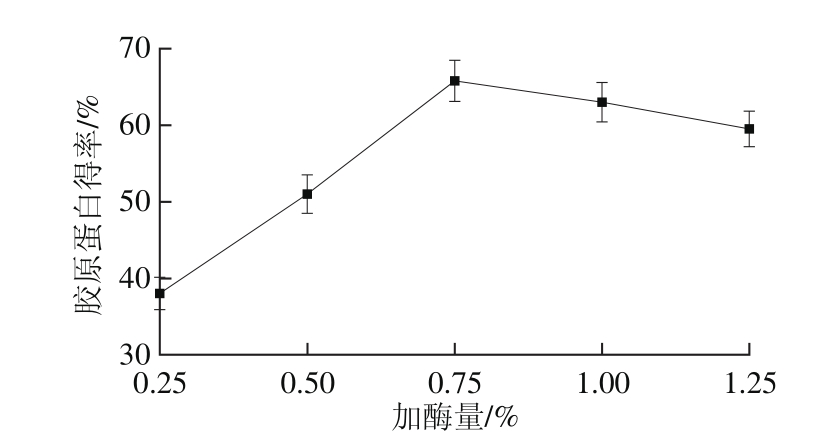
图4 加酶量对胶原蛋白得率的影响
Fig. 4 Effect of enzyme dosage on the yield of collagen
由图4可以看出,胶原蛋白得率随加酶量的增加而增大,加酶量为0.75%时达到最高值,这是因为加酶量增加使得底物与酶充分反应增加胶原蛋白得率。然而随着加酶量的继续增加,胶原蛋白得率开始下降。这可能是由于加酶量过大,底物已经反应完全,而且当酶过量时底物会完全与酶结合,加快胶原蛋白降解,该加酶量与鮟鱇鱼皮胶原蛋白的提取相差较大,可能是底物种类的不同,或者酶活力不一样[22],因此选取最适加酶量为0.75%。
2.2.1 数学模型的建立与显著性分析
对表2中响应值与各个元素进行回归拟合,该模型对应的回归方程为Y/%=72.98+3.25X1+3.06X2+![]()
![]()
经Design-Expert 8.0.6软件处理,采用二次型进行方差分析,二次回归方程的显著性分析见表3。从表3可以看出,模型的P值小于0.000 1,表明回归模型极显著,失拟误差P值为0.113 1大于0.05,不显著,说明该模型可用来进行响应值的预测。试验设计通过软件分析得到的二次回归方程的拟合系数R2值为0.998 9大于0.9,说明回归模型与试验结果的拟合度高[21]。模型调整确定系数![]() 为0.997 5,说明该模型能够解释99.75%的响应值变化。一次项系数
为0.997 5,说明该模型能够解释99.75%的响应值变化。一次项系数![]() 均表现为极显著,表明这些因素对胶原蛋白得率的影响极显著。而F值表示的是加酶量、超声时间、超声功率这3 个因素对胶原蛋白得率的影响程度,F值越大,说明影响越大[24]。由3 个影响因素的F值大小可以推断出,3 个因素对胶原蛋白得率影响主次顺序为加酶量>超声时间>超声功率。
均表现为极显著,表明这些因素对胶原蛋白得率的影响极显著。而F值表示的是加酶量、超声时间、超声功率这3 个因素对胶原蛋白得率的影响程度,F值越大,说明影响越大[24]。由3 个影响因素的F值大小可以推断出,3 个因素对胶原蛋白得率影响主次顺序为加酶量>超声时间>超声功率。
表2 Box-Behnken试验设计与结果
Table 2 Box-Behnken design matrix with experimental results

表3 回归统计分析结果
Table 3 Statistical analysis of the developed response surface regression model

注:*. P<0.05,差异显著;**. P<0.01,差异极显著。
2.2.2 因素间交互作用影响结果
经Design-Expert 8.0.6软件处理,得到加酶量(X1)、超声时间(X2)、超声功率(X3)交互作用的响应面和等高线图。一般来说,等高线图呈椭圆状时表示两因素交互作用显著,圆形则相反[22]。如图5所示,超声功率和加酶量(X1X3)、超声功率和超声时间(X2X3)对胶原蛋白得率的影响极显著,加酶量和超声时间(X1X2)交互作用显著,与显著性分析结果相符。
根据所得到的响应面模型,经Design-Expert 8.0.6软件处理得到最优工艺为加酶量0.8%、超声时间43.31 min、超声功率176.71 W,在此条件下胶原蛋白得率为74.45%。考虑到实际可操作性,调整工艺参数为加酶量0.8%、超声时间43 min、超声功率176 W,在此条件下进行3 组验证实验,胶原蛋白得率为74.35%、74.47%、74.68%,取平均值为74.50%,与理论值较为接近,表明响应面模型对优化胶原蛋白的提取工艺可行,所得的胶原蛋白仍保持三螺旋结构,属于胶原蛋白-Ⅰ型[25]。

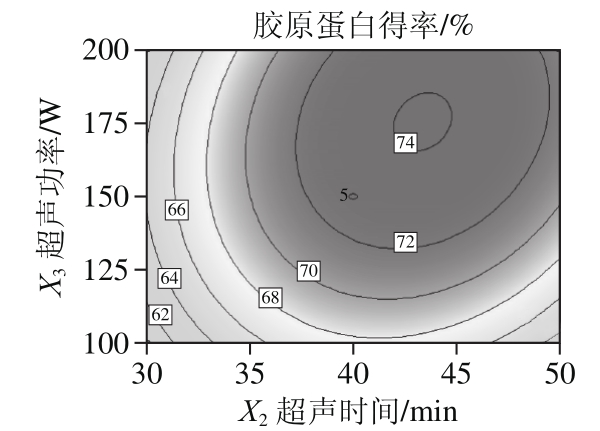
图5 各因素交互作用对胶原蛋白得率影响的响应面和等高线图
Fig. 5 Response surface and contour plots showing the interactive effect of extraction parameters on the yield of collagen

图6 胶原蛋白的DSC分析
Fig. 6 DSC curves of pepsin-soluble collagen from turtle calipash extracted by different methods
DSC广泛应用于蛋白质热变性的研究[26]。在DSC图谱中,最大峰对应的温度代表蛋白质变性时的转化温度,变性温度能反映蛋白质的热稳定性及蛋白质分子的聚集程度。由图6可知,与常规酶提的相比,超声辅助酶提胶原蛋白的变性温度发生了变化,经过超声辅助酶提胶原蛋白的变性温度由33.4 ℃升高到36.5 ℃,这与张俊杰等[27]的研究结论一致,表明经过超声辅助酶提的胶原蛋白的结构趋于稳定,分子结构趋于松散。以上结果表明,超声辅助酶提的中华鳖裙边胶原蛋白在食品和生物材料领域中具有潜在的应用前景。
为了更加深入地探讨超声波辅助酶提对胶原蛋白热稳定性质的影响机理,分别对胶原蛋白进行氨基酸组成分析,其结果见表4。从表4可以看出,与常规酶提相比,经超声酶提后,胶原蛋白的氨基酸组成发生了明显变化,超声辅助提取产物的疏水性氨基酸和支链氨基酸的含量增多,胶原蛋白中亚氨酸比常规酶提法提高了9.8%。其中,中华鳖裙边胶原蛋白的亚氨酸(脯氨酸和羟脯氨酸)含量均较高,接近猪皮和牛皮中的胶原蛋白含量[28],这2 种氨基酸由吡咯环形成的非共价键在稳定胶原蛋白的三股螺旋结构方面发挥着非常重要的作用[29]。一般来说,胶原蛋白中亚氨酸的含量比较高,其热稳定性也比较好。水产胶原蛋白的热稳定性还与水产动物的生活环境有关。真鳕鱼由于生活在较低的温度下,所以表现出较低的热变性温度。而中华鳖喜欢生活在水温偏高的环境中[30],所以其亚氨酸含量偏高,因此表现出较高的热变性温度。
表4 胶原蛋白的氨基酸组成分析
Table 4 Amino acid composition of pepsin-soluble collagen from turtle calipash extracted by different methods

注:*.脯氨酸+羟脯氨酸。同行不同字母表示具有显著性差异,P<0.05。
本实验对超声辅助酶提中华鳖裙边胶原蛋白的工艺进行了优化,结果显示,影响胶原蛋白得率的主次顺序依次为加酶量>超声时间>超声功率。在优化后的工艺参数下胶原蛋白得率为74.50%。此方法高效方便,提取时间较常规酶提法大幅度的缩小,适用于大规模生产。并且所得胶原蛋白的热稳定性较好,不仅为中华鳖裙边的精深加工提供理论基础,还为中华鳖裙边胶原蛋白在食品加工和生物材料领域中的应用提供一定科学依据。
参考文献:
[1] 宋芹, 陈封政, 颜军, 等. 胶原蛋白的研究进展[J]. 成都大学学报(自然科学版), 2012, 31(6): 35-38. DOI:10.3969/j.issn.1004-5422.2012.01.011.
[2] CHIQUET M, BIRK D E, BONNEMANN C G, et al. Collagen Ⅻ:protecting bone and muscle integrity by organizing collagen fibrils[J].International Journal of Biochemistry & Cell Biology, 2014, 53(7): 51-54. DOI:10.1016/j.biocel.2014.04.020.
[3] LEE C H, SINGLA A, LEE Y. Biomedical applications of collagen[J]. International Journal of Pharmaceutics, 2001, 221(1/2): 1.DOI:10.1016/S0378-5173(01)00691-3.
[4] 王秋卓. 胶原蛋白在健康美容方面的应用研究[J]. 价值工程, 2011,30(29): 304-305. DOI:10.3969/j.issn.1006-4311.2011.29.210.
[5] CHEN S, CHEN H, XIE Q, et al. Rapid isolation of high purity pepsin-soluble type Ⅰ collagen from scales of red drum fish (Sciaenops ocellatus)[J]. Food Hydrocolloids, 2016, 52: 468-477. DOI:10.1016/j.foodhyd.2015.07.027.
[6] ZHANG Y H, OLSEN K, GROSSI A, et al. Effect of pretreatment on enzymatic hydrolysis of bovine collagen and formation of ACE-inhibitory peptides[J]. Food Chemistry, 2013, 141(3): 2343-2354.DOI:10.1016/j.foodchem.2013.05.058.
[7] FERRARO V, ANTON M, SANTE-LHOUTELLIER V. The “sisters”α-helices of collagen, elastin and keratin recovered from animal by-products:functionality, bioactivity and trends of application[J]. Trends in Food Science & Technology, 2016, 51: 65-75. DOI:10.1016/j.tifs.2016.03.006.
[8] YAMADA M. The first Japanese case of variant Creutzfeldt-Jakob disease showing periodic electroencephalogram[J]. Lancet, 2006, 367:874-874. DOI:10.1016/S0140-6736(06)68344-X.
[9] GOYAL D, GOYAL A, BRITTBERG M. Consideration of religious sentiments while selecting a biological product for knee arthroscopy[J].Knee Surgery Sports Traumatology Arthroscopy, 2013, 21(7): 1577-1586. DOI:10.1017/S00167-012-2292-z.
[10] 陆剑锋, 万全, 殷章敏, 等. 中华鳖裙边胶原蛋白的提取及其特征[J].水产学报, 2010, 34(6): 801-808. DOI:10.3724/sp.j.2010.06800.
[11] 江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 1979:27-35.
[12] 刘彦, 刘承初. 甲鱼的营养价值与保健功效研究[J]. 上海农业学报,2010, 26(2): 93-96. DOI:10.3969/j.issn.1000-3924.2010.02.022.
[13] 王楠, 王伟, 刘彩琴, 等. 甲鱼蛋白质各组分的营养价值分析[J]. 食品工业科技, 2015, 36(8): 343-347. DOI:10.13386/j.issn.1002-0306.2015.08.063.
[14] 梁拥军, 孙向军, 杨璞, 等. 罗非鱼鱼皮胶原蛋白多肽的制备及其理化性质研究[J]. 安徽农业科学, 2009, 37(4): 1588-1590.DOI:10.3969/j.issn.0517-6611.2009.04.082.
[15] ZHANG Q, WANG Q, LY S, et al. Comparison of collagen and gelatin extracted from the skins of Nile tilapia (Oreochromis niloticus)and channel catfish (Ictalurus punctatus)[J]. Food Bioscience, 2016,13: 41-48. DOI:10.1016/j.fbio.2015.12.005.
[16] 袁园, 胡建平. 微波法提取鱼鳞胶原蛋白及其性质研究[J]. 湖北农业科学, 2013, 52(3): 662-664. DOI:10.3969/j.issn.0439-8114.2013.03.046.
[17] CHEN Y, YE R, WANG Y. Acid-soluble and pepsin-soluble collagens from grass carp (Ctenopharyngodon idella) skin: a comparative study on physicochemical properties[J]. International Journal of Food Science & Technology, 2015, 50(1): 186-193. DOI:10.1111/ijfs.12675.
[18] YANG Y N, LI C Y, SONG W, et al. Purification, optimization and physicochemical properties of collagen from soft-shelled turtle calipash[J]. International Journal of Biological Macromolecules, 2016,89: 344-352. DOI:10.1016/j.ijbiomac.2016.04.048.
[19] JIANG Y J, WANG H B, DENG M X, et al. Effect of ultrasonication on the fibril-formation and gel properties of collagen from grass carp skin[J]. Materials Science and Engineering C, 2016, 59: 1038-1046.DOI:10.1016/j.msec.2015.11.007.
[20] WANG L, LIANG Q, CHEN T, et al. Characterization of collagen from the skin of Amur sturgeon (Acipenser schrenckii)[J]. Food Hydrocolloids,2014, 38(38): 104-109. DOI:10.1016/j.foodhyd.2013.12.002.
[21] PIZZOLATO M, BOUTELIER T, DERICHE R. Perfusion deconvolution in DSC-MRI with dispersion-compliant bases[J]. Medical Image Analysis,2017, 36: 197-215. DOI:10.1016/j.media.2016.12.001.
[22] BHASKARACHARYA R K, KENTISH S, ASHOKKUMAR M.Selected applications of ultrasonics in food processing[J]. Food Engineering Reviews, 2009, 1(1): 31-49. DOI:10.1017/s12393-009-9003-7.
[23] 王珮, 苏秀榕, 张永飞, 等. 鮟鱇鱼皮胶原蛋白酶提取最优工艺研究与结构表征[J]. 食品科学, 2013, 34(7): 217-222. DOI:10.7506/spkx1002-6630-201307045.
[24] 王升力, 黄雪琴, 郭诗, 等. 响应面法优化虾壳中虾青素提取工艺的研究[J]. 陕西农业科学, 2016, 62(2): 1-5. DOI:10.3969/j.issn.0488-5368.2016.02.001.
[25] ZOU Y, XU P P, LI P P, et al. Effect of ultrasound pre-treatment on the characterization and properties of collagen extracted from soft-shelled turtle (Pelodiscus sinensis)[J]. LWT-Food Science and Technology, 2017, 82: 72-81. DOI:10.1016/j.lwt.2017.04.024.
[26] DINANI S T, HAMDAMI N, SHAHEDI M, et al. Influence of the electrohydrodynamic process on the properties of dried button mushroom slices: a differential scanning calorimetry (DSC) study[J].Food and Bioproducts Processing, 2015, 95: 83-95. DOI:10.1016/j.fbp.2015.04.001.
[27] 张俊杰, 段蕊, 许晓静, 等. 鱿鱼鱼皮酶溶性胶原蛋白部分生化性质研究[J]. 食品与发酵工业, 2009(12): 57-60. DOI:10.13995/j.cnki.11-1802/ts.2009.12.025.
[28] ZHANG Y, LIU W T, LI G Y, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp(Ctenopharyngodon idella)[J]. Food Chemistry, 2007, 103: 906-912.DOI:1016/j.foodchem.2006.09.053.
[29] DUAN L, YUAN X, YANG X, et al. Interaction study of collagen and sericin in blending solution original[J]. International Journal of Biological Macromolecules, 2016, 93: 468-475. DOI:10.1016/j.ijbiomac.2016.09.003.
[30] YANG Y, LI C, SONG W, et al. Purification, optimization and physicochemical properties of collagen from soft-shelled turtle calipash[J]. International Journal of Biological Macromolecules, 2016,89: 344-352. DOI:10.1016/j.ijbiomac.2016.04.048.
Ultrasonic-Assisted Enzymatic Extraction and Thermal Stability of Collagen from Soft-Shelled Turtle Calipash
ZOU Ye1, CAI Panpan1,2, WANG Li1,3, WANG Daoying1,*, ZHOU Tao2, XU Weimin1
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2. Ginling College, Nanjing Normal University, Nanjing 210097, China;3. College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China)
Abstract:In the current study we optimized the ultrasonic-assisted enzymatic extraction of collagen from soft-shelled turtle calipash. One-factor-at-a-time method was used to investigate four factors affecting the extraction efficiency including enzyme dosage, ultrasonic time, ultrasonic power and solid-to-solvent ratio. Subsequently, a mathematical model with enzyme dosage, ultrasonic time and ultrasonic power as independent variables was established by Box-Behnken design.Meanwhile, we compared the thermostability of collagen extracted by routine enzymatic extraction and ultrasoundassisted enzymatic extraction. The optimal extraction conditions that provided the maximum collagen yield (74.50%) were determined as follows: 0.5 mol/L acetic acid as the extraction solvent, solid-to-liquid ratio 1:20 (g/mL), enzyme dosage 0.8%, ultrasonic time 43 min, and ultrasonic power 176 W. The results of differential scanning calorimetry showed that the thermostability of collagen extracted by the modified method was better than that of collagen prepared by conventional enzymatic extraction. The results of this study can provide a basis for intensitive processing and application of collagen from soft-shelled turtle calipash.
Keywords:soft-shelled turtle calipash; optimization of ultrasonic-assisted enzymatic extraction; collagen; yield; thermal stability
DOI:10.7506/spkx1002-6630-201802040
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2018)02-0254-06
引文格式:邹烨, 蔡盼盼, 王立, 等. 超声辅助酶法提取中华鳖裙边胶原蛋白及其热稳定性能[J]. 食品科学, 2018, 39(2): 254-259.
DOI:10.7506/spkx1002-6630-201802040. http://www.spkx.net.cn
ZOU Ye, CAI Panpan, WANG Li, et al. Ultrasonic-assisted enzymatic extraction and thermal stability of collagen from softshelled turtle calipash[J]. Food Science, 2018, 39(2): 254-259. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201802040. http://www.spkx.net.cn
收稿日期:2017-03-21
基金项目:江苏省苏北科技专项(BN2015148);江苏省博士后科研资助计划项目(1601131C)
第一作者简介:邹烨(1986—),女,助理研究员,博士,研究方向为肉品加工与质量控制。E-mail:zouye@jaas.ac.cn
*通信作者简介:王道营(1979—),男,副研究员,博士,研究方向为肉品加工与质量控制。E-mail:wdy0373@aliyun.com