任彦荣1,2,张忠明3,谢跃杰1,熊政委1,2,王仲明1,吴洪斌4,*
(1.重庆第二师范学院生物与化学工程学院,重庆 400067;2.重庆第二师范学院 重庆市功能性食品协同创新中心,重庆 400067;3.甘肃农业大学食品科学与工程学院,甘肃 兰州 737100;4.新疆农垦科学院农产品加工研究所,新疆 石河子 832000)
摘 要:以新疆红枣为原料提取环磷酸腺苷(cyclic adenosine 3’,5’-monophosphate,cAMP),通过响应面法优化微波辅助复配酶法提取cAMP工艺,并建立回归模型;同时研究cAMP提取物对D-半乳糖诱导衰老模型小鼠的游泳耐力的影响。结果表明,最佳提取工艺为复配酶(纤维素酶-半纤维素酶-果胶酶)质量比1∶1∶1、复配酶添加量1.5%(质量分数)、酶解温度31.3 ℃、酶解时间20 min、微波功率500 W,在此条件下cAMP提取量为560.9 μg/g;新疆红枣cAMP提取物能延长小鼠力竭游泳时间,增加小鼠游泳耐力,说明cAMP对小鼠具有很好的抗疲劳作用。新疆红枣作为cAMP的提取原料在食品和医药工业中具有较好的应用前景。
关键词:红枣;环磷酸腺苷(cAMP);微波辅助水酶法提取;游泳耐力
红枣(Z i z y p h u s j u j u b e M i l 1.)系鼠李科(Rhamnaceae)枣属(Ziziphus Mil1.)植物的果实,在我国与桃、李、杏、栗并称“中国五果”。红枣不仅口味鲜美,同时也具有极强的药用价值[1-2]。国内外研究结果显示,红枣独特的调节机体功能与其含有的多糖、黄酮、维生素、环磷酸腺苷(cyclic adenosine 3’,5’-monophosphate,cAMP)等活性物质紧密相关[3-5]。cAMP为核苷酸的衍生物,是有机体中广泛存在的重要活性物质[6-8]。在血管扩张、心肌缺氧、舒张平滑肌、神经再生、血糖调节、肝功能等方面具有良好的改善作用,同时可促进细胞调节功能和呼吸链氧化酶的活性[9-10]。
近年来新疆红枣产业发展迅速,其品质享誉全国,但同时新疆红枣产业存在着加工水平低、品种单一、市场竞争力低等问题;为了解决红枣产业化发展中的上述问题,针对目前新疆红枣加工能力较弱及资源综合利用较低的情况,研究学者对红枣提取技术进行了广泛的探讨。国内外研究发现,红枣中存在丰富的cAMP,是一种优质的cAMP提取资源,不同种类的红枣鲜果的cAMP含量约1.23~99.60 μg/g,平均含量为12.53 μg/g,在水果中含量最高,约为酸枣的2 倍,是梨、桃的近千倍[11-13]。目前,cAMP的主要提取方法为水提法、乙醇提取法、酶法、微波辅助提取法、超声辅助提取法、微波-超声波辅助提取等[14-17];王立霞[14]研究了微波辅助提取和田玉枣cAMP工艺参数,并与传统溶剂法和超声波辅助法对比,结果表明,微波辅助法较传统溶剂法和超声波辅助法提取量高、提取时间短、能耗低。微波辅助水酶法提取技术利用微波热效应和分子振动降低反应活化能的非热效应,可以缩短酶解时间,从而提高提取效率、降低成本,已被广泛应用于天然有效成分的提取[18-22]。目前采用微波辅助水酶法提取红枣中cAMP的方法鲜有报道。本实验以新疆红枣为研究对象,采用单因素及响应面法优化微波辅助复配酶法提取cAMP工艺,同时研究了cAMP提取物对D-半乳糖诱导衰老模型小鼠的游泳耐力的影响,可对红枣深加工和专属功效红枣产品提供科学依据。
新疆红枣2015年10月份采摘(充分成熟,新鲜);SPF级昆明种小鼠50 只,体质量18~22 g。
D-半乳糖 美国Sigma Aldrich公司;对照品cAMP(50 mg/瓶) 中国食品药品检定研究院;乙腈(色谱纯) 德国Merck公司;纤维素酶、半纤维素酶、果胶酶 诺维信(中国)生物技术有限公司;磷酸二氢钾、柠檬酸(分析纯)、甲醇(色谱纯) 成都科龙试剂厂;本实验所用水均为双蒸水,实验所有溶液均为自行配制。
12 00液相色谱-6 46 0三重四极杆质谱联用仪美国Agilent公司;MAS-II常压微波合成/萃取反应工作站上海新仪微波化学科技有限公司;RE-52A旋转蒸发仪上海沪西仪器设备公司;DHG-9240A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;电子天平 梅特勒-托利多国际贸易(上海)有限公司。
1.3.1 原料预处理方法
红枣样品去核后置于冷冻干燥机(-50 ℃,1 0 0 P a)中干燥。各样品均干燥至含水率约为(8±1)%。干燥后样品进行粉碎并过60 目筛,真空密封后置于常温干燥器中备用。
1.3.2 微波辅助酶法提取cAMP
称取10.00 g预处理后的红枣粉放入三角瓶中,加入纯净水溶解(液料比为10∶1(mL/g)),加入酶制剂,搅拌均匀后置于MAS-II常压微波合成/萃取反应工作站,3 000 r/min离心10 min取上清液,洗涤滤渣后与上清液合并过滤浓缩至50 mL备用。
提取工艺流程:红枣粉(10 g)→加酶制剂→设定微波辅助水酶法处理条件(液料比10∶1(mL/g),仪器搅拌速率300 r/min)→离心分离→cAMP提取物。
1.3.3 红枣中cAMP测定
1.3.3.1 高效液相色谱法
采用高效液相色谱法进行测定:色谱柱为C18柱(4.6 mm×250 mm,5 μm),流动相采用甲醇-0.05 mol/L磷酸二氢钾溶液(10∶90,V/V),流速1.0 mL/min,检测波长258 nm,柱温30 ℃,进样量20 μL。
1.3.3.2 cAMP标准曲线绘制
取cAMP的对照品适量,精密称定,加超纯水配制成1.00 mg/mL的混合储备液,于4 ℃保存;使用时用超纯水稀释,配制成cAMP质量浓度为0.01、1.00、10.00、50.00、100.00、500.00、1 000.00 μg/mL的混合对照品溶液。
1.3.3.3 样品cAMP提取量的测定
将cAMP提取液定容到50 mL后,经0.45 μm滤膜过滤,再用微量进样器吸取20 μL注入高效液相色谱仪,将色谱图积分后记录峰面积,外标法计算,得样品cAMP提取量。cAMP提取量计算见下式:
1.3.4 单因素试验
在前期查阅文献及预实验的基础上,选取对cAMP提取量影响较大的因素如酶添加量、酶解温度、酶解时间、微波功率等进行单因素试验。单因素试验对应的固定条件为酶添加量1.0%、酶解温度45 ℃、酶解时间30 min、微波功率400 W,实验重复3 次。各因素与水平见表1。
表1 单因素试验因素与水平
Table 1 Levels of independent variables used in one-factor-at-a-time design

1.3.5 响应面试验
通过前期实验及单因素试验结果,确定在pH 5、液料比10∶1(mL/g)及搅拌速率300 r/min的条件下,研究酶添加量、酶解温度、酶解时间和微波功率等因素对cAMP提取量的影响。根据Box-Behnken试验原理进行四因素三水平的响应面分析。
1.3.6 cAMP抗疲劳实验
1.3.6.1 小鼠实验条件和分组
参照郑飞[23]方法:本实验供试小鼠饲喂条件为温度(20±2)℃、相对湿度(50±5)%,采食和饮水均采用自由给予形式。通过基础饲料喂养供试小鼠(50 只)1 周后以体质量为标准分成5 组,具体见表2。
表2 实验分组及灌胃剂量
Table 2 Animal grouping and administration

注:灌胃剂量以每天每千克体质量小鼠的给药量计。
1.3.6.2 力竭游泳实验
本实验最后给药30 min后,小鼠尾部负重5%铅丝,将供试小鼠分别置于恒温水池箱(水深20~30 cm、水温24~26 ℃)内进行力竭游泳实验。供试小鼠放入后即刻计时,同时观察小鼠情况并使小鼠始终处于运动状态。秒表记录小鼠自开始到沉于水下10 s后无法浮出水面的时间即为力竭游泳时间。
本实验数据均以 ±s(n=3)表示,通过DPS V7.05数据处理软件进行方差分析,多重比较采用LSD法,P<0.05表示差异显著;响应面采用Design-Expert 7.1.6软件对数据进行多元回归分析并建立多元回归方程。
按照1.3.3.1节色谱条件,将处理后的标准品溶液经0.45 μm滤膜过滤后自动进样,标准品和样品色谱图如图1所示。标准品cAMP在1.0~50.0 μg/mL质量浓度范围内峰面积与样品含量呈线性关系,回归方程为y=0.557 5x+0.637 5,回归系数R2为0.999 3,回归性较好。

图1 cAMP标准品(A)和红枣提取样品(B)的液相色谱图
Fig. 1 HPLC chromatograms of cAMP reference standard and cAMP extracted from Chinese jujube

图2 纤维素酶、半纤维素酶、果胶酶及其复配后对新疆红枣中cAMP提取量的影响
Fig. 2 Effects of cellulase, hemicellulase, pectinase and their mixture on the yield of cAMP
微波辅助酶法是通过物理机械作用与酶解技术相结合破坏植物细胞壁,从而使细胞中活性成分释放出来达到其含量增加的目的[18-19]。国内外研究表明,通过采用纤维素酶、半纤维酶、果胶酶等生物酶制剂破坏细胞壁结构,可提高红枣中cAMP的提取量,在酶直接辅助提取cAMP的工艺中,生物酶的选择是影响cAMP得率的关键因素[24]。本研究选用纤维素酶、半纤维素酶、果胶酶在酶添加量1.0%、酶解温度45 ℃、酶解时间30 min、微波功率400 W的条件下进行新疆红枣中cAMP提取实验。由图2可知,与对照组(未添加酶制剂)相比,3 个酶单独处理均可显著提高新疆红枣中cAMP的提取量(P<0.05),但是3 种酶复合(纤维素酶-半纤维素酶-果胶酶质量比1∶1∶1)处理新疆红枣中cAMP的提取量较高,且与其他各组相比较,均具有显著性差异(P<0.05),因此选择3 种酶的复合配比进行后续优化试验。

图3 单因素试验对新疆红枣中cAMP提取量的影响
Fig. 3 Effect of various variables on the yield of cAMP
由图3可知,随着酶添加量的不断增加,cAMP提取量呈现先上升随后降低的趋势,是因为酶添加量的增加提高了酶与底物的结合能力,加快了反应速率,从而使红枣cAMP提取量增加;当达到临界点2%时,此时反应速率已达到最大;酶添加量1.5%和2%两组处理相比无显著性差异(P>0.05),1.5%和2%酶添加量与其他3 组相比,差异显著(P<0.05),因此综合统计学结果和成本考虑,确定酶添加量为1.5%;随着酶解温度的提高,cAMP提取量呈现先升高后下降的趋势。50 ℃后cAMP提取量下降是因为温度高于临界温度后会抑制酶的活性,降低反应速率,导致红枣cAMP提取量降低;统计学结果显示温度在50 ℃和60 ℃两组相比,差异不显著(P>0.05),与其他组相比,差异显著(P<0.05),因此选择温度为50 ℃。综合实验结果及成本考虑,同理分析酶解时间和微波功率的单因素最佳水平为40 min和375 W。通过对单因素试验结果分析,确定各因素的最佳水平分别为酶添加量1.5%、酶解温度50 ℃、酶解时间40 min、微波功率375 W进行后续响应面试验。
2.4.1 响应面回归模型的建立与分析
在单因素试验的基础上,进行四因素三水平试验设计及分析(表3和表4)。分析结果表明cAMP提取量影响因素中一次项A、B、C和D均表现出显著水平,交互项仅AC、AD、BC、BD、CD表现出显著水平,而二次项均表现出了显著水平。因此建立多元二次回归方程:
Y=509.44+39.33A+29.21B-37.38C+24.89D+10.52AB-34.80AC-58.63AD+64.75BC-25.85BD-53.90CD-92.90A2-35.21B2-49.24C2-42.38D2
表3 响应面试验方案及结果
Table 3 Experimental design and results for response surface analysis
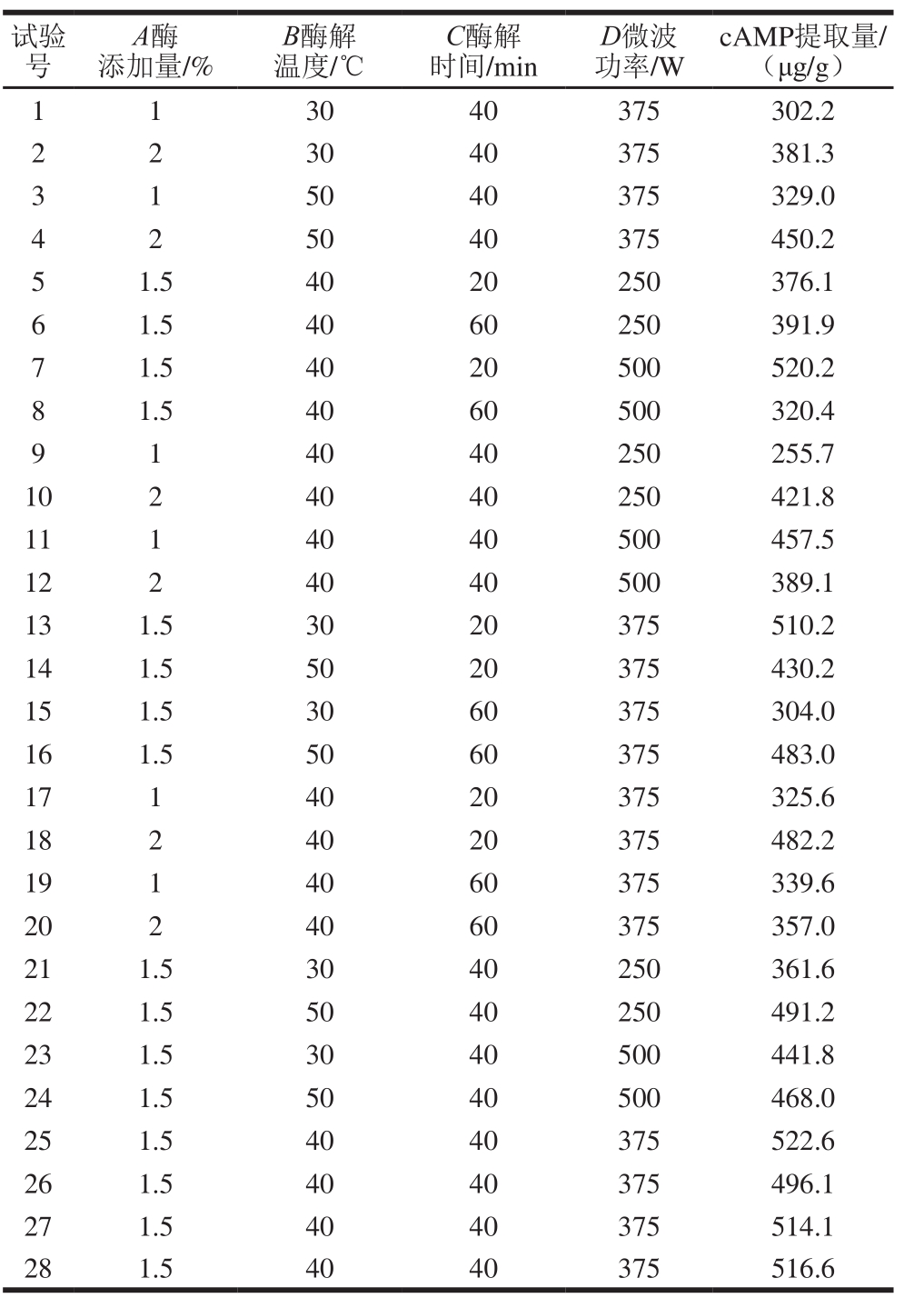
由表3可知,上述方程模型极显著(F=21.10,P<0.000 1)且失拟项不显著(F=5.33,P=0.060 5),说明该模型能较好地拟合实际值。对该方程进行显著性检验发现,其决定系数R2和校正决定系数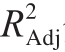 分别为0.954 7和0.909 5,均大于0.90,说明模型相关度很好。
分别为0.954 7和0.909 5,均大于0.90,说明模型相关度很好。
表4 新疆红枣cAMP提取量回归方程的方差分析
Table 4 Analysis of variance of regression equation with the yield of cAMP as response variable

通过固定其他3 个因素条件为“0”水平,对建立的预测新疆红枣中cAMP提取量回归模型进行降维分析,考察交互项对cAMP提取量的影响,经软件分析,可得响应面试验结果。由图4可知,回归模型存在稳定点特征值,表明稳定点为最大值点,等高线的形状可反映出交互作用影响大小,椭圆形表示两因素交互作用显著,而圆形则与之相反。通过等高线图可以直观看出AC、AD、BC、BD、CD两因素交互作用显著,与方差分析结果一致。各因素最佳水平选择在响应面设计的0点水平较为合理。过高或过低的各因素水平对红枣cAMP提取量均有不利的影响,单因素结果分析亦可得出相同结论。


图4 新疆红枣cAMP提取量的响应面和等高线图
Fig. 4 Response surface and contour plots showing the interactive effects of various variables on the yield of cAMP
2.4.2 验证实验结果
根据上述结果,微波辅助复配酶法提取红枣cAMP最佳工艺参数为复配酶添加量1.5%、酶解温度31.3 ℃、酶解时间20 min、微波功率500 W,理论计算提取量最大值为560.9 μg/g。在此条件下进行验证实验,红枣cAMP提取量为(551.6±18.4)μg/g,与模型预测值的相对误差为1.66%。表明实验所得回归方程的最大预测值与验证值非常接近,说明回归方程能较真实地反映各筛选因素的影响,建立的模型与实际情况比较吻合。
表5 各组小鼠 30 min内的力竭游泳时间比较(n=50)
Table 5 Effect of the cAMP on exhaustive swinging time in mice (n= 50)

注:不同小写字母表示差异显著(P<0.05)。
小鼠负重游泳实验是评价天然提取物抗疲劳作用的动物模型,若负重游泳时间越长,则表明测试物的抗疲劳效果越佳。力竭游泳时间可以充分反映动物机体的耐力,是目前评价疲劳状态较为客观的指标[13]。构建衰老模型目前主要采用老龄动物、D-半乳糖、臭氧损伤、去胸腺或其他药物等方法[25-30],其中由于D-半乳糖造模容易、实验周期较短已经被广泛用于动物机体的抗疲劳评价[31-32]。本实验通过D-半乳糖致小鼠衰老模型,评价cAMP的抗疲劳效果。由表5可知,各组动物在30 min内均无死亡,CN组和DC组差异显著(P<0.05),不同新疆红枣cAMP剂量组小鼠力竭游泳时间均高于DC组,150、300 mg/(kg·d)剂量的cAMP组与CN组差异不显著(P>0.05),450 mg/(kg·d)剂量的cAMP组比CN组提高了30.6%,且与CN组具有显著差异(P<0.05),结果说明新疆红枣cAMP可有效提高衰老小鼠的运动能力,延缓机体疲劳的出现。本实验中,新疆红枣cAMP各剂量组均可不同程度地延长D-半乳糖所致衰老模型小鼠的力竭游泳时间,表明新疆红枣cAMP可以提高小鼠的运动耐力,具有抗疲劳作用。
微波辅助水酶法是通过两者直接的协同作用破坏植物细胞壁达到其含量增加的目的。本研究采用Design-Expert软件通过Box-Behnken试验设计获得了微波辅助复配酶法提取新疆红枣中cAMP的最佳工艺条件为复配酶(纤维素酶-半纤维素酶-果胶酶质量比1∶1∶1)添加量1.5%、酶解温度31.3 ℃、酶解时间20 min、微波功率500 W,在此条件下新疆红枣cAMP提取量预测值达到最大值560.9 μg/g。
疲劳是主观上的一种不适感觉,但客观上会在同等条件下影响其完成原来所从事的正常活动或工作能力。抗疲劳就是通过一些方法手段来抵消这种疲劳的感觉。本研究通过D-半乳糖造模,对供试小鼠进行不同剂量的cAMP灌胃,同时以CN和DC组为对比进行实验。研究结果表明衰老小鼠力竭游泳时间与新疆红枣中cAMP剂量呈正相关,而且450 mg/(kg•d)剂量的cAMP组的小鼠力竭游泳时间显著高于CN组,比CN组提高了30.6%(P<0.05),该结论与刘庆春等[3]研究结果相一致。结果说明新疆红枣中cAMP可显著提高衰老小鼠的运动能力,延缓疲劳的发生。
参考文献:
[1] SIRIAMORNPUN S, WEERAPREEYAKUL N, BARUSRUX S.Bioactive compounds and health implications are better for green jujube fruit than for ripe fruit[J]. Journal of Functional Foods, 2015,12: 246-255. DOI:10.1016/j.jff.2014.11.016.
[2] ZOZIO S, SERVENT A, CAZAL G. Changes in antioxidant activity during the ripening of jujube (Ziziphus mauritiana Lamk)[J].Food Chemistry, 2015, 150(2): 448-456. DOI:10.1016/j.foodchem.2013.11.022.
[3] 刘庆春, 毕珣. 枣环磷酸腺苷提取液对小鼠抗疲劳作用的药效学研究[J]. 肠外与肠内营养, 2015, 22(1): 46-48. DOI:10.16151/j.1007-810x.2015.01.014.
[4] PATRICK O, BASTIAN H, BORIS F. G-protein coupled receptor 6 deficiency alters striatal dopamine and cAMP concentrations and reduces dyskinesia in a mouse model of Parkinson’s disease[J]. Experimental Neurology, 2014, 257: 1-9. DOI:10.1016/j.expneurol.2014.04.010.
[5] 赵爱玲, 李登科, 王永康. 枣树不同品种、发育时期和器官的cAMP和cGMP含量研究[J]. 园艺学报, 2009, 36(8): 1134-1139.DOI:10.16420/j.issn.0513-353x.2009.08.007.
[6] 杨芳媛, 赵智慧, 赵锦, 等. 枣中环磷酸腺苷的研究进展[J]. 塔里木大学学报, 2016, 28(3): 119-122.
[7] WANG W, ZHANG X, ZHENG J Q, et al. High glucose stimulates adipogenic and inhibits osteogenic differentiation in MG-63cells through cAMP/protein kinase A/extra cellular signal-regulated kinase pathway[J]. Molecular and Cellular Biochemistry, 2010, 338(1/2):115-122. DOI:10.1007/s11010-009-0344-6.
[8] KERFANT B G, ROSE R A, SUN H, et al. Phosphoinositide 3-kinase gamma regulates cardiac contractility by locally controlling cyclic adenosine monophosphate levels review[J]. Trends in Cardiovascular Medicine, 2006, 16(7): 250-256. DOI:10.1016/j.tcm.2006.04.006.
[9] SUBR A H, WALTER U, GAMBAR Y S. Differential regulation of platelet inhibition by cGMP and cAMP dependent protein kinases[J]. BMC Pharmacology and Toxicology, 2013, 14(S1): 69.DOI:10.1186/2050-6511-14-S1-P69.
[10] 樊君, 石奇, 尚红伟. 环磷酸腺苷的研究进展[J]. 中国现代应用药学,2005, 22(增刊1): 597-599.
[11] CLAIRE Y, ZHAO C Y, JOSEPH L, et al. Roles of phosphodiesterases in the regulation of the cardiac cyclic nucleotide cross-talk signaling network[J]. Journal of Molecular and Cellular Cardiology, 2016, 91:215-227. DOI:10.1016/j.yjmcc.2016.01.004.
[12] 周向辉, 王娜. 微波-超声波联合提取枣中环磷酸腺苷的工艺研究[J].食品科学, 2009, 30(18): 196-201.
[13] 史红梅, 尹卓容, 蒋文强. 高压液相色谱法测定金丝小枣环磷酸腺苷的含量[J]. 食品科学, 2006, 27(5): 216-218.
[14] 王立霞. 微波辅助提取和田玉枣环磷酸腺苷的工艺及与其他方法比较[J]. 食品与生物技术学报, 2014, 33(3): 293-300.
[15] CHANG Y M, DU J J. Extraction and separation of cAMP from Zizyphus jujuba fruit[J]. Acta Hortic, 2009, 840: 541-546.DOI:10.17660/ActaHortic.2009.840.77.
[16] 张明娟, 李薇, 庞晓明. 枣果中环磷酸腺苷(cAMP)的提取工艺及含量测定[J]. 食品与发酵工业, 2012, 38(5): 228-231.
[17] 蒋劢博, 王强, 李建贵, 等. 响应面法优化红枣中环磷酸腺苷(cAMP)超声提取工艺[J]. 中国食品学报, 2014, 14(1): 114-120.
[18] CHENG Z, SONG H, YANG Y, et al. Optimization of microwaveassisted enzymatic extraction of polysaccharides from the fruit of Schisandra chinensis Baill[J]. International Journal of Biological Macromolecules, 2015, 76(5): 161-168. DOI:10.1016/j.ijbiomac.2015.01.048.
[19] ZHANG G, HU M, HE L, et al. Optimization of microwave-assisted enzymatic extraction of polyphenols from waste peanut shells and evaluation of its antioxidant and antibacterial activities in vitro[J].Food and Bioproducts Processing, 2013, 91(2): 158-168. DOI:10.1016/j.fbp.2012.09.003.
[20] WU D, GAO T, YANG H, et al. Simultaneous microwave/ultrasonicassisted enzymatic extraction of antioxidant ingredients from Nitraria tangutorun Bobr. juice by-products[J]. Industrial Crops and Products,2015, 66(4): 229-238. DOI:10.1016/j.indcrop.2014.12.054.
[21] 于丽秀, 华小黎, 陈东生, 等. 微波辅助提取菝葜有效成分及其对钙调神经磷酸酶活性的作用[J]. 中国医院药学杂志, 2010, 30(9): 738-740.
[22] 张丽芝. 酶协同微波辅助提取红枣多糖的工艺优化[J]. 食品与机械,2016, 32(11): 145-147.
[23] 郑飞. 蓝莓多糖对衰老小鼠运动耐力及抗疲劳效果研究[J]. 食品科学,2014, 35(21): 249-252. DOI:10.7506/spkx1002-6630-201421049.
[24] 许牡丹, 邹继伟, 史芳. 超声波辅助酶法提取木枣环磷酸腺苷的工艺条件优化[J]. 食品科技, 2013, 38(7): 220-224. DOI:10.13684/j.cnki.spkj.2013.07.023.
[25] SUN Y, PAN D, GUO Y. Purif i cation of chicken breast protein hydrolysate and analysis of its antioxidant activity[J]. Food and Chemical Toxicology, 2012, 50: 3397-3404.
[26] CHEN X C, BAI J X, CAO J M, et al. Medium optimization for the production of cyclic adenosine 3’,5’-monophosphate by Microbacterium sp. no. 205 using response surface methodology[J]. Bioresource Technology, 2009, 100(2): 919-924. DOI:10.1016/j.biortech.2008.07.062.
[27] ZHAO C Y, GREENSTEIN J L, WINSLOW R L. Interaction between phosphodiesterases in the regulation of the cardiac β-adrenergic pathway[J]. Journal of Molecular and Cellular Cardiology, 2015, 88:29-38. DOI:10.1016/j.yjmcc.2015.09.011.
[28] LEE J, KIM H, HAN J, et al. Anti-fatigue effect of Myelophil in a chronic forced exercise mouse model[J]. European Journal of Pharmacology,2015, 764(5): 100-108. DOI:10.1016/j.ejphar.2015.06.055.
[29] 王郅媛, 王友升, 李丽萍. 抗衰老研究新模型-酵母细胞活性氧代谢研究进展[J]. 食品科学, 2012, 33(7): 354-358.
[30] 杨婷, 张冲, 陈清轩. 衰老机制研究进展[J]. 中国生物工程杂志,2005, 25(3): 6-11.
[31] 陈艳珍. 复合微量营养素对衰老雌性小鼠抗疲劳和抗氧化作用的研究[J]. 山东理工大学学报(自然科学版), 2009, 23(5): 1-4.
[32] 赵凡凡, 周玉枝, 高丽, 等. D-半乳糖致衰老大鼠模型的研究进展[J].药学学报, 2017, 52(3): 347-354.
Optimization of Microwave-Assisted Aqueous Enzymatic Extraction of Cyclic Adenosine 3’,5’-Monophosphate
(cAMP) from Chinese Jujube (Ziziphus jujuba Mill.) and Its Anti-Fatigue Effect
REN Yanrong1,2, ZHANG Zhongming3, XIE Yuejie1, XIONG Zhengwei1,2, WANG Zhongming1, WU Hongbin4,*
(1. College of Biological and Chemical Engineering, Chongqing University of Education, Chongqing 400067, China;2. Chongqing Collaborative Innovation Center for Functional Food, Chongqing University of Education, Chongqing 400067,China; 3. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 737100, China; 4. Institute of Agro-Food Science and Technology, Xinjiang Academy of Agricultural and Reclamation Sciences, Shihezi 832000, China)
Abstract:Response surface methodology was used to optimize the microwave-assisted aqueous enzymatic extraction of cyclic adenosine 3’,5’-monophosphate (cAMP) from Chinese jujube (Zizyphus jujuba Mill.) grown in Xinjiang. The antifatigue effect of the cAMP extracted was investigated. The optimal extraction conditions was found as follows: enzyme concentration 1.5% (a mixture of cellulase, hemicellulase and pectinase, 1:1:1 (m/m)), temperature 31.3 ℃, time 20 min and microwave power 500 W. Under these conditions, the yield of cAMP was 560.9 μg/g. The results showed that the cAMP could extend exhaustive swimming time and enhance swimming endurance in mice, suggesting good anti-fatigue effect.Therefore, cAMP holds great promise for its application in the food and pharmaceutical industry.
Keywords:Zizyphus jujuba; cyclic adenodsine 3’,5’-monophosphat (cAMP); microwave-assisted aqueous enzymatic extraction; swimming time
DOI:10.7506/spkx1002-6630-201802041
中图分类号:TS255
文献标志码:A
文章编号:1002-6630(2018)02-0260-07
引文格式:任彦荣, 张忠明, 谢跃杰, 等. 微波辅助水酶法优化红枣中环磷酸腺苷(cAMP)提取工艺及其抗疲劳作用[J]. 食品科学,2018, 39(2): 260-266.
DOI:10.7506/spkx1002-6630-201802041. http://www.spkx.net.cn
REN Yanrong, ZHANG Zhongming, XIE Yuejie, et al. Optimization of microwave-assisted aqueous enzymatic extraction of cyclic denosine 3’,5’-monophosphate (cAMP) from Chinese jujube (Ziziphus jujuba Mill.) and its anti-fatigue effect[J]. Food Science,2018, 39(2): 260-266. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802041. http://www.spkx.net.cn
收稿日期:2017-03-24
基金项目:新疆建设兵团工业科技攻关项目(2015AB030);重庆市五大功能区域创新创业团队建设项目(201618793)
第一作者简介:任彦荣(1980—),女,教授,博士,研究方向为天然产物分析。E-mail:cqueryr@126.com
*通信作者简介:吴洪斌(1980—),男,副研究员,硕士,研究方向为果蔬农产品加工。E-mail:woo2007@foxmail.com