
图1 8 种抗病毒化合物的结构图
Fig. 1 Chemical structures of eight antiviral compounds
张颖颖,李慧晨,吴彦超,李莹莹*
(中国肉类食品综合研究中心,北京 100068)
摘 要:建立同时测定鸡肉、猪肉、鸡肝和猪肝中阿比朵尔、金刚烷胺、金刚乙胺、泛昔洛韦、帕拉米韦、咪喹莫特、奥司他韦、拉米夫定8 种抗病毒药物残留的超高效液相色谱-串联质谱的检测方法。样品采用乙腈-0.1%甲酸溶液(9∶1,V/V)经一次性振荡提取,用MCX固相萃取柱净化,内标法定量。结果表明:8 种抗病毒药物的检出限均低于1.0 μg/kg,定量限均低于3.0 μg/kg,空白鸡肉、鸡肝、猪肉、猪肝中分别添加5.0、10.0 μg/kg和20.0 μg/kg,8 种抗病毒药物的回收率均在70%~120%之间。该方法基质干扰小、灵敏度高、回收率好,可用于日常动物性样品中抗病毒类药物的残留检测。
关键词:抗病毒类药物;超高效液相色谱-串联质谱;鸡肉;鸡肝;猪肉;猪肝
抗病毒类药物原是用于治疗人类流行性感冒的一类药物,但多次大型流感的爆发[1],如1997年中国香港爆发的H1N5流感;2013年中国内地发生的H7N9流感,其极高的畜禽发病率及死亡率均造成巨大的经济损失,因此养殖者便将抗病毒类药物添加至畜禽饲料中以降低发病率,甚至一些不法商贩为谋取不正当利益,避免“速成鸡”[2]生病死亡,也大量喂食抗病毒类药物。然而非法使用抗病毒类药物会造成动物体内药物残留,加大病毒的耐药性及变异的可能性,甚至部分残留的抗病毒类药物,如金刚烷胺、金刚乙胺,会损伤人体的生殖系统,并造成不可恢复性的损伤。因此多个国家均将抗病毒类药物列为禁用药物,2005年我国农业部发布了560号公告,明文规定养殖业禁止使用金刚烷胺、利巴韦林类抗病毒药物[3],2006年美国食品药品监督管理局也明文规定禁止将人类抗病毒类药物用于禽类饲养过程中[4]。
目前,有关抗病毒类药物残留的检测方法的报道较多[5],有酶联免疫法[6-7]、气相色谱法[8-9]、气相色谱-质谱法[10]、液相色谱法[11-13]、液相色谱-串联质谱法[14-15]、毛细管电泳法[16-17]、分光光度法[18-19]、近红外法[20-21]、电化学法[22]以及芯片法等。但由于液相色谱-串联质谱所采用的多重反应监测模式定性及定量的高准确性、高分辨率、高通量、高灵敏度等优点,可用于各种基质样品的检测,如鸡蛋[23-25]、鸡肉[26-29]、鸡肝[30]、猪肉[31],已成为当前用于检测抗病毒类药物残留的主要方法。本实验通过对相关标准及国内外文献进行分析总结,建立一种基质干扰小、分析速度快,可用于测定鸡肉、猪肉、鸡肝和猪肝中阿比朵尔、金刚烷胺、金刚乙胺、泛昔洛韦、帕拉米韦、咪喹莫特、奥司他韦、拉米夫定8 种抗病毒药物残留的超高效液相色谱-串联质谱法。8 种抗病毒药物分子结构式如图1所示。

图1 8 种抗病毒化合物的结构图
Fig. 1 Chemical structures of eight antiviral compounds
阿比朵尔、金刚烷胺、金刚乙胺、泛昔洛韦、帕拉米韦、咪喹莫特、奥司他韦、拉米夫定、阿比朵尔-D6、金刚烷胺-D6、奥司他韦-D3、拉米夫定-13C 德国Dr.Ehrenstorfer公司;乙腈(色谱纯) 德国Merck公司;乙腈、甲醇、乙酸、氨水、三氯乙酸、盐酸、甲酸(均为分析纯) 国药集团化学试剂(上海)有限公司;MCX固相萃取柱 美国Waters公司。
TSQ超高效液相色谱-串联四极杆质谱仪(配有电喷雾离子源及Xcalibur 2.2与LCquan 2.8数据处理系统)美国Thermo公司;HENGAO T&D固相萃取装置 美国Agilent公司;CR21N高速冷冻离心机 日本Hitachi公司;HGC-24A氮吹仪 天津市恒奥科技发展有限公司。
1.3.1 标准溶液的配制
分别准确称取阿比朵尔、金刚烷胺、金刚乙胺、泛昔洛韦、帕拉米韦、咪喹莫特、奥司他韦、拉米夫定8 种标准品,用乙腈配制成100 μg/mL的标准溶液(根据溶解度可适当加水溶解),于4 ℃的冰箱中冷藏保存。使用时依次用水稀释至相应质量浓度。
分别准确称取阿比朵尔-D6、金刚烷胺-D6、奥司他韦-D3、拉米夫定-13C标准品,用乙腈配制为100 μg/mL的标准溶液(根据溶解度可适当加水溶解),于4 ℃的冰箱中冷藏保存。使用时用水稀释至100 μg/L。
1.3.2 样品制备
准确称取2 g样品,加入100 μL 100 μg/L的内标溶液,加入5 mL乙腈-0.1%甲酸(9∶1,V/V)提取溶液,用玻璃棒搅匀后,继续加入5 mL乙腈-0.1%甲酸溶液,振荡1 h,取出,4 ℃、12 000 r/min离心5 min;取5 mL上清液,加入5 mL水,混匀,通过已分别用甲醇、0.1%甲酸-水活化平衡后的MCX固相萃取柱,再分别用3 mL 2%甲酸溶液、甲醇淋洗MCX萃取柱,而后用氨水-甲醇溶液(5∶95,V/V)洗脱,洗脱溶液在50 ℃条件下氮气吹干,用1 mL 0.1%甲酸-甲醇(9∶1,V/V)溶液溶解残渣。
1.3.3 仪器条件
1.3.3.1 液相色谱条件
色谱柱:T h e r m o H y p e r s i l G o l d C18(100 mm×2.1 mm,1.9 μm);柱温30 ℃;进样体积10 μL;流动相A:0.1%甲酸溶液;流动相B:乙腈;二元梯度洗脱程序见表1。
表1 二元梯度洗脱程序
Table 1 Binary gradient elution program

1.3.3.2 质谱条件
电喷雾离子源:正离子模式;毛细管电压3 000 V;毛细管温度350 ℃;雾化温度350 ℃;辅助气压力30 arb;鞘气压力10 arb;质谱多反应监测采集参数见表2。
表2 抗病毒类药物的保留时间及质谱参数
Table 2 HPLC retention times and mass spectral parameters for antiviral drugs
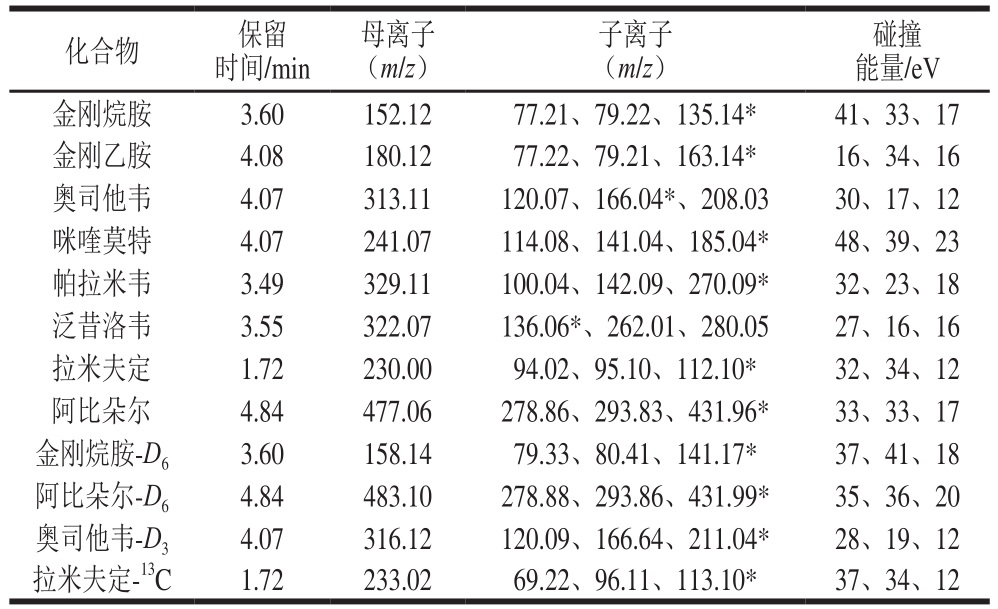
注:*.定量离子。
由图1可知,该类化合物均含有胺基基团,在质谱检测过程中,该类化合物易结合H质子,带正电荷,因此,在进行质谱扫描过程中采用正离子扫描模式。通过优化离子源参数,确认母离子峰,并进行二级质谱分析,确保每个母离子均有3 个子离子,同时监测多个子离子能够减少基质造成的干扰,避免假阳性结果的发生,更能保证样品的准确性,最终为8 种抗病毒药物选取合适的多重反应监测离子对信息。
正离子扫描模式下,在液相色谱流动相中加入少量的甲酸会增强待测化合物的响应强度,这主要是由于酸提供了更多的H+。因此本实验选用0.1%甲酸溶液与乙腈为流动相,通过合适的梯度洗脱程序,从而保证各个化合物有良好的峰形、分离度及响应强度。
2.2.1 提取试剂的选择
8 种化合物中均含有极性基团,根据相似相溶原理,此类化合物更易溶解于极性有机溶剂中,因此本实验考察了乙腈与甲醇的提取效果,相比甲醇而言,乙腈沉淀蛋白脂肪的效果更强,离心后的溶液更为干净,这为后续净化步骤提供了便利;此外,化合物中所含的胺基基团,在酸性条件下带正电荷易溶于水,因此本实验分别考察了三氯乙酸、甲酸、盐酸及其与不同比例的乙腈的提取效果。
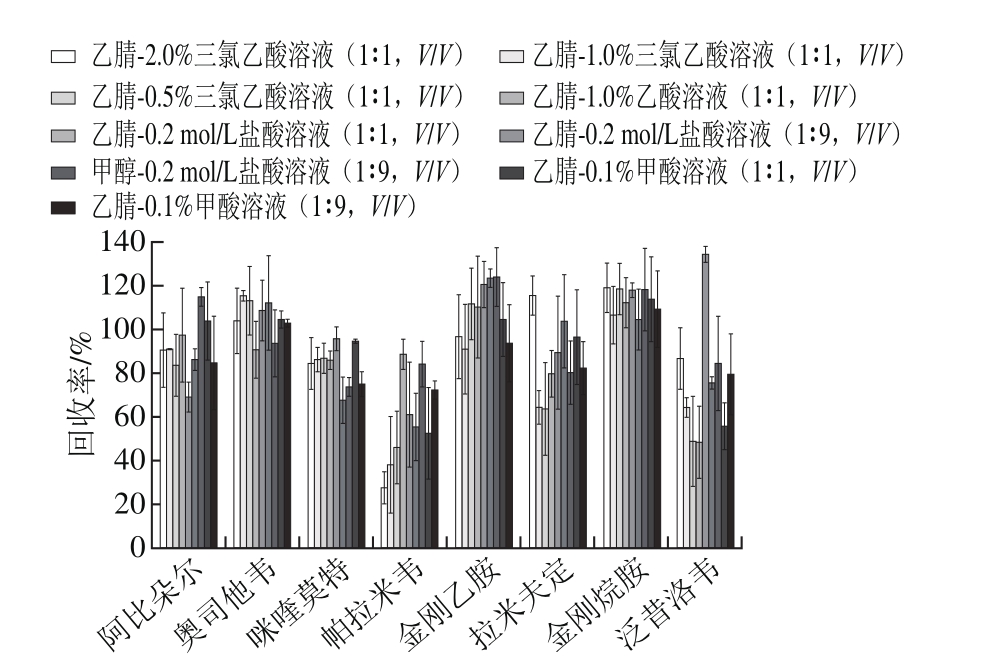
图2 8 种抗病毒药物在不同提取溶剂条件下回收率
Fig. 2 Recoveries of eight antiviral drugs extracted using different solvent systems
如图2所示,提取溶液为乙腈-0.1%甲酸(1∶9,V/V)溶液时,8 种抗病毒药物的回收率均在70%~110%之间,并不存在过高或过低的回收现象,因此本方法最终以乙腈-0.1%甲酸(1∶9,V/V)为提取溶液。
2.2.2 净化方法的优化
由于8 种抗病毒药物均含有胺基基团,在酸性条件下带正电荷,可在阳离子交换固相萃取柱中进行阳离子交换作用,并吸附至固相萃取柱中,进而与中性杂质分离,从而使样品得到净化,因此本方法选用MCX混合型阳离子交换固相萃取柱对样品进行净化。根据MCX柱的原理及化合物的相关结构信息,对淋洗溶剂、洗脱溶剂及定容溶剂分别进行了考察,以8 种抗病毒类化合物的回收率为参数,最终选取最佳条件,结果如表3所示。
表3 抗病毒类药物在不同操作条件下回收率
Table 3 Comparison of the recoveries of eight antiviral drugs using different operating conditions
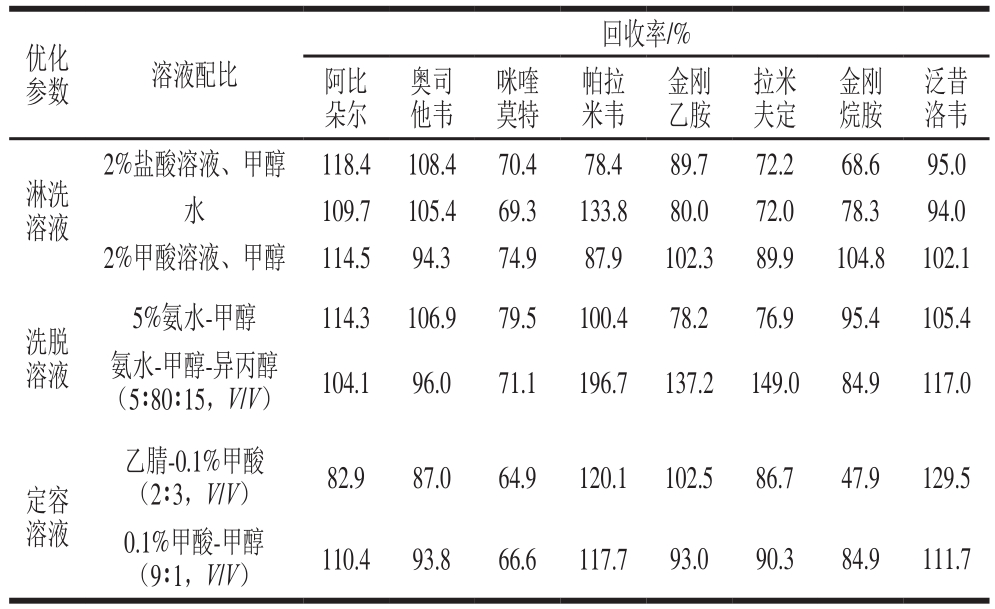
如表3所示,淋洗溶液为2%甲酸、甲醇时,各化合物的回收率最为适宜。而仅通过水进行淋洗时,并不能完全将MCX柱上所吸附的其他杂质洗脱下来,最终所得到的样品溶液较为混浊,影响后续实验;先用2%甲酸溶液淋洗,可使所测定的含碱性基团的化合物与MCX柱的结合更为牢固,然后再用甲醇淋洗,可将中性杂质,如脂肪、蛋白等,洗脱至废液,进而净化样品。对比洗脱溶液,发现5%氨水-甲醇溶液对8 种化合物的洗脱效果更好,并且加入异丙醇后,由于黏度增大,在后续氮吹过程中所消耗的时间更长,降低了实验速度。由于8 种抗病毒类药物在质谱检测中采用的是正模式,因此定容溶液中添加适量的有机酸溶液会增加化合物的响应值,对比上述2 种定容溶剂,最终选择0.1%甲酸-甲醇(9∶1,V/V)为定容溶液。
本实验拟测定动物性食品中8 种抗病毒类药物,为保证测量结果的准确性,采用同位素内标法进行定量。其中,金刚烷胺、拉米夫定、奥司他韦、阿比朵尔4 种化合物可分别用自身的同位素内标金刚烷胺-D6、拉米夫定-13C、奥司他韦-D3、阿比朵尔-D6进行定量。而对于泛昔洛韦、咪喹莫特、金刚乙胺及帕拉米韦则需要进实验操作及数据处理,根据回收率等条件,对上述4 种内标进行选择以保证定量结果的准确性。如图3所示,咪喹莫特、泛昔洛韦在使用奥司他韦-D3为内标进行定量时回收率最佳,金刚烷胺、帕拉米韦在使用金刚烷胺-D6作为内标定量时回收率最佳,因此咪喹莫特、泛昔洛韦以奥司他韦-D3作为内标,帕拉米韦、金刚乙胺以金刚烷胺-D6作为内标。

图3 4 种抗病毒类药物在不同内标条件下回收率
Fig. 3 Comparison of the recoveries of four antiviral drugs using different internal standard compounds
2.4.1 线性范围及检出限结果
8 种抗病毒类药物的质量浓度为1~50 μg/L,采用内标法,以待测物的质量浓度作为横坐标,以待测物定量离子的峰面积与内标定量离子的峰面积之比作为纵坐标,绘制标准曲线;此外,在空白鸡肉、鸡肝、猪肝、猪肉样品中加入8 种抗病毒类药物的标准溶液,经过提取和净化后,进行仪器检测,以3 倍信噪比为检出限,以10 倍信噪比为定量限。8 种化合物的线性方程、相关系数及检出限、定量限见表4。目前,我国行业标准SN/T 4253—2015《出口动物组织中抗病毒类药物残留量的测定 液相色谱-质谱/质谱法》[32]中对抗病毒类药物的检测低限为1.0 µg/kg,《食药监食监三便函[2014] 73号 动物源性食品中金刚烷胺的检测》中对金刚烷胺的检测低限为5.0 µg/kg,因此,本实验建立的8 种抗病毒类药物方法能够符合国内检测的要求。
表4 方法的线性方程及灵敏度
Table 4 Linearity and sensitivity of the developed method

2.4.2 回收率及精密度结果
表5 空白鸡肉、鸡肝、猪肉和猪肝中8 种药物的加标回收率和精密度(n=6)
Table 5 Recoveries and relative standard deviation (RSD) of the eight drugs in blank chicken meat, pork meat, chicken liver and pork liver (n= 6)
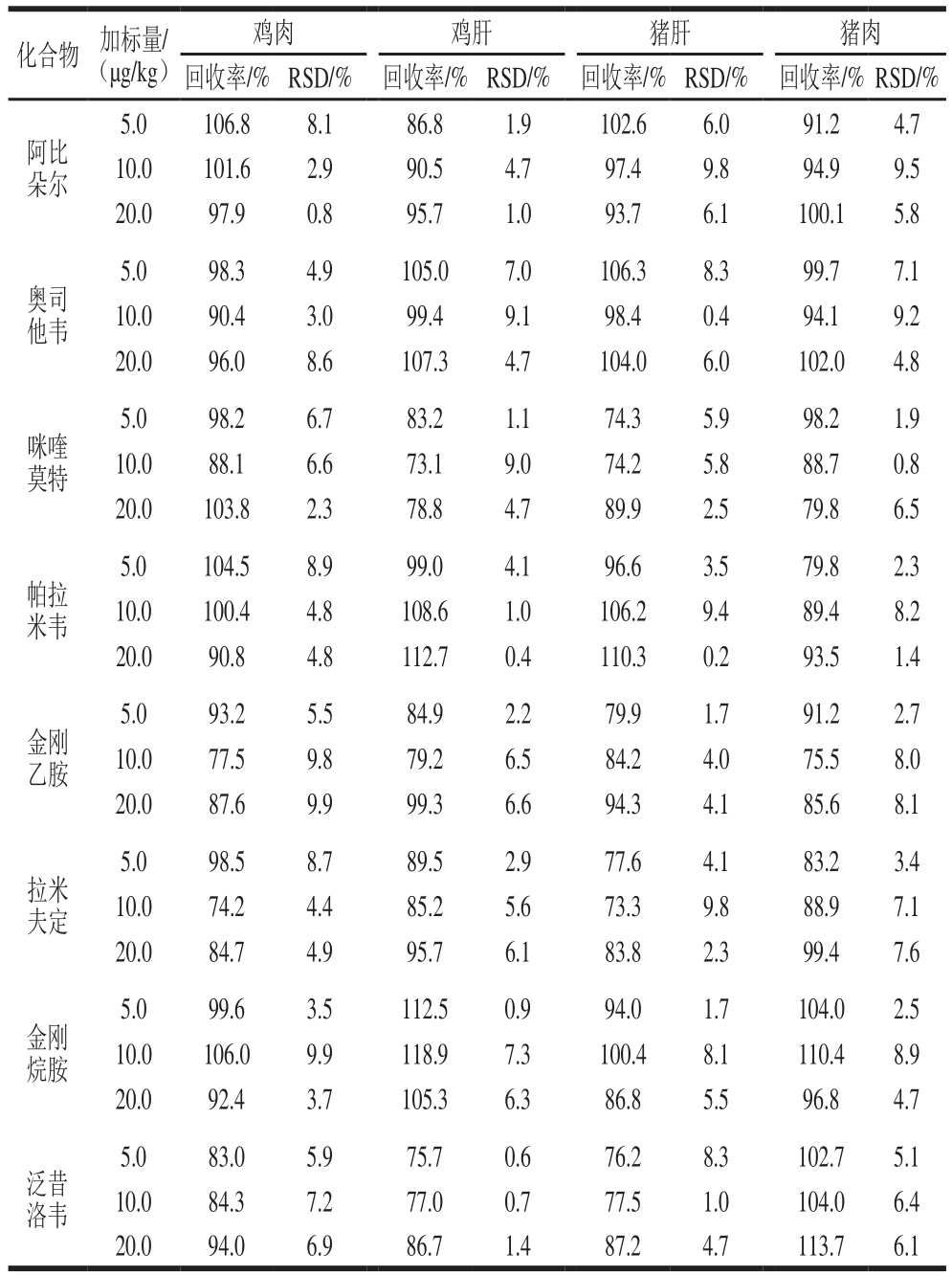
分别在空白鸡肉、鸡肝、猪肉、猪肝中添加5.0、10.0 μg/kg和20.0 μg/kg的混合标准溶液,每个添加量分别做6 个平行,进行回收率实验。如表5所示,8 种抗病毒药物的回收率在70%~120%之间,相对标准偏差(relative standard deviation,RSD)均小于10%,其精密度和回收率均符合残留分析方法的要求。空白鸡肉样品中添加10.0 μg/kg标准溶液质谱图,如图4所示。



图4 空白鸡肉中添加10.0 μg/kg混合标准溶液及内标的多重反应监测图谱
Fig. 4 Multiple reaction monitoring mass spectra of blank chicken samples spiked with mixed standard solution and internal standards at 10.0 μg/kg
根据本实验建立的前处理方法,对实验室留存的10 份鸡肉、7 份鸡肝、5 份猪肉和5 份猪肝样品进行检测,其中4 份鸡肝检出金刚烷胺残留,其含量分别为6.2、40.3、5.7 μg/kg和32.5 μg/kg。其他化合物均未检出。
本方法建立了鸡肉、鸡肝、猪肉、猪肝中阿比朵尔、金刚烷胺、金刚乙胺、泛昔洛韦、帕拉米韦、咪喹莫特、奥司他韦、拉米夫定8 种抗病毒类药物残留的超高效液相色谱-串联质谱的检测方法。该方法采用乙腈-0.1%甲酸溶液(9∶1,V/V)一次性振荡提取,用MCX固相萃取柱净化,整个样品运行时间为7 min,简便快速。该方法采用内标法定量,空白鸡肉、鸡肝、猪肉、猪肝中添加量为5.0、10.0、20.0 μg/kg,8 种抗病毒药物的平均回收率为70%~120%,总体RSD小于10%。该方法操作简便,前处理干净,基质干扰少,回收率高,重复性好,满足国内外相关法规的要求,适合大批量样品的监测分析。
参考文献:
[1] 艾美. 禽流感疫情大事年表[J]. 生命与危害, 2015(3): 13.
[2] YUN H, CUI F, YAN H, et al. Determination of ribavirin and amantadine in chicken by ultra performance liquid chromatographytandem mass spectrometry[J]. Chinese Journal of Chromatography,2013, 31(8): 724-728. DOI:10.3724/SP.J.1123.2013.01023.
[3] 农业部. 兽药地方标准废止目录: 560号公告[EB/OL]. (2005-11-01) [2005-11-01]. http://www.moa.gov.cn/zwllm/tzgg/gg/200511/t20051117_496523.htm.
[4] FDA prohibits use of antiviral drugs in poultry to help keep drugs effective for humans[EB/OL]. [2009-06-l8]. http://www.fda.Gov/NewsEvents/Newsroom/Press Announcements/2006/ucml08620.htm.
[5] 乔柯. 食品中抗病毒类药物残留检测方法研究进展[J]. 食品安全导刊, 2017(18): 112. DOI:10.16043/j.cnki.cfs.2017.18.086.
[6] 冯才伟, 黄健, 王兆芹, 等. 检测动物组织中金刚烷胺残留的酶联免疫试剂盒的研制[J]. 畜牧与兽医, 2016, 48(11): 27-31.
[7] 蒋佳颖, 王一成, 杨孝朴, 等. 双抗体夹心ELISA法测定猪α-干扰素的浓度[J]. 浙江农业学报, 2015, 27(5): 740-745. DOI:10.3969/j.issn.1004-1524.2015.05.06.
[8] FARAJZADEH M A, NOURI N, NABIL A A A. Determination of amantadine in biological fluids using simultaneous derivatization and dispersive liquid-liquid microextraction followed by gas chromatography-flame ionization detection[J]. Journal of Chromatography B, 2013, 940(4): 142-149. DOI:10.1016/j.jchromb.2013.09.035.
[9] 楼永军, 陈爽, 陶巧凤. 毛细管柱气相色谱法测定盐酸金刚烷胺有关物质[J]. 药物分析杂志, 2011, 31(3): 493-495.
[10] HEROLD D A, ANONICK P K, KNTER M, et al. Measurement of rimantadine in plasma by capillary gas chromatography/mass spectrometry with a deuterium-labeled internal standard[J]. Clinical Chemistry, 1988, 34(8): 1597-1599.
[11] HAGGAG R S, BELAL S F, HEWALA I I, et al. Stability-indicating HPLC-DAD determination of ribavirin in capsules and plasma[J].Journal of Chromatographic Science, 2014, 52(6): 493-500.DOI:10.1093/chromsci/bmt067.
[12] DAO Y J, JIAO Z, ZHONG M K. Simultaneous determination of aciclovir, ganciclovir, and penciclovir in human plasma by highperformance liquid chromatography with fluorescence detection[J].Journal of Chromatography B, 2008, 867(2): 270-276. DOI:10.1016/j.jchromb.2008.04.022.
[13] JING S J, LI Q L, JIANG Y. A new simultaneous derivatization and microextration method for the determination of memantine hydrochloride in human plasma[J]. Journal of Chromatography B,2016, 1008: 26-31. DOI:10.1016/j.jchromb.2015. 09.016.
[14] 杨旭, 刘正才, 杨方, 等. 固相萃取UPLC-MS/MS法同时检测鸡肉中8 种抗病毒药物的残留量[J]. 药物分析杂志, 2016, 36(3): 513-521.DOI:10.16155/j.0254-1793.2016.03.19.
[15] CHAN D, TARBIN J, SHARMAN M, et al. Screening method for the analysis of antiviral drugs in poultry tissues using zwitterionic hydrophilic interaction liquid chromatography/tandem mass spectrometry[J]. Analytica Chimica Acta, 2011, 700(1): 194-200.DOI:10.1016/j.aca.2010.11.015.
[16] REICHOVA N, PAZOUREK J, POLASKOVA P, et al.Electrophoretic behavior of adamantane derivatives possessing antiviral activity and their determination by capillary zone electrophoresis with indirect detection[J]. Electrophoresis, 2002,23(2): 259-262. DOI:10.1002/1522-2683(200202)23:2<259::AIDELPS259>3.0.CO;2-U.
[17] LABORDE-KUMMER E, GAUDIN K, CHARLES J, et al.Development and validation of a rapid capillary electrophoresis method for the determination of oseltamivir phosphate in Tamiflu and generic version[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009, 50(3): 544-546.
[18] RAUT C S, GHARGEA D S, DHABALEA P N, et al. Development and validation of oseltamivir phosphate in fluvir by UV-spectrophotometer[J]. International Journal of Pharmtech Research,2010, 2(1): 363-366.
[19] MUSTAFA A A, ABDEL-FATTAH S A, TOUBAR S S, et al.Spectrophotometric determination of acyclovir and amantadine hydrochloride through metals complexation[J]. Journal of Analytical Chemistry, 2004, 59(1): 33-38. DOI:10.1023/B:JANC.0000011665.20059.4f.
[20] DOU Y, SUN Y, REN Y, et al. Simultaneous non-destructive determination of two components of combined paracetamol and amantadine hydrochloride in tablets and power by NIR spectroscopy and artificial networks[J]. Journal of Pharmaceutical and Biomedical Analysis, 2005, 37(3): 543-549. DOI:10.1046/j.1365-2222.1999.00519.x.
[21] TITOVA A V, ARZAMASTSEV A P, GRETSKII S V. Analysis of rimantadine hydrochloride by near-IR spectroscopy[J]. Pharmaceutical Chemistry Journal, 2009, 43(9): 534-537. DOI:10.1007/s11094-009-0344-6.
[22] JALALI F, MAGHOOLI R. Potentiometric determination of trace amounts of amantadine using a modified carbon-paste electrode[J].Analytical Science, 2009, 25(10): 1227-1230. DOI:10.2116/analsci.25.1227.
[23] 孙海新, 许娜, 张慧, 等. 鸡蛋中金刚烷胺、金刚乙胺、利巴韦林和吗啉胍多残留检测方法的研究[J]. 中国家禽, 2015, 37(23): 22-26.DOI:10.16372/j.issn.1004-6364.2015.23.005.
[24] TSURUOKA Y, NAKAJIMA T, HASHIMOTO T, et al.Determination of amantadine in poultry tissues and egg by LC-MS/MS[J]. Journal of the Food Hygienic Society of Japan, 2015, 56(3):83-87. DOI:10.3358/shokueishi.56.83.
[25] 尹晖, 孙雷, 毕言锋, 等. 鸡肉和鸡蛋中金刚烷胺与金刚乙胺残留检测UPLC-MS/MS法研究[J]. 中国兽药杂志, 2014, 48(6): 32-35.
[26] 常平平, 许春南, 张立新, 等. 鸡肉中金刚烷胺超高效液相色谱-电喷雾串联质谱检测方法的建立及阳性样品的制备[J]. 中国畜牧兽医,2015, 42(9): 2278-2285. DOI:10.16431/j.cnki.1671-7236.2015.09.009.
[27] 云环, 崔凤云, 严华, 等. 超高效液相色谱-串联质谱法测定鸡肉中的利巴韦林和金刚烷胺[J]. 色谱, 2013, 31(8): 724-728. DOI:10.3724/SP.J.1123.2013.01023.
[28] YAN H, LIU X, CUI F Y, et al. Determination of amantadine and rimantadine in chicken muscle by QuEChERS pretreatment method and UHPLC coupled with LTQ Orbitrap mass spectrometry[J].Journal of Chromatography B, 2013, 938(9): 8-13. DOI:10.1016/j.jchromb.2013.08.020.
[29] 魏秀丽, 高迎春, 陈玲, 等. 超高效液相-串联质谱法测定鸡肉组织中金刚烷胺残留[J]. 中国兽药杂志, 2013, 47(6): 53-55.
[30] 齐凯, 汤晓艳, 陶瑞, 等. 超高效液相色谱-串联质谱法检测鸡肉和鸡肝中抗病毒药物利巴韦林残留[J]. 食品科学, 2016, 37(20): 146-150.DOI:10.7506/spkx1002-6630-201620024.
[31] 陈慧华, 韦敏珏, 周炜, 等. 液相色谱-串联质谱法测定动物组织中金刚烷胺和金刚乙胺的残留量[J]. 质谱学报, 2013, 34(4): 226-232.DOI:10.7538/zpxb.2013.34.04.0226.
[32] 国家质量监督检验检疫局. 出口动物组织中抗病毒类药物残留量的测定 液相色谱-质谱/质谱法: SN/T 4253—2015[S]. 北京: 中国标准出版社, 2015.
Determination of Eight Antiviral Drug Residues in Animal-Derived Food by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
ZHANG Yingying, LI Huichen, WU Yanchao, LI Yingying*
(China Meet Food Research Center, Beijing 100068, China)
Abstract:An efficient ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method was established for the simultaneous analysis of residues of 8 antiviral drugs (arbidol, amantadine, rimantadine, famciclovir,peramivir, imiquimod, oseltamivir, and lamivudine) in chicken meat and liver and pork meat and liver. Samples were extracted with 1% formic acid-acetonitrile, and the extract was subjected to chromatographic separation on MCX solidphase extraction column. Quantification of the analytes was achieved by UPLC-MS/MS using the internal standard method.The limit of detection (LOD) and limit of quantification (LOQ) of the method were lower than 1.0 and 3.0 μg/kg for all the antiviral drugs, respectively. The average recoveries of 8 antiviral drugs in blank chicken meat, pork meat, chicken liver and pork liver at spiked levels of 5.0, 10.0, and 20.0 μg/kg ranged from 70% to 120%, with relative standard deviation (RSD) of less than 10%. The method had the advantages of small matrix interference, high sensitivity and good recovery. Therefore, it can be used for the detection of antiviral drugs residues in animal-derived food.
Keywords:antiviral drugs; ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS);chicken meat; chicken liver; pork meat; pork liver
DOI:10.7506/spkx1002-6630-201802048
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2018)02-0303-07
引文格式:张颖颖, 李慧晨, 吴彦超, 等. 超高效液相色谱-串联质谱法测定动物性食品中8 种抗病毒类药物残留量[J]. 食品科学,2018, 39(2): 303-309.
DOI:10.7506/spkx1002-6630-201802048. http://www.spkx.net.cn
ZHANG Yingying, LI Huichen, WU Yanchao, et al. Determination of eight antiviral drug residues in animal-derived food by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2018, 39(2): 303-309. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802048. http://www.spkx.net.cn
收稿日期:2017-05-07
第一作者简介:张颖颖(1990—),女,工程师,硕士,研究方向为食品安全与检测。E-mail:yingying_sys@163.com
*通信作者简介:李莹莹(1984—),女,高级工程师,硕士,研究方向为食品安全与检测。E-mail:ying_sky@126.com