赵 莉,卢 凯,王小红,刘 睿*
(华中农业大学食品科技学院,环境食品学教育部重点实验室,湖北 武汉 430070)
摘 要:以花生红衣原花青素(peanut skin procyanidins,PSP)混合物经过凝胶色谱分离后得到的第4个级分PSP-4为原料,通过制备型高效液相色谱分离得到1 种原花青素,记为PSP-4-1,并利用液相色谱-四极杆飞行时间质谱及核磁共振技术鉴定其结构。分别比较其在化学模拟体系和炸薯条食品体系中对丙烯酰胺的抑制效果。结果表明:分离制备得到的PSP-4-1结构为表儿茶素-(2β→O→7,4β→8)-儿茶素(原花青素A1),在化学模拟体系和炸薯条食品体系中对丙烯酰胺的抑制均呈非线性的质量浓度-抑制率关系,在化学模拟体系中,原花青素A1添加质量浓度为0.05 mg/mL时抑制率可达(58.10±3.86)%,在炸薯条食品体系中原花青素A1添加质量浓度为0.03 mg/mL时抑制率可达(57.16±2.61)%。这一研究对于开发一种高效、经济的丙烯酰胺抑制剂具有指导意义。
关键词:花生红衣;原花青素A1;丙烯酰胺;抑制
热加工能赋予食品诱人的风味和色泽,是一种重要的食品加工技术,但随着检测技术的进步,越来越多的新生有害物质在热加工食品中被检测出来,主要有丙烯酰胺、呋喃、羟甲基糠醛[1]、多环芳烃和杂环胺。研究表明油炸薯条、薯片等富含淀粉质碳水化合物的高温加工食物中含有高含量的丙烯酰胺[1],因其具有致畸性、致癌性、神经系统毒性和生殖毒性而引起人们对热加工食品中包括丙烯酰胺在内的新生污染物的高度关注[2-3]。而如何筛选到高效的丙烯酰胺抑制剂添加到食品加工中从而减少食品热加工过程中丙烯酰胺的产生一直是人们关注的焦点。
已有研究表明,酸化剂、氨基酸和蛋白质均可作为丙烯酰胺抑制剂[4]。柠檬酸在土豆和谷物食品体系中对丙烯酰胺的抑制率为23%[5],二棕榈酰磷脂酰乙醇胺可以使天冬酰胺-葡萄糖模型中丙烯酰胺含量降低57%[6]。近年来,包括原花青素在内的天然产物对丙烯酰胺抑制作用的研究被广泛报道,如绿茶、肉桂、牛至等提取物能显著抑制油炸土豆片中丙烯酰胺的产生[7-8],香豆酸也具有类似的效果[9]。作为植物多酚中典型代表之一,黄烷醇及其衍生物对丙烯酰胺的抑制效果明显优于黄酮、异黄酮、黄酮醇、黄烷醇及其衍生物[10]。研究也证实儿茶素、表儿茶素这些黄烷醇类化合物抑制丙烯酰胺产生的效果优于槲皮素、没食子酸等[11],这表明黄烷醇类多酚——原花青素可能是一种更值得关注的丙烯酰胺抑制剂。已有研究发现葡萄籽原花青素在化学模拟体系中能显著抑制丙烯酰胺的形成并且在添加量为0.5%时,抑制率可达58.4%[12];苹果原花青素粗提物在低浓度条件下对丙烯酰胺有明显抑制作用[13];莲原花青素提取物在添加质量浓度为0.1 mg/mL、荔枝原花青素提取物在添加质量浓度为0.5 mg/mL时,丙烯酰胺的生成量均显著减少[14];花生红衣原花青素(peanut skin procyanidins,PSP)在化学模拟体系和食品体系中对丙烯酰胺均有良好的抑制效果[15]。然而上述有关原花青素抑制丙烯酰胺效果的研究主要是以原花青素粗提物或混合物为研究材料而展开,重点关注单一的低聚体原花青素对丙烯酰胺抑制效果却鲜有报道。
花生在中国是一种重要的油料作物,种植广泛,其种皮即花生红衣中含有丰富的原花青素,且以A型原花青素为主[16],但是利用率很低[17]。因此本研究以花生红衣为原料,制备并鉴定其中一种原花青素的结构,并探究该原花青素在天冬酰胺-葡萄糖化学模拟体系和炸薯条食品体系中对丙烯酰胺生成的抑制效果,以期为提高花生红衣的利用率以及开发一种高效抑制食品热加工过程中丙烯酰胺产生的食品添加剂提供一定的实验依据。
花生产于辽宁地区,品种为白沙;速冻薯条 山东绿润食品有限公司;花生油 山东鲁花集团有限公司。
原花青素A1(≥98%) 上海源叶生物科技有限公司;丙烯酰胺(≥99%) 美国Sigma-Aldrich试剂公司;甲醇、乙腈(色谱级) 美国Thermo Fisher Scientific公司;L-天冬酰胺一水合物(纯度99%)上海麦克林生化科技有限公司;D(+)-无水葡萄糖、甲醇、甲酸、亚铁氰化钾、硫酸锌、正己烷(均为分析纯) 国药集团化学试剂有限公司。
RE52CS-1旋转蒸发器 上海亚荣生化仪器厂;KQ-100DE型数控超声波清洗器 昆山市超声仪器有限公司;AL 204电子天平 梅特勒-托利多仪器(上海)有限公司;YZ-1531-8友田多功能油炸锅 广东容声电器股份有限公司;2695型高效液相色谱仪、Oasis HLB(200 mg,30 μm) 美国Waters公司;Hypercarb色谱柱(100 mm×4.6 mm,3 μm)、Hypercarb保护柱(10 mm×2 mm) 赛默飞世尔科技(中国)有限公司;核磁共振光谱仪(600 MHz) 德国Bruker仪器公司;Accurate-Mass Q-TOF LC/MS 6520液相色谱-四极杆飞行时间质谱联用仪、ZORBAX SB-C18色谱柱(250 mm×9.4 mm,5 μm) 美国安捷伦科技公司。
1.3.1 花生红衣中原花青素单体的分离制备
参考陈洋[18]的方法,以花生红衣为原料,采用70%乙醇溶液进行热提取90 min,通过AB-8大孔树脂以40%乙醇溶液进行纯化得到高纯度的原花青素混合物粉末,然后将粉末通过Toyopearl HW-40(S)凝胶色谱柱进行分离,得到用于分离原花青素纯品的目标级分记为PSP-4。采用制备型高效液相色谱分离PSP-4得到目标原花青素纯品记为PSP-4-1。
反相-高效液相色谱条件:ZORBAX SB-C18色谱柱(250 mm×9.4 mm,5 μm);流动相A为0.13%甲酸溶液,流动相B为乙腈;流速3 mL/min;进样量1 mL;检测波长280 nm;梯度洗脱:0 min,15% B;15 min,15% B;30 min,45% B;35 min,15% B。
1.3.2 PSP-4-1的液相色谱-四极杆飞行时间质谱及核磁分析
用甲醇分别配制质量浓度为1.0 mg/mL的目标原花青素纯品和原花青素A1对照品,分别通过0.22 μm滤膜过滤得到样液,待进样分析。
液相色谱-四极杆飞行时间质谱条件:Hypersil C18色谱柱(250 mm×4.6 mm,5 μm);流动相A为0.13%甲酸溶液,流动相B为乙腈;流速0.8 mL/min;进样量5 μL;检测波长280 nm;柱温25 ℃;梯度洗脱:0 min,15% B;15 min,15% B;30 min,45% B;5 min,15% B。
质谱条件:电喷雾离子源,负离子模式;毛细管电压3 500 V;干燥气温度350 ℃;干燥气流速8 L/min;喷雾压力45 psi;质量扫描范围m/z 100~900。
一维核磁共振采用Bruker Avance III HD 600 MHz核磁共振仪鉴定,氘代甲醇作溶剂。
1.3.3 丙烯酰胺的高效液相色谱测定
参考周婷[15]的分析方法。Hypercarb色谱柱(100 mm×4.6 mm,3 μm);Hypercarb保护柱(10 mm×2 mm);检测波长205 nm;进样量10 μL;柱温25 ℃;流速0.6 mL/min;流动相为超纯水;运行时间20 min。
1.3.4 丙烯酰胺标准曲线的绘制
将丙烯酰胺标准品配制成1.0 mg/mL标准溶液,采用稀释法分别用超纯水配制成0.5、1.0、5、10、20、30 μg/mL的标准液,采用1.3.3节方法,进行高效液相色谱分析。以丙烯酰胺标准品的质量浓度为横坐标(X),相应的峰面积为纵坐标(Y),绘制标准曲线,得到线性回归方程为y=131 935x+35 560(R2=0.999 9),线性范围在0.5~30 μg/mL之间。
1.3.5 模拟化学体系中丙烯酰胺抑制效果测定
参考周婷[15]的方法。称一定量的天冬酰胺与葡萄糖,溶解在超纯水中,制成丙烯酰胺反应液。用超纯水将原花青素A1配制成质量浓度分别为0.001、0.005、0.01、0.05、0.1、0.5 mg/mL的溶液。移取1.0 mL反应液加入10 mL耐高温的螺口试管中,实验组加入100 μL已配制好的不同质量浓度的原花青素A1溶液,空白对照添加超纯水。180 ℃油浴加热30 min,反应后加入超纯水定容至3 mL。取1.5 mL反应样液于离心管中,分别加入carrez I和carrez II,混匀;5 000 r/min离心15 min。吸取上清液通过固相萃取柱,加入3 mL超纯水洗脱,收集洗脱液过0.22 μm滤膜,通过1.3.3节建立的高效液相色谱法进行分析。通过1.3.4节绘制的标准曲线计算丙烯酰胺含量,并按下式计算原花青素A1对丙烯酰胺的抑制率。每组实验重复4 次。
式中:M0为空白对照组中丙烯酰胺质量/μg;Mn为实验组中丙烯酰胺质量/μg。
1.3.6 炸薯条食品体系中丙烯酰胺抑制效果测定
参考Qi Yajing等[19]方法,并稍作修改。温水洗去薯条上的油脂,沥干。采用超纯水分别配制0.01、0.03、0.1、0.3 mg/mL的原花青素A1浸渍液,将薯条浸渍在不同质量浓度原花青素A1浸渍液中15 min,为实验组;空白组浸渍在水溶液中;取出后将多余水分用滤纸擦干。薯条在175 ℃油炸6 min后,沥干薯条残余油分,并冷却。称取15 g炸薯条样品粉碎,用正己烷脱脂30 min,弃去油层;重复脱脂1 次。样品脱脂后,加入100 mL超纯水超声提取30 min;重复2 次,合并提取液。提取液在5 000 r/min离心20 min后,弃去正己烷层;再次向离心管中加入carrez I和carrez II,混匀;5 000 r/min离心20 min以沉淀蛋白。吸取处理后的提取液990 μL,并加入质量浓度为1 mg/mL的丙烯酰胺10 μL,通过固相萃取柱,加入3 mL超纯水洗脱,收集洗脱液过0.22 μm滤膜,通过1.3.3节建立的高效液相色谱法进行分析。计算同1.3.5节。
采用SPSS 17.0软件和Origin 9.1软件进行数据处理,结果以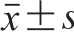 表示,采用Duncan’s多重比较法进行显著性检验。
表示,采用Duncan’s多重比较法进行显著性检验。

图1 以原花青素A1(a)为对照的PSP-4-1(b)的液相色谱-四极杆飞行时间质谱分析色谱图
Fig. 1 Q-TOF-LC/MS chromatogram of procyanidin A1(a) and PSP-4-1 (b)
如图1所示,PSP-4-1的保留时间为10.6 min,与原花青素A1的保留时间相对应。对图1中原花青素A1和PSP-4-1进行一级质谱和二级质谱分析,结果如图2所示。
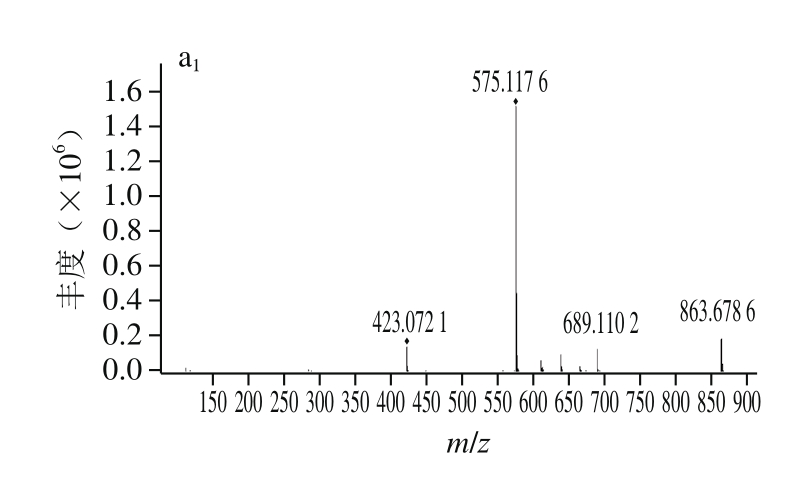

图2 原花青素A1(a)和PSP-4-1(b)的一级和二级质谱图
Fig. 2 Mass and MS2chromatogram of procyanidin A1(a) and PSP-4-1 (b)
由图2b1可以看出,负离子模式下,在保留时间为10.6 min时出现m/z 575.117 8的准分子离子峰,其是原花青素组成单元(儿茶素和/或表儿茶素)由C4~C8或者C4~C6相连并在C2和C7或C2与C5之间形成C—O—C键的原花青素二聚体(即A型原花青素)在电喷雾离子源负离子模式下失去1个H而形成的分子离子质荷比,相对分子质量为576.117 8,分子式为C30H24O12。A型聚合体原花青素常发生RDA(Retro-Diels-Alder)裂解,即原花青素的C环,失去1个中性的C8H8O3,因此出现了m/z 423.072 6碎片[20]。A型二聚体可能会发生聚合,m/z 863.678 9是两分子A型二聚体聚合后,在负离子模式下,失去1个H并发生quinone methide fission (QM) cleavage分子间断裂(m/z减少290)产生的[21]。由图2b2可知,PSP-4-1的二级碎片离子分别为m/z 539.099 0、407.078 1、285.040 8,其中m/z 539.099 0是分子离子脱去两分子的H2O(m/z减少36)产生的,m/z 407.078 1是分子离子发生RDA裂解(m/z减少152)同时再脱去一分子的H2O产生的,m/z 285.040 8是分子离子发生quinone methide fi ssion (QM) cleavage分子间断裂(m/z减少290)产生的。PSP-4-1中的分子离子断裂及碎片符合A型原花青素二聚体裂解规律[22-23]。综上,可以推断制备后得到的PSP-4-1为A型原花青素二聚体。且与图2a对比发现,其与原花青素A1的裂解信息基本一致,由此可初步推断制备得到的PSP-4-1可能为原花青素A1。但由于原花青素的同分异构体种类很多,因此通过核磁共振进一步确定其结构。
表1 化合物PSP-4-1的氢谱和碳谱数据
Table 11H and13C NMR data of PSP-4-1 (methanol-d4)

如表1所示,1H NMR氢谱数据显示δ 2.57(1H,dd,J=16.44 Hz,J=8.22 Hz),2.94(1H,dd,J=16.44 Hz,J=5.58 Hz)为典型的原花青素H4信号,并且将PSP-4-1的1H NMR和13C NMR数据与参考文献[20,24-25]对比,确定PSP-4-1为原花青素A1,其具体结构如图3所示。

图3 原花青素A1结构
Fig. 3 Structure of procyanidin A1
从图4可以看出,在天冬酰胺-葡萄糖化学体系中,原花青素A1对丙烯酰胺的生成有一定的抑制作用,这与Qi Yajing等[19]报道的结果一致。并且结果显示丙烯酰胺抑制率与原花青素A1存在一定的质量浓度效应关系,在0.001~0.05 mg/mL质量浓度范围内,随着质量浓度的增大,抑制率增加;并且当质量浓度在0.05 mg/mL时,原花青素A1对丙烯酰胺的抑制率达到最大,为(58.10±3.86)%;但当在0.05~0.5 mg/mL质量浓度范围内时,抑制率在逐渐下降。

图4 化学体系中丙烯酰胺的抑制率与原花青素A1添加质量浓度之间的关系
Fig. 4 Relationship between inhibition percentage of acrylamide formation and procyanidin A1concentration in chemical model system (n = 4)
在化学体系中多酚类化合物可能与羰基和二羰基反应从而抑制丙烯酰胺的形成,如表儿茶素能与化学模拟体系中还原糖的C2、C3、C4直接反应,即表儿茶素A环上的C6、C8通过亲电芳香取代与活性羰基形成共价键,从而抑制丙烯酰胺产生[26]。柚皮素结构中A环上的C6、C8与3-氧丙酰胺醛基结合,减少3-氨基丙酰胺(丙烯酰胺生成过程中重要的前体物质)的产生,从而抑制丙烯酰胺的形成[27]。原花青素在化学体系中可以显著抑制丙烯酰胺的形成,其抑制机制可能也与此相关。但关于原花青素抑制丙烯酰胺的作用机制现在尚未阐明,还需进一步研究。

图5 食品体系中丙烯酰胺的抑制率与原花青素A1添加质量浓度之间的关系
Fig. 5 Relationship between inhibition percentage of acrylamide formation and procyanidin A1concentration in French fries (n = 4)
从图5可以看出,在食品体系中,丙烯酰胺抑制率与原花青素A1也存在一定的质量浓度效应关系,在0.01~0.3 mg/mL质量浓度范围内,随着质量浓度的增加抑制率增加并达到最大值,当浓度进一步增大时,抑制率逐渐下降。并且当质量浓度在0.03 mg/mL时,原花青素A1对丙烯酰胺的抑制率达到最大,为(57.16±2.61)%,此质量浓度条件下对丙烯酰胺的抑制率与其他质量浓度条件下的抑制率比较,均存在显著性差异(P<0.05)。
相关研究发现,在化学体系中,P S P-4质量浓度在0.5 mg/mL时对丙烯酰胺抑制效果最佳,为(42.06±1.02)%[15],而在本研究中,PSP-4-1即原花青素A1在0.05 mg/mL时已达到最大抑制率(58.10±3.86)%。同样地,在食品体系中,PSP-4质量浓度也在0.5 mg/mL时对丙烯酰胺抑制效果最佳,为(46.13±1.56)%,而原花青素A1在0.03 mg/mL已达到最佳抑制率(57.16±2.61)%。即无论是在化学体系下,还是在食品体系下,原花青素A1对丙烯酰胺的抑制效果达到最佳时的质量浓度低于混合物PSP-4,但其最大抑制率却高于混合物PSP-4对丙烯酰胺的最大抑制率。这一结果说明经纯化分离得到的原花青素A1对于丙烯酰胺的抑制效果优于混合物,这对于开发高效的丙烯酰胺抑制剂及开发原花青素A1具有积极意义。
在食品体系中,油脂氧化能产生大量的丙烯醛,丙烯醛氧化形成丙烯酸可以与氨反应产生丙烯酰胺,而研究表明多酚,包括原花青素可以作为油脂氧化链式反应的断裂剂[28],可能会抑制油脂氧化产生丙烯醛,从而抑制丙烯酰胺的产生。由此可以推测原花青素A1抑制食品体系中丙烯酰胺的形成可能与其抑制油脂氧化有关。
大量研究表明多酚的浓度与其对丙烯酰胺的抑制效果间存在非线性量效关系,如竹叶抗氧化物在较低浓度条件下,对丙烯酰胺呈现正相关,而在较高浓度条件下,呈现负相关[29]。苹果原花青素在低浓度条件下对丙烯酰胺抑制效果明显高于高浓度苹果原花青素抑制效果[13]。Budryn等[30]探究绿咖啡提取物(主要成分是黄酮和酚酸)对食品体系中丙烯酰胺产生的影响效果时发现,低浓度的绿咖啡提取物抑制丙烯酰胺的形成,而在高浓度时却促进丙烯酰胺的形成。Qi Yajing等[19]研究发现不同聚合度的原花青素在食品体系中对丙烯酰胺的抑制效果均呈现先增大后减小的趋势。而在本研究中,不管是化学模拟体还是食品体系也得到了类似的结果。这可能是由于丙烯酰胺的形成和消除是一个动态的过程,在加热过程中,氧自由基可能诱导丙烯酰胺发生聚合,而多酚由于其结构中的酚羟基具有清除氧自由基的能力,影响了丙烯酰胺的聚合,导致部分多酚在较高浓度时对丙烯酰胺抑制效果下降的原因。
本研究以花生红衣为原料,采用凝胶色谱分离并结合反相高效液相色谱分离制备得到一种原花青素,通过与对照品比较、液相色谱-四极杆飞行时间质谱分析及核磁共振技术鉴定其结构为表儿茶素-(2β→O→7,4β→8)-儿茶素(原花青素A1)。
研究原花青素A1在化学模拟体系及炸薯条食品体系中对丙烯酰胺生成的影响,原花青素A1在2 种体系中对丙烯酰胺的形成均有抑制作用,并且在实验选定质量浓度范围内,原花青素A1对丙烯酰胺的抑制均呈现先增大后减小的趋势。在化学模拟体系中,当原花青素A1的质量浓度在0.05 mg/mL时,对丙烯酰胺的抑制率达到最大,为(58.10±3.86)%;食品体系中,其质量浓度在0.03 mg/mL时,对丙烯酰胺的抑制率达到最大,为(57.16±2.61)%。这一研究对于开发一种高效、经济的丙烯酰胺抑制剂具有指导意义。
参考文献:
[1] CAPUANO E, FOGLIANO V. Acrylamide and 5-hydroxymethylfurfural(HMF): a review on metabolism, toxicity, occurrence in food and mitigation strategies[J]. LWT-Food Science and Technology, 2011, 44(4):793-810. DOI:10.1016/j.lwt.2010.11.002.
[2] ZYZAK D V, SANDERS R A, STOJANOVIC M, et al. Acrylamide formation mechanism in heated foods[J]. Journal of Agricultural and Food Chemistry, 2003, 51(16): 4782-4787. DOI:10.1021/jf034180i.
[3] PELLE T O, OLSEN A, FRANDSEN H, et al. Acrylamide exposure and incidence of breast cancer among postmenopausal women in the Danish Diet, Cancer and Health study[J]. International Journal of Cancer Journal International Du Cancer, 2008, 122(9): 2094-2100.DOI:10.1002/ijc.23359.
[4] GOKMEN V, SENYUVA H Z. Acrylamide formation is prevented by divalent cations during the Maillard reaction[J]. Food Chemistry,2007, 103: 196-203. DOI:10.1016/j.foodchem.2006.08.011.
[5] 龙小涛, 何嘉锐, 叶雪丽, 等. 食品中丙烯酰胺的抑制方法研究进展[J]. 现代食品科技, 2012, 28(6): 687-690. DOI:10.13982/j.mfst.1673-9078.2012.06.030.
[6] COOK D J, TAYLOR A J. On-line MS/MS monitoring of acrylamide generation in potato- and cereal-based systems[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 8926-8933.DOI:10.1021/jf051585p.
[7] MORALES G, JIMENEZ M, GARCIA O, et al. Effect of natural extracts on the formation of acrylamide in fried potatoes[J]. LWTFood Science and Technology, 2014, 58(2): 587-593. DOI:10.1016/j.lwt.2014.03.034.
[8] CHENG J, CHEN X, ZHAO S, et al. Antioxidant-capacitybased models for the prediction of acrylamide reduction by flavonoids[J]. Food Chemistry, 2015, 168: 90-99. DOI:10.1016/j.foodchem.2014.07.008.
[9] ORAL R A, DOGAN M, SARIOGLU K. Effects of certain polyphenols and extracts on furans and acrylamide formation in model system, and total furans during storage[J]. Food Chemistry, 2014,142(1): 423-429. DOI:10.1016/j.foodchem.2013.07.077.
[10] 章宇. 生物黄酮抑制食品中丙烯酰胺形成的机理及其构效关系研究[D]. 杭州: 浙江大学, 2008.
[11] XU C M, YAGIZ Y, MARSHALL S, et al. Application of muscadine grape (Vitis rotundifolia Michx.) pomace extract to reduce carcinogenic acrymide[J]. Food Chemistry, 2015, 182: 200-208. DOI:10.1016/j.foodchem.2015.02.133.
[12] CORKE H, CAI Y Z, ZHU F, et al. Inhibitory effect and primary mechanism of proanthocyanidins from grape seeds against acrylamide formation in a Maillard reaction model system[J]. Scientific Bulletin,2014, 18: 207-210.
[13] CHENG K W, SHI J J, OU S Y, et al. Effects of fruit extracts on the formation of acrylamide in model reactions and fried potato crisps[J].Journal of Agricultural & Food Chemistry, 2010, 58(1): 309-312.DOI:10.1021/jf902529v.
[14] 周梦舟, 丁城, 关亚飞, 等. 原花青素抑制丙烯酰胺的动力学研究[J].食品科学, 2018, 39(3): 123-128. DOI:10.7506/spkx1002-6630-201803019.
[15] 周婷. 花生红衣低聚体原花青素对丙烯酰胺的抑制作用和协同作用研究[D]. 武汉: 华中农业大学, 2016.
[16] DUDEK M K, GLINSKI V B, DAVEY M H. Trimeric and tetrameric A-type procyanidins from peanut skins[J]. Natural Products, 2017,80(2): 415-426. DOI:10.1021/acs.jnatprod.6b00946.
[17] 张慧文, 许海燕, 马超美. 花生红衣研究进展[J]. 花生学报, 2015(1):53-59. DOI:10.14001/j.issn.1002-4093.2015.01.010.
[18] 陈洋. 花生红衣原花青素的分离鉴定及其对丙烯酰胺抑制作用的研究[D]. 武汉: 华中农业大学, 2014.
[19] QI Y J, ZHANG H, WU G C, et al. Mitigation effects of proanthocyanidins with different structures on acrylamide formation in chemical and fried potato crisp models[J]. Food Chemistry, 2018, 250:98-104. DOI:10.1016/j.foodchem.2018.01.012.
[20] 张慧文. 花生红衣原花青素化学成分、衍生物和生物活性研究[D].呼和浩特: 内蒙古农业大学, 2014.
[21] 陈洋, 王冰, 玉佳男, 等. RP-H PLC-ESI-M S/M S分离鉴定花生红衣原花青素A型和B型二聚体[J]. 食品科学, 2013, 34(23): 142-146.DOI:10.7506/spkx1002-6630-201323030.
[22] LI S, XIAO J, CHEN L, et al. Identification of A-series oligomeric procyanidins from pericarp of Litchi chinensis by FT-ICR-MS and LC-MS[J]. Food Chemistry, 2012, 135(1): 31-38. DOI:10.1016/j.foodchem.2012.04.039.
[23] CHIA Y H, GONG M L, HUAN Y L, et al. Characteristics of proanthocyanidins in leaves of Chamaecyparis obtusa var. formosana as strong α-glucosidase inhibitors[J]. Journal of the Science of Food and Agriculture, 2018, 98(10): 3806-3814. DOI:10.1002/jsfa.8894.
[24] ZHANG H W, YERIGUI, YANG Y, et al. Structures and antioxidant and intestinal disaccharidase inhibitory activities of A-type proanthocyanidins from peanut skin[J]. Journal of Agricultural and Food Chemistry, 2013, 61(37): 8814-8820. DOI:10.1021/jf402518k.
[25] GONG M L, HUAN Y L, CHIA Y H, et al. Structural characterization and bioactivity of proanthocyanidins from indigenous cinnamon(Cinnamomum osmophloeum)[J]. Journal of Agricultural and Food Chemistry, 2016, 96(14): 4749-4759. DOI:10.1002/jsfa.7802.
[26] LIU Y B, WANG P P, CHEN F, et al. Role of plant polyphenols in acrylamide formation and elimination[J]. Food Chemistry, 2015,186(1): 46-53. DOI:10.1016/j.foodchem.2015.03.122.
[27] CHENG K W, ZENG X, TANG Y S, et al. Inhibitory mechanism of naringenin against carcinogenic acrylamide formation and nonenzymatic browning in Maillard model reactions[J]. Chemical Research in Toxicology, 2009, 22(8): 1483-1489. DOI:10.1021/tx9001644.
[28] TICHONOV I, ROGINSKY V, PLISS E. Natural polyphenols as chain-breaking antioxidants during methyl linoleate peroxidation[J].European Journal of Lipid Science & Technology, 2010, 112(8): 887-893. DOI:10.1002/ejlt.200900282.
[29] ZHANG Y, YING T. Reduction of acrylamide and its kinetics by addition of antioxidant of bamboo leaves (AOB) and extract of green tea (EGT) in asparagine-glucose microwave heating system[J].Journal of Food Science, 2008, 73(2): C60-C66. DOI:10.1111/j.1750-3841.2007.00619.x.
[30] BUDRYN G, DOROTA Ż, NEBESNY E, et al. Inf l uence of addition of green tea and green coffee extracts on the properties of fi ne yeast pastry fried products[J]. Food Research International, 2013, 50(1):149-160. DOI:10.1016/j.foodres.2012.10.006.
Isolation and Identification of Procyanidin A1from Peanut Skins and Its Inhibitory Effect on the Formation of Acrylamide
ZHAO Li, LU Kai, WANG Xiaohong, LIU Rui*
(Key Laboratory of Environment Correlative Dietology, Ministry of Education, College of Food Science and Technology,Huazhong Agricultural University, Wuhan 430070, China)
Abstract:Peanut skin procyanidins were fractionated using gel permeation chromatography with a Toyopearl HW-40S column. Afterwards fraction 4, named PSP-4-1, was collected and further separated by preparative high performance liquid chromatography. As a result, we obtained a procyanidin monomer, procyanidin-4-1 (PSP-4-1). The structure of PSP-4-1 was identified by quadrupole-time of flight-liquid chromatography/mass spectrometry (Q-TOF-LC/MS) and nuclear magnetic resonance (NMR). Its inhibitory effects on acrylamide formation in a chemical model system and French fries were analyzed. The results showed that the structure of PSP-4-1 was epicatechin-(2β→O→7,4β→8)-catechin (procyanidins A1).It inhibited acrylamide formation in the chemical system and French fries in a nonlinear concentration-dependent fashion. In the chemical model system and French fries, the highest inhibition percentage of acrylamide formation was (58.10 ± 3.86)%and (57.16 ± 2.61)% at procyanidins A1concentrations of 0.05 and 0.03 mg/mL, respectively. This study can provide a useful guideline for the development of a highly efficient and economical acrylamide inhibitor.
Keywords:peanut skin; procyanidins A1; acrylamide; inhibition
ZHAO Li, LU Kai, WANG Xiaohong, et al. Isolation and identification of procyanidin A1from peanut skins and its inhibitory effect on the formation of acrylamide[J]. Food Science, 2018, 39(20): 1-6. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201820001. http://www.spkx.net.cn
引文格式:赵莉, 卢凯, 王小红, 等. 花生红衣中原花青素A1的分离鉴定及其对丙烯酰胺的抑制效果[J]. 食品科学, 2018, 39(20):1-6. DOI:10.7506/spkx1002-6630-201820001. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0001-06
文献标志码:A
中图分类号:TS201.6
DOI:10.7506/spkx1002-6630-201820001
*通信作者简介:刘睿(1969—),男,教授,博士,研究方向为天然产物化学。E-mail:liurui@mail.hzau.edu.cn
第一作者简介:赵莉(1993—),女,硕士研究生,研究方向为天然产物化学。E-mail:836439807@qq.com
基金项目:国家自然科学基金面上项目(31671962)
收稿日期:2018-03-21