李 杨,邹晓霜,李佳妮,李 红,齐宝坤,王中江,江连洲,隋晓楠*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:研究不同质量浓度花青素与大豆分离蛋白在碱性条件(pH 9.0)下的共价复合,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、荧光光谱、圆二色光谱对复合产物的结构进行分析,并建立以脂多糖诱导的Raw264.7炎症细胞模型探究大豆分离蛋白对花青素抗炎能力的影响。结果表明,花青素质量浓度升高会导致大豆分离蛋白溶解度降低,主要猝灭机制为静态猝灭,二级结构中α-螺旋含量逐渐降低,β-折叠与无规则卷曲含量逐渐增加。当花青素质量浓度为1.000 mg/mL可通过SDS-PAGE观察到超大分子质量亚基的生成。大豆分离蛋白-花青素复合物剂量为200 μg/mL时,当复合物体系花青素的添加质量浓度大于0.167 mg/mL,可以明显降低细胞分泌肿瘤坏死因子TNF-α以及NO的浓度。
关键词:大豆分离蛋白;花青素;共价复合;抗炎
大豆分离蛋白(soybean protein isolate,SPI)由豆粕低温提取,富含多种必需氨基酸并具有特定的空间结构,是一种安全可靠又经济实用的蛋白资源,其氨基酸分数近乎等同于动物蛋白,还可满足乳糖不耐症患者的需求[1-2],能取代动物蛋白[3],但SPI的加工特性还不能满足现代工业的需求[4]。目前除传统物理、化学、生物改性外,利用酚类来改善蛋白质的加工特性是一个全新的领域[5]。
研究表明,在一定条件下蛋白质可以与酚类物质发生相互作用形成相对稳定的衍生物[6-7]。食品工业中,产品研发和加工制造的核心研究目的是提高食品的营养和功能品质,向原食物组分中加入酚类物质,既可提高产品营养性、丰富性[8],还在一定程度上提高蛋白的加工特性以及改善生物学活性[9],但酚类物质都不可避免地会与蛋白质等生物大分子发生相互作用[10]。其中,花青素是一种黄酮类纯天然活性物质,由于具有抗氧化、抗炎等生物活性被广泛应用于保健、食品、医药等领域[11-12]。目前,国内外对于蛋白与酚类互作的研究主要局限在非共价复合,Asquith等[13]发现多酚与蛋白的结合能力与种类有关。刘勤勤等[4]研究了茶多酚与SPI的相互作用。姚惠芳等[14]研究了笃斯越橘花青素与牛血清白蛋白的相互作用;对于共价复合的研究相对较少,Tantoush等[15]发现β-乳球蛋白与酸樱桃酚共价复合后致敏性降低。Prodpran等[7]发现鱼肌原纤维蛋白与多种酚类共价复合后,蛋白加工特性增强。Rawel等[16]发现大豆球蛋白与多种酚类共价复合后,蛋白质溶解性改变,等电点偏移。目前国内对于花青素与蛋白的非共价相互作用已经进行了一些报道,但对于花青素与SPI共价相互作用的机理研究尚存空白。
针对上述问题,本实验探究了在碱性条件下不同质量浓度花青素与SPI互作,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、荧光光谱、圆二色光谱等对蛋白结构进行分析,并建立以脂多糖(lipopolysaccharides,LPS)诱导的Raw264.7体外细胞炎症模型,通过对肿瘤坏死因子TNF-α以及NO的分泌量,测定SPI对花青素抗炎能力的影响。本研究为花青素与SPI共价相互作用的研究提供了理论方法和指导意义,并为进一步研究提供基础。
大豆 市售;黑米提取物 中国山西天之润生物科技有限公司;SDS-PAGE凝胶试剂盒 中国Solarbio公司;乙腈、甲酸(均为色谱纯)、LPS 美国Sigma-Aldrich公司;RAW264.7小鼠单核巨噬细胞 中国科学院上海生科院细胞资源中心;3 kDa超滤离心管 美国Millipore公司;Griess试剂 中国碧云天生物技术有限公司;TNF-α ELISA试剂盒 中国上海哈灵生物科技有限公司;胎牛血清(fetal bovine serum,FBS)、DMEM培养基、磷酸盐缓冲液 美国Gibco BRL公司;其余试剂均为分析纯。
F-4500型荧光分光光度计 日本Hitachi公司;W A T 0 2 3 6 3 5高效液相色谱仪、C18反向色谱柱(250 mm×4.6 mm,2.5 μm) 美国Waters公司;GL-25MS超速高速冷冻离心机 上海盛析仪器设备有限公司;J-810圆二色光谱仪 日本Jasco公司;SPCH-10超高压纳米均质机 安盛联合科技有限公司;PHS-25型酸度计 上海仪电科学仪器股份有限公司;BSM电子分析天平 上海亭衡衡器有限公司;JJ-1电动搅拌器金坛市天竟实验仪器厂;KDN-04B消化炉 上海昕瑞有限公司;RE201D旋转蒸发仪 中浮仪器设备有限公司;RVC 2-18真空离心浓缩仪 德国Christ公司;FD5-3型冷冻干燥机 美国SIM公司;ULTRATURRAXUTL 2000乳化机 德国IKA公司;Tecan M200 PRO多功能酶标仪 瑞士帝肯公司。
1.3.1 SPI的制备
参考Torrezan等[17]的方法,用粉碎机将大豆粉碎后过60 目筛网,按1∶3(g/mL)用正己烷脱脂豆粉3次。脱脂豆粉置入通风橱中12 h除去正己烷。将脱脂豆粉溶解于去离子水中,用2 mol/L的NaOH溶液调节溶液pH值至9.0并充分搅拌,4 ℃、14 000×g离心20 min取上清液,用2 mol/L的HCl溶液调节溶液pH值至4.5,4 ℃、4 000×g离心20 min弃去上清液,将沉淀用去离子水充分水洗3 次后,用2 mol/L的NaOH溶液将溶液pH值调至7.0。样品经-40 ℃预冻24 h后冷冻干燥,研磨后得到SPI(根据GB/T 5009.5—2010《食品中蛋白质的测定》蛋白质质量分数为(90.5±0.30)%)。
1.3.2 黑米提取物中花青素的提纯及主要成分的鉴定
花青素的提纯参考Sui Xiaonan等[18]的方法,称取10 g黑米提取物,将黑米提取物与去离子水按1∶10(g/mL)配制成混合液后进行减压抽滤。将滤液进行固相萃取分别依次加入0.01 mol/L的HCl-乙酸乙酯-甲醇(5∶4∶4,V/V),最后采用旋转蒸发去除甲醇得到花青素提纯样品。
花青素主要成分的鉴定,取50 μL溶于甲醇的花青素样品于EP管中,用真空浓缩仪除去甲醇后加入50 μL去离子水经振荡器混匀,取20 μL样液稀释至10 mL并过0.45 μm滤膜,单次进样量50 μL,流速1 mL/min,流动相A为5%甲酸,流动相B为100%乙腈,梯度0~5 min流动相A为100%,流动相B为0%;20 min流动相A为90%,流动相B为10%;40 min流动相A为87%,流动相B为13%;44 min流动相A为80%,流动相B为20%;50 min时流动相A为75%,流动相B为25%,55 min时流动相A为0%,流动相B为100%。柱温25℃,检测器波长520 nm。
最终检测结果黑米提取物中花青素主要成分为矢车菊素-3-O-葡萄糖苷,根据拟合曲线计算最终纯度为(89.40±0.02)%,可认为纯品,相对分子质量按449.38计算。将旋转蒸发后得到的提纯样品溶于0.01 mol/L的HCl溶液中配制成50 mg/mL的花青素母液,于-20 ℃冷冻保存备用。
1.3.3 SPI与花青素的共价复合
参考Rawel等[19]的方法稍加修改,用去离子水配制质量浓度为20 mg/mL的SPI溶液,500 r/min磁力搅拌2 h以确保蛋白充分溶解,分别加入50 mg/mL的花青素母液,调节溶液pH值至9.0后加入去离子水并定容使蛋白最终质量浓度为10 mg/mL,并分别使花青素最终质量浓度为1.000、0.500、0.250、0.167、0.125 mg/mL,加入质量分数为0.02%叠氮化钠防止微生物滋生,并在室温下500 r/min磁力搅拌16 h,然后将部分样品在4 000×g于3 kDa超滤离心管中离心20 min以除去游离花青素,冻干后用于结构测定。其余样品直接冻干,花青素对照组经相同处理后冻干。
1.3.4 溶解度测定
参考Morr等[20]的方法,将样品分散于10 mL的去离子水中,然后用0.1 mol/L的NaOH或HCl溶液调节溶液pH值(pH 2~10),500 r/min条件下磁力搅拌30 min,随后4 ℃、14 000×g离心20 min。取上清液,采用微量凯氏定氮法测定蛋白质含量。蛋白质溶解度计算公式如下:
1.3.5 SDS-PAGE检测
根据Liu Fuguo等[21]的方法稍加修改,将20 μL样品稀释于含有β-巯基乙醇的2×上样缓冲液中,于95 ℃加热90 s变性处理。分别配制12%和5%的分离胶与浓缩胶,上样量为10 μL,电泳过程电压恒定,浓缩胶电压60 V,分离胶电压120 V。染色剂为0.25 g/L考马斯亮蓝R-250(0.25 g考马斯亮蓝R-250、400 mL甲醇、70 mL冰乙酸定容至1 L),电极液为甘氨酸14.41 g、Tris 3.03 g、SDS 1.0 g定容至1 L,脱色液A为甲醇-冰乙酸-水(40∶7∶53,V/V),脱色液B为甲醇-冰乙酸-水(5∶7∶88,V/V)。
1.3.6 荧光光谱分析
根据王中江等[22]的方法,用0.01 mol/L磷酸盐缓冲液(pH 7.0)分别将样品稀释至0.2 mg/mL,在280 nm波长处激发,测定波长范围为300~400 nm,扫描速率60 nm/s,激发条带宽度10 nm,激发和发射狭缝均为10 nm,每组样品重复测定3 次。
1.3.7 圆二色光谱
根据Rawel等[19]的方法。分别称取一定量的样品,溶于磷酸盐缓冲液(0.05 mol/L pH 7.0)中,使得蛋白质量浓度为0.25 mg/mL,样品池光程为1 mm,实验温度25 ℃,扫描速率100 nm/min,分辨率0.1 nm。采用CDpro曲线拟合软件包分析复合物的二级结构组成使用的参考蛋白为SMP56,取蛋白平均残基摩尔质量为115 g/mol,计算波长范围为200~240 nm,每组样品重复测定3 次。
1.3.8 体外Raw264.7炎症细胞模型的建立
Raw264.7细胞采用DMEM完全培养基(10%的FBS、4 mmol/L的L-谷氨酰胺、100 U/mL的青霉素、100 μg/mL的链霉素)于25 cm2带盖透气斜口培养瓶中,并在无菌培养箱中37 ℃、5% CO2孵育;当细胞融合至70%~80%时进行传代处理,弃去细胞培养液,用磷酸盐缓冲液冲洗后,加入DMEM培养基2 mL并用细胞刮刀将贴壁细胞刮落,以1∶2的比例进行细胞传代,选取5 代后细胞用于实验;使用无FBS、无双抗的DMEM培养基溶解花青素以及花青素与未超滤SPI的复合物冻干样。当细胞密度达到105个/mL时将细胞接种于24 孔平板中,在37 ℃、5% CO2无菌培养箱用不含FBS、双抗的DMEM培养基饥饿处理24 h后,分别用花青素以及未超滤SPI-花青素的复合物孵育细胞4 h,最后以质量浓度10 ng/mL的LPS孵育24 h。
1.3.9 MTT法检测细胞活性
采用MTT法检测花青素以及SPI-花青素复合物对RAW264.7细胞的增殖作用。取对数生长期的RAW264.7细胞,细胞密度达到5×104接种于96 孔细胞养板中,分别加入不同质量浓度花青素以SPI-花青素的复合物,补充无FBS、无双抗DMEM培养基至200 μL并使样品最终质量浓度为50、100、200 μg/mL,对照组加入无FBS、无双抗DEME培养基。在5% CO2、37 ℃培养箱中孵育24 h后,弃去培养基,每孔加入MTT试剂20 μL,在培养箱中4 h后,每孔加入二甲基亚砜150 μL,振荡10 min后检测570 nm波长的光密度,计算细胞活力。
1.3.10 TNF-α及NO含量的测定
Raw264.7细胞经LPS处理24 h后,用无菌离心管收集细胞悬液,1 000 r/min离心20 min,收集上清液,测定不同质量浓度花青素以及SPI-花青素复合物处理Raw264.7细胞后TNF-α的分泌量,采用酶联免疫吸附试剂盒,具体操作按说明书进行,以空白孔调零,450 nm波长处测定各孔OD值,每实验组重复3 次。氮氧化物含量的测定,采用NO检测试剂盒,具体操作按说明书进行,540 nm波长处测定各孔OD值,每实验组重复3 次[23]。
使用Statistics 8进行ANOVA差异显著性分析和方差分析(P<0.05为显著性差异),若P值小于0.05,使用Duncan’s multiple range test进行多重比较。采用Sigma Plot软件进行图谱分析和图表制作。每个实验重复3 次,结果表示为 ±s。
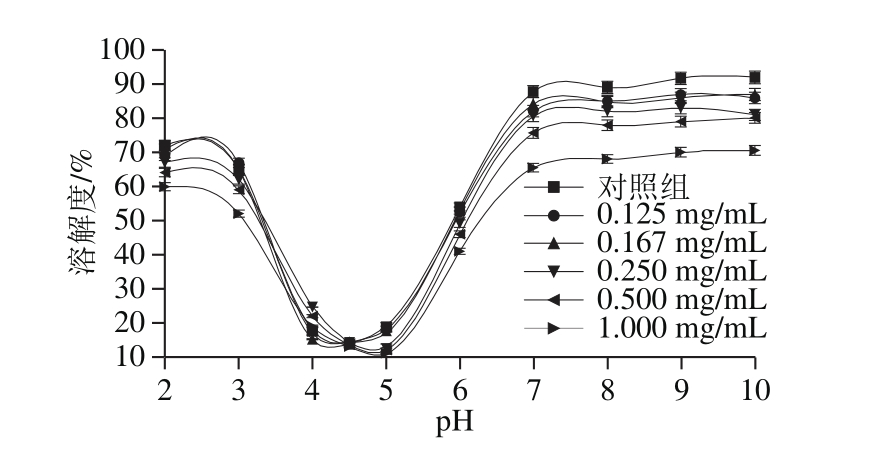
图1 花青素质量浓度对SPI溶解性的影响
Fig. 1 Effects of different concentrations of anthocyanins on the solubility of SPI
食物组分中蛋白质的溶解性与乳化性、凝胶性、持水性等加工特性息息相关。凯氏定氮法测定SPI与不同质量浓度花青素复合后溶解度的变化情况(pH 2.0~10.0),如图1所示,SPI的溶解度随花青素质量浓度增加呈下降趋势,等电点略微向pH值增大方向偏移,且当SPI与1.000 mg/mL质量浓度的花青素复合时溶解度最低。SPI主要由球蛋白组成,这种蛋白质分子极性集团朝向外部,可以与极性的水分子相互作用[24],当加入花青素后,可能是由于在碱性条件下SPI的侧链氨基酸极性集团与花青素的酚羟基结合,导致蛋白质分子体系极性下降,溶解度降低。Rawel等[16]曾研究过大豆球蛋白与多种酚类物质碱性条件下共价复合,结果表明大豆蛋白溶解性的改变与所加入酚的种类有关。
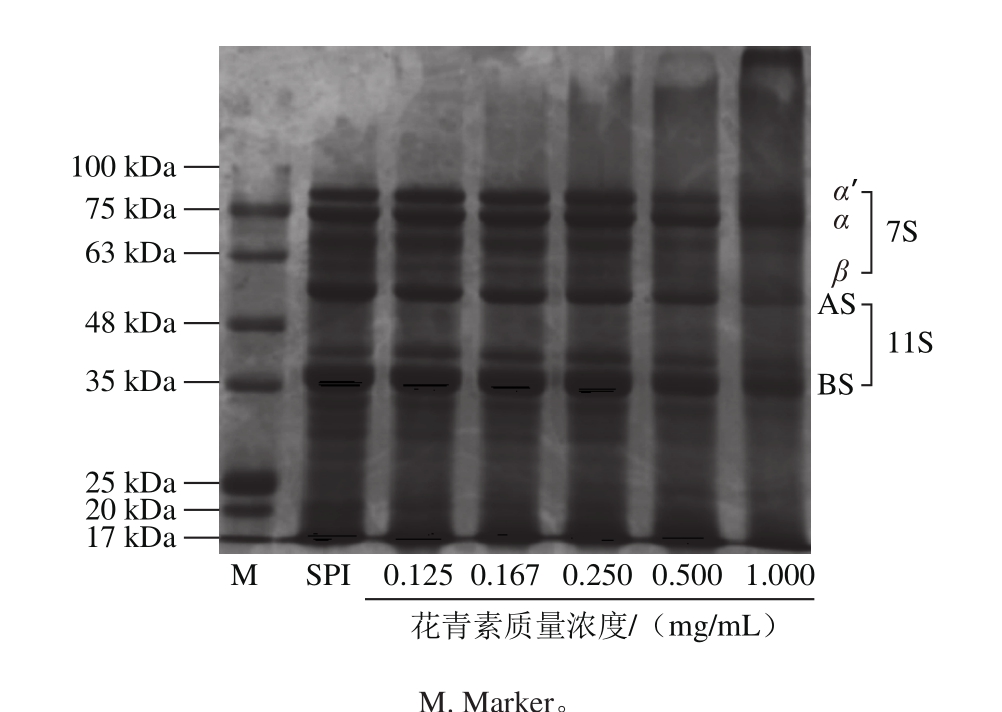
图2 花青素质量浓度对SPI亚基组成的影响
Fig. 2 Effects of different concentrations of anthocyanins on subunit composition of SPI
SDS-PAGE具有较高的灵敏度的蛋白质分离技术,可根据亚基的分子质量在电泳的过程中呈梯度逐渐分开[25]。由图2可以看出,随着花青素质量浓度的增加,分子质量在63~75 kDa的亚基与20~35 kDa的亚基逐渐消失,并伴随着超高分子质量亚基的与色散带的生成,花青素质量浓度为1.000 mg/mL条带现象最为明显。Liu Fuguo等[26]研究乳铁蛋白与绿原酸相互作用,会导致乳铁蛋白亚基的分子质量稍有增加的趋势;Rawel等[16]对大豆球蛋白与绿原酸、咖啡酸、杨梅素、槲皮素在碱性条件下互作时均出现超大分子质量亚基的生成。在Liu Fuguo[26]、与Rawel[16]等的实验结果中未观察到低分子质量亚基的消耗,可能由于未进行对酚类物质添加质量浓度进行探究,由于花青素分子质量远小于大豆蛋白,因此图中高分子质量亚基条带的生成,可能是由于花青素与蛋白互作后,使蛋白质不同亚基之间发生聚合形成大分子亚基,而非花青素与亚基结合所产生。

图3 花青素质量浓度对SPI荧光强度的影响
Fig. 3 Effects of different concentrations of anthocyanins on fl uorescence intensity of SPI
一般色氨酸残基与酪氨酸残基是蛋白质的主要内源荧光源,易受微环境极性的影响,因而可用作研究蛋白质与小分子物质相互作用的依据。本实验采用内源荧光分析方法研究了花青素与SPI复合后对蛋白质三级结构的变化。在280 nm波长下激发的SPI样品荧光发射光谱主要发色基团为色氨酸与酪氨酸。由图3可知,花青素对SPI荧光具有明显的猝灭作用,在一定质量浓度SPI溶液条件下,花青素质量浓度的升高会引起SPI荧光强度的降低,表明花青素与SPI相互作用时,将位于内部的疏水基团暴露于水相中,导致蛋白发生荧光猝灭。同时,最大发射峰λmax红移,由波长337.6 nm处偏移至339.6 nm处,表明蛋白质内部结构中的发色基团在溶液中所处的微环境极性提高,肽链变得更加伸展。许铭珠等[27]根据猝灭常数判断葡萄皮花青素与5 种蛋白相互作用的均为静态猝灭。刘勤勤等[4]发现茶多酚会导致SPI荧光光谱红移,与本实验结果一致。
动态猝灭及静态猝灭是引起SPI荧光猝灭的主要机制。动态猝灭过程中,升温会导致猝灭常数随着温度的升高而增加;反之,静态猝灭的猝灭常数降低。因此,可通过Stern-Volmer方程,根据不同温度下荧光强度的改变判定猝灭机制,公式如下:
式中:F0为未加入花青素时SPI的荧光强度;F为加入花青素后SPI的荧光强度;[Q]为花青素的总浓度/(mol/L);KSV为动态猝灭常数/(L/mol);Kq为双分子猝灭速率常数/(L/(mol·s));τ0为猝灭剂不存在时荧光体的寿命(通常生物大分子的平均寿命约为10-8s[28-29])。
表1 花青素对SPI的猝灭常数
Table 1 Stern-Volmer quenching constants

各类荧光猝灭剂对生物大分子的最大猝灭常数约为2.0×10 L/(mol·s),若Kq大于2.0×1010L/(mol·s)时为静态猝灭;若Kq小于2.0×1010L/(mol·s)时为静态猝灭。不同温度下花青素对SPI的猝灭常数结果见表1,显然花青素对SPI的猝灭机制主要为静态猝灭,这进一步说明花青素与SPI形成了不发光的复合物,从而导致SPI荧光强度降低。
选择紫外光谱范围为190~240 nm,测定不同质量浓度的花青素与蛋白质复合后的圆二色吸收,由图4可以看出,在光谱范围为200~230 nm时蛋白质的平均残基摩尔椭圆度[θ]发生了改变,通过CONTIN/LL程序计算,结果见表2。

图4 不同质量浓度花青素与SPI复合物的圆二色光谱
Fig. 4 CD spectra of SPI complexes with different concentrations of anthocyanins
表2 花青素质量浓度对SPI的二级结构的影响
Table 2 Effect of different concentrations of anthocyanins on protein secondary structure of SPI

注:所有样品均重复测定3 次取平均值,同列不同字母表示差异显著(P<0.05)。
SPI与不同质量浓度花青素复合后,二级结构含量发生了明显变化。如表2所示,随着花青素质量浓度的增加,α-螺旋结构含量降低,β-折叠含量上升,转角结构变化不明显,当花青素质量浓度为1.000 mg/mL时,无规则卷曲含量明显增加。可能是由于α-螺旋结构中的疏水性氨基酸区域,从而使肽链延伸改变其空间构象。Ali等[30]研究牛奶的乳清蛋白与咖啡酸相互作用导致二级结构中的无规则卷曲含量升高。Liu Fuguo等[26]研究乳铁蛋白与绿原酸、没食子酸碱性条件下复合,结果表明乳铁蛋白-绿原酸复合物、与乳铁蛋白-没食子酸复合物的二级结构中α-螺旋结构含量降低,β-折叠含量增加,无规则卷曲含量增加,与本实验结论一致。
TNF-α是细菌感染、组织破坏以及肿瘤细胞等多种刺激激活巨噬细胞而产生的一种引起炎症反应的关键细胞因子[31]。TNF-α能诱导炎症细胞因子的产生,在一定质量浓度范围下可以保护细胞[32],但过量的TNF-α会导致炎症细胞因子的过度表达,从而引起一系列的炎症反应[33]。
花青素具有抗氧化、抗肿瘤、抗炎的功效[34],先前研究表明蛋白与多酚的相互作用,会在一定程度影响多酚的生物活性[35]。花青素以及SPI-花青素复合物的剂量通过MTT实验进行检测,剂量范围为50~200 μg/mL,在该质量浓度范围下并未对细胞活力产生明显影响。
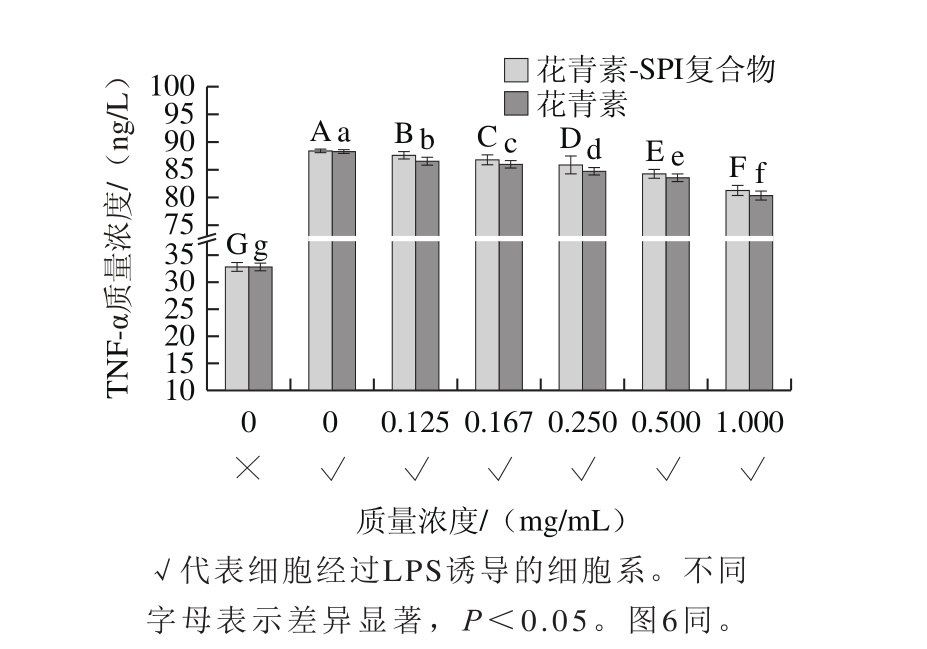
图5 200 μg/mL剂量下花青素及SPI-花青素复合物处理细胞后TNF-α的分泌量
Fig. 5 TNF-α secretion after treatment with anthocyanins or SPI-anthocyanins complex at 200 μg/mL

图6 200 μg/mL剂量下不同质量浓度花青素与SPI复合物处理后NO的分泌量
Fig. 6 NO production after treatment with different concentrations of SPI-anthocyanins complex at 200 μg/mL
本实验以质量浓度为10 ng/mL的LPS诱导Raw264.7细胞系,结果显示LPS诱导细胞24 h后,TNF-α含量明显增加,加入剂量为50、100 μg/mL的花青素及SPI-花青素复合物后,TNF-α含量几乎无明显变化(P>0.05)。在200 μg/mL剂量下(图5),TNF-α的分泌量随花青素质量浓度的升高而降低(P<0.05)。在200 μg/mL剂量下(图6),通过Griess试剂发现氮氧化物代谢量降低(P<0.05),与不同质量浓度花青素对TNF-α以及氮氧化物含量影响趋势一致,但质量浓度低于0.250 mg/mL时效果并不十分显著。此外,发现SPI并未对炎症产物TNF-α以及NO分泌量产生任何影响,花青素单独存在时较SPI-花青素复合物炎症产物分泌量少,可能是由于蛋白质与花青素结合后会形成一定的空间位阻,间接降低了花青素的抗炎能力。综上,低质量浓度花青素与SPI复合后抗炎效果并不显著,SPI-花青素复合物具有一定抗炎能力。
本实验探究了在碱性条件下不同质量浓度花青素与SPI复合,探究花青素质量浓度对复合物结构以及抗炎能力的影响,主要结论如下:1)随着花青素质量浓度的增加,SPI溶解度逐渐降低。2)SDS-PAGE表明,花青素会导致7S与11S中部分亚基的消耗,以及超大分子质量亚基的形成。3)荧光色谱法分析表明,花青素能够通过改变酪氨酸与色氨酸所处的极性微环境导致蛋白发生荧光猝灭,通过Stern-Volmer方程计算得出该猝灭方式为静态猝灭。4)圆二色光谱法分析表明,花青素会导致SPI的α-螺旋结构含量降低,β-折叠与无规则卷曲结构含量增加。5)通过酶联免疫法以及NO试剂盒对Raw264.7细胞炎症代谢产物的分析表明,当剂量为200 μg/mL时随着体系花青素质量浓度的增加,炎症代谢物TNF-α与NO分泌量呈下降趋势。
参考文献:
[1] 王浩冉. 脱脂豆粕的预处理及其对大豆蛋白提取和性质的影响[D].无锡: 江南大学, 2012.
[2] LIM T J, EASA A M, KARIM A A, et al. Development of soy-based cream cheese via the addition of microbial transglutaminase, soy protein isolate and maltodextrin[J]. British Food Journal, 2011, 113(9):1147-1172. DOI:10.1108/00070701111174587.
[3] 左进华, 董海洲, 侯汉学. 大豆蛋白生产与应用现状[J]. 粮食与油脂,2007(5): 12-15. DOI:10.3969/j.issn.1008-9578.2007.05.004.
[4] 刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J].食品科学, 2015, 36(17): 43-47. DOI:10.7506/spkx1002-6630-201517009.
[5] 田梅, 覃思, 余冰, 等. 速溶绿茶及其提取物对大豆分离蛋白界面性能的影响研究[J]. 食品工业科技, 2007, 28(2): 140-145.DOI:10.3969/j.issn.1002-0306.2007.02.037.
[6] YANG J, LEE R, HENNING S M, et al. Soy protein isolate does not affect ellagitannin bioavailability and urolithin formation when mixed with pomegranate juice in humans[J]. Food Chemistry, 2016, 194:1300-1303. DOI:10.1016/j.foodchem.2015.08.099.
[7] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782. DOI:10.1016/j.ijbiomac.2012.07.010.
[8] 刘婵, 何志勇, 秦昉, 等. 多酚与蛋白质, 消化酶相互作用的研究进展[J]. 食品与发酵工业, 2015, 41(11): 256-560. DOI:10.13995/j.cnki.11-1802/ts.201511045.
[9] 郭兴凤, 石晶, 薛园园, 等. 茶多酚对大豆蛋白溶解性影响[J]. 粮食与油脂, 2010(3): 18-20. DOI:10.3969/j.issn.1008-9578.2010.03.006.
[10] 范金波, 周素珍, 郑立红, 等. 果蔬中酚类成分及其与蛋白质相互作用的研究进展[J]. 食品工业科技, 2013, 34(19): 352-357.
[11] 周瑞, 董学艳, 景浩. 不同溶液中牛血清白蛋白与花青素相互作用特征及抗氧化性[J]. 食品科学, 2013, 34(15): 11-16. DOI:10.7506/spkx1002-6630-201315003.
[12] 徐青, 周元敬, 黄筑, 等. 蓝莓花青素的提取及分离研究进展[J].食品与生物技术学报, 2016, 35(9): 897-906. DOI:10.3969/j.issn.1673-1689.2016.09.001.
[13] ASQUITH T N, BUTLER L G. Interactions of condensed tannins with selected proteins[J]. Phytochemistry, 1986, 25(7): 1591-1593.
[14] 姚惠芳, 景浩. 笃斯越橘花青素与牛血清白蛋白的相互作用[J]. 食品科学, 2013, 34(23): 6-10. DOI:10.7506/spkx1002-6630-201323002.
[15] TANTOUSH Z, STANIC D, STOJADINOVIC M, et al. Digestibility and allergenicity of β-lactoglobulin following laccase-mediated crosslinking in the presence of sour cherry phenolics[J]. Food Chemistry,2011, 125(1): 84-91. DOI:10.1016/j.foodchem.2010.08.040.
[16] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3/4): 137-150.
[17] TORREZAN R, THAM W P, BELL A E, et al. Effects of high pressure on functional properties of soy protein[J]. Food Chemistry, 2007,104(1): 140-147. DOI:10.1016/j.foodchem.2006.11.013.
[18] SUI X N, BARY S, ZHOU W B. Changes in the color, chemical stability and antioxidant capacity of thermally treated anthocyanin aqueous solution over storage[J]. Food Chemistry, 2016, 192: 516-524.DOI:10.1016/j.foodchem.2015.07.021.
[19] RAWEL H M, ROHN S, KRUSE H P, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid[J]. Food Chemistry, 2002, 78(4): 443-455.
[20] MORR C, GERMAN B, KINSELLA J, et al. A collaborative study to develop a standardized food protein solubility procedure[J]. Journal of Food Science, 1985, 50(6): 1715-1718.
[21] LIU F G, SUN C X, YANG W, et al. Structural characterization and functional evaluation of lactoferrin-polyphenol conjugates formed by free-radical graft copolymerization[J]. RSC Advances, 2015, 5(20):15641-15651. DOI:10.1039/C4RA10802G.
[22] 王中江, 江连洲, 魏冬旭, 等. pH 值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51.
[23] TANAKA K, OHGO Y, KATAYANAGI Y, et al. Anti-inflammatory effects of green soybean extract irradiated with visible light[J].Scientific Reports, 2014, 4(16): 4732-4732. DOI:10.1038/srep04732.
[24] 田其英, 华欲飞. 大豆蛋白溶解性研究[J]. 粮食与油脂, 2006(6): 6-8.DOI:10.3969/j.issn.1008-9578.2006.06.002.
[25] SHAPIRO A L, VIÑUELA E, Jr. MAIZEL J V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels[J].Biochemical & Biophysical Research Communications, 1967, 28(5): 815-820.
[26] LIU F G, WANG D, SUN C X, et al. Utilization of interfacial engineering to improve physicochemical stability of β-carotene emulsions: multilayer coatings formed using protein and proteinpolyphenol conjugates[J]. Food Chemistry, 2016, 205: 129-139.DOI:10.1016/j.foodchem.2016.02.155.
[27] 许铭珠. 葡萄皮花青素提取物与蛋白质的相互作用及其对色素稳定性的影响[D]. 无锡: 江南大学, 2015.
[28] YU X, LU S, YANG Y, et al. The investigation of the interaction between NCP-EDA and bovine serum albumin by spectroscopic approaches[J]. Molecular Biology Reports, 2011, 38(6): 4185-4192.DOI:10.1016/j.saa.2011.09.014.
[29] 张冰卫, 李博, 夏文水, 等. 用荧光光谱法研究分子间结合常数和结合位点数时的公式选择[J]. 药学进展, 2011, 35(7): 296-303.
[30] ALI M, HOMANN T, KHALIL M, et al. Milk whey protein modification by coffee-specific phenolics: effect on structural and functional properties[J]. Journal of Agricultural and Food Chemistry,2013, 61(28): 6911-6920. DOI:10.1021/jf402221m.
[31] 张晶, 钟武, 李松. TNF-α抑制剂的研究进展[J]. 中国药物化学杂志,2010(4): 310-318.
[32] BAKALA H. Metalloproteinases as targets for anti-inflammatory drugs[J]. Biochimie, 2001, 83(6): 547-548.
[33] KITANO K, RIVAS C I, BALDWIN G C, et al. Tumor necrosis factor-dependent production of human immunodeficiency virus 1 in chronically infected HL-60 cells[J]. Blood, 1993, 82(9): 2742.
[34] 王静, 马养民, 逯文静. 蓝莓花青素的纯化及镇痛、抗炎药效学研究[J]. 食品工业科技, 2013, 34(5): 338-340.
[35] MANACH C, SCALBERT A, MORAND C, et al. Polyphenols: food sources and bioavailability[J]. The American Journal of Clinical Nutrition, 2004, 79(5): 727-747.
Effects of Anthocyanins on the Structure of Soybean Protein and Anti-Inf l ammatory Activity of Their Complex
LI Yang, ZOU Xiaoshuang, LI Jiani, LI Hong, QI Baokun, WANG Zhongjiang, JIANG Lianzhou, SUI Xiaonan*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:In this paper, the covalent cross-linking at an alkaline pH (pH 9.0) between different concentrations of anthocyanins and soybean protein isolate (SPI) was studied. The structure of the products was analyzed by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), fl uorescence spectroscopy and circular dichroism (CD)spectroscopy, and their inhibitory effect on lipopolysaccharide (LPS)-induced inflammation in RAW264.7 cell line was assessed. Results showed that the solubility of SPI decreased in the presence of increasing concentrations of anthocyanins and the quenching mechanism was a static process, showing a decrease in α-helix and an increase in β-sheet and random coil. The formation of super-macromolecular subunits was observed by SDS-PAGE in the presence of anthocyanins at 1.000 mg/mL. Besides, the addition of 0.167 mg/mL of the complex formed between SPI and anthocyanins at 200 μg/mL could markedly reduce the secretion of TNF-α and nitrite oxide (NO).
Keywords:soybean protein isolate; anthocyanins; covalent cross-link; anti-inf l ammatory activity
LI Yang, ZOU Xiaoshuang, LI Jiani, et al. Effects of anthocyanins on the structure of soybean protein and anti-inf l ammatory activity of their complex[J]. Food Science, 2018, 39(20): 7-12. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820002. http://www.spkx.net.cn
引文格式:李杨, 邹晓霜, 李佳妮, 等. 花青素对大豆分离蛋白结构影响及其复合物抗炎能力[J]. 食品科学, 2018, 39(20): 7-12.DOI:10.7506/spkx1002-6630-201820002. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0007-06
文献标志码:A
中图分类号:TS214.2
DOI:10.7506/spkx1002-6630-201820002
*通信作者简介:隋晓楠(1987—),男,副教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:xiaonan.sui@neau.edu.cn
第一作者简介:李杨(1981—),男,副教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:lihuangyu@163.com
基金项目:国家自然科学基金面上项目(31671807);国家自然科学基金青年科学基金项目 (31601475)
收稿日期:2017-04-10