表1 NaClO和NaBr的配比与用量
Table 1 Dosages of sodium hypochlorite and sodium hypochlorite and ratios between them
陈 爽1,张心钰2,吴 昊1,胡雪芹1,*
(1.合肥工业大学生物与医学工程学院,安徽 合肥 230000;2.合肥工业大学附属中学,安徽 合肥 230000)
摘 要:以低分子质量右旋糖酐(mw5 400 Da)为原料在碱性条件下通过NaClO-NaBr将其氧化并对氧化后的产物进行理化性质分析。结果表明,随着氧化剂用量的增加,羧基含量逐渐增加,羧基质量分数的变化范围为0.05%~0.8%。高效液相色谱分析显示,右旋糖酐在氧化过程中随着氧化剂用量的增加会发生一定的降解。随着NaClO用量逐渐增加,氧化程度逐渐增加,NaClO过量使用,则氧化产物降解加剧。氧化的发生会破坏右旋糖酐的晶体结构,使其结晶区逐渐变为无定型区。核磁共振碳谱表明氧化产物的结构随着氧化剂的用量的增加氧化反应不仅发生在C1的半缩醛羟基上,还会发生在葡萄糖环的其他碳上。氧化改性提高了右旋糖酐的水溶性并且得到的产物具有良好的热稳定性。本研究在碱性条件下利用NaClO-NaBr将右旋糖酐中的羟基氧化为羧基,揭示了氧化产物理化性质的变化规律,研究结果为生物多糖的氧化改性提供了参考依据。
关键词:右旋糖酐;多糖;氧化改性;理化特性
右旋糖酐是由葡萄糖脱水缩合而成的一种生物多糖,由重复的α-D-吡喃葡萄糖单元(主要含有α-1,6-糖苷键)构成。右旋糖蔗糖酶通过催化蔗糖合成右旋糖酐[1-2],不同右旋糖酐蔗糖酶的产生菌能够合成不同类型的右旋糖酐。右旋糖酐蔗糖酶主要来源于肠膜状明串珠菌(Leuconostoc mesenteroides)、乳酸杆菌[3](Lactobacillus)、链球菌(Streptococcus)以及魏斯氏菌[4](Weissella)。其中由肠膜状明串珠菌(L. mesenteroides)0326生产的右旋糖酐被广泛应用于食品的凝胶化、稠化和乳化。在面包的烘焙过程中添加右旋糖酐则可以增加面包的柔软度和体积,使得面包具有更好的口感[5]。因其含有95%以上的α-1,6-糖苷键而具有很好的水溶性。除此之外,与含有α-1,4-糖苷键的淀粉不同,它很难被人体内的酶分解[6-7]。
多糖因具有大量的羟基基团而被认为适用于化学改性,其中氧化是多糖的重要改性方法之一,氧化型淀粉多糖就被广泛应用于食品添加剂。右旋糖酐作为一种生物多糖也适用于氧化改性,以往的研究表明,水凝胶就是通过右旋糖酐氧化得到醛基和ε-聚赖氨酸复合而成[8]。并且氧化后的右旋糖酐可以络合金属离子成为多糖金属离子络合物用于补充人体所需要的金属离子[9-10]。不同的氧化条件对右旋糖酐的分子质量和其他的理化性质都有不同的影响。在文献报道中,主要氧化剂有NaClO、H2O2、Na5IO6以及KMnO4和选择性氧化体系TEMPONaClO-NaBr[11]。目前,NaClO是工业上使用最为广泛的多糖氧化剂[12-13]。H2O2作为可供选择的氧化剂不常应用于工业,但是,H2O2不像NaClO会产生氯离子污染,它是一种安全无害的环保型氧化剂[14]。选择性氧化体系TEMPO-NaClO-NaBr能够选择性的氧化多糖葡萄糖单元上的伯醇羟基,使其被氧化为羧基。除了氧化葡萄糖单元C6上的羟基之外,氧化还会发生在C1的羟基上,随着氧化剂用量的增加C1与C2之间的键会发生断裂氧化还会发生在C2的羟基上。此外,随着氧化程度的进一步加深,C2与C3之间的键会发生断裂C3上的羟基还会被氧化为羧基[15]。溴酸盐在酸性条件下氧化淀粉目前被报道,除了将淀粉葡萄糖单元上的伯醇羟基氧化之外,C2与C3之间的键会发生断裂,C2与C3上的羟基也会被氧化,产物中不仅有羧基还有醛基[16-17]。尽管关于多糖的氧化改性的研究很多。但是,关于NaClO-NaBr氧化右旋糖酐尚无深入研究。
在本研究中,选取NaClO-NaBr氧化体系在碱性条件下氧化低分子质量右旋糖酐(mw5 400 Da)得到分子质量适中并含有羧基基团的右旋糖酐用于食品和药品。由于右旋糖酐氧化物的理化性质和结构特性受氧化条件影响较大,氧化产物的表征是研究氧化条件对产物理化特性的影响重要手段。傅里叶变换红外光谱用于表征羧基的产生情况,核磁表征了氧化后右旋糖酐的结构变化。本研究利用NaClO-NaBr在碱性条件下将右旋糖酐进行氧化改性,通过对氧化产物的检测和表征分析,揭示了氧化条件对右旋糖酐氧化物的理化性质的影响规律。研究结果为氧化型右旋糖酐的制备提供了可行的方法,也为氧化剂的选择提供了理论依据。
右旋糖酐蔗糖酶为本实验工程菌E. coli BL21(DE3)/pET28-dexYG在肠膜状明串珠菌0326中构建表达得到的[18],棘孢青霉H5为本实验室从土壤中筛选的[19-20];NaClO、NaBr、盐酸、氢氧化钠 四川美丰化工股份有限公司。
DF-102S恒温水浴锅 巩义予华仪器有限公司;DHF-9070A烘箱 上海一恒科技仪器有限公司;1525高效液相色谱仪 美国Waters公司;BSA224S-CW分析天平、BS 200S电子天平 北京赛多利斯天平有限公司;Avanti J-E高速低温离心机 美国贝克曼库尔特公司;CHA-SA恒温摇床 江苏金坛国胜实验仪器厂;LDZX-40 SCI高压立式蒸汽灭菌锅 上海申安医疗器械厂;KS-150超声细胞破碎仪 宁波科生仪器厂;D/MAX2500V X射线粉末衍射仪 日本理学公司;6700傅里叶变换红外光谱仪 美国Thermo Nicolet公司;Q-500E超声波清洗器 昆山市超声仪器有限公司;VIS-723紫外分光光度计 上海精密科学仪器有限公司;HSC-3/2热分析仪 北京恒久仪器有限公司;VNMRS600超导核磁共振波谱仪 美国安捷伦科技公司。
1.3.1 低分子质量右旋糖酐的制备
用pH 5.0乙酸-乙酸钠缓冲液配制300 mL质量浓度为0.1 g/mL的蔗糖溶液为酶催化底物,并将水浴温度维持在25 ℃。将右旋糖酐酶(2.5 U/mL)与右旋糖酐蔗糖酶(2.0 U/mL)同时加入到蔗糖溶液中。在电动机械搅拌下反应24 h,将水浴温度升高至80 ℃,保温1 h终止反应。酶产物经滤纸过滤及抽滤多次除去杂质。随后将滤液煮沸10 min,再用滤纸抽滤2~3 次,得到澄清透明的滤液。产品用95%乙醇溶液进行分级醇沉,共进行3 级醇沉,收集第3级醇沉产品。静置若干小时得到右旋糖酐粉末,并将右旋糖酐粉末置于40 ℃烘箱中烘干收率为35.5%。将产品用高效液相色谱测定分子,收集mw5 400 Da的右旋糖酐备用[21]。
1.3.2 低分子质量右旋糖酐的氧化
称取右旋糖酐12 g,加48 mL水,充分溶解后,置于55 ℃恒温水浴进行氧化反应。氧化剂的用量如表1所示。NaBr和NaClO加入过程中用20%的氢氧化钠溶液调节pH 10,并维持反应pH 10左右,直到氧化剂加入完毕,加入时间控制在1 h左右。全部加入完毕后维持水浴温度55 ℃,反应3.5 h后用10%的盐酸将pH值调至6~7,终止反应。将氧化后的右旋糖酐透析处理24 h后,放在40 ℃烘箱中烘干。
表1 NaClO和NaBr的配比与用量
Table 1 Dosages of sodium hypochlorite and sodium hypochlorite and ratios between them

1.3.3 傅里叶变换红外光谱确定低分子质量右旋糖酐氧化后羧基基团
以KBr为固体稀释剂,压成薄片进行检测,具体方法为:首先分别精密称取1 mg的干燥右旋糖酐以及氧化后的样品于研钵中,在红外灯下均匀研磨,再精密称取100 mg干燥的KBr加入其中(KBr与样品的比例为100∶1),一起研磨约30 min,至二者完全混合;然后取适量的待测样品于模具中压片30 s,制成薄片待检测。预先用空白KBr样品扫背景,再将样品用傅里叶变换红外光谱仪扫描。
1.3.4 滴定法确定低分子质量右旋糖酐氧化后羧基含量
精密称取5 g氧化后的右旋糖酐,在搅拌条件下30 mL含有0.1 mol/L的盐酸溶液中,溶解30 min左右,用透析袋透析16 h,并用纯水多次洗涤直至氯离子完全除去。将透析处理后的样品40 ℃烘干48 h。烘干后的样品加入到600 mL的烧杯中,并用250 mL的纯水溶解,并煮沸15 min直到完全溶解。样品用0.1 mol/L的氢氧化钠溶液滴定,并用酚酞作为指示剂。空白对照溶解在30 mL的纯水中,同上处理[12]。羧基质量分数计算如下:

式中:C为NaOH标准液浓度/(mol/L);V为NaOH标准液在滴定终点时消耗的体积/mL;M为样品的质量/g。
1.3.5 高效液相色谱测量右旋糖酐氧化降解情况
蔗糖以及分子质量为5 400 Da的右旋糖酐用作对照品,高效液相色谱测量右旋糖酐氧化物样品和对照品的分子质量。色谱柱为TSKgel G-Oligo-PW 0008031,色谱条件为纯水做流动相,流速为0.6 mL/min,柱温为60 ℃。进样量为50 μL,每隔30 min进一次样。
1.3.6 右旋糖酐氧化物水溶性的测量
称取右旋糖酐氧化物20 mg溶解在0.4 mL,振荡使其充分溶解,然后在13 400×g离心2 min。之后将上层清液倒出,并烘干,将烘干后的样品精密称量其质量,用其质量除以样品质量得到水溶性[11]。
1.3.7 X射线衍射表征右旋糖酐以及右旋糖酐氧化物的晶体结构
取约30 mg干燥的产品进行研磨成细粉,用X射线衍射仪(XPert Pro MPD)对样品进行晶体结构表征,扫描条件为CuKα射线,Ni滤波。扫描速率和范围分别为4 °/min和0°~50°。
1.3.8 右旋糖酐及其氧化物的热分析
取约3 mg的干燥样品进行研磨成细粉,溶解在去6 μL离子水中,用热分析仪在氮气保护条件下测定其热重(thermogravimetry,TG)和差示扫描量热(diffrential scanning calorimeter,DSC)变化,升温速率为10 ℃/min,温度范围为35~700 ℃[22]。
1.3.9 核磁共振表征右旋糖酐及右旋糖酐氧化物结构
取少量氧化产物冻干成粉溶于0.6 mL重水中,在600MHz下用VNMRS600超导核磁共振波谱仪扫描检测13C核磁共振。
傅里叶变换红外光谱扫描完毕将数据以ASC格式保存,再用Origin软件绘图分析。低分子质量右旋糖酐氧化后羧基含量图采用Origin软件绘图分析。高效液相色谱图采用Origin软件绘图分析。X射线衍射将数据以ASC格式保存,再用Origin软件绘图分析。右旋糖酐及其氧化物的热分析将数据以ASC格式保存,再用Origin软件绘图分析。核磁共振图采用MestReNova软件分析。
用傅里叶变换红外光谱表征氧化后的右旋糖酐羧基基团,氧化右旋糖酐分别通过表1中实验1、2、3,NaBr用量为1.1 mmol/g,右旋糖酐用量为12 g。原始右旋糖酐与氧化后右旋糖酐的傅里叶变换红外光谱图见图1。在低分子质量右旋糖酐的红外谱图中,3 397 cm-1处的较宽峰是右旋糖酐分子间的氢键O—H伸缩振动峰,2 927 cm-1处是糖环上的饱和C—H伸缩振动峰[23],1 156 cm-1处是糖环上C—O吸收峰,1 015 cm-1处的尖峰可以证明右旋糖酐长链中α-1,6-糖苷键的存在[24]。图中所有峰都是以3 397 cm-1处的较宽峰为标准进行校准。氧化后的产物傅里叶变换红外光谱图与原始右旋糖酐十分相似,但是,图1中,氧化后的右旋糖酐在1 628 cm-1波长处出现了一处原始图中没有的吸收峰,此吸收峰为羧基中羰基的吸收峰,这个峰证实了羧基的产生。并且随着NaClO用量的增加,此峰强度明显增强。这说明了随着氧化剂用量的增加,氧化程度逐渐增加。可以看出,在氧化后的产物红外光谱中,1 156 cm-1处的糖环C—O吸收峰以及1 015 cm-1处的尖峰仍然存在,这也说明了氧化后产物仍保留大量的α-D-吡喃葡萄糖单元并且仍然是有一定聚合度的[15]。

图1 右旋糖酐及其氧化产物的傅里叶变换红外光谱图
Fig. 1 FTIR spectra of native and oxidized dextran
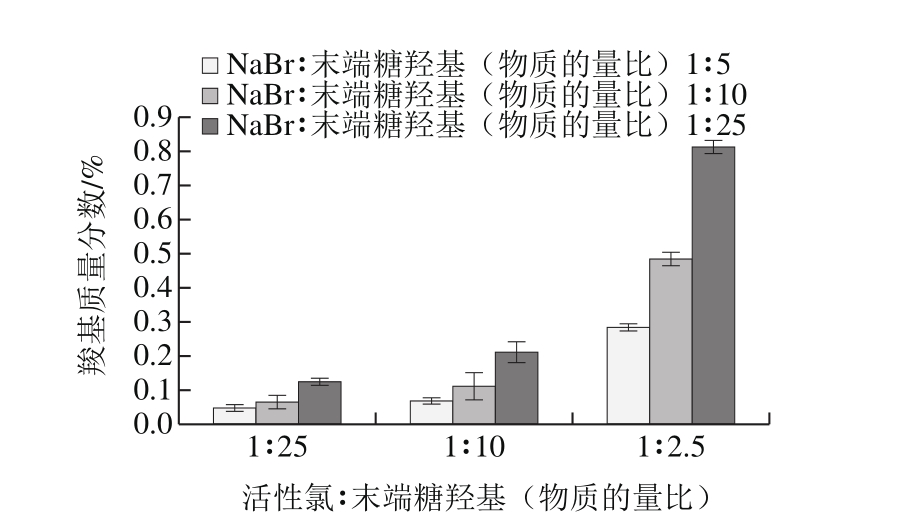
图2 不同NaClO和NaBr配比与用量得到右旋糖酐氧化物的羧基含量
Fig. 2 Effect of ratio between sodium hypochlorite and sodium
hypochlorite on the carboxyl group content of oxidized dextran
图2表明,随着氧化剂用量的增加,羧基含量也随之增加,羧基质量分数从0.05%增加至0.8%。NaClO和NaBr用量都会影响羧基含量。但是,NaClO用量对羧基含量的影响更为显著,当NaClO用量较低时,随着NaBr用量的影响并不是很明显,只有NaClO用量达到一定值时羧基含量随着NaBr用量的增加才十分显著。这是由于NaClO和NaBr在联合使用的过程中,NaBr是可以再生的[25],反应前后质量是几乎不变的。因此,NaBr用量对于氧化的程度即羧基含量的影响并不是很显著。
按照表1中的实验1、2、3(NaBr用量为1.1 mmol/g,右旋糖酐用量为12 g)对右旋糖酐氧化降解情况通过高效液相色谱的检测进行粗略的估计[17]。由图3可以看出,氧化的发生会使得右旋糖酐的糖苷链发生断裂,右旋糖酐分子发生降解,并且随着NaClO浓度的增加降解加剧。当NaClO用量为0.26 mmol/g时(羧基质量分数为0.05%),右旋糖酐氧化物的分子质量较高保留时间为10.006 min,稍有降解,但是降解程度较弱。当NaClO用量为0.52 mmol/g时(羧基质量分数为0.3%),保留时间延长至10.446 min,右旋糖酐降解加剧,但仍保留多糖单元聚合结构。当NaClO用量为2.08 mmol/g时(羧基质量分数为0.8%),保留时间为13.124 min,降解十分剧烈,聚合程度也显著减弱,并且有部分已经降解为寡聚糖。这说明随着NaClO用量增加,右旋糖酐降解剧烈,并且还会伴有寡聚糖的产生。
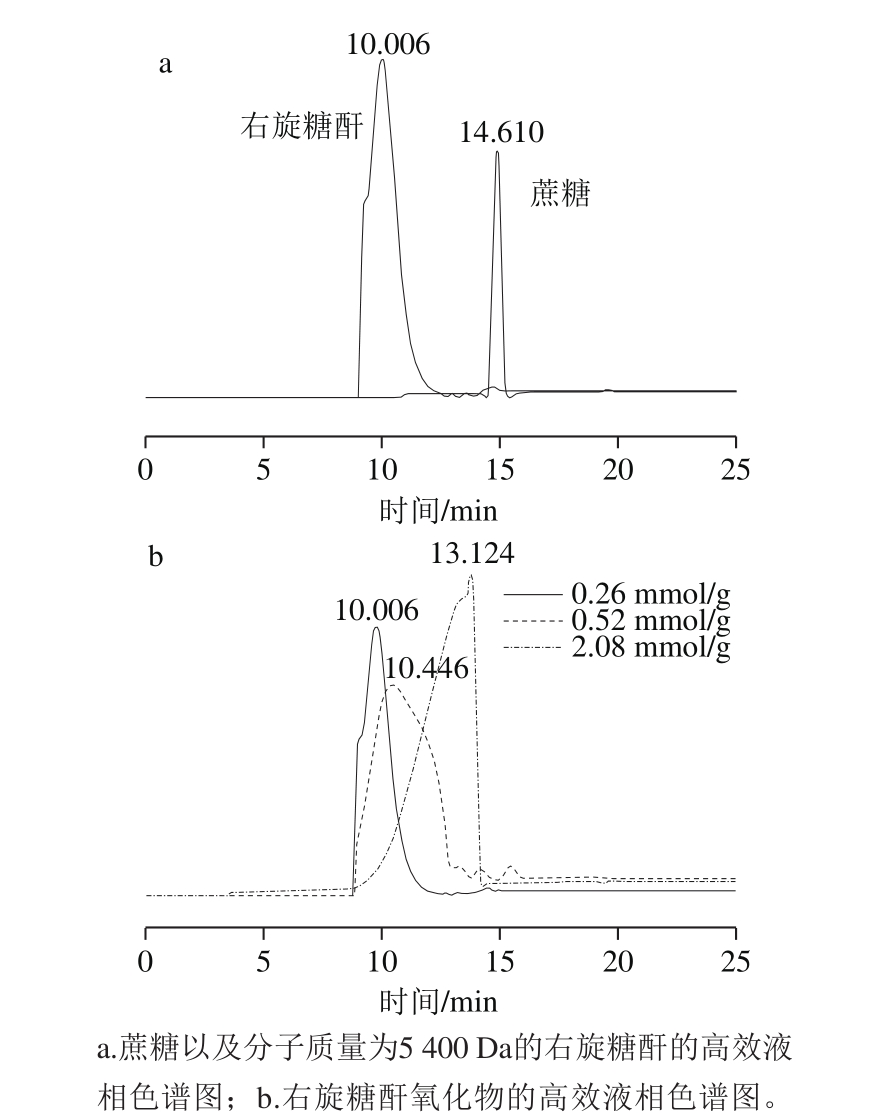
图3 旋糖酐氧化产物的分子质量分布图
Fig. 3 Molecular size distribution of oxidized dextran

图4 低分子质量右旋糖酐及其氧化产物的X射线衍射谱图
Fig. 4 XRD patterns of native and oxidized dextran
由图4可知,在原始的右旋糖酐晶体结构中,在2θ为17°处的吸收峰说明右旋糖酐为A-型晶体结构,并且除了结晶区之外还有无定型区[26-27]。氧化后的右旋糖酐的X射线衍射谱图与原始右旋糖酐谱图差异较大,2θ为17°处的吸收峰已经完全消失,这证实氧化会破坏右旋糖酐的晶体结构,这是由于右旋糖酐中羧基的引入减少了羟基的数量,而残留的羟基不足以形成分子间和分子内高度有序的晶体结构。在2θ为7°处的吸收峰(图4b)为氧化后右旋糖酐的结晶区,并且随着氧化程度的增加(即羧基质量分数的增加),吸收峰开始逐渐变得弥散(图4b~d),说明氧化的发生会降低结晶区比例,使得多晶结构向无定形转变。
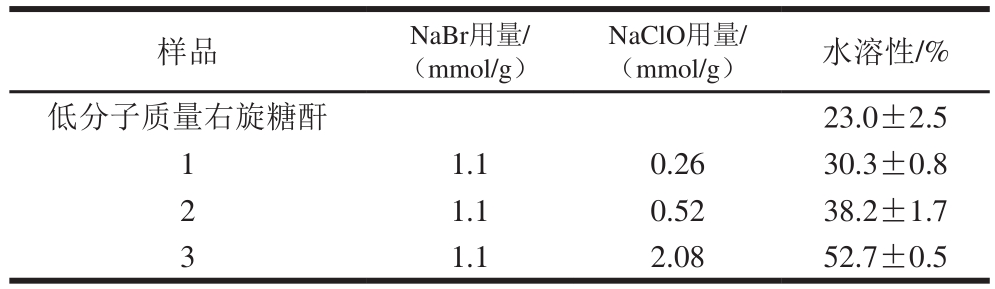
低分子质量右旋糖酐和不同氧化度的右旋糖酐氧化物在室温(25 ℃)水溶性测量结果见表2,原始的右旋糖酐和氧化后的右旋糖酐在水中都是可溶性的。但是由于原始的右旋糖酐具有较长的α-D-葡聚糖分子链以及较多氢键导致其在室温的条件下水溶性不是很好。较多的氢键结构很容易形成晶体结构,从而导致水分子难以渗透到右旋糖酐的分子内部。经过NaClO-NaBr的氧化,晶体结构被破坏,使得水分子的渗透变得容易,因此水溶性得到了较好的改善[27]。并且随着氧化程度的增加,羧基含量也随之增加,羧基作为亲水基团也能够提高其水溶性。而右旋糖酐水溶性的增加能够改善右旋糖酐在食品和药品等领域中的使用。
表2 右旋糖酐氧化物的水溶性
Table 2 Solubility of oxidized dextan
将低分子质量右旋糖酐及其氧化物烘干并达到质量恒定后,对其TG和DSC特性进行测试分析。图5a表明,右旋糖酐有3 个热质量损失阶段在35~700 ℃的温度变化范围内。第1阶段的热质量损失发生在38.5~276 ℃温度范围内质量损失为13.2%,是由于结合水的蒸发产生的。第2阶段的热质量损失发生在在276~335 ℃阶段质量损失52.3%,随着温度的升高右旋糖酐长链的发生了降解。当温度超过335℃后产生第3次热质量损失,这时右旋糖酐骨链会完全降解,残留物的剩余质量约为原质量的18.7%。氧化后的右旋糖酐产物也会发生3 次热质量损失,第1阶段的热质量损失发生在38~261 ℃温度范围内质量损失为20%,是由于结合水的蒸发产生的。第2阶段的热质量损失发生在在261~329 ℃阶段质量损失35.1%,随着温度的升高右旋糖酐长链的发生了降解,并且在这个过程中羧基基团也会发生降解。当温度超过329 ℃后产生第3次热质量损失,这时右旋糖酐骨链会完全降解,残留物的剩余质量约为32.7%。同时,从氧化产物的DSC曲线(图5b)可以看出,热流率随温度的升高出现一个明显的热吸收峰这与原始右旋糖酐的DSC曲线是完全一致的,但是得到氧化物的玻璃转化温度为281 ℃,而原始的右旋糖酐的玻璃转化温度为305 ℃。这是由于羧基基团的引入到右旋糖酐链上之后,取代了糖链上的羟基,这就破坏了右旋糖酐的分子间和分子内的氢键作用使得右旋糖酐的结构变得松散,这种松散的结构更容易发生热降解也就导致为玻璃转化温度稍有降低[28]。从右旋糖酐及其氧化物的TG和DSC数据分析结果表明右旋糖酐氧化产物具有较好的热稳定性。

图5 原始右旋糖酐与氧化后右旋糖酐的热分析图
Fig. 5 TG and DSC curves of native and oxidized dextran
图6a为原始右旋糖酐的核磁共振碳谱图,其中C1的δ为97.62,C2~C5的δ依次为73.15、71.22、69.36和69.96。C6为葡萄糖残基的异头碳,其δ为66.32[29]。如图6所示,氧化产物的核磁图谱与原始右旋糖酐的核磁图谱葡萄糖环上碳的化学位移基本一致。但是,在δ为170~180处出现了羧基碳的信号峰[30]。并且随着氧化剂用量增加,化学位移增强,这与红外的结果是一致的。并且随着δ为170~180处羧基碳的信号峰的增加,C1的信号峰是逐渐减弱的,这说明氧化反应发生在了C1的半缩醛羟基上。图6b~c都只是出现了单一的羧基碳的化学位移信号峰,而在图6d中,在δ170附近,出现了多个羧基碳的信号峰,这说明用量NaClO氧化条件下葡萄糖碳环上不止一处碳上的羟基被氧化为羧基。因此,产物的结构也不再单一。
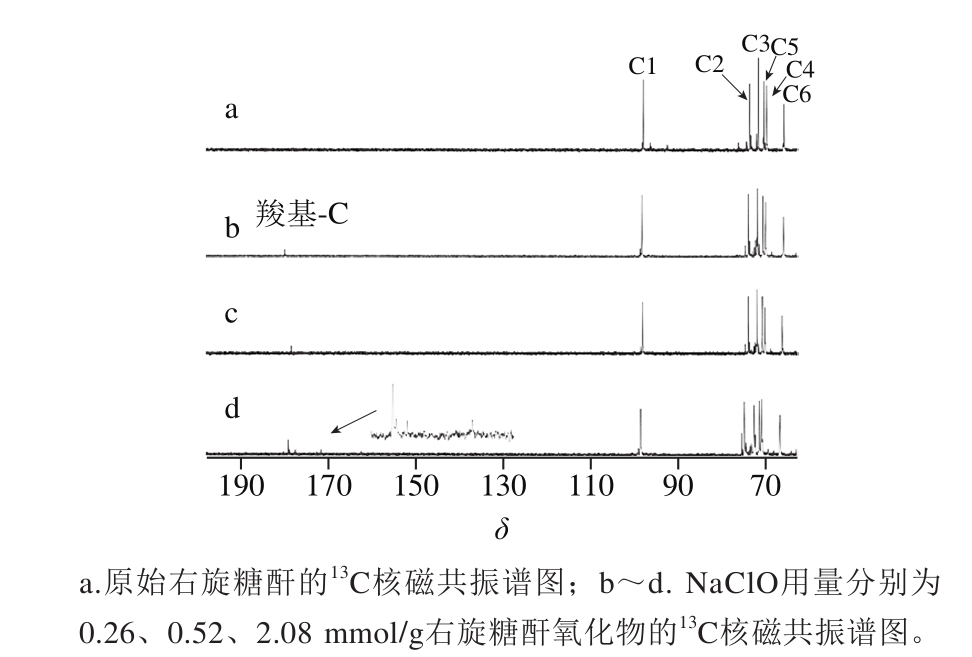
图6 低分子质量右旋糖酐及其氧化产物的核磁共振13C核磁共振谱图
Fig. 613C NMR spectra of native and oxidized dextran
本研究证实了NaClO-NaBr氧化体系能够在碱性条件下将右旋糖酐中的羟基氧化为羧基。滴定结果表明,羧基质量分数在0.05%~0.8%之间。NaClO用量以及NaBr用量对羧基的含量都有影响。但是,NaClO用量影响更为显著。高效液相色谱结果显示,右旋糖酐在氧化的过程中会发生降解。当右旋糖酐的氧化程度较低时(NaClO用量为0.26 mmol/g)羧基质量分数为0.05%时,氧化后的右旋糖酐几乎不发生降解。但是,当羧基质量分数为0.3%时(NaClO用量为0.52 mmol/g),氧化后的右旋糖酐保留多糖单元聚合结构。当右旋糖酐氧化物的羧基质量分数达到0.8%时(NaClO用量为2.08 mmol/g),右旋糖酐降解剧烈,有寡聚糖产生。因此,通过氧化过程中氧化剂用量的改变,可以使得氧化后的右旋糖酐有不同的羧基含量以及不同聚合长度的糖苷链。X射线衍射谱图表明,氧化的发生会降低结晶区比例,使得多晶结构向无定形转变。水溶性测定结果和热分析结果显示,氧化后的右旋糖酐水溶性得到了改善并且仍然具有较好的热稳定性。根据核磁共振碳谱的检测结果可知,当NaClO用量为0.26 mmol/g和0.52 mmol/g时,氧化会使得葡萄糖环打开,并将半缩醛羟基氧化生成羧基。但是,当NaClO用量为2.08 mmol/g,氧化部位不再单一。根据核磁和红外结果,氧化主要产生羧基,并未检测出醛基。
参考文献:
[1] KOTHEARI D, GOYAL A. Structural characterization of enzymatically synthesized dextran and oligosaccharides from Leuconostoc mesenteroides NRRL B-1426 dextransucrase[J].Biochemistry Biokhimiia, 2013, 78(10): 1164-1170. DOI:10.1134/S0006297913100118.
[2] 任亮, 张洪斌, 胡雪芹,等. 基于右旋糖酐蔗糖酶转糖基作用的槲皮素葡萄糖苷的合成研究[J]. 生物学杂志, 2014(5): 93-98.DOI:10.3969/j.issn.2095.1736.2014.05.093.
[3] HAMMOND B F. Dextran production by a human oral strain of Lactobacillus casei[J]. Archives of Oral Biology, 1969, 14(8):879-890. DOI:10.1016/0003-9969(69)90266-0.
[4] TAKAGI K, IOROI R, TAI U, et al. Purification and some properties of dextransucrase from Streptococcus bovis 148[J]. Journal of Fermentation and Bioengineering, 1994, 77(5): 551-553. DOI:10.1007/s00253-005-0082-y.
[5] GALLE S, SCHWAB C, BELLO F D, et al. Influence of in-situ,synthesized exopolysaccharides on the quality of gluten-free sorghum sourdough bread[J]. International Journal of Food Microbiology, 2012,155(3): 105-112. DOI:10.1016/j.ijfoodmicro.2012.01.009.
[6] LEATHERS T D. Dextran[J]. Biopolymers: Polysaccharides I,Polysaccharides from Prokaryotes, 2002, 5: 299-321.DOI:10.1002/3527600035.bpol5012.
[7] DE BELDER A N. Medical applications of dextran and its derivatives[J]. Polysaccharides in Medicinal Applications, 1996: 505-523. DOI:10.1007/978-1-4615-3858-5_29.
[8] HYON S H, NAKAJIMA N, SUGAI H, et al. Low cytotoxic tissue adhesive based on oxidized dextran and epsilon-poly-L-lysine[J].Journal of Biomedical Materials Research Part A, 2014, 102(8): 2511-2520. DOI:10.1002/jbm.a.34923.
[9] GRACZYKOWSKI B, DOBEK A. Iron-dextran complex:geometrical structure and magneto-optical features[J]. Journal of Colloid & Interface Science, 2011, 363(2): 551-556. DOI:10.1016/j.jcis.2011.07.080.
[10] LONDON E. The molecular formula and proposed structure of the iron-dextran complex, IMFERON[J]. Journal of Pharmaceutical Sciences, 2004, 93(7): 1838-1846. DOI:10.1002/jps.20093.
[11] KATO Y, KAMINAGA J I, MATSUO R, et al. Oxygen permeability and biodegradability of polyuronic acids prepared from polysaccharides by TEMPO-mediated oxidation[J]. Journal of Polymers & the Environment, 2005, 13(3): 261-266. DOI:10.1007/s10924-005-4760.
[12] SANGSEETHONG K, TERMVEJSAYANON N, SRIROTH K.Characterization of physicoche- mical properties of hypochlorite and peroxide-oxidized cassava starches[J]. Carbohydrate Polymers, 2010,82(2): 446-453. DOI:10.1016/j.carbpol.2010.05.003.
[13] 罗发兴, 扶雄, 黄强, 等. 次氯酸钠轻度氧化淀粉的性质及交联机理[J]. 华南理工大学学报(自然科学版), 2006, 34(8): 79-83.
[14] ISBeELL H S, FRUSH H L. Mechanisms for hydroperoxide degradation of disaccharides and related compounds[J]. Carbohydrate Research, 1987, 161(2): 181-193. DOI:10.1016/S008-6215(00)90076-4.
[15] HAO J, XU S, XU N, et al. Impact of degree of oxidation on the physicochemical properties of microcrystalline cellulose[J].Carbohydrate Polymers, 2017, 155: 483-490. DOI:10.1016/j.carbpol.2016.09.012.
[16] DING B, YE Y Q, CHENG J, et al. TEMPO-mediated selective oxidation of substituted polysaccharides: an efficient approach for the determination of the degree of substitution at C-6[J]. Carbohydrate Research, 2008,343(18): 3112-3116. DOI:10.1016/j.carres.2008.09.005.
[17] KOMULAINEN S, VERLACKT C, PURSIAINEN J, et al. Oxidation and degradation of native wheat starch by acidic bromated in water at room temperature[J]. Carbohydrate Polymers, 2013, 93(1): 73-80.DOI:10.1016/j.carbpol.2012.06.001.
[18] ZHANG H, HU Y, ZHU C, et al. Cloning, sequencing and expression of a dextransucrase gene (dexYG) from Leuconostoc mesenteroides[J].Biotechnology Letters, 2008, 30(8): 1441-1446. DOI:10.1007/s10529-008-9711-8.
[19] ZHANG H, WU D, HUANG L, et al. Purification, characterization of an extracellular dextranase from an isolated Penicillium sp.[J].Acta Microbiologica Sinica, 2011, 51(4): 495-503. DOI:10.1016/j.carpol.2018.02.009.
[20] 张宇琪, 张洪斌, 甘微苇, 等. 右旋糖酐酶研究进展[J]. 生物工程学报, 2015, 31(5): 634-647. DOI:10.13345/j.cjb.140475.
[21] GAN W, ZhANG H, ZHANG Y, et al. Biosynthesis of oligodextrans with different Mw by synergistic catalysis of dextransucrase and dextranase[J]. Carbohydrate Polymers, 2014, 112(21): 387-395.DOI:10.1016/j.carbpol.2014.06.018.
[22] LI R H, ZENG T, WU M, et al. Effects of esterification on the structural, physicochemical, and fl occulation properties of dextran[J].Carbohydrate Polymers, 2017, 174: 1129-1137. DOI:10.1016/j.carbpol.2017.07.034.
[23] NIKONERNKON A, SUSHKO N I, ZHBANKOV R G, et al.Investigation of stretching vibrations of IR spectra deconvolution[J].Biopolymers, 2000, 57(4): 257-262. DOI:10.1002/1097-0282.
[24] SHINGEL K I. Determination of structural peculiarities of dexran, pullulan and γ-irradiated pullulan by fourier-transform IR spectroscopy[J]. Carbohydrate Research, 2002, 337(16): 1445-1451.DOI:10.1016/S0008-6215(02)00209-4.
[25] KATO Y, MATSUO R, ISOGAI A. Oxidation process of watersoluble starch in TEMPO-mediated system[J]. Carbohydrate Polymers,2003, 51(1): 69-75. DOI:10.1016/S0144-8617(02)00159-5.
[26] WANG J P, YUAN S J, WANG Y, et al. Synthesis, characterization and application of a novel starch-based flocculant with high flocculation and dewatering properties[J]. Water Research, 2013,47(8): 2643-2648. DOI:10.1016/j.watres.2013.01.050.
[27] LI R H, ZHANG H B, HU X Q, et al. An efficiently sustainable dextran-based flocculant: synthesis, characterization and flocculation[J]. Chemosphere, 2016, 159: 342-350. DOI:10.1016/j.chemosphere.2016.06.010.
[28] LI R H, ZENG T, WU M, et al. Effects of esterification on the structural, physicochemical, and fl occulation properties of dextran[J].Carbohydrate Polymers, 2017, 174: 1129-1137. DOI:10.1016/j.carbpol.2017.07.034.
[29] MOHANAD B, LAGNIKA C, OCEN D, et al. Separation and characterization of dextran extracted from deteriorated sugarcane[J].International Journal of Biological Macromolecules, 2013, 59: 246-254. DOI:10.1016/j.ijbiomac.2013.04.046.
[30] HAO J, LU J, XU N, et al. Specific oxidation pattern of soluble starch with TEMPO-NaBr-NaClO system[J]. Carbohydrate Polymers, 2016,146: 238-244. DOI:10.1016/j.carbpol.2016.03.040.
Oxidative Modification of Low Molecular Mass Dextran and Physicochemical Properties of Oxidized Dextran
CHEN Shuang1, ZHANG Xinyu2, WU Hao1, HU Xueqin1,*
(1. School of Biological and Medical Engineering, Hefei University of Technology, Hefei 230000, China;2. The Middle School Affiliated to Hefei University of Technology, Hefei 230000, China)
Abstract:In the current work, low molecular mass dextran (with a molecular mass of 5 400 Da) was oxidized by NaClONaBr in a basic environment. The content of carboxyl groups gradually increased from 0.05% to 0.8% with increasing oxidant dosage. HPLC analysis indicated that dextran was degraded during the course of oxidation. Moreover, the degree of oxidation gradually increased with the increase of NaClO dosage, whereas the oxidized products were partly degraded into oligosaccharides when the dosage of NaClO was excessive. During the oxidation process the crystalline structures were gradually transformed into amorphous states. Structural characterization by13C nuclear magnetic resonance (NMR)demonstrated that NaClO-NaBr oxidized the hemiacetal hydroxyl groups at the C1 position and other C positions of the glucose ring into carboxyl groups. This modification improved dextran solubility and the oxidized dextran exhibited good thermal stability. The oxidation of the hydroxyl groups of dextran into carboxyl groups under basic condition and the resulting changes in the physicochemical and structural properties of dextran provide a foundation for the oxidative modification of polysaccharides.
Keywords:dextran; polysaccharides; oxidation; physicochemical properties
CHEN Shuang, ZHANG Xinyu, WU Hao, et al. Oxidative modification of low molecular mass dextran and physicochemical properties of oxidized dextran[J]. Food Science, 2018, 39(20): 13-19. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820003. http://www.spkx.net.cn
引文格式:陈爽, 张心钰, 吴昊, 等. 低分子质量右旋糖酐的氧化改性及其理化特性[J]. 食品科学, 2018, 39(20): 13-19. DOI:10.7506/spkx1002-6630-201820003. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0013-07
文献标志码:A
中图分类号:Q81
DOI:10.7506/spkx1002-6630-201820003
*通信作者简介:胡雪芹(1975—),女,副教授,博士,研究方向为生物制药与酶工程。E-mail:huxq@hfut.edu.cn
第一作者简介:陈爽(1992—),女,硕士研究生,研究方向为生物制药。E-mail:1046595670@qq.com
基金项目:国家自然科学基金面上项目(81573399)
收稿日期:2018-03-01