
图1 PV纯化过程的SDS-PAGE分析(a)及PV的
Western-blotting鉴定(b)
Fig. 1 SDS-PAGE analysis (a) and Western-blotting identi fi cation of puri fi ed PV (b)
杨汝晴1,林灵海1,万楚君1,陈玉磊1,张凌晶1,2,曹敏杰1,2,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361102)
摘 要:通过建立鱼类主要过敏原小清蛋白(parvalbumin,PV)磷酸化反应的条件,研究磷酸化对PV的抗原性及结构影响。将PV和葡萄糖-6-磷酸二钠盐(D-glucose-6-phosphate disodium salt hydrate,G6P-Na2)混合,在不同质量比、反应时间以及反应温度条件下进行干法磷酸化反应。采用Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和Dot-blotting检验其聚合类型以及抗原性变化。通过扫描电镜对聚合物的微观结构进行分析,利用圆二色谱仪和ANS探针法分析磷酸化产物的二级结构和疏水性变化。结果显示,在PV与G6P-Na2质量比为1∶4、反应温度80 ℃、反应时间80 min条件下生成的磷酸化产物的抗原性最低。磷酸化反应后,产物呈现聚集状态,其二级结构变化较为明显,疏水性明显提高。磷酸化反应对蛋白结构的改变可能是影响PV抗原性降低的主要原因。
关键词:小清蛋白;葡萄糖-6-磷酸二钠盐;磷酸化反应;抗原性;二级结构
鱼类含有丰富的优质蛋白质和不饱和脂肪酸,是重要的食品原料。但是,鱼类作为八大食物过敏原之一,在易感人群中会引起严重的IgE介导的不良反应[1]。鱼类过敏的主要症状包括皮肤系统红疹、消化道腹泻等,严重时甚至会威胁生命。据报道,美国有5.9%的人对海鲜过敏,其中0.4%的人群对鱼类产生严重过敏反应[2];在澳大利亚,儿童对鱼过敏非常普遍,有三分之一的儿童至少对2 种鱼类有临床反应[3]。实际上,鱼类过敏不仅发生在西方国家,在亚洲国家也有类似问题。据报道[4],菲律宾、新加坡和泰国的儿童对鱼类过敏率分别为2.29%、0.26%和0.29%。最近一项对我国珠三角地区过敏患者血清中各食物变应原进行检测的研究表明,有10.3%的样本对鱼类呈现阳性反应[5]。
鱼类过敏严重影响着致敏人群的生活质量,通过不同的加工手段降低鱼类产品的致敏性已经受到越来越多人的关注。鱼类主要过敏原为小清蛋白[6](parvalbumin,PV)。PV是一种Ca2+结合的水溶性蛋白,分子质量约为12 ku,等电点在3.9~5.5之间,具有耐热、耐酶解等特点[7]。鱼糜制品加工过程中,需对鱼肉进行漂洗以去除蛋白酶等水溶性蛋白。漂洗水中富含PV,对漂洗水蛋白的回收利用需要考虑如何降低PV的过敏原性。由于PV良好的稳定性,一般的加工方式,如蒸煮、烘烤、油炸,都很难在根本上消除其致敏性[8],因此,寻求一种能有效降低PV致敏性的方法显得尤为重要。
磷酸化反应是一种能有效改善食物蛋白功能特性的方法[9],该方法通过引入带有负电荷的磷酸基团,对蛋白的疏水性[10]、凝胶特性[11]、乳化性[12]产生显著影响。Enomoto等[13]在干热条件下将牛血清白蛋白和焦磷酸盐反应,结果显示,磷酸化反应能有效降低牛血清白蛋白的IgG结合活性。Aoki等[14]用葡萄糖-6-磷酸通过美拉德反应实现乳球蛋白质的磷酸化。Kato等[15]用葡萄糖-6-磷酸对卵清蛋白进行磷酸化,结果表明磷酸化能显著改善卵清蛋白的溶解性、热稳定性和乳化性。
本研究以鲢鱼PV为对象,采用葡萄糖-6-磷酸二钠盐(D-glucose-6-phosphate disodium salt hydrate,G6P-Na2)对其进行磷酸化改性,确定磷酸化反应条件,分析磷酸化反应对鲢鱼PV的蛋白结构和抗原性的影响。通过获得的磷酸化方案,使鲢鱼PV的抗原性得到有效降低,以期为低致敏性鱼类制品的开发提供理论依据。
鲜活白鲢鱼购于厦门市集美菜市场。
G6P-Na2 上海Macklin生化科技有限公司;ECL底物 美国Thermo Scientific公司;三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethane,Tris)(分析纯) 青岛福林生物化学公司;β-巯基乙醇(分析纯) 北京Solarbio科技有限公司;DEAESepharose 美国GE Healthcare公司;牛血清蛋白、十二烷基硫酸钠、丙烯酰胺(均为分析纯) 美国Bio-Rad公司;辣根过氧化酶标记的兔抗鼠IgG 丹麦Dako公司;抗鲢PV单克隆抗体为本实验室制备;其他试剂如无特殊说明均为分析纯。
Avanti J-26SXP高速冷冻离心机 美国Beckman公司;Infinite M200 PRO多功能酶标仪 美国Tecan公司;FD-1C-80冷冻干燥机 北京博医康实验仪器有限公司;G:BOX凝胶成像仪 美国Synegene公司;Fluor Chem Q化学发光荧光成像仪 美国Alpha Innotech公司;Chirascan圆二色谱仪 美国Applied Photophysics公司;Phenom-World BV扫描电子显微镜 美国Phenom公司。
1.3.1 PV的制备
鲢鱼PV粗提取参照汪宁等[16]的方法略加修改。鲢鱼即杀后取肌肉、切碎,将其在3 倍体积的20 mmol/L Tris-HCl(pH 7.5)缓冲液中组织捣碎,4 ℃、15 000 r/min离心30 min,所得上清液即为PV粗提取物。
所得粗提物参照Kobayashi等[17]的方法,将粗提物100 ℃加热20 min,离心,所得上清液即为PV热提取物。PV的纯化参考Liu Guangming等[18]的方法略作修改,将PV热提取物利用60%~100%饱和度的硫酸铵盐析得沉淀,溶于20 mmol/L Tris-HCl(pH 7.5)缓冲液中,透析,上样到DEAE-Sepharose阴离子交换柱,用20 mmol/L Tris-HCl(pH 7.5)缓冲液以0.6 mL/min流洗,收集未吸附部分。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分析蛋白纯度。
1.3.2 PV的磷酸化条件确定
采用干热法对PV进行磷酸化改性。用含有1 mmol/L NaHCO3的磷酸盐缓冲液(phosphate buffer saline,PBS)(20 mmol/L,pH 7.0)将G6P-Na2配成溶液,与PV混合,在-80 ℃预冻8 h后,在真空度30 Pa条件下冷冻干燥48 h。
质量比:取PV溶液和G6P-Na2溶液,设置PV质量浓度为2 mg/mL,PV与G6P-Na2质量比分别为1∶0.25、1∶0.5、1∶1、1∶2、1∶4、1∶8和1∶16,于80 ℃进行干热法磷酸化反应,反应时间为80 min。
反应温度:配制PV与G6P-Na2质量比为1∶4的样品,然后设置反应温度分别为30、40、50、60、70、80、90、100 ℃,进行干热法磷酸化反应,反应时间为80 min。
反应时间:配制PV与G6P-Na2质量比为1∶4的样品,设置反应时间分别为20、40、60、80、160 min,进行干热法磷酸化反应,反应温度为80 ℃。
将干热磷酸化反应产物复溶,用PBS(20 mmol/L,pH 7.0)充分透析,以去除溶液中未反应的G6P-Na2;通过测定透析之后反应产物在波长420 nm处的吸光度判定反应产物的褐变度;蛋白迁移状态通过Tricine-SDSPAGE分析。
1.3.3 磷酸化PV浓度测定
采用Bio-Rad蛋白检测试剂盒测定,将样品与染料室温孵育5 min,测定在波长595 nm处的吸光度。以牛血清蛋白为标准蛋白制备标准曲线。每个样品重复测定3 次。
1.3.4 Tricine-SDS-PAGE测定
参考Schägger[19]的方法进行。浓缩胶4%,夹层胶10%,分离胶16%。电泳结束后,用考马斯亮蓝染色,脱色液脱色后,凝胶成像系统记录结果。
1.3.5 免疫印记
Western-blotting是通过半干转膜方式将蛋白从SDSPAGE胶转移到NC膜,以5%的脱脂奶室温封闭1.5 h,TBS-T清洗5 次后,以抗鲢PV单克隆抗体为一抗室温孵育1.5 h。TBS-T清洗5 次后,以辣根过氧化酶标记的兔抗鼠IgG为二抗室温孵育1.5 h。TBS-T清洗5 次后,加入ECL底物孵育2 min,在化学发光荧光成像系统上记录结果。
Dot-blotting是取磷酸化反应前后样品各1.5 μL点样NC膜。封闭液为5%的脱脂奶,室温封闭1.5 h。之后,一抗、二抗的操作同Western-blotting。TBS-T清洗5 次后,加入ECL底物孵育2 min,在化学发光荧光成像系统上记录结果。
1.3.6 圆二色谱分析
采用圆二色谱法分析比较PV磷酸化反应前后的二级结构变化[20]。操作参数[21]:操作温度为室温,扫描波长范围190~260 nm,扫描速率50 nm/min,带宽1 nm,响应时间2 s,以PBS作为空白对照。
1.3.7 扫描电子显微镜观察
将磷酸化反应前后的样品固定,均匀铺在电镜样品台上,快速冷冻后,放入载物台调节最佳视野和放大倍数进行观察,记录结果。
1.3.8 表面疏水性测定
参照Tong Ping等[22]的方法略作修改,采用ANS荧光探针法对磷酸化后蛋白的疏水性进行检测。将样品用缓冲液稀释到0.1 mg/mL。取4 μL 8 mmol/L的ANS与200 μL的蛋白液混合,常温反应10 min。反应后,在激发波长为385 nm,发射波长为400~600 nm,测量产物的相对荧光值。

图1 PV纯化过程的SDS-PAGE分析(a)及PV的
Western-blotting鉴定(b)
Fig. 1 SDS-PAGE analysis (a) and Western-blotting identi fi cation of puri fi ed PV (b)
将鲢鱼肉捣碎、离心获得总粗提蛋白(图1a,泳道1),将粗提蛋白加热处理获得较高纯度PV提取物(图1a,泳道2),经过硫酸铵盐析、DEAE-Sepharose柱层析后PV得到高度纯化,分子质量为12 ku左右(图1a,泳道3)。采用抗鲢PV单克隆抗体作为一抗,进行Western-blotting分析,结果如图1b所示,抗体与蛋白发生特异性的结合反应,证实纯化蛋白为PV。
2.2.1 样品质量比对磷酸化反应的影响
由图2可知,加热对照组蛋白在25 ku处有细微条带,推测是因为蛋白加热而形成了二聚体。与对照组相比,PV与G6P-Na2质量比为1∶0.25~1∶16,反应产物分子质量变化随着G6P-Na2添加比例的增加而增加。蛋白质条带出现了明显的多聚体以及迁移阻滞现象,且随着迁移阻滞程度的增加,褐变度也依次提高。当质量比为1∶4时,迁移阻滞程度达到最大值。故选择PV与G6P-Na2质量比1∶4为反应最适比例。
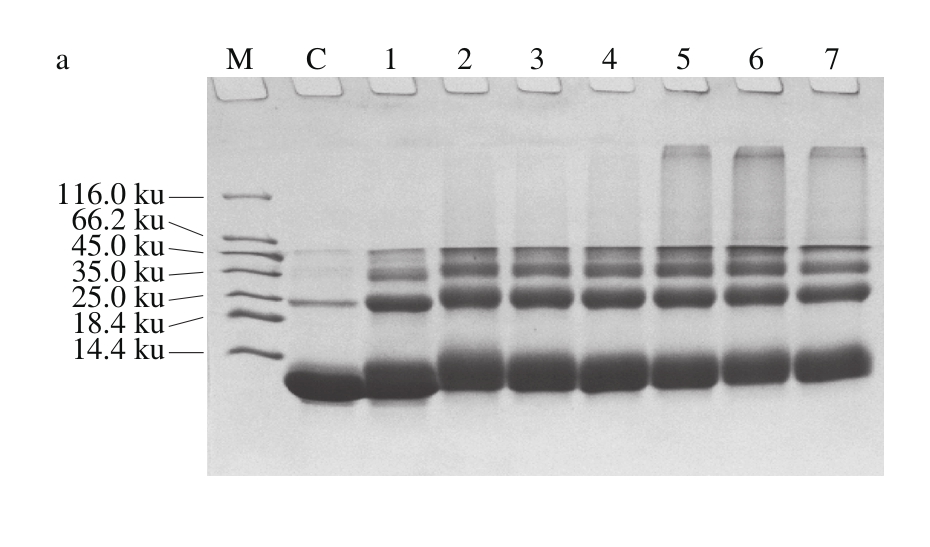
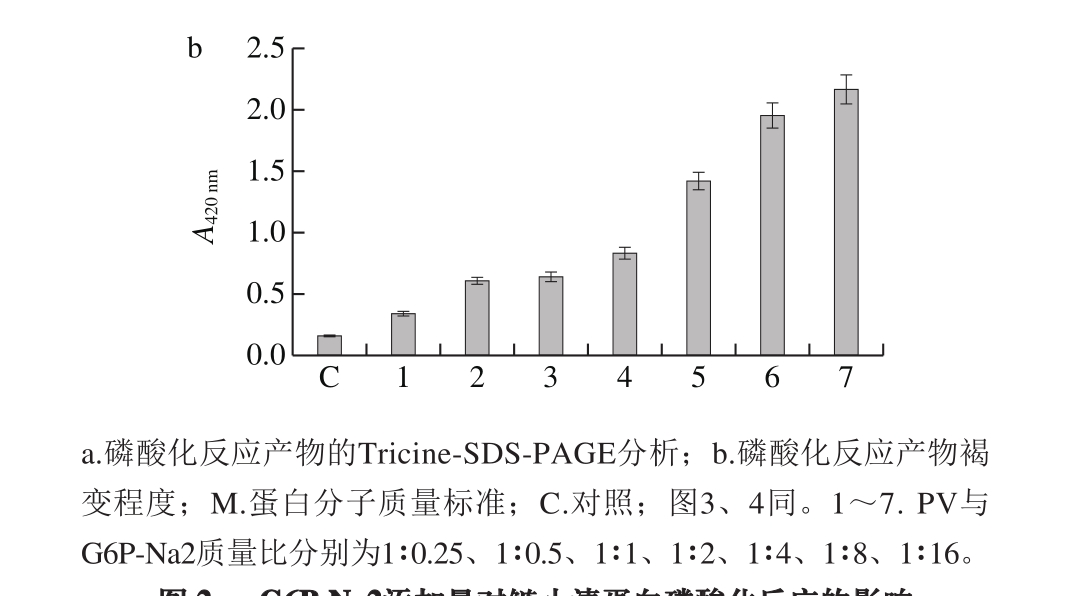
图2 G6P-Na2添加量对鲢小清蛋白磷酸化反应的影响
Fig. 2 Effect of G6P-Na2 addition on the phosphorylation of parvalbumin
2.2.2 反应温度对磷酸化反应的影响
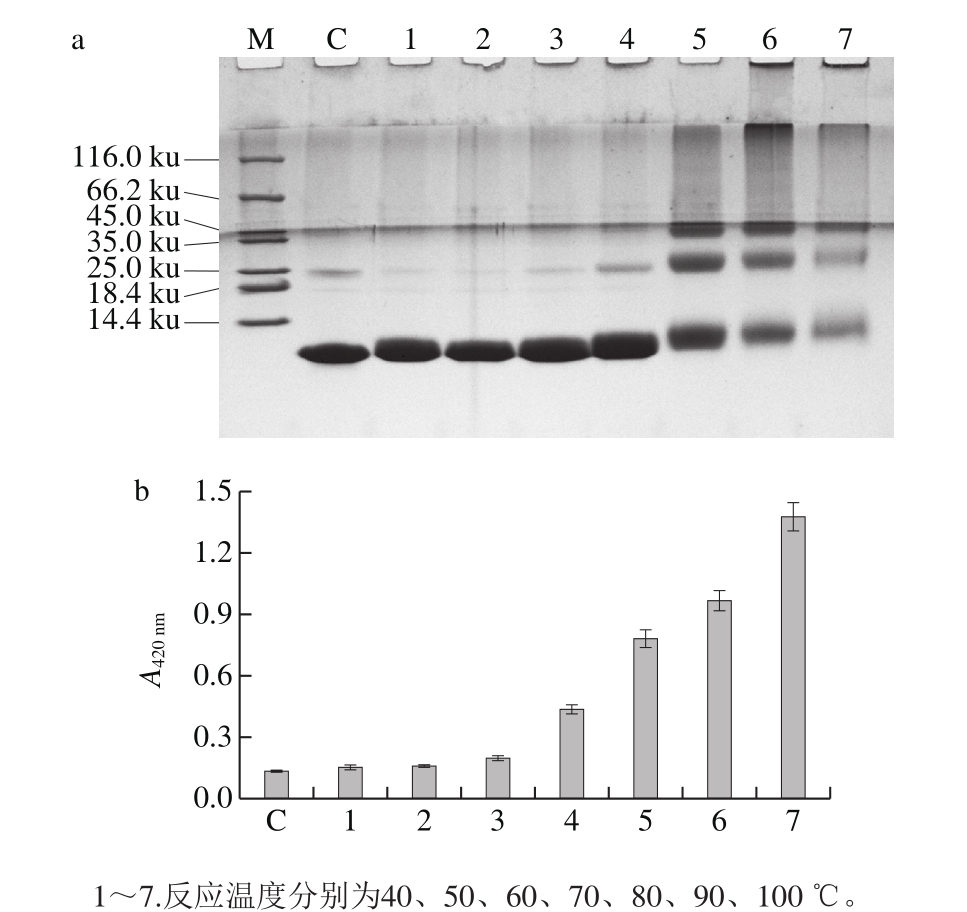
图3 反应温度对鲢小清蛋白磷酸化反应的影响
Fig. 3 Effect of heating temperature on the phosphorylation of parvalbumin
如图3所示,当反应温度在60 ℃以下,蛋白在SDSPAGE中的迁移率没有受到影响,褐变度也没有变化。但是,随着温度的进一步升高,蛋白多聚体形成、迁移阻滞现象产生,褐变度也随着温度的升高呈现上升趋势。在80 ℃条件下,蛋白多聚体条带加深并逐步趋于稳定,而高分子质量聚合物的生成导致产物溶解性降低。综合考虑,选择80 ℃为反应温度。
2.2.3 反应时间对磷酸化的影响
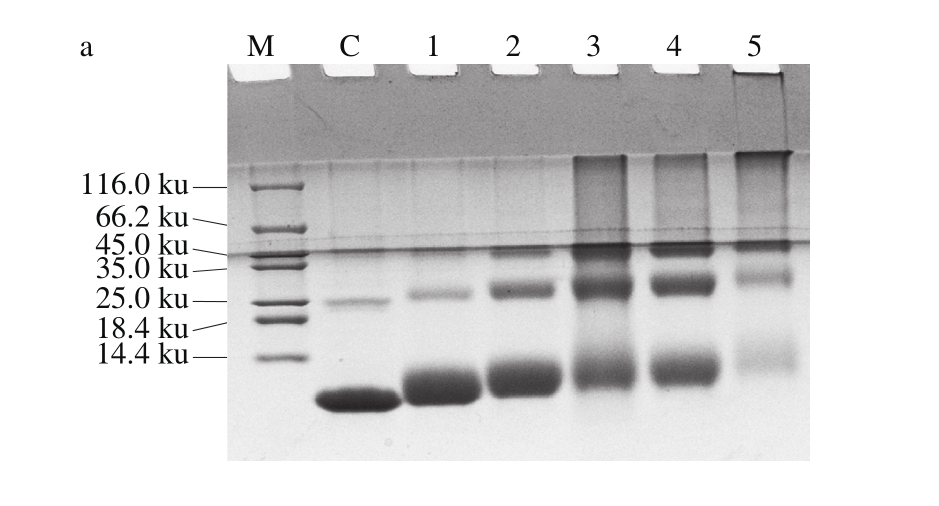

图4 反应时间对鲢小清蛋白磷酸化反应的影响
Fig. 4 Effect of heating time on the phosphorylation of parvalbumin
已有研究表明,美拉德反应时间影响过敏原的免疫活性[23]。如图4所示,随着反应时间的延长,电泳的迁移阻滞现象明显,产物的褐变度也呈现逐渐增加的趋势,反应20 min时已有25 ku的条带出现,40 min时45 ku左右的条带出现,80 min时条带迁移达到最大值。而加热时间在160 min和320 min时蛋白产生沉淀,溶解度降低,故选择80 min为反应时间。
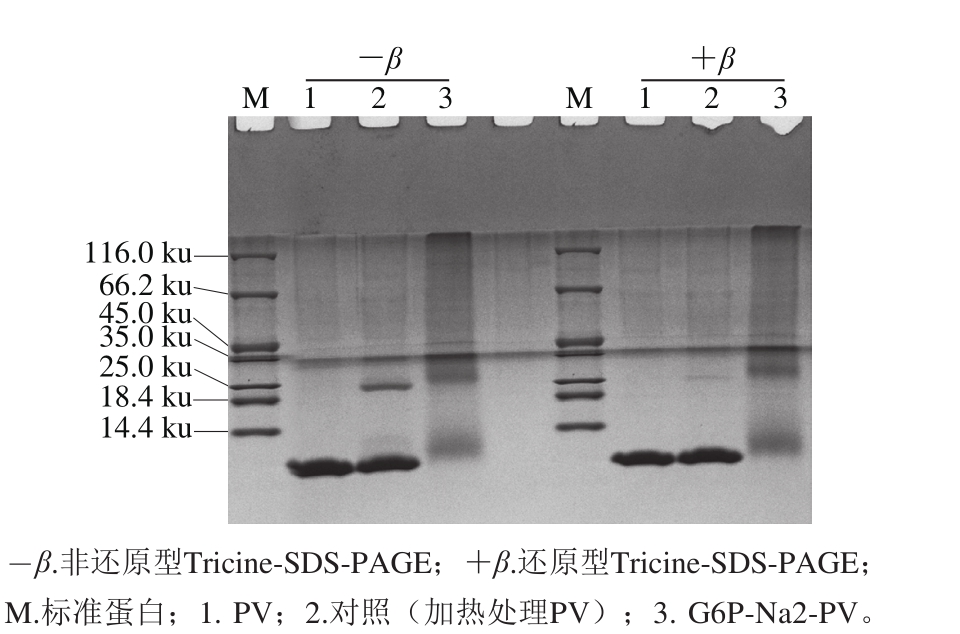
图5 磷酸化反应产物的Tricine-SDS-PAGE分析
Fig. 5 Tricine-SDS-PAGE analysis of phosphorylated PV
如图5所示,与对照组相比,磷酸化反应产物在12 ku处的目标条带基本消失,蛋白条带迁移率发生了明显的降低,条带出现扩散,有大量的二聚体、多聚体形成(图5a,泳道3)。当样品中加入β-巯基乙醇后,PV呈现单一条带,磷酸化反应产物的聚合情况基本没有发生变化(图5b,泳道3),说明PV与G6P-Na2发生磷酸化反应后,蛋白发生共价交联。Bu Guanhao等[24]曾报道大豆球蛋白11S与乳糖加热处理,通过SDS-PAGE确定糖化样品与11S相比迁移率降低,蛋白相对分子质量增加,11S与乳糖共价结合。
进一步采用扫描电镜观察PV在磷酸化反应前后聚合情况的改变。如图6所示,蛋白未经修饰前呈现稀松分散状态,当PV发生磷酸化反应后,形成蛋白纤维相互交联的网状结构,微观结构变化明显。
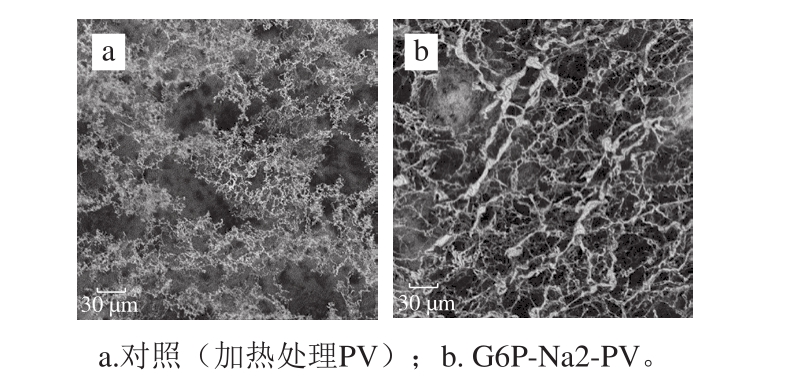
图6 磷酸化反应产物的扫描电镜分析(2 000×)
Fig. 6 SEM analysis of phosphorylated PV (2 000 ×)
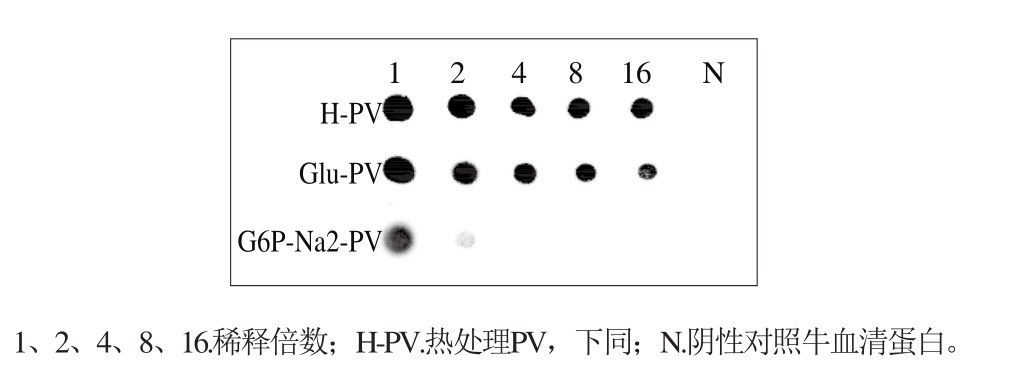
图7 磷酸化反应对PV抗原性的影响
Fig. 7 Inf l uence of phosphorylation reaction on PV antigenicity
利用Dot-blotting对磷酸化样品抗原性变化进行研究,如图7所示,与对照Glu-PV和H-PV稀释16 倍时仍具有IgG结合活性相比,与G6P-Na2反应后的产物(G6P-Na2-PV)即便仅稀释2 倍,其IgG结合活性已几乎完全消失。Li Canpeng等[25]曾报道卵白蛋白(ovalbumin,OVA)与焦磷酸盐在85 ℃进行干热磷酸化,磷酸化反应之后免疫活性降低;也有研究表明磷酸化能降低蛋清蛋白与IgG的结合活性[26]。

图8 磷酸化反应对PV二级结构的影响
Fig. 8 Inf l uence of phosphorylation reaction on the secondary structures of PV
如图8所示,磷酸化后的PV与对照组相比,二级结构变化明显。利用CDNN软件分析,如表1所示,磷酸化反应后,产物的α-螺旋相对含量降低了5.7%,β-折叠相对含量增加了10.8%,β-转角相对含量增加了1.6%,无规则卷曲相对含量由35.1%降低到30.1%。
蛋白质的三级结构是通过蛋白表面的疏水键来维持的,本研究通过ANS疏水性荧光探针的方式来检测磷酸化后样品中疏水性的变化。ANS能结合在蛋白质疏水区,使荧光强度增大。如图9所示,对照组样品的曲线整体趋势平缓,而与对照组相比较,磷酸化PV在波长450 nm处荧光吸收达到峰值,其疏水性有明显的增加。Li Canpeng等[25]研究表明磷酸化反应也能增加OVA的表面疏水性,使OVA分子发生构象变化。暴露在蛋白质表面的疏水性氨基酸增加了疏水相互作用的程度,促进了蛋白质相互作用和聚集,使PV抗原表位发生改变[27]。
表1 磷酸化反应产物的二级结构相对含量
Table 1 Proportions of secondary structures of phosphorylated PV

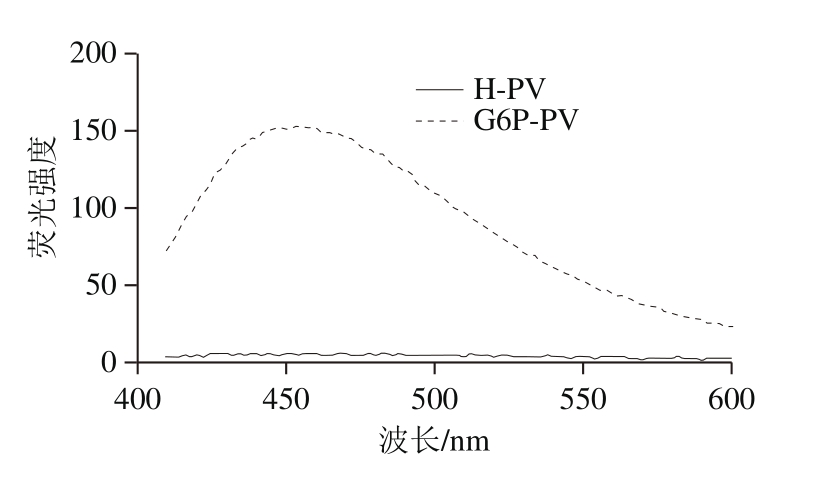
图9 磷酸化反应对PV表面疏水性的影响
Fig. 9 Inf l uence of phosphorylation reaction of PV on surface hydrophobicity
水产食品中,鱼类的主要过敏原为水溶性PV[6],而甲壳类的主要过敏原为盐溶性原肌球蛋白[28]。鱼类及其制品是重要的营养素来源[29]。但是,不明确的标注使得鱼类过敏的风险大大增加,因此对鱼类脱敏技术的研究尤为重要。本研究通过硫酸铵盐析、DEAE-Sepharose柱层析从鲢鱼肌肉中分离纯化获得PV,以G6P-Na2为磷酸化试剂对鲢鱼PV进行磷酸化反应,建立PV的磷酸化反应条件。最终获得最佳磷酸化反应条件:PV与G6P-Na2质量比为1∶4,在80 ℃条件下反应80 min。该方法能有效降低PV的抗原性。
圆二色谱分析结果表明,磷酸化反应导致了PV二级结构中α-螺旋和无规则卷曲的相对含量减少,而β-折叠的相对含量增加。蛋白质分子中NH—及—CO之间的氢键是维持α-螺旋稳定的关键力。有研究指出,相比α-螺旋和β-折叠,无规则卷曲为可塑性结构[30],较易形成抗原表位。磷酸化反应使PV抗原性降低,在反应过程中α-螺旋发生解螺旋,而无规则卷曲结构比例降低转变成β-折叠。因此,本研究发现的磷酸化PV二级结构改变可能是其免疫活性降低的一个主要原因。扫描电镜微观分析结果显示,磷酸化PV呈现相互交联的网状结构。这种网状结构可能会形成空间位阻,进而掩盖PV的抗原表位,从而改变其IgG/IgE结合活性[27]。蛋白质中,可被磷酸化的氨基酸残基是丝氨酸、苏氨酸、酪氨酸、精氨酸、赖氨酸[31]。在前期工作中,通过对PV抗原表位的研究,确定了3 个构象型表位和1 个线性表位[27],发现88、97、108位赖氨酸残基和37、92位丝氨酸残基位于抗原表位区域。PV与G6P-Na2反应,G6P-Na2连接在氨基酸残基可能对表位产生直接封闭作用。同时,磷酸化反应使亲水性抗原表位发生改变,可能也是抗原性降低的原因之一[23]。基于美拉德反应的磷酸化反应复杂,对于其影响机理还有待更深入的研究。
鱼糜制品加工需经过漂洗工艺,水溶性过敏原PV含量有很大程度的降低,因此被认为是低致敏性鱼类加工品。但未经漂洗的鱼糜,会导致过敏症状的发生[16]。鱼糜漂洗过程利弊并存:一方面水溶性的肌浆蛋白,特别是蛋白酶的作用会导致鱼糜制品凝胶强度的下降,所以鱼糜生产中需要将肌浆蛋白漂洗去除;另一方面,漂洗导致大量的水溶性蛋白流失,不仅浪费蛋白资源也带来环境问题。因此,现有一些研究也针对回收和重新利用漂洗水中的水溶性蛋白开展[32]。由于水溶性蛋白中PV为主要成分之一,采用合理有效的措施回收水溶性蛋白并降低其抗原性对于该类蛋白的高效安全利用尤为重要。本研究结果表明,磷酸化反应能有效降低PV的抗原性,为低致敏性鱼类蛋白的制备提供了一定的理论依据。
参考文献:
[1] TSABOURI S, TRIGA M, MAKRIS M, et al. Fish and shellfish allergy in children: review of a persistent food allergy[J]. Pediatric Allergy and Immunology, 2012, 23(7): 608-615. DOI:10.1111/j.1399-3038.2012.01275.x.
[2] SICHERER S H, MUNOZ-FURLONG A, SAMPSON H A.Prevalence of seafood allergy in the United States determined by a random telephone survey[J]. The Journal of Allergy and Clinical Immunology, 2004, 114(1): 159-165. DOI:10.1016/j.jaci.2004.04.018.
[3] TURNER P, NG I, KEMP A, et al. Seafood allergy in children: a descriptive study[J]. Annals of Allergy Asthma & Immunology, 2011,106(6): 494-501. DOI:10.1016/j.anai.2011.02.001.
[4] CONNETT G J, GEREZ I, CABRERA-MORALES E A, et al.A population-based study of fi sh allergy in the Philippines, Singapore and Thailand[J]. International Archives of Allergy and Immunology,2012, 159(4): 384-390. DOI:10.1159/000338940.
[5] 朱振潮, 彭杨, 陈卓, 等. 珠三角地区人群吸入和食物变应原谱分析及动态观察[J]. 临床耳鼻咽喉头颈外科杂志, 2017, 31(5): 343-346.DOI:10.13201/j.issn.1001-1781.2017.05.004.
[6] PRESTE R, LJERK A. Seafood allergy, toxicity, and intolerance:a review[J]. Journal of the American College of Nutrition, 2016, 35(3):271-283. DOI:10.1080/07315724.2015.1014120.
[7] ELSAYED S, BENNICH H. The primary structure of allergen M from cod[J]. Scandinavian Journal of Immunology, 1975, 4(2): 203-208.DOI:10.1111/j.1365-3083.1975.tb02618.x.
[8] 蔡秋凤, 王锡昌, 郭城, 等. 加工处理对鲢小清蛋白免疫活性的影响[J]. 水产学报, 2013, 37(2): 297-302. DOI:10.3724/SP.J.1231.2013.38222.
[9] LI C P, ENOMOTO H, HAYASHI Y, et al. Recent advances in phosphorylation of food proteins: a review[J]. LWT-Food Science and Technology, 2010, 43(9): 1295-1300. DOI:10.1016/j.lwt.2010.03.016.
[10] LI C P, CHEN D, PENG J, et al. Improvement of functional properties of whey soy protein phosphorylated by dry-heating in the presence of pyrophosphate[J]. LWT-Food Science and Technology, 2010, 43(6):919-925. DOI:10.1016/j.lwt.2010.01.027.
[11] KAEWRUANG P, BENJAKUL S, PRODPRAN T. Effect of phosphorylation on gel properties of gelatin from the skin of unicorn leatherjacket[J]. Food Hydrocolloids, 2014, 35: 694-699.DOI:10.1016/j.foodhyd.2013.08.017.
[12] XIONG Z Y, ZHANG M J, MA M H. Emulsifying properties of ovalbumin: improvement and mechanism by phosphorylation in the presence of sodium tripolyphosphate[J]. Food Hydrocolloids, 2016,60: 29-37. DOI:10.1016/j.foodhyd.2016.03.007.
[13] ENOMOTO H, LI C P, MORIZANE K, et al. Improvement of functional properties of bovine serum albumin through phosphorylation by dry-heating in the presence of pyrophosphate[J].Journal of Food Science, 2008, 73(2): C84-C91. DOI:10.1111/j.1750-3841.2007.00634.x.
[14] AOKI T, FUKUMOTO T, KIMURAT T, et al. Whey protein and egg white protein-glucose 6-phosphate conjugates with calcium phosphate-solubilizing properties[J]. Bioscience, Biotechnology, and Biochemistry, 1994, 58(9): 1727-1728. DOI:10.1271/bbb.58.1727.
[15] KATO Y, AOKI T, KATO N, et al. Modification of ovalbumin with glucose 6-phosphate by amino-carbonyl reaction. Improvement of protein heat stability and emulsifying activity[J]. Journal of Agricultural and Food Chemistry, 1995, 43(2): 301-305. DOI:10.1021/jf00050a007.
[16] 汪宁, 王锡昌, 蔡秋凤, 等. 鱼类肌肉中过敏蛋白的检测与分析[J].厦门大学学报(自然科学版), 2008, 47(S2): 141-145. DOI:10.3321/j.issn:0438-0479.2008.z2.033.
[17] KOBAYASHI A, TANAKA H, HAMADA Y, et al. Comparison of allergenicity and allergens between fi sh white and dark muscles[J]. Allergy,2006, 61(3): 357-363. DOI:10.1111/j.1398-9995.2006.00966.x.
[18] LIU G M, WANG N, CAI Q F, et al. Purification and characterization of parvalbumins from silver carp (Hypophthalmichthy molitrix)[J].Journal of the Science of Food and Agriculture, 2010, 90(6): 1034-1040. DOI:10.1002/jsfa.3913.
[19] SCHÄGGER H. Tricine-SDS-PAGE[J]. Nature Protocols, 2006, 1(1):16-22. DOI:10.1038/nprot.2006.4.
[20] KELLY S M, JESS T J, PRICE N C. How to study proteins by circular dichroism[J]. Biochimica et Biophysica Acta, 2005, 1751: 119-139.DOI:10.1016/j.bbapap.2005.06.005.
[21] 徐超, 鲍俊旺, 蔡秋凤, 等. 鲤鱼肌肉Ⅴ型胶原蛋白的分离纯化及其抗体制备[J]. 集美大学学报(自然科学版), 2015, 20(6): 401-406.DOI:10.3969/j.issn.1007-7405.2015.06.001.
[22] TONG P, GAO J, CHEN H, et al. Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin[J]. Food Chemistry, 2012, 131(2): 603-610.DOI:10.1016/j.foodchem.2011.08.084
[23] 蔺海鑫, 林洪, 王晓斐, 等. 美拉德反应对菲律宾蛤仔原肌球蛋白结构及免疫活性的影响[J]. 食品科学, 2016, 37(3): 22-26.DOI:10.7506/spkx1002-6630-201603005.
[24] BU G H, ZHANG N, CHEN F S. The inf l uence of glycosylation on the antigenicity, allergenicity, and structural properties of 11S-lactose conjugates[J]. Food Research International, 2015, 76: 511-517.DOI:10.1016/j.foodres.2015.08.004.
[25] LI C P, HAYASHI Y, SHINOHARA H, et al. Phosphorylation of ovalbumin by dry-heating in the presence of pyrophosphate: effect on protein structure and some properties[J]. Journal of Agricultural and Food Chemistry, 2005, 53(12): 4962-4967. DOI:10.1021/jf047793j.
[26] ENOMOTO H, NAGAE S, HAYASHI Y, et al. Improvement of functional properties of egg white protein through glycation and phosphorylation by dry-heating[J]. Asian-Australasian Journal of Animal Sciences, 2009, 22(4): 591-597. DOI:10.5713/ajas.2009.80363.
[27] ZHAO Y J, CAI Q F, JIN T C, et al. Effect of Maillard reaction on the structural and immunological properties of recombinant silver carp parvalbumin[J]. LWT-Food Science and Technology, 2017, 75: 25-33.DOI:10.1016/j.lwt.2016.08.049.
[28] 林江伟, 游洪燕, 沈海旺, 等. 克氏原螯虾原肌球蛋白的纯化及过敏原性分析[J]. 集美大学学报(自然科学版), 2012, 17(3): 168-174.DOI:10.3969/j.issn.1007-7405.2012.03.002.
[29] 方忠兴, 翁武银, 王美贵, 等. 添加水产下脚料对蓝圆鲹发酵鱼露的影响[J]. 食品科学, 2010, 31(23): 132-137.
[30] ZHAO S, GOODSELL D S, OLSON A J. Analysis of a data set of paired uncomplexed protein structures: new metrics for side-chain flexibility and model evaluation[J]. Proteins, 2001, 43(3): 271-279.DOI:10.1002/prot.1038.
[31] WANG H, TU Z, LIU G, et al. Identification and quantification of the phosphorylated ovalbumin by high resolution mass spectrometry under dry-heating treatment[J]. Food Chemistry, 2016, 210: 141-147.DOI:10.1016/j.foodchem.2016.04.082.
[32] 王秀敏, 解相林, 黄连光, 等. 利用鱼糜漂洗水回收的蛋白肽制备肽钙复合物[J]. 食品研究与开发, 2017, 38(1): 83-86. DOI:10.3969/j.issn.1005-6521.2017.01.019.
Effect of Phosphorylation on Reducing the Allergenicity of Silver Carp Parvalbumin
YANG Ruqing1, LIN Linghai1, WAN Chujun1, CHEN Yulei1, ZHANG Lingjing1,2, CAO Minjie1,2,*
(1. College of Food and Biological Engineering, Jimei University, Xiamen 361021, China;2. Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, Xiamen 361102, China)
Abstract:The aims of this work were to establish and optimize the phosphorylation reaction conditions of parvalbumin (PV),the major allergen of silver carp (Hypophthalmichthys molitrix), and to determine the in fl uence of phosphorylation reaction on the structural and immunological properties of PV. Phosphorylation of PV was carried out by dry heating of its mixture with D-glucose-6-phosphate disodium salt hydrate (G6P-Na2) under varying conditions of mass ratio between reactants,reaction time and temperature. The type of polymerization was determined by tricine-SDS-PAGE, and the antigenicity was detected by dot blotting. The microstructure of the obtained polymer was examined by scanning electron microscope (SEM),and its secondary structure and surface hydrophobicity were measured by circular dichroism (CD) spectroscopy and the hydrophobic fl uorescence probe 8-anilino-1-naphthalenesulfonate (ANS), respectively. The results indicated that the optimal conditions for phosphorylation reaction of PV were as follows: reaction temperature, 80 ℃; reaction time, 80 min; and ratio of PV to G6P-Na2, 1:4. The aggregate formation and the changes in the secondary structures of G6P-Na2-PV might explain the decrease of PV antigenicity after the phosphorylation reaction. Our present work strongly suggested an effect of phosphorylation on reducing the antigenicity of food allergens.
Keywords:parvalbumin; D-glucose-6-phosphate disodium salt hydrate; phosphorylation reaction; antigenicity;secondary structure
YANG Ruqing, LIN Linghai, WAN Chujun, et al. Effect of phosphorylation on reducing the allergenicity of silver carp parvalbumin[J]. Food Science, 2018, 39(20): 20-26. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820004. http://www.spkx.net.cn
引文格式:杨汝晴, 林灵海, 万楚君, 等. 磷酸化对鲢小清蛋白抗原性降低的作用[J]. 食品科学, 2018, 39(20): 20-26. DOI:10.7506/spkx1002-6630-201820004. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0020-07
文献标志码:A
中图分类号:TS254.1
DOI:10.7506/spkx1002-6630-201820004
*通信作者简介:曹敏杰(1964—),男,教授,博士,研究方向为水产品加工与综合利用。E-mail:micao@jmu.edu.cn
第一作者简介:杨汝晴(1993—),女,硕士研究生,研究方向为水产品加工。E-mail:201511832009@jmu.edu.cn
基金项目:国家自然科学基金面上项目(31471640);福建省科技计划高校产学合作项目(2017N5011)
收稿日期:2017-07-20