郭晓峰,毕艳兰*,陈佳丽
(河南工业大学粮油食品学院,河南 郑州 450001)
摘 要:以大豆油、棕榈油、茶油和猪油为材料,以α-生育酚为研究对象,采用Rancimat法(110~130 ℃)和烘箱法(120~180 ℃)研究在加热条件下α-生育酚在油脂中的抗氧化活性、损耗情况及其对油脂全氧化值的影响。Rancimat结果表明:110 ℃条件下,α-生育酚(200~1 000 mg/kg)能显著延长猪油、茶油和棕榈油的氧化诱导期(P<0.05),且添加量越大,油脂的氧化诱导期越长,而在大豆油中,α-生育酚则表现出促氧化现象,即添加量越大,大豆油氧化诱导期越短;烘箱实验结果表明:α-生育酚在油脂中的损耗率,与加热温度呈正相关,与其添加量呈负相关;180 ℃条件下,α-生育酚(1 000 mg/kg)能有效抑制大豆油、茶油和猪油在加热过程中全氧化值的增长;而在棕榈油中,α-生育酚促进了棕榈油全氧化值的增大,添加量越大,促进作用越强。
关键词:α-生育酚;损耗;抗氧化;油脂;加热
生育酚作为一类天然抗氧化剂,其广泛存在于植物油中。根据其苯环上甲基的位置和数目不同,可分为α-,β-,γ-和δ-生育酚[1]。生育酚抗氧化活性强,而且无毒性,还有许多对人体有益的生理功能,例如降低胆固醇、预防心脑血管疾病,增强人体免疫力和预防不育症等[2-3]。其中α-生育酚几乎存在于所有植物油中,其生理活性在生育酚4 种同系物中最强,是β-和γ-生育酚的2 倍,δ-生育酚的100 倍[4-5],因而被人们广泛研究。
Cao Jun等[6]研究认为,当油脂中的α-生育酚浓度在一定范围内时,其抗氧化活性随浓度增大而增强,但当其浓度高于该范围时,其抗氧化活性会逐渐减弱。Satue等[7]研究发现当α-生育酚在精炼棕榈油中含量高于250 mg/kg时,具有促氧化效应。吴侯等[8]在电导法实验(110 ℃)中也发现,当生育酚浓缩物在猪油中的含量低于0.08%时,其抗氧化活性随添加量增加而逐渐增强;当其含量超过0.08%时,随生育酚浓缩物添加量的增大,其抗氧化活性逐渐趋于稳定。由此可知,α-生育酚在油脂中的抗氧化活性与其浓度具有一定的相关性[9]。一些学者[10-12]研究认为,由于氧化和降解,α-生育酚在加热油脂体系中会发生损耗而降低其在油脂中的浓度。Juárez等[13]通过180 ℃煎炸实验发现,经过14 h煎炸后,油脂中生育酚损耗高达76%。Andrikopoulos等[14]用橄榄油、葵花油和植物酥油(由葵花油、棉籽油和棕榈油调和而成)进行煎炸实验发现:在经过8次煎炸后橄榄油、葵花油和植物酥油中α-生育酚的保留率分别约为15%、30%和25%,煎炸后橄榄油、葵花油和植物酥油的酸度(以油酸计)由初始值0.49%、0.14%和0.14%分别变为0.46%、0.16%和0.29%;其过氧化值由1.05、1.65 mmol/kg和1.25 mmol/kg分别升至5.6、6.7 mmol/kg和5.4 mmol/kg,这说明不同油脂中α-生育酚的损耗及其对油脂品质的影响是不同的。Rancimat法以及烘箱加速氧化法是评价油脂氧化稳定性时较为常用的两种方法。Rancimat法实验结果可以直观地反映油脂氧化稳定性,氧化诱导期越长,则油脂氧化稳定性越强,烘箱法可以实时监控加热过程中油脂的氧化程度,相关研究已见诸报道[15-17]。因此,本实验以大豆油、棕榈油、茶油和猪油为实验原料,分别采用烘箱法和Ranciamt法研究α-生育酚在加热过程中的损耗及其对油脂品质的影响,对调控油脂和食品加工过程中α-生育酚的有效存留,科学使用α-生育酚提供参考依据。
猪油 天津九源油脂有限公司;大豆油 河南阳光油脂集团有限公司;茶油 金健米业股份有限公司;棕榈油 中储粮油脂工业东莞有限公司;α-生育酚(≥96%,色谱纯) 美国Sigma-Aldrich公司;冰乙酸(色谱纯、分析纯)、异辛烷(色谱纯)、三氯甲烷(分析纯) 天津科密欧化学试剂有限公司;正己烷、异丙醇(均为色谱纯) 美国VBS试剂公司;硫代硫酸钠、碘化钾、可溶性淀粉(均为分析纯) 天津永大化学试剂厂。
2695高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司;7890B气相色谱仪 美国Agilent Technologies公司;892型氧化酸败仪 瑞士Mctrohm公司;WGL-125B电热鼓风干燥箱 天津市泰斯特仪器有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;BSA224S电子天平 赛多利斯科学仪器(北京)有限公司;KQ-500超声波清洗器 昆山市超声仪器有限公司。
1.3.1 原料油脂理化指标测定
过氧化值的测定:参照AOCS Method Cd: 8-53[18];茴香胺值的测定:参照GB/T 24304—2009《动植物油脂茴香胺值的测定》[19];原料油脂水分和挥发物含量的测定:参照GB 5009.236—2016《动植物油脂水分及挥发物的测定》[20];原料油脂脂肪酸组成及含量测定:参照GB 5009.168—2016《食品中脂肪酸的测定》[21]。
1.3.2 气相色谱条件
色谱柱:S G E B P X-7 0石英毛细柱(30.0 m×250 μm,0.5 μm);柱箱温度:200 ℃,进样口温度:210 ℃;载气(N2)流量0.4 mL/min,压力18.00 psi;进样量:1 μL;分流比:30∶1;氢火焰离子化检测器温度:300 ℃,氢气流量:30.0 mL/min,空气流量:400 mL/min。
1.3.3 全氧化值的计算
全氧化值按公式(1)计算[22]:
式中:TV为全氧化值;PV为过氧化值/(mmol/kg);AV为茴香胺值。
1.3.4 油脂加速氧化实验
1.3.4.1 烘箱法
烘箱实验油样配制:由于原料油脂本身已含有一定含量的α-生育酚,因此在配制时,需要扣除原料油脂本身所含α-生育酚。准确称取0.408、0.918 g(精确至0.1 mg)α-生育酚于1.5 L干洁塑料瓶中,并加入大豆油至1 020 g(精确至0.01 g),配成α-生育酚添加量分别为500、1 000 mg/kg的大豆油油样,摇晃25 min使α-生育酚完全溶解并均匀分布于油脂中。同样方法配制其他α-生育酚添加量为500、1 000 mg/kg的茶油、棕榈油和猪油油样(猪油和棕榈油需在40 ℃水浴中加热至油脂澄清透明后再进行油脂的配制,下同)。
加速氧化实验:用电子天平准确称取1 000.0 g(精确至0.01 g)配好的油样于2 000 mL烧杯,超声5 min,放入烘箱中180 ℃加热,并分别于加热4、12、24、36、48、60、72 h时取样检测,检测指标包括α-生育酚含量、油脂过氧化值及茴香胺值。
1.3.4.2 Rancimat法加速氧化实验[23]
不同α-生育酚添加量油脂的配制:准确称取0.29 g(精确至0.1 mg)α-生育酚于100 mL样品瓶中,再加入大豆油至100 g,剧烈摇晃25 min,超声20 min至生育酚溶解均匀,得到α-生育酚添加量为3 000 mg/kg的大豆油。分别称取4.00、10.00 g和20.00 g于100 mL样品瓶中,并分别加入大豆油至60.00 g,得到α-生育酚添加量为200、500 mg/kg和1 000 mg/kg的大豆油。同样方法配制α-生育酚添加量为200、500 mg/kg和1 000 mg/kg的茶油、棕榈油和猪油。
实验参数:空气流量为20 L/h;反应池温度为(110±1.6)、(120±1.6)、(130±1.6)℃;样品质量为5.00 g;测量池蒸馏水量为60 mL。
氧化诱导期增加值按公式(2)计算:
式中:PA为氧化诱导期增加值/h;IPX为添加α-生育酚后油脂的氧化诱导期/h;IP0为原料油脂的氧化诱导期/h。
1.3.5 α-生育酚测定
1.3.5.1 油样前处理
准确称取0.5 g(精确至0.1 mg)油样于25 mL棕色容量瓶中,用正己烷将瓶中油样完全溶解后定容至刻度线,混合均匀,用0.45 μm有机滤膜进行过滤后,进行HPLC检测。
1.3.5.2 HPLC检测α-生育酚的实验参数
色谱柱:Sun Fire Prep Silica柱(4.6 mm×250 mm,5 µm);流动相:正己烷-异丙醇(98.5∶1.5,V/V);进样量:20 µL;流速:0.8 mL/min;柱温:30 ℃;荧光检测器:发射波长330 nm,激发波长290 nm。
1.3.6 油样中α-生育酚损耗率按公式(3)计算:
式中:C0为加热前油样中总α-生育酚含量/(mg/kg);C1为加热后油样中总α-生育酚含量/(mg/kg)。
使用线性拟合软件Origin 8.5软件来分析数据之间的线性关系。实验数据均以 ±s表示,每组实验都至少有2个平行样,并且通过方差分析。采用SPSS 16.0 Duncan软件进行显著性分析,P<0.05,差异显著。
表1 原料油脂的脂肪酸组成及相对含量、酸价、过氧化值、茴香胺值、水分及挥发物含量
Table 1 Fatty acid composition, acid value, peroxide value, p-anisidine value, and moisture content of oils and fats
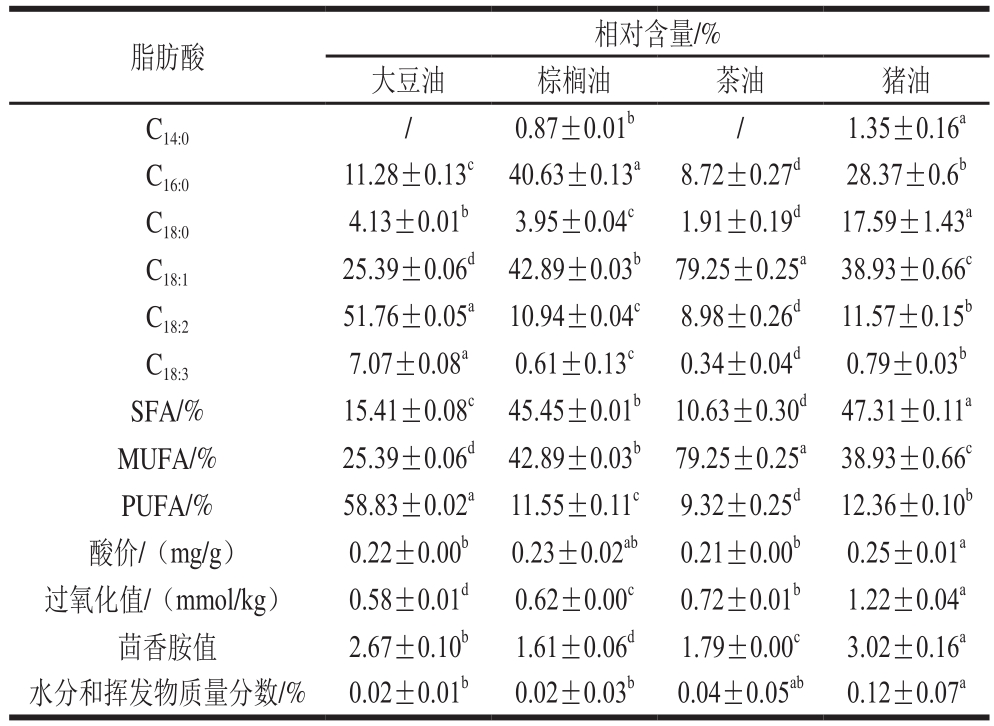
注:SFA.饱和脂肪酸的百分比;MUFA.单不饱和脂肪酸的百分比;PUFA.多不饱和脂肪酸的百分比;/.未检出,下同。同行不同小写字母表示差异显著(P<0.05)。
表2 原料油脂的生育酚及生育三烯酚含量
Table 2 Individual and total tocopherol contents and tocotrienol contents of oils and fats
mg/kg

注:本实验所用油脂均不含任何合成抗氧化剂。
由表1可知,本研究选用的4 种油脂脂肪酸组成具有明显的差异:大豆油中不饱和脂肪酸相对含量较高,主要含有油酸((25.39±0.06)%)和亚油酸((51.76±0.05)%);棕榈油中棕榈酸相对含量((40.63±0.13)%)显著高于其他油脂;4 种油脂中茶油油酸相对含量最高((79.25±0.25)%);猪油作为较为常用的一种动物脂肪,主要含有棕榈酸((28.37±0.60)%)、硬脂酸((17.59±1.43)%)和油酸((38.93±0.66)%)。4 种油脂的初始酸价、过氧化值和水分含量如表1所示,均符合食用油脂卫生标准[24-25](GB 2716—2005《食用植物油卫生标准》和GB 10146—2015《食用植物油卫生标准》)中的相关规定。本研究旨在为α-生育酚在食用油脂的实际生产中的合理添加提供一定的参考依据,故并未对本研究所选用的动植物油脂中的天然抗氧化成分进行脱除。4 种油脂中初始生育酚和生育三烯酚种类及含量如表2所示,大豆油中生育酚种类丰富且含量较高(α-生育酚、γ-生育酚和δ-生育酚分别为(101.14±0.85)、(693.66±1.26)mg/kg和(173.97±2.29)mg/kg),棕榈油中含有α-生育酚((134.59±2.75)mg/kg)和γ-生育酚((217.62±5.72)mg/kg),此外,棕榈油中还含有一定量的生育三烯酚((198.51±3.15)mg/kg),茶油中主要含有α-生育酚((128.63±3.33)mg/kg)和少量γ-生育酚((17.84±0.98)mg/kg),猪油中3 种生育酚以及相应的生育三烯酚均未检出。
表3 不同温度、不同α-生育酚添加量条件下油脂的氧化诱导期及其增加值
Table 3 Effect of α-tocopherol on induction period of oil and fats in Rancimat test at different temperatures
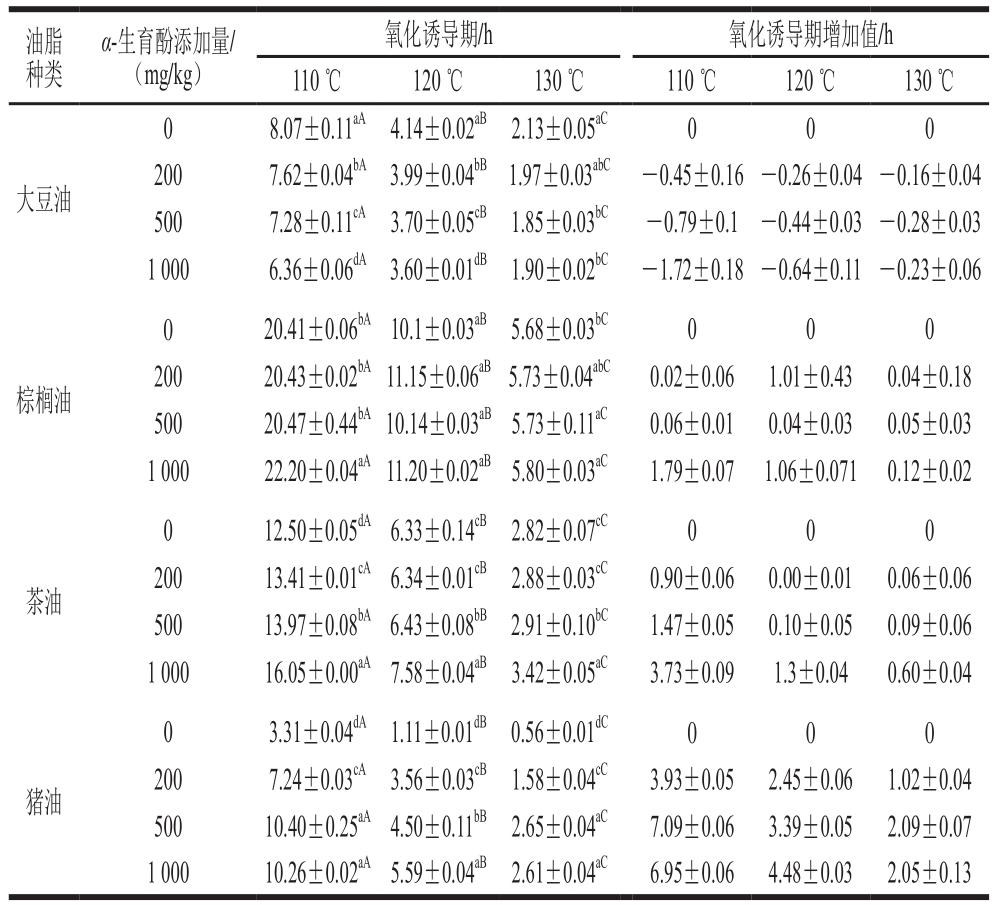
注:每组实验均重复2 次;同种油脂同列不同小写字母表示差异显著(P<0.05),同行不同大写字母表示差异显著(P<0.05)。
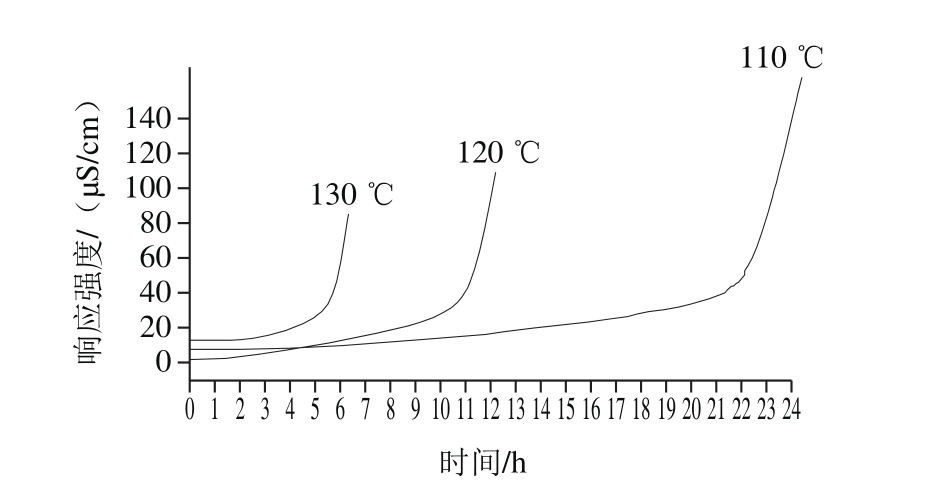
图1 不同温度条件下α-生育酚添加量为1 000 mg/kg时棕榈油的氧化诱导期
Fig. 1 Oxidative induction period of palm oil with 1 000 mg/kg of α-tocopherol added at different temperatures
如表3所示,添加α-生育酚后,猪油、茶油、棕榈油的氧化诱导期均有不同程度的增加,其中,猪油和茶油的氧化诱导期增加显著(P<0.05)。比较特殊的是,添加α-生育酚(200~1 000 mg/kg)后,大豆油氧化诱导期呈现缩短的趋势,且添加量越大,大豆油氧化诱导期越短,说明在大豆油中,当添加量大于200 mg/kg时,α-生育酚对大豆油具有促氧化作用。这与胡传荣等[26]所报道相似,具体为α-生育酚对猪油具有良好抗氧化效果,而对大豆色拉油具有一定的促氧化作用。Evans等[27]的研究发现α-生育酚在脱除生育酚的大豆油中的含量超过100 mg/kg时,对大豆油具有促氧化作用。由表2可知,大豆油中初始α-生育酚含量为101.14 mg/kg,添加200 mg/kg后超过了α-生育酚最大抗氧化含量,导致大豆油的氧化稳定性降低。高浓度下,α-生育酚在大豆油中的促氧化可能是由其氧化产物,如α-生育酚过氧自由基、α-生育酚羟自由基、α-生育酚氧自由基和单线态氧等导致,这些极性和非极性的组分能够降低油脂表面张力,加速氧气的传播,进而促进油脂氧化[28]。在Rancimat实验条件下,大量空气(20 L/h)进入到油脂中,大豆油中生育酚迅速氧化,由此导致油脂中氧化的生育酚含量短时间内迅速增大,促进了大豆油不饱和双键的氧化。
同一添加量下,随着温度升高,4 种油脂氧化诱导期均显著减小(P<0.05)。例如,当α-生育酚添加量为1 000 mg/kg时,110、120 ℃和130 ℃条件下,棕榈油的氧化诱导期分别为(22.2±0.04)、(11.2±0.02)h和(5.8±0.05)h(表3和图1)。110 ℃条件下,α-生育酚添加量对4 种油脂的氧化诱导期的影响显著;120 ℃和130 ℃条件下,α-生育酚添加量对大豆油、茶油和棕榈油的氧化诱导期影响不显著(表3)。
2.3.1 加热温度和加热时间对α-生育酚热损耗规律的影响
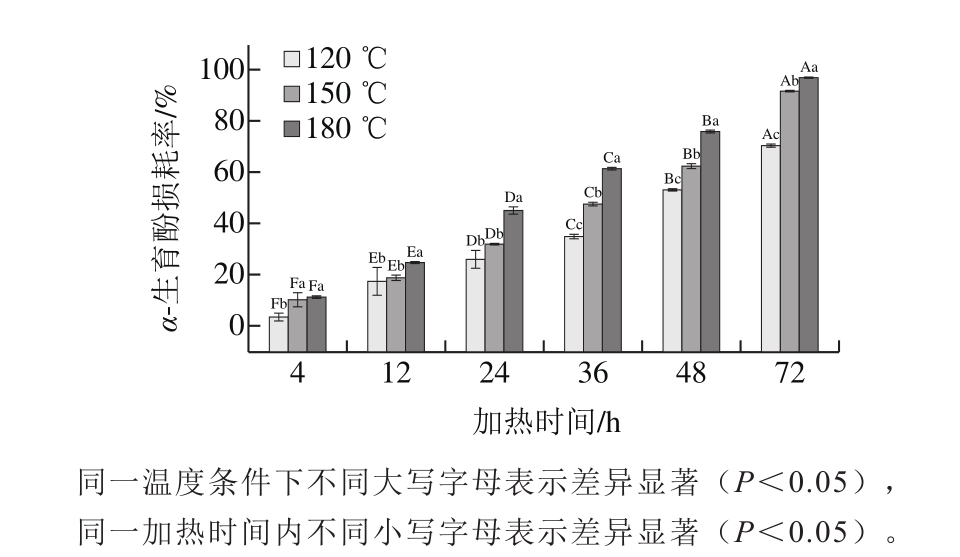
图2 不同加热温度下添加量为200 mg/kg时α-生育酚在棕榈油中的损耗
Fig. 2 Loss of α-tocopherol in palm oil with 200 mg/kg α-tocopherol added at different heating temperatures
由图2和图3可知,在同一温度下,α-生育酚(200 mg/kg)在棕榈油中的损耗率随加热时间延长而不断增大(P<0.05)。例如180 ℃条件下,加热时间分别为4、24、48 h和72 h时,α-生育酚在棕榈油中的损耗率分别为(11.58±0.63)%、(45.14±1.22)%、(75.85±0.61)%和(96.91±0.17)%。这与Bruscatto等[10]在研究180 ℃条件下米糠油中α-生育酚的损耗结果相似。相同时间内,温度越高,α-生育酚损耗率越大(P<0.05)。120、150 ℃和180 ℃加热48 h时,α-生育酚在棕榈油中的损耗率分别为(53.13±0.28)%、(62.33±0.94)%和(75.85±0.61)%,Choe等[29]在研究氧化过程中温度和光照对葵花油中α-生育酚损耗的影响时也得出过相似的结论。此处的结果也解释了2.1节中α-生育酚在油脂中的抗氧化效果随着温度升高而逐渐减弱的现象,即温度越高,α-生育酚在油脂中损耗率越大,从而导致其抗氧化效果逐渐减弱。
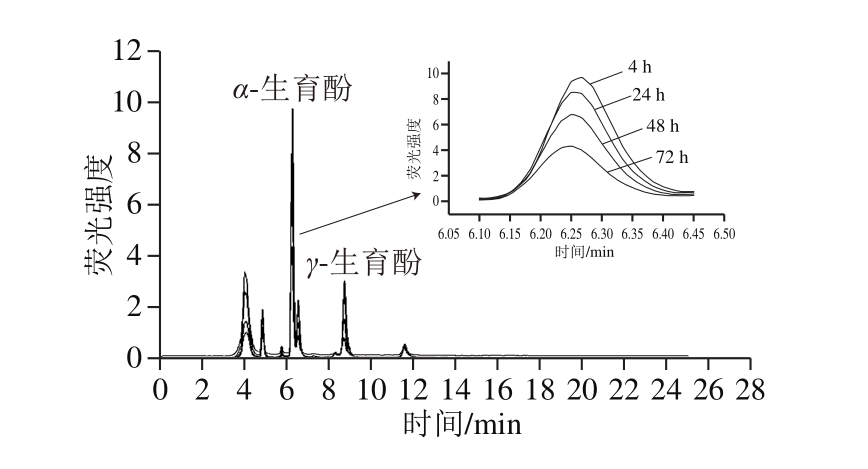
图3 180 ℃条件下不同加热时间棕榈油中α-生育酚的HPLC叠加图
Fig. 3 Superimposed HPLC chromatograms of α-tocopherol in palm oil heated at 180 ℃ for different periods of time
2.3.2 α-生育酚在不同油脂中热损耗情况
由图4可知,在一定的添加范围内,α-生育酚在棕榈油、大豆油、茶油、猪油中的损耗率随其添加量增加而显著降低(P<0.05)。如在180 ℃棕榈油中,当加热24 h后,在添加量为500、1 000 mg/kg 的油样中,α-生育酚的损耗率分别为(26.87±2.47)%、(14.29±2.47)%。结果表明,在相同温度下,α-生育酚添加量越大,其在油脂中的热损耗率越低,其在油脂中的绝对含量就越高,从而实现了对加热条件下油脂中生育酚的有效保留。
此外,实验研究发现α-生育酚在不同油脂中的热损耗也存在差异,当添加量为500 mg/kg时,180 ℃加热48 h后,α-生育酚在棕榈油、大豆油、茶油和猪油中的损耗率分别为(48.81±0.63)%、(68.99±0.34)%、(92.28±0.23)%和(98.26±0.01)%,即α-生育酚在猪油中损耗率最大,棕榈油中损耗率最小。α-生育酚在不同油脂中损耗率的差异可能与油脂中初始生育酚含量以及油脂脂肪酸组成等因素相关。一方面,不同油脂中初始生育酚种类及含量不同(表2),加热过程中其他生育酚对α-生育酚也具有一定的保护作用;另一方面,对于不饱和双键含量高的油脂而言,不饱和双键与α-生育酚之间可能存在争夺氧的竞争反应,在一定程度上能够减缓α-生育酚的损耗,Rossi等[9]在研究煎炸条件下油脂中生育酚对自由基清除能力时也有相似的报道。当然,油脂中水分以及其他微量成分也可能会对α-生育酚的热损耗产生一定的影响,这也有待于进一步的详细研究。
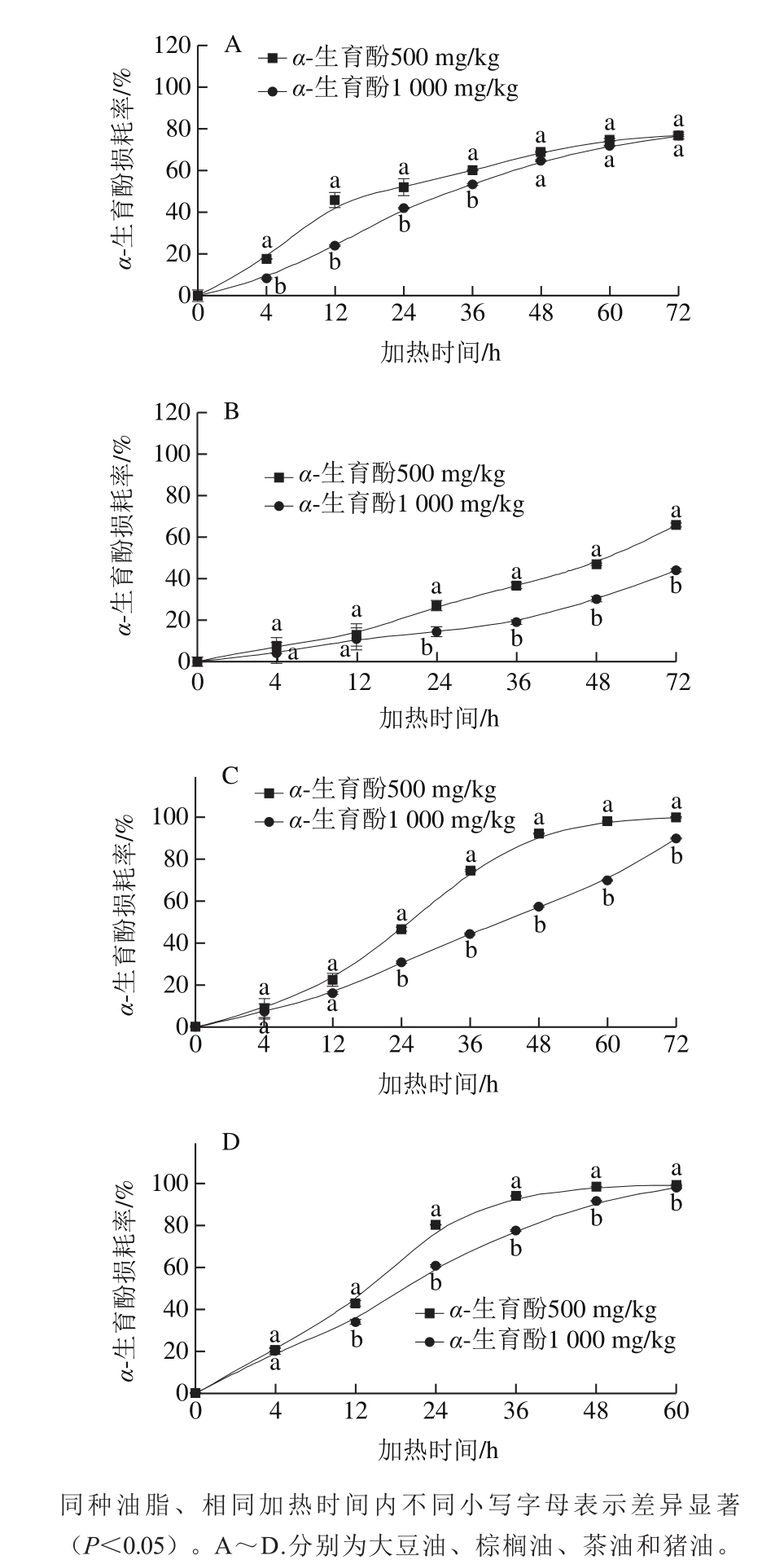
图4 180 ℃条件下α-生育酚在4 种油脂中损耗情况
Fig. 4 Loss of α-tocopherol in oils and fats at 180 ℃


图5 180 ℃条件下α-生育酚对4 种油脂全氧化值的影响
Fig. 5 Effect of α-tocopherol on total oxidation values of oils and fats at 180 ℃
油脂过氧化值主要反映油脂初期氧化产物氢过氧化物的含量,p-茴香胺值主要反映油脂次级氧化产物2-烯醛的含量。因此,为全面评价α-生育酚在加热过程中对油脂品质的影响,本研究采用全氧化值作为评价指标。
如图5所示,180 ℃条件下,无论是否添加抗氧化剂,棕榈油、大豆油、茶油和猪油的全氧化值均随加热时间延长均显著增大(P<0.05)。对于猪油而言,添加的α-生育酚对猪油全氧化值的增长具有显著抑制作用,α-生育酚添加量越大,抑制作用越强。例如加热48 h时,对照组与添加500、1 000 mg/kg α-生育酚3 个实验组猪油的全氧化值分别为101.94±0.21、86.33±0.30、74.50±0.02。而在茶油和大豆油中,α-生育酚添加量与其对油脂全氧化值增长的抑制作用相关性不大。值得注意的是,在200、500、1 000 mg/kg的添加量下,α-生育酚对棕榈油全氧化值的增长均表现出促进作用,且该促进作用随α-生育酚添加量增大而不断增强。如180 ℃加热48 h后,α-生育酚添加量为0(对照)、500、1 000 mg/kg的3 个实验组中棕榈油的全氧化值分别为46.02±0.32、65.87±0.08和67.45±0.12,这与Nogalakalucka等[30]研究α-生育酚对氢化油脂煎炸稳定性的结果相似。引起这种现象的可能原因是:研究所用的棕榈油除了含有较高含量的α-生育酚外还含有一定量的生育三烯酚(表2),α-生育酚添加量较大时(≥200 mg/kg),加热过程中α-生育酚及α-生育三烯酚被氧化,尤其是生育三烯酚,其侧链含有3 个不饱和双键,高温条件下,更容易受到自由基攻击,其氧化产物加速棕榈油的不饱和双键氧化从而促进了棕榈油全氧化值的增长。
对大豆油和棕榈油而言,α-生育酚在2.2节和2.3节两种实验条件下对它们的抗氧化活性具有一定的差异性。
对于大豆油而言,α-生育酚在180 ℃烘箱实验中对大豆油具有抗氧化作用(图5B),这与Rancimat实验中α-生育酚促大豆油氧化有一定的差异。Jung等[31]报道称氧化后的α-生育酚对脱生育酚后的大豆油具有促氧化作用,且随添加量增大,促氧化作用增强。在Rancimat实验条件(130 ℃)下,实验研究发现受通入的空气(20 L/h)影响,在实验结束时大豆油中的α-生育酚含量已全部消耗殆尽,由此导致油脂中生育酚氧化产物含量的骤增,促进了大豆油中不饱和双键的氧化,从而对大豆油表现出促氧化作用,即Rancimat实验条件(130 ℃)下,α-生育酚促进大豆油的氧化。在180 ℃烘箱实验中,当α-生育酚添加量为1 000 mg/kg时,随着加热时间延长,α-生育酚对大豆油的抗氧化作用逐渐减弱,72 h后α-生育酚对大豆油的全氧化值的抑制作用与添加量为500 mg/kg时无显著性差异。当加热时间继续延长,由于油脂氧化程度不断增大,油脂中α-生育酚氧化产物的含量不断增大,进而也可能会出现促氧化的现象。
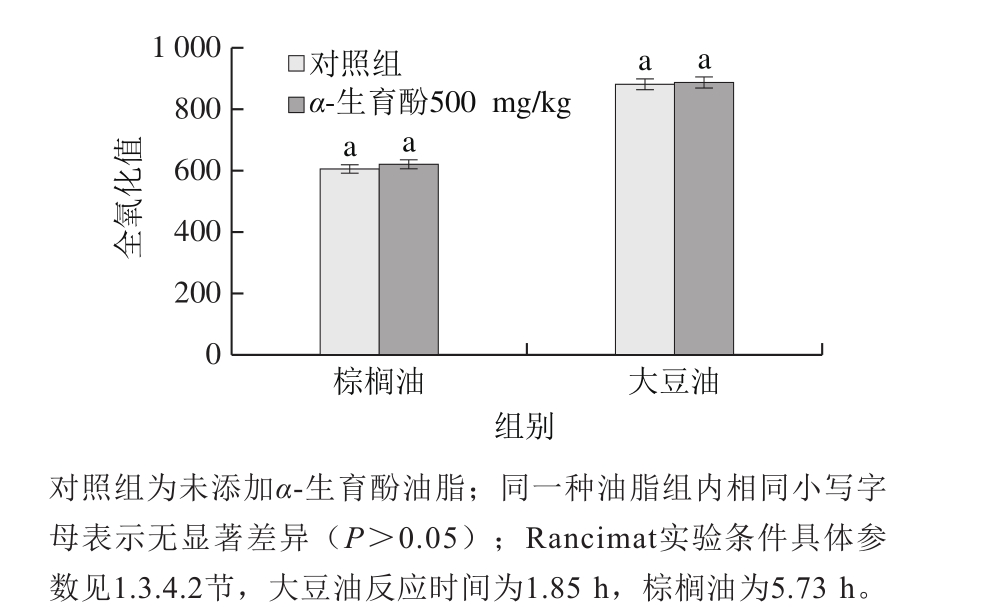
图6 Rancimat实验条件(130 ℃)下大豆油和棕榈油全氧化值
Fig. 6 Total oxidation values of soybean oil and palm oil under Rancimat condition (130 ℃)
对棕榈油而言,在Rancimat实验条件(130 ℃)下,添加α-生育酚棕榈油的氧化诱导期较对照组显著增大(表3),这与烘箱实验中α-生育酚的促氧化作用有一定的差异。通过分析Rancimat实验中两组棕榈油氧化诱导期时的全氧化值(图6)可知,对照组与实验组棕榈油的全氧化值并无显著差异(P>0.05);在大豆油中,两个实验组油样全氧化值之间也并无显著差异(P>0.05)。对比这两种情况可知,在不同的实验条件下,用以评价α-生育酚对油脂的抗氧化效果存在一定的偏差,因此在评价抗氧化剂抗氧化效果时最好结合抗氧化剂的实际使用条件选择合适研究条件更有实际意义。
加热条件下,油脂中的α-生育酚发生损耗,影响其抗氧化活性。不同油脂中,α-生育酚的添加量对油脂氧化诱导期及热稳定性具有显著影响,尤其是在不饱和脂肪酸含量或VE(生育酚及生育三烯酚)含量较高的油脂中,如大豆油、棕榈油中,使用α-生育酚作为外源抗氧化剂时,一定要考虑其添加浓度、使用温度以及空气带入量等因素。Rancimat实验结果表明:110 ℃条件下,α-生育酚(200~1 000 mg/kg)能有效延长猪油和茶油的氧化诱导期,对棕榈油氧化诱导期影响不明显,而在大豆油中,当添加量高于200 mg/kg时,α-生育酚具有促氧化作用;180 ℃条件下,添加量为500、1 000 mg/kg时,α-生育酚对大豆油、茶油和猪油全氧化值的增长具有显著抑制作用(P<0.05),而在棕榈油中,当添加量高于500 mg/kg时,α-生育酚则具有促氧化作用。不同实验条件下,用以评价α-生育酚对油脂抗氧化效果之间也存在一定的偏差,因此在评价抗氧化剂抗氧化效果时最好结合抗氧化剂的实际使用条件选择合适的研究条件更有实际意义。
参考文献:
[1] 阚建全, 谢笔钧. 食品化学[M]. 北京: 中国农业大学出版社,2008: 205.
[2] 宋晓燕, 杨天奎. 天然维生素E的功能及应用[J]. 中国油脂, 2000,25(6): 45-47. DOI:10.3321/j.issn:1003-7969.2000.06.011.
[3] ETMINAN M, GILL S S, SAMII A. Intake of vitamin E, vitamin C,and carotenoids and the risk of Parkinson’s disease: a meta-analysis[J].The Lancet Neurology, 2005, 4(6): 362-365. DOI:10.1016/S1474-4422(05)70097-1.
[4] ROBERT P, MASSON L, ORTIZ J, et al. Effect of α-tocopherol,α-tocotrienol and Rosa mosqueta shell extract on the performance of antioxidant-stripped canola oil (Brassica sp.) at high temperature[J].Food Chemistry, 2007, 104(1): 383-389. DOI:10.1016/j.foodchem.2006.11.052.
[5] NOLASCO S M, LAN A, CRAPISTE G H. Tocopherol oil concentration in fi eld-grown sunf l ower is acounted for by oil weight per seed[J]. Journal of the American Oil Chemists’ Society, 2004,81(11): 1045-1051. DOI:10.1007/s11746-004-1020-6.
[6] CAO J, LI H, XIA X, et al. Effect of fatty acid and tocopherol on oxidative stability of vegetable oils with limited air[J]. International Journal of Food Properties, 2015, 18(4): 808-820. DOI:10.1080/10942 912.2013.864674.
[7] SATUE M T, HUANG S W, FRANKEL E N. Effect of natural antioxidants in virgin olive oil on oxidative stability of refined,bleached, and deodorized olive oil[J]. Journal of the American Oil Chemists’ Society, 1995, 72(10): 1131-1137. DOI:10.1007/BF02540978.
[8] 吴侯, 翁新楚. 天然生育酚抗氧化活性的研究[J]. 上海大学学报(自然科学版), 2001, 7(2): 142-146. DOI:10.3969/j.issn.1007-2861.2001.02.011.
[9] ROSSI M, ALAMPRESE C, RATTI S. Tocopherols and tocotrienols as free radical-scavengers in refined vegetable oils and their stability during deep-fat frying[J]. Food Chemistry, 2007, 102: 812-817.DOI:10.1016/j.foodchem.2006.06.016.
[10] BRUSCATTO M H, ZAMBIAZI R C, SGANZERLA M, et al.Degradation of tocopherols in rice bran oil submitted to heating at different temperatures[J]. Journal of Chromatographic Science, 2009,47(9): 762-765. DOI:10.1093/chromsci/47.9.762.
[11] VERLEYEN T, KAMAL-ELDIN A, DOBARGANES C, et al.Modeling of α-tocopherol loss and oxidation products formed during thermoxidation in triolein and tripalmitin mixtures[J]. Lipids, 2001,36(7): 719-726. DOI:10.1007/s11745-001-0777-6.
[12] VERLEYEN T, VERHE R, HUYGHEBAERT A, et al. Identification of α-tocopherol oxidation products in triolein at elevated temperatures[J]. Journal of Agricultural and Food Chemistry, 2001,49(3): 1508-1511. DOI:10.1021/jf001142f.
[13] JUÁREZ M D, OSAWA C C, ACUNA M E, et al. Degradation in soybean oil, sunflower oil and partially hydrogenated fats after food frying, monitored by conventional and unconventional methods[J]. Food Control, 2011, 22(12): 1920-1927. DOI:10.1016/j.foodcont.2011.05.004.
[14] ANDRIKOPOULOS N K, DEDOUSSIS G V, FALIREA A, et al.Deterioration of natural antioxidant species of vegetable edible oils during the domestic deep-frying and pan-frying of potatoes[J].International Journal of Food Sciences and Nutrition, 2002, 53(4):351-363. DOI:10.1080/09637480220138098.
[15] 方冰, 王瑛瑶, 栾霞, 等. 生育酚及甾醇含量对大豆油氧化稳定性及贮藏稳定性的影响[J]. 中国粮油学报, 2016, 31(11): 69-73.DOI:10.3969/j.issn.1003-0174.2016.11.012.
[16] 王明霞, 黄凤洪, 刘昌盛, 等. 天然抗氧化剂对α-亚麻酸的抗氧化效果研究[J]. 中国油料作物学报, 2007, 29(4): 466-469. DOI:10.3321/j.issn:1007-9084.2007.04.021.
[17] 朱振宝, 刘梦颖, 易建华. 2 种方法测定核桃油脂氧化稳定性相关性[J]. 中国粮油学报, 2016, 31(4): 85-88. DOI:10.3969/j.issn.1003-0174.2016.04.017.
[18] AOCS: Official methods and recommended practices of the american oil chemists’ society[S]. 4nd ed. Champaign: AOCS Press, 1993,Method Cd: 8-53.
[19] 栾霞, 薛雅琳, 姜荷, 等. 动植物油脂茴香胺值的测定: GB/T 24304—2009[S]. 北京: 中国标准出版社, 2009.
[20] 郭新东, 罗海英, 李洪燕, 等. 动植物油脂水分及挥发物的测定: GB 5009.236—2016[S]. 北京: 中国标准出版社, 2016.
[21] 孟橘, 夏天文, 王慧芳, 等. 食品中脂肪酸的测定: GB 5009.168—2016[S]. 北京: 中国标准出版社, 2016.
[22] 李军, 毕艳兰, 杨会芳, 等. 加热条件下大豆油中TBHQ的挥发、转化规律及其对大豆油品质的影响[J]. 食品科学, 2014, 35(14): 106-112. DOI:10.7506/spkx1002-6630-201414021.
[23] AOCS: Official methods and recommended practices of the american oil chemists’ society: Method No. Cd 12b-92[S]. Champaign, AOCS Press, 2009.
[24] 须欣, 郑云雁, 刘建成, 等. 食用植物油卫生标准: GB 2716—2005[S].北京: 中国标准出版社, 2005.
[25] 张志强, 郑云雁. 食用动物油脂: GB 10146—2015[S]. 北京: 中国标准出版社, 2015.
[26] 胡传荣, 谷文英. 高D-α-生育酚抗氧化活性研究[J]. 中国油脂, 2003,28(6): 37-40. DOI:10.3321/j.issn:1003-7969.2003.06.013.
[27] EVANS J C, KODALI D R, ADDIS P B. Optimal tocopherol concentrations to inhibit soybean oil oxidation[J]. Journal of the American Oil Chemists’ Society, 2002, 79(1): 47-51. DOI:10.1007/s11746-002-0433-6.
[28] KIM H J, LEE H O, MIN D B. Effects and pro-oxidant mechanisms of oxidized α-tocopherol on the oxidative stability of soybean oil[J].Journal of Food Science, 2007, 72(4): C223.
[29] CHOE E. Interaction of light and temperature on tocopherols during oxidation of sunf l ower oil[J]. Journal of the American Oil Chemists’Society, 2013, 90(12): 1851-1857. DOI:10.1007/s11746-013-2330-0.
[30] NOGALAKALUCKA M, KORCZAK J, ELMADFA I, et al. Effect of α- and δ-tocopherol on the oxidative stability of a mixed hydrogenated fat under frying conditions[J]. European Food Research and Technology,2005, 221(3/4): 291-297. DOI:10.1007/s00217-005-1161-0.
[31] JUNG M Y, MIN D B. Effects of oxidized α-, γ- and δ-tocopherols on the oxidative stability of purified soybean oil[J]. Food Chemistry,1992, 45(3): 183-187. DOI:10.1016/0308-8146(92)90112-F.
Antioxidant Activity and Loss of α-Tocopherol and Its Effect on the Total Oxidation Value of Edible Oils and Fats under Heating Conditions
GUO Xiaofeng, BI Yanlan*, CHEN Jiali
(College of Food Science and Engineering, Henan University of Technology, Zhengzhou 450001, China)
Abstract:In this study, the antioxidant activity of α-tocopherol in soybean oil, palm oil, tea seed oil (Camellia oleifera Abel.) and lard was investigated under Rancimat test (110–130 ℃) and oven heating (120–180 ℃) conditions. α-Tocopherol loss and its effect on the total oxidation value of oils and fats were determined as well. The Rancimat test results showed that the addition of α-tocopherol (200–1 000 mg/kg) could concentration dependently significantly prolong the induction period(IP) of lard, and tea seed oil at 110 ℃ (P < 0.05), while the IP of soybean oil was negatively correlated with the concentration of α-tocopherol added. The oven test results showed that α-tocopherol loss was positively correlated with the heating temperature but negatively correlated with α-tocopherol addition. α-Tocopherol (1 000 mg/kg) could inhibit the increase of total oxidation values (TV) of soybean oil, tea seed oil, and lard at 180 ℃. On the other hand, the addition of α-tocopherol(500–1 000 mg/kg) showed a pro-oxidant effect in palm oil.
Keywords:α-tocopherol; loss; antioxidant activity; oils and fats; heating
GUO Xiaofeng, BI Yanlan, CHEN Jiali. Antioxidant activity and loss of α-tocopherol and its effect on the total oxidation value of edible oils and fats under heating conditions[J]. Food Science, 2018, 39(20): 27-33. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820005. http://www.spkx.net.cn
引文格式:郭晓峰, 毕艳兰, 陈佳丽. 加热条件下α-生育酚在油脂中的抗氧化活性、损耗及其对油脂全氧化值的影响[J]. 食品科学,2018, 39(20): 27-33. DOI:10.7506/spkx1002-6630-201820005. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0027-07
文献标志码:A
中图分类号:TS202.3
DOI:10.7506/spkx1002-6630-201820005
*通信作者简介:毕艳兰(1969—),女,教授,硕士,研究方向为脂质化学与品质。E-mail:bylzry@126.com
第一作者简介:郭晓峰(1992—),男,硕士研究生,研究方向为脂质化学与品质。E-mail:huiguangdell@163.com
基金项目:国家自然科学基金面上项目(31671818)
收稿日期:2017-07-11