
孙领鸽,王丹丹,毛晓英*,詹 萍,田洪磊
(石河子大学食品学院,新疆 石河子 832000)
摘 要:采用不同浓度(0~1 mmol/L)的丙烯醛代表多不饱和脂肪酸在脂肪氧合酶诱导下发生脂质过氧化反应过程中产生的小分子醛类物质,研究脂质活性氧化产物丙烯醛氧化对核桃蛋白结构和乳化特性的影响。结果表明,随着丙烯醛浓度的增加,核桃蛋白羰基含量从4.287 nmol/mg显著增加到11.078 nmol/mg。游离巯基和总巯基含量分别下降了55.18%和31.13%,说明丙烯醛使核桃蛋白发生了显著氧化。随着核桃蛋白氧化程度的增加,溶解度下降了84%;表面疏水指数从469.47下降到412.22;β-折叠、α-螺旋(有序)结构相对含量减少,β-转角、无规则卷曲(无序)结构相对含量增加。同时,核桃蛋白的乳化性和乳化稳定性分别从46.87 m2/g和25.93 min下降至9.86 m2/g和17.63 min。研究结果说明丙烯醛氧化能够导致核桃蛋白发生结构性氧化修饰,从而引起其乳化特性的变化。
关键词:丙烯醛;蛋白氧化;核桃蛋白;结构;乳化特性
在食品科学领域,蛋白质氧化是指蛋白质分子受活性氧直接攻击,或与次生氧化产物间接反应而发生的共价结构修饰[1]。蛋白质氧化会导致蛋白质主链发生断裂、氨基酸残基侧链发生氧化修饰以及形成蛋白质分子间交联物[2],从而引起食品营养成分损失、品质下降。在自然条件或高温、高压、辐照等加工条件下,食品中含有的不饱和脂肪酸、色素、金属离子、酶等成分均能够诱导蛋白质发生氧化。近年来,蛋白质氧化对食品营养成分和品质的影响成为国内外学者的研究热点。卢岩等[3]研究发现羟自由基氧化能使大豆蛋白产生共价交联;刘晶等[4]研究发现高浓度的丙二醛能够使大豆蛋白持水性、乳化性等功能性质下降。
核桃被称为世界四大坚果之一[5],营养物质丰富且含量均衡[6],具有极高的营养价值和保健功效。核桃中油脂含量占50%以上[7],且以多不饱和脂肪酸为主。在自然条件和加工过程中,核桃中的脂肪氧合酶(lipoxygenase,LOX)诱导多不饱和脂肪酸发生脂质过氢化反应产生的脂质自由基或脂质活性氧化产物(包括脂质氢过氧化物、活性醛类等)能够诱导蛋白质发生氧化。与自由基和脂质氢过氧化物相比,活性醛类因其结构比较稳定能够导致更大程度的蛋白质氧化。在脂质过氧化反应所产生的α,β-不饱和醛中,丙烯醛的反应活性最强,能够使蛋白质发生共价交联[8]。此前关于丙烯醛对蛋白质结构和功能性质影响的研究报道主要集中在动物蛋白和大豆蛋白。如李学鹏等[9]采用丙烯醛溶液对大黄鱼鱼肉进行体外氧化模拟,研究发现丙烯醛能够破坏大黄鱼肌肉组织结构并引起肌原纤维蛋白氧化;Wu Wei等[10]采用不同浓度的丙烯醛氧化大豆蛋白,发现丙烯醛氧化修饰使得大豆蛋白发生交联,蛋白结构发生变化。而关于丙烯醛氧化对核桃蛋白结构和功能性质的影响鲜见报道。目前,关于大豆等植物性原料在贮藏和加工过程中由LOX催化的脂质过氧化反应是导致植物蛋白质结构性氧化修饰从而造成其功能性质下降的主要原因基本得到了广泛共识。然而,关于蛋白质结构性氧化修饰对其功能性产生的影响机理尚不清楚。
乳化性作为核桃蛋白加工过程中重要的功能指标,是影响核桃蛋白产品品质稳定性的关键因素。影响核桃蛋白乳化特性的因素有很多。赵润泽等[11]研究发现烘烤处理会使核桃蛋白乳化稳定性下降;Tapal等[12]利用姜黄素提高大豆蛋白乳化性。而蛋白质的种类和结构是影响蛋白质乳化性的关键因素。因此,本实验以丙烯醛代表LOX催化的脂质过氧化反应产生的次生产物,采用不同浓度(0~1 mmol/L)的丙烯醛溶液氧化核桃蛋白,以氧化后核桃蛋白的羰基含量、巯基含量、溶解度、表面疏水指数和圆二色光谱表征核桃蛋白结构,乳化性和乳化稳定性表征核桃蛋白乳化特性,以研究LOX催化的脂质过氧化反应次生产物的活性醛对核桃蛋白结构和乳化特性的影响机理,为核桃蛋白产品在加工及贮藏过程中品质控制提供理论依据。
和田产薄皮核桃购于新疆石河子市农贸市场;丙烯醛(分析纯) 山东西亚化学工业有限公司;其他试剂均为国产分析纯。
LGJ-18S冷冻干燥机 北京松源华兴科技有限公司;PHS-3C雷磁pH计 上海仪电科学仪器股份有限公司;MULTIFUGE X1R高速冷冻离心机 赛默飞世尔科技(中国)有限公司;SHZ-B水浴恒温振荡器 上海博迅实业有限公司医疗设备厂;F-7000荧光光谱仪 日本日立公司;ELE高速均质剪切机 上海易勒机电设备有限公司;MOS-450圆二色光谱仪 法国Biologic公司。
1.3.1 核桃分离蛋白的制备
以当年收获的和田薄皮核桃为原料,参照毛晓英[13]的方法采用碱溶酸沉法制备核桃分离蛋白。采用正己烷对脱皮后的核桃仁进行脱脂得到脱脂核桃粉。将脱脂核桃粉用95%乙醇溶液(料液比1∶10)进行醇洗,过滤得到滤饼后挥干溶剂,用去离子水(料液比1∶26)溶解得到蛋白质溶液。调节蛋白质溶液pH值为11,搅拌离心得到上清液。调节上清液pH值为4.5,搅拌离心得到沉淀,调节蛋白质沉淀pH值至中性用冷冻干燥机冻干24 h,即得到核桃分离蛋白。
1.3.2 丙烯醛氧化核桃蛋白的制备
根据Wu Wei等[10]的方法,略修改。用0.01 mol/L pH 8.0磷酸盐缓冲溶液溶解核桃分离蛋白,加入一定量NaN3以防止微生物滋生。将丙烯醛与核桃蛋白溶液混合,使得丙烯醛在核桃蛋白溶液中的浓度分别为0、0.001、0.01、0.1 mmol/L及1 mmol/L。将含有丙烯醛的核桃蛋白溶液在25 ℃恒温水浴振荡器中振荡反应24 h,反应过程中注意避光。反应结束后将核桃蛋白溶液在4 ℃去离子水中透析72 h,透析过程中要及时更换去离子水。最后将透析后的溶液冷冻干燥得到氧化核桃蛋白。
1.3.3 核桃蛋白羰基含量的测定
采用2,4-二硝基苯肼法[14]测定羰基含量。
1.3.4 巯基含量的测定
参照Huang Youru等[15]的方法。对照组不加5,5’-二硫双(2-硝基苯甲酸),在波长412 nm处测定上清液的吸光度,巯基含量用13 600 L/(mol•cm)消光系数进行计算。
1.3.5 溶解度的测定
根据叶林[16]的方法,略修改。将核桃蛋白样品溶于去离子水中,磁力搅拌1 h,离心后取上清液测定波长540 nm处吸光度。以牛血清白蛋白作标准曲线。溶解度为样品蛋白质含量和溶液蛋白质含量的比值。
1.3.6 表面疏水指数的测定
采用ANS作为荧光探针[15]。核桃蛋白样品溶于0.01 mol/L pH 7.0磷酸盐缓冲溶液中,使得蛋白溶液质量浓度在0.005~0.5 mg/mL之间。取50 μL浓度为8 mmol/L ANS溶液加入4 mL不同浓度的稀释样品中。激发波长和发射波长分别为365 nm和484 nm。以蛋白质质量浓度为横坐标,荧光强度为纵坐标,蛋白质分子表面疏水指数为蛋白质质量浓度为0时得到的斜率。
1.3.7 圆二色光谱的测定
根据吴伟[17]的方法,略修改。用去离子水溶解核桃蛋白样品使蛋白质量浓度为50 μg/mL,扫描核桃蛋白样品在波长190~250 nm之间的圆二色光谱。扫描3 次得到平均值,以去离子水作为空白组。
1.3.8 乳化性和乳化稳定性的测定
参考Pearce等[18]方法,略修改。将一定量核桃蛋白样品溶解于去离子水中,取9 mL蛋白质溶液加入3 mL大豆油,用均质机以10 000 r/min均质2 min后在0 min和10 min时取乳状液5 μL溶于0.1%十二烷基硫酸钠溶液中混匀,在波长500 nm处测定吸光度分别记为A0和A10。以0.1%十二烷基硫酸钠溶液为空白。乳化性和乳化稳定性按公式(1)、(2)计算:

式中:A0为均质后0 min测定的吸光度;A10为均质后10 min测定的吸光度;c为蛋白溶液的质量浓度/(g/mL);φ为油占总乳液的体积分数,0.25。
每个指标进行3 次重复实验,实验结果用 ±s表示。绘图采用Origin 8.5软件,显著性分析采用SPSS Statisics 23.0单因素ANOVE中的Dukeny检验。
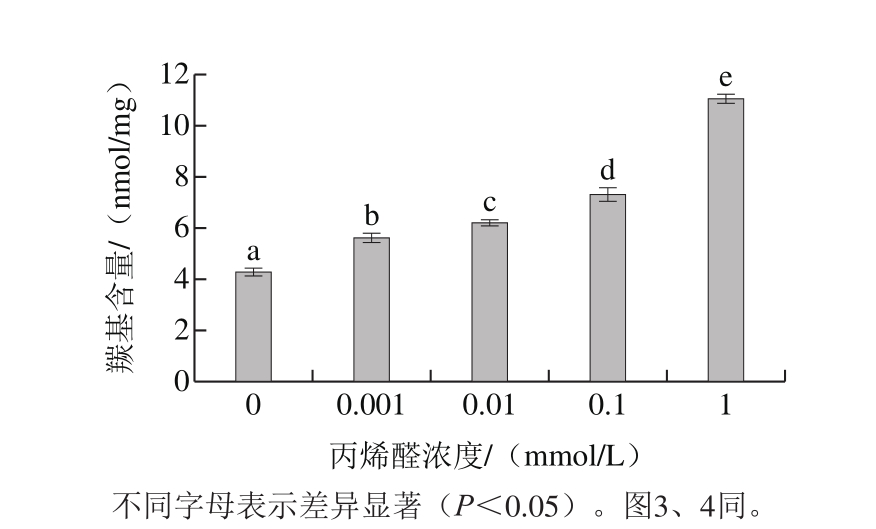
图1 丙烯醛氧化对核桃蛋白羰基含量的影响
Fig. 1 Effect of oxidative modification with acrolein on the carbonyl content of walnut protein
蛋白质氧化发生的显著变化之一就是羰基的形成,用羰基含量表征蛋白质氧化程度已经成为广泛共识。由图1可以看出,丙烯醛浓度为0 mmol/L时,核桃蛋白羰基含量为4.287 nmol/mg;随着丙烯醛浓度增加,核桃蛋白羰基含量显著增加(P<0.05);当丙烯醛浓度为1 mmol/L时,核桃蛋白羰基含量为11.078 nmol/mg,与未氧化的核桃蛋白相比增加了158.41%。Mellon等[19]研究发现当丙烯醛浓度为0.005~50 μmol/L时,突触体的蛋白质羰基值随着丙烯醛浓度的增加呈线性增加。这是因为核桃蛋白质中部分氨基酸残基上的基团与丙烯醛分子中存在的双键发生亲核加成反应生成NH3和相应的羰基衍生物[20]。
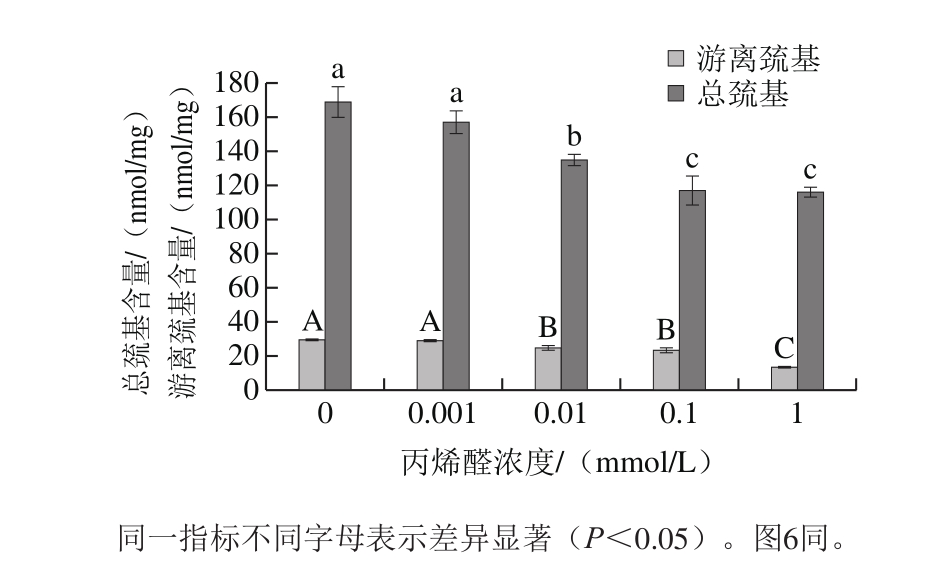
图2 丙烯醛氧化对核桃蛋白巯基含量的影响
Fig. 2 Effect of oxidative modification with acrolein on the sulfhydryl content of walnut protein
因蛋白质中的半胱氨酸最容易被氧化修饰,其氧化状态可反映蛋白质的氧化程度。而半胱氨酸的氧化状态通常用巯基含量来表征[21]。由图2可以得出,随着丙烯醛浓度的增加,核桃蛋白游离巯基和总巯基含量呈下降趋势;且丙烯醛浓度大于等于0.01 mmol/L时,游离巯基和总巯基含量显著下降(P<0.05)。当丙烯醛浓度达到1 mmol/L时,核桃蛋白游离巯基和总巯基含量相比于未氧化的蛋白分别下降55.18%和31.13%。李学鹏等[9]研究发现大黄鱼肌原纤维蛋白的游离巯基和总巯基含量随着丙烯醛浓度的增加而下降。这是因为软亲电试剂丙烯醛与软亲核试剂蛋白质巯基可迅速发生迈克尔加成反应,从而使暴露在外面的游离巯基含量降低[22]。随着丙烯醛浓度的增加,蛋白质氧化变性伸展使得蛋白质内部的巯基得到释放进一步与丙烯醛反应,从而使总巯基含量下降。同时研究结果表明丙烯醛氧化使核桃蛋白二硫键减少,这是由于丙烯醛氧化使得二硫键断裂,蛋白质构象发生变化。巯基与二硫键交互反应的平衡常数受蛋白质氧化修饰的影响[23],游离巯基和二硫键含量同时下降说明丙烯醛氧化使核桃蛋白生成了含硫氧化产物。
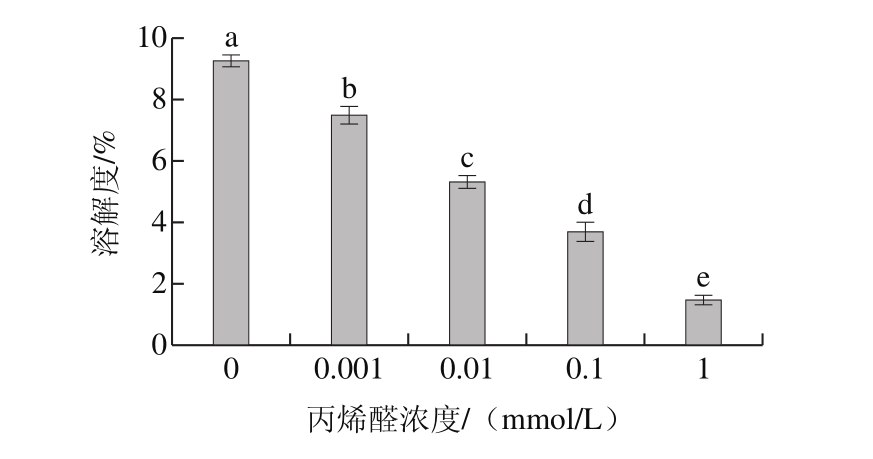
图3 丙烯醛氧化对核桃蛋白溶解度的影响
Fig. 3 Effect of oxidative modification with acrolein on solubility of walnut protein
溶解度的大小与蛋白样品的变性和聚集程度有关,是实现蛋白质功能性质的基础和前提[24]。由图3可以看出,丙烯醛氧化对核桃蛋白溶解度影响比较大。随着丙烯醛浓度的增加,核桃蛋白溶解度从9.25%降低到1.48%(P<0.05)。未氧化的核桃蛋白溶解度比较低是由于溶解性差的谷蛋白占核桃蛋白组成的70%以上且在核桃蛋白的氨基酸组成中主要以酸性氨基酸和疏水性氨基酸为主[13]。Ye Lin等[25]认为氧化导致花生分离蛋白溶解度下降是由于不溶性蛋白质氧化聚集体的形成。核桃蛋白溶解度随着氧化程度增加而下降的原因可能是核桃蛋白中多肽链的亲核基团与丙烯醛中的不饱和双键结合发生加成反应,蛋白质上氨基与丙烯醛上的羰基结合发生羰氨反应生成Schiff碱,两者共同作用使得蛋白质发生共价交联生成了大量不可溶性聚集体[10]。
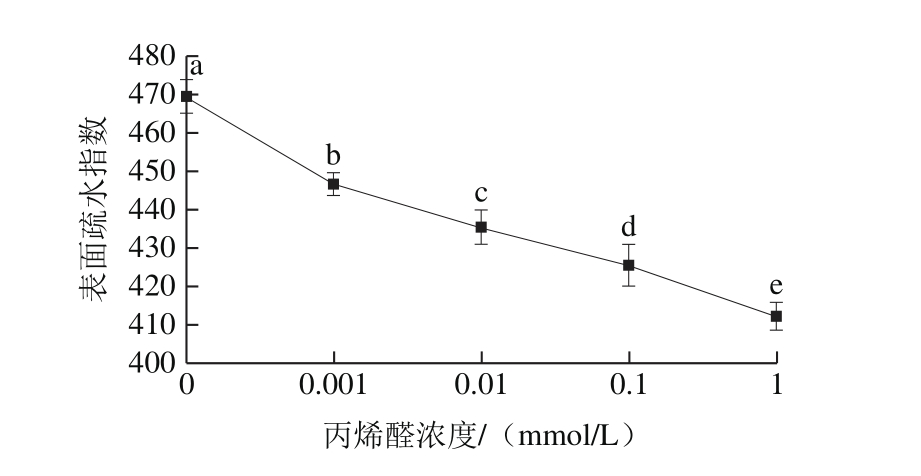
图4 丙烯醛氧化对核桃蛋白表面疏水性的影响
Fig. 4 Effect of oxidative modification with acrolein on the surface hydrophobicity of walnut protein
蛋白质表面疏水指数能够衡量蛋白质变性的程度[26],对蛋白质结构和功能特性有重要的影响[27]。表面疏水指数反映了蛋白质表面疏水性氨基酸的相对含量[26]。由图4可以看出,核桃蛋白的表面疏水指数随着丙烯醛浓度的增加显著下降,从469.47降低至412.22(P<0.05)。Tamamizu-Kato等[28]也发现丙烯醛氧化能够降低阿朴脂蛋白的表面疏水性。吴伟等[29]研究结果表明大豆蛋白被氧化后容易发生去折叠反应从而使其表面疏水性降低。丙烯醛氧化使得蛋白质发生变性,蛋白质结构被破坏,内部氨基酸残基被氧化,原本包藏在蛋白质内部的疏水性基团如芳香族氨基酸被暴露出来,这些暴露出来的疏水基团在疏水相互力的作用下形成氧化聚集体,从而使氧化核桃蛋白的表面疏水性下降;另外,蛋白质羰基等亲水基团的形成也是引起蛋白质表面疏水性下降的原因之一[30]。
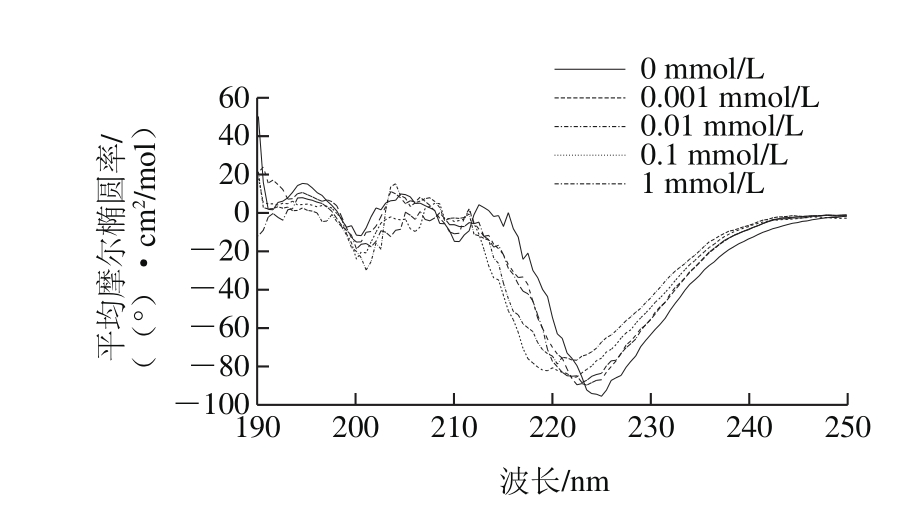
图5 核桃蛋白样品圆二色光谱图
Fig. 5 Circular dichroism spectra of walnut protein samples
表1 丙烯醛氧化对核桃蛋白二级结构的影响
Table 1 Effect of oxidative modification with acrolein on the secondary structure contents of walnut protein
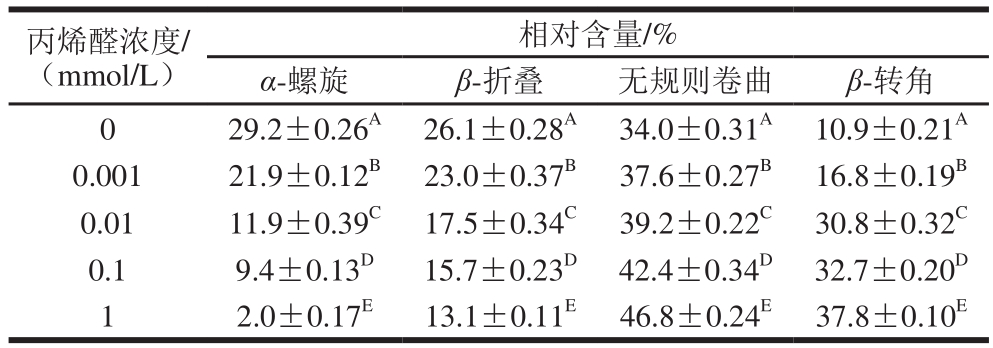
注:同列不同肩标大写字母表示差异显著(P<0.05)。
圆二色光谱技术对检测溶液蛋白质二级结构十分灵敏[31]。远紫外圆二色可以用来表征核桃蛋白氧化过程中二级结构的变化。如图5所示,未氧化核桃蛋白在波长209 nm和222 nm处各存在一个负肩峰,这是因为α-螺旋结构能够引起负科顿效应[17],195 nm附近的正峰和200 nm的凹槽说明未氧化核桃蛋白含有β-折叠结构和无规则卷曲结构。随着丙烯醛浓度的增加,195 nm处的正峰和209、222 nm处负肩峰强度呈现下降趋势,200 nm处的凹槽强度呈现增强趋势。通过软件分析得到氧化核桃蛋白二级结构相对含量,如表1所示。核桃蛋白中含有4 种类型的二级结构,其中以无规则卷曲和α-螺旋结构相对含量居多。随着丙烯醛浓度的增加,核桃蛋白α-螺旋、β-折叠相对含量减少,同时无规则卷曲和β-转角相对含量增加。丙烯醛氧化使得核桃蛋白中有序的α-螺旋、β-折叠结构转变为无序的无规则卷曲和β-转角结构,核桃蛋白二级结构发生改变。这一结果与吴伟等[32]研究蛋白质氧化对大米蛋白二级结构含量的影响结果一致。Sun Weizheng等[33]认为氧化导致蛋白结构展开使得α-螺旋发生解螺旋,导致有序结构下降。β-折叠结构的变化与蛋白表面疏水性有关[34],无规则卷曲和β-转角含量的变化影响蛋白质乳化稳定[35]。

图6 丙烯醛氧化对核桃蛋白乳化性和乳化稳定性的影响
Fig. 6 Effects of oxidative modification with acrolein on emulsifying capacity and emulsion stability of walnut protein
乳化特性是蛋白质重要的功能性质之一,通常用乳化性和乳化稳定性表征蛋白质的乳化特性[36]。由图6可以看出,随着氧化程度的增加,核桃蛋白乳化性和乳化稳定性均呈减小的趋势。未氧化的核桃蛋白乳化性和乳化稳定性分别为46.87 m2/g和25.93 min;丙烯醛浓度为1 mmol/L时,核桃蛋白乳化性和乳化稳定性分别下降了78.96%和32%(P<0.05)。说明丙烯醛氧化破坏了核桃蛋白乳化性和乳化稳定性。这一结果与核桃蛋白溶解度和表面疏水指数变化趋势相符合。李艳青[37]认为蛋白质聚集体的形成是造成其乳化性及乳化稳定性下降的主要原因。丙烯醛氧化导致核桃蛋白乳化性和乳化稳定性的降低,一方面是由于丙烯醛氧化使得蛋白质发生共价交联而形成的不可溶性蛋白质聚集体使得分子柔韧性降低,蛋白质溶解度和表面疏水性降低,蛋白表面积减小,蛋白膜黏度降低;另一方面是由于氧化使核桃蛋白质结构的完整性被破坏,蛋白质与界面的作用力减弱,蛋白质分子无法再结合到水-油界面形成稳定的界膜。
在核桃贮藏和加工过程中由LOX催化的脂质过氧化反应是导致核桃蛋白质发生结构性氧化修饰的主要途径。为探究核桃蛋白发生结构性氧化修饰并影响其功能性的机理,本研究以丙烯醛代表脂质氧化产生的次生产物,采用不同浓度的丙烯醛溶液氧化核桃蛋白,研究丙烯醛氧化对核桃蛋白结构和乳化特性的影响。结果表明丙烯醛能够使核桃蛋白发生显著氧化,导致核桃蛋白结构的变化。表现在核桃蛋白羰基含量显著增加;游离巯基和总巯基含量显著降低;二级结构发生变化,从而使核桃蛋白溶解度和表面疏水性减小,乳化性和乳化稳定性降低。研究结果表明丙烯醛氧化可使核桃蛋白发生结构性修饰,并对其乳化特性产生负面影响。本研究结果为核桃蛋白产品在加工及贮藏过程中品质控制提供参考,并为蛋白氧化过程中脂质氧化产生的次生产物对其结构和功能特性的影响提供理论支持。
参考文献:
[1] SHACTER E.Quantification and significance of protein oxidationin biological samples[J]. Drug Metabolism Reviews, 2000, 32(3/4): 307-326. DOI:10.1081/DMR-100102336.
[2] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition and Food Research,2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[3] 卢岩, 刘骞, 耿蕊. 羟基自由基氧化对大豆分离蛋白结构特性的影响[J]. 中国食品学报, 2015, 10(15): 73-79. DOI:10.16429/j.1009-7848.2015.10.010.
[4] 刘晶, 蔡勇健, 吴伟. 丙二醛氧化对大豆蛋白功能性质的影响[J].中国油脂, 2014, 39(6): 41-44.
[5] 李冰, 樊金拴, 李红娟. 我国核桃产业现状及发展对策[J]. 防护林科技, 2012(1): 76-78. DOI:10.13601/j.issn.1005-5215.2012.01.005.
[6] 陆俊, 赵安琪, 成策, 等. 核桃营养成分与生理活性及开发利用[J]. 食品与机械, 2016, 30(6): 238-241. DOI:10.13652/j.issn.1003-5788.2014.06.057.
[7] CREWS C, HOUGH P, GODWARD J, et al. Study of the main constituents of some authentic walnut oils[J]. Journal of Agricultural and Food Chemistry, 2005, 53(12): 4853-4860. DOI:10.1021/jf0478354.
[8] DELLES R M, XIONG Y L. The effect of protein oxidation on hydration and water-binding in pork packaged in an oxygen-enriched atmosphere[J]. Meat Science, 2014, 97(2): 181-188. DOI:10.1016/j.meatsci.2014.01.022.
[9] 李学鹏, 王祺, 周凯, 等. 丙烯醛氧化对大黄鱼肌肉组织和肌原纤维蛋白结构性质的影响[J]. 现代食品科技, 2014, 30(10): 1-7.DOI:10.13982/j.mfst.1673-9078.2014.10.001.
[10] WU W, WU X J, HUA Y F. Structural modification of soy protein by the lipid peroxidation product acrolein[J]. LWT-Food Science and Technology, 2010, 43(1): 133-140. DOI:10.1016/j.lwt.2009.05.006.
[11] 赵润泽, 蒋将, 李进伟, 等. 烘烤对核桃蛋白二级结构、表面疏水性及乳化性的影响[J]. 食品工业科技, 2016, 37(16): 157-166.DOI:10.13386/j.issn1002-0306.2016.16.023.
[12] TAPAL A, TIKU P K. Complexation of curcumin with soy protein isolate and its implicationson solubility and stability of curcumin[J]. Food Chemistry, 2012, 130(4): 960-965. DOI:10.1016/j.foodchem.2011.08.025.
[13] 毛晓英. 核桃蛋白质的结构表征及其制品的改性研究[D]. 无锡:江南大学, 2012.
[14] WU W, LIN Q L, HUA Y F, et al. Study on mechanism of soy protein oxidation induced by lipid peroxidation products[J]. Advance Journal of Food Science and Technology, 2013, 5(1): 46-53. DOI:10.19026/ajfst.5.3310.
[15] HUANG Y R, HUA Y F, QIU A Y. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International, 2006, 39(2): 240-249. DOI:10.1016/j.foodres.2005.07.012.
[16] 叶林. 花生蛋白质氧化作用及其对花生乳饮料稳定性影响的研究[D].广州: 华南理工大学, 2014.
[17] 吴伟. 蛋白质氧化对大豆蛋白结构和凝胶性质的影响[D]. 无锡:江南大学, 2010.
[18] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[19] MELLO C F, SULTANA R, PIRODDI M, et al. Acrolein induces selective protein carbonylation in synaptosomes[J]. Neurocience,2007, 147(3): 674-679. DOI:10.1016/j.neuroscience.2007.04.003.
[20] ESTERBAUER H, SCHAUR R J, ZOLLNER H. Chemistry and biochemistry of 4-hydroxynonenal, malonaldehyde and related aldehydes[J]. Free Radical Biology and Medicine, 1991, 11(1): 81-128. DOI:10.1016/0891-5849(91)90192-6.
[21] 朱卫星, 王远亮, 李宗军. 蛋白质氧化机制及其评价技术研究进展[J]. 食品工业科技, 2011, 32(11): 483-486. DOI:10.13386/j.issn1002-0306.2011.11.133.
[22] LOPACHIN R M, BARBER D S, GAVIN T. Molecular mechanisms of the conjugated α, β-unsaturated carbonyl derivatives: relevance to neurotoxicity and neurodegenerative diseases[J]. Toxicological Sciences, 2008, 104(2): 235-249. DOI:10.1093/toxsci/kfm301.
[23] THOMAS J A, MALLIS R J. Aging and oxidation of reactive protein sulphydryls[J]. Experimental Gerontology, 2001, 36(9): 1519-1526.DOI:10.1016/S0531-5565(01)00137-1.
[24] 吴伟, 蔡勇健, 吴晓娟, 等. 丙二醛氧化对大米蛋白功能性质的影响[J]. 食品工业科技, 2015, 36(18): 113-116. DOI:10.13386/j.issn1002-0306.2015.18.014.
[25] YE L, LIAO Y, ZHAO M M, et al. Effect of protein oxidation on the conformational properties of peanut protein isolate[J]. Journal of Chemistry, 2013, 2013: 1-6. DOI:10.1155/2013/423254.
[26] WANG J, ZHAO M, YANG X, et al. Improvement on functional properties of wheat gluten by enzymatic hydrolysis and ultrafiltration[J]. Journal of Cereal Science, 2006, 44(1): 93-100.DOI:10.1016/j.jcs.2006.04.002.
[27] HOU D H, CHANG K C. Structural characteristics of purified glycinin from soybeans stored under various conditions[J]. Journal of Agricultural and Food Chemistry, 2004, 52(12): 3792-3800.DOI:10.1021/jf035072z.
[28] TAMAMIZUKATO S, WONG J Y, JAIRAM V, et al. Modification by acrolein, a component of tobacco smoke and age-related oxidative stress, mediates functional impairment of human apolipoprotein E[J].Biochemistry, 2007, 46(28): 8392-8400. DOI:10.1021/bi700289k.
[29] 吴伟, 林亲录, 华欲飞. 脂质氢过氧化物氧化修饰对大豆蛋白去折叠和复折叠性质的影响[J]. 中国粮油学报, 2011, 26(7): 17-21.
[30] 卢岩, 于飞, 刘骞, 等. 蛋白氧化对大豆蛋白凝胶和乳化特性影响的研究进展[J]. 食品研究与开发, 2014, 21(35): 413-147. DOI:10.3969/j.issn.1005-6521.2014.21.038.
[31] MOURE A, SINEIRO J, DOMINGUEA H, et al. Functionality of oilseed peotein products: a review[J]. Food Research Internation,2006, 39(9): 945-963. DOI:10.1016/j.foodres.2006.07.002.
[32] 吴伟, 李彤, 蔡勇建, 等. 过氧自由基氧化对大米蛋白结构的影响[J]. 现代食品科技, 2016, 32(11): 111-116. DOI:10.13982/j.mfst.1673-9078.2016.11.017.
[33] SUN W Z, ZHOU F B, SUN D W, et al. Effect of oxidation on the emulsifying properties of myofibrillar proteins[J]. Food and Bioprocess Technology, 2013, 6(7): 1703-1712. DOI:10.1007/s11947-012-0823-8.
[34] PRZYBYCIEN T M, BAILEY J E. Secondary structure perturbations in salt-induced protein precipitates[J]. Biochem Biophys Acta, 1991,1076: 103-111. DOI:10.1016/0167-4838(91)90226-P.
[35] 赵润泽, 蒋将, 李进伟, 等. 烘烤对核桃蛋白二级结构、表面疏水性及乳化性的影响[J]. 食品工业科技, 2016, 37(16): 157-166.DOI:10.13386/j.issn1002-0306.2016.16.023.
[36] 田童童, 巩子路, 朱新荣. 蛋白质氧化对乳清分离蛋白功能性质的影响[J]. 现代食品科技, 2014, 30(7): 110-116. DOI:10.13982/j.mfst.1673-9078.2014.07.029.
[37] 李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D]. 哈尔滨: 东北农业大学, 2013.
Inf l uence of Oxidative Modification with Acrolein on Structural and Emulsifying Properties of Walnut Protein
SUN Lingge, WANG Dandan, MAO Xiaoying*, ZHAN Ping, TIAN Honglei
(College of Food, Shihezi University, Shihezi 832000, China)
Abstract:In order to investigate the effect of oxidative modification with reactive aldehyde on the structural and emulsifying properties of walnut protein, acrolein (0–1 mmol/L) was selected as a representative secondary byproduct of lipid peroxidation induced by lipoxygenase (LOX) for incubation with walnut protein. The results showed that the carbonyl content of walnut protein significantly increased from 4.287 to 11.078 nmol/mg with increasing aldehyde concentration,accompanied by a decrease in free sulphydryl and total sulphydryl by 55.18% and 31.13%, respectively suggesting that acrolein caused significant changes to walnut protein. The solubility of walnut protein decreased by up to 84% with the increase in its degree of oxidation, and the surface hydrophobicity declined from 469.47 to 412.22; the contents of α-helix and β-sheet increased, while the contents of β-turn and random coil decreased. In addition, the emulsifying capacity and emulsion stability of walnut protein decreased from 46.87 to 9.86 m2/g and from 25.93 to 17.63 min, respectively. All of these results indicate that acrolein can lead to oxidative structural modification of walnut protein, thus causing damage to the emulsifying properties of the protein.
Keywords:acrolein; protein oxidation; walnut protein; structure; emulsifying properties
SUN Lingge, WANG Dandan, MAO Xiaoying, et al. Influence of oxidative modification with acrolein on structural and emulsifying properties of walnut protein[J]. Food Science, 2018, 39(20): 43-48. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201820007. http://www.spkx.net.cn
引文格式:孙领鸽, 王丹丹, 毛晓英, 等. 丙烯醛氧化修饰对核桃蛋白结构和乳化特性的影响[J]. 食品科学, 2018, 39(20): 43-48.DOI:10.7506/spkx1002-6630-201820007. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0043-06
文献标志码:A
中图分类号:TS201
DOI:10.7506/spkx1002-6630-201820007
*通信作者简介:毛晓英(1976—),女,副教授,博士,主要从事植物蛋白结构与功能性研究。E-mail:maoxiaoying99@163.com
第一作者简介:孙领鸽(1993—),女,硕士研究生,主要从事植物蛋白结构与功能性研究。E-mail:13119936760@163.com
基金项目:国家自然科学基金地区科学基金项目(31560433)
收稿日期:2017-07-27