表1 模拟消化液(唾液、胃液、小肠液)成分
Table 1 Compositions of digestive juices used for in vitro digestion of fi sh samples

胡吕霖,任思婕,沈 清,陈健初*,叶兴乾
(浙江大学生物系统工程与食品科学学院,馥莉食品研究院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程中心,浙江 杭州 310058)
摘 要:研究水煮、汽蒸、微波、烤箱烤制、油炸5 种烹饪方式对鲟鱼肉的脂肪和蛋白质氧化的影响,熟肉在模拟消化过程中后续氧化情况及这些氧化反应与蛋白质消化性的相互关系。结果表明,不同烹饪方式均导致鱼肉的脂质与蛋白质氧化,其中烤制与油炸的样品氧化程度最显著,这些氧化反应会在模拟胃肠道消化过程中进一步加深,尤其在模拟肠消化阶段变化更为强烈。在烹饪与消化过程中,脂质与蛋白质的相互氧化作用也非常明显。此外,不同烹饪方式引起的蛋白质氧化显著影响蛋白质在模拟消化过程中的水解程度。在胃消化阶段,烤制与油炸样品中大分子蛋白氧化聚集形成致密结构,降低了蛋白质消化性;小肠消化后,由于部分小分子肽类(<14 kDa)无法被彻底水解,各类熟制样品的游离氨基值均低于原料肉。
关键词:烹饪方式;鱼类;蛋白质氧化;蛋白水解;体外模拟消化
烹调是常见的肉类热处理方式之一。烹调加工有许多益处:高温消灭致病菌、腐败菌等有害微生物以保证肉类安全可食;赋予肉类良好的感官品质,如产生诱人香气与可口滋味[1];促使蛋白质变性以助消化。同时,烹调加工又不免带来一些消极作用,如脂质、蛋白质氧化等一系列化学反应损害肉的感官品质与营养价值。
脂质氧化会使食品产生不良风味,也会产生有害物质,例如丙二醛(malondialdehyde,MDA)和4-羟基-2-壬烯醛(4-hydroxynon-2-enal,HNE)[2]。蛋白质的氧化会导致多种结构性变化,例如蛋白质分子交联与聚集、侧链残基的氧化修饰等,影响蛋白质对消化酶的敏感性。因此,肉类蛋白的氧化可能会导致必需氨基酸损失、消化性减弱、氨基酸生物利用度降低及有害物质生成,从而损害肉蛋白的营养价值[3]。
除了烹饪加工使脂质与蛋白质发生氧化之外,熟肉在人体消化过程中,其组分会因消化液中促氧化因子(酸碱性、抗坏血酸、铁离子等)的存在而继续遭受氧化攻击[4],Estévez等[5]指出消化道中脂质与蛋白氧化产物的累积对人体健康具有潜在危害。已有许多文献报道了烹饪加工对肉类脂质和蛋白质的氧化影响[6-8],而熟肉中这些组分在消化道中的后续氧化,及这些氧化反应与蛋白质的消化性的相互作用仍有待探究。目前,体外消化法已经被广泛用于研究食物各组分在消化道中的降解、释放及氧化变化[9-10]。
长久以来,鱼类受人们的喜爱且是日常饮食中常见的食物,其丰富的优质蛋白与多不饱和脂肪酸对人体有益。鲟鱼,是亚洲重要的商业鱼类,珍贵的鱼子酱是其主要价值来源,而鱼肉的利用率却很低。实际上,鲟鱼肉质地无骨、肉味鲜美,具有较好的食用价值。本研究以鲟鱼为食材,将其进行水煮、汽蒸、微波加热、烤箱烤、油炸5 种烹调处理,再通过体外模拟消化,测定经烹调处理后及体外模拟消化后鲟鱼肉中脂质与蛋白氧化情况,同时探究这些组分的氧化与蛋白质消化性之间的联系,为建立鱼类合理烹调方式,提高鱼类营养价值提供科学依据。
冷冻鲟鱼块由浙江千岛湖鲟龙科技股份有限公司提供,在冰块包裹下2 h内送达实验室。
4%~20%预制凝胶、上样缓冲液、宽分子质量蛋白标准、二硫苏糖醇、胃蛋白酶、胰酶 美国Sigma-Aldrich公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DNTB)、2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS) 上海阿拉丁公司;改良Bradford蛋白含量测定试剂盒、考马斯亮蓝染色液 生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
电磁炉 美的集团;JYL-C16V料理机 九阳股份有限公司;家用煮锅 浙江苏泊尔股份有限公司;微波炉、电蒸箱、电烤箱 宁波方太厨具有限公司;控温油炸锅 英联斯特(广州)餐饮设备有限公司;MA-150水分测定仪 赛多利斯科学仪器(北京)有限公司;K9860全自动凯氏定氮仪 济南海能仪器股份有限公司;旋转蒸发仪 上海亚荣生化仪器厂;FSH-II型高速电动匀浆机 江苏金坛市振兴仪器厂;HH-10数显恒温搅拌水浴锅 金坛市科杰仪器厂;电热恒温振荡水浴锅上海一恒科技有限公司;UV 2550紫外-可见分光光度计日本岛津公司;Cary Eclipse荧光分光光度计 美国安捷伦公司;Multiskan GO全波长酶标仪 美国赛默飞世尔科技公司;VE 180微型垂直电泳槽、EPS电泳仪、Tanon 2500R凝胶成像仪 上海天能科技有限公司;innoLab 20P pH计 英国普律玛仪器有限公司。
1.3.1 鲟鱼烹饪方法
将冷冻鲟鱼置于冰箱冷藏室(4 ℃)过夜解冻。将解冻后的鱼肉切成大小相似的块状(7 cm×5 cm×1.5 cm)所有鱼块分成6 组:对照(生肉)、水煮处理、汽蒸处理、微波加热、烤箱烤制、油炸处理。
1)水煮:将鱼块放入沸水中,煮制8 min后捞出,吸去表面水分。2)汽蒸:将鱼块整齐地摆放在带孔不锈钢盘中,将钢盘放入电蒸箱内开始蒸制。电蒸箱温度设置100 ℃,时间设定为8 min。结束后取出吸去表面水分。3)微波:将鱼块放入微波专用碗中,再放入微波炉中加热。功率设定为800 W,加热3 min后取出,翻面,再放入微波炉继续加热3 min。结束后取出吸去表面水分(油分)。4)烤制:将鱼块整齐地摆放于烤盘上,将烤盘放入电烤箱中。烤箱温度设定为200 ℃,加热时间20 min(10 min后取出翻面,再放入烤箱)。结束后取出吸去表面油分。5)油炸:鱼块浸没于预先加热至180 ℃的大豆油中,油炸5 min。结束后取出吸去表面油分。
所有烹饪方式都以样品中心温度达约80~90 ℃为结束点,所有处理组样品一式3 份。为单纯研究烹饪方式对物料的影响,本实验不额外添加其他调料。待样品冷却后,绞碎,包装于塑封袋中置于-80 ℃冰箱以待后续检测。检测前,各类肉样(装于塑封袋中)均在室温下解冻1 h。
1.3.2 体外模拟消化模型
称取2 g肉样依次经过口-胃-肠三部分消化体系(各阶段模拟消化液成分参照Van Hecke等[4],具体如表1所示)先在3 mL模拟唾液中消化5 min,再加入5 mL模拟胃液(含胃蛋白酶),调pH 2.0±0.2,消化1 h ,最后加入5 mL模拟小肠液(含胰酶),调pH 8.0±0.2,消化2 h。整个消化过程,样品置于37 ℃恒温振荡水浴锅中。每种肉样重复3 次消化实验。分别留取胃消化后的与经过整个消化过程的样品,贮存于EP管中置于-80 ℃冰箱以待后续检测。
表1 模拟消化液(唾液、胃液、小肠液)成分
Table 1 Compositions of digestive juices used for in vitro digestion of fi sh samples

1.3.3 基础成分分析
1.3.3.1 脂肪含量
参照Folch等[11]方法,称取10 g肉样,加入100 mL二氯甲烷-甲醇(2∶1,V/V)溶液,于55 ℃提取30 min,抽滤后于烘箱干燥,得到的产品称量,计算脂肪质量分数,每个样品重复实验3 次,取平均值。
1.3.3.2 蛋白质含量
精确称取0.200 0 g样品于消化管中,加入0.2 g无水硫酸铜,3 g硫酸钾,10 mL浓硫酸,再放入消化炉,于120 ℃消化40 min,240 ℃消化40 min,360 ℃消化1 h,420 ℃消化1 h,消化结束后冷却至室温后利用全自动凯氏定氮仪测定。每个样品重复实验3 次,取平均值。
1.3.3.3 水分含量
称取约3 g肉样,铺平于样品盘上,使用AM150快速水分测定仪测定,每个样品重复3 次,取平均值。
1.3.4 硫代巴比妥酸(thiobarbituric reactive substances,TBARS)值测定
参考S u n等[12]方法,取2 g肉样,加1 0 m L 10 g/100 mL的三氯乙酸(含0.1%乙二酸四乙胺)溶液,用组织高速匀浆机均质处理30 s(10 000 r/min),过滤,取滤液3 mL,加3 mL 0.02 mol/L TBARS溶液,100 ℃沸水浴中反应45 min,取出后冷却至室温,于532 nm波长处测定吸光度。所有样品重复实验3 次,结果用1 kg肉(干基)中MDA当量(以质量计)表示,单位为mg/kg。
1.3.5 蛋白总羰基值测定
参考Mercier等[13]的方法,即DNPH比色法。取2 g肉样于10 mL含浓度0.6 mol/L NaCl的20 mmol/L磷酸缓冲液(pH 6.5)中匀浆,离心取上清液即为蛋白提取液。每0.4 mL的蛋白液(或消化液)加入0.2 mL含浓度10 mmol/L DNPH的2 mol/L的HCl溶液,30 ℃避光水浴l h(每隔10 min旋涡1 次)。充分反应后加入1 mL质量分数40%的三氯乙酸沉淀蛋白质,静置20 min,13 000 r/min离心15 min,弃上层清液,用1 mL乙酸乙酯-乙醇(l∶1,V/V)洗涤沉淀,在13 000 r/min离心10 min以去除未反应的DNPH,重复上述洗涤过程,直至上清液为无色透明。用3 mL盐酸胍溶液(6 mol/L)溶解沉淀,溶液于370 nm处测定羰基物质吸光度,并于278 nm波长处测定蛋白浓度。利用羰基分子吸光系数22 000 L/(mol·cm)计算羰基含量。实验重复3 次,结果用1 mg蛋白中羰基物质的量表示,单位为nmol/mg。
1.3.6 游离巯基值测定
根据Morzel等[14]的方法测定巯基,即经过适当修改的Ellman试剂法。取2 g肉样于10 mL 50 mmol/L磷酸缓冲液(pH 8.0)中匀浆,离心取上清液即为蛋白液。经10 倍稀释的蛋白质液样(或消化液)加入0.02 mL 2 mmol/L DTNB,然后将混合液在25 ℃避光反应1 h,在412 nm波长处测定吸光度。利用巯基的分子吸光系数13 600 L/(mol·cm)计算巯基含量。实验重复3 次,结果用1 g 肉(干基)中巯基物质的量表示,单位为nmol/g。
1.3.7 席夫碱类(Schiff bases,SB)物质测定
参考Gatellier等[15]的方法,取4 g肉样于10 mL 20 mmol/L磷酸缓冲液(pH 6.5)中匀浆,离心取上清液。在四面透光比色皿中倒入3 mL上清液,放入Cary Eclipse荧光分光光度计中,对上清液进行380~600 nm的荧光发射光谱扫描(激发波长设定为360 nm,激发发射狭缝均为5 nm)。所有样品重复2 次实验。
1.3.8 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)
将各消化液样品与上样缓冲液以3∶1比例混合,于70 ℃水浴加热10 min。制样完毕后,在4%~20%预制胶的每孔中加入10 μL样品,在150 V电压下与Tricine SDS电解缓冲液中通电70 min。电泳结束后,取下胶片,用蒸馏水冲洗5 min,再用考马斯亮蓝R-250染色1.5 h。接着,用甲醇-乙酸-水(45∶10∶45,V/V)溶液进行脱色。最后用2500R凝胶成像系统对胶片进行拍照。
1.3.9 游离氨基测定
参考Adler-Nissen等[16]的方法,利用TNBS测定。取2 g肉样于10 mL pH 8.0磷酸缓冲液中匀浆,离心取上清液即为蛋白液。取1 mL蛋白液(或消化液)与1 mL 0.5% TNBS溶液振荡混匀,在50 ℃避光条件下水浴中反应1 h。随后加入2 mL的0.1 mol/L盐酸溶液终止反应,溶液在340 nm波长处测定吸光度。自由氨基含量根据甘氨酸含量的标准曲线确定。实验重复3 次,结果用1 g肉(干基)中甘氨酸当量(以物质的量计)表示,单位为mol/g。
测定结果均以 ±s表示,方差分析进行Duncan’s差异分析,P值小于0.05表示差异显著。
2.1.1 烹饪方式及模拟消化阶段对鱼肉脂肪氧化的影响

图1 不同烹饪方式下及消化前后的鱼肉脂肪氧化情况
Fig. 1 Lipid oxidation in sturgeon fi llets during cooking and in vitro digestion
如图1所示,不同烹饪导致的脂肪氧化程度不同。水煮、汽蒸、微波加热及油炸肉样的TBARS值分别为0.73、0.72、0.92 mg/kg和0.77 mg/kg,均高于原料的0.61 mg/kg。然而,烤制鱼肉中TBARS值(0.52 mg/kg)却显著低于原料及经其他处理方式的肉样,理论上,烧烤涉及长时间的高温条件,应当加剧脂肪氧化,致使更多MDA等次级氧化产物生成,TBARS值增大。Utrera[17]及Roldan[18]等研究报道了类似结果,长时间高温加热下,肉中TBARS值反而会下降。原因可能是醛类等次级氧化产物会继续降解成挥发性物质,除此之外,在长时间的高温刺激下,醛类还会与肉中其他组分,如蛋白质相互结合,导致能与TBARS试剂反应的醛类减少,从而TBARS值降低。
经模拟胃肠道消化后,各肉样中的TBARS值相对于消化前都显著升高,尤其在肠道消化过程中升高幅度更大。在胃消化阶段,胃液的强酸环境与胃液中含有的抗坏血酸、金属离子等助氧剂与催化剂,会促进脂质进一步氧化,并且消化前肉样的TBARS值的高低会影响胃消化后TBARS值的高低,与Rysman等[19]研究结果一致。模拟肠消化过程中脂肪氧化比胃消化阶段强烈,原因可能如下:脂质在含脂肪酶的模拟胰液中水解,产生大量游离脂肪酸,而游离脂肪酸比酯化的脂肪酸更容易遭受氧化。烤制的肉样经过消化后TBARS仍较低,推测虽然消化过程中脂质氧化加强,但是生成更多的醛类转变成挥发性物质,或与蛋白质等其他组分相互作用。
2.1.2 烹饪方式及模拟消化阶段对鱼肉蛋白羰基产物的影响
羰基化是蛋白氧化最显著的特征之一。本实验中羰基含量通过DNPH法测得,结果如图2所示。经水煮、汽蒸的样品中羰基含量比原料增加了近1 倍,微波加热的样品中羰基含量增加了约2 倍,而烤制与油炸样品中的羰基含量增加程度显著高于其他烹饪方式。本实验结果与许多研究相一致,Traore等[20]研究了水煮过程中猪肉的蛋白氧化情况,与原料肉相比,煮后熟肉蛋白的羰基值较高,且30 min水煮处理后的羰基值高于10 min水煮。Gatellier等[21]用不同温度的蒸汽对牛肉加热,在高温下(肉表面温度达207 ℃),羰基产物增加为原料肉的6 倍。
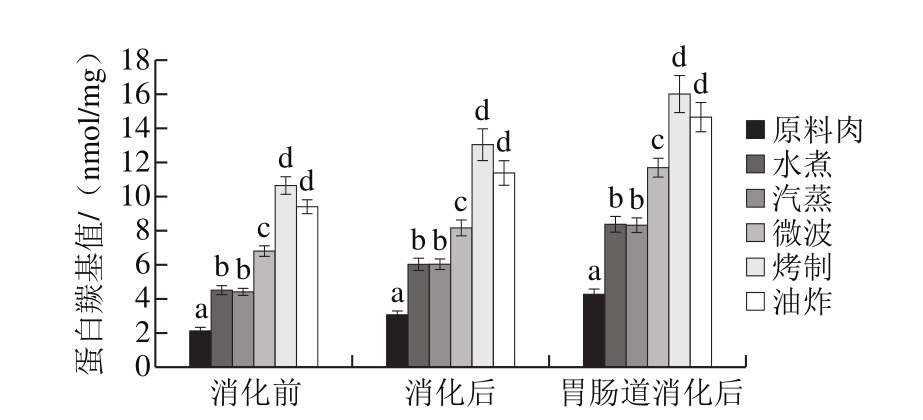
图2 不同烹饪方式下及消化前后的鱼肉蛋白羰基产物含量变化
Fig. 2 Changes in protein carbonyl level in sturgeon fi llets during cooking and in vitro digestion
蛋白羰基产物可通过许多途径形成,最主要的是以下两条:1)赖氨酸、精氨酸等侧链氨基酸直接氧化引进羰基基团;2)与脂肪氧化产物,如HNE、MDA等非蛋白来源的羰基物质,发生加成作用[19]。烤制样品经长时间高温加热,羰基含量大量增加在意料之中,而在油炸处理的情况下,肉中的蛋白暴露于油脂的机会大大增加,考虑到油脂氧化会促进蛋白氧化,所以除了途径1之外,途径2引起的羰基含量增加也成为主要原因。
如图2所示,胃和肠消化后,样品羰基含量相比未消化肉样显著升高,且不同阶段各肉样之间的含量变化趋势是类似的,即消化前后,羰基含量最高的均是经烧烤处理的肉样,而羰基含量最低的均是原料肉。模拟小肠消化过程中,蛋白质羰基增加幅度更大,原因可能是上述途径2起了更重大的作用,因为脂肪氧化在这一阶段也更为剧烈(图1),生成更多醛类与蛋白质发生间接氧化。
蛋白质羰基化会影响肉类的营养价值,除了一些必需氨基酸因羰基化而损失之外,羰基基团还可与其他氨基酸残基或其他羰基形成交联,生成希夫碱结构和羟醛缩合产物[19],这些交联会促使蛋白质聚集进而影响蛋白质消化性。
2.1.3 烹饪方式及模拟消化阶段对鱼肉游离巯基值的影响
含硫氨基酸(半胱氨酸与甲硫氨酸)易氧化生成多种产物,如次磺酸、亚磺酸与磺酸等硫氧化合物与二硫键交联产物[23]。因此游离巯基含量常用来表示蛋白氧化程度,即游离巯基损失越多代表氧化程度越高。
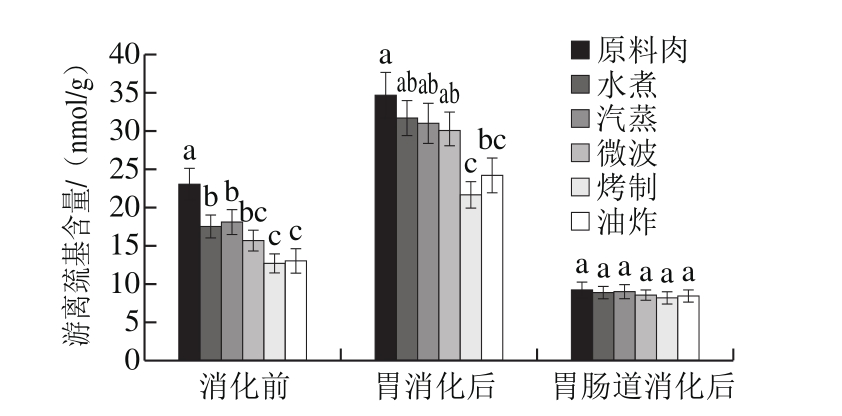
图3 不同烹饪方式下及消化前后的鱼肉游离巯基含量变化
Fig. 3 Changes in free thiol level in sturgeon fi llets during cooking and in vitro digestion
本实验中,经不同烹饪方式后的肉样都损失了较多游离巯基(图3),与蒸煮、微波加热肉样相比,烤制与油炸样品中游离巯基损失程度最大,约为40%。此结果与国内外其他研究相一致,如Hernández-lópez等[24]对猪肉水煮后,发现巯基损失了约50%,同时二硫键含量增加。但是也有研究人员发表了不同结果,Promeyrat等[25]发现加热过程中,蛋白质的游离巯基含量会呈现两阶段变化,可能由于初始阶段高温使二硫键断裂,巯基增多,而随着加热时间延长,巯基氧化损失严重。
与未消化的样品相比,经胃消化后的样品游离巯基含量显著增加(增幅约为50%),趋势与消化前一致,推测在胃蛋白酶作用下部分水解的蛋白分子结构展开,使更多被掩盖的巯基基团暴露于外与DTNB试剂反应。
虽然胃阶段中,游离巯基含量大幅度增加,但在肠消化阶段中又大量减少,甚至显著低于肉样消化前的巯基数量,表明巯基在肠消化期间氧化程度严重,并且从结果来看似乎不受烹饪方式的影响。原因可能是,在肠消化液中胰酶的作用下,蛋白较为彻底的水解使得大量半胱氨酸或含半胱氨酸的短肽释放出来,暴露于消化液中遭受ROS等自由基攻击。
2.1.4 脂质与蛋白质相互作用——SB含量
SB的生成可表征脂质与蛋白的相互氧化作用。蛋白质的游离氨基(赖氨酸、精氨酸、谷氨酰胺等侧链残基)可与醛类等脂质氧化产物发生加成反应形成含R—C=N—的物质[26],其荧光特性较强,因此可利用荧光光谱法分析其含量。
不同烹饪处理后的肉样提取液的荧光光谱图呈现不同形态,如图4所示,蒸和煮方式对肉样荧光特性影响较小,只是略微提高,而烤制与油炸处理的肉样的荧光强度大幅度增加,几乎是原料肉的10 倍。Gatellier等[15]加热牛肉至表面温度分别达65、96、207 ℃,探究烹饪过程中蛋白与脂肪氧化的关系。结果表明温度越高,SB含量越多,蛋白总羰基含量越高,而TBARS值则先升后降,猜测蛋白与脂质氧化产物醛类可能发生了加成反应,从而形成含SB结构的物质。胃肠道消化会进一步促进SB生成,在小肠消化中此现象更为明显,主要原因可能是,蛋白质与脂质在胰酶作用下中充分降解,释放大量游离脂肪酸与氨基酸,使两者之间的接触机会大大增加,从而促进SB大量生成。并且烤制与油炸的样品消化后SB含量仍是最高,消化后的SB含量与消化前的初始值关系很大。
另外,原料肉及水煮、汽蒸、微波加热肉样的荧光谱图带有2 个峰(405、515 nm),而油炸与烤制的肉样提取物的光谱只显示一个峰,峰形变宽,且从原来的405 nm红移向425 nm处,此红移现象同时发生在消化前后的样品光谱图中,原因可能是SB的大量增多,两个峰相互重叠,致使第2个小峰消失不见,峰的位移则表明不同烹饪方式及模拟消化过程会导致含有不同复杂结构的SB生成,但确切结构还有待解析。SB结构与其他交联的形成会促进蛋白质聚集,影响蛋白质的消化率。
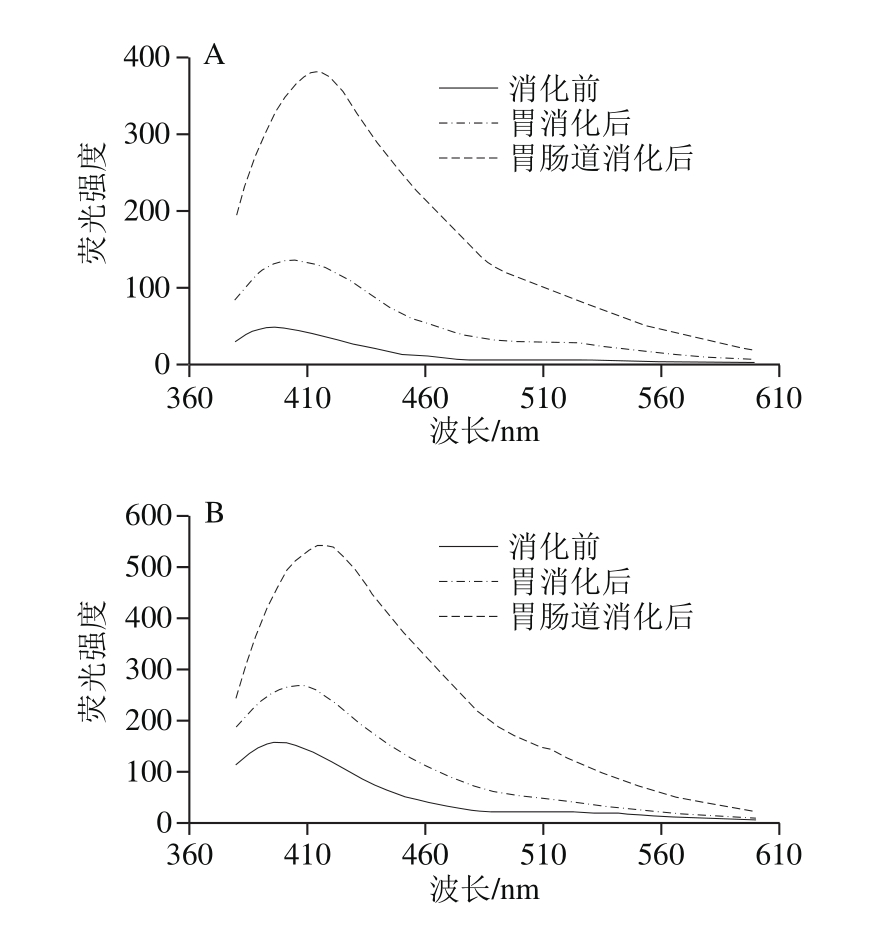
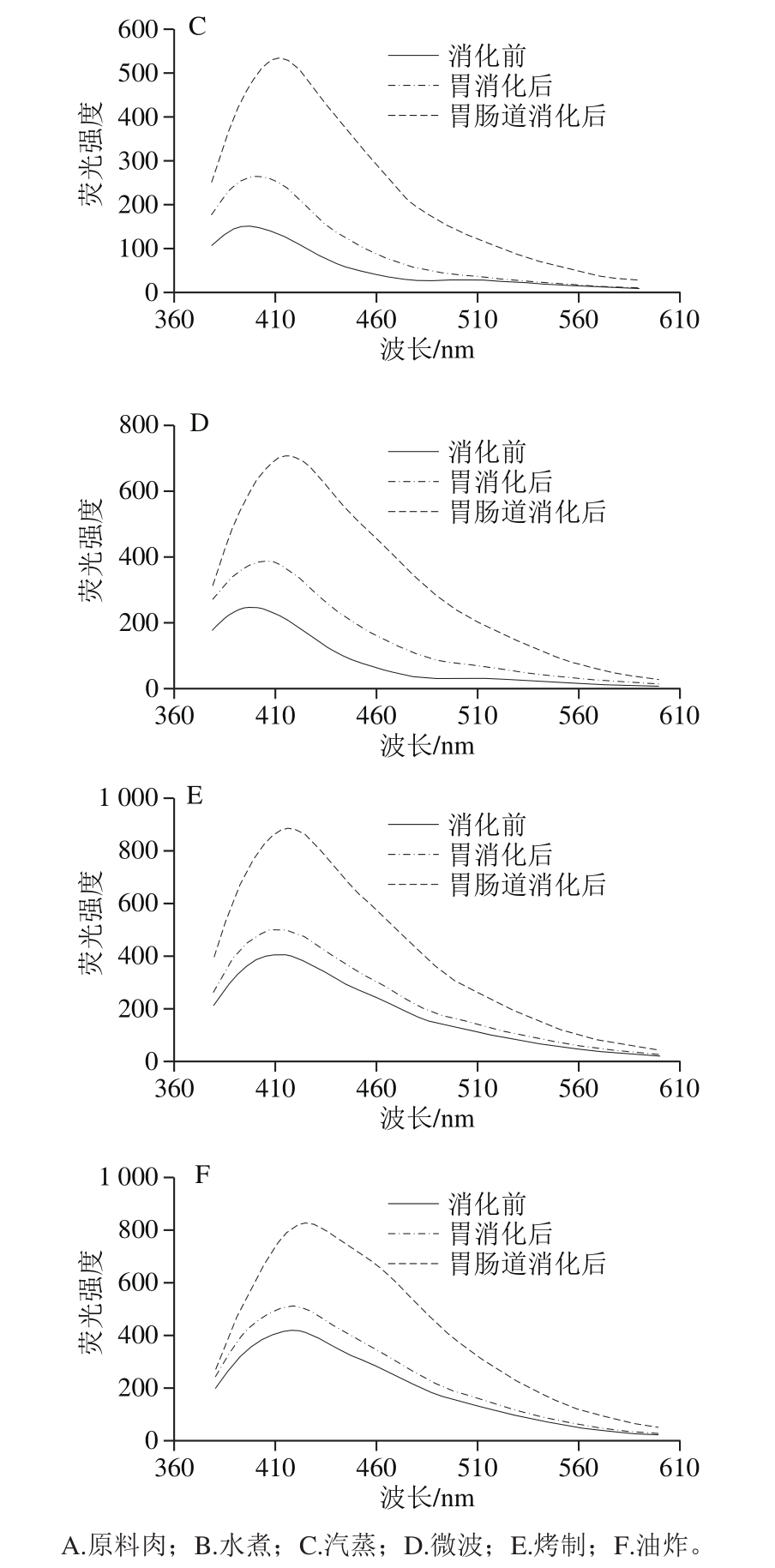
图4 不同烹饪方式下及消化前后的鱼肉的荧光特性变化
Fig. 4 Emission fl uorescence spectra (formation of Schiff bases) of extracts from sturgeon fi llets during cooking and in vitro digestion
2.2.1 SDS-PAGE
在不添加胃蛋白酶的模拟胃液中消化1 h后,与原料肉相比,不同烹饪方式后的鱼肉蛋白条带有所变化(图5)。原料肉与水煮、汽蒸、微波加热肉样的蛋白条带相对清晰,而烤制、油炸样品中,大于50 kDa的条带处比较模糊。最显著的变化则是经烹饪处理后,样品的肌球蛋白重链(myosin heavy chain,MHC)有所损失,原料肉中MHC含量丰富,而水煮,汽蒸的样品蛋白中MHC含量虽减少,但仍相对较高,微波后样品的MHC有所减少,而油炸与烤制导致大量MHC损失。以下两种原因可解释上述现象:1)蛋白分子的聚集使分子过大而无法进入胶内[27];2)受热分解成较小的蛋白分子。有些条带(如40 kDa附近的条带)在各种烹饪方式后几乎保持不变,表明这些蛋白质即使在烤制与油炸等剧烈条件下也相当稳定。经不添加胰酶的模拟肠道消化后,各样品的条带与只经胃消化后略有差别,主要由于蛋白质在不同pH值的消化液中溶解度不同。
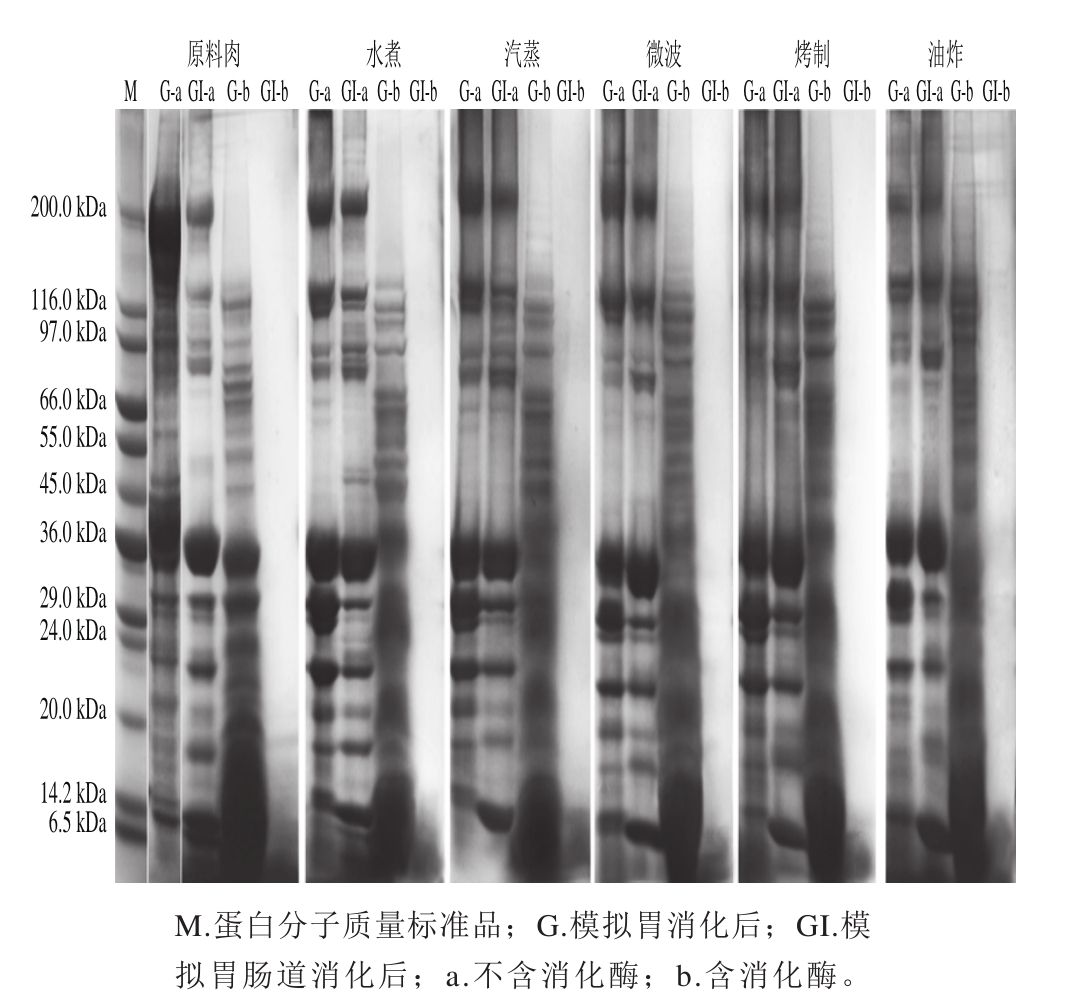
图5 经不同烹调加工的鲟鱼肉体外模拟消化后的SDS-PAGE图
Fig. 5 Representative SDS-PAGE patterns of proteins from raw and cooked sturgeon fi llets after simulated gastrointestinal digestion
在模拟胃消化后(含有胃蛋白酶),各消化液的SDS-PAGE条带如图5所示,与经过烹饪处理的样品差别最大的是,原料肉在胃蛋白酶消化后,分子质量小于45 kDa的条带依然清晰可见且含量丰富,表明仍有大量蛋白或肽未被水解,而熟肉中 这部分蛋白或肽更容易被酶解。此外,不同烹饪方式后的肉样的胃消化产物也存在差别,虽然各样品电泳图中分子质量50~130 kDa的条带都仍较清晰,但烤制与油炸样品这部分条带相比蒸煮样品颜色更深,微波样品介于之间,说明烤制与油炸的肉样在胃蛋白酶作用下仍有大量大分子蛋白存在。
不同烹饪方式对蛋白质在胃消化阶段的影响机制如下:一方面,原料肉蛋白相对紧凑的空间结构使得其对胃蛋白酶作用的抵抗性较强,而熟肉蛋白对消化酶的敏感性取决于蛋白质的氧化状态。由于蒸煮的温和条件诱导的热变性及较弱的氧化引起蛋白质部分展开,使胃蛋白酶更容易地进入水解位点[28]。而烤制与油炸等剧烈条件下,蛋白质氧化程度加重,更倾向于发生交联与聚集,增加了大分子质量的肽含量,形成致密结构,抵抗酶蛋白水解,从而抑制胃酶对蛋白的进一步水解[29]。
模拟胃肠道消化3 h后,不论是原料肉还是经不同烹调处理的肉的消化液在电泳图上均没有可见的条带,仅在14 kDa或更低的分子质量下观察到一片模糊,表明经胃酶部分消化的蛋白质在胰蛋白酶作用下充分水解,只剩下一些小肽。仅从SDS-PAGE分析,不同烹饪方式对蛋白在模拟肠消化阶段的水解情况影响并不明显。
2.2.2 游离氨基值
虽然SDS-PAGE从分子质量层面表征了各类肉样的蛋白水解程度,但分子质量非常小的肽(<6.5 kDa)却不能被准确地检测到。TBNS法被广泛用于测定蛋白质的游离氨基,与SDS-PAGE结合可以更好地表征蛋白质的消化性。
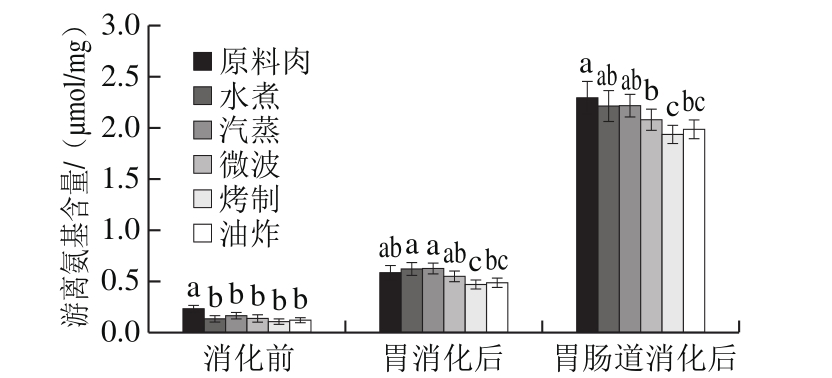
图6 不同烹饪方式下及消化前后的鲟鱼肉游离氨基含量变化
Fig. 6 Proteolysis in sturgeon fi llets during cooking and in vitro digestion
生鱼肉中游离氨基的含量相对较高,而经烹调处理的肉样游离氨基含量较低(图6)。烹饪后游离氨基的损失可归因于与醛反应生成了SB,此与荧光强度的增加结果相互印证(图4)。不同烹饪方式对鱼肉蛋白水解程度有较大影响。
经过胃消化阶段,蛋白水解程度与未消化相比显著增加,且经蒸煮方式的样品的游离氨基含量高于其他样品,经烤制与油炸的肉样水解程度最低。此结果与SDSPAGE条带结果相互印证,原因也如前所述。
与胃阶段相比,小肠消化阶段游离氨基大幅度增加,说明蛋白质主要在肠道中消化,与前面SDS-PAGE图所一致,胃消化后仍有大量蛋白或肽类,而肠消化后无可见条带。经模拟胃肠道消化后,熟肉蛋白释放的游离氨基量相比原料肉少,说明蛋白质消化性降低,与Rysman[19]、Kaur[30]等研究结果一致。考虑到蛋白质大量水解而发生结构崩塌,氧化诱导紧密结构形成致使蛋白酶不能酶切位点这个原因可被排除,更可能是由于多种氨基酸残基或酶切位点的修饰导致了消化酶无法识别位点,此外,考虑到在模拟胃肠道消化后SDS-PAGE图中没有观察到条带,推断一些较小的肽段不能被进一步水解。
本实验采用不同烹调方式均促进了鲟鱼肉蛋白与脂质的氧化,表现在蛋白羰基产物增加,TBARS值升高,BS增加与游离巯基大量损失,5 种烹饪方式中,油炸与烤制方式造成的氧化程度最大。而烤制样品中TBARS值降低,总羰基和SB大量增多则表明蛋白质与脂质的相互作用强烈。另外,这些氧化反应会在胃肠道消化过程中持续进行。概括而言,胃消化过程中的氧化主要归因于胃液的低pH值及许多促氧化剂的存在,而肠道消化中,脂质和蛋白质的水解释放大量游离氨基和脂肪酸,促进这些组分的氧化及相互作用。
蛋白质氧化会引起蛋白质的展开或聚集,从而对蛋白质消化率有影响。SDS-PAGE条带与游离氨基含量测定的结果表明在消化前不同烹饪方式引起的蛋白质氧化对胃消化过程中的蛋白水解产生不同影响,这可归因于部分氧化的蛋白质结构展开与严重氧化的蛋白质分子发生聚集,分别促进与抑制了酶解作用。而在整个胃肠道消化后,仍存在一些较短的肽段难以被彻底水解。
参考文献:
[1] DIKEMAN M, DEVINE C. Encyclopedia of meat sciences[M]. 2nd ed. Oxford: Academic Press, 2014: 385-390.
[2] TULLBERG C, LARSSON K, CARLSSON N G, et al. Formation of reactive aldehydes (MDA, HHE, HNE) during the digestion of cod liver oil: comparison of human and porcine in vitro digestion models[J]. Food &Function, 2016, 7: 1401-1412. DOI:10.1039/C5FO01332A.
[3] SOLADOYE O P, JUÁREZ M L, AALHUS J L, et al. Protein oxidation in processed meat: mechanisms and potential implications on human health[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14: 106-122. DOI:10.1111/1541-4337.12127.
[4] VAN HECKE T, VANDEN BUSSCHE J, VANHAECKE L, et al.Nitrite curing of chicken, pork, and beef inhibits oxidation but does not affect N-nitroso compound (NOC)-specific DNA adduct formation during in vitro digestion[J]. Journal of Agricultural and Food Chemistry, 2014, 62: 1980-1988.
[5] ESTÉVEZ M, LUNA C. Dietary protein oxidation: a silent threat to human health?[J]. Critical Reviews in Food Science & Nutrition, 2016,57(17): 3781.
[6] GATELLIER P, KONDJOYAN A, PORTANGUEN S, et al. Effect of cooking on protein oxidation in n-3 polyunsaturated fatty acids enriched beef. implication on nutritional quality[J]. Meat Science,2010, 85: 645-650. DOI:10.1016/j.meatsci.2010.03.018.
[7] ROLDAN M, ANTEQUERA T, ARMENTEROS M, et al. Effect of different temperature-time combinations on lipid and protein oxidation of sous-vide cooked lamb loins[J]. Food Chemistry, 2014, 149: 129-136. DOI:10.1016/j.foodchem.2013.10.079.
[8] YU T Y, MORTON J D, CLERENS S, et al. Proteomic investigation of protein profile changes and amino acid residue-level modification in cooked lamb longissimus thoracis et lumborum: the effect of roasting[J]. Meat Science, 2016, 119: 80-88. DOI:10.1016/j.meatsci.2016.04.024.
[9] VAN HECKE T, VOSSEN E, HEMERYCK L Y, et al. Increased oxidative and nitrosative reactions during digestion could contribute to the association between well-done red meat consumption and colorectal cancer[J]. Food Chemistry, 2015, 187: 29-36.
[10] VOSSEN E, DE SMET S. Protein oxidation and protein nitration inf l uenced by sodium nitrite in two different meat model systems[J].Journal of Agricultural and Food Chemistry, 2015, 63: 2550-2556.DOI:10.1021/jf505775u.
[11] FOLCH J, LEES M, STANLEY G H S. A simple method for the isolation and purification of total lipids from animal tissue[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[12] SUN Q, FAUSTMAN C, SENECAL A, et al. Aldehyde reactivity with 2-thiobarbituric acid and TBARS in freeze-dried beef during accelerated storage[J]. Meat Science, 2001, 57(1): 55-60.DOI:10.1016/S0309-1740(00)00076-0.
[13] MERCIER Y, GATELLIER P H, VIAU M, et al. Effect of dietary fat and vitamin E on lipid and protein oxidation in turkey meat during storage[J].Meat Science, 1998, 48: 301-317. DOI:10.1016/S0309-1740(97)00113-7.
[14] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science, 2006, 73(3): 536-543. DOI:10.1016/j.meatsci.2006.02.005.
[15] GATELLIIER P, SANTE-LHOUTELLIER V, PORTANGUEN S,et al. Use of meat fluorescence emission as a marker of oxidation promoted by cooking[J]. Meat Science, 2009, 83(4): 651-656.DOI:10.1016/j.meatsci.2009.07.015.
[16] ADLER-NISSEN J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J].Journal of Agricultural & Food Chemistry, 1979, 27(6): 1256-1262.DOI:10.1021/jf60226a042.
[17] UTRERA M, PARRA V, ESTÉVEZ M. Protein oxidation during frozen storage and subsequent processing of different beef muscles[J].Meat Science, 2014, 96: 812-820. DOI:10.1016/j.meatsci.2013.09.006.
[18] ROLDAN M, ANTEQUERA T, ARMENTEROS M, et al. Effect of different temperature-time combination on lipid and protein oxidation of sous-vide cooked lamb loins[J]. Food Chemistry, 2014, 149(149):129-136. DOI:10.1016/j.foodchem.2013.10.079.
[19] RYSMAN T, HECKE T V, POUCKE C V, et al. Protein oxidation and proteolysis during storage and in vitro digestion of pork and beef patties[J]. Food Chemistry, 2016, 209(15): 177-184. DOI:10.1016/j.foodchem.2016.04.027.
[20] TRAORE S, AUBRY L, GATELLIIER P, et al. Effect of heat treatment on protein oxidation in pig meat[J]. Meat Science, 2012,91(1): 14-21. DOI:10.1016/j.meatsci.2011.11.037.
[21] GATELLIER P, KONDJOYAN A, PORTANGUEN S, et al. Effect of cooking on protein oxidation in n-3 polyunsaturated fatty acids enriched beef. Implication on nutritional quality[J]. Meat Science,2010, 85: 645-650. DOI:10.1016/j.meatsci.2010.03.018.
[22] ESTÉVEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89(3): 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[23] ZHANG W, XIAO S, DONG U. Protein oxidation: basic principles and implications for meat quality[J]. Critical Reviews in Food Science and Nutrition, 2013, 53(11): 1191-1201. DOI:10.1080/10408398.2011.577540.
[24] HERNÁNDEZ-LÓPEZ S H, RODRÍGUEZ-CARPENA J G, LEMUSFLORES C, et al. Antioxidant protection of proteins and lipids in processed pork loin chops through feed supplementation with avocado[J]. Journal of Food Science and Technology, 2016, 53: 1-9.
[25] PROMEYRAT A, GATELLIIER P, LEBRET B, et al. Evaluation of protein aggregation in cooked meat[J]. Food Chemistry, 2010, 121(2):412-417. DOI:10.1016/j.foodchem.2009.12.057.
[26] BARELLI S, CANELLINI G, THADIKKARAN L, et al. Oxidation of proteins: basic principles and perspectives for blood proteomics[J].Proteomics Clinical Applications, 2008, 2(2): 142-157. DOI:10.1002/prca.200780009.
[27] KAJAK-SIEMASZKO K, AUBRY L, PEYRIN F, et al.Characterization of protein aggregates following a heating and freezing process[J]. Food Research International, 2012, 44(10): 3160-3166.
[28] BAX M L, AUBRY L, FERREIRA C, et al. Cooking temperature is a key determinant of in vitro meat protein digestion rate: investigation of underlying mechanisms[J]. Journal of Agriculture and Food Chemistry, 2012, 60(10): 2569-2576. DOI:10.1021/jf205280y.
[29] SANTÉ-LHOUTELLIER V, ASTRUC T, MARINOVA P, et al. Effect of meat cooking on physicochemical state and in vitro digestibility of myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry,2008, 56(4): 1488-1494. DOI:10.1021/jf072999g.
[30] KAUR L, MAUDENS E, HAISMAN D R, et al. Microstructure and protein digestibility of beef: the effect of cooking conditions as used in stews and curries[J]. LWT-Food Science and Technology, 2014, 55(2):612-620. DOI:10.1016/j.lwt.2013.09.023.
Effect of Different Cooking Treatments and in Vitro Digestion on Protein Oxidation and Digestibility of Sturgeon Fillets
HU Lülin, REN Sijie, SHEN Qing, CHEN Jianchu*, YE Xingqian
(College of Biosystems Engineering and Food Science, Fuli Institute of Food Science, Zhejiang Key Laboratory for Agro-Food Processing, Zhejiang R&D Center for Food Technology and Equipment, Zhejiang University, Hangzhou 310058, China)
Abstract:The effects of fi ve different cooking methods (boiling, steaming, microwaving, oven baking and frying) on lipid and protein oxidation and their inf l uence on the in vitro protein digestibility of sturgeon fi llets were studied. Significant lipid and protein oxidative changes occurred in cooked fi sh fi llets and were much more pronounced in roasted and fried samples.These changes were further reinforced during simulated digestion, especially intestinal digestion. A marked interaction between lipid and protein oxidation was also manifested during cooking and digestion. Furthermore, protein oxidation induced by cooking before digestion had a notable impact on proteolysis during digestion. Roasted and fried samples were less sensitive to pepsin due to polymerization of severely oxidized protein. After the completion of gastrointestinal digestion, there still existed some short peptides in cooked fi sh, especially roasted and fried fi sh, which could not be digested thoroughly.
Keywords:cooking method; fi sh; protein oxidation; proteolysis; in vitro digestion
HU Lülin, REN Sijie, SHEN Qing, et al. Effect of different cooking treatments and in vitro digestion on protein oxidation and digestibility of sturgeon fi llets[J]. Food Science, 2018, 39(20): 63-70. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820010. http://www.spkx.net.cn
引文格式:胡吕霖, 任思婕, 沈清, 等. 不同烹饪方式及体外模拟消化环境对鲟鱼蛋白质氧化及消化性的影响[J]. 食品科学, 2018,39(20): 63-70. DOI:10.7506/spkx1002-6630-201820010. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0063-08
文献标志码:A
中图分类号:TS251.1
DOI:10.7506/spkx1002-6630-201820010
*通信作者简介:陈健初(1964—),男,教授,博士,主要从事食品加工研究。E-mail:jc@zju.edu.cn
第一作者简介:胡吕霖(1992—),女,硕士研究生,主要从事现代调理食品研究与开发。E-mail:21513075@zju.edu.cn
基金项目:“十二五”国家科技支撑计划项目(2014BAD04B01)
收稿日期:2017-04-05