
图1 黄酮结构式
Fig. 1 Structural formulas of fl avonoids with different structures
周 伟,胡 熠,张进杰*,徐大伦,楼乔明,杨文鸽
(宁波大学海洋学院,浙江省动物蛋白食品精深加工重点实验室,浙江 宁波 315211)
摘 要:通过分别添加木犀草素、槲皮素、杨梅素优化鱼鳞明胶可食膜,对比复合膜的机械性能和光学属性,探究不同羟基(—OH)数的黄酮与明胶分子的内部相互作用对鱼鳞明胶膜性能的优化作用。差示扫描量热仪和傅里叶变换红外光谱测定结果表明:植物黄酮在鱼鳞明胶膜中可能会形成明胶分子之间的空间阻隔作用;同时黄酮分子的—OH能与明胶分子形成氢键和偶极作用力,且作用力随着黄酮分子的—OH数目的增加而加强。黄酮分子的疏水环和—OH与明胶分子的作用力,导致鱼鳞明胶分子二级结构中的β-转角逐渐转化为β-折叠、无规则卷曲和α-螺旋;—OH数目的增加加强了明胶与黄酮的氢键、电荷间的偶极作用力,降低明胶分子链的移动性,致使黄酮膜内部结构更加致密,提升了明胶膜的拉伸延展性;黄酮的添加会增进明胶膜的紫外光吸收,但黄酮分子中—OH数目对膜的透光度无影响。本研究结果可为采用天然黄酮类物质优化明胶可食性包装膜提供理论指导。
关键词:相互作用;黄酮;明胶;性能优化
近年来,消费者对高品质、长货架期食品的需求日益增长;与此同时,废弃包装数量与日俱增,而导致的环境问题也引起全社会的广泛关注,因而,可食性包装已成为绿色包装领域研究的一大热点[1]。可食膜是以天然可食性物质(如蛋白质、多糖、脂类等)为原料,添加可食用的增塑剂、交联剂、活性功能成分等,通过分子间的相互作用而形成的具有网络结构的薄膜,能够防止气体、水分和溶质等的迁移,保持食品质量,延长食品货架期[2]。明胶是由多种氨基酸组成且具有蛋白质结构的大分子,可由动物的骨头或皮肤胶原经过热变性或物理、化学降解得到,由于其具有无毒并且可降解等特性,在食品和医药领域得到广泛应用[3]。
天然黄酮类化合物作为多酚类物质,具有优越的抗菌抗氧化性能,作为功能性天然食品添加剂已被人们广泛接受[4];近年来有研究表明,添加天然植物黄酮类物质可优化明胶可食性膜的性能。Bitencourt等[5]研究显示,姜黄根茎醇提物中的多酚可以改善明胶膜的机械性能,赋予明胶膜良好的自由基清除活性。Fu Shalu等[6]研究将绿原酸与明胶以4∶1混合制备生物活性保鲜膜,通过核磁共振与傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)证实了绿原酸同明胶成功结合,两者的结合作用赋予了明胶膜优良的抑菌性和抗氧化性。因此研究黄酮物质优化明胶高分子可食性膜的作用机理具有理论意义和广阔的应用前景。
黄酮类物质与蛋白分子之间的相互作用已有较多报道,天然植物黄酮物质的活性位点可以与蛋白活性部位进行结合[7]。多酚的结合位点主要是疏水性芳香环以及亲水性羟基(—OH),这2 个部位可以和蛋白形成疏水相互作用和氢键作用;Haroun等[8]研究证实氢键和疏水相互作用是维持多酚-明胶膜结构稳定性的主要作用力;蛋白的结合部位除普遍存在的氨基、羰基外,还有疏水性氨基酸、带电荷氨基酸、带—OH氨基酸;Bi Shi等[9]研究表明,蛋白疏水性氨基酸越多,黄酮物质与蛋白之间相互作用位点越多;除氢键和疏水相互作用外,蛋白和多酚之间还存在由于两者官能团的正负电荷差异导致的电荷相互作用[10];Haroun等[8]将儿茶酚、糖苷槲皮素、没食子酸加入明胶中制备成了多酚-明胶膜,得到多酚与明胶成膜之后维持膜稳定的主要驱动力是多酚的—OH和芳香环同明胶分子中氨基酸残基形成的氢键和疏水相互作用。因而,探明黄酮物质的结构与黄酮物质优化明胶膜性能的构效关系,可以为明胶膜性能的改进提供理论指导。
鱼鳞明胶资源丰富,我国为渔业大国,青鱼、草鱼、鲢鱼、鲤鱼、罗非鱼等养殖和加工产量极大,仅罗非鱼2014年产量高达169万 t,按4%鱼鳞含量的质量比例计算,加工过程中会产生7万 t左右鱼磷下脚料,可分离加工成鱼鳞明胶[11]。本实验以鱼鳞明胶为研究对象,选取不同—OH基团个数,相同2-苯基色原酮基础结构的黄酮物质:木犀草素、槲皮素和杨梅素(图1)对鱼鳞明胶可食膜进行添加混合优化处理,研究黄酮结构的—OH个数变化对明胶膜性能作用的变化机理,为生产高品质功能性鱼鳞明胶膜提供理论依据。

图1 黄酮结构式
Fig. 1 Structural formulas of fl avonoids with different structures
罗非鱼鱼鳞明胶(A型240凝冻强度) 广东欧帝玛生物工程有限公司;甘油 国药集团化学试剂有限公司;木犀草素、槲皮素、杨梅素(纯度98%) 西安贝拉生物科技有限公司。
TA.XT Plus质构仪 英国SMSTA公司;SpectraMax i3酶标仪 美国Molecular Devices公司;S-3400N扫描电镜、L-8900高速氨基酸分析仪 日本日立公司;DSC200F3差示扫描量热(differential scanning calorimeter,DSC)仪 德国Netzsch公司;JascoFT/IR-4700 FTIR仪 日本分光公司。
1.3.1 氨基酸组成
根据GB 5009.124—2016《食品中氨基酸的测定》方法,利用氨基酸自动分析仪测定鱼鳞明胶氨基酸组成。
1.3.2 黄酮-鱼鳞明胶膜制备
称取0.6 g干样罗非鱼鳞明胶置于20 mL去离子水中,吸水溶胀20 min,50 ℃水浴20 min充分溶解,制成3 g/100 mL明胶溶液;将0.105 mmol黄酮(木犀草素、槲皮素、杨梅素)溶于5 mL乙醇之后,倒入20 mL成膜液;每克明胶中再加入0.4 g甘油,磁力搅拌5 min混匀;将上述成膜液4 000 r/min离心1 min去除气泡;最后将成膜液倾倒入聚苯乙烯平板中(直径90 mm)流延成膜,放入恒温恒湿箱(25 ℃,相对湿度50%)中干燥24 h。揭膜后得到鱼鳞明胶膜(scale gelatin,SG)、木犀草素膜(luteolin scale gelatin,LT-SG)、槲皮素膜(quercetin scale gelatin,QC-SG)、杨梅素膜(myricetin scale gelatin,MC-SG),再进行各项性能指标测试。
1.3.3 明胶膜DSC测定
参照Hosseini等[12]的方法,利用DSC进行测定。在测试前,膜在硅胶干燥器中干燥24 h以脱除水分。以打孔器制备6 mm直径的圆形膜片(约5 mg)平铺于铝制坩埚中,压片,置于DSC仪中进行测量。测试温度范围30~150 ℃,升温速率10 ℃/min,N2作为吹扫气和保护气。以空白铝制坩埚作为参照。
1.3.4 FTIR测定
参照Hosseini等[12]的方法。测试前,样品保存在硅胶干燥器中干燥24 h以脱除大部分水分。将膜样品剪碎加入KBr研磨,压片,使用FTIR仪进行检测。光谱范围4 000~400 cm-1;分辨率4 cm-1;样品扫描次数32。
1.3.5 二级结构相对含量计算
利用Peakfit软件对红外光谱酰胺I带进行去卷积以及二阶导拟合。确认峰位归属,计算各分峰面积的相对含量[13]。
1.3.6 机械性能测定
采用测厚规测定膜厚度;膜机械性能测试参照Alkan等[10]的方法,采用质构仪测量拉伸强度和断裂伸长率。抓距30 mm,拉伸速率5 mm/s。每组膜测5 个平行。测试之前将20 mm×50 mm的膜保存在25 ℃、相对湿度50%的恒温恒湿箱中平衡24 h。
1.3.7 透光度测定
参照Vejdan等[14]的方法,用打孔器将膜制成直径6 mm圆片,紧贴于微孔板底部,用SpectraMax i3酶标仪进行230~800 nm范围的波长扫描测量透光度,扫描波长间隔5 nm。
1.3.8 扫描电镜测定
膜微观图像测定采用Hosseini等[12]方法进行检测。膜在干燥器中放置24 h后,取1 cm×4 cm膜样品,用液氮浸没之后进行人工折断,将样品黏贴于金属圆台上,真空状态下喷金,置于扫描电镜中,电子束加速电压为10.0 kV,观察膜截面和表面微观结构,在放大倍数5 000 倍和100 倍条件下拍照截图。
以SAS 9.3统计分析软件进行数据处理,计算标准误或标准差,以邓肯多重比较方法进行方差分析;以ChemSketch和Origin 9.0软件绘制图形。
表1 鱼鳞明胶氨基酸组成分析
Table 1 Amino acid composition of fi sh scale gelatin
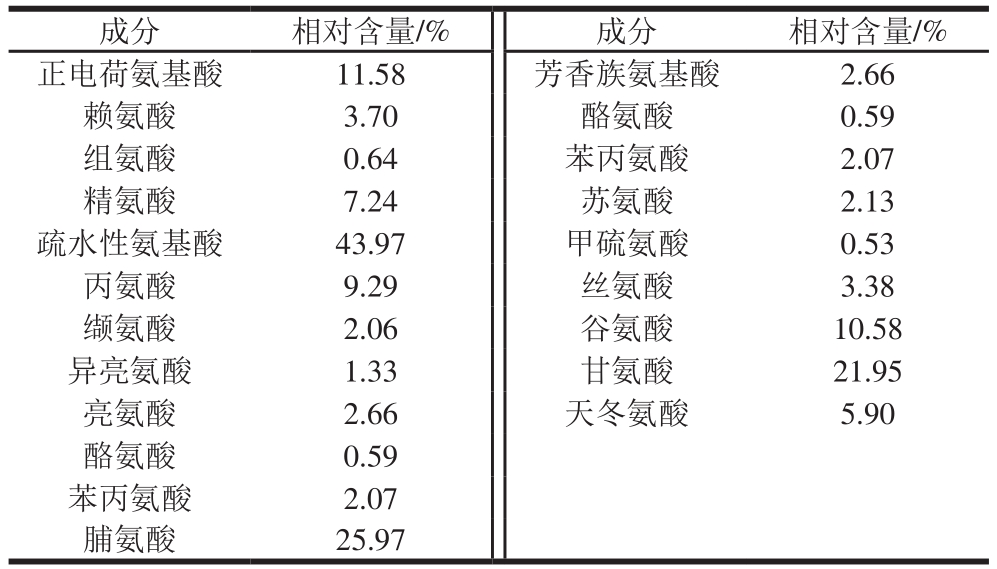
如表1所示,本实验中鱼鳞明胶分子的氨基酸组成中正电荷氨基酸相对含量为11.58%;疏水性氨基酸相对含量为43.97%;芳香族氨基酸相对含量为2.66%;不同种类氨基酸组成的明胶利于对膜基质内部相互作用的探究。

图2 添加不同结构黄酮膜热特性曲线
Fig. 2 DSC curves of gelatin fi lms with different fl avonoids
玻璃化转变温度(Tg)由吸热变化中点所得,是非固形材料从玻璃态转变为橡胶态时的温度,与体系的流动性有关[15]。如图2所示,对照SG的Tg为79.2 ℃,添加了不同黄酮物质的LT-SG、QC-SG和MC-SG的Tg分别为60.9、69.0 ℃和71.5 ℃,反映了添加黄酮膜Tg与纯明胶膜相比有所降低。文献报道,增塑剂插入到聚合物大分子之间,通过隔离作用(增加聚合物分子链之间距离)、屏蔽作用(以非极性部分遮蔽聚合物的极性基)、偶和作用(极性基与聚合物极性基团偶合),从而起到增塑剂的作用,降低高分子膜的Tg[16];因而本实验中,LT-SG、QC-SG和MC-SG膜的Tg均小于SG,因为三环黄酮物质的添加增加了明胶分子链之间的距离,非极性环遮蔽了明胶分子极性基团,极性—OH与明胶分子极性基团偶合,从而增大了明胶链的自由体积,增强了明胶分子的移动性,从而导致LT-SG、QC-SG和MC-SG的Tg降低。
LT-SG、QC-SG和MC-SG的Tg依次升高(60.9 ℃<69.0 ℃<71.5 ℃)。而槲皮素仅在2-苯基色原酮C环的3号位比木犀草素多了一个—OH,而杨梅素仅在2-苯基色原酮B环的3号位比槲皮素多了一个—OH(图1)。结果表明,2-苯基色原酮上—OH基团数的增加能减弱明胶分子的流动性,提高复合膜的Tg。这可能是由2 个因素造成:正负电荷相互作用以及黄酮—OH基团与蛋白之间形成的氢键[17]。
—OH数增加的黄酮与明胶分子间电荷作用增强可能导致了Tg提高[10]。由表1可知,鱼鳞明胶分子的氨基酸组成中正电荷氨基酸相对含量为11.58%(赖氨酸3.70%、组氨酸0.64%、精氨酸7.24%);由于酚—OH个数的增加,木犀草素、槲皮素和杨梅素在复合膜环境中负电荷性逐渐增强;所以,木犀草素、槲皮素、杨梅素与SG正电荷基团部位结合的电荷相互作用会逐渐增强。—OH数增加的黄酮与明胶分子间氢键作用增强可能导致了Tg提高。陆国弟等[18]研究表明,黄酮B环—OH数目越多,该黄酮与人血清蛋白通过氢键形成的亲和力越强;Tang Fen等[19]研究也显示,黄酮和血浆蛋白的亲密作用随着黄酮氢供体数目的增长而增强。而木犀草素、槲皮素、杨梅素的—OH基团的增多提供了更多的氢供体,因而造成黄酮—OH与明胶氨基酸之间的氢键作用增强。
因而DSC以热变性温度的表现形式展现了黄酮的添加以及—OH数的不同对明胶膜热稳定性以及明胶链移动性的影响,并间接体现了不同黄酮结构对明胶膜内部相互作用的影响。
如图3所示,明胶膜在3 379、2 932、1 656、1 552、1 241 cm-1附近显示的吸收峰,分别归属于明胶膜中水的—OH与明胶分子中NH的伸缩振动(酰胺A),明胶脂肪族侧链的CH伸缩振动(酰胺B)[20],酰胺I区C=O伸缩振动,酰胺II区NH弯曲振动,酰胺III区C—N和NH伸缩振动[21]。1 045 cm-1附近峰位归属于甘油中—OH吸收峰[22]。这些峰位在添加黄酮后有不同的变化。
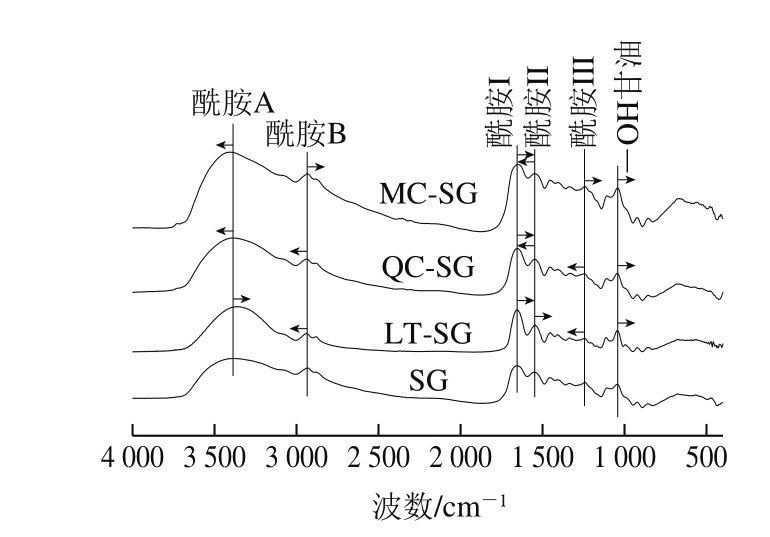
图3 黄酮FTIR图
Fig. 3 FTIR spectra of gelatin fi lms with different fl avonoids
SG的酰胺I区(VC=O)处于1 656.55 cm-1。加入木犀草素(4×—OH)、槲皮素(5×—OH)、杨梅素(6×—OH)后,随着—OH不断增加,LT-SG、QC-SG、MC-SG的酰胺I峰位不断向低波数位移至1 655.59、1 653.66 cm-1和1 647.88 cm-1。结果表明,添加黄酮的鱼鳞明胶分子的酰胺I峰位向低频位移,且随着黄酮物质—OH个数的不断增加,移动越显著。由此说明,黄酮物质与鱼鳞明胶分子中C=O参与形成氢键,并且随着黄酮物质的—OH数的增加呈现增强的趋势[23]。
酰胺A吸收峰的峰位受到明胶中氨基基团参与形成氢键以及电荷基团之间的偶极作用的影响[17]。明胶分子中的—NH2基团之间形成氢键会造成相应酰胺A吸收峰位向低频位移[24]。明胶分子中氨基基团偶极力的增加会造成酰胺A峰位高频位移[25]。本实验中对照SG的酰胺A吸收峰在3 379.64 cm-1,LT-SG的峰位低频位移至3 364.21 cm-1;QC-SG和MC-SG的峰位不断向高波数位移至3 390.24 cm-1和3 401.82 cm-1。结果表明,黄酮物质的添加及—OH数的变化会影响明胶分子中氨基基团参与形成的氢键和电荷基团之间的偶极作用。
SG的酰胺II区峰位在1 552.42 cm-1,LT-SG、QC-SG、MC-SG的酰胺II峰呈现出与酰胺A吸收峰位同样的位移趋势。因此,酰胺A和酰胺II峰的位移表明,加入三环木犀草素后,黄酮—OH与明胶氨基之间形成氢键,并且氢键作用对NH峰位的影响强于电荷相互作用;加入槲皮素和杨梅素后,随着—OH的增多,黄酮与明胶中氨基之间的正负电荷相互作用逐渐增强,并且电荷相互作用对NH峰位的影响强于氢键相互作用。
SG加入木犀草素后,酰胺B峰由2 932.23 cm-1高频位移至2 938.02 cm-1,添加槲皮素的酰胺B峰位维持在2 938.02 cm-1。而添加杨梅素的膜的此峰位下降到2 932.23 cm-1。Herrero等[26]研究显示,拉曼光谱CH峰位移受到脂肪族氨基酸残基的疏水性影响。这间接表明明胶脂肪族氨基酸侧链受到黄酮中疏水性环以及—OH数影响。
SG的酰胺III区峰位在1 241.93 cm-1,在加入木犀草素、槲皮素之后,该峰位向高波数移至1 243.86 cm-1和1 246.75 cm-1,添加杨梅素的膜峰位则低频位移到1 241.93 cm-1。此区峰位移是NH形成氢键作用、离子作用和CN受到影响共同作用的结果。
SG中甘油—OH特征吸收峰位在1 045.23 cm-1,LT-SG、QC-SG、MC-SG膜中此峰位不断低频位移至1 044.26、1 044.26 cm-1和1 042.34 cm-1;表明黄酮中—OH数的增加使得增塑剂甘油中—OH参与形成氢键作用增强。
因而,FTIR结果显示,黄酮的添加以及—OH数的差异影响了明胶膜内部基团参与形成的氢键作用以及电荷相互作用,造成了相应基团键位吸收峰的位移。
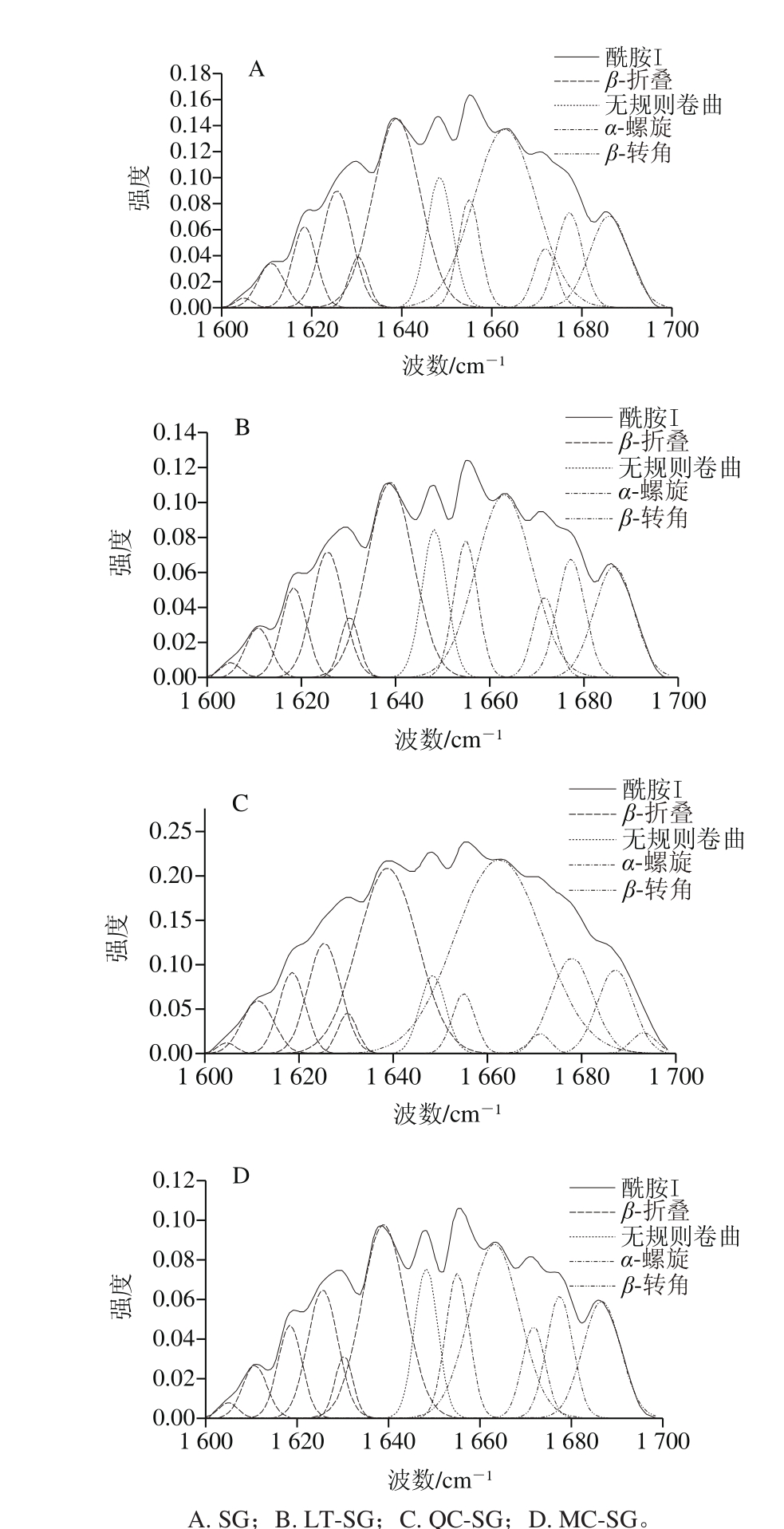
图4 膜中蛋白质酰胺I带拟合图谱
Fig. 4 Fitting spectra of amide I band of gelatin fi lms
蛋白的FTIR中,酰胺I区(1 600~1 700 cm-1)具有强吸收峰,并且对蛋白构象敏感,因而适合作为二级结构的分析手段[27]。将FTIR蛋白酰胺I带进行去卷积和二阶导拟合计算,分峰数目为11~12,确定相关系数R2达到0.999,拟合度较高,拟合结果如图4所示。1 600~1 640 cm-1波段峰归属于β-折叠,1 640~1 650 cm-1波段峰归属于无规则卷曲,1 650~1 660 cm-1波段峰归属于α-螺旋,1 660~1 670 cm-1波段峰归属于β-转角[28]。

图5 添加不同结构黄酮的明胶膜二级结构相对含量
Fig. 5 Secondary structure contents of gelatin fi lms with different fl avonoids
如图5所示,黄酮物质的添加显著影响鱼鳞明胶分子的二级结构。相对于SG,加入木犀草素后,鱼鳞明胶分子的β-结构(β-折叠和β-转角)相对含量增加,α-螺旋和无规则卷曲相对含量减少。对比LT-SG、QC-SG和MC-SG中明胶分子各二级结构的变化,得出:随着—OH数的增多,明胶分子的β-转角相对含量逐渐减小,转化为β-折叠、无规则卷曲和α-螺旋。对比SG膜中明胶分子的二级结构,LT-SG、QC-SG和MC-SG膜中明胶分子的β-折叠相对含量随着—OH数的增加而增加。蛋白结构主链上的C=O和N—H间的氢键作用力是构成蛋白质形成特定二级结构的主要动力[23],本实验中各SG的明胶分子二级结构成分相对含量的不同,说明黄酮物质的添加能影响明胶分子的二级结构,同时黄酮物质中—OH基团数起到关键影响作用。结果与FTIR中酰胺A、酰胺I、酰胺II的峰位变化显示的明胶内部C=O和NH氢键变化的结果相印证。
优良的机械性能可确保膜在应用过程中的完整性,是分子交联作用与分子移动性的体现[29]。图6是选取SG、LT-SG、QC-SG、MC-SG的一组数据绘制的应力-应变曲线,显示了不同组别明胶膜的抗拉强度和断裂伸长率的变化,结果表明各组膜厚度之间没有明显差异(P>0.05)。对照明胶膜SG的断裂伸长率和抗拉强度分别为36.9%和156.9 N/mm;加入木犀草素后,LT-SG的断裂伸长率提高至108.3%,抗拉强度降低至122.4 N/mm;表明木犀草素的加入提高了SG的延展性;Alkan等[10]向玉米醇溶蛋白中添加麝香草酚、香芹酚、丁香酚等天然酚类化合物制备抑菌膜,也发现所有抑菌膜抗拉强度都有所降低,断裂伸长率都有所升高,其结果表明添加部分酚类物质使膜变得更有弹性,并且丧失脆性。这与本研究中木犀草素膜Tg降低反映的分子链移动性增强相一致,说明黄酮—OH数较少时,多环的空间阻隔作用占据主导地位。抗拉强度的降低可能是因为,此时少—OH数的黄酮打断原有明胶分子之间连接,但同时本身的各部位与明胶的结合作用弱于原来明胶之间的结合作用,从而造成抗拉强度的降低。

图6 添加不同结构黄酮膜的厚度(A)和机械性能(B)
Fig. 6 Thickness (A) and mechanical properties (B) of gelatin fi lms with different fl avonoids
加入槲皮素和杨梅素后,QC-SG和MC-SG的断裂伸长率明显降低至95.7%和69.2%,抗拉强度明显提高至150.1 N/mm和178.8 N/mm;表明—OH数增多会提升膜的拉伸强度,但会降低膜的延展性;这与QC-SG和MC-SG的Tg升高反映的分子链移动性降低也相一致,说明—OH数增多时,黄酮和明胶的疏水性结合作用、正负电荷相互作用、氢键相互作用逐渐增强并占据主导地位,明显加强了分子链的紧密连结;从而印证了FTIR显示的C=O形成氢键作用增强,NH形成电荷作用增强的结果。
本实验中,LT-SG、QC-SG和MC-SG膜的断裂伸长率均高于SG,与Tg反映的黄酮导致明胶分子移动性提高相一致;因而机械性能分析表明,以2-苯基色原酮为基础的黄酮添加明胶制膜时,—OH数较少时会提高膜的塑性,降低膜的强度;而随着—OH数增加,黄酮膜的延展性得到降低,强度得到增强;膜机械性能变化受到黄酮环的空间阻隔作用,黄酮分子中—OH和明胶氨基正负电荷作用、氢键作用,以及环疏水相互作用的影响;黄酮-鱼鳞明胶复合膜的DSC、FTIR以及明胶分子二级结构的变化分析印证了此原因。
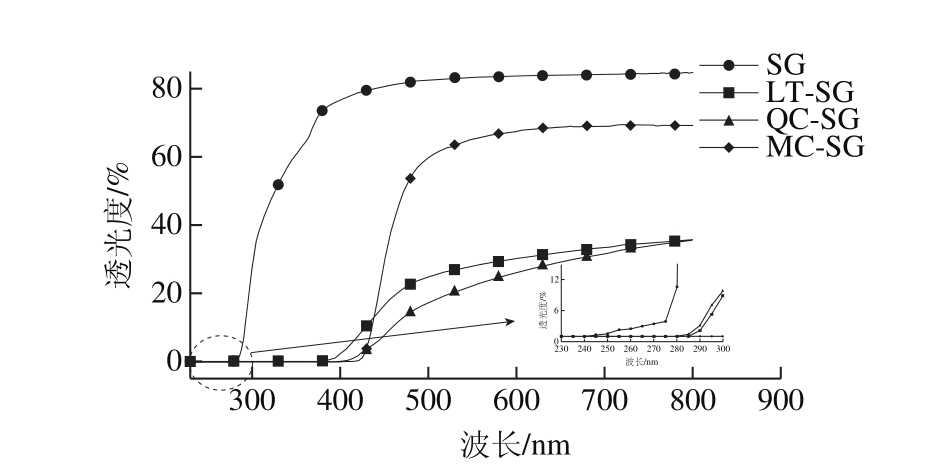
图7 添加不同结构黄酮明胶膜的透光性
Fig. 7 Light transmittance of gelatin fi lms with addition of different fl avonoids
透光度显示了可食膜的光阻隔能力与外观色泽[14]。如图7所示,在230~300 nm紫外光区,添加木犀草素、槲皮素、杨梅素的膜的紫外透光度明显下降。因为SG由于芳香族氨基酸的存在(表1氨基酸组成分析得到0.59%酪氨酸、2.07%苯丙氨酸),本身具有一定的紫外吸收能力[30];木犀草素、槲皮素、杨梅素苯环的存在也使膜增强了对紫外的吸收。但此LT-SG、QC-SG、MC-SG 3 种膜的透光度之间没有明显差异;则说明—OH数目和位置对与明胶膜的紫外吸收没有显著影响。
在300~800 nm的可见光区,LT-SG、QC-SG、MC-SG的透光度都低于SG;其中LT-SG和QC-SG的可见光透光度曲线相近,而MC-SG透光度要高于LT-SG和QC-SG。有研究显示,A环7位和B环4’位的—OH及其活性会影响黄酮的颜色[31]。木犀草素、槲皮素、杨梅素的A环7位和5位都连接2 个—OH;LT和QC的B环都在4’和5’位连接2 个相同的—OH,因而颜色差异小,可见光透过性相近;而MC的B环的3’、4’和5’位连接了3 个—OH,使得4’位的—OH活性受到影响,从而使MC的颜色产生明显变化,造成MC-SG可见光透过与LT-SG和QC-SG有明显差别。这也与观察到的木犀草素、槲皮素、杨梅素的颜色差异相一致。
因而黄酮与明胶的结合能够增强明胶膜对紫外的吸收;—OH数目、位置和活性差异则会影响膜的可见光透过性,但不会明显影响紫外吸收。


图8 添加不同结构黄酮明胶膜的表观图
Fig. 8 Morphological pictures of gelatin fi lms containing different fl avonoids
由图8可知,黄酮加入后且随着—OH数增加,表面凸起增多。对照SG截面光滑;加入木犀草素的LT-SG截面出现凸起;可能是黄酮和明胶的芳香环的疏水性堆积作用导致[32];Tang Fen等[19]研究表明,在白藜芦醇相似物和血浆蛋白结合作用中,疏水相互作用占据重要地位;而表1显示,明胶疏水性氨基酸占43.97%(丙氨酸、缬氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、脯氨酸),因而木犀草素的疏水环状结构同明胶疏水性氨基酸的疏水性结合作用增强,会造成膜部分凝集现象。
加入槲皮素和杨梅素后,QC-SG和MC-SG截面致密性增强;FTIR显示膜内氢键作用、电荷作用增强;因此以黄酮分子为中心,—OH数增多使得黄酮分子通过氢键、正负电荷相互作用连结更多的明胶分子部位,使得明胶分子部分聚集,明胶膜致密性得以提高[33];与机械性能抗拉强度的增强,DSC反映的分子链移动性降低相互印证。
因此,扫描电镜图展现了黄酮添加及其—OH数差异对明胶膜表观状态的影响;其表观状态变化的深层原因是内部黄酮分子和明胶分子网络的多种相互作用的变化。
本实验在SG中添加黄酮(木犀草素、槲皮素、杨梅素)以探究黄酮不同—OH数对明胶膜的改性作用。FTIR和DSC表明,黄酮分子—OH数的增加,加强了黄酮分子与鱼鳞明胶分子之间的氢键、偶极作用力,并导致鱼鳞明胶分子二级结构中的β-转角逐渐转化为β-折叠、无规则卷曲和α-螺旋。黄酮类物质的属性以及黄酮类物质与鱼鳞明胶分子之间产生的作用力,优化了鱼鳞明胶的机械性能和紫外阻隔性能。与纯明胶膜相比,加入—OH数较少的黄酮(木犀草素和槲皮素)后拉伸强度下降,是因为此时黄酮的各部位与明胶的结合作用弱于原来明胶之间的结合作用。但随着黄酮—OH数不断增加,黄酮分子的—OH数与其优化SG拉伸强度呈正相关性,黄酮分子的—OH数越多,黄酮-鱼鳞明胶复合膜的内部结构越致密,膜的拉伸强度越大。本研究结果解析了在黄酮-鱼鳞明胶复合膜中,黄酮分子(木犀草素、槲皮素、杨梅素)与鱼鳞明胶分子结合作用力的形式,以及黄酮分子中—OH数对鱼鳞明胶分子结构作用的影响和对复合明胶膜性能改性的作用,为开发可食性高性能黄酮-明胶复合膜提供理论指导。
参考文献:
[1] 宫志强, 李彦春, 祝德义. 增塑剂对壳聚糖-明胶复合膜物理性能的影响[J]. 食品工业科技, 2008, 29(3): 231-233.
[2] 陈丽. 可食性狭鳕鱼皮明胶复合膜的制备、性质与应用研究[D].青岛: 中国海洋大学, 2009. DOI:10.7666/d.y1503213.
[3] 曹娜, 符玉华, 贺军辉. 明胶膜的制备及性能[J]. 华东理工大学学报(自然科学版), 2006, 32(10): 1192-1196. DOI:10.3969/j.issn.1006-3080.2006.10.011.
[4] RASHIDINEJAD A, BIRCH E J, HINDMARSH J, et al. Molecular interactions between green tea catechins and cheese fat studied by solidstate nuclear magnetic resonance spectroscopy[J]. Food Chemistry, 2017,215: 228-234. DOI:10.1016/j.foodchem.2016.07.179.
[5] BITENCOURT C M, FAVARO-TRINDADE C S, SOBRAL P J A, et al.Gelatin-based fi lms additivated with curcuma ethanol extract: antioxidant activity and physical properties of films[J]. Food Hydrocolloids, 2014,40(10): 145-152. DOI:10.1016/j.foodhyd.2014.02.014.
[6] FU S, WU C, WU T, et al. Preparation and characterisation of Chlorogenic acid-gelatin: a type of biologically active film for coating preservation[J]. Food Chemistry, 2017, 221: 657-663. DOI:10.1016/j.foodchem.2016.11.123.
[7] HANLIN R L, HRMOVA M, HARBERTSON J F, et al. Condensed tannin and grape cell wall interactions and their impact on tannin extractability into wine[J]. Australian Journal of Grape &Wine Research, 2010, 16(1): 173-188. DOI:10.1111/j.1755-0238.2009.00068.x.
[8] HAROUN A A, EL T S A. Effect of natural polyphenols on physicochemical properties of crosslinked gelatin-based polymeric biocomposite[J]. Journal of Applied Polymer Science, 2010, 116(5):2825-2832. DOI:10.1002/app.31736.
[9] BI S. Gelatin-polyphenol interaction[J]. Journal of the American Leather Chemists Association, 1995.
[10] ALKAN D, YEMENICIOGLU A. Potential application of natural phenolic antimicrobials and edible film technology against bacterial plant pathogens[J]. Food Hydrocolloids, 2016, 55: 1-10. DOI:10.1016/J.Foodhyd.2015.10.025.
[11] 董金和. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2013.
[12] HOSSEINI S F, REZAEI M, ZANDI M, et al. Fabrication of bio-nanocomposite films based on fish gelatin reinforced with chitosan nanoparticles[J]. Food Hydrocolloids, 2015, 44: 172-182.DOI:10.1016/j.foodhyd.2014.09.004.
[13] 蒋士龙. 加工条件对再制干酪蛋白质二级结构的影响[J]. 上海交通大学学报(农业科学版), 2009, 27(3): 297-299. DOI:10.3969/j.issn.1671-9964.2009.03.021.
[14] VEJDAN A, OJAGH S M, ADELI A, et al. Effect of TiO2,nanoparticles on the physico-mechanical and ultraviolet light barrier properties of fi sh gelatin/agar bilayer fi lm[J]. LWT-Food Science and Technology, 2016, 71: 88-95. DOI:10.1016/j.lwt.2016.03.011.
[15] TONGNUANCHAN P, BENJAKUL S, PRODPRAN T, et al.Mechanical, thermal and heat sealing properties of fish skin gelatin film containing palm oil and basil essential oil with different surfactants[J]. Food Hydrocolloids, 2016, 56: 93-107. DOI:10.1016/j.foodhyd.2015.12.005.
[16] 张亨. 增塑剂综述[C]//塑料助剂生产与应用技术信息交流会. 青岛:中国塑料加工工业协会, 2008: 61-68.
[17] LOPEZMARTINEZ L M, SANTACRUZORTEGA H, NAVARRO R E, et al. A 1H NMR investigation of the interaction between phenolic acids found in mango (Manguifera indica cv Ataulfo) and papaya(Carica papaya cv Maradol) and 1,1-diphenyl-2-picrylhydrazyl(DPPH) free radicals[J]. PLoS ONE, 2015, 10(11): e0140242.DOI:10.1371/journal.pone.0140242.
[18] 陆国弟, 马宏跃, 萧伟, 等. 不同结构黄酮类化合物对人血清白蛋白亲和力的影响[J]. 中医药信息, 2012, 29(3): 8-11. DOI:10.3969/j.issn.1002-2406.2012.03.005.
[19] TANG F, XIE Y, CAO H, et al. Fetal bovine serum influences the stability and bioactivity of resveratrol analogues: a polyphenolprotein interaction approach[J]. Food Chemistry, 2017, 219: 321-328.DOI:10.1016/j.foodchem.2016.09.154.
[20] ALTIOK D, ALTIOK E, TIHMINLIOGLU F. Physical, antibacterial and antioxidant properties of chitosan fi lms incorporated with thyme oil for potential wound healing applications[J]. Journal of Materials Science Materials in Medicine, 2010, 21(7): 2227-2236. DOI:10.1007/s10856-010-4065-x.
[21] LIU Z, GE X, LU Y, et al. Effects of chitosan molecular weight and degree of deacetylation on the properties of gelatine-based films[J]. Food Hydrocolloids, 2012, 26(1): 311-317. DOI:10.1016/j.foodhyd.2011.06.008.
[22] HOQUE M S, BENJAKUL S, PRODPRAN T. Effect of heat treatment of fi lm-forming solution on the properties of fi lm from cuttlefish (Sepia pharaonis) skin gelatin[J]. Journal of Food Engineering, 2010, 96(1):66-73. DOI:10.1016/j.jfoodeng.2009.06.046.
[23] 顾小红, 孟旭, 汤坚. 豆浆凝固过程中大豆蛋白质二级结构的研究[J]. 分析科学学报, 2006, 22(6): 675-678. DOI:10.3969/j.issn.1006-6144.2006.06.013.
[24] BENBETTAIEB N, KARBOWIAK T, BRACHAIS C H, et al.Coupling tyrosol, quercetin or ferulic acid and electron beam irradiation to cross-link chitosan-gelatin films: a structure-function approach[J]. European Polymer Journal, 2015, 67: 113-127.DOI:10.1016/j.eurpolymj.2015.03.060.
[25] FAKHREDDIN H S, REZAEI M, ZANDI M, et al. Preparation and functional properties of fish gelatin-chitosan blend edible fi lms[J]. Food Chemistry, 2013, 136(3/4): 1490-1495. DOI:10.1016/j.foodchem.2012.09.081.
[26] HERRERO A M, CARMONA P, COFRADES S, et al. Raman spectroscopic determination of structural changes in meat batters upon soy protein addition and heat treatment[J]. Food Research International,2008, 41(7): 765-772. DOI:10.1016/j.foodres.2008.06.001.
[27] DENG S, LV L, YANG W, et al. Effect of electron irradiation on the gel properties of Collichthys lucidus, surimi[J]. Radiation Physics & Chemistry, 2017, 130: 316-320. DOI:10.1016/j.radphyschem.2016.08.022.
[28] DOGAN A, SIYAKUS G, SEVERCAN F. FTIR spectroscopic characterization of irradiated hazelnut (Corylus avellana L.)[J]. Food Chemistry, 2007, 99(3): 1106-1114. DOI:10.1016/j.foodchem.2005.11.017.
[29] M U R I L L O M A R T I N E Z M M, P E D R O Z A I S L A S R,LOBATOCALLEROS C, et al. Designing W1/O/W2double emulsions stabilized by protein-polysaccharide complexes for producing edible films: rheological, mechanical and water vapour properties[J].Food Hydrocolloids, 2011, 25(4): 577-585. DOI:10.1016/j.foodhyd.2010.06.015.
[30] LE T, MAKI H, TAKAHASHI K, et al. Properties of gelatin film from horse mackerel (Trachurus japonicus) scale[J]. Journal of Food Science, 2015, 80(4): E734-E741. DOI:10.1111/1750-3841.12806.
[31] 杨红. 中药化学实用技术[M]. 北京: 化学工业出版社, 2004.
[32] 苗敏. 黄酮类化合物对溶菌酶淀粉样纤维化过程的抑制作用研究[D].郑州: 郑州大学, 2016: 49-54.
[33] LIU E H, QI L W, LI P. Structural relationship and binding mechanisms of fi ve fl avonoids with bovine serum albumin[J]. Molecules, 2010, 15(12):9092-9103. DOI:10.3390/molecules15129092.
Modification of Fish Scale Gelatin Edible Films Using Flavonoids with Different Hydroxyl Structures
ZHOU Wei, HU Yi, ZHANG Jinjie*, XU Dalun, LOU Qiaoming, YANG Wenge
(Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province,School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Abstract:Luteolin, quercetin and myricetin are natural plant fl avonoids with similar structure and different numbers of hydroxyl groups. In this work, the mechanical and optical properties of fi sh scale gelatin edible fi lms incorporated with luteolin, quercetin or myricetin were measured and compared with the aim of exploring the role of interaction between gelatin and fl avonoids with different numbers of hydroxyl groups inside the composite fi lms in improving the properties of the fi lms. Differential scanning calorimetry (DSC) and Fourier transform infrared (FTIR) spectroscopy showed that steric hindrance between gelatin molecules was formed by the addition of the fl avonoids. In the meantime, hydrogen bonds and dipole-dipole force were formed between the hydroxyl groups of fl avonoids and gelatin, and they were strengthened with the increasing number of hydroxyl groups. The interactions between the hydrophobic rings and hydroxyl groups of fl avonoids and gelatin molecules led to the secondary structural transition from β-turn to β-sheet, random coil and α-helix. As a result of the strengthened hydrogen bonds and dipole-dipole force between fl avonoids and gelatin molecules with the increasing number of hydroxyl groups, the molecular mobility of gelatin was weakened, making the fi lm structure more compact and elevating the tensile extensibility. Although incorporation of fl avonoids improved the ultraviolet absorbance, the number of hydroxyl groups did not affect the light transmittance of gelatin fi lms. These results can provide a theoretical guideline for the improvement of gelatin edible fi lms with the addition of fl avonoids.
Keywords:interactions; fl avonoids; gelatin; improvement of fi lm properties
ZHOU Wei, HU Yi, ZHANG Jinjie, et al. Modification of fi sh scale gelatin edible fi lms using fl avonoids with different hydroxyl structures[J]. Food Science, 2018, 39(20): 78-85. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820012. http://www.spkx.net.cn
引文格式:周伟, 胡熠, 张进杰, 等. 不同羟基结构的黄酮对鱼鳞明胶可食性膜的改性作用[J]. 食品科学, 2018, 39(20): 78-85.DOI:10.7506/spkx1002-6630-201820012. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0078-08
文献标志码:A
中图分类号:TS254.1
DOI:10.7506/spkx1002-6630-201820012
*通信作者简介:张进杰(1981—),男,讲师,博士,研究方向为食品加工。E-mail:jackace@163.com
第一作者简介:周伟(1993—),男,硕士研究生,研究方向为食品加工。E-mail:1072233476@qq.com
基金项目:浙江省自然科学基金项目(LY15C20008);国家自然科学基金青年科学基金项目(31201284)
收稿日期:2017-08-03