表1 Box-Behnken试验因素与水平
Table 1 Factors and levels used in Box-Behnken design

刘 今,李 伟,别小妹,吕凤霞,陆兆新*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:为拓宽表面活性素Surfactin的应用范围,拟制备以卡波姆974p作为抑菌凝胶基质、Surfactin作为抑菌成分、三乙醇胺为中和剂的Surfactin抑菌凝胶。通过研究各成分对该抑菌凝胶的抑菌作用、pH值和黏度的影响,设计Box-Behnken响应面试验得到最佳配方,优化结果为Surfactin用量0.60%、卡波姆974p用量0.35%、三乙醇胺用量0.30%,此条件下得到的抑菌凝胶感官清亮,Surfactin性质更加稳定,有较强的瞬时杀菌活性,与溶液相比,对成熟的金黄色葡萄球菌生物膜的清除效果有显著提升,处理后的生物膜出现裂纹,颜色变浅透亮,分布稀疏,更容易被清除。
关键词:Surfactin;卡波姆;抑菌凝胶;金黄色葡萄球菌;生物膜
表面活性素Surfactin是由芽孢杆菌产生的一类胞外分泌的次级代谢产物,对Surfactin的生理毒性研究显示,Surfactin小鼠口服半致死剂量超过5 000 mg/kg,急性毒性属实际低毒或无毒级[1-2],表明Surfactin具有较高的安全性。还有研究表明,Surfactin同样具有较为广谱的抗菌活性,对革兰氏阳性菌、革兰氏阴性菌、真菌以及微浆菌等均具有较强的杀灭作用[3],较高浓度下的Surfactin对于食源性致病菌形成的生物膜也有一定的抑制效果[4],能够有效防止微生物对食品的污染和对生产设备的危害。Surfactin这些优良的性质在生物防治、食品加工以及医药等领域都具有巨大的应用价值。但由于Surfactin属于生物类表面活性剂(由一个7 个氨基酸的内脂环肽和13~16 个碳的碳链组成[5]),为保证其活性,常在低温环境下以冻干粉末贮存,限制了Surfactin的使用范围。
常见的凝胶高分子赋形剂有羟丙基甲基纤维素、卡波姆、羧甲基纤维素、羧甲基纤维素钠、壳聚糖等。卡波姆为丙烯酸键合烯丙基蔗糖或季戊四醇烯丙醚的高分子聚合物[6],利用氢氧化钠和三乙醇胺作为中和剂可使其卷曲的分子因静电斥力张开或形成氢键而增稠形成凝胶。以卡波姆为辅料制备的凝胶剂质地均匀,附着性强,有较强的黏附力和清洁性,已被广泛用于凝胶剂和乳膏剂的研究与生产[7-9]。以卡波姆为辅料制备的凝胶剂性质稳定,涂布在器皿表面上可形成透明的薄膜,附着性强,残留低[10],不会对人体产生毒性作用。其中标有字母p的卡波姆是惟一可用于口服或与黏膜接触的药用级别聚合物。常用的卡波姆中和剂为三乙醇胺、氢氧化钠、氨水等,因氨水浓度不易控制,对配制人员有刺激性,故选用三乙醇胺或氢氧化钠。研究表明用三乙醇胺比氢氧化钠调节酸碱度得到的凝胶剂更为细腻,通过与卡波姆的羧基中和,可交联形成稳定的高分子化合物,达到增稠的效果[11]。因此,出于安全性考虑,本实验选择卡波姆974p作为抑菌凝胶的基质,脂肽Surfactin作为本抑菌凝胶中的主要有效成分发挥抗菌活性,选择三乙醇胺作为卡波姆的中和剂。
将Surfactin固定在凝胶体系中,利用Box-Behnken试验设计最佳配方,该凝胶可在常温下贮存,改善Surfactin保存条件单一的缺点,并通过卡波姆良好的黏附性提升Surfactin对于成熟的金黄色葡萄球菌生物膜的清除效果,提高Surfactin的利用效率、降低成本,以保障食品安全、避免食品加工过程中出现二次污染,为实现抗菌脂肽高产值化、拓宽Surfactin在食品工业的应用提供参考。
Surfactin为南京农业大学食品科技学院酶工程实验室自制[12],提取自实验室保存的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)fmb50;金黄色葡萄球菌(ATCC 6538)、单核细胞性李斯特菌(CICC 21663)、蜡样芽孢杆菌(AS1.1846)均为实验室保藏菌株。
卡波姆974p(生物试剂) 印度科瑞医药化工有限公司;三乙醇胺、丙三醇(均为分析纯) 国药集团化学试剂有限公司;结晶紫(分析纯) 上海晶纯生化科技股份有限公司;营养肉汤培养基 北京陆桥有限公司;营养琼脂 青岛MDBio生物科技有限公司。
UV-2450紫外分光光度计 日本岛津公司;AY120电子精密天平 日本Shimadzu公司;移液器 大龙兴创实验仪器有限公司;3 STAR pH计 美国Orion公司;二级生物安全柜 苏州长留净化科技有限公司;BC/BP-225SB冷柜 海尔集团;MCR 301界面流变仪 澳大利亚Anton Paar有限公司。
1.3.1 抑菌凝胶制备工艺流程
卡波姆974p溶液制备:将卡波姆974p粉末加入无菌去离子水中,以2 000 r/min转速磁力搅拌2~3 h,得到A液。将A液在室温下静置8~12 h,使其充分水合。
Surfactin抑菌凝胶贮备:称取Surfactin冻干粉末加入无菌去离子水中,超声10~15 min,使其完全溶解。将三乙醇胺缓慢加入制备好的Surfactin溶液中,在室温下搅拌均匀,得到B液。将A液缓慢加入B液中,不断搅拌混合,直至凝胶初步成型。然后室温下静置12 h,使其自然溶胀,即得Surfactin抑菌凝胶。
1.3.2 抑菌效果测定
采用琼脂扩散法[13]考察抑菌凝胶的抑菌作用,所选菌株为金黄色葡萄球菌ATCC 6538。
1.3.3 黏度测定
使用MCR 301界面流变仪,对抑菌凝胶的黏度进行测定,测定温度为(25±1)℃,测定时间为5 min。
1.3.4 pH值测定
取2 mL抑菌凝胶样品溶于2 mL去离子水中,搅拌均匀后得混合溶液,用电子pH计测定混合溶液的pH值并记录,每组样品重复测定3 次。
1.3.5 抑菌凝胶配方优化
本研究中所用Surfactin为实验室自制,其在水中的溶解度不超过1%,因此在响应面试验设计中Surfactin的用量(各成分以质量分数计)范围定为0.2%~0.8%;根据梅清华[14]、吴浪[6]等的研究,将卡波姆的用量定为0.2%~0.5%;根据郭红叶等[10]的研究,一般情况下1 g卡波姆约需三乙醇胺1.35 g中和,因此三乙醇胺的用量范围定为0.3%~1.2%。采用Box-Behnken试验对配方进行优化,试验设计为3因素3水平,考察因素和水平如表1所示。评价指标为抑菌圈直径(R1)、样品pH值(R2)和样品黏度(R3)。
表1 Box-Behnken试验因素与水平
Table 1 Factors and levels used in Box-Behnken design

1.3.6 感官评定
取适量样品,置于干燥洁净的透明器皿内,在非直射光条件下进行观察,对外观及气味进行评判。
1.3.7 稳定性测定
离心法:取样品5 mL置于离心管中,以3 000 r/min离心5 min后,观察水分析出及分层现象产生情况。
耐热耐寒实验:样品置于(54±2)℃放置24 h,取出,置室温观察外观变化情况、凝胶分层现象;再将样品置于(4±2)℃冰箱内放置24 h,取出恢复室温后,观察外观变化情况、凝胶分层现象。
留样观察法:取样品10 mL,置室温避光贮存3 个月,观察均匀度、稠度、外观是否存在明显变化。
粒径稳定性:分别配制质量分数为0.60% Surfactin的溶液和复合凝胶,使用Zeta电位仪测定2 种样品在第0天及室温下存放14 d后的粒径大小。
1.3.8 瞬时杀菌效果测定
按照GB 15979—2002《一次性使用卫生用品卫生标准》附录C[15]在规定的浓度下测定,待测菌株为金黄色葡萄球菌(ATCC 6538)、单核细胞性李斯特菌(CICC 21663)和蜡样芽孢杆菌(AS1.1846)。
1.3.9 对金黄色葡萄球菌生物膜清除效果评价
除凝胶原液(Surfactin质量浓度为6 000 μg/mL)外,将复配好的凝胶用无菌去离子水分别稀释成Surfactin终质量浓度为64(2 MIC)、128(4 MIC)、1 000、2 000 μg/mL的凝胶稀释液,设无菌水作为对照组,分别加入附有培养72 h的金黄色葡萄球菌生物膜的96 孔板中,每孔样液体积为200 μL,处理时间为0.5、2 h及4 h,用无菌水洗脱各孔内样液后,采用结晶紫染色法[16]测量孔板内生物膜残留量,评价抑菌凝胶对于金黄色葡萄球菌生物膜的清除效果。
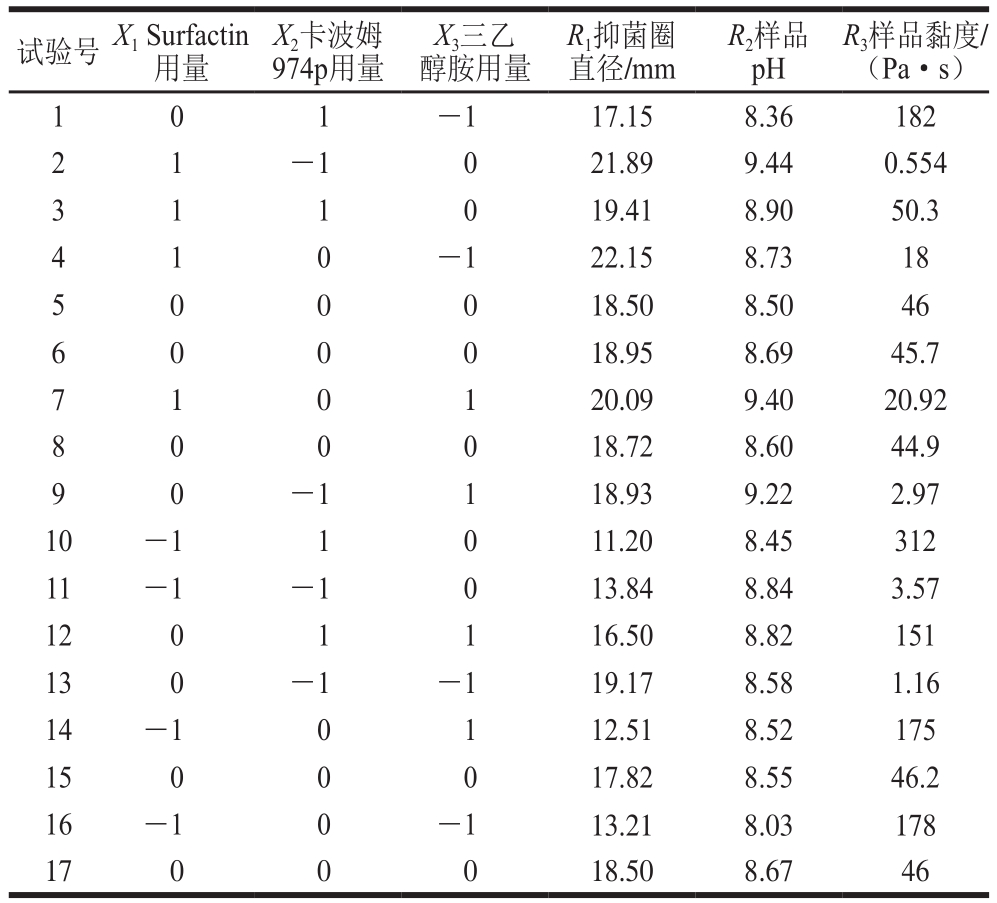
抑菌凝胶Box-Behnken试验设计及结果如表2所示。
表2 响应面试验设计及结果
Table 2 Experimental design and results for response surface analysis
通过Design-Expert 8.0.6进行多元回归拟合,对回归系数和回归模型进行方差分析,结果如表3~5所示。
表3 以抑菌圈直径为响应值的回归模型方差分析
Table 3 Analysis of variance for regression model with inhibition zone diameter as response
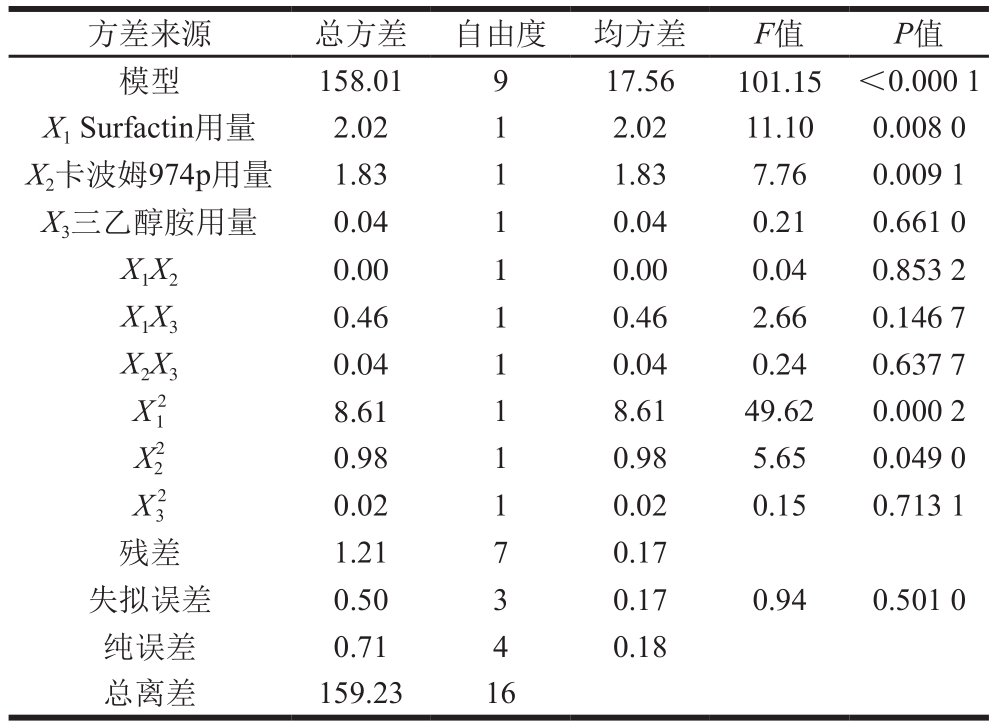
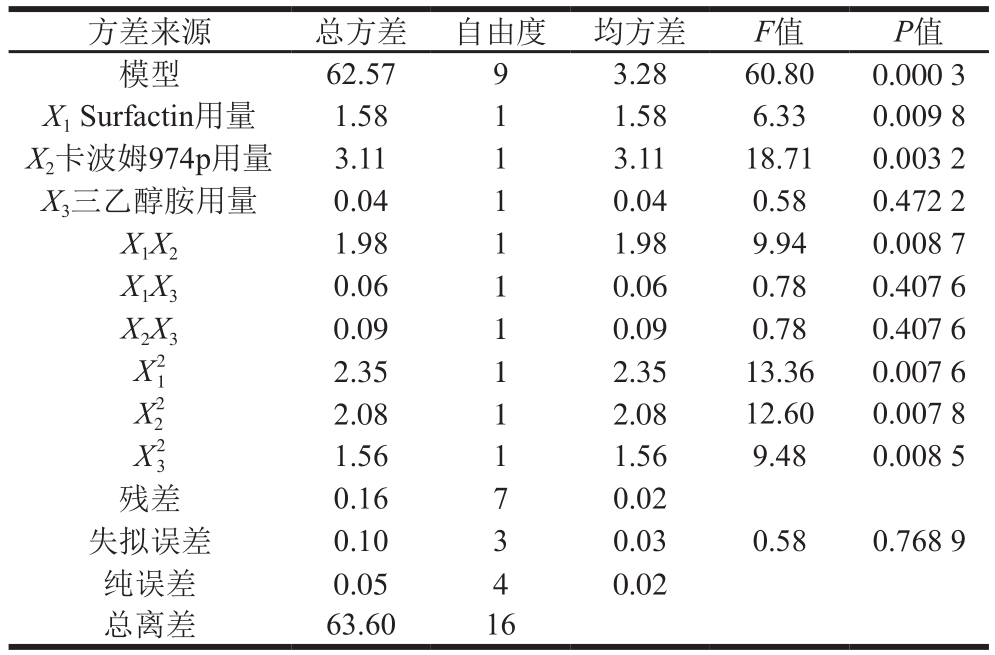
表4 以样品pH值为响应值的回归模型方差分析
Table 4 Analysis of variance for regression model with pH as response

表5 以样品黏度为响应值的回归模型方差分析
Table 5 Analysis of variance for regression model with gel viscosity as response
2.1.1 各因素对抑菌凝胶抑菌活性的影响结果
根据多元回归处理后得到的关于抑菌凝胶抑菌圈直径R1的回归模型方程为R1=18.50+4.10X1-1.20X2-![]()
![]()
由表3可知,回归模型极显著(P<0.01),R2值为0.992 4,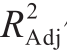 值为0.921 3,说明该模型拟合良好[17]。其中,X1、X2、X12对响应值R1的影响极显著(P值均小于0.01),
值为0.921 3,说明该模型拟合良好[17]。其中,X1、X2、X12对响应值R1的影响极显著(P值均小于0.01),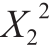 对响应值R1的影响显著(P=0.049 0),影响大小顺序为Surfactin用量>卡波姆974p用量>三乙醇胺用量。由图1可知,因素间交互作用影响不显著,当卡波姆974p和三乙醇胺用量一定时,Surfactin用量越高,抑菌凝胶的抑菌活性越强;当Surfactin用量一定时,卡波姆974p用量在0.2%~0.35%之间、三乙醇胺用量在0.30%~0.50%之间,抑菌凝胶的抑菌活性最好。
对响应值R1的影响显著(P=0.049 0),影响大小顺序为Surfactin用量>卡波姆974p用量>三乙醇胺用量。由图1可知,因素间交互作用影响不显著,当卡波姆974p和三乙醇胺用量一定时,Surfactin用量越高,抑菌凝胶的抑菌活性越强;当Surfactin用量一定时,卡波姆974p用量在0.2%~0.35%之间、三乙醇胺用量在0.30%~0.50%之间,抑菌凝胶的抑菌活性最好。
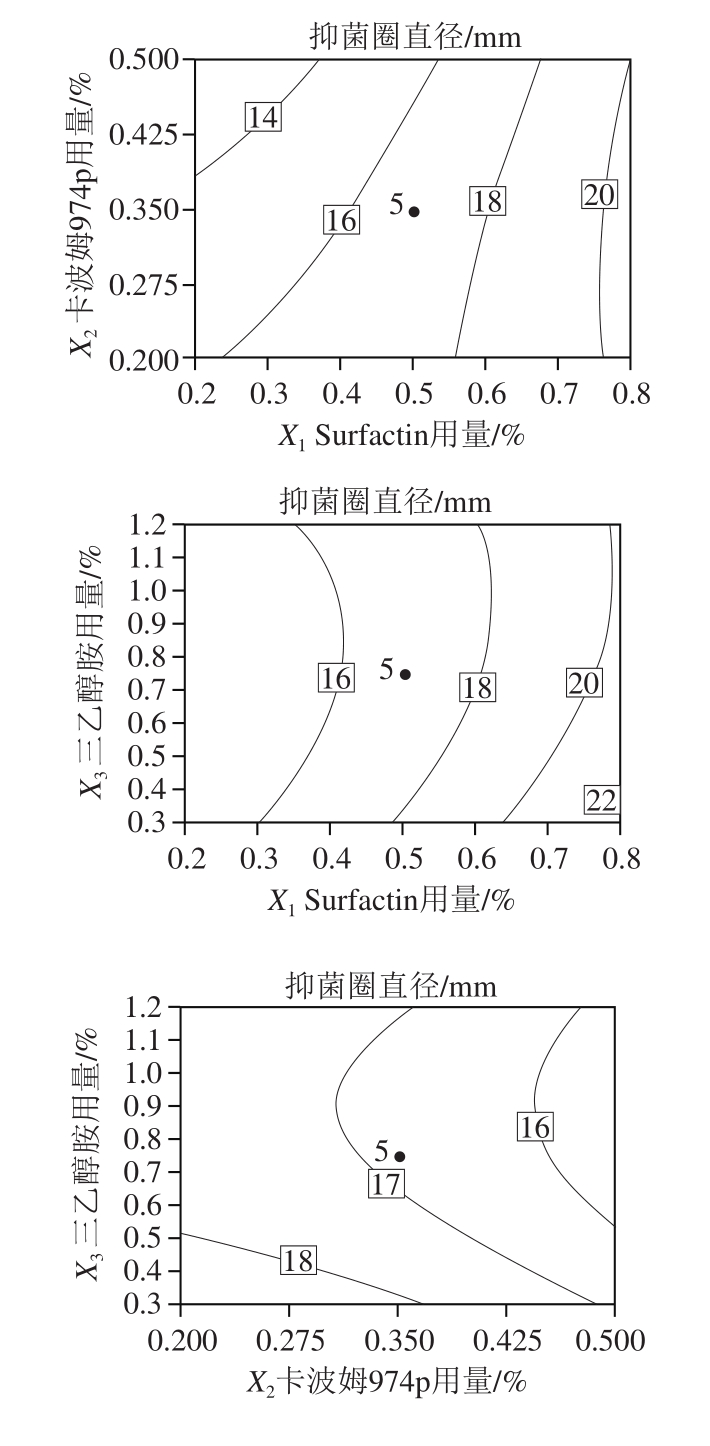
图1 Surfactin、卡波姆974p及三乙醇胺用量交互作用对抑菌凝胶抑菌圈直径的影响
Fig. 1 Effect of interaction between Surfactin and Carbopol, Surfactin and TEA, and Carbopol and TEA on inhibition zone diameter
2.1.2 各因素对抑菌凝胶pH值的影响
根据多元回归处理后得到的关于抑菌凝胶pH值R2的回归模型方程为R2=8.60+0.33X1-0.19X2+0.28X3-![]()
![]()
由表4可知,回归模型极显著(P<0.01),R2值为0.965 6,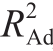 j值为0.921 3,说明该模型拟合良好。其中,X1、X2、X3、
j值为0.921 3,说明该模型拟合良好。其中,X1、X2、X3、 对响应值R2的影响极显著(P值均小于0.01),影响大小顺序为Surfactin用量>三乙醇胺用量>卡波姆974p用量。各因素间的交互作用不显著,X1、X2、X3对复合凝胶pH值的影响见图2。由图2可知,当卡波姆974p和三乙醇胺用量一定时,Surfactin用量越高,抑菌凝胶的pH值越高;当Surfactin和三乙醇胺用量一定时,卡波姆974p用量越高,抑菌凝胶的pH值越低;当Surfactin和卡波姆974p用量一定时,三乙醇胺用量越高,抑菌凝胶的pH值越高。凝胶的pH值尽可能接近中性,则Surfactin用量为0.2%~0.4%、卡波姆974p用量为0.35%~0.5%、三乙醇胺用量为0.30%~0.45%最为适宜。
对响应值R2的影响极显著(P值均小于0.01),影响大小顺序为Surfactin用量>三乙醇胺用量>卡波姆974p用量。各因素间的交互作用不显著,X1、X2、X3对复合凝胶pH值的影响见图2。由图2可知,当卡波姆974p和三乙醇胺用量一定时,Surfactin用量越高,抑菌凝胶的pH值越高;当Surfactin和三乙醇胺用量一定时,卡波姆974p用量越高,抑菌凝胶的pH值越低;当Surfactin和卡波姆974p用量一定时,三乙醇胺用量越高,抑菌凝胶的pH值越高。凝胶的pH值尽可能接近中性,则Surfactin用量为0.2%~0.4%、卡波姆974p用量为0.35%~0.5%、三乙醇胺用量为0.30%~0.45%最为适宜。
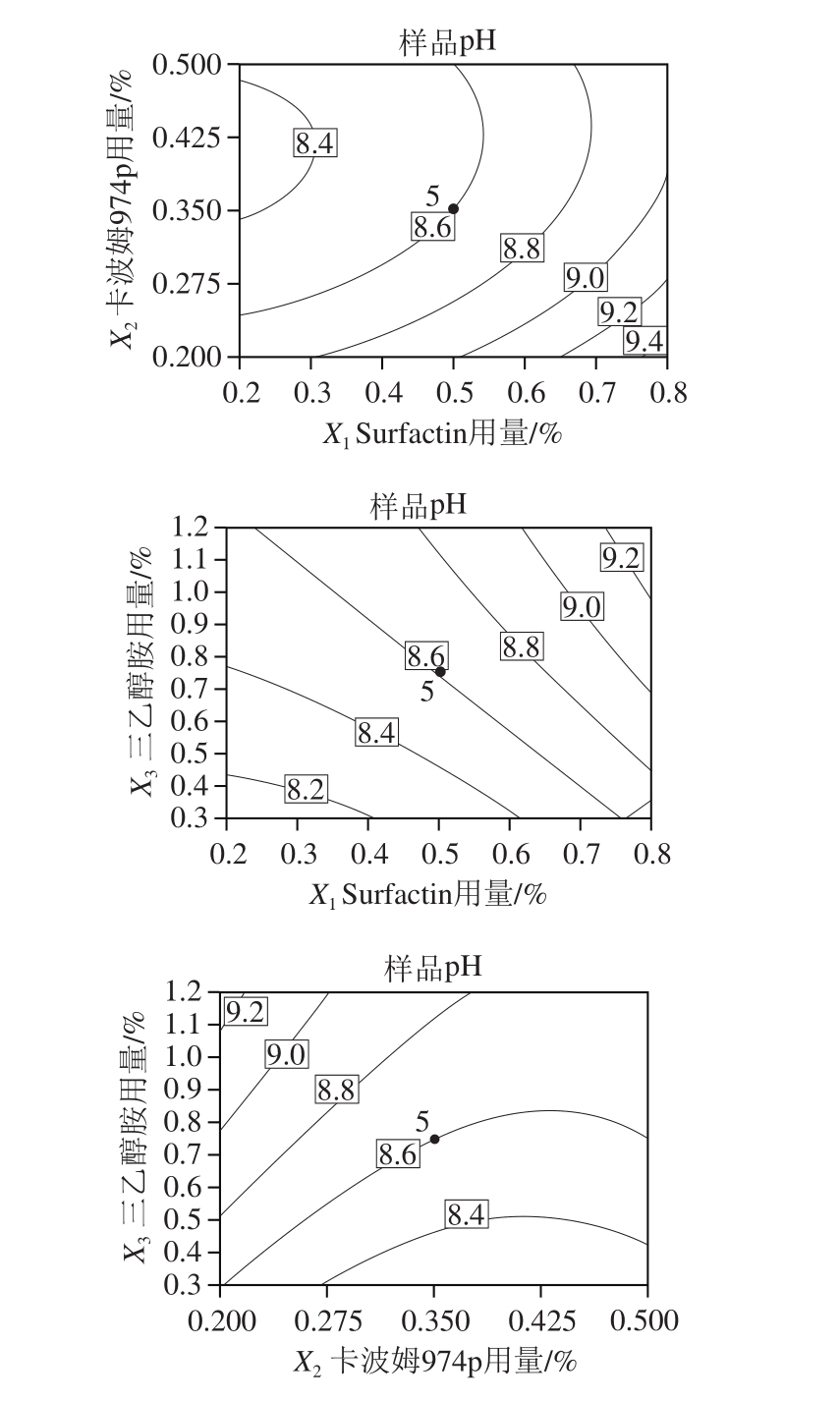
图2 Surfactin、卡波姆974p及三乙醇胺用量交互作用对抑菌凝胶pH值的影响
Fig. 2 Effect of interaction between Surfactin and Carbopol, Surfactin and TEA, and Carbopol and TEA on pH
2.1.3 各因素对抑菌凝胶黏度的影响
根据多元回归处理后得到的关于抑菌凝胶黏度R3的回归模型方程:R3=45.76-72.35X1+85.88X2-3.66X3-64.67X1X2+1.48X1X3-8.20X2X3+29.77X12+16.07X22+22.45X32。
由表5可知,回归模型极显著(P<0.01),R2值为0.995 9,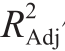 值为0.990 6,说明该模型拟合良好。其中,
值为0.990 6,说明该模型拟合良好。其中,![]() 对响应值R3的影响极显著(P值均小于0.01),影响大小顺序为卡波姆974p用量>Surfactin用量>三乙醇胺用量。Surfactin和卡波姆974p存在明显的交互作用。由图3可知,当卡波姆974p和三乙醇胺用量一定时,Surfactin用量越高,抑菌凝胶的黏度越低;当Surfactin和三乙醇胺用量一定时,卡波姆974p用量越高,抑菌凝胶的黏度越高;三乙醇胺对样品黏度影响较小。根据凝胶的感官及性状,选择30 Pa·s作为目标值,则Surfactin用量为0.5%~0.8%、卡波姆974p用量为0.2%~0.35%最为适宜。
对响应值R3的影响极显著(P值均小于0.01),影响大小顺序为卡波姆974p用量>Surfactin用量>三乙醇胺用量。Surfactin和卡波姆974p存在明显的交互作用。由图3可知,当卡波姆974p和三乙醇胺用量一定时,Surfactin用量越高,抑菌凝胶的黏度越低;当Surfactin和三乙醇胺用量一定时,卡波姆974p用量越高,抑菌凝胶的黏度越高;三乙醇胺对样品黏度影响较小。根据凝胶的感官及性状,选择30 Pa·s作为目标值,则Surfactin用量为0.5%~0.8%、卡波姆974p用量为0.2%~0.35%最为适宜。

图3 Surfactin、卡波姆及三乙醇胺用量交互作用对抑菌凝胶黏度的影响
Fig. 3 Effect of interaction between Surfactin and Carbopol, Surfactin and TEA, and Carbopol and TEA on viscosity
2.1.4 优化配方验证实验结果
结合回归模型,设定3 组指标权重比为1∶1∶1,由Design-Expert 8.0.6软件分析得到优化后的Surfactin抑菌凝胶的配方为Surfactin用量0.64%、卡波姆974p用量0.32%、三乙醇胺用量0.30%,在此条件下复配得到的抑菌凝胶对金黄色葡萄球菌ATCC 6538的抑菌圈直径理论值为20.86 mm,pH理论值为8.48,黏度理论值为30.27 Pa·s。考虑到实际操作,将优化配方修正为Surfactin用量0.60%、卡波姆974p用量0.35%、三乙醇胺用量0.30%。在此条件下进行验证实验,得到的Surfactin抑菌凝胶的抑菌圈直径为(20.66±0.08)mm,pH值为8.52,黏度为31.6 Pa·s,与理论预测值基本一致,说明回归模型可靠,预测性良好。
在非直射光条件下进行观察,本品外观均一透明,黏度和流动性适中,有良好的附着性,离心后未见分层现象,无特殊气味。
本实验中采用Surfactin作为抑菌剂,具有低毒、易降解的特点。对Surfactin的急性毒性实验表明,小鼠口服7 d 5 000 mg/kg[18]或28 d 500 mg/kg[19]小鼠体质量对小鼠无明显影响,即属于实际无毒级。采用卡波姆974p作为凝胶剂,卡波姆系列已被收载于FDA《非活性组分指南》(用于口服混悬剂和片剂,眼用制剂、直肠制剂和局部用制剂),其中标有字母p的卡波姆是一类可口服或与黏膜接触的药用级别的聚合物,由于残留溶剂微量常用于口含或口服生物黏附制剂中[20]。一般认为卡波姆基本上是无毒、无刺激性的辅料,没有证据表明局部应用卡波姆有过敏反应;采用三乙醇胺作为中和剂,三乙醇胺在胺类中口服毒性最低,属实际无毒级别。优化配方中三乙醇胺用量为0.3%,远低于最大限量2.5%[11,21]。由此可知本研究中的抑菌凝胶毒性较低,使用起来较为安全。
Surfactin作为一种脂肽类物质,其结构中含有7 个氨基酸组成的内脂环肽,关于其抑菌机制有多种解释,其中大部分解释认为Surfactin的抑菌活性和表面活性与其特殊的组成和空间结构有关,因此保持Surfactin性状的稳定性对维持其优良性质有重要意义。
2.4.1 感官稳定性
表6 抑菌凝胶的稳定性
Table 6 Stability of the antibacterial gel

从表6可以看出,抑菌凝胶性状稳定,由离心法和耐热耐寒实验发现,抑菌凝胶均无分层和脱水收缩现象出现;室温下避光贮存3 个月后样品黏度稍有下降,无特殊气味和沉淀产生。
2.4.2 粒径稳定性
由图4a可知,新配制的Surfactin溶液粒径集中分布在100~1 000 nm范围内,说明此体系中主要由单一的聚集形态构成。李翌[22]研究表明Surfactin分子在溶液中都趋向于形成球形胶束,与本实验检测结果一致;新配制的Surfactin溶液外观表现为均一透明的溶液;由图4b可知,在室温下贮存14 d后的Surfactin溶液中粒径变大且分布散乱,从100~10 000 nm均有一定量的分布,说明形成了其他不对称胶束;溶液外观表现为溶液中出现白色絮状沉淀并产生特殊气味,发泡性下降;图4c为新配制Surfactin凝胶中的粒径分布状态,图4d为在室温下贮存14 d后Surfactin凝胶中的粒径分布,两者对比可见粒径分布变化较小,粒径分布均在1~10 nm及10~1 000 nm范围内且分布峰形一致;观察外观来看两组均为均一透明的凝胶,未见沉淀或分层现象,经过测定后发现仍有较好的抑菌活性和表面活性,可知凝胶状态下的Surfactin分子更稳定。根据刘方[23]对脂肽复合体系溶液性质的研究结果,推测出现多个分布峰形的原因可能是Surfactin分子与卡波姆等其他高分子缠绕形成棒状或椭球形胶束,体系黏度增大,因此出现多种粒径分布。
对比粒径测定结果可知,相较于溶液状态,Surfactin存在于卡波姆凝胶中更为稳定,使用寿命更长。推测可能是卡波姆与三乙醇胺的相互作用交联形成的凝胶作为客体,将Surfactin作为主体分子固定在凝胶的网状结构中,从而稳定了Surfactin的空间结构,保护Surfactin的抑菌活性和表面活性,延长了Surfactin的使用期限。
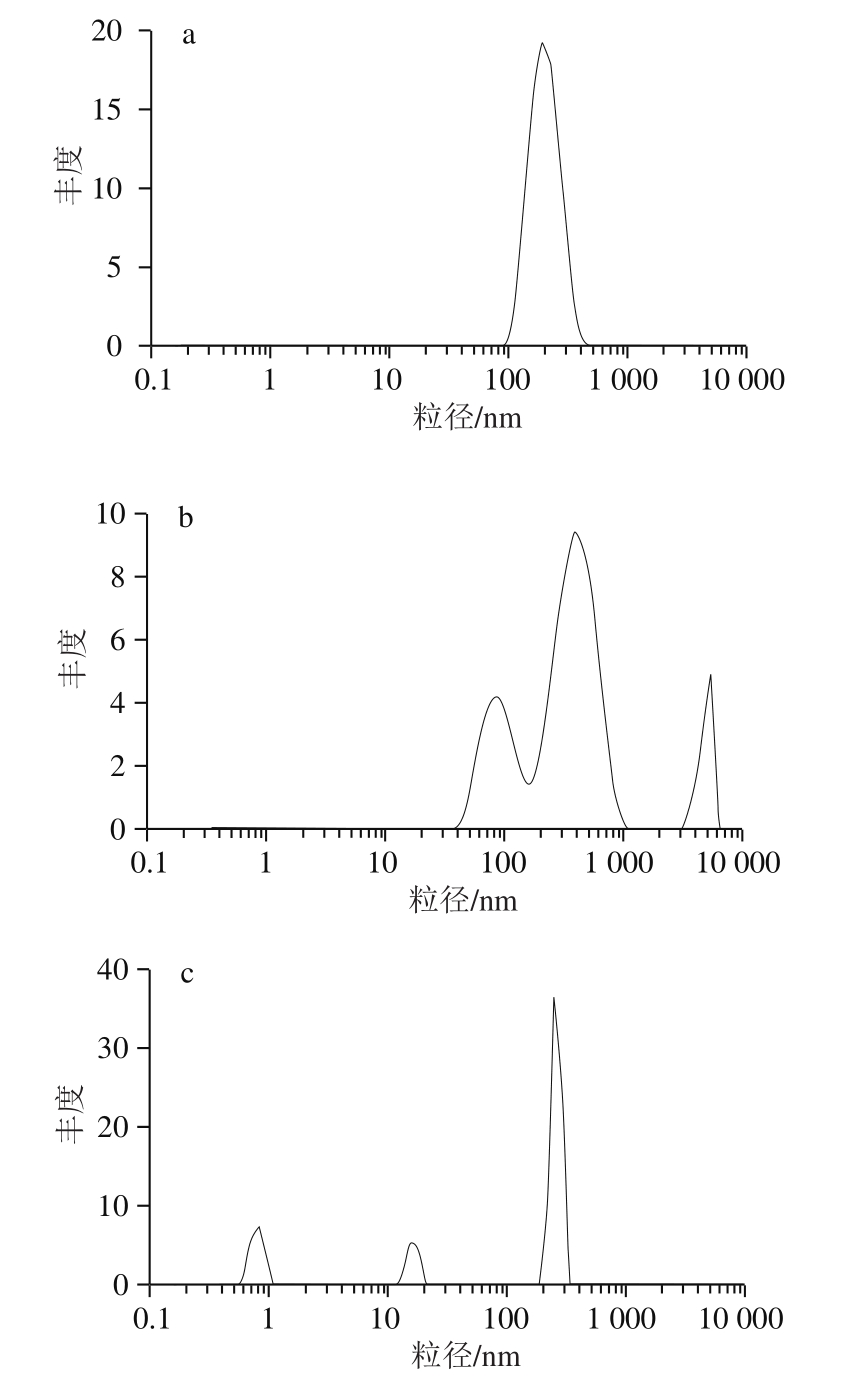
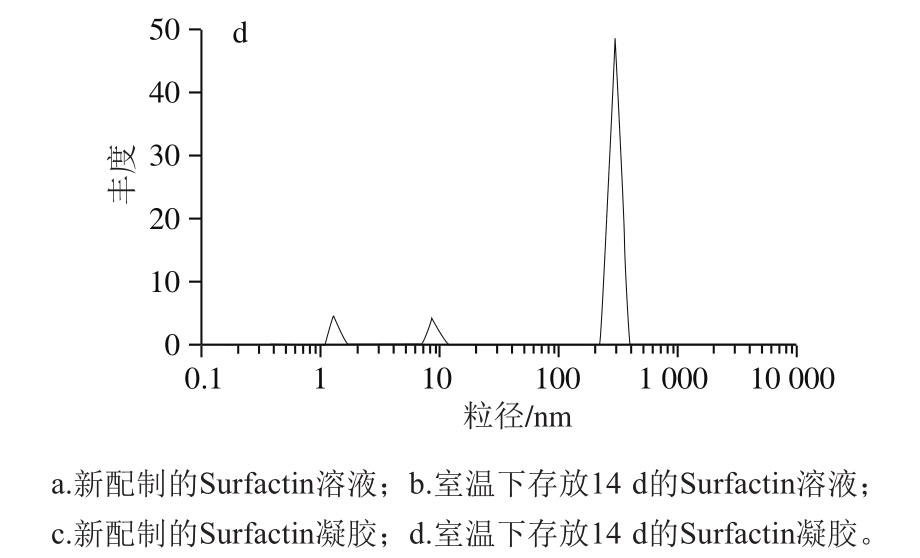
图4 不同时间内Surfactin在不同体系中的粒径分布
Fig. 4 Particle size distribution of Surfactin in different solutions at various time intervals
表7 抑菌凝胶的瞬时杀菌能力
Table 7 Instantaneous bactericidal ability of the antibacterial gel

由表7可知,在凝胶作用1 min后,被测菌株的数量均有显著下降;作用5 min后瞬时杀菌率均达到了50%以上;作用10 min后瞬时杀菌率均能达到60%以上。说明Surfactin凝胶的瞬时杀菌性能良好,有较强的抑菌作用。
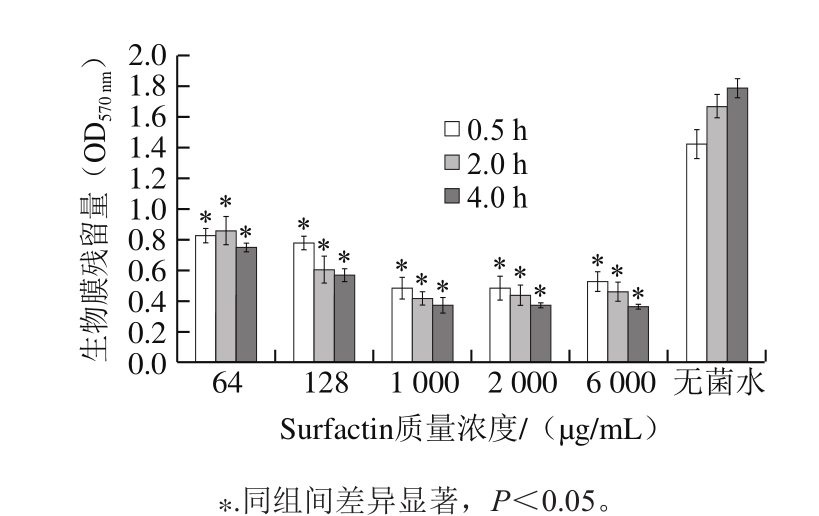
图5 抑菌凝胶对成熟金黄色葡萄球菌生物膜的清除效果
Fig. 5 Disruption of mature S. aureus biofilm by the antibacterial gel
食品加工过程中虽经过清洗消毒工序,但微生物还是可能残留在食品接触表面,如设备、包装容器、台面等,并易形成生物膜。与游离菌体相比,成熟的生物膜更难清除[24-25],污染食品的可能性也更大。金黄色葡萄球菌的生物膜具有极强的黏附性,在低氧环境下很容易产生肠毒素,一旦污染就会对食品安全产生极大威胁[26-27]。因此本实验研究了Surfactin经过凝胶化之后对成熟的金黄色葡萄球菌生物膜的清除效果。由图5可知,Surfactin凝胶对于金黄色葡萄球菌生物膜的清除效果明显,当Surfactin在凝胶中的质量浓度达到1 000 μg/mL及以上时,生物膜残留量(OD570nm)低至0.5以下,感官上表现为处理后的生物膜出现大量裂纹、分布稀疏、颜色变浅透亮、黏附性降低、易被清除,且不同作用时间之间差别并不明显,说明抑菌凝胶及其稀释液在较短的处理时间(0.5~2 h)内就能破坏并去除较多的生物膜,清除效果良好;而在相同的处理时间内加入无菌水后并未发现生物膜残留量显著降低,说明水对金黄色葡萄球菌的生物膜清洁力较弱。
目前对于生物类表面活性剂对生物膜的清除作用机制尚不明确,多数研究都认为与生物表面活性剂的物理化学性质有关。生物类表面活性剂依靠自身优良的表面活性渗入生物膜与接触的固体基质之间,并吸附在界面上,降低界面张力。因此,细菌与它们所黏附的介质表面之间的相互作用力也被削弱[28],这使得生物膜更容易去除。作为表面活性最强的生物表面活性剂之一,Surfactin在10 µmol/L的浓度下就可以将水的界面张力从72 mN/m降低至27 mN/m[29]。除此之外,Surfactin在远低于临界胶束浓度时就可表现出较强的膜渗透能力,诱导膜内容物流出[30],从而造成目标细胞的完全裂解,这也是它能够破坏成熟生物膜的可能原因之一;由于卡波姆具有良好的黏附性和滞留性,向Surfactin溶液中加入卡波姆后提高了整个体系的黏附性,使Surfacin渗入生物膜内部的能力增强,在生物膜与固体介质接触界面上的停留时间变长,使得Surfactin的表面活性作用得以更好的发挥,从而提高了对生物膜的清除效率和效果。
本实验以卡波姆为基质、以Surfactin为主要有效成分配制抑菌凝胶,制备原料主要有Surfactin、卡波姆974p、三乙醇胺。经过Box-Behnken试验优化后得到的抑菌凝胶配方为Surfactin用量0.60%、卡波姆974p用量0.35%、三乙醇胺用量0.30%,在此条件下得到的Surfactin抑菌凝胶的抑菌圈直径为(20.66±0.08)mm,pH值为8.52,黏度为31.6 Pa·s。
本实验中制备的Surfactin抑菌凝胶感官清亮,性质稳定,可在常温下贮存,并对几种常见的食源性致病菌均有较强的瞬时杀灭作用;卡波姆的加入使Surfactin对于金黄色葡萄球菌生物膜的清除力显著提升,在较短的处理时间(0.5~2 h)内即可使生物膜的残留量显著降低。由此可见制备得到的Surfactin抑菌凝胶高效实用、清洁力强。这些优良性质为实现Surfactin等天然脂肽类物质日后在保障食品安全、减少食品生产过程中加工设备的污染等方面的应用提供了参考依据。
参考文献:
[1] 戴超, 郭芳芳, 陆兆新, 等. 脂肽类生物表面活性剂Surfactin的乳化性[J]. 日用化学工业, 2015, 36(9): 40-44. DOI:10.7506/spkx1002-6630-201515009.
[2] GEORGIOU G, LIN S C, SHARMA M M. Surface-active compounds from microorganisms[J]. Biotechnology, 1992, 10(1): 60-65.DOI:10.1016/s0065-2164(08)70335-6.
[3] SHALIGRAM N S, SINGHAL R S. Surfactin: a review on biosynthesis, fermentation, purification and applications[J]. Food Technology & Biotechnology, 2010, 48(2): 119-134. DOI:10.1007/978-1-4419-5979-9_24.
[4] GOMES M Z D V, NITSCHKE M. Evaluation of rhamnolipid and surfactin to reduce the adhesion and remove biofilms of individual and mixed cultures of food pathogenic bacteria[J]. Food Control, 2012,25(2): 441-447. DOI:10.1016/j.foodcont.2011.11.025.
[5] 姚树林, 陆兆新, 郝天怡, 等. 氨基酸和碳架物质前体对surfactin生物合成的影响[J]. 南京农业大学学报, 2014, 37(2): 139-145.DOI:10.7685/j.issn.1000-2030.2014.02.023.
[6] 吴浪. 酶解猪血活性抑菌剂的制备及其免洗洗手液的研制[D].长春: 吉林大学, 2014.
[7] 庄远红, 刘静娜, 黄家福, 等. 食用菌壳聚糖卡波姆抗菌凝胶的稳定性及其抑菌效果[J]. 浙江大学学报(农业与生命科学版), 2015,41(2): 147-152.
[8] CHAUDHARY H, ROHILLA A, RATHEE P, et al. Optimization and formulation design of carbopol loaded Piroxicam gel using novel penetration enhancers[J]. International Journal of Biological Macromolecules, 2013, 55(2): 246-253. DOI:10.1016/j.ijbiomac.2013.01.015.
[9] JANA S, MANNA S, NAYAK A K, et al. Carbopol gel containing chitosan-egg albumin nanoparticles for transdermal aceclofenac delivery[J]. Colloids & Surfaces B: Biointerfaces, 2014, 114(8): 36-44.DOI:10.1016/j.colsurfb.2013.09.045.
[10] 郭红叶, 伊博文, 闫小平, 等. 新型辅料卡波姆在凝胶剂中应用现状[J].中国实验方剂学杂志, 2013, 19(17): 371-374.
[11] 常银子, 赖徐倩, 戴蓓蕾, 等. 一种茶皂素洗洁产品的研制[J].经济林研究, 2015, 33(2): 129-134. DOI:10.14067/j.cnki.1003-8981.2015.02.023.
[12] 章栋梁. Surfactin工业分离纯化工艺及其对肉品的防腐保鲜效果[D].南京: 南京农业大学, 2013. DOI:10.7666/d.Y2527169.
[13] 张国只, 陈林海, 杨天佑, 等. 琼脂扩散法测定乳链菌肽效价的优化[J]. 食品科学, 2007, 28(3): 175-178. DOI:10.3321/j.issn:1002-6630.2007.03.040.
[14] 梅清华, 励石寒, 高玲. 卡波姆凝胶制备的新方法[J]. 中国医院药学杂志, 2006, 26(1): 82-83. DOI:10.3321/j.issn:1001-5213.2006.01.040.
[15] 卫生部. 一次性使用卫生用品卫生标准: GB 15979—2002[S]. 北京:中国标准出版社, 2002.
[16] ARAUJO L V D, GUIMARÃES C R, MARQUITA R L D S, et al.Rhamnolipid and surfactin: anti-adhesion/antibiofilm and antimicrobial effects[J]. Food Control, 2016, 63: 171-178. DOI:10.1016/j.foodcont.2015.11.036.
[17] 陈钏杰, 陈培琳, 陈丽, 等. 响应面法优化莲子多糖提取工艺的研究[J]. 食品工业科技, 2017, 38(18): 177-182. DOI:10.13386/j.issn1002-0306.2017.18.034.
[18] 孙力军, 王雅玲, 刘唤明, 等. 一种新型抗菌肽APNT-6的溶血性和急性毒性评价[J]. 水产学报, 2012, 36(6): 974-978. DOI:10.3724/SP.J.1231.2012.27759.
[19] HWANG Y H, KIM M S, SONG I B, et al. Subacute (28 day) toxicity of surfactin C, a lipopeptide produced by Bacillus subtilis in rats[J].Journal of Health Science, 2009, 55230(3): 351-355. DOI:10.1248/jhs.55.351.
[20] 李晏, 杨延莉, 邹豪, 等. 卡波姆及其在药剂学上的应用[J]. 解放军药学学报, 2002, 18(2): 91-95. DOI:10.3969/j.issn.1008-9926.2002.02.011.
[21] 郑增娟, 李志韧, 冯占芹, 等. 卡波姆水凝胶的处方筛选与质量考察[J].医药导报, 2015, 34(2): 244-248. DOI:10.3870/yydb.2015.02.029.
[22] 李翌. 表面活性素在溶液中胶束化行为的研究[D]. 上海: 华东理工大学, 2009.
[23] 刘方. 微生物脂肽复合体系溶液性质的研究[D]. 上海: 华东理工大学, 2013.
[24] 娄凡丽. 鱼精蛋白对金黄色葡萄球菌生物膜干预作用的初步研究[D].武汉: 华中农业大学, 2014.
[25] DOULEGRAKI A I, CICCIO P D, IANIERI A, et al. Methicillinresistant food-related Staphylococcus aureus: a review of current knowledge and biofilm formation for future studies and applications[J].Research in Microbiology, 2016, 168(1): 1-15. DOI:10.1016/j.resmic.2016.08.001.
[26] CICCIO P D, VERGARA A, FESTINO A R, et al. Biofilm formation by Staphylococcus aureus on food contact surfaces: relationship with temperature and cell surface hydrophobicity[J]. Food Control, 2015,50: 930-936. DOI:10.1016/j.foodcont.2014.10.048.
[27] RODRIGUES J B D S, CARVALHO R J D, SOUZA N T D, et al. Effects of oregano essential oil and carvacrol on biofilms of Staphylococcus aureus from food-contact surfaces[J]. Food Control,2016, 73(Part B): 1237-1246. DOI:10.1016/j.foodcont.2016.10.043.
[28] SEDLOVÁG, SVOBODOVÁ J. Review of surfactin chemical properties and the potential biomedical applications[J]. Open Medicine, 2008, 3(2): 123-133. DOI:10.2478/s11536-008-0002-5.
[29] CHEN W C, JUANG R S, WEI Y H. Applications of a lipopeptide biosurfactant, surfactin, produced by microorganisms[J].Biochemical Engineering Journal, 2015, 103: 158-169. DOI:10.1016/j.bej.2015.07.009.
[30] MCLANDSBOROUGH L, RODRIGUEZ A, PÉREZ-CONESA D, et al.Biofilms: at the interface between biophysics and microbiology[J].Food Biophysics, 2006, 1(2): 94-114. DOI:10.1007/s11483-005-9004-x.
Formulation Design and Antibacterial Properties of Carbopol Loaded Surfactin Gel
LIU Jin, LI Wei, BIE Xiaomei, LÜ Fengxia, LU Zhaoxin*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:A carbopol loaded-Surfactin antibacterial gel was prepared by using Surfactin as a major effective component,carbopol as a thickener and triethanolamine as a neutralizer. The formulation was optimized using response surface methodology with Box-Behnken design. Three dependent variables were considered: diameter of inhibition zone, pH and viscosity of the gel. The optimal formulation was determined as follows: Surfactin 0.60%, carbopol 0.35%, and triethanolamine 0.30%. The optimized gel was transparent and stable with effective antibacterial activity, and the disruption of mature Staphylococcus aureus bio fi lm by the gel was improved obviously as compared with sterile water. After being treated with the Surfactin gel, the bio fi lm showed lighter color and sparse distribution with a certain light transmittance and high disruption.
Keywords:Surfactin; carbopol; antibacterial gel; Staphylococcus aureus; bio fi lm
LIU Jin, LI Wei, BIE Xiaomei, et al. Formulation design and antibacterial properties of carbopol loaded Surfactin gel[J].Food Science, 2018, 39(20): 104-111. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820016.http://www.spkx.net.cn
引文格式:刘今, 李伟, 别小妹, 等. Surfactin凝胶配方设计及其抑菌性能分析[J]. 食品科学, 2018, 39(20): 104-111. DOI:10.7506/spkx1002-6630-201820016. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0104-08
文献标志码:A
中图分类号:TS201.6
DOI:10.7506/spkx1002-6630-201820016
*通信作者简介:陆兆新(1957—),男,教授,博士,研究方向为食品生物技术。E-mail:fmb@njau.edu.cn
第一作者简介:刘今(1993—),女,硕士研究生,研究方向为食品生物技术。E-mail:2015108043@njau.edu.cn
基金项目:国家自然科学基金面上项目(31571887);2016年度江苏省农业科技自主创新资金项目(CX(16)1058)
收稿日期:2018-03-20