表1 非酿酒酵母与S. cerevisiae混合发酵用于生产低醇葡萄酒的研究进展总结
Table 1 Summary of recent studies on the mixed fermentation of non-S. cerevisiae and S. cerevisiae for the production of low alcohol wines

尤 雅,段长青,燕国梁*
(中国农业大学食品科学与营养工程学院,农业部葡萄酒加工重点实验室,北京 100083)
摘 要:为降低葡萄酒中的乙醇含量,采用不同接种方式(同时接种和顺序接种)在两个温度下(13 ℃和23 ℃)进行扁平云假丝酵母(Candida humilis)与酿酒酵母(Saccharomyces cerevisiae)的发酵实验。结果表明:23 ℃时混合发酵除高产甘油外,还有效降低了乙醇含量,其中与S. cerevisiae单独发酵相比,顺序接种可降低乙醇体积分数约2.59%,降醇幅度达到17.56%。在香气方面,混合发酵能产生较高含量的酯类物质,其中顺序接种最为明显,如乙酯类物质总量和乙酸乙酯含量分别增加了18.30%和16.03%,丁酸乙酯含量提高了2.77 倍,明显增加了花香和果香;13 ℃时,混合发酵显著提高了β-大马士酮的含量,其中同时接种发酵增加26.19%。结果表明C. humilis与S. cerevisiae进行混合发酵具有较好的降醇效果,可以为葡萄酒的降醇研究提供一种新的解决方法。
关键词:扁平云假丝酵母;酿酒酵母;混合发酵;发酵温度;葡萄酒香气
近年来,由于全球气候变暖,为追求葡萄成熟度对其采收期的延长,导致果实中糖含量大大增加,这也大幅提高了葡萄酒的乙醇体积分数[1-4]。已有不少研究表明,高乙醇含量会严重影响葡萄酒的风味特征,增加酒的灼热感和苦涩味,掩盖一些芳香类化合物,使甜味和酸味减弱[1-2,4]。低醇葡萄酒已逐步成为国内外葡萄酒研究的主要对象。
国内外降低葡萄酒乙醇含量的方法主要有采用真空蒸馏、反渗透技术、萃取等物理方法脱醇[5],但这些方法或多或少都存在着一些不足,如使用的费用过于昂贵,不仅会增加生产成本,还会改变一些代谢物含量从而严重影响酒质[1-2,5]。构建低产乙醇的基因工程菌等转基因技术在食品饮料中的使用有一定限制且会导致某些非目标性发酵产物的增加,会对葡萄酒质量产生不利影响[1-7]。
当前生产中多采用的酿酒酵母(Saccharomyces cerevisiae)能高效地把葡萄酒中的糖分转化为乙醇,在发酵相同的葡萄汁时,其乙醇体积分数大致相同[1,2,4]。因此,目前较为经济、简单、有效的方法是筛选出低产乙醇的酵母菌株,将碳的代谢路径转移到除乙醇外的其他产物上[1-4,6-10]。S. cerevisiae具有发酵快、产乙醇能力强、发酵性能稳定等特点,而大多数的非酿酒酵母不具备完全发酵的能力,产乙醇的能力较差。已有较多研究表明充分利用这两种菌株的特点,进行同时或顺序接种的混合发酵可有效降低乙醇含量[2-4,6-10]。表1总结了近年来采用非酿酒酵母与S. cerevisiae进行混合发酵在降醇方面的研究进展。可以看出,主要用于降醇的菌种有Metschnikowia pulcherrima和Starmerella bacillaris,乙醇体积分数一般降低0.9%~2.0%[3-4,6-10]。此外,非酿酒酵母不仅能产生大量的甘油、酯类等代谢物,而且具有能够分解香气前体物质的酶[2,11-12],在发酵初期参与发酵,可产生一些重要的次级代谢产物,可在一定程度上提高葡萄酒的风味复杂性,改善单一菌种发酵带来的不良影响[2,12]。
表1 非酿酒酵母与S. cerevisiae混合发酵用于生产低醇葡萄酒的研究进展总结
Table 1 Summary of recent studies on the mixed fermentation of non-S. cerevisiae and S. cerevisiae for the production of low alcohol wines

在前期研究中从新疆产区分离到一株非酿酒酵母,经鉴定为Candida humilis。初步研究发现,其具有高产甘油、低产乙醇的能力以及较高的硫耐受性(60 mg/L),具有较好的葡萄酒酿造潜力。另外,C. humilis被认为是一种公认安全的酵母[13],其与乳酸菌存在一定的营养关系,二者常作为天然发酵剂广泛应用于面包[14]、动物饲料、谷物等一些烘焙产品中。在分类学上,C. humilis与Kazachstania exigua同位于哈萨克斯坦种属Kazachstania的进化分支上,Vaughan等[15]将其归类于Kazachstania种属。
温度是影响酵母菌代谢重要的环境因素。研究发现,酵母菌生长的最适温度为20~30 ℃,较低的发酵温度会限制其代谢活动,延缓发酵进程[16]。低温可以增加酵母菌细胞膜流动性,提高细胞内中链脂肪酸(C4~C12)的含量,从而影响细胞膜中脂肪酸的代谢。葡萄酒中挥发性香气成分也会受到温度的影响,低温条件下通常能产生更多的酯类物质,挥发酸和杂醇物质的含量则减少[17-18]。
为探究C. humilis在葡萄酒发酵中是否还具有降低乙醇的能力,本实验在两种发酵温度(13 ℃和23 ℃)下研究C. humilis与S. cerevisiae以两种接种方式(同时接种和顺序接种)混合发酵对葡萄酒乙醇含量及香气物质合成的影响,以期为葡萄酒的降醇研究提供一种新的解决方法。
赤霞珠葡萄汁取自2015年河北沙城赤霞珠葡萄果实,还原糖210 g/L,可滴定酸(以酒石酸计)5.5 g/L,pH 3.35。
商业S. cerevisiae EC1118购于法国Lallemand Inc公司,于本实验室-80 ℃保存;C. humilis CVE20从新疆赤霞珠葡萄在(11±1)℃条件下自然发酵分离获得,并经26S rDNA(D1/D2)鉴定(同源性达到99%)。
YPD培养基:1.0%酵母浸提物,2.0%蛋白胨,2.0%葡萄糖;WLN培养基购于海博生物技术有限公司,具体成分如下:胰蛋白胨5.0 g/L,酵母浸粉4.0 g/L,葡萄糖50.0 g/L,磷酸二氢钾0.55 g/L,氯化钾0.425 g/L,氯化钙0.125 g/L,硫酸镁0.125 g/L,硫酸锰0.002 5 g/L,三氯化铁0.002 5 g/L,溴甲酚绿0.022 g/L,琼脂20.0 g/L。
1200系列LC高效液相色谱仪(含G1362A示差折光检测器和G1315D二极管阵列检测器)、6890N/5975BMS气相色谱-质谱联用仪(配置PAL-SPME自动进样器)美国Agilent公司。
1.3.1 发酵实验
将供试菌株接种于500 mL的YPD培养基(1.0%酵母浸提物,2.0%蛋白胨,2.0%葡萄糖)中进行活化,28 ℃、180 r/min摇床培养至对数期,4 ℃低温离心收集菌体,经无菌水洗涤后接入葡萄汁中。混合发酵实验中,非酿酒酵母和S. cerevisiae的接种比例为10∶1,即非酿酒酵母C. humilis接种量约为107CFU/mL,S. cerevisiae接种量约为106CFU/mL。采用两种不同的接种方式:同时接种C. humilis和S. cerevisiae;先接种C. humilis,48 h后再接入S. cerevisiae。单一接种106CFU/mL S. cerevisiae和接种107CFU/mL C. humilis的发酵实验作为对照。
发酵在250 mL摇瓶中密封进行,每瓶装有200 mL巴氏灭菌的葡萄汁,接供试菌株后以橡胶塞和立式发酵栓液封瓶口,分别在(13±1)℃和(23±1)℃下静置发酵,每组处理生物学重复3 次。采用二氧化碳失重法监测发酵进程,直至发酵结束(连续2 d的质量变化小于0.2 g/100 mL)。随后将样品低温(4 ℃)3 000 r/min离心20 min后弃除菌体,保留上清液于-20 ℃冻藏,用于香气化合物和其他代谢产物的测定。
1.3.2 酵母菌数量测定
葡萄酒发酵中酵母菌的种类及其数量变化会对葡萄酒的香气物质产生重要的影响[7]。研究发现利用WLN培养基的形态分类能够将不同酵母进行区分[19]。因此利用WLN培养基对两种酵母进行菌落计数来监测不同菌株数量的变化。
1.3.3 发酵主产物分析
发酵液过滤(PES,0.22 μm)后,采用高效液相色谱进行发酵主产物分析。检测参考Verwaal等[20]的方法,离子交换色谱柱HPX-87H Aminex ion-exchange column,流动相为5 mmol/L的H2SO4溶液,等度洗脱,流速0.6 mL/min。
葡萄糖、果糖、乙醇和甘油的测定使用示差折光检测器,进样量为20 μL,柱温45 ℃,分析时间30 min;有机酸(酒石酸、苹果酸、柠檬酸、乳酸、琥珀酸和乙酸)的测定采用二极管阵列检测器,进样量为10 μL,柱温60℃,分析时间30 min。
1.3.4 香气化合物的检测
利用本实验室已优化的顶空固相微萃取-气质联用技术的方法测定[21]。在顶空固相微萃取结合气相色谱-质谱联用仪上进行,选用50/30 μm DVB/CAR/PDMS fiber萃取。萃取前,萃取头270 ℃老化1 h。将5 mL发酵样品加入到15 mL样品瓶中,同时加入1 g NaCl、10 µL内标(4-甲基-2-戊醇)后迅速用带有聚四氟乙烯隔垫的样品瓶盖拧紧密封,在40 ℃恒温条件下,180 r/min平衡30 min,待瓶中的气-液相香气物质达到平衡后,将已活化或热解析过的聚二甲基硅氧烷/碳筛/二乙烯苯(PDMS/CAR/DVB)萃取头插入样品瓶的顶空部分,在40 ℃恒温下搅拌萃取30 min,使样品瓶中的香气物质达到气-固和气-液平衡。然后将萃取头插入GC-MS进样口,250℃热解析8 min,不分流进样。
气相色谱-质谱条件:采用配置PAL-SPME自动进样器的气相色谱-质谱联用仪,所用毛细管色谱柱为HP-INNOWAX(60 m×0.25 mm,0.25 μm),载气为高纯氦气(纯度99.999%),流速1 mL/min,自动进样。柱温箱升温程序:50 ℃保持1 min,以3 ℃/min速率升温至220℃,保持5 min,总运行时间62.67 min。质谱接口温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃,电离方式为电子电离源,离子源能量70 eV,质量扫描范围m/z 20~350。每个样品做2 个独立重复实验。
香气物质的定性和定量分析:利用质谱全离子扫描图谱,对于已有标准品的物质,依据本实验已建立的相同色谱条件下该化合物的保留时间、保留指数和质谱信息进行定性分析,制作其在模拟酒溶液中的标准曲线进行定量(合成酒溶液为2 g/L葡萄糖、7 g/L酒石酸和体积分数12%乙醇溶液,NaOH调pH值至3.3。将混合香气标准品配制成15 个梯度)。
采用SPSS 20.0(IBM公司)对乙醇发酵结束后的主产物以及挥发性香气成分进行单因素方差分析(ANOVA),P<0.05,差异显著,并对超过其阈值(>1)的香气成分进行主成分分析。
图1为两种酵母于WLN培养基在25 ℃培养2 d后的不同菌落形态图。
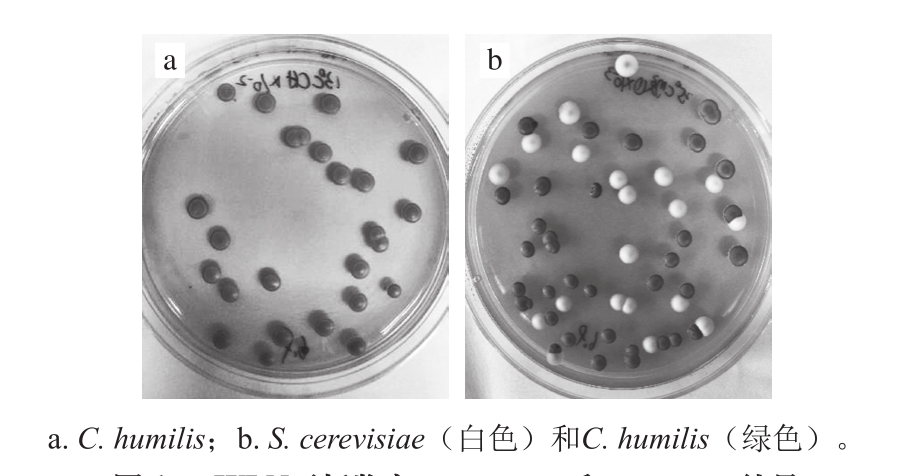
图1 WLN平板鉴定S. cerevisiae和C. humilis结果
Fig. 1 Identification of S. cerevisiae and C. humilis growing on WLN plates
如图2所示,两个温度发酵均有以下规律:C. humilis单独发酵组中CO2总产量最少,S. cerevisiae单独发酵组的CO2产量最多。顺序接种发酵组的总CO2产量低于同时接种发酵组的CO2产量。说明S. cerevisiae主导整个发酵过程,非酿酒酵母C. humilis存在的时间越长,发酵速率越慢。发酵温度也能够显著影响发酵进程。13 ℃发酵时CO2产量最大仅为12 g/200 mL左右,而23 ℃发酵时CO2总产量可达到20 g/200 mL左右,约为低温发酵条件下的2 倍。说明低温抑制了酵母菌的代谢活动,减缓了发酵进程,延长了乙醇发酵的时间。
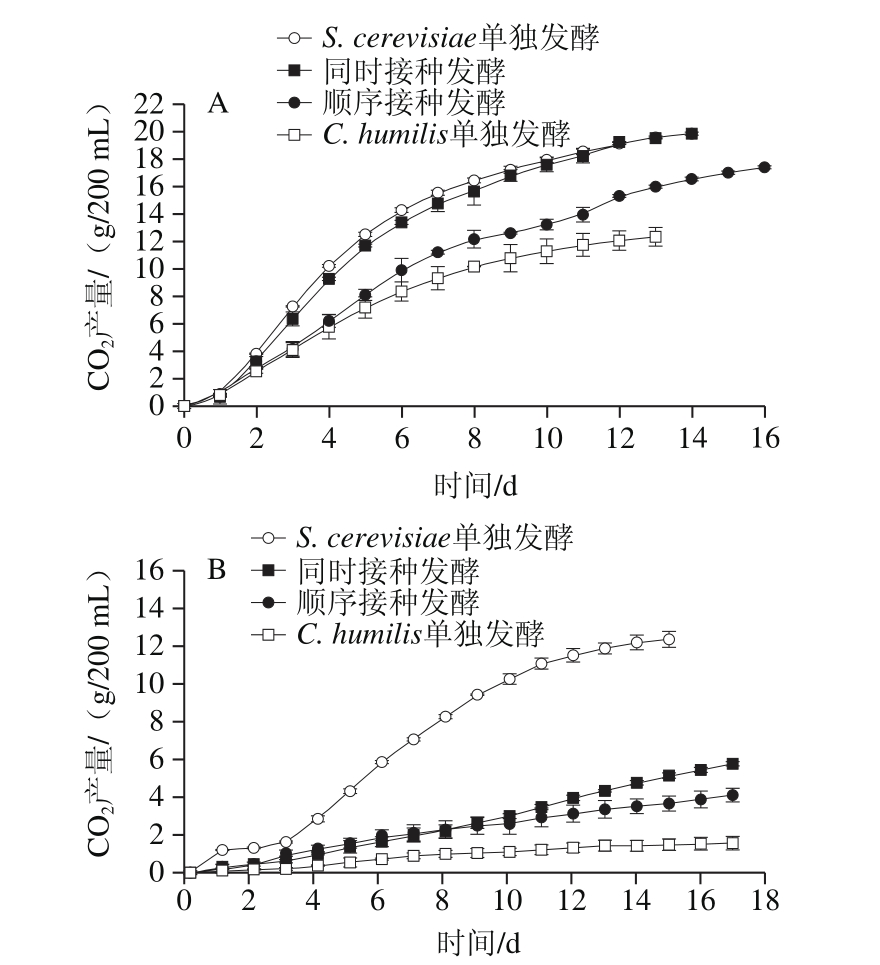
图2 23 ℃(A)和13 ℃(B)各发酵实验组的发酵动力学曲线
Fig. 2 Fermentation kinetics (CO2production) of the mixed and pure fermentations at 23 ℃ (A) and 13 ℃ (B)
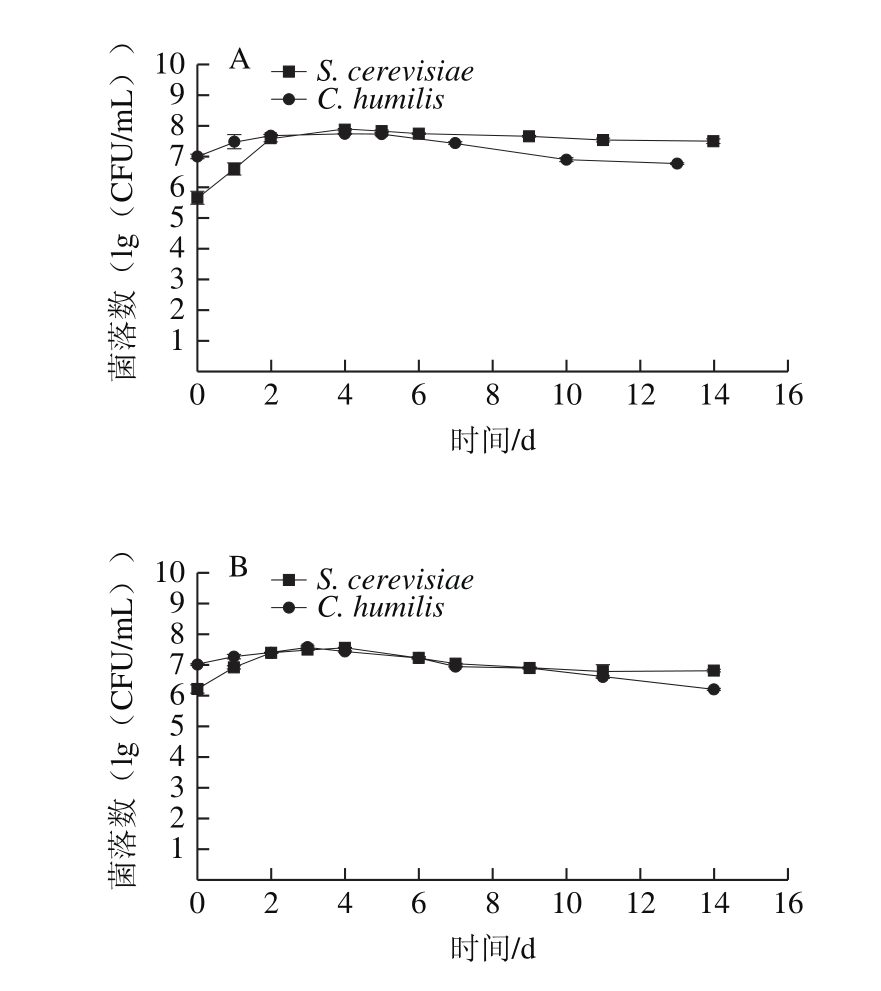
图3 23 ℃(A)和13 ℃(B)纯培养发酵S. cerevisiae和C. humilis的细胞生长变化曲线
Fig. 3 Growth kinetics of pure fermentation of S. cerevisiae and C. humilis at 23 (A) and 13 ℃ (B)
如图3所示,单独发酵中,23 ℃时,S. cerevisiae和C. humilis具有相似的生长状况,均在发酵的第4~5天达到最大数量,分别为7.76×107CFU/mL和5.50×107CFU/mL。随着发酵的进行,两种菌的数量始终维持在106~107CFU/mL左右。13 ℃时,S. cerevisiae在前期数量较为缓慢其后数量迅速增加,而C. humilis的生长速率一直较为缓慢,尽管其接种量约为S. cerevisiae的10 倍,但在发酵中后期,其数量明显低于S. cerevisiae。

图4 同时接种及顺序接种S. cerevisiae和C. humilis各自的细胞生长变化曲线
Fig. 4 Growth kinetics of mixed fermentation performed with S. cerevisiae and C. humilis at 23 and 13 ℃
如图4所示,同时接种中,在接入S. cerevisiae后,C. humilis的数量在达到其最大值3.09×107CFU/mL之后开始迅速减少,直至不能在WLN平板上检测到。相较之下,S. cerevisiae在达到其最大数量后一直以较为平稳的速度保持在较高的数量级(106~107CFU/mL)直至发酵结束。顺序接种中,C. humilis的数量在第2天达到其最大值4.88×107CFU/mL,由于S. cerevisiae迟于C. humilis 48 h接入葡萄汁,发酵前期基质中的氮源被C. humilis大量消耗,导致S. cerevisiae的生长受到抑制,其最大数量为6.03×107CFU/mL,远小于S. cerevisiae纯培养发酵。说明两种酵母之间存在明显的竞争关系。这与前人结果相一致,S. cerevisiae能更快、更有效地利用基质中的氮源[22],在混合发酵中显示出远优于非酿酒酵母的发酵能力。
表2 乙醇发酵结束时发酵主产物
Table 2 Primary fermentation products in wine at the end of alcoholic fermentation
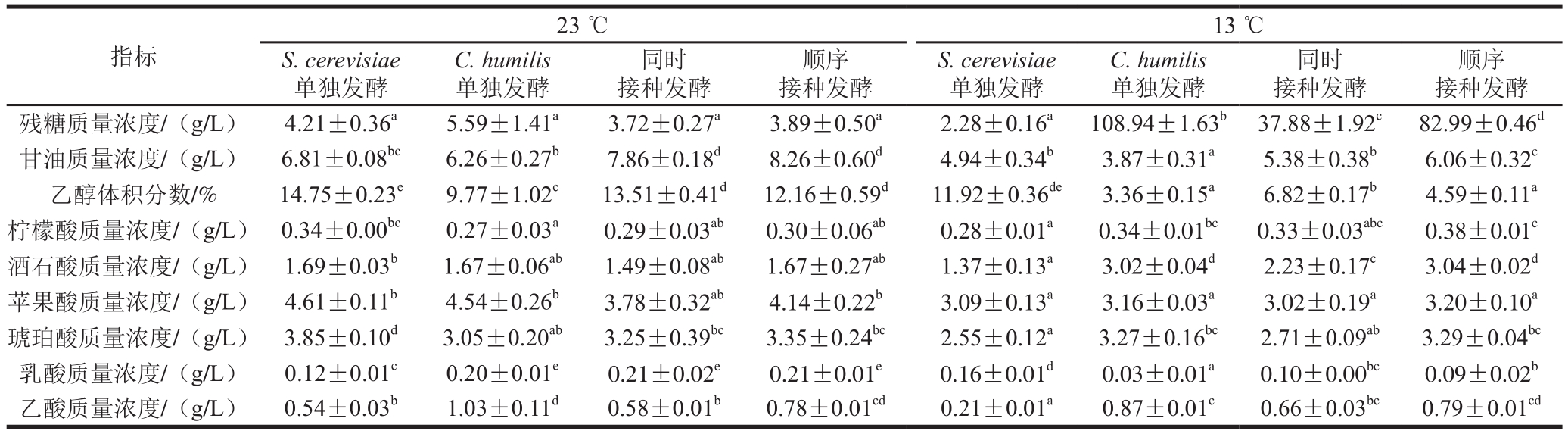
注:表中数据为 ±s:利用独立样本T检验进行显著性方差分析,同行肩标不同字母表示不同处理组之间差异显著(P<0.05)。下同。
混合发酵不仅会影响发酵进程,还会进一步影响葡萄汁发酵过程中产生的代谢产物的组成和含量。本实验测定了发酵结束后各发酵液中发酵主产物,包括乙醇、甘油和6 种重要的有机酸,结果如表2所示。
由表2可知,与S. cerevisiae单独发酵相比,23 ℃条件下,混合发酵时甘油含量明显增加,其中同时接种和顺序接种中分别增加了15.42%和21.29%,明显增加了葡萄酒的圆润感[12]。混合发酵时乙醇含量显著降低,同时接种和顺序接种时分别降低了约1.24%和2.59%,降醇程度达到了8.41%和17.56%。接种有C. humilis的处理中乙酸含量显著增加,虽仍在国标规定乙酸最高质量浓度1.2 g/L以内。但通常认为其在0.2~0.7 g/L左右较为适宜,在接近感觉阈值0.7~1.1 g/L时,会给葡萄酒带来一定的溶剂味和酸败感[12]。与S. cerevisiae单独发酵相比,其他3 个实验组的琥珀酸含量明显降低,乳酸含量显著增加,而各实验组的酒石酸、苹果酸和柠檬酸的含量并无显著差异。
低温13 ℃发酵时,C. humilis的代谢活动受到抑制,发酵并不完全,导致其残糖量较高,代谢物乙醇和甘油含量也相应减少。与S. cerevisiae单独发酵相比,甘油、乙醇和乙酸在混合发酵组中变化与23 ℃发酵相类似,它们的含量均有显著增加。柠檬酸、酒石酸和琥珀酸的含量也有所增加,但乳酸含量有所减少,苹果酸含量并无显著差异。
香气值(odour activity value,OAV)是用来评价葡萄酒挥发性组分对实际香气贡献大小所普遍采用的指标,每组挥发性组分的OAV是由该物质的含量除以其阈值得到的[23],其中OAV大于1的物质共16 种。发酵结束后共检测到28 种香气物质,包括4 种酸类、10 种乙酯类、4 种酯类、6 种高级醇类、2 种萜烯类物质以及2 种其他物质,见表3。
由表3可知,23 ℃时混合发酵实验组中酸类物质的总量较S. cerevisiae单独发酵显著下降,尤其是己酸、辛酸、癸酸等带有酸腐味的脂肪酸。2-苯乙酸的含量显著提高了79.17%,而C. humilis单独发酵时其含量并没有显著变化。但带有类似蜂蜜、丁香、玫瑰香气的2-苯乙酸的含量显著提高,而C. humilis单独发酵时2-苯乙酸的含量并没有明显的提高。因此可以认为:混合发酵时S. cerevisiae与C. humilis存在协同作用促进2-苯乙酸的生成,明显增加酒中的甜香味。
与S. cerevisiae单独发酵相比,虽然混合发酵中己酸乙酯、辛酸乙酯和癸酸乙酯的含量有所减少,但乙酯类物质的总量却有明显的提高,这主要是由于乙酸乙酯含量的显著增加,顺序发酵其含量增加了16.04%。高质量浓度的乙酸乙酯(>100~150 mg/L)会使葡萄酒具有溶剂味[3,12],本实验中该物质的含量在50 mg/L左右,可以增加酒中香气的复杂性。与S. cerevisiae单独发酵相比,C. humilis单独发酵能产生高质量浓度的丁酸乙酯(1.81 mg/L),约是S. cerevisiae单独发酵(0.43 mg/L)的4.2 倍。顺序接种发酵中其含量也有明显增加,约提高了2.77倍,为葡萄酒带来香蕉、菠萝等果香。混合发酵时乙酸苯乙酯的含量均超过了其阈值(0.25 mg/L),其含量增加了1.46倍,有类似玫瑰、丁香等花香。乙酸异戊酯等乙醇酯类物质的含量显著降低,酯类物质的总量并无显著差异。
混合发酵时明显减少的异戊醇是高级醇总量下降的主要原因。葡萄酒中高级醇质量浓度超过400 mg/L时,会带来强烈的刺鼻味,当其质量浓度低于300 mg/L时,可以增加香气复杂性[3,12]。实验中各处理组的高级醇质量浓度在100 mg/L左右,给酒带来愉悦的香气。虽然混合发酵中香气复杂性有所下降,但指甲油味等不良味感由于异戊醇含量的减少而明显下降。异丁醇含量有所增加,但并未达到其感觉阈值,不会增加生青味等不良味感。同时,β-苯乙醇的含量显著增加,顺序接种中增幅达到了23.9%。
萜烯物质的总量并未在不同组间表现出差异性。混合发酵中β-大马士酮的含量高于S. cerevisiae单独发酵,其中23 ℃顺序接种时增加18.74%。这种高产β-大马士酮的特性在低温下表现更为显著,13 ℃同时接种发酵其含量增加26.19%。在接种有C. humilis的发酵实验中,带有脂肪味的3-甲硫基丙醇含量明显减少。
13 ℃时,与S. cerevisiae单独发酵相比,混合发酵实验组中高级醇、酯类物质、乙酯类物质的总量以及酸类物质的含量均有所下降,萜烯物质的总量没有表现出显著差异性。13 ℃发酵时,S. cerevisiae单独发酵中β-苯乙醇、异戊醇的含量显著减少,而异丁醇的含量有所增加。
将葡萄酒中物质结构类似的挥发性香气组分归为一组,并计算该组的OAV总和,即可对样品的香气轮廓进行模拟,结果如图5所示。
由图5可知,采用不同的酵母菌株在不同温度下发酵获得的葡萄酒具有不同的香气特征。与单菌株发酵相比,23 ℃混合发酵时萜烯类物质无显著变化,酸类、高级醇类和其他酯类物质有所减少,但乙酯类物质的含量显著增加(图5a)。13 ℃混合发酵能显著增加萜烯类物质,酸类、酯类和高级醇类物质均有所减少(图5b)。
表3 发酵结束酒样中挥发性香气物质的含量、阈值及其香气描述
Table 3 Volatile aroma compounds, threshold and their odor descriptions in wines after alcoholic fermentation

注:其中编号C1~C16表示超过其阈值(OAV>1)的香气物质。
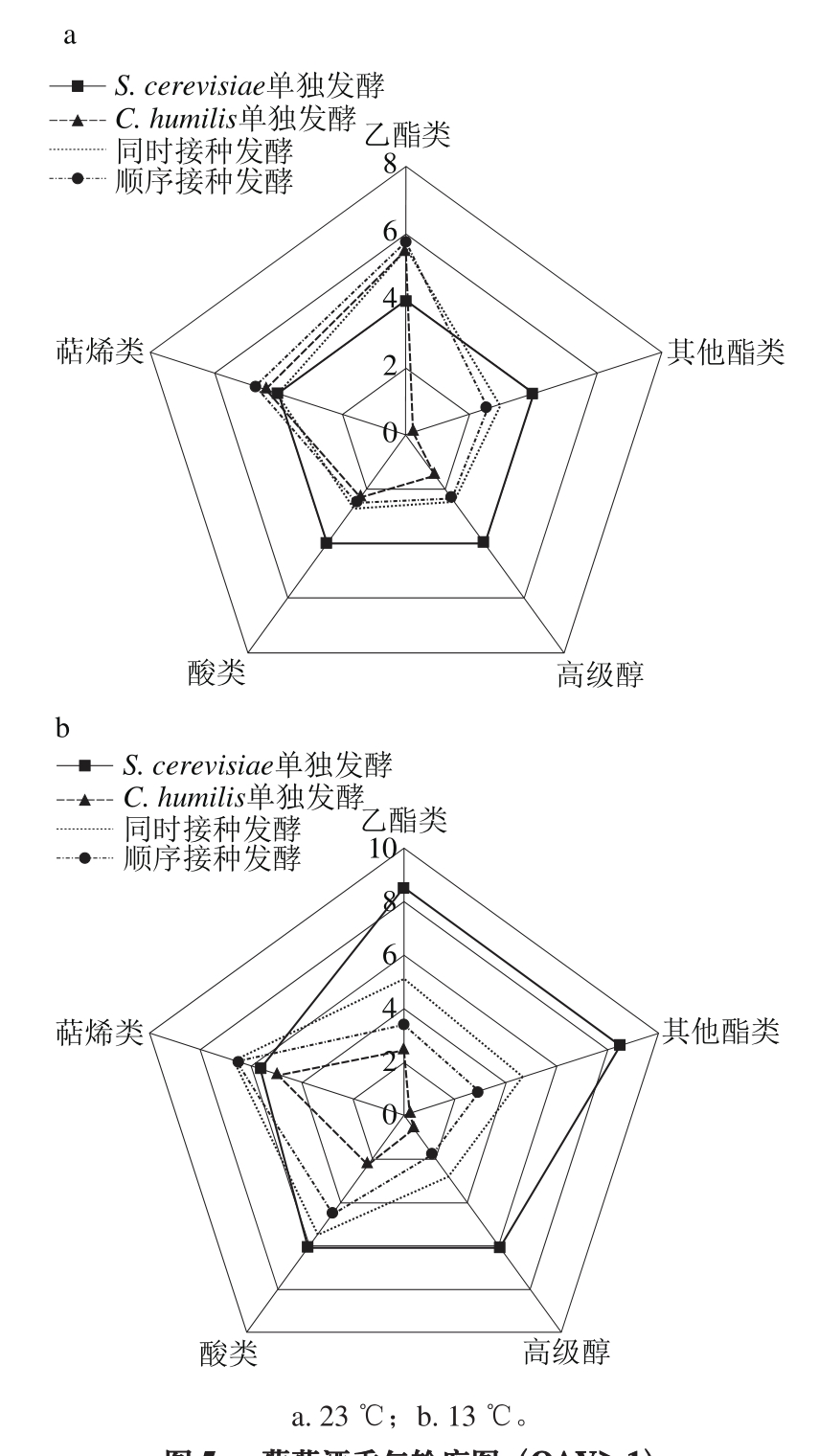
图5 葡萄酒香气轮廓图(OAV>1)
Fig. 5 Wine aroma profile (OAV > 1)
为更好地分析不同处理之间葡萄酒挥发性香气成分的差异,选取样品中OAV大于1的16 种香气成分进行主成分分析,结果如图6所示。
由图6可知,两个主成分(PC1和PC2)的总贡献率为82.4%,其中PC1的贡献率为50.1%,PC2的贡献率为32.3%。由于接种菌株的不同,S. cerevisiae和C. humilis单独发酵分别位于图的左右两边。而根据不同的发酵温度,该图又被大致分为上下两部分。其中,13 ℃的4 个发酵实验组主要位于PC2正方向上,23 ℃的4 个发酵实验组主要位于PC2负方向上。23 ℃时,同时接种和顺序接种两个混合发酵实验组距C. humilis单独发酵组较近。13 ℃时,两个混合发酵实验组与S. cerevisiae单独发酵组相距较近,说明23 ℃时C. humilis在混合发酵中对香气的影响更为显著,其特征香气为丁酸乙酯、乙酸苯乙酯和β-苯乙醇,这些化合物均有类似丁香、玫瑰花香以及蜂蜜果香,可以提高香气质量。低温下C. humilis代谢活动受到抑制,导致13 ℃混合发酵的呈香特征与S. cerevisiae单独发酵较为接近,而β-大马士酮、1-己醇、萜烯醇和癸酸乙酯等化合物可以较好地区分C. humilis和S. cerevisiae的发酵香气。
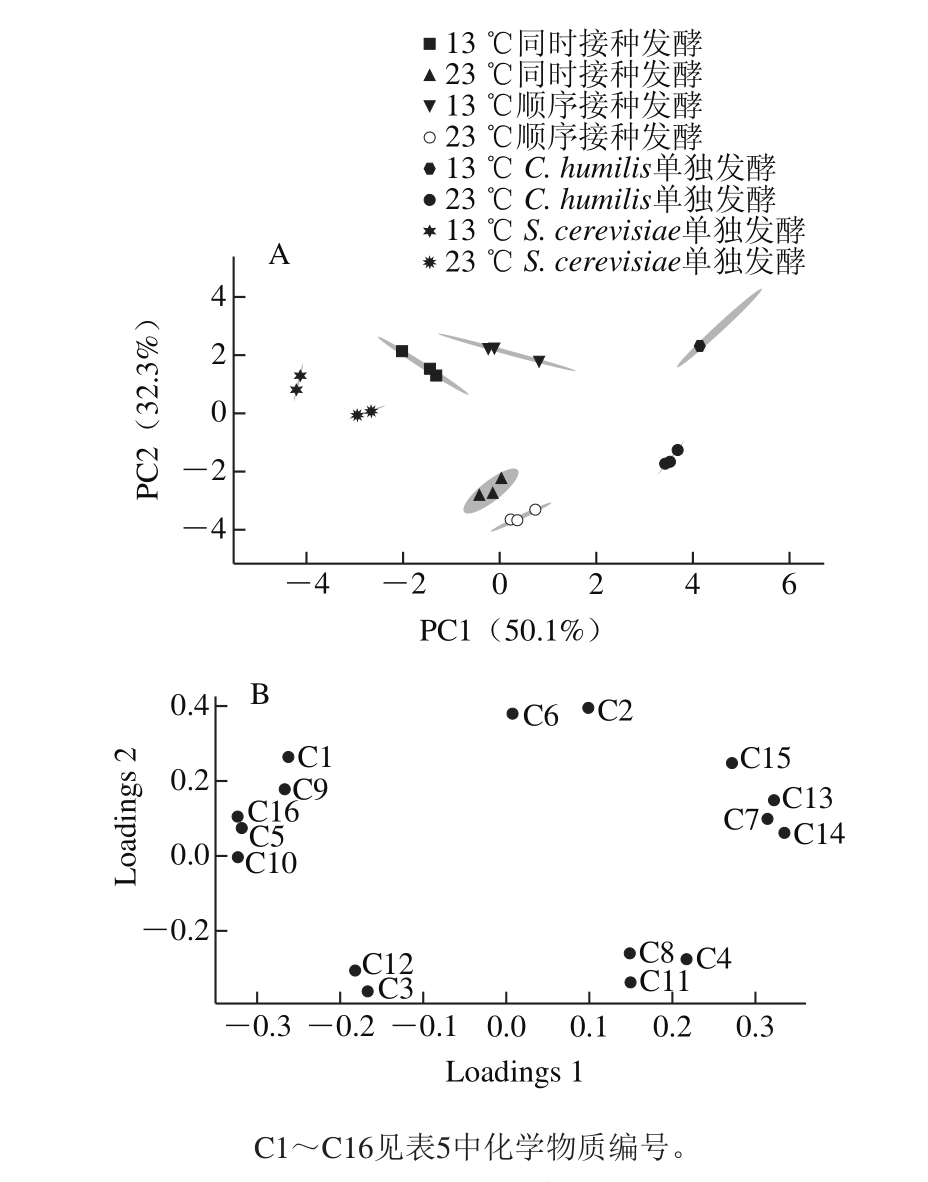
图6 发酵结束后酒样中OAV大于1部分香气化合物主成分分析得分图(A)和载荷图(B)
Fig. 6 Score and loading plots of principal component analysis(PCA) for aroma compounds (OAV > 1) in fi nal wines after alcoholic fermentation
利用不同菌株进行混合发酵是降低葡萄酒中乙醇含量的一种有效手段。Contreras等[6]采用M. pulcherrima 和S.cerevisiae以顺序接种的方式分别在霞多丽和西拉酒中进行混合发酵,乙醇体积分数分别降低了0.9%和1.6%。同年,Contreras等[7]又发现采用M. pulcherrima和S. uvarum两种菌株与S. cerevisiae混合发酵比任意接入一种非酿酒酵母与S. cerevisiae混合发酵的降醇程度都大,乙醇体积分数可降低1.7%~1.8%。本研究采用C. humilis与S. cerevisiae以两种接种方式(同时接种和顺序接种)进行混合发酵,研究对酒中乙醇含量及香气物质的影响。研究发现,同时接种和顺序接种发酵能分别降低乙醇体积分数约1.24%和2.59%。与S. cerevisiae单一菌株发酵相比,顺序接种的降醇幅度可以达到17.56%。Merico等[29]发现,Kazachstania种属菌株的代谢方式为产生—积累—消耗,当培养基质中葡萄糖殆尽时,乙醇作为碳源会被Kazachstania吸收代谢。这可能是发酵后乙醇含量较少的原因。另一方面,由于糖酵解途径向产物甘油方向的转移[4],甘油含量显著增加。本研究发现,同时接种和顺序接种发酵中甘油含量分别增加了15.42%和21.29%,这可能也是导致乙醇含量降低的原因。Vaudano等[30]发现K.exigua与S. cerevisiae进行混合发酵时产生了较多的乙酸,Kurtzman等[15]发现C. humilis用于酸面团发酵时产挥发酸极少,本研究发现接种C. humilis增加了乙酸含量,可能是不同的发酵基质及菌株差异导致这一差别。
除了降低乙醇含量,混合发酵还能够提高某种重要香气物质的含量。例如,采用S. uvarum与S. cerevisiae混合发酵得到的低醇葡萄酒中,β-苯乙醇和乙酸苯乙酯的含量与S. cerevisiae单独发酵相比,分别提高了2.46 倍和1.81 倍[4]。采用M. pulcherrima 和S. cerevisiae 得到的低醇葡萄酒中,其乙酯类物质和乙酸乙酯的含量明显增加[8]。本研究发现,使用S. cerevisiae和C. humilis进行混合发酵,β-苯乙醇和乙酸苯乙酯的含量分别增加了23.9%和1.46倍。此外,顺序接种发酵中乙酯类物质的总量增加了18.30%,其中丁酸乙酯的含量提高了2.77倍。这些物质通常被描述为具有花香(类似蜂蜜、玫瑰和紫丁香)和果香(香蕉、菠萝),可以显著提高葡萄酒的香气质量。单萜和降异戊二烯可以赋予葡萄酒特殊的品种香气,对葡萄酒的品质有重要的贡献[31]。本研究发现,混合发酵组中β-大马士酮的含量显著增加,低温条件其增幅更显著:13 ℃同时接种发酵其含量增加26.19%,为葡萄酒带来类似紫罗兰的香气。
从整体上来看,采用C. humilis与S. cerevisiae混合发酵可以显著降低葡萄酒中乙醇含量,不会降低葡萄酒的香气品质。目前还鲜有相关的研究报道,本研究结果可以为葡萄酒的降醇提供一种新的方法。由于该菌株还具有较高的耐硫特性,因此也具有较好的工业应用前景。在后续工作中,可以通过优化发酵条件(如改变C. humilis的接种浓度、时间以及与S. cerevisiae的接种比例)来继续提高该菌的酿造品质(如继续提高酯类物质以及甘油的含量,降低乙酸的浓度),以满足实际生产的需要。
参考文献:
[1] KUTYNA D R, VARELA C, HENSCHKE P A, et al. Microbiological approaches to lowering ethanol concentration in wine[J]. Trends in Food Science and Technology, 2010, 21(6): 293-302. DOI:10.1016/j.tifs.2010.03.004.
[2] CIANI M, MORALES P, COMITINI F, et al. Non-conventional yeast species for lowering ethanol content of wines[J]. Front Microbiology,2016, 7: 642. DOI:10.3389/fmicb.2016.00642.
[3] VARELA C. The impact of non-Saccharomyces yeasts in the production of alcoholic beverages[J]. Applied Microbiology Biotechnology, 2016,100(23): 9861-9874. DOI:10.1007/s00253-016-7941-6.
[4] VARELA C, SENGLER F, SOLOMON M, et al. Volatile flavour profile of reduced alcohol wines fermented with the non-conventional yeast species Metschnikowia pulcherrima and Saccharomyces uvarum[J]. Food Chemistry, 2016, 209: 57-64. DOI:10.1016/j.foodchem.2016.04.024.
[5] 刘伟, 李剑, 高年发. 低醇葡萄酒的初步研究[J]. 酿酒, 2001, 28(6):98-101.
[6] CONTRERAS A, HIDALGO C, SCHMIDT S, et al. The application of non-Saccharomyces yeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content[J].International Journal of Food Microbiology, 2015, 205: 7-15.DOI:10.1016/j.ijfoodmicro.2015.03.027.
[7] CONTRERAS A, CURTIN C, VARELA C. Yeast population dynamics reveal a potential ‘collaboration’between Metschnikowia pulcherrima and Saccharomyces uvarum for the production of reduced alcohol wines during Shiraz fermentation[J]. Applied Microbiology and Biotechnology,2015, 99(4): 1885-1895. DOI:10.1007/s00253-014-6193-6.
[8] VARELA C, BARKER A, TRAN T, et al. Sensory profile and volatile aroma composition of reduced alcohol Merlot wines fermented with Metschnikowia pulcherrima and Saccharomyces uvarum[J].International Journal of Food Microbiology, 2017, 252(1): 1-9.DOI:10.1016/j.ijfoodmicro.2017.04.002.
[9] CONTRERAS A, HIDALGO C, HENSCHKE P A, et al. Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J]. Applied and Environmental Microbiology, 2014, 80(5): 1670-1678. DOI:10.1128/AEM.03780-13.
[10] CANONICO L, COMITINI F, ORO L, et al. Sequential fermentation with selected immobilized non-Saccharomyces yeast for reduction of ethanol content in wine[J]. Frontiers in Microbiology, 2016, 7: 1-11.DOI:10.3389/fmicb.2016.00278.
[11] ROSSOUW D, BAUER F. Exploring the phenotypic space of non-Saccharomyces wine yeast biodiversity[J]. Food Microbiology, 2016,55: 32-46. DOI:10.1016/j.fm.2015.11.017.
[12] JOLLY N P, VARELA C, PRETORIUS I S. Not your ordinary yeast:non-Saccharomyces yeasts in wine production uncovered[J]. FEMS Yeast Research, 2014, 14(2): 215-237. DOI:10.1111/1567-1364.12111.
[13] DE V L, HARTH H, VAN K S, et al. Yeast diversity of sourdoughs and associated metabolic properties and functionalities[J]. International Journal of Food Microbiology, 2016, 239: 26-34. DOI:10.1016/j.ijfoodmicro.2016.07.018.
[14] GULLO M, ROMANO A D, PULVIRENTI A, et al. Candida humilis—dominant species in sourdoughs for the production of durum wheat bran fl our bread[J]. International Journal of Food Microbiology,2003, 80(1): 55-59. DOI:10.1016/S0168-1605(02)00121-6.
[15] VAUGHAN-MARTINI A, LACHANCE M-A, KURTZMAN C P.Kazachstania Zubkova (1971)[M]//The Yeasts(Fifth Edition). 2010:439-470. DOI:10.1016/B978-0-444-52149-1.00034-3.
[16] TORIJA M J, BELTRAN G, NOVO M, et al. Effects of fermentation temperature and Saccharomyces species on the cell fatty acid composition and presence of volatile compounds in wine[J].International Journal of Food Microbiology, 2003, 85(1/2): 127-136.DOI:10.1016/S0168-1605(02)00506-8.
[17] BELTRAN G, NOVO M, GUILLAMON J M, et al. Effect of fermentation temperature and culture media on the yeast lipid composition and wine volatile compounds[J]. International Journal of Food Microbiology, 2008, 121(2): 169-177. DOI:10.1016/j.ijfoodmicro.2007.11.030.
[18] TRONCHONI J, ROZES N, QUEROL A, et al. Lipid composition of wine strains of Saccharomyces kudriavzevii and Saccharomyces cerevisiae grown at low temperature[J]. International Journal of Food Microbiology, 2012, 155(3): 191-198. DOI:10.1016/j.ijfoodmicro.2012.02.004.
[19] PALLMANN C L, BROWN J A, OLINEKA T L, et al. Use of WL medium to profile native fl ora fermentations[J]. American Journal of Enology and Viticulture, 2001, 52(3): 198-203. DOI:10.1016/S0065-2164(01)49013-7.
[20] VERWAAL R, JIANG Y, WANG J, et al. Heterologous carotenoid production in Saccharomyces cerevisiae induces the pleiotropic drug resistance stress response[J]. Yeast, 2010, 27(12): 983-998.DOI:10.1002/yea.1807.
[21] LAN Y B, QIAN X, YANG Z J, et al. Striking changes in volatile profiles at sub-zero temperatures during over-ripening of ‘Beibinghong’grapes in Northeastern China[J]. Food Chemistry, 2016, 212: 172-182.DOI:10.1016/j.foodchem.2016.05.143.
[22] LIU J, ARNEBORG N, TOLDAM-ANDERSEN T B, et al. Effect of sequential fermentations and grape cultivars on volatile compounds and sensory profiles of Danish wines[J]. Journal Science of Food and Agriculture, 2017, 97(11). DOI:10.1002/jsfa.8218.
[23] GUTH H. Quantitation and sensory studies of character impact odorants of different white wine varieties[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 3027-3022. DOI:10.1021/jf970280a.
[24] NOGUEROL-PATO R, GONZALEZ-ALVAREZ M, GONZALEZBARREIRO C, et al. Aroma profile of Garnacha Tintorera-based sweet wines by chromatographic and sensorial analyses[J]. Food Chemistry,2012, 134(4): 2313-2325. DOI:10.1016/j.foodchem.2012.03.105.
[25] JIANG B, ZHANG Z. Volatile compounds of young wines from cabernet sauvignon, cabernet gernischet and chardonnay varieties grown in the loess plateau region of China[J]. Molecules, 2010,15(12): 9184-9196. DOI:10.3390/molecules15129184.
[26] SÁNCHEZPALOMO E, GARCÍACARPINTERO E G,ALONSOVILLEGAS R, et al. Characterization of aroma compounds of Verdejo white wines from the La Mancha region by odour activity values[J]. Flavour & Fragrance Journal, 2010, 25(6): 456-462.DOI:10.1002/ffj.2005.
[27] TAO Y, ZHANG L. Intensity prediction of typical aroma characters of Cabernet Sauvignon wine in Changli County (China)[J]. LWT-Food Science and Technology, 2010, 43(10): 1550-1556. DOI:10.1016/j.lwt.2010.06.003.
[28] SMYTH H E. The compositional basis of the aroma of Riesling and unwooded Chardonnay wine[D]. Adelaide: The University of Adelaide, 2005: 58-69.
[29] MERICO A, SULO P, PISKUR J, et al. Fermentative lifestyle in yeasts belonging to the Saccharomyces complex[J]. FEBS Journal,2007, 274(4): 976-989. DOI:10.1111/j.1742-4658.2007.05645.x.
[30] VAUDANO E, BERTOLONE E, PETROZZIELLO M. Exploring the possibility of using Kazachstania exigua (ex. Saccharomyces exiguus)in wine production[M]//Industrial, medical, and environmental applications of microorganisms. 2014: 304-309.
[31] WEN Y Q, HE F, ZHU B Q, et al. Free and glycosidically bound aroma compounds in cherry (Prunus avium L.)[J]. Food Chemistry,2014, 152: 29-36. DOI:10.1016/j.foodchem.2013.11.092.
Effects of Mixed Fermentation of Candida humilis and Saccharomyces cerevisiae on Ethanol Content and Aroma of Wine
YOU Ya, DUAN Changqing, YAN Guoliang*
(Key Laboratory of Viticulture and Enology, Ministry of Agriculture, College of Food Science and Nutritional Engineering,China Agricultural University, Beijing 100083, China)
Abstract:In order to reduce the ethanol content in wine, mixed-culture wine fermentations with Candida humilis and Saccharomyces cerevisiae were carried out using different inoculation methods (simultaneous inoculation and sequential inoculation) at two temperatures (13 and 23 ℃). The results showed that compared with the pure S. cerevisiae fermentation,the co-inoculation and sequential inoculation of S. cerevisiae with C. humilis could significantly enhance glycerol content and reduce ethanol yield during fermentation at 23 ℃, especially the sequential inoculation, which exhibited a 17.56%reduction (i.e., from (14.75 ± 0.23)% to (12.16 ± 0.59)%) in ethanol concentration (V/V) compared to the pure culture of S. cerevisiae. The co-fermentation generated more esters than the single strain fermentation, and especially the sequential inoculation increased the concentrations of total ethyl esters and ethyl acetate by 18.30% and 16.03%, respectively and ethyl butyrate concentration by 2.77 folds and significantly enhanced the fl oral and fruity aroma. As for fermentation at 13 ℃,the co-fermentation showed an increasing concentration of β-damascenone, and increased β-damascenone concentration by 26.19% with the simultaneous inoculation compared with the control. These results indicated that C. humilis had potential application for producing reduced alcohol wine when used in mixed fermentation with S. cerevisiae, which could provide a new tool for reducing alcohol level in wine production.
Keywords:Candida humilis; Saccharomyces cerevisiae; mixed fermentation; temperature; wine aroma
YOU Ya, DUAN Changqing, YAN Guoliang. Effects of mixed fermentation of Candida humilis and Saccharomyces cerevisiae on ethanol content and aroma of wine[J]. Food Science, 2018, 39(20): 146-154. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201820022. http://www.spkx.net.cn
引文格式:尤雅, 段长青, 燕国梁. 扁平云假丝酵母与酿酒酵母混合发酵对葡萄酒乙醇含量及香气的影响[J]. 食品科学, 2018,39(20): 146-154. DOI:10.7506/spkx1002-6630-201820022. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0146-09
文献标志码:A
中图分类号:TS261.1
DOI:10.7506/spkx1002-6630-201820022
*通信作者简介:燕国梁(1976—),男,副教授,博士,研究方向为酿酒酵母分子生物学。E-mail:glyan@cau.edu.cn
第一作者简介:尤雅(1994—),女,硕士研究生,研究方向为食品生物技术。E-mail:17801135734@163.com
基金项目:现代农业产业技术体系建设专项(CARS-29);中央高校基本科研业务费专项(2017SP003)
收稿日期:2017-08-26