崔益玮1,俞喜娜1,李诗言2,王 扬2,戴志远1,张燕平1,陈 康1,沈 清1,*
(1.浙江省水产品加工技术研究联合重点实验室,浙江工商大学海洋食品研究院,浙江 杭州 310012;2.浙江省水产质量检测中心,浙江 杭州 310023)
摘 要:研究虾头中磷脂的提取制备方法,并分别利用气相色谱法和多维度串联质谱法对样品磷脂的脂肪酸链结构进行脂质组学分析。利用乙醇浸提法制备得到虾头中的磷脂,并从乙醇体积分数、提取温度和提取时间3 个因素对提取方法进行优化,得到较优条件为乙醇体积分数90%、提取温度50 ℃、提取时间30 min,磷脂的提取效果最佳,实际提取量可达到(11.58±0.03)mg/g,与优化前相比提高了83.8%。磷脂样品经甲酯化反应后用气相色谱法分析其脂肪酸链组成,并用高效液相色谱-质谱联用技术经负离子全扫描对磷脂分子实现分离鉴定和定量分析。结果显示,磷脂的脂肪酸链中主要含有棕榈酸链、亚油酸链、二十碳五烯酸和硬脂酸链等23 种脂肪酸链,其中单不饱和脂肪酸链占9.51%,多不饱和脂肪酸链占35.33%;磷脂样品中共检出磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇和磷脂酰丝氨酸4 类共28 种磷脂分子,该提取方法所得各种类磷脂的脂肪酸链中存在许多不饱和度较高的脂肪酸链,如40∶8、36∶7、38∶7、O-40∶7、40∶7、34∶6、O-36∶6、36∶6、O-38∶6、38∶6、40∶6等。虾头中磷脂含量丰富,其脂肪酸链不饱和度较高,因此具有较高的开发利用价值。
关键词:虾头;副产物;磷脂;脂质组学;质谱
我国虾类资源十分丰富,但在加工过程中,虾头常因口感坚硬而作为加工废物处理或仅用于生产饲料[1]。这些不被用于食品加工的虾头、壳等可占到虾体总质量的30%~40%[2],据报道,我国仅广东省湛江市每年虾加工下脚料就达到了3万 t[3]。研究显示,虾头中含有的蛋白质、不饱和脂肪酸、虾红素及必需微量元素等物质均对人体健康有重要作用[4-6]。因此,对于虾头的研究不仅可以充分利用其中的营养物质、扩大其经济价值,还可以减少资源浪费、降低环境压力[7]。
虾头中含有丰富的磷脂。磷脂广泛存在于包括细菌、动植物等各种生物体内[8]。它是维持细胞结构的重要组成部分[9],也是新陈代谢不可或缺的营养元素[10]。实验证明,磷脂可以活化细胞,维持代谢与荷尔蒙分泌均衡,分解血脂、胆固醇,阻止多余脂肪在血管壁沉积,改善受损的胰岛B细胞及周围的组织结构[11-14]。
脂质组学研究内容包括生物体内脂质分子的结构鉴定与定量,及其在生物代谢、疾病、免疫等所扮演的角色分析[15-16]。随着软电离离子化技术和高分辨质谱技术的发展及其在脂质分析中的应用,已经实现了对生物样品中各种微量脂质进行快速、高精度的分析检测,极大地促进了规模性、整体性的脂质分析[17]。目前,脂质组学研究已成为一个前景广阔的热门领域,但其在食品科学领域的研究则相对较少[18-19]。因此,开展虾头脂质组学研究为海洋食品研究与开发提供了一个崭新的视角。
目前,最常使用的磷脂提取方法为Folch法和Bligh &Dyer法[20]。边晶晶等[21]利用Folch法提取虾头中的磷脂;卢航等[22]利用Folch法提取鮰鱼脑中的磷脂;陈康等[23]利用超声辅助Bligh & Dyer脂质提取法提取南极磷虾中磷脂;邹舟等[24]利用Bligh & Dyer法提取鲢(Hypophthalmichthys molitrix)各组织部位中的磷脂。除此之外,Shen Qing等[7]通过二氧化钛包覆二氧化硅(TiO2/SiO2)核壳复合材料作为吸附剂,采用固相萃取法提取虾副产物中的磷脂。然而这些方法或使用毒性较强的试剂作为溶剂,或方法过于繁琐而不适用于食品工业。乙醇提取法因其提取剂乙醇毒性小、易挥发、可回收反复使用而被广泛应用于食品、药品工业中[25-27]。刘大川等[28]利用乙醇浸提法提取紫苏压榨饼中的油脂;Ristíc等[29]利用乙醇浸提法提取橙花糙苏(Phlomis fruticosa L.)中的活性物质,并检测其对于人类、动植物病原体以及引起食物中毒的细菌和真菌的抑菌效果。Lei Lin等[30]通过硅胶柱层析,完全采用乙醇法从母鸡蛋黄中分离提取磷脂。
本研究建立并优化乙醇浸提法提取虾头中的磷脂,并通过组学技术对磷脂分子种类及脂肪酸链结构进行脂质组学分析。目的在于探索适用于虾头加工业的食品级磷脂提取方法,从分子结构揭示虾头磷脂营养,为磷脂提取提供新思路的同时达到资源的充分利用。
虾头样品购于杭州物美超市,经鉴定虾种为中国明对虾(Fenneropenaeus chinensis);虾头去壳取内容物于4 ℃冷藏备用。
甲酸(色谱纯) 美国Tedia公司;乙腈(质谱级)德国Merck公司;磷脂酰胆碱(phosphatidyl choline,PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)、磷脂酰肌醇(phosphatidyl inositol,PI)、磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂标准品(纯度≥99.9%) 美国Avanti公司;乙醇(分析纯)中国西陇化工股份有限公司;超纯水系统(电阻率18.2 MΩ·cm) 美国Milli-Q公司。
涡旋混匀器 北京金紫光公司;AL204电子天平梅特勒-托利多仪器(上海)有限公司;落地式高速冷冻离心机 美国Thermo公司;Acquity高效液相色谱仪美国Waters公司;4000QTRAP串联四极杆质谱(配电喷雾离子源) 美国AB Sciex公司;离心管等耗材杭州常盛科教器具厂。
1.3.1 虾头磷脂提取
将虾头组织匀浆后精确称量100.00 g样品于500 mL离心管中,加入250 mL 70%乙醇溶液后振荡混匀,在20 ℃的恒温水浴锅中浸提10 min。混合物用冷冻离心机以9 000 r/min离心10 min,离心后用移液管将上清液转移到圆底烧瓶内,在下层组织样品中再次加入150 mL 70%乙醇溶液二次萃取,并重复2次。合并3次提取所得上清液,并用旋转蒸发仪于65 ℃将有机溶剂蒸干得到虾油浓缩液,冷却后向其中加入提前预冷过的500 mL丙酮,振荡萃取后移入1 000 mL离心瓶中,以8 000 r/min离心6 min,转移溶液后将磷脂沉淀物蒸干并称质量。取磷脂样品用乙腈复溶后用于液相色谱和质谱分析。磷脂提取量按下式进行计算:
1.3.2 磷脂提取条件优化
在其余提取条件均不变的前提下,将虾头组织分为3 组。第1组样品分别以乙醇体积分数70%、80%、85%、90%、95%、100%进行提取;第2组样品分别在20、30、40、50、60 ℃的恒温水浴锅中浸提;第3组样品在恒温水浴锅中的提取时间分别设置为10、20、30、40、50、60 min,对上述样品对比最终磷脂提取量。由此优化得到各单因素最佳提取条件。
根据Box-Behnken设计原理,分别选取乙醇体积分数、提取温度、提取时间3 个单因素最佳值及其前后相邻值作为试验因素,并选取磷脂提取量作为响应值,进行响应面优化设计,得到磷脂提取最优条件。试验设计因素与水平见表1。
表1 响应面试验因素与水平
Table 1 Factors and levels used in response surface methodology (RSM)

1.3.3 样品甲酯化
将0.1 g磷脂与2 mL的NaOH-甲醇溶液(0.5 mol/L)混合后振荡摇匀,在65 ℃的水浴锅中加热30 min,取出后冷却至室温,在加入2 mL的BF3-甲醇溶液,振荡混匀,在65 ℃水浴锅中继续加热3 min,取出并自然冷却后加入2 mL正己烷提取,同时加入2 mL饱和NaCl溶液水洗,取出上清液后在其中加入1/10体积无水硫酸钠,取上清液用于气相色谱分析。
1.3.4 气相色谱条件
色谱柱:HP-88毛细管色谱柱(30 m×0.25 mm,0.2 μm);载气:高纯氮气;恒流:0.65 mL/min;进样量:1 μL;分流比:40∶1;进样口温度:250 ℃;升温程序:初始温度50 ℃,保持2 min,以4 ℃/min升至220 ℃维持15 min。
1.3.5 高效液相色谱条件
色谱柱:YMC Triart二醇基HILIC柱(4.6 mm×250 mm,3 μm);流动相A:含有53 mmol/L甲酸的乙腈溶液(pH 4.0~4.5);流动相B:含有60 mmol/L甲酸铵和53 mmol/L甲酸的溶液(pH 3.6);流动相流速:200 μL/min。进样量:10 μL;梯度洗脱程序:0~15 min,2% A;15~60 min,2%~40% A;60~70 min,40% A;70~80 min,40%~2% A。
1.3.6 质谱条件
负离子模式检测;扫描范围:500~1 000 Da;去簇电压1:50 V;聚焦电势:200 V;离子源电压:4 500 V;去簇电压2:10 V;气源1:50 psi;气源2:45 psi;气帘气:40 psi;脱溶剂温度:450 ℃;子离子扫描碰撞能:20 V。
数据采集与分析采用美国AB Sciex公司Analyst QS v2.0软件。磷脂提取中对于实验所得的6 组平行数据用Excel进行标准差分析,并用Origin软件作图。响应面优化设计中利用Design-Expert 8.0软件对实验数据进行回归分析和响应面绘制。高效液相色谱及质谱分析中均使用归一化法进行定量分析。
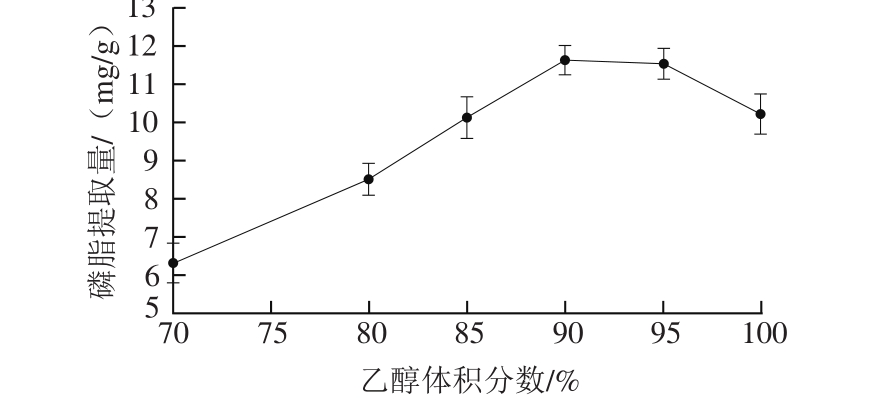
图1 乙醇体积分数对虾头磷脂提取的影响
Fig. 1 Effect of ethanol concentration on the extraction of phospholipids from shrimp heads
由图1可知,当乙醇体积分数由70%提高到90%时,虾头副产物中磷脂提取量随着乙醇体积分数增大而增加,其原因可能是溶剂的极性与磷脂性质趋于相似,进而提高了磷脂在溶剂中的溶解度。随后虾头副产物中磷脂的提取量略有下降,当使用纯乙醇时,磷脂的提取量下降显著。因此,兼考虑提取效率与经济性,萃取溶剂为90%乙醇溶液是该因素的最优条件。
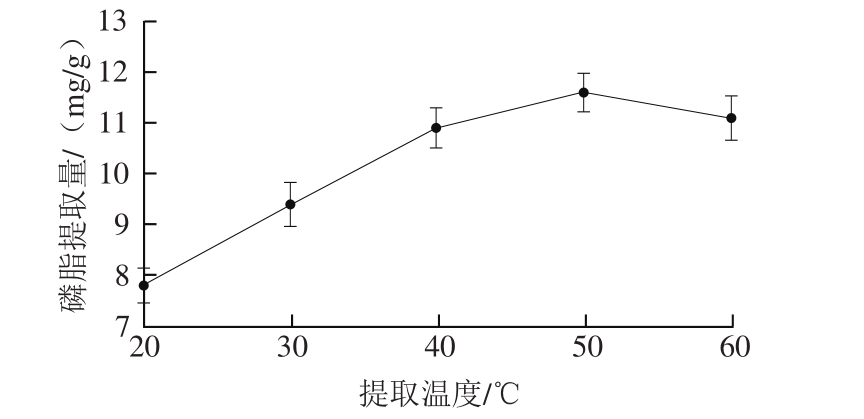
图2 提取温度对虾头磷脂提取的影响
Fig. 2 Effect of temperature on the extraction of phospholipids from shrimp heads
提取过程是固相液相之间的扩散过程,提取效率极易受温度的影响。由图2可见,虾头副产物中磷脂的提取量自20 ℃开始随着温度的升高而逐渐增加,50 ℃时提取量达到最大,升高温度能提高分子的动能和扩散速率,促进溶剂渗入细胞组织间隙。当继续升温时提取量反而呈现下降趋势,原因可能是过高的温度会导致料液间出现气化层,阻碍了分子运动,另一方面,磷脂溶于乙醇属于放热反应,其溶解度随着温度升高有所降低。在工业化生产应用中,虾头副产物中磷脂的提取必须保持在一定的温度范围(45~50 ℃),使用温控系统创造适宜和稳定的温度环境。
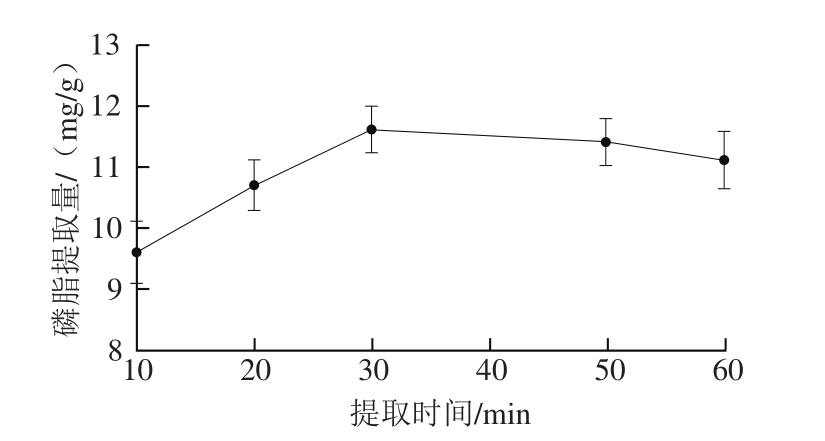
图3 提取时间对虾头磷脂提取的影响
Fig. 3 Effect of extraction time on the extraction of phospholipids from shrimp heads
由图3可以看出,虾头副产物中磷脂的提取量随着时间的延长而增大,将静置时间从10 min延长至30 min磷脂提取量逐渐提高,随后趋于平衡并略有下降。通常提取时间越长,磷脂溶出越充分,但时间过长易导致磷脂被磷脂酶分解以及磷脂氧化降解。实践中考虑到效率问题,选用30 min提取时间有利于达到最经济的效果。
表2 响应面试验设计与结果
Table 2 Experimental design and results for response surface analysis
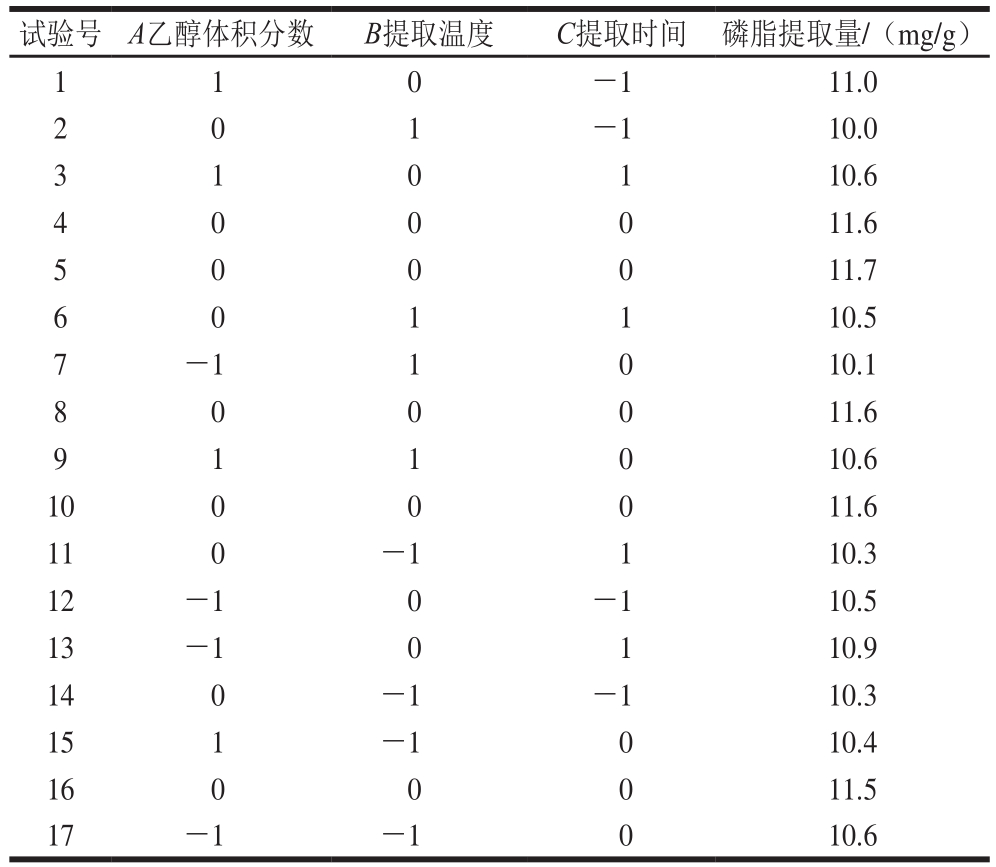
利用Design-Expert 8.0软件对表2试验数据进行回归分析,得到相应的二次响应面回归方程:Y=11.60+0.063A-0.050B+0.063C+0.17AB-0.20AC+0.13BC-0.35A2-0.83B2-0.50C2。
以磷脂提取量为响应值进行二次多元回归拟合,对回归方程模型各项系数进行方差分析,分析结果见表3。由表3可知,模型P值小于0.000 1,回归模型极显著(P<0.01)。失拟项P值为0.198 5大于0.05,不显著。此方程R2值为0.983 9,即响应值的变化有98.39%与所选变量有关,说明该回归方程与实际数据拟合度较高。此二次模型成立,该模型可以有效拟合3 个因素与磷脂提取量。可以看出乙醇体积分数和提取时间对磷脂提取量影响显著,并且3 个因素的交互影响均显著,说明3 个因素之间的交互作用可以显著地影响磷脂提取量。
表3 回归方程参数方差分析
Table 3 Analysis of variance for regression model
注:*.差异显著,P<0.05;**.差异极显著,P<0.01。
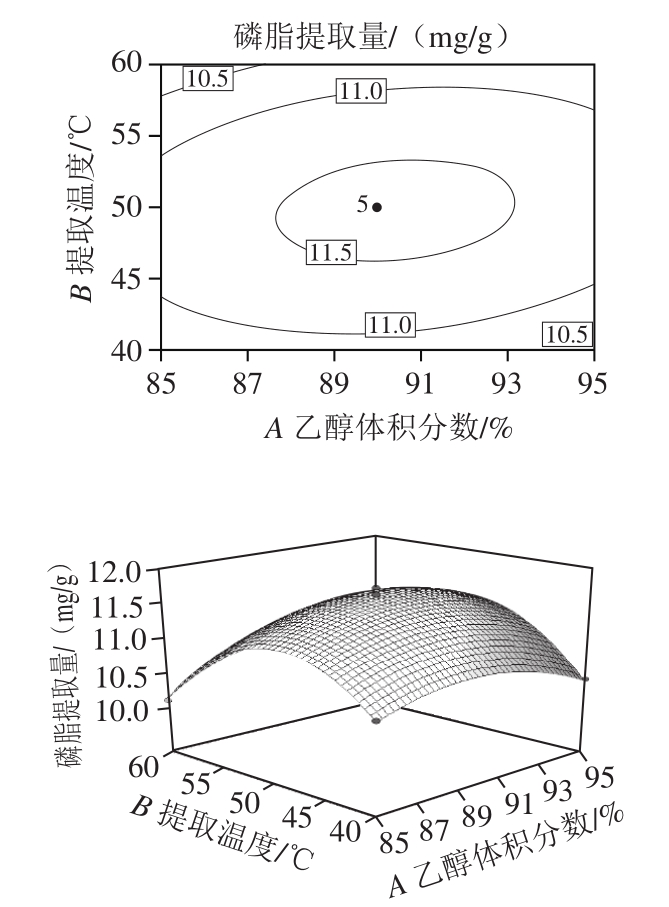
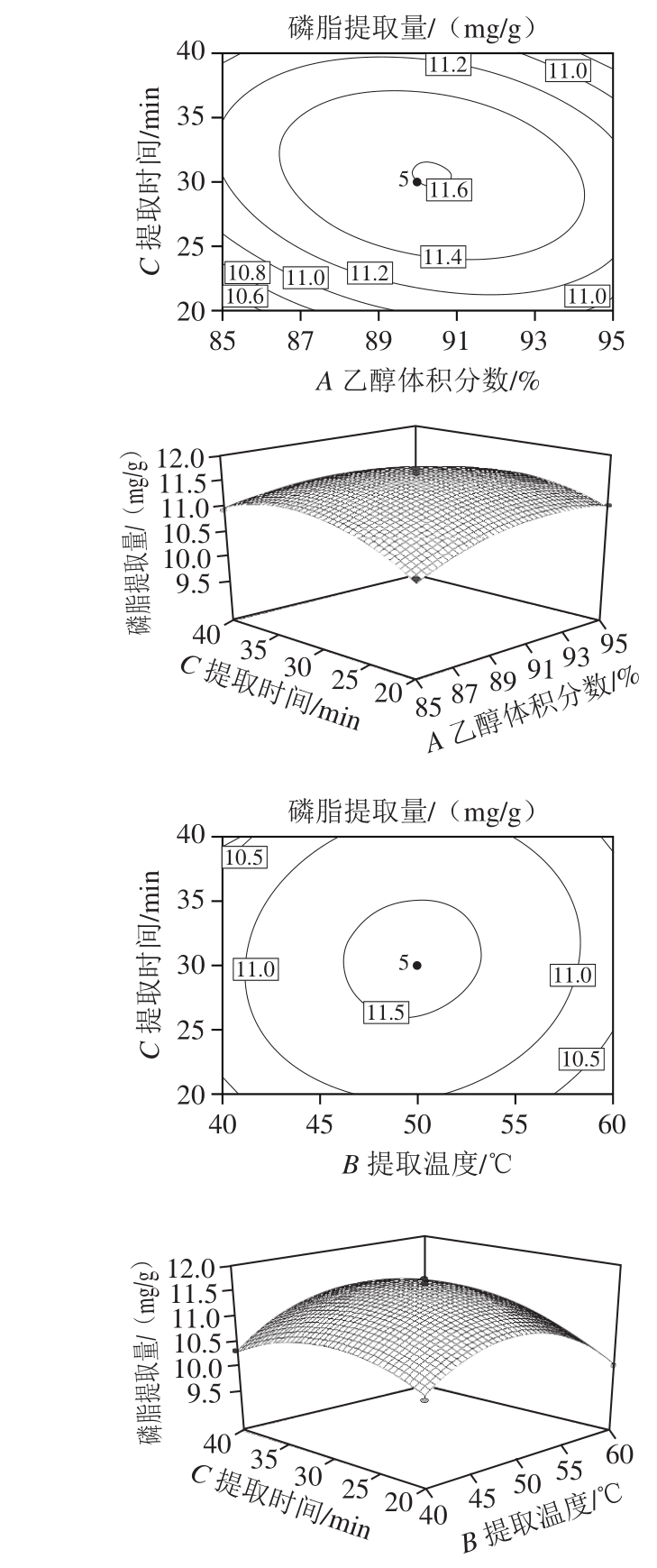
图4 各因素交互影响的等高线及响应面图
Fig. 4 Response surface and corresponding contour plots
由图4可知,因素A(乙醇体积分数)和因素C(提取时间)的响应面曲线坡度较大,表明这二者对磷脂提取量的影响较为显著;因素B(提取温度)曲线则较为平滑,说明提取温度对磷脂提取量的影响相对较小,这与回归模型方差分析中的结果一致。
通过Design-Expert 8.0软件对响应面进行最优化分析后得出最佳提取条件为乙醇体积分数90.35%、提取温度49.81 ℃、提取时间30.47 min,提取量预测值为11.60 mg/g。考虑到实际的操作条件,将提取条件调整为乙醇体积分数90%、提取温度50 ℃、提取时间30 min。在最佳条件下进行5 次重复实验,验证得到磷脂的实际提取量平均值为(11.58±0.03)mg/g,与优化前的(6.30±0.52)mg/g相比提高了83.8%,此优化条件有效。使用该方法提取磷脂,提取量略低于经典的氯仿-甲醇法[21,23],但方法安全性高,更适用于食品加工工业。

图5 高效液相色谱流动相条件优化
Fig. 5 Optimization of the mobile phase in high performance liquid chromatography
由图5A可见,磷脂标准品在二醇基HILIC柱上分离度不佳,多数峰在保留时间10~20 min区间内重叠效应较为严重,仅有PS分离度尚可,在保留时间28.38 min时可见峰形对称尖锐的色谱峰。调节流动相的pH值,向流动相A中加入53 mmol/L甲酸(pH 4.0~4.5),向流动相B中加入60 mmol/L的甲酸铵和53 mmol/L甲酸(pH 3.6),再次对磷脂标准品分离,结果如图5B所示,各个色谱峰分离度均较佳,峰形独立对称,该流动相条件可用于下一步定性定量实验。将本实验方法应用于虾头副产物中的磷脂提取物时,由于实验样品中成分较为复杂,杂质峰较多,得益于较好的色谱分离条件,目标磷脂化合物依然清晰可辨,在选定条件下得到的样品色谱分离如图5C所示。
本实验对提取所得磷脂样品进行甲酯化后,利用气相色谱法测定磷脂的脂肪酸链化学组分,并用面积归一法确定各脂肪酸的相对含量。通过对磷脂样品中化学成分气相色谱图与37 种脂肪酸甲酯混合标准品气相色谱图的对比,可得到表4。结果显示,磷脂样品中共包含23 种不同的脂肪酸链,其中饱和脂肪酸(saturated fatty acid,SFA)链占39.66%,单不饱和脂肪酸(monounsaturated fatty acid,MUFA)链占9.51%,多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)链占35.33%。SFA链中,以棕榈酸链、硬脂酸链和十七烷酸链为主要组成成分,其相对含量分别为27.70%、8.20%和2.20%;MUFA链中,以油酸链、棕榈油酸链和花生一烯酸链为主要组成成分,其相对含量分别为3.06%、2.97%和2.26%;PUFA链中,以亚油酸链、二十碳五烯酸(eicosapentaenoic acid,EPA)链和二十二碳六烯酸(docosahexaenoic acid,DHA)链为主要组成成分,其相对含量分别为16.16%、8.56%和3.65%。由该方法所提取的虾头副产物磷脂的脂肪酸链中,多数为不饱和脂肪酸链,这其中大部分为PUFA链。该结果与Shen Qing等[7]对虾副产物进行磷脂提取时所得结果基本类似。
表4 虾头副产物磷脂的脂肪酸链化学组分及相对含量
Table 4 Relative contents of fatty acyl chains of phospholipids from shrimp heads

对比图5B和图5C可知磷脂样品中所含的磷脂种类。因磷脂酰甘油(phosphatidyl glycerol,PG)一般不存在于动物骨骼肌组织中,甘油磷脂酸(phosphatidic acid,PA)在虾类组织中属低丰度磷脂,故这2 类磷脂在本实验中均未检出[31]。标准品中PC的出峰时间为19.98 min(图5B),对比可得,样品中20.02 min的峰即为PC(图5C)。同理,图5C中出峰时间为22.11 min的峰为PI,出峰时间为50.73 min的峰为PE,出峰时间为51.35 min的峰为PS。继而可得到每类磷脂分子所包含的分子种类(图6)。
由图6可知,该磷脂样品中,PC和PS两类磷脂分子检测图谱出峰较多,PE类磷脂分子检测图谱出峰次之,PI类磷脂分子检测图谱出峰为4类中最少。其中,PC类m/z多集中在824.6~876.7,m/z 850.6、m/z 852.7等峰丰度较大;PE类m/z多集中在748.6~774.6,m/z 774.6、m/z 748.6等峰丰度较大;PI类m/z多集中在855.6~885.6,m/z 883.6、m/z 885.6等峰丰度较大;PS类m/z多集中在750.6~830.7,m/z 778.6、m/z 750.6等峰丰度较大。
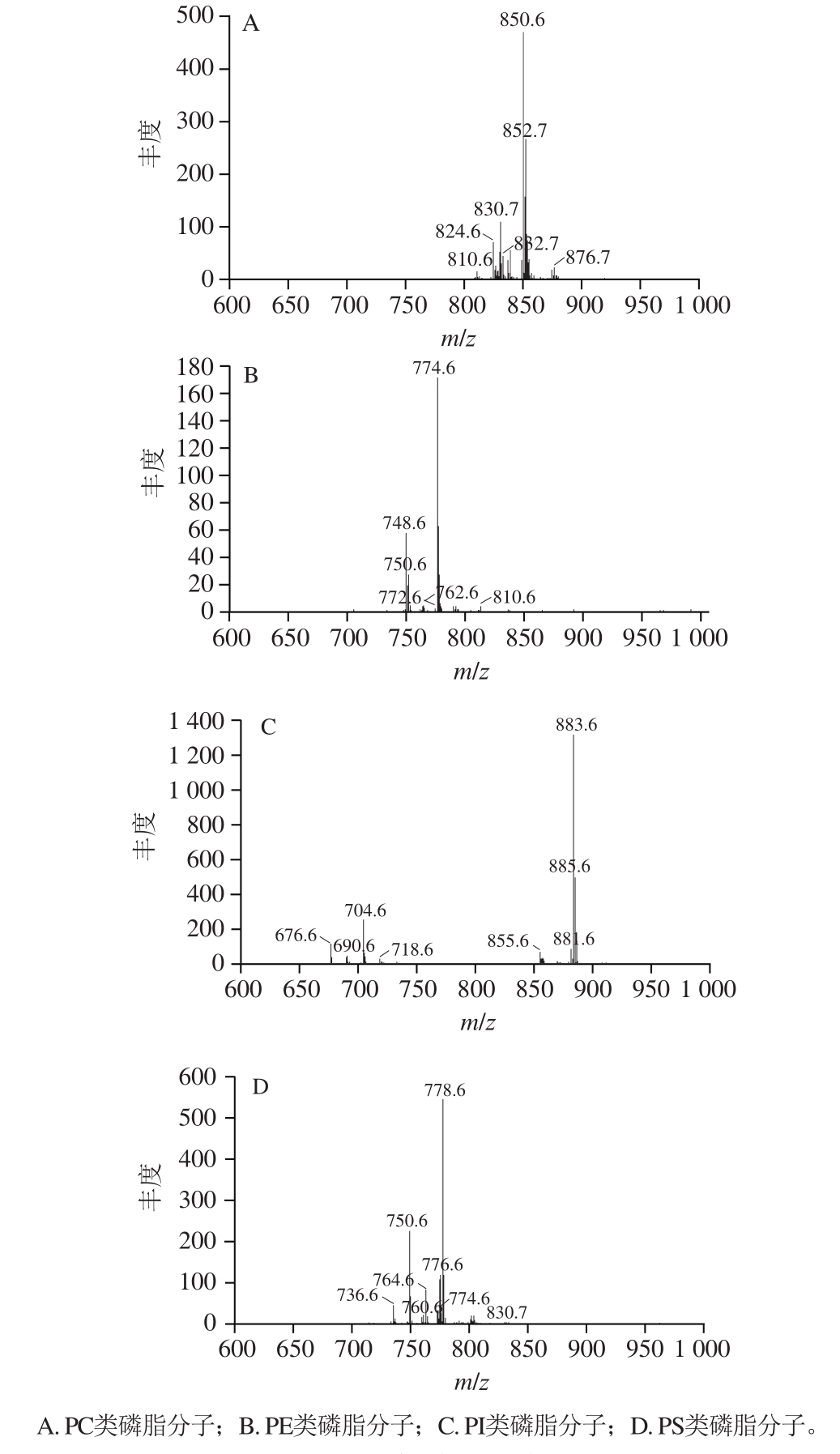
图6 磷脂样品质谱图
Fig. 6 Mass spectra of phospholipids
待磷脂分子种类确定后,本实验先用多维质谱法得到所有含有选定脂肪酸链碎片的磷脂,与图6进行对比后由LipidViewTM软件定性和多维质谱解析,并通过归一化法对已鉴定的磷脂分子进行相对含量测定,结果见表5。实验表明,提取所得磷脂样品中共检测出10 种PC、6 种PE、4 种PI、8 种PS。其中,磷脂的C原子总数为34~40,双键数为1~8。在这4类磷脂中,PC中38∶6(38.52%)、38∶5(20.71%)、36∶2(8.54%)等分子种含量较高;PE中O-40∶7(52.32%)、O-38∶6(20.31%)、O-38∶5(10.22%)等分子种较高;PI中38∶5(31.32%)、38∶4(15.69%)、36∶5(7.88%)等分子种含量较高;PS中36∶6(28.74%)、34∶6(13.65%)、36∶7(6.24%)等分子种含量较高。由表5还可看出,该提取方法所得各种类磷脂的脂肪酸链中存在许多不饱和度较高的脂肪酸链,如PC中有38∶7、40∶7、O-38∶6、38∶6、40∶6、36∶5、O-38∶5、38∶5等分子种;PE中有38∶7、O-40∶7、O-38∶6、38∶6、O-38∶5等分子种;PI中有36∶5、38∶5等分子种;PS中有40∶8、36∶7、38∶7、40∶7、34∶6、O-36∶6、36∶6、40∶6等分子种。
表5 虾头副产物中磷脂分子结构与含量
Table 5 Molecular structures and contents of phospholipids in shrimp heads
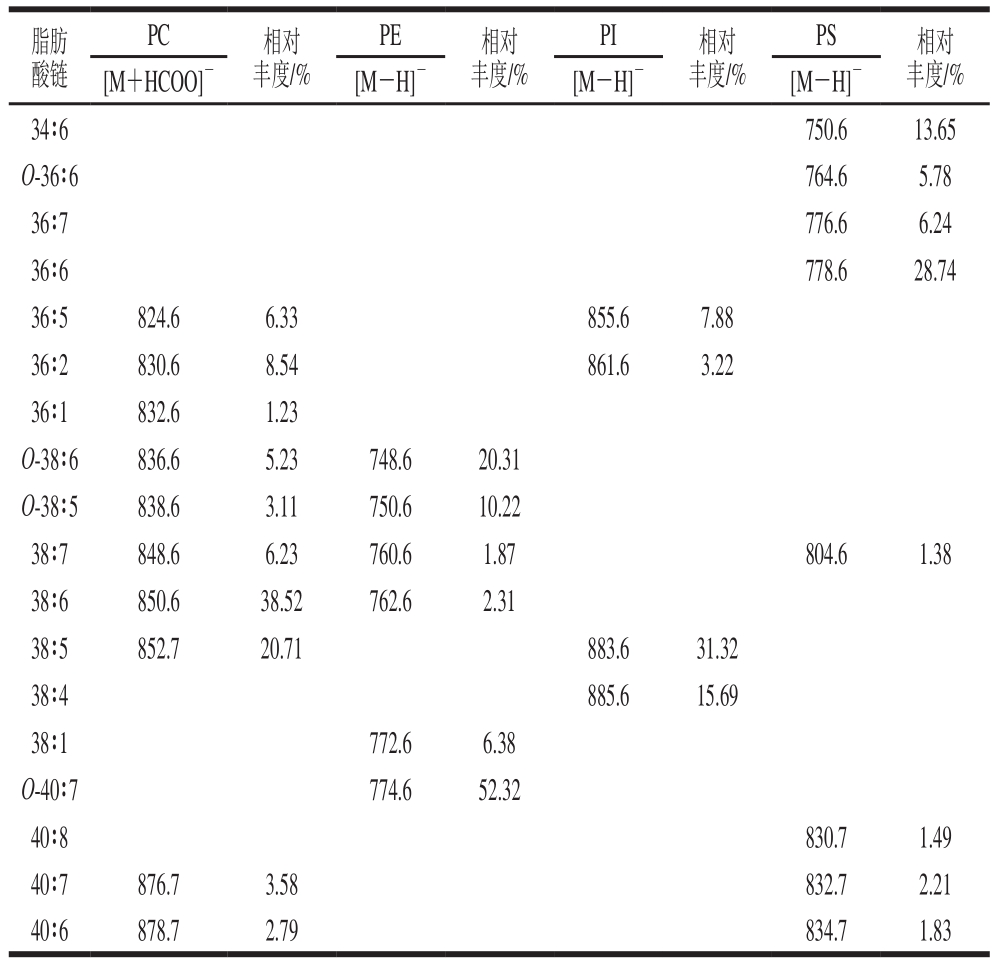
经脂质组学定性定量分析,该提取方法共从虾头中提取得到PC、PE、PI、PS四类磷脂分子,与其他方法提取所得相似。同时,各类磷脂分子又共计得到28 种分子种,较经典氯仿-甲醇法略少[7,23]。
目前磷脂的提取方法中多采用氯仿或二氯甲烷等不适用于食品工业的溶剂进行提取,本方法则采用了乙醇浸提法,并对其进行优化,得到最佳实验条件为体积分数90%乙醇溶液在50 ℃条件下提取30 min,实际提取量平均值为(11.58±0.03)mg/g,与优化前的(6.30±0.52)mg/g相比提高了83.8%。通过对该方法提取所得磷脂样品进行脂肪酸链分析和脂质组学研究发现,虾头副产物中磷脂的脂肪酸链主要含有棕榈酸链、亚油酸链、EPA链和硬脂酸链等23 种脂肪酸链,其中MUFA链占9.51%,PUFA链占35.33%;共检测出10 种PC、6 种PE、4 种PI、8 种PS,且磷脂的不饱和脂肪酸链比例较高。该方法安全性高,适用于食品工业生产,并很好地优化了对于虾头副产物的利用,不仅为磷脂提取提供了新途径,还在很大程度上达到了保护生态环境的目的。
参考文献:
[1] 陈天忠, 姚歆和, 文立新. 虾头、虾壳资源综合利用研究进展[J]. 湖南饲料, 2006(4): 35-36. DOI:10.3969/j.issn.1673-7539.2006.04.012.
[2] 刘芳, 叶克难. 虾头、壳废弃物的综合利用[J]. 水产养殖, 2007,28(5): 30-33. DOI:10.3969/j.issn.1004-2091.2007.05.013.
[3] 张祥刚, 周爱梅, 林晓霞, 等. 南美白对虾虾头、虾壳化学成分的对比研究[J]. 现代食品科技, 2009, 25(3): 224-227. DOI:10.3969/j.issn.1673-9078.2009.03.002.
[4] 龚钢明, 顾慧, 蔡宝国. 鱼类加工下脚料的资源化与利用途径[J]. 中国资源综合利用, 2003(7): 23-24. DOI:10.3969/j.issn.1008-9500.2003.07.009.
[5] 崔宏博, 薛勇, 宿玮, 等. 南美白对虾即食虾仁加工工艺和贮藏研究[J].食品科学, 2012, 33(4): 257-261.
[6] 唐义宝, 谢晶. 苹果酸用于虾头、虾壳脱钙的工艺研究条件[J].福建农林大学学报(自然科学学报), 2012, 41(3): 310-314.DOI:10.3969/j.issn.1671-5470.2012.03.017.
[7] SHEN Q, CHEUNG H Y. TiO2/SiO2core-shell composites based sample preparation method for selective extraction of phospholipids from shrimp waste followed by HILIC-QTOF/MS analysis[J].Journal of Agricultural & Food Chemistry, 2014, 62(36): 8944-8951.DOI:10.1021/jf503040p.
[8] 崔益玮, 李诗言, 王珏, 等. 水产加工副产物中磷脂和鱼油的分离及脂质组学研究[J]. 水产学报, 2017, 41(6): 827-835. DOI:10.11964/jfc.20170310748.
[9] CHANG W P, KWON S J, HAN J J, et al. Transesterification of phosphatidylholine with eicosapentaenoic acid ethyl ester using phospholipase A2 in organic solvent[J]. Biotenology Letters, 2000,22(2): 147-150. DOI:10.1023/A:1005626508891.
[10] KING J D, WHITE D C, TAYLOR C W. Use of lipid composition and metabolism to examine structure and activity of estuarine detrital microf l ora[J]. Applied & Environmental Microbiology, 1977, 33(5):1177-1183.
[11] 穆玉云, 王洋. 磷脂在猪禽饲料中的应用[J]. 中国饲料, 2007(19):35-36. DOI:10.3969/j.issn.1004-3314.2007.19.009.
[12] N A V D E R K P, B A R A O N A E, L I E B E R C S.Polyenylphosphatidylcholine attenuates alcohol-induced fatty liver and hyperlipemia in rats[J]. Journal of Nutrition, 1997, 127(9): 1800-1806.
[13] 王琦. 海产动物来源n-3 PUFA磷脂的提取及生物活性研究[D].青岛: 中国海洋大学, 2008: 16-17.
[14] 汪海峰, 杨受保. 磷脂的功能及其在水产养殖中的作用[J]. 水利渔业, 2004, 24(5): 67-69.
[15] SHEN Q, WANG Y Y, GONG L K, et al. Shotgun lipidomics strategy for fast analysis of phospholipids in fi sheries waste and its potential in species differentiation[J]. Journal of Agricultural & Food Chemistry,2012, 60(37): 9384-9393. DOI:10.1021/jf303181s.
[16] HAN X L, GROSS R W. Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: a bridge to lipidomics[J]. Journal of Lipid Research, 2003, 44(6): 1071-1079. DOI:10.1194/jlr.R300004-JLR200.
[17] SHEN Q, YANG Q, CHEUNG H Y. Hydrophilic interaction chromatography based solid-phase extraction and MALDI TOF mass spectrometry for revealing the inf l uence of pseudomonas fl uorescens on phospholipids in salmon fi llet[J]. Analytical & Bioanalytical Chemistry,2015, 407(5): 1475-1484. DOI:10.1007/s00216-014-8365-8.
[18] SHEN Q, DONG W, YANG M, et al. Lipidomic fingerprint of almonds (Prunus dulcis L. cv Nonpareil) using TiO2nanoparticle based matrix solid-phase dispersion and MALDI-TOF/MS and its potential in geographical origin verification[J]. Journal of Agricultural &Food Chemistry, 2013, 61(32): 7739-7748. DOI:10.1021/jf4016448.
[19] SHEN Q, YANG M, LI L Q, et al. Graphene/TiO2nanocomposite based solid-phase extraction and matrix-assisted laser desorption/ionization time-of-f l ight mass spectrometry for lipidomic profiling of avocado (Persea americana Mill.)[J]. Analytica Chimica Acta, 2014,852: 153-161. DOI:10.1016/j.aca.2014.09.022.
[20] YIN F W, ZHOU D Y, ZHAO Q, et al. Dentification of glycerophospholipid molecular species of mussel (Mytilus edulis)lipids by high-performance liquid chromatography-electrospray ionization-tandem mass spectrometry[J]. Food Chemistry, 2016, 213:344-351. DOI:10.1016/j.foodchem.2016.06.094.
[21] 边晶晶, 谢晶, 陈舜胜. 南美白对虾虾头中磷脂提取工艺的优化[J].食品科学, 2011, 32(24): 11-15.
[22] 卢航, 里慧, 赵景华, 等. 利用高效液相色谱-蒸发光检测器法分析鮰鱼脑中磷脂组成[J]. 食品科学, 2015, 36(24): 177-180. DOI:10.7506/spkx1002-6630-201524032.
[23] 陈康, 戴志远, 沈清, 等. 响应面法提取南极磷虾磷脂及其分子种组成的测定[J]. 南方水产科学, 2017, 13(3): 104-112. DOI:10.3969/j.issn.2095-0780.2017.03.014.
[24] 邹舟, 王琦, 于刚, 等. 鲢鱼各部位磷脂组分及脂肪酸组成分析[J]. 食品科学, 2014, 35(24): 105-109. DOI:10.7506/spkx1002-6630-201424020.
[25] 萧力争, 胡祥文, 蔡金娥, 等. 绿茶乙醇浸提技术研究[J]. 天然产物研究与开发, 2006, 18(4): 634-636. DOI:10.3969/j.issn.1001-6880.2006.04.026.
[26] 周雪敏, 朱科学, 房一明, 等. 黑胡椒油树脂乙醇浸提工艺研究[J]. 中国调味品, 2016, 41(10): 1-7. DOI:10.3969/j.issn.1000-9973.2016.10.001.
[27] 潘璨, 鞠兴荣, 徐宗季, 等. 乙醇浸提大蒜油工艺的研究及GC-MS呈香成分分析[J]. 中国调味品, 2017, 42(2): 19-23. DOI:10.3969/j.issn.1000-9973.2017.02.005.
[28] 刘大川, 余华峰. 乙醇浸提紫苏籽压榨饼中油脂的工艺[J]. 农业工程学报, 2008, 24(11): 242-246. DOI:10.3321/j.issn:1002-6819.2008.11.049.
[29] RIST C M D, DULETIĆ-LAUSEVIĆ S, KNEZEVIĆ-VUKCEVIĆ J, et al. Antimicrobial activity of essential oils and ethanol extract of Phlomis fruticosa L. (Lamiaceae)[J]. Phytotherapy Research, 2015,14(4): 267-271. DOI:10.1002/1099-1573(200006)14:4<267::AIDPTR644>3.0.CO;2-7.
[30] LEI L, LI J, HU J N, et al. Separation of phospholipids from hen egg yolk by short packed silica gel column chromatography[J]. Journal of Food Science, 2012, 77(9): C948-C953. DOI:10.1111/j.1750-3841.2012.02850.x.
[31] SHEN Q, DAI Z Z, HUANG Y W, et al. Lipidomic pro fi ling of dried seahorses by hydrophilic interaction chromatography coupled to mass spectrometry[J]. Food Chemistry, 2016, 205: 89-96. DOI:10.1016/j.foodchem.2016.02.151.
Extraction and Lipidomic Profiling of Phospholipids from Shrimp Heads
CUI Yiwei1, YU Xina1, LI Shiyan2, WANG Yang2, DAI Zhiyuan1, ZHANG Yanping1, CHEN Kang1, SHEN Qing1,*
(1. State Key Laboratory of Aquatic Products Processing of Zhejiang Province, Institute of Seafood, Zhejiang Gongshang University,Hangzhou 310012, China; 2. Aquatic Products Quality Inspection Center of Zhejiang Province, Hangzhou 310023, China)
Abstract:To make full use of nutrients in shrimp heads and reduce the waste of resources, this experiment investigated the extraction of phospholipids from shrimp heads and the lipidomic analysis of phospholipid fatty acyl chains by multidimensional tandem mass spectrometry and gas chromatography. Ethanol was used as extraction solvent, and the optimized parameters were determined as follows: ethanol concentration 90%, extraction temperature 50 ℃ and extraction time 30 min.The extraction yield under these conditions was (11.58 ± 0.03) mg/g, which was 83.8% higher than that before optimization.The obtained phospholipids were esterified before analysis of fatty acyl chains by gas chromatography and were identified and quantified by high performance liquid chromatography-mass spectrometry in the negative-ion full scan mode. The results showed that the phospholipids contained 23 fatty acyl chains, including palmitic, linoleic, eicosapentaenoic and stearic acyl chain. The content of monounsaturated fatty acid chain was 9.51%, while that of polyunsaturated fatty acyl chain was 35.33%. A total of 28 phospholipids belonging to four classes (phosphatidyl choline, phosphatidyl ethanolamine,phosphatidyl inositol, and phosphatidyl serine) were detected in the phospholipid extract. The phospholipids obtained by this extraction method contained many highly unsaturated fatty acyl chains, such as 40:8, 36:7, 38:7, O-40:7, 40:7, 34:6, O-36:6,36:6, O-38:6, 38:6, and 40:6. In conclusion, the abundant phospholipids from shrimp heads are highly worth developing and utilizing due to the high degree of unsaturation of their fatty acyl chains.
Keywords:shrimp head; waste; phospholipids; lipidomics; mass spectrometry
CUI Yiwei, YU Xina, LI Shiyan, et al. Extraction and lipidomic profiling of phospholipids from shrimp heads[J]. Food Science,2018, 39(20): 218-225. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820032. http://www.spkx.net.cn
引文格式:崔益玮, 俞喜娜, 李诗言, 等. 虾头中磷脂提取与组学分析[J]. 食品科学, 2018, 39(20): 218-225. DOI:10.7506/spkx1002-6630-201820032. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0218-08
文献标志码:A
中图分类号:S912
DOI:10.7506/spkx1002-6630-201820032
*通信作者简介:沈清(1986—),男,研究员,博士,研究方向为水产品加工与安全。E-mail:leonqshen@163.com
第一作者简介:崔益玮(1992—),女,硕士研究生,研究方向为水产品脂质。E-mail:ccdeyxzh@qq.com
浙江省重点研发计划项目(2017C03041)
基金项目:浙江省公益技术研究计划项目(LGN18C200001);国家自然科学基金青年科学基金项目(31601542);
收稿日期:2017-09-20