表1 响应面试验因素与水平
Table 1 Factors and levels used in response surface methodology

宋正规,朱丽娜,张洪超,薛张芝,李和生*,付晶晶,周 伟
(宁波大学海洋学院,浙江 宁波 315211)
摘 要:以马面鱼皮为原料,优化胃蛋白酶提取马面鱼皮胶原蛋白工艺,并对所提胶原蛋白进行结构分析,为马面鱼皮胶原蛋白的制备提供实验基础。得到提取最优条件为胃蛋白酶加酶量16 800 U/g、缓冲液pH 3.0、料液比1∶30(g/mL)、提取时间21.5 h,马面鱼皮胶原蛋白提取率为27.6%。氨基酸分析、紫外光谱分析、傅里叶变换红外光谱分析、垂直电泳分析表明,所提胶原蛋白符合I型胶原蛋白特征,保持胶原蛋白的三螺旋结构。
关键词:马面鱼;鱼皮胶原蛋白;提取工艺;结构分析
马面鱼又称绿鳍马面鲀,多产于黄海、东海、日本海、朝鲜海等领域,其中东海产量最多,已成为我国仅次于带鱼的第二大海洋经济鱼类。马面鱼肉被普遍应用于工厂加工、餐厅食材制作[2],鱼皮多半被当作废料丢弃。马面鱼皮约占马面鱼质量的12%,如能高值化利用,便能变废为宝,产生重大的经济效益。胶原蛋白是动物细胞合成的一种具有生物活性的高分子化合物,是人体皮肤的重要组成部分,同时也是结缔组织重要组成,起到支撑器官、保护机体的作用[3]。马面鱼皮含有大量可溶性胶原蛋白,而且氨基酸种类含量丰富,易于吸收,综合利用率高,对于幼童和老人营养更佳[4]。
梁建华[5]用柠檬酸、乙酸和乳酸提取了罗非鱼皮胶原蛋白,其中乳酸的提取率最高。杨玲等[6]分别用柠檬酸和乙酸提取波罗的海鳕鱼皮胶原蛋白,24 h内分3 个阶段用柠檬酸提取胶原蛋白,约有85%的胶原蛋白能够被分离出来,用0.5 mol/L的乙酸溶液连续提取24 h可得到相似的产率。李燕等[7]比较研究了采用胰蛋白酶、木瓜蛋白酶和胃蛋白酶从猪皮中提取胶原蛋白,发现采用胰蛋白酶提取胶原蛋白得率最高,但结构破坏较为严重,而用胃蛋白酶提取的胶原蛋白结构保存最为完整。钟朝辉等[8]用胃蛋白酶法提取草鱼鳞胶原蛋白,并对其基本特性进行研究,红外光谱和圆二色谱分析表明该胶原蛋白具有典型的三股螺旋结构。
实验选取马面鱼皮为主要原料,选择酶法常用的胃蛋白酶提取胶原蛋白,并对酶法提取马面鱼皮胶原蛋白的结构进行鉴定,通过对加酶量、缓冲液pH值、料液比、提取时间工艺条件的优化,为马面鱼皮胶原蛋白的提取、利用提供实验基础,对于变废为宝、提高马面鱼的附加值有重要意义。
马面鱼购于宁波庄市菜市场,流水解冻后,去皮,清水清洗干净,阴凉处自然晾干,然后用剪刀剪碎,装入密封袋封口后在-20 ℃条件下贮藏备用。
胃蛋白酶、酪蛋白 上海星科生物科技有限公司;福林-酚试剂(密封贮存于4 ℃冰箱中避光保存) 北京索莱宝科技有限公司。
XHF-D内切式匀浆机 宁波新芝生物科技股份有限公司;H-1650高速台式离心机 长沙湘仪离心机仪器有限公司;pHS-3C精密pH计 上海雷磁仪器厂;AFC-2000-G实验室超纯水机、氨基酸分析仪 德国赛卡姆公司;紫外-可见光谱仪 美国Varian公司;Jasco FT/IR-4700傅里叶变换红外光谱仪 日本分光公司。
1.3.1 胃蛋白酶活力的测定
参照楚水晶[9]报道方法测定胃蛋白酶活力。经测定,酶粉稀释液的净吸光度平均值为0.327 2,通过酪氨酸标准曲线查得所用胃蛋白酶活力为2 800 U/mg。
1.3.2 羟脯氨酸标准曲线的制作
采用比色法测定羟脯氨酸标准曲线[10]。羟脯氨酸质量浓度范围0~4 μg/mL,以羟脯氨酸质量浓度为横坐标、吸光度为纵坐标制作标准曲线,得方程为y=0.173 7x+0.018 6(R2=0.995 8)。
1.3.3 马面鱼皮的预处理
精确称取鱼皮200.00 g,用含有1% H2O2、3% NaCl、0.1 mol/L NaOH的溶液浸泡鱼皮,料液比1∶30(g/mL),放置在4 ℃冰箱中进行脱色、脱杂蛋白处理,6 h后取出过滤,鱼皮备用。
1.3.4 单因素试验
试验选取加酶量、缓冲液pH值、料液比、提取时间4 个因素,分析各因素对马面鱼皮胶原蛋白提取率的影响。
1.3.4.1 加酶量对胶原蛋白提取率的影响
用pH 3.0的磷酸氢二钠-柠檬酸缓冲液浸泡溶胀处理后的鱼皮,溶胀12 h匀浆,加胃蛋白酶量分别为10 000、12 500、15 000、17 500、20 000 U/g,料液比1∶30(g/mL),4 ℃提取20 h后,10 000 r/min冷冻离心20 min,取上清液,测定羟脯氨酸的含量。
1.3.4.2 缓冲液pH值对胶原蛋白提取率的影响
分别选用pH 2.2、2.6、3.0、3.4、3.8的磷酸氢二钠-柠檬酸缓冲液浸泡溶胀处理后的鱼皮,溶胀12 h之后匀浆,选用胃蛋白酶提取,加酶量为15 000 U/g,料液比1∶30(g/mL),在4 ℃提取20 h,10 000 r/min冷冻离心20 min,取上清液,测定羟脯氨酸的含量。
1.3.4.3 料液比对胶原蛋白提取率的影响
用pH 3.0的磷酸氢二钠-柠檬酸缓冲液浸泡溶胀处理后的鱼皮,溶胀12 h之后匀浆,选用胃蛋白酶提取,加酶量为15 000 U/g,料液比1∶10、1∶20、1∶30、1∶40、1∶50(g/mL),提取20 h后,10 000 r/min冷冻离心20 min,取上清液,测定羟脯氨酸的含量。
1.3.4.4 提取时间对胶原蛋白提取率的影响
用pH 3.0的磷酸氢二钠-柠檬酸缓冲液浸泡溶胀处理后的鱼皮,溶胀12 h之后匀浆,选用胃蛋白酶提取,加酶量为15 000 U/g,料液比1∶30,分别提取10、15、20、25、30 h后,10 000 r/min冷冻离心20 min,取上清液,测定羟脯氨酸的含量。
1.3.5 响应面试验
利用Design-Expert 8.06软件,按照Box-Behnken试验设计原理,综合单因素试验结果,选取加酶量、缓冲液pH值、料液比、提取时间4 个因素,以提取率为响应值,采用4因素3水平的响应面分析方法,因素与水平如表1所示。
表1 响应面试验因素与水平
Table 1 Factors and levels used in response surface methodology

1.3.6 胶原蛋白的纯化
在胶原蛋白提取液中加入氯化钠晶体,边加入边搅拌,使溶液中氯化钠最终浓度为1 mol/L,倒去上层溶液,将下层溶液与析出白色絮状物一并倒入截留相对分子质量10 000的透析袋中,采用10 倍于胶原蛋白溶液体积的纯水溶液进行脱盐,每隔6 h换水一次,脱盐48 h,倒入培养皿,冷冻干燥透析袋内液体。
1.3.7 胶原蛋白结构分析
1.3.7.1 氨基酸组成测定
胶原蛋白溶于6 mol/L盐酸溶液,130 ℃微波消解60 min,氨基酸自动分析仪分析氨基酸组成[11]。
1.3.7.2 紫外吸收光谱分析
将胶原蛋白溶解于0.5 mol/L的醋酸溶液,配成2 mg/mL的胶原蛋白溶液,于190~400 nm近紫外光区处进行扫描。
1.3.7.3 傅里叶变换红外光谱测定
测试前,样品保存在硅胶干燥器中室温干燥24 h以脱除大部分水分。向样品中加入KBr研磨,压片。使用傅立叶变换红外光谱仪进行检测。光谱范围4 000~400 cm-1;分辨率4 cm-1;样品扫描次数32。
1.3.7.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
采用SDS-PAGE,10%的分离胶和5%的浓缩胶,Tris-甘氨酸缓冲系统。取冻干样品溶解于0.1 mol/L酒石酸溶液中,加2×SDS样品缓冲液混合稀释,100 ℃煮沸处理5 min,自然冷却后上样。用微量加样器分别吸取处理好的样品10 μL及蛋白质分子质量标准品5 μL,轻轻加入加样槽内。恒压条件下用80 V电压,样品在浓缩胶内浓缩成一条线进入分离胶后,加大电压值到140 V,电泳结束后倒入考马斯亮蓝R-250染色液,平缓摇动染色1~2 h。随后倒出染色液,加入甲醇-乙酸脱色液,平缓摇动脱色至条带清晰,背景为浅色或无色,期间换脱色液数次[12]。
利用SAS 9.4软件对单因素数据进行统计学显著性分析,所有数据均采用 ±s表示,不同处理间差异采用One-Way ANOVA进行比较分析,以P值小于0.05为差异显著,最终利用OriginPro 8.5对单因素数据作图。胶原蛋白SDS-PAGE图采用凝胶成像系统进行拍照。
胶原蛋白易受温度影响,造成三螺旋结构发生变化、肽键及其各链之间链接断裂,为保证所提胶原蛋白结构稳定,整个实验过程在4 ℃条件下进行。
2.1.1 加酶量对胶原蛋白提取率的影响
如图1所示,随着加酶量的增多,提取率提高,当加酶量增大到15 000 U/g时,底物不足使提取反应饱和,此时,底物浓度是影响提取率的主要因素,在底物浓度保持不变的条件下,增加加酶量,提取率增长缓慢,根据图1可知,胃蛋白酶提取马面鱼皮胶原蛋白的加酶量最佳选择为15 000 U/g。
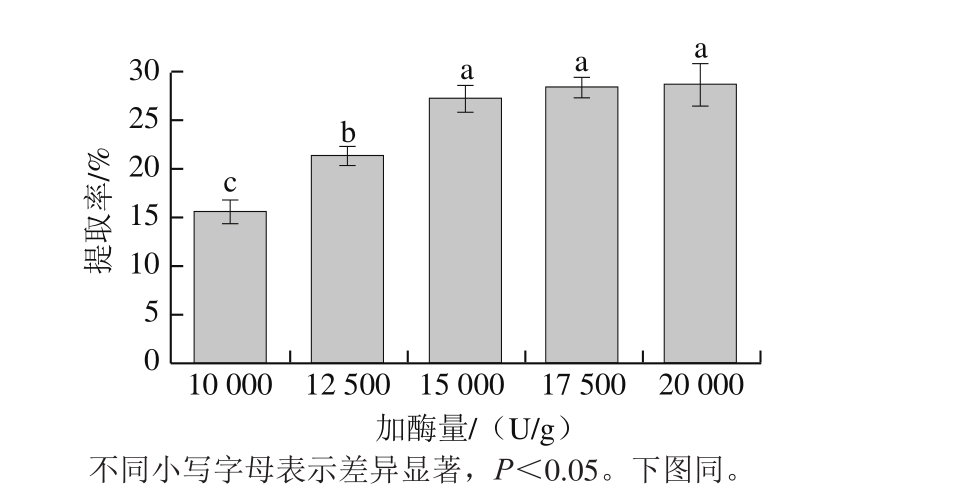
图1 加酶量对胶原蛋白提取率的影响
Fig. 1 Effect of enzyme dosage on extraction efficiency of collagen
2.1.2 缓冲液pH值对胶原蛋白提取率的影响
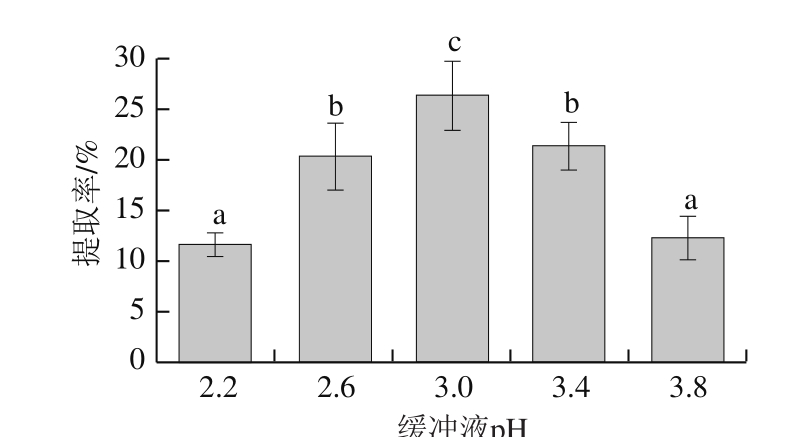
图2 缓冲液pH值对胶原蛋白提取率的影响
Fig. 2 Effect of buffer pH values on extraction efficiency of collagen
由图2可知,当pH值为3.0时,胃蛋白酶提取马面鱼皮胶原蛋白的最大提取率为26.4%。
2.1.3 料液比对胶原蛋白提取率的影响
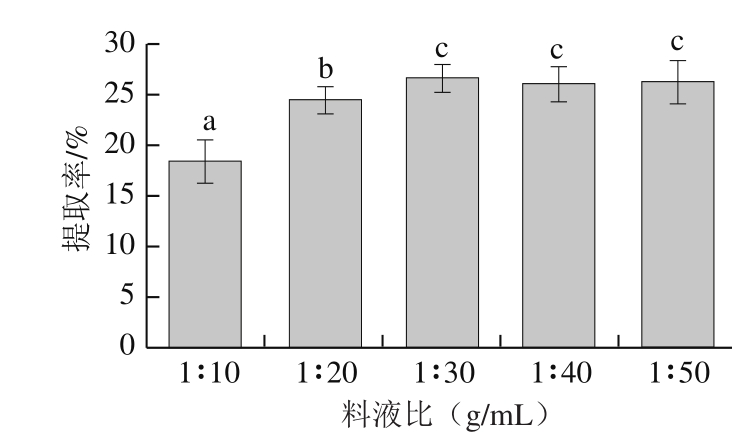
图3 料液比对胶原蛋白提取率的影响
Fig. 3 Effect of solid to solvent ratio on extraction ef fi ciency of collagen
如图3所示,随着提取试剂用量的增加,当料液比为1∶30(g/mL)时,提取率达到最大值26.7%,料液比1∶30之后,提取率未有明显增加。
2.1.4 提取时间对胶原蛋白提取率的影响
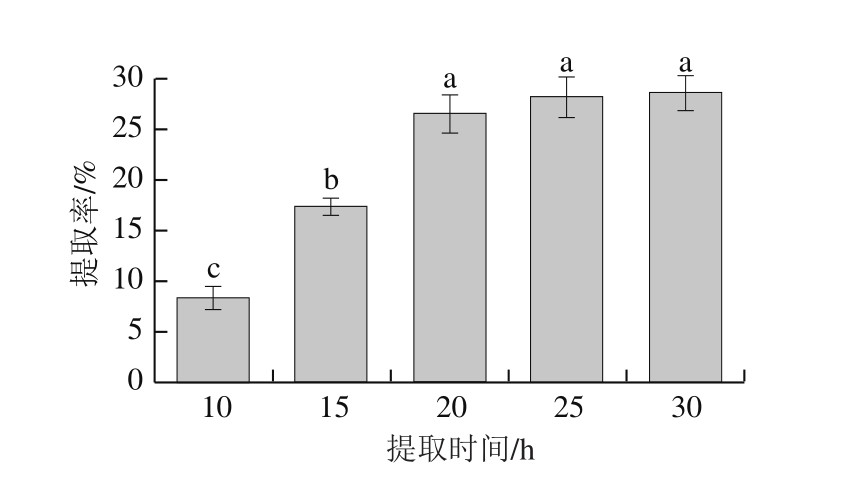
图4 提取时间对胶原蛋白提取率的影响
Fig. 4 Effect of hydrolysis time on extraction efficiency of collagen
如图4所示,在提取反应初期,较短的反应时间内,马面鱼皮中的反应底物还没有完全溶于提取液中,所以胶原蛋白提取率较低,随着反应时间的延长,反应底物的溶解量不断增大,相应地,提取率提高,且提取率增长率较大,在反应进行20 h后,反应底物基本溶解完全,所以延长反应时间,提取率变化不大,提取率增长缓慢。
2.2.1 响应面试验结果及方差分析
利用Design-Expert 8.0.6软件中Box-Behnken法进行4因素3水平的试验设计,以马面鱼皮胶原蛋白的提取率为响应值进行优化得出29 组试验安排,试验设计及结果见表2,对结果进行方差分析见表3。
表2 Box-Behnken试验设计方案及结果
Table 2 Box-Behnken design with experimental results

Box-Behnken响应面设计有各因素自变量取值所构成的24 个三维顶点和重复5 次试验以估计误差的区域中心零点,共29 个试验点。利用Design-Expert 8.0.6软件对马面鱼皮胶原蛋白的提取率进行多元回归拟合分析,得到马面鱼皮胶原蛋白提取率回归方程:Y=26.82+2.08A-0.59B-0.66C+1.17D-0.75AB+0.40AC-0.55AD-0.10BC+0.22BD+0.075CD-1.57A2-5.16B2-2.76C2-1.39D2。
表3 方差分析
Table 3 Analysis of variance
注:*. P<0.05,差异显著;**. P<0.01,差异极显著。
对所得到的回归模型进行显著性检验和方差分析,其结果如表3所示。由表3可以看出,模型P小于0.000 1,说明回归模型达到极显著水平,且失拟项P为0.067 5大于0.05,说明回归模型拟合度较好,试验误差小,绝对系数R2为0.976 9,说明97.69%的马面鱼皮胶原蛋白提取率可用该回归方程分析预测得到,该模型拟合程度良好,回归方程很好地描述了试验各因素与响应值之间的真实关系,可以通过此模型分析和预测胃蛋白酶提取马面鱼皮胶原蛋白的工艺参数。校正绝对系数R2Adj为0.953 9,与R2接近,说明该模型有充分的通用性和准确性,并表明有占总变异的4.61%不能用该模型来解释。变异系数表示试验的精确度,精确度越小说明试验数据可靠性越大,本试验变异系数3.06%,说明试验数据可靠,精密度为18.855,远大于4,说明该模型可以用来对试验结果进行拟合。从表3还可以看出,该模型的一次项和二次项达到极显著水平,交互项AB对提取率影响显著,其他因素的影响不显著。
2.2.2 响应面交互效应分析
在加酶量、缓冲液pH值、料液比、提取时间某两个因素条件固定不变(0水平)的情况下,根据回归方程绘制交互项的三维响应面及与之对应的等高线,考察交互项对提取率的影响,并对模型进行降维分析。
等高线的形状及三维响应面坡度陡峭程度可以反映各因素相互作用的强弱,等高线形状为鞍形或椭圆形,说明两者的交互作用显著;等高线形状为圆形,则说明两者交互作用不显著[13-14]。三维响应面坡度平缓说明响应值对交互因素变化不敏感;坡度陡峭,则说明响应值对交互因素变化敏感[15-16]。本试验因素间交互作用的等高线及响应面如图5所示。
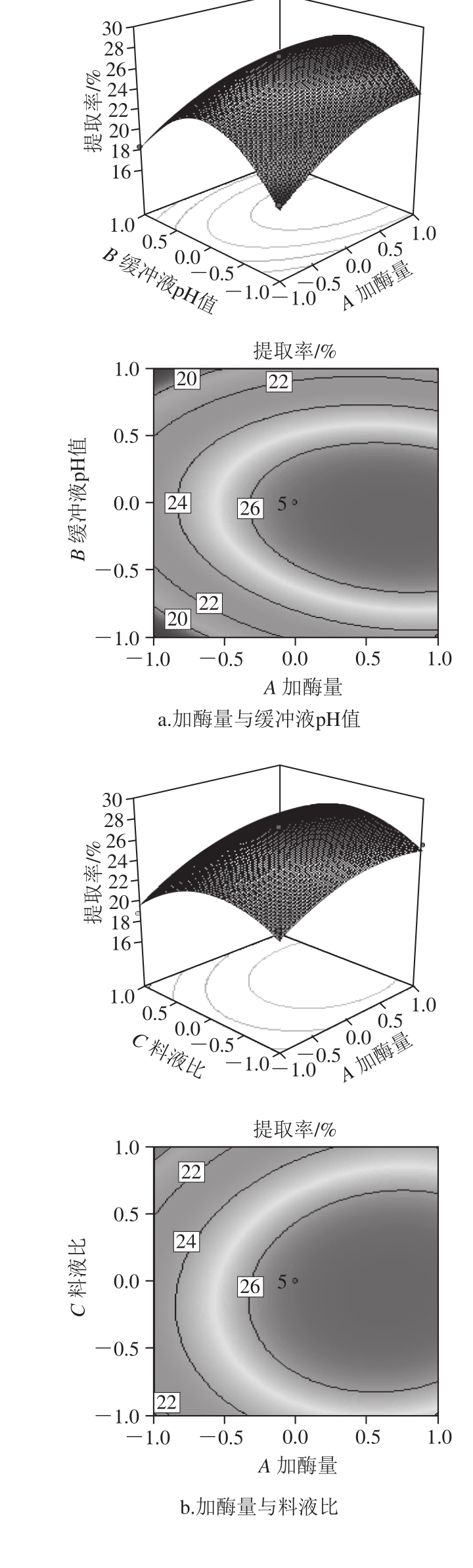
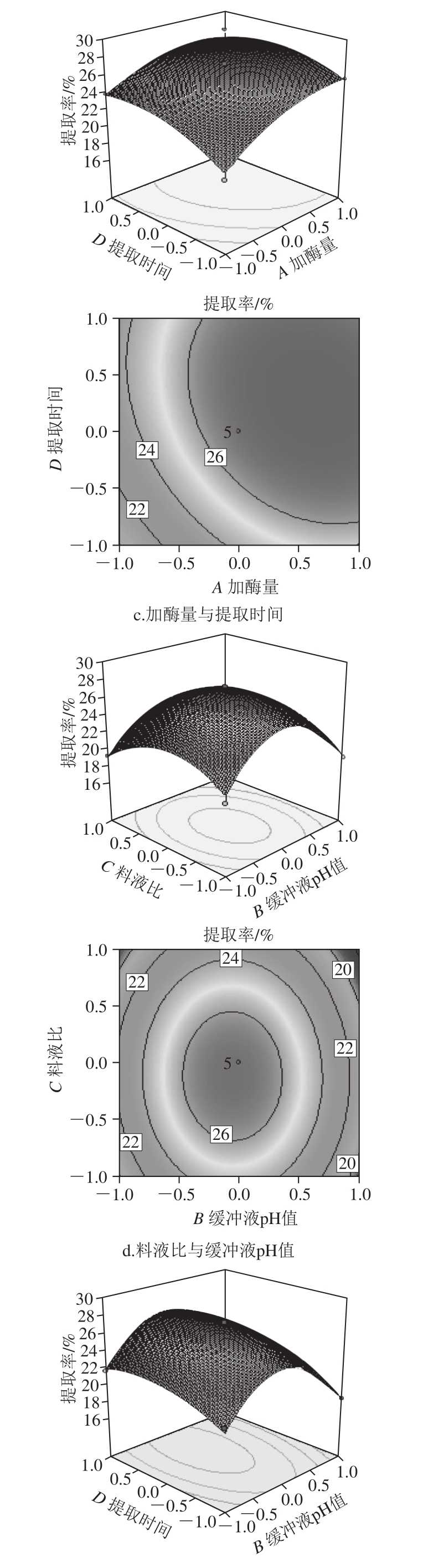
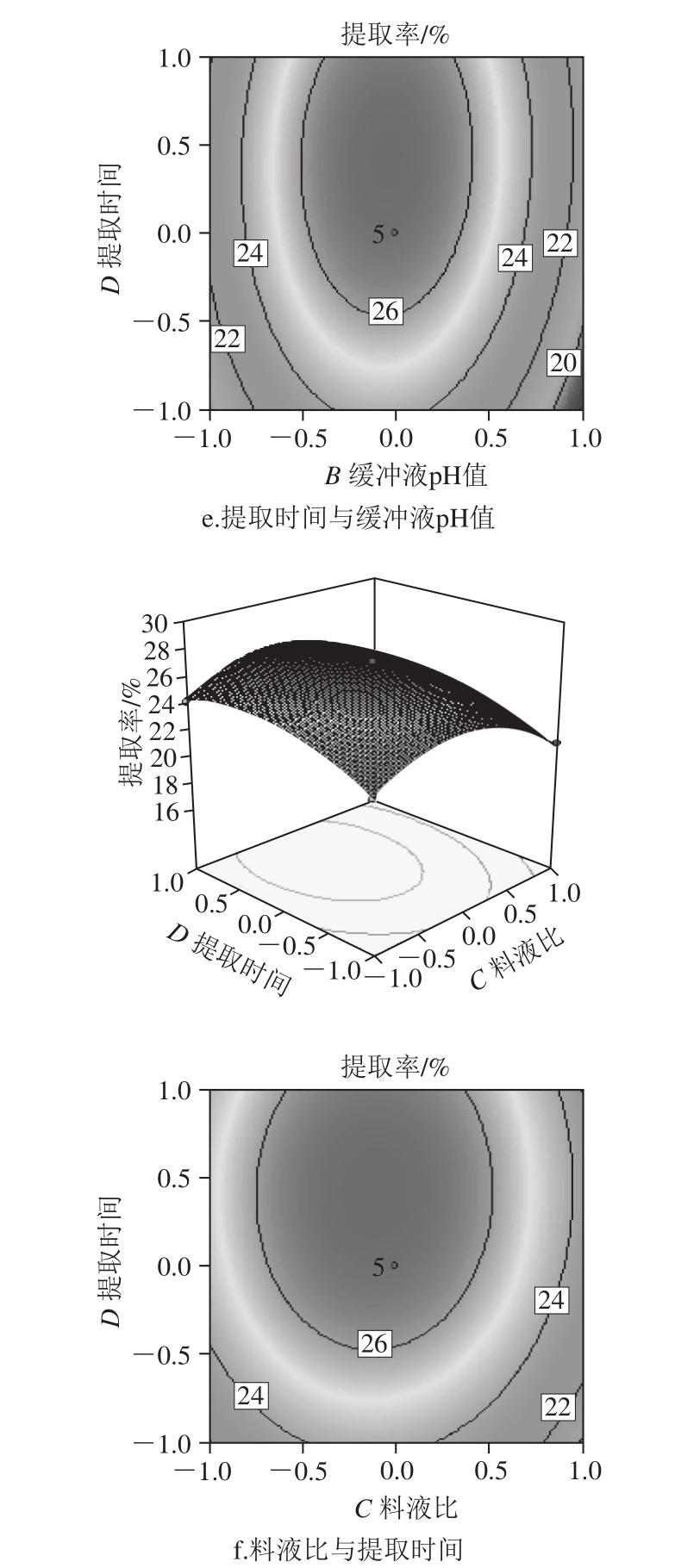
图5 交互作用对胶原蛋白提取率的影响
Fig. 5 Interactive effects of various factors on the yield of collagen
由图5a可知,当加酶量不变时,胶原蛋白提取率随缓冲液pH值升高先增大后减小,说明缓冲液pH值过高或者过低,都不利于提取,这和胃蛋白酶最适pH值为3有密切关系,当缓冲液pH值不变时,胶原蛋白提取率随加酶量的增加而增大,但加酶量过高,容易造成胶原蛋白三螺旋结构的破坏,同时根据等高线为椭圆形可以得出,加酶量和缓冲液pH值交互作用明显,这与表3方差分析中回归模型系数显著性检验结果一致。由图5b可知,当料液比不变时,胶原蛋白的提取率随加酶量的增加而增大,加酶量不变时,随着料液比的变化,提取率呈现相同的变化趋势。由图5c可知,当加酶量不变时,随着提取时间延长,提取率逐渐增大,但提取24 h后,提取率增加不再明显,当提取时间不变时,提取率随加酶量的增加而增大。由图5d可知,当料液比不变时,胶原蛋白提取率随缓冲液pH值升高先增大后减小,当缓冲液pH值不变时,胶原蛋白提取率随料液比变大先增大后减小。由图5e可知,当缓冲液pH值不变时,随着提取时间的延长,胶原蛋白提取率呈现相同的变化趋势,当提取时间不变时,胶原蛋白提取率随缓冲液pH值升高先增大后减小。由图5f可知,当料液比不变时,随着提取时间延长,胶原蛋白提取率变化较小,当提取时间不变时,提取率随料液比的变化先增大后减小。
2.2.3 最佳提取条件的确定和验证实验结果
利用Design-Expert 8.0.6软件建立的模型对胃蛋白酶提取马面鱼皮胶原蛋白工艺进行优化,得到最大提取率的最佳工艺条件为加酶量16 800 U/g、缓冲液pH 2.97、料液比1∶30、提取时间21.32 h,在此工艺条件下,得到马面鱼皮胶原蛋白的提取率为27.9%,考虑到实际操作的便利性,将最佳工艺条件修正为加酶量16 800 U/g、缓冲液pH 3.0、料液比1∶30、提取时间21.5 h。为验证模型分析的准确性,在修正后的工艺条件下进行实验,做3 次平行,结果取平均值,得到马面鱼皮胶原蛋白的提取率为27.6%,与模型预测值相差0.014%,说明该模型可以较好地反映胃蛋白酶提取马面鱼皮胶原蛋白工艺条件的影响,且用Box-Behnken设计法对胃蛋白酶提取马面鱼皮胶原蛋白的工艺优化是可行的。
2.3.1 氨基酸分析
表4 马面鱼皮胶原蛋白氨基酸组成
Table 4 Amino acid composition of collagen from Thamnaconus modestus skin
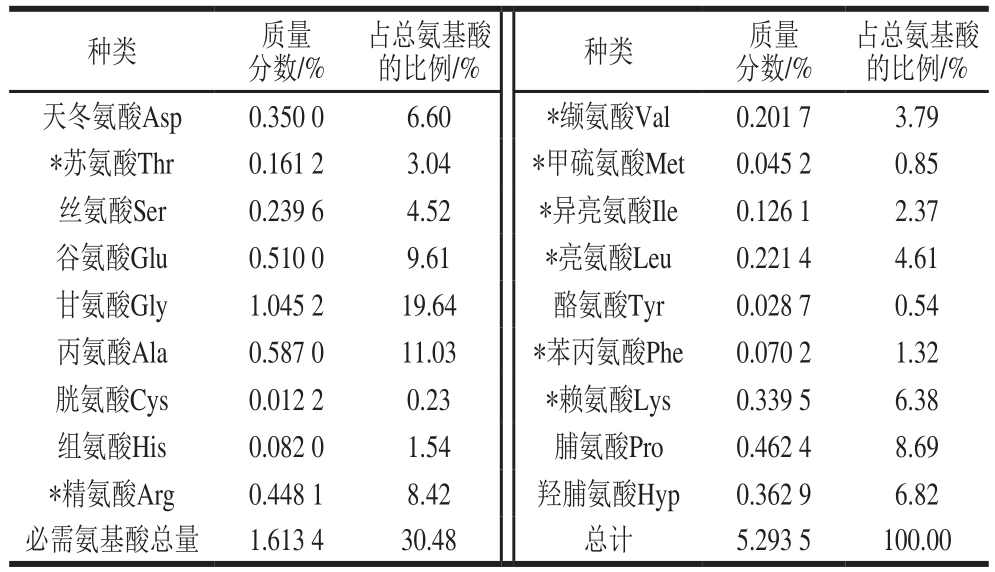
注:*.必需氨基酸。
一般胶原蛋白都由18 种不同氨基酸组合而成。从表4可以看出,马面鱼皮的胃蛋白酶提取产物中,含有18 种氨基酸,其中必需氨基酸有8 种,占总氨基酸含量的30.48%,缺少色氨酸,甲硫氨酸、酪氨酸、苯丙氨酸和胱氨酸含量较低,甘氨酸含量最高,约占总氨基酸含量的19.64%,同时脯氨酸、羟脯氨酸含量也较高,分别占总氨基酸含量的8.69%、6.82%,据楚水晶[9]报道胶原蛋白中含有18 种氨基酸,缺少色氨酸,大部分胶原蛋白特征芳香氨基酸(酪氨酸,苯丙氨酸)和胱氨酸含量较少,同时含有大量的脯氨酸和羟脯氨酸,其中脯氨酸含量一般应高于羟脯氨酸含量。马面鱼皮的胃蛋白酶提取产物中,氨基酸的组成成分与胶原蛋白的接近,且含量相似,据此可推断,马面鱼皮的胃蛋白酶提取产物可能为胶原蛋白。
2.3.2 紫外光谱分析
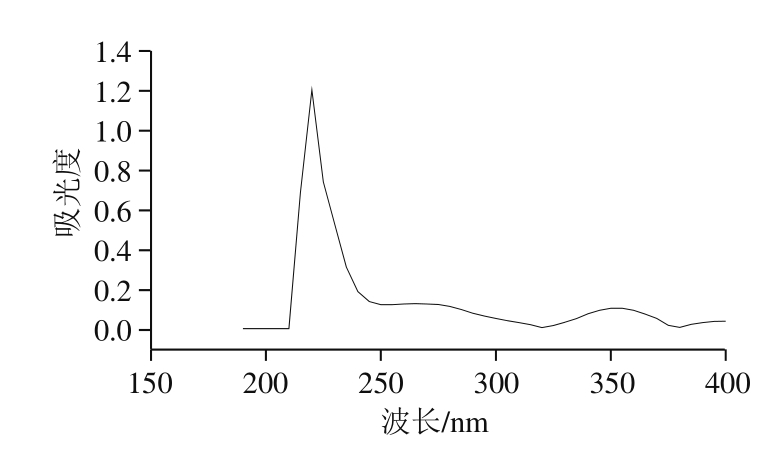
图6 马面鱼皮胶原蛋白的紫外吸收光谱
Fig. 6 UV absorption spectrum of collagen from T. modestus skin
由图6可知,胃蛋白酶提取马面鱼皮胶原蛋白在220 nm波长处有最大吸收峰,而在280 nm波长处无吸收峰,说明提取的胶原蛋白纯度较高[14]。实验所测和黄石溪[15]所测草鱼I型胶原蛋白吸光特性一致。胶原蛋白所含的—C=O、—COOH、CO—NH2等生色基团在225 nm波长附近对紫外光有较大吸收,本实验所提胶原蛋白在220 nm波长处吸收最大,这与报道胶原蛋白的紫外吸收特征相一致[16-17]。芳香族氨基酸在250~290 nm波长范围内有最大吸收,但根据胶原蛋白氨基酸组成可知,芳香族氨基酸,如酪氨酸、苯丙氨酸、色氨酸含量并不多,但吸收有所增强,其中苯丙氨酸、酪氨酸、色氨酸分别在257、275、280 nm波长处有最大吸收峰,所测结果符合3 种氨基酸吸收特性[18-20]。
2.3.3 红外光谱分析

图7 马面鱼皮胶原蛋白的红外光谱图
Fig. 7 Infrared spectrum of the collagen
由图7可知,3 412.8 cm-1附近为酰胺A带的N—H伸缩振动峰,证明氢键的存在[21-23],2 925.2 cm-1附近为胶原蛋白酰胺B带的C—N伸缩振动峰,胶原蛋白的高频酰胺A、B带直接与其超螺旋的三股螺旋构型相关[27]。1 650.4 cm-1附近为酰胺I带的C=O伸缩振动峰,也是α螺旋的COOH—反对称收缩振动峰,胶原蛋白的酰胺II带出现在1 530.7、1 438.2、1 370.8 cm-1处,它是由C—N伸缩振动和N—H弯曲振动、CH2弯曲、COO—对称伸缩共同引起的[24-29],1 080.2 cm-1附近为酰胺IV带的C=N伸缩振动峰。胶原蛋白红外吸收光谱与詹永献[26]所测草鱼鳔胶原蛋白红外吸收一致。出现1 650.4、1 080.2 cm-1和1 438.2 cm-1三个明显的吸收峰,分别位于酰胺I、酰胺IV带和酰胺II带的出峰位置,与文献中报道的鲤鱼皮胶原蛋白[24]、狭鳕鱼皮胶原蛋白[25]进行比较,表明马面鱼皮胶原蛋白具有完整的三螺旋结构。
2.3.4 SDS-PAGE分析
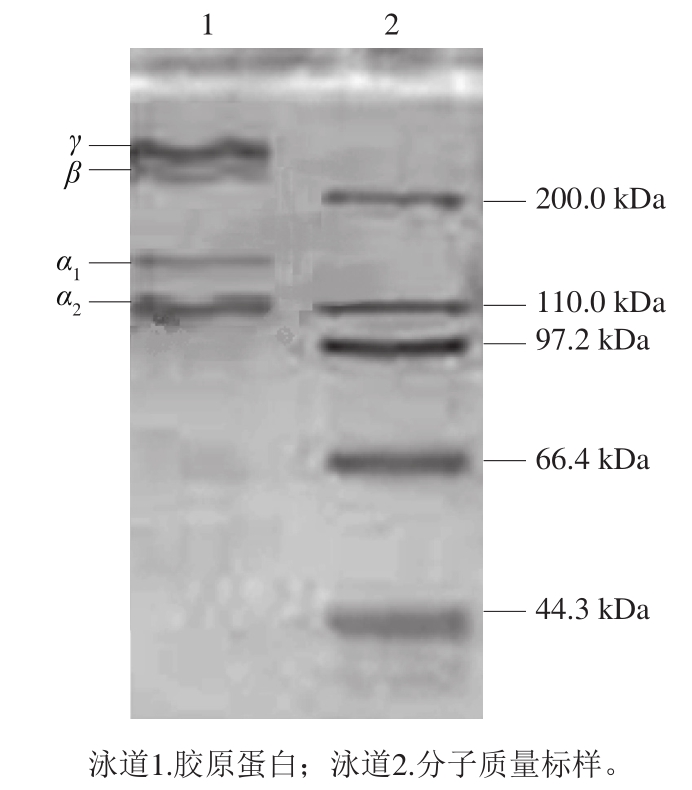
图8 马面鱼皮胶原蛋白的SDS-PAGE图谱
Fig. 8 SDS-PAGE profile of the collagen
由图8可知,马面鱼皮所提胶原蛋白有α1(α2)、β、γ链组成,α链分子质量在110~150 kDa之间,β、γ链分子质量在200 kDa以上,符合I型胶原蛋白结构特征,与文献[29-32]所测一致。电泳图谱无杂带,可见所提胶原蛋白纯度较高。
通过试验优化得到胃蛋白酶提取马面鱼皮胶原蛋白最佳条件为胃蛋白酶加酶量16 800 U/g、缓冲液pH 3.0、料液比1∶30(g/mL)、提取时间21.5 h,提取率为27.6%。同时对所提胶原蛋白进行氨基酸分析,紫外和红外光谱分析,SDS-PAGE分析,结果表明所提马面鱼皮胶原蛋白紫外最大吸收峰为225 nm,在1 650.4、1 080.2 cm-1处出现酰胺I、酰胺IV带和酰胺II带的红外吸收峰,含有α1(α2)、β、γ链,符合I型胶原蛋白特征,保留了完整的三螺旋结构。
参考文献:
[1] 温慧芳, 陈丽丽, 白春清, 等. 基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J]. 食品科学, 2016, 37(1): 74-81.DOI:10.7506/spkx1002-6630-201601014.
[2] 楚水晶, 农绍庄, 柳春山, 等. 酶法提取马面鱼鱼皮胶原蛋白的工艺研究[J]. 食品科技, 2010, 35(5): 234-237. DOI:10.13684/j.cnki.spkj.2010.05.022.
[3] 雷静, 李和生, 张丽媛, 等. 乌贼皮胶原蛋白的提取及结构表征[J].天然产物研究与开发, 2012, 24(5): 575-580. DOI:10.16333/j.1001-6880.2012.05.025.
[4] 曹少谦, 夏珊珊, 刘亮, 等. 马面鱼皮胶原蛋白的提取及其特性研究[J]. 中国食品学报, 2014, 14(10): 117-123. DOI:10.16429/j.1009-7848.2014.10.024.
[5] 梁健华. 超声波辅助提取罗非鱼皮胶原蛋白及其功能结构性质的研究[D]. 广州: 华南理工大学, 2015: 33-41.
[6] 杨玲, 赵燕, 鲁亮. 鲟鱼鱼皮胶原蛋白的提取及其理化性能分析[J].食品科学, 2013, 34(23): 41-45. DOI:10.7506/spkx1002-6630-201323010.
[7] 李燕, 王川. 胶原蛋白的分离纯化及氨基酸组成分析[J]. 食品科技,2007, 32(10): 135-139. DOI:10.13684/j.cnki.spkj.2007.10.015.
[8] 钟朝辉. 鱼鳞酶溶性胶原蛋白的提取、特性及其二级结构的温度效应研究[D]. 武汉: 华中农业大学, 2006: 10-13.
[9] 楚水晶. 马面鱼皮胶原蛋白的制备及特性研究[D]. 大连: 大连工业大学, 2010: 25-26.
[10] REZA M, MOHAMMAD A M, AMIR M M, et al. Extraction optimization of pepsin-soluble collagen from eggshell membrane by response surface methodology (RSM)[J]. Food Chemistry, 2016, 190:234-238.
[11] 李超, 杨文鸽, 徐大伦, 等. 电子束辐照对泥蚶肉营养成分的影响[J].核农学报, 2011, 25(5): 959-964.
[12] 周先碗, 胡晓倩. 生物化学仪器分析与实验技术[M]. 北京: 化学工业出版社, 2003: 22-25.
[13] ZHANG B, CHEN Y, WE X, et al. Optimization of conditions for collagen extraction from the swim bladders of grass carp(Ctenopharyngodon idella) by response surface methodology[J].International Journal of Food Engineering, 2010, 6(3): 1772-1792.
[14] 茅宇虹, 刘俊豪, 杨文鸽, 等. 鱿鱼皮胶原蛋白的提取条件优化及其特性分析[J]. 核农学报, 2014, 28(3): 459-466. DOI:1000-8551(2014)03-0459-08.
[15] 黄石溪. 草鱼不同部位胶原蛋白的提取及特性研究[D]. 长沙: 湖南农业大学, 2013: 35-40.
[16] 赵玉红, 高天. 鹿骨胶原蛋白特性的研究[J]. 食品科学, 2008, 29(7):43-47.
[17] 钟朝辉, 李春美, 顾海峰, 等. 草鱼鱼鳞酶溶性胶原蛋白的提取及基本特性[J]. 水产科学, 2007, 2: 91-95. DOI:10.16378/j.cnki.1003-1111.2007.02.008.
[18] 张建忠, 安辛欣, 王林, 等. 草鱼皮酸溶性和酶溶性胶原蛋白的提取及性质[J]. 食品科学, 2006, 27(12): 556-558.
[19] 张建忠. 草鱼皮胶原蛋白的制备及性质研究[D]. 南京: 南京农业大学, 2007.
[20] 杨树奇. 军曹鱼鱼皮胶原蛋白的提取与性质研究[D]. 湛江: 广东海洋大学, 2010.
[21] 刘丽莉, 马美湖, 杨协力. 牛骨I型胶原蛋白提取及结构表征[J]. 食品科学, 2010, 31(2): 87-92. DOI:10.7506/spkx1002-6630-201002021.
[22] 莫重文. 食品蛋白质化学与工艺学[M]. 北京: 化学工业出版社,2007: 87-88; 91.
[23] MYUNG C C, JUNZO T. FTIR Study for hydroxyapatie/collagen nanocomposite cross-linked by glutaraldehyde[J]. Biomaterials, 2002,23: 4811-4818.
[24] 段蕊, 张俊杰, 今野久仁彦, 等. 鲤鱼鱼皮和鱼骨酶溶性胶原蛋白的性质比较[J]. 食品与发酵工业, 2008, 34(5): 10-13. DOI:10.13995/j.cnki.11-1802/ts.2008.05.037.
[25] 张俊杰, 段蕊, 今野久仁彦, 等. 鲤鱼鱼皮胶原蛋白的提取及其性质研究[J]. 氨基酸和生物资源, 2008, 30(1): 18-21. DOI:10.14188/j.ajsh.2008.01.012.
[26] 詹永献. 草鱼鱼鳔胶原蛋白理化性质及结构特点的研究[D]. 洛阳:河南科技大学, 2012: 20-30.
[27] 蔡路昀, 马帅, 李秀霞, 等. 不同提取方法对鲽鱼皮胶原蛋白结构特征和功能性质的影响[J]. 食品与发酵工业, 2017, 43(5): 240-246.DOI:10.13995/j.cnki.11-1802/ts.201705039.
[28] 段宙位, 申铉日, 陈秀明, 等. 罗非鱼尾胶原蛋白的提取与鉴定[J].食品科学, 2012, 33(6): 59-64.
[29] 于玮, 王雪蒙, 马良, 等. 猪皮胶原蛋白提取过程中酶解条件优化及其结构鉴定[J]. 西南大学学报(自然科学版), 2015, 37(4): 106-113.DOI:10.13718/j.cnki.xdzk.2015.04.019.
[30] 蔡路昀, 马帅, 李秀霞. 不同提取方法对鲽鱼皮胶原蛋白结构特征和功能性质的影响[J]. 食品与发酵工业, 2017, 43(5): 241-245.DOI:10.13995/j.cnki.11-1802/ts.201705039.
[31] 陆剑锋, 万全, 殷章敏. 中华鳖裙边胶原蛋白的提取及其特征[J].水产学报, 2010, 34(6): 801-808. DOI:10.3724/SP.J.1231.2010.06800.
[32] GALARRETA M R, NAVARRO A, ANASORENA E. Unfolded protein response induced by Brefeldin A increases collagen type I levels in hepatic stellate cells through an IRE1α, p38 MAPK and Smad-dependent pathway[J]. Biochimica et Biophysica Acta, 2016,1863(8): 2115-2123. DOI:10.1016/j.bbamcr.2016.05.002.
Extraction and Structural Characterization of Collagen from Skin of Thamnaconus modestus
SONG Zhenggui, ZHU Lina, ZHANG Hongchao, XUE Zhangzhi, LI Hesheng*, FU Jingjing, ZHOU Wei
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Abstract:In order to provide an experimental basis for preparing collagen from the skin of Thamnaconus modestus,the conditions for enzymatic extraction of collagen from T. modestus skin with pepsin were optimized in this study,and we also analyzed the structure of the obtained collagen. A buffer pH of 3.0 for pretreatment, an enzyme dosage of 16 800 U/g, a solid-to-solvent ratio of 1:30 (g/mL) and a hydrolysis time of 21.5 h were found to be the optimum conditions to obtain a higher extraction yield of 27.6%. Amino acid analysis, UV spectroscopy, Fourier transform infrared spectroscopy,and sodium dodecyl sulfate-polyacrylamide-gel electrophoresis (SDS-PAGE) demonstrated that the collagen from T. modestus might be classified as type I collagen containing a unique triple helical structure.
Keywords:Thamnaconus modestus; collagen; extraction; structural characterization
SONG Zhenggui, ZHU Lina, ZHANG Hongchao, et al. Extraction and structural characterization of collagen from skin of Thamnaconus modestus[J]. Food Science, 2018, 39(20): 260-267. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820038. http://www.spkx.net.cn
引文格式:宋正规, 朱丽娜, 张洪超, 等. 胃蛋白酶提取马面鱼皮胶原蛋白及结构分析[J]. 食品科学, 2018, 39(20): 260-267.DOI:10.7506/spkx1002-6630-201820038. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0260-08
文献标志码:A
中图分类号:TS254.9;Q58
DOI:10.7506/spkx1002-6630-201820038
*通信作者简介:李和生(1960—),男,教授,硕士,研究方向为水产品加工与贮藏。E-mail:lihesheng@nbu.edu.cn
第一作者简介:宋正规(1989—),男,硕士研究生,研究方向为水产品加工与贮藏。E-mail:songzhenggui0@163.com
基金项目:浙江省科技厅重大科技专项(2009C03017-3)
收稿日期:2017-10-25