市售凉皮中金黄色葡萄球菌的肠毒素基因、耐药特征检测及SPA 分型
王盼盼1,李穗霞1,曾 琪2,周陆红1,张鹏飞1,王 新1,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.中国农业大学食品科学与营养学院,北京 100083)
摘 要:为监测并研究凉皮中金黄色葡萄球菌的污染情况,选取连锁超市、流动摊点、小餐馆和学校餐厅4 种销售渠道,在陕西杨凌地区进行为期一年的凉皮跟踪采样,共得样本432 个,金黄色葡萄球菌检出率为24.3%(105/432)。检测sea、seb、sec、sed、see、seg、seh、sei、sej 9 种肠毒素基因,sea携带率最高为96.2%(101/105),see次之为64.8%(68/105),还有部分seb和sec检出,检出率分别为54.3%(57/105)和49.5%(52/105),seh检出率为1.0%(1/105),sed、seg、sei、sej的检出率则均为0.0%(0/105)。研究针对青霉素、氨苄西林和苯唑西林等14 种常见药物进行耐药性实验,105 株来自阳性样本的金黄色葡萄菌全部具有耐药性,对青霉素和甲氧苄啶/磺胺甲恶唑耐受率为100.0%(105/105),对头孢哌酮、环丙沙星、万古霉素和阿米卡星均敏感。此外,多重(n≥3)耐药率高达90.5%(95/105),表型为青霉素-氨苄西林-甲氧苄啶/磺胺甲恶唑-阿莫西林/克拉维酸的耐药率最高,为61.9%(65/105)。检测105 株金黄色葡萄球菌的SPA型别,共包括4 种结果,优势型别为t701(81.9%,86/105),其次是t441(16.2%,17/105),t127和t796占比最少均为1.0%(1/105)。最终,发现该地区所售凉皮除学校餐厅外,其余3 种销售渠道的检出率均较高,且菌株具有较高的肠毒素基因携带率和耐药性,优势SPA型别为t701和t441,为相应监管部门提供一定理论指导。
关键词:金黄色葡萄球菌;肠毒素基因;SPA分型;耐药性
凉皮是陕西地区深受人们喜爱的即食食品之一,其入口爽滑、风味独特,一年四季皆宜食用。凉皮制作工艺简单,主要以普通面粉为原料,经和面、洗面后,保留面水进行二次过滤处理,再取适量面水于平底容器中隔沸水煮3~4 min,室温晾凉即可调制食用。在整个过程中,凉皮与从业人员接触频率极高,且食用前不需要进行热处理[1-2]。如果相关行业标准不明确、操作管理不规范,凉皮、凉拌菜、速冻食品等食物极易被致病微生物污染,金黄色葡萄球菌(Staphylococcus aureus)便是其中之一[2]。已有报道表明,在速冻米面制品、熟肉制品、凉拌菜等即食食品中常有金黄色葡萄球菌检出[3-5]。
金黄色葡萄球菌是自然界中极为常见的致病微生物之一,大约20%~30%的人口是金黄色葡萄球菌携带者[6]。不管是发达国家还是发展中国家,由金黄色葡萄球菌引起的食物中毒在整个细菌性食物中毒中均占有较大比例[7]。金黄色葡萄球菌引起食物中毒的主要原因是其可在食物中产生肠毒素,主要症状表现为呕吐、腹泻及腹绞痛[8-9]。现已报道的金黄色葡萄球菌肠毒素种类有24 种,其中包含19 种已经动物实验证明可产生催吐作用的肠毒素(SEA、SEB、SEC、SED、SEE、SEG、SEH、SEI、SEK、SEL、SEM、SEN、SEO、SEP、SEQ、SER、SES、SET)和5 种尚待证实可产生催吐作用的肠毒素(SE1J、SE1U2、SE1V、SE1X、SE1Y)[10]。
在检测爆发型流行病及相关致病因子时,金黄色葡萄球菌A蛋白(Staphylococcus pvotein A,SPA)分型方法得以广泛应用[11]。SPA是由Fc结合区域、X区域及C末端3 部分组成,其中X区域由可变数量的24 bp重复序列组成,呈现基因多态性,据此建立分型方法即SPA分型[12-14]。此外,由于抗生素滥用,致病微生物多呈现耐药性,金黄色葡萄球菌便是其中之一,典型代表为耐甲氧西林金黄色葡萄球菌[15]。一旦爆发由食品安全事件,相关致病菌较高的耐药性将给治疗带来难度。因此,对食源性金黄色葡萄球菌进行持续调查与耐药特征分析显得尤为重要。
为研究陕西特色小吃——凉皮中的金黄色葡萄球菌污染情况及其流行现状,本实验以陕西省杨凌地区为基点,选择连锁超市、学校餐厅、小餐馆、流动摊点4 种常见销售渠道,进行为期一年的定点跟踪采样。对金黄色葡萄球菌检测阳性样本中进行肠毒素基因检测、SPA分型及耐药特征分析,为该地区凉皮安全控制与监测提供科学依据和理论参考。
1 材料与方法
1.1 材料
1.1.1 实验菌株与标准菌株
实验所用凉皮样品由本实验室采集,对样品进行处理,最终分离得到105 株金黄色葡萄球菌用于实验,由本实验室保存;标准菌株大肠埃希氏菌(ATCC25922)和金黄色葡萄球菌(ATCC29213),由中国食品药品检定研究院惠赠。
1.1.2 试剂
胰蛋白胨大豆琼脂、胰蛋白胨大豆肉汤、甘露醇氯化钠琼脂、Baird-Parker琼脂、亚碲酸盐卵黄增菌液北京陆桥技术股份有限责任公司;聚合酶链式反应(polymerase chain reaction,PCR)用Taq DNA聚合酶、10×PCR buffer、dNTPs、Mg2+、DL2000 DNA Marker和引物 大连宝生物公司;药敏实验所用14 种抗生素:红霉素(erythromycin,Ery)、青霉素(penicillin,Pen)、头孢西丁(cefoxitin,Cefox)、氨苄青霉素(ampicillin,Amp)、阿莫西林/克拉维酸(amoxicillin/clavulanic acid,A/C)、苯唑西林(oxacillin,Oxa)、环丙沙星(ciprofloxacin,Cip)、利福平(rifampin,Rif)、万古霉素(vancomycin,Van)、四环素(tetracycline,Tet)、氯霉素(chloramphenicol,Chl)、头孢哌酮(cefoperazone,Cefop)、阿米卡星(amikacin,Amk)、甲氧苄啶/磺胺甲恶唑(trimethoprim/sulfamethoxazole,T/S) 美国Sigma公司。
1.2 仪器与设备
Mycircle PCR基因扩增仪、GEL DOC XR凝胶成像系统 美国伯乐公司;NU-425-400E超净工作台苏州安泰空气技术有限公司;Milli-Q Synthesis超纯水机德国默克密理博公司;微量移液枪 德国艾本德股份公司;GNP-9080隔水式恒温培养箱 上海精宏实验设备有限公司;MDF-U5411高压灭菌锅 上海申安高压仪器设备有限公司。
1.3 方法
1.3.1 样本采集
采集陕西省杨凌区市售凉皮为实验样本,2015年3月—2016年3月进行跟踪采样。采样地点包括连锁超市、学校餐厅、小餐馆、流动摊点4 种销售渠道,选取分散于杨陵区各方位的12 个销售点,共采集凉皮样本432 个。
1.3.2 样本处理
根据GB 4789.10—2010《食品微生物学检验 金黄色葡萄球菌检验》方法。称取25 g样品至盛有225 mL 0.9%的无菌生理盐水中,均质。用1 mL微量移液枪吸取1∶10样品匀液1 mL,沿管壁缓慢注于盛有9 mL稀释液的无菌试管中,充分混合均匀,制成1∶100的样品匀液。选择2 个适宜稀释度的样品匀液,在进行10 倍递增稀释时,每个稀释度分别吸取1 mL样品匀液,以0.3、0.3、0.4 mL接种量分别加入3 个Baird-Parker平板,然后用无菌L棒涂布整个平板,37 ℃培养适宜时间后,挑选典型菌落至甘露醇氯化钠平板再次培养筛选后,进行保菌。最后,通过PCR扩增金黄色葡萄球菌特异性基因nuc进行再次确认阳性菌株。
1.3.3 基因组提取
用灭菌后的棉签蘸取胰蛋白胨大豆琼脂培养基上的纯培养菌落,转移至装有1 000 μL灭菌蒸馏水的1.5 mL离心管中,振荡混匀。煮沸20 min后,置于离心机内,在12 000 r/min离心5 min[16],然后取上清液,密封于灭菌离心管内,于-40 ℃冰箱中保存备用。
1.3.4 PCR扩增与引物设计
PCR体系共25 μL,其中包括灭菌水15.775 μL、10×PCR buffer 2.5 μL、dNTPs 2 μL、MgCl21.5 μL、TaKaRa Taq酶0.125 μL、引物(上游引物,下游引物)各0.3 μL,DNA提取物2.5 μL。PCR条件和引物设计根据相关参考文献执行(表1),引物由大连宝生物公司合成。
表1 PCR扩增引物
Table 1 Oligonucleotide primers used in PCR

基因 上游引物 下游引物 产物大小/bp参考文献nuc GCGATTGATGGTGGTGATACGGTT AGCCAAGCCTTGACGAACTAAAGC 279 [17]sea AAAGATTTGCGAAAAAAGTGTGAATTTAAATCGTAATTAACCGAAGGTTCTG 521 [18]seb GTATGGTGGTGTAACTGAGC CCAAATAGTGACGAGTTAGG 164 [19]sec AGATGAAGTAGTTGATGTGTATGG CACACTTTTAGAATCAACCG 451 [19]sed CCAATAATAGGAGAAAATAAAAG ATTGGTATTTTTTTTCGTTC 278 [19]see AGGTTTTTTCACAGGTCATCC CTTTTTTTTCTTCGGTCAATC 209 [19]seg TGCTATCGACACACTACAACC CCAGATTCAAATGCAGAACC 704 [19]seh CGAAAGCAGAAGATTTACACG GACCTTTACTTATTTCGCTGTC 495 [19]sei GACAACAAAACTGTCGAAACTG CCATATTCTTTGCCTTTACCAG 630 [19]sej CATCAGAACTGTTGTTCCGCTAG CTGAATTTTACCATCAAAGGTAC 142 [19]
1.3.5 spa测序分型
s p a测序分型所使用引物序列根据网站(http://www.seqnet.org/)提供:spa-1113f(5’-TAAAGACGATCCTTCGGTGAGC-3’),spa-1514r(5’-CAGCAGTAGTGCCGTTTGCTT-3’)。测序由北京奥科鼎盛生物科技有限公司完成,运用Ridom Staph 软件(Ridom Gmb, Würzburg,Germany)对测序结果进行聚类分析。
1.3.6 药敏实验
采用临床和实验室标准协会推荐的琼脂稀释法测定抗生素对供试菌的最小抑菌浓度(minimum inhibitory concentrations,MlCs),确定14 种抗生素耐药表型。具体使用药物为:Pen、Amp、Oxa、Ery、Tet、Cefox、Cefop、Chl、Cip、Rif、Van、Amk、T/S、A/C。
2 结果与分析
2.1 金黄色葡萄球菌计数及检出率
本研究凉皮样本采集时间为2015年3月—2016年3月,针对所采集的432 份样本进行金黄色葡萄球菌的分离检测,其中105 份呈阳性,总检出率为24.3%(105/432)。对105 份阳性样本进行金黄色葡萄球菌计数,根据销售渠道、采样时间不同,选取12个采样点每月金黄色葡萄球菌计数结果最大值进行统计分析。如表2所示,凉皮中所含金黄色葡萄球菌数量分布于0.1~3.1(lg(CFU/g)),计数值最高点落于5月份从小餐馆采得的样品。计数结果中,分布于1.0~2.0(lg(CFU/g))水平的样本最多,且大都来自于流动摊点和小餐馆两种销售渠道。
对105 份样本进行金黄色葡萄球菌检出率结果统计,4 种销售渠道中,从连锁超市采得的凉皮金黄色葡萄球菌检出率最高为44.4%(16/36),流动摊点以31.5%(34/108)检出率次之,小餐馆检出率为21.0%(53/252),而学校餐厅的样本检出率最低为5.6%(2/36)。
表2 不同销售渠道金黄色葡萄球菌计数
Table 2 Counts of S. aureus in cold noodle samples from different distribution channels

销售渠道 编号 第1季度(lg(CFU/g)) 第2季度(lg(CFU/g)) 第3季度(lg(CFU/g)) 第4季度(lg(CFU/g))1月 2月 3月 4月 5月 6月 7月 8月 9月 10月 11月 12月大型超市(1) 1 1.5 0.0 1.9 2.2 1.0 2.3 2.0 1.7 2.2 0.0 0.0 0.3流动摊点(3) 2 0.0 0.0 0.0 1.5 2.3 2.2 1.7 0.3 1.3 0.0 0.6 0.0 3 1.8 0.0 0.0 2.7 1.8 2.0 1.7 1.1 0.0 2.1 0.9 0.0 4 0.0 0.0 0.0 1.4 0.6 2.3 0.9 1.3 0.9 2.3 0.3 0.3小餐馆(7) 5 0.0 0.0 2.3 1.2 0.0 2.8 0.0 0.0 1.3 0.0 0.0 2.4 6 1.8 0.9 1.1 2.5 3.1 0.8 2.2 0.0 0.0 2.0 2.2 0.0 7 0.3 0.0 0.0 0.3 0.0 0.0 1.3 1.9 0.0 0.0 0.0 0.0 8 0.0 0.0 0.6 1.3 0.0 0.0 0.9 0.0 2.8 0.0 1.3 0.0 9 0.0 0.0 0.0 2.4 2.1 1.8 2.7 2.2 2.8 1.7 0.0 2.4 10 0.0 1.9 0.9 1.3 0.0 0.0 0.0 0.0 1.5 0.0 0.0 0.0 11 0.0 0.0 0.3 0.0 0.0 1.7 0.0 0.0 0.0 0.0 0.0 0.0学校餐厅(1) 12 0.0 0.0 0.0 0.0 0.2 0.0 0.0 0.0 0.0 0.1 0.0 0.0
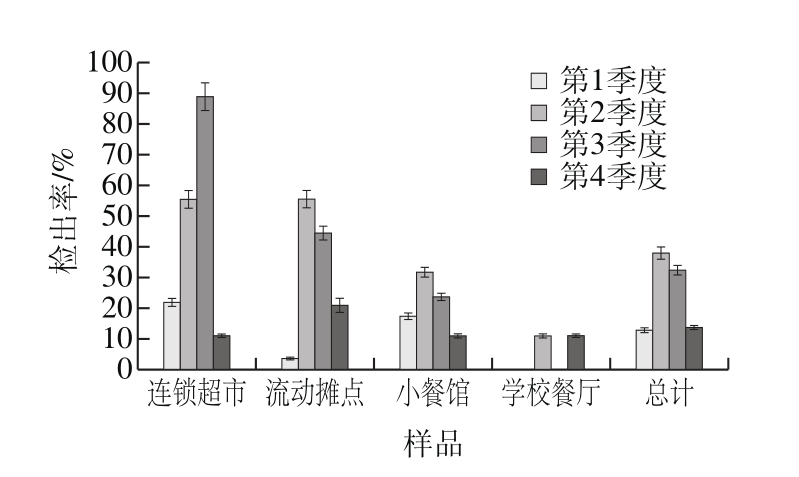
图1 不同季度金黄色葡萄球菌检出率
Fig. 1 Detection rate of S. aureus in different quarters
根据季度对采集样本分析,4 个季度中均有金黄色葡萄球菌检出。如图1所示,对比各销售渠道的不同季度检出率,除学校餐厅,其他3 种渠道均是第2、3季度金黄色葡萄球菌检出率最高,这与已有报道所示结果——由金黄色葡萄球菌引起的食物中毒多发于夏秋季节吻合[20-22]。综合统计4 个季度中的金黄色葡萄球菌检出率,第2季度金黄色葡萄球菌检出率最高为38.0%(41/108),第3季度以32.4%(35/108)的检出率次之,第4季度检出率13.9%(15/108)与第1季度检出率为13.0%(14/108)相对较低。
2.2 肠毒素基因检出率
由携带sea、seb、sec、sed、see基因的金黄色葡萄球菌引起的食物中毒占金黄色葡萄球菌食物中毒的95%[3],另有报道表明,越来越多不同类别食物中有新型肠毒素基因seg、seh、sei、sej的检出[23]。故本研究选择这9 种肠毒素基因进行检测,各销售渠道肠毒素基因检出结果如表3所示。结果表明,105 株金黄色葡萄球菌的肠毒素基因携带率高达100%(105/105)。9 种肠毒素基因中,sea检出率最高为96.2%(101/105),see次之为64.8%(68/105),还有部分seb和sec检出,检出率分别为54.3%(57/105)和49.5%(52/105),seh检出率为1.0%(1/105),sed、seg、sei、sej的检出率则均为0.0%(0/105)。对于4 种销售渠道,连锁超市菌株主要携带sea(93.8%,12 /16)和seb(75.0%,12/16),流动摊点和小餐馆则主要携带sea(97.1%,33/34;96.2%,51/53)和see(67.6%,23/34;64.2%,34/53)。此外,这些菌株携带2 种及其以上肠毒素基因的概率较高,为90.5%(95/105)。携带3 种肠毒素基因概率相对较高为37.1%(39/105),同时携带4 种肠毒素基因的概率为19.0%(20/105),且其肠毒素基因表型为sea-seb-sec-see。
表3 肠毒素基因检出结果
Table 3 Results of detection of enterotoxin genes
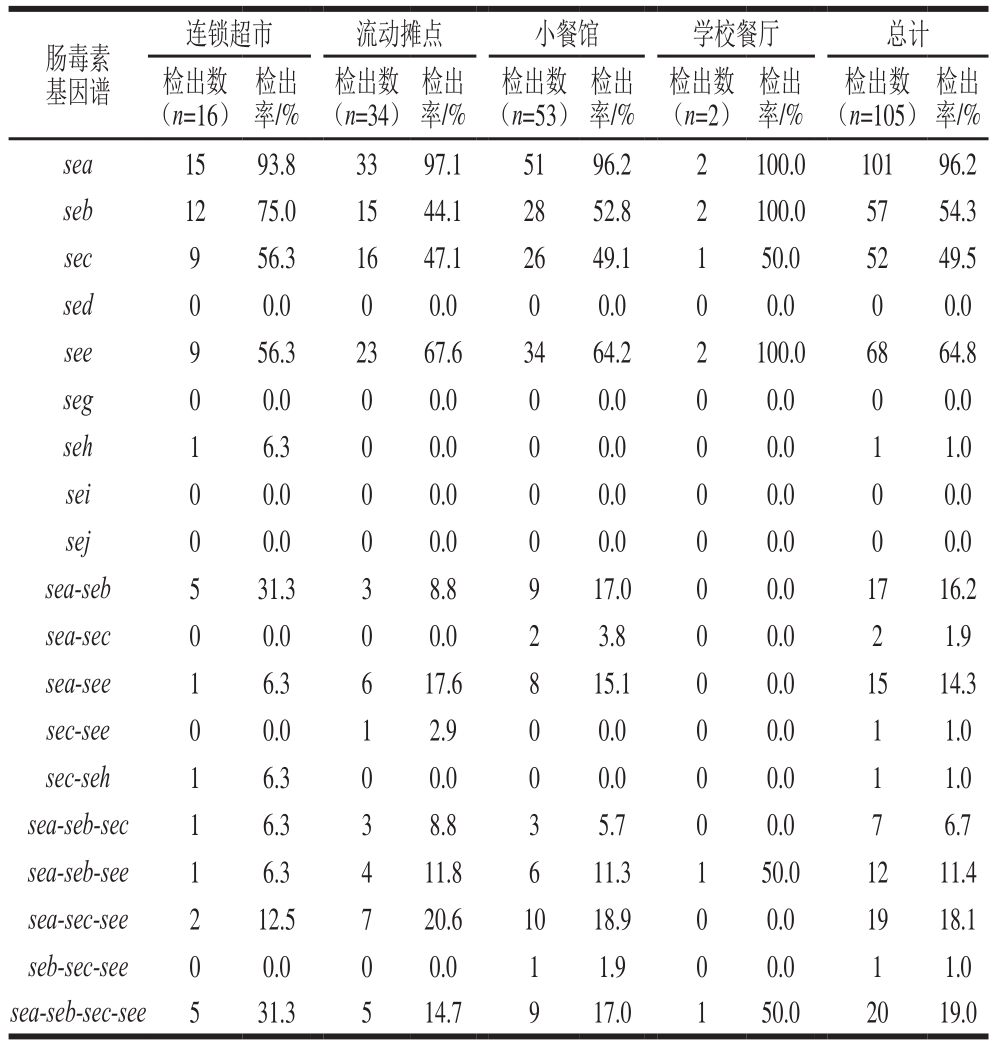
检出率/%sea 15 93.8 33 97.1 51 96.2 2 100.0 101 96.2 seb 12 75.0 15 44.1 28 52.8 2 100.0 57 54.3 sec 9 56.3 16 47.1 26 49.1 1 50.0 52 49.5 sed 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 see 9 56.3 23 67.6 34 64.2 2 100.0 68 64.8 seg 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 seh 1 6.3 0 0.0 0 0.0 0 0.0 1 1.0 sei 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 sej 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 sea-seb 5 31.3 3 8.8 9 17.0 0 0.0 17 16.2 sea-sec 0 0.0 0 0.0 2 3.8 0 0.0 2 1.9 sea-see 1 6.3 6 17.6 8 15.1 0 0.0 15 14.3 sec-see 0 0.0 1 2.9 0 0.0 0 0.0 1 1.0 sec-seh 1 6.3 0 0.0 0 0.0 0 0.0 1 1.0 sea-seb-sec 1 6.3 3 8.8 3 5.7 0 0.0 7 6.7 sea-seb-see 1 6.3 4 11.8 6 11.3 1 50.0 12 11.4 sea-sec-see 2 12.5 7 20.6 10 18.9 0 0.0 19 18.1 seb-sec-see 0 0.0 0 0.0 1 1.9 0 0.0 1 1.0 sea-seb-sec-see 5 31.3 5 14.7 9 17.0 1 50.0 20 19.0肠毒素基因谱连锁超市 流动摊点 小餐馆 学校餐厅 总计检出数(n=16)检出率/%检出数(n=34)检出率/%检出数(n=53)检出率/%检出数(n=2)检出率/%检出数(n=105)
2.3 耐药性检测结果(多重(n≥3))
随着抗性药物的广泛应用,金黄色葡萄球菌的耐药性发生了很大变化。本研究对分离自凉皮的105 株金黄色葡萄球菌进行14 种常见药物的耐受性检测,所有菌株100.0%耐药。如表4所示,14 种药物中,金黄色葡萄球菌对青霉素类药品——青霉素和叶酸代谢途径抑制剂类药品——T/S均100.0%耐药,其次对氨苄西林(84.8%)和A/C(87.6%)有较高耐受率,对Ery(26.7%)和Cefox(24.8%)有一定耐受力,对Cefop、Cip、Amk和Van的耐受力最低均为0.0%。就药物类别来说,研究样本对青霉素类和四环素类药物具有较高耐受性。
表4 凉皮中金黄色葡萄球菌的耐药情况
Table 4 Antimicrobial resistance profiles of S. aureus isolated from cold noodles

分类(n=10) 抗菌药(n=14) 耐受值/(μg/mL) 菌株数 耐药率/%Pen 8 105 100.0 Amp 0.5 89 84.8 Oxa 4 8 7.6四环素类(2) Ery 8 28 26.7 Tet 16 7 6.7头孢类(2) Cefox 8 26 24.8 Cefop 64 0 0.0氯霉素类(1) Chl 32 2 1.9大环内酯类(1) Cip 4 0 0.0利福霉素类(1) Rif 4 3 2.9糖肽类(1) Van 16 0 0.0氟喹诺酮类(1) Amk 64 0 0.0叶酸代谢途径抑制剂(1) T/S 4/76 105 100.0其他类(1) A/C 8/4 92 87.6青霉素类(3)
表5 金黄色葡萄球菌多重(n≥3)耐药谱
Table 5 Multi-antimicrobial resistance pro fi les of S. aureus isolates
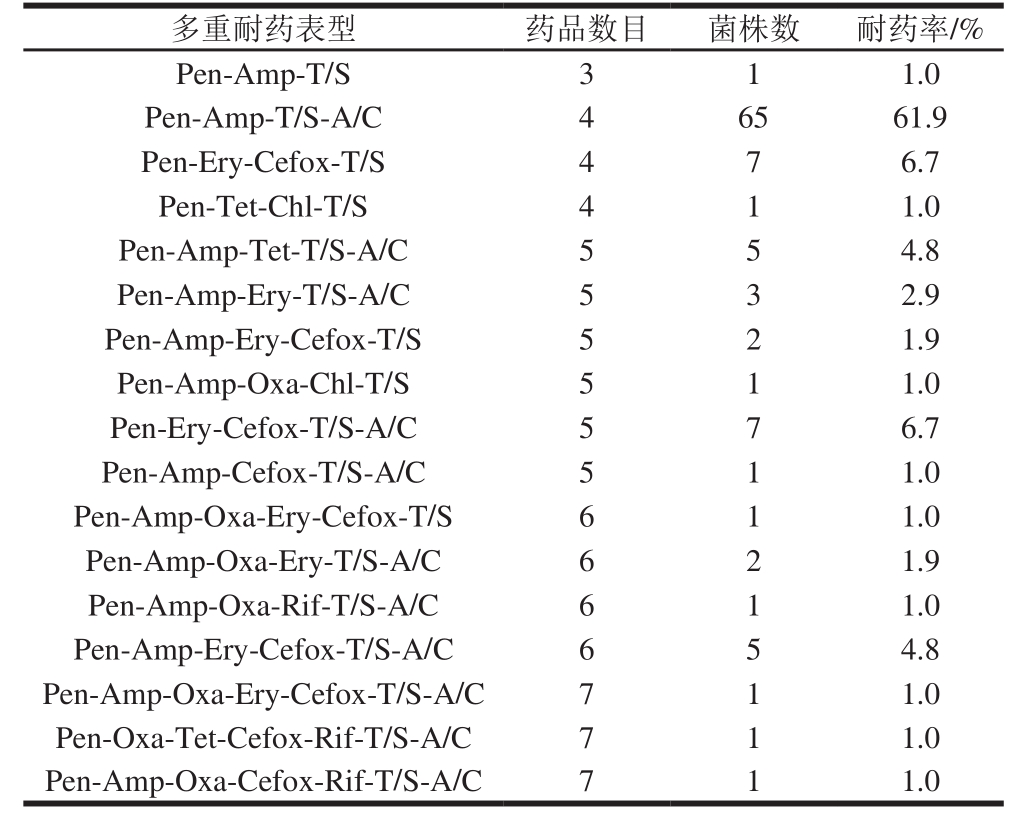
多重耐药表型 药品数目 菌株数 耐药率/%Pen-Amp-T/S 3 1 1.0 Pen-Amp-T/S-A/C 4 65 61.9 Pen-Ery-Cefox-T/S 4 7 6.7 Pen-Tet-Chl-T/S 4 1 1.0 Pen-Amp-Tet-T/S-A/C 5 5 4.8 Pen-Amp-Ery-T/S-A/C 5 3 2.9 Pen-Amp-Ery-Cefox-T/S 5 2 1.9 Pen-Amp-Oxa-Chl-T/S 5 1 1.0 Pen-Ery-Cefox-T/S-A/C 5 7 6.7 Pen-Amp-Cefox-T/S-A/C 5 1 1.0 Pen-Amp-Oxa-Ery-Cefox-T /S 6 1 1.0 Pen-Amp-Oxa-Ery-T/S-A/C 6 2 1.9 Pen-Amp-Oxa-Rif-T/S-A/C 6 1 1.0 Pen-Amp-Ery-Cefox-T/S-A/C 6 5 4.8 Pen-Amp-Oxa-Ery-Cefox-T/S-A/C 7 1 1.0 Pen-Oxa-Tet-Cefox-Rif-T/S-A/C 7 1 1.0 Pen-Amp-Oxa-Cefox-Rif-T/S-A/C 7 1 1.0
/S 6 1 1.0 Pen-Amp-Oxa-Ery-T/S-A/C 6 2 1.9 Pen-Amp-Oxa-Rif-T/S-A/C 6 1 1.0 Pen-Amp-Ery-Cefox-T/S-A/C 6 5 4.8 Pen-Amp-Oxa-Ery-Cefox-T/S-A/C 7 1 1.0 Pen-Oxa-Tet-Cefox-Rif-T/S-A/C 7 1 1.0 Pen-Amp-Oxa-Cefox-Rif-T/S-A/C 7 1 1.0
统计分析样本金黄色葡萄球菌的多重(n≥3)耐药情况,如表5所示,105 株金黄色葡萄球菌至少耐受3 种药物。其中,出现对4 种药物具有耐受性的概率最高,为69.5%(73/105),且主要表型为耐受Pen-Amp-T/S-A/C(61.9%,65/105)。当药品数目大于5 种(包含5 种)时,菌株的耐受率为29.5%(31/105)。研究还发现有3 株金黄色葡萄球菌耐药数目高达7 种,它们均对Pen、Cefox、T/S和A/C耐药,差异性体现在对Oxa、Ery和Rif的耐受性上。
2.4 SPA型检测结果
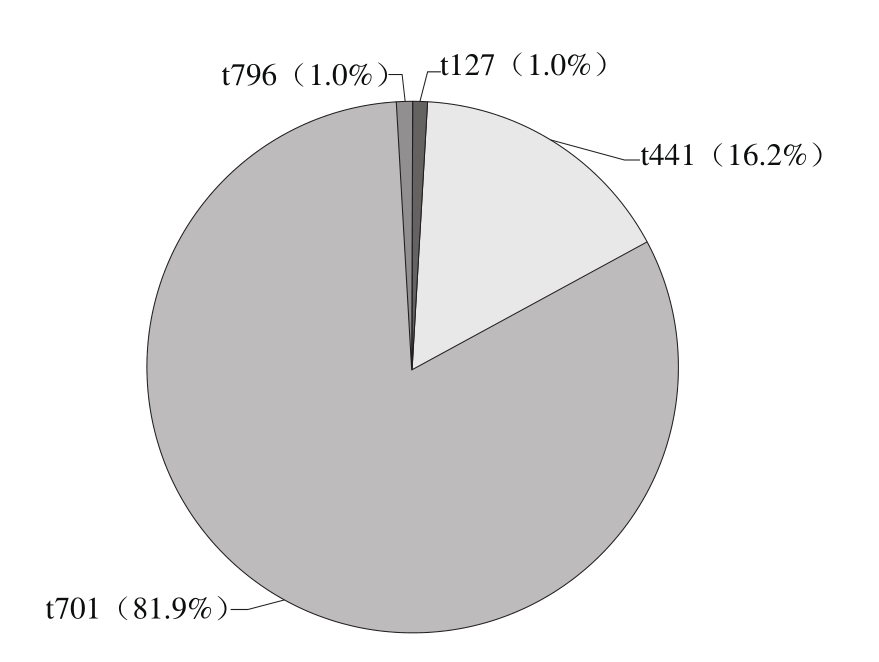
图2 105 株金黄色葡萄球菌的SPA型别
Fig. 2 SPA types of 105 S. aureus isolates
对105 株金黄色葡萄球菌进行spa扩增,送样检测并分析SPA型别。如图2所示,所检样本SPA型别主要以t701(81.9%,86/105)为主,其次为t441(16.2%,17/105),t127和t796占比最少(1.0%,1/105)。分析优势SPA型别t701和t441的肠毒素基因携带情况:t701主要携带sea(97.7%,84/86)和see(74.4%,64/86),sec(55.8%,48/86)和seb(46.5%,40/86)的携带率次之、t441的17株金黄色葡萄球菌100%携带肠毒素基因sea和seb,携带see的概率为23.5%(4/17),携带sec的概率为11.8%(2/17)。此外,这2 种SPA型别对于sed、seg、seh、sei、sej的携带率则均为0.0%。
3 讨 论
本研究在陕西杨凌地区定点选取12 个采样点,涵盖连锁超市(1 个)、流动摊点(3 个)、小餐馆(7 个)和学校餐厅(1 个)4 种该地区人们常选择的凉皮销售渠道,进行为期1 a的凉皮跟踪采样监测实验。最终,采集凉皮样本432 个,有金黄色葡萄球菌分离检出的样本为105 个,检出率为24.3%。研究发现,杨凌区市售凉皮中金黄色葡萄球菌阳性样本检出多发生在夏秋季节,其中第2季度检出率最高(38.0%),其次为第3季度(32.4%),第1季度(13.0%)、第4季度(13.9%)相对较低。金黄色葡萄球菌是典型的环境微生物之一,在37 ℃可稳定生长,空气、灰尘、人手上均有存在。第2、3季度属夏秋季节,环境温度相对较高,而凉皮在从餐厅至饭桌的过程中有较大机会与从业人员接触,因此大大增加了凉皮被金黄色葡萄球菌污染的概率。在4 种销售渠道中,连锁超市的金黄色葡萄球菌检出率最高(44.4%),流动摊点(31.5%)和小摊点(21.0%)的检出率次之,学校餐厅的检出率最低(5.6%)。
研究者走访连锁超市发现,凉皮在被购买前大量保藏在室温环境,且在相应货架上搁置时间较长(9:00~21:00),此存放环境适宜金黄色葡萄球菌生长。此外,超市人流量大,顾客随意碰触到凉皮的可能性高,这大大增加了凉皮被金黄色葡萄球菌污染的概率。一旦有少量金黄色葡萄球菌被带入凉皮中,即可大量繁殖生长,严重者则会爆发食品安全事件。对于流动摊点销售渠道,它们没有固定的销售地点,贮藏方式简便且销售环境多变,多数从业者甚至在不佩戴食品级一次性手套的情况下称取凉皮,故凉皮被污染概率极高。相对流动摊点,小餐馆的销售环境较为良好,但依然存在餐具消毒不严格、从业人员未佩戴口罩和手套现象。因杨凌地区学生数量较大,故选择某学校餐厅作为采样点。研究者调研发现该校餐饮安全把控较为严格、操作相对规范,故所售卖的凉皮被污染概率最低。对比这4 种销售渠道,人们有较大概率选择在小餐馆、流动摊点购食凉皮,连锁超市也是选择之一,而这3 种渠道所售凉皮均具有较高的金黄色葡萄球菌检出率,这表明相关行业从在较高的食品安全隐患。
针对常见致病微生物进行耐药性研究是现代食品安全检测行业常做的项目之一,本研究针对105株金黄色葡萄球菌进行药敏实验。在研究选取的14 种常见药品中,涵盖10 种药品类型,结果表明105 株金黄色葡萄球菌的耐药率高达100%,且呈现多重(n≥3)趋势。对于青霉素类、四环素类、叶酸代谢途径抑制剂类和其他类(A/C)药物具有较高耐受性,对于糖肽类的Van、大环内脂类的Cip以及氟喹诺酮类的阿米卡星则均不具有耐受性。在分析多重(n≥3)耐药结果时发现,表型为Pen-Amp-T/S-A/C时105 株金黄色葡萄球菌的耐受率最高达61.9%,这4 种药品中,有2 种(Pen和Amp)属青霉素类药物。
研究中的105 株金黄色葡萄球菌不仅具有较高耐药性,还具有较高的肠毒素基因携带率。肠毒素是金黄色葡萄球菌产生的典型致病因子之一,具有较高的热稳定性,可在100 ℃煮沸30 min不被破坏,亦能抵抗胃肠道中蛋白酶的水解作用[24-25]。此外,肠毒素的产生与环境条件(如水分活度、酸碱度及温度等)密切相关。研究表明,当环境温度为37 ℃,水分活度大于0.85,酸碱度接近于0.74且氧气和二氧化碳充分的条件下,金黄色葡萄球菌可保持较高的生长速度,产生大量的肠毒素[26]。凉皮制作通常在室温(25 ℃)下即可进行,在此温度下金黄色葡萄球菌亦可生长繁殖。同时,凉皮是以普通面粉为主要原料,经过和面、洗面等前处理工序,将面水隔水蒸熟3~4 min左右制成。此加工过程并未有足够且充分的杀菌、灭菌工序,而金黄色葡萄球菌产生的肠毒素一旦形成即使加热充分也不能将其彻底消灭[27-28],且广泛引发食物中毒事件的A型肠毒素在酸碱度pH值大于4.5的情况下即可产生[29],这大大增加了凉皮被金黄色葡萄球菌污染的概率。实际生活中,凉皮的销售地点以小餐馆为主,此途径售卖的凉皮制品贮存十分简便,通常在开放、未经严格消毒处理的托盘中放置,仅有部分食品贮藏设施配备齐全的销售点会采取低温、封闭的贮藏方式,这大大增加了凉皮进入餐桌前被金黄色葡萄球菌污染的可能性。综合凉皮的制作过程,一旦有金黄色葡萄球菌侵入制作凉皮原料或所使用器具,便极易快速生长繁殖,产生肠毒素,导致食品安全事件的发生。
本研究通过对分离所得的金黄色葡萄球菌株进行检测,发现该地区所售凉皮含有的金黄色葡萄球菌携带肠毒素基因以sea(96.2%)最多,同时携带2 种及其以上肠毒素基因的概率高达90.5%,且主要以携带sea~see 5 种经典肠毒素基因为主。事实上,由金黄色葡萄球菌引起的食物中毒多数是由肠毒素SEA所引起,而本研究中的金黄色葡萄球菌可编码此蛋白的基因sea携带率又极高。研究对105株金黄色葡萄球菌进行SPA型别检测,分析发现该地区金黄色葡萄球菌的SPA优势型别为t701(73.7%),其次还有部分t441(16.2%)。现有报道表明,分离自陕西西安地区食物中毒的金黄色葡萄球菌其SPA型别为t701[30]。此外,t701是相关城市由金黄色葡萄球菌引起食物中毒的2 种SPA型别之一(另一种为t189)[31]。分析本研究中86 株t701金黄色葡萄球菌的sea~sei 9 种肠毒素基因携带情况:sea携带率最高为97.7%,see次之为74.4%,sec和seb相对较高分别为55.8%和46.5%,其余均为0.0%。
本研究针对杨凌4 种销售渠道进行定点跟踪检测,结果发现105 株金黄色葡萄球菌株的肠毒素基因、SPA分型结果具有较高稳定性,具体表现在spa-t701及肠毒素基因sea、see的高检出率。分析原因,其一是该种SPA型别可长期且较稳定存在于陕西杨凌区凉皮食品中;其二是本研究选择长期定点的采样方式,所获得样本的检测结果在一定程度上具有重复性;其三是陕西杨凌区覆盖面积有限,检测结果呈现相对稳定性。
参考文献:
[1] CHAJĘ‘CKA-WIERZCHOWSKA W, ZADERNOWSKA A,NALEPA B, et al. Retail ready-to-eat food as a potential vehicle for Staphylococcus spp. harboring antibiotic resistance genes[J]. Journal of Food Protection, 2014, 77(6): 993-998. DOI:10.4315/0362-028X.JFP-13-466.
[2] YANG X J, ZHANG J M, YU S B, et al. Prevalence of Staphylococcus aureus and methicillin-resistant Staphylococcus aureus in retail readyto-eat foods in China[J]. Frontiers in Microbiology, 2016, 7(816): 1-7.DOI:10.3389/fmicb.2016.00816.
[3] 诸葛石养, 谭冬梅, 李秀桂. 广西速冻米面制品金黄色葡萄球菌肠毒素分型及耐药性研究[J]. 现代预防医学, 2015, 42(10): 1765-1767.
[4] 彭莎莎. 2011-2015年灵宝市8 类市售即食食品中金黄色葡萄球菌监测结果分析[J]. 河南预防医学杂志, 2016, 27(7): 546-548.DOI:10.13515/j.cnki.hnjpm.1006-8414.2016.07.022.
[5] YANG S R, PEI X Y, WANG G, et al. Prevalence of foodborne pathogens in ready-to-eat meat products in seven different Chinese regions[J]. Food Control, 2016, 65: 92-98. DOI:10.1016/j.foodcont.2016.01.009.
[6] MOHAMMED E Y, ABDEL-RHMAN S H, BARWA R, et al. Studies on enterotoxins and antimicrobial resistance in Staphylococcus aureus isolated from various sources[J]. Advances in Microbiology, 2016,6(4): 263-275. DOI:10.4236/aim.2016.64026.
[7] 邓泽静, 李毅, 洪程基, 等. 食品中金黄色葡萄球菌污染状况及其毒素检测[J]. 浙江预防医学, 2011, 23(2): 92-93. DOI:10.3969/j.issn.1007-0931.2011.02.043.
[8] COSTALUNGA L G, REGINA L M, SOPEÑA C L, et al.Assessing the epidemiological data of Staphylococcus aureus food poisoning occurred in the State of Rio Grande do Sul, Southern Brazil[J]. Brazilian Journal of Microbiology, 2013, 44(3): 759-763.DOI:10.1590/S1517-83822013005000063.
[9] FETSCH A, CONTZEN M, HARTELT K, et al. Staphylococcus aureus food-poisoning outbreak associated with the consumption of ice-cream[J]. International Journal of Food Microbiology, 2014,186(1): 1-2. DOI:10.1016/j.ijfoodmicro.2014.06.017.
[10] ARGUDIN M A, MENDOZA M C, RODICIO M R. Food poisoning and Staphylococcus aureus enterotoxins[J]. Toxins (Basel), 2010, 2(7):1751-1773. DOI:10.3390/toxins2071751.
[11] 毛镭篥, 肖盟, 王贺, 等. 全国多中心细菌耐药监测网中血流感染相关金黄色葡萄球菌的分子流行病学研究[J]. 中国感染与化疗杂志,2015, 15(2): 120-125. DOI:10.3969/j.issn.1009-7708.2015.02.003.
[12] SHOPSIN B, GOMEZ M, MONTGOMERY S O, et al. Evaluation of protein A gene polymorphic region DNA sequencing for typing of Staphylococcus aureus strains[J]. Journal of Clinical Microbiology,1999, 37(11): 3556-3563.
[13] FRENAY H M E, BUNSCHOTEN A E, SCHOULS L M, et al.Molecular typing of methicillin-resistant Staphylococcus aureus on the basis of protein A gene polymorphism[J]. European Journal of Clinical Microbiology & Infectious Diseases, 1996, 15(1): 60-64.DOI:10.1007/BF01586186.
[14] FRENAY H M, THEELEN J P, SCHOULS L M, et al. Discrimination of epidemic and nonepidemic methicillin-resistant Staphylococcus aureus strains on the basis of protein A gene polymorphism[J]. Journal of Clinical Microbiology, 1994, 32(3): 846-847.
[15] BHATI T, KATARIA A K, NATHAWAT P, et al. Antimicrobial susceptibility profiling of Staphylococcus aureus isolates from bovine subclinical mastitis[J]. Veterinary Research, 2013, 6(2): 39-42.DOI:10.3923/vr.2013.39.42.
[16] 王新, 韦艺媛, 张静, 等. 乳房炎奶牛金黄色葡萄球菌毒素基因的检测及PFGE分型研究[J]. 畜牧兽医学报, 2011, 42(7): 974-980.
[17] BRAKSTAD O G, AASBAKK K, MAELAND J A. Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene[J]. Journal of Clinical Microbiology, 1992, 30(7): 1654-1660. DOI:10.1038/s41598-017-11597-z.
[18] MARTÍN M C, GONZ Á LEZ-HEVIA M A, MENDOZA M C. Usefulness of a two-step PCR procedure for detection and identification of enterotoxin genic Staphylococci of bacterial isolates and food samples[J]. Food Microbiology, 2003, 20(5): 605-610.DOI:10.1016/S0740-0020(02)00180-6.
[19] PELES F, WAGNER M, VARGA L, et al. Characterization of Staphylococcus aureus strains isolated from bovine milk in Hungary[J]. International Journal of Food Microbiology, 2007, 118(2):186-193. DOI:10.1016/j.ijfoodmicro.2007.07.010.
[20] GROTTO I, MANDEL Y, ASHKENAZI I, et al. Epidemiological characteristics of outbreaks of diarrhea and food poisoning in the Israel Defense Forces in the years 1978-1995[J]. Harefuah, 1997, 133(7/8):255-264; 336.
[21] 袁月明, 黄锐敏, 陈辉, 等. 南山区2004年细菌性食物中毒检验结果与分析[J]. 现代预防医学, 2007, 34(1): 86-87. DOI:10.3969/j.issn.1003-8507.2007.01.039.
[22] 周有森. 35 例细菌性食物中毒分析[J]. 临床医学工程, 2009, 16(9):95-96. DOI:10.3969/j.issn.1003-8507.2007.01.039.
[23] MURRAY B E. New aspects of antimicrobial resistance and the resulting therapeutic dilemmas[J]. Journal of Infectious Diseases,1991, 163(6): 1184-1194. DOI:10.1093/infdis/163.6.1185.
[24] 杨波. 乌鲁木齐地区奶牛隐性乳房炎主要致病菌分析及金黄色葡萄球菌毒力基因检测的研究[D]. 乌鲁木齐: 新疆农业大学, 2009: 4-53.
[25] 任天红, 刘景武, 付素兰. 金黄色葡萄球菌肠毒素检测方法的应用及进展[J]. 河北医药, 2008, 30(8): 1224-1226. DOI:10.3969/j.issn.1002-7386.2008.08.084.
[26] 徐振波, 刘晓晨, 李琳, 等. 金黄色葡萄球菌肠毒素在食源性微生物中的研究进展[J]. 现代食品科技, 2013(9): 2317-2324.DOI:10.13982/j.mfst.1673-9078.2013.09.020.
[27] MARGOSCH D, MORAVEK M, GÄNZLE M G, et al. Effect of high pressure and heat on bacterial toxins[J]. Food Technology &Biotechnology, 2005, 43(3): 211-217.
[28] FRIEDMAN M, RASOOLY R, DOE P M, et al. The olive compound 4-hydroxytyrosol inactivates Staphylococcus aureus, bacteria and Staphylococcal enterotoxin A (SEA)[J]. Journal of Food Science,2011, 76(8): M558-M563. DOI:10.1111/j.1750-3841.2011.02365.x.
[29] 王彤. 金黄色葡萄球菌在搅打奶油中的生长、产肠毒素条件及其抑制方法研究[D]. 上海: 上海海洋大学, 2015: 1-58.
[30] LI G, WU S, LUO W, et al. Staphylococcus aureus ST6-t701 isolates from food-poisoning outbreaks (2006-2013) in Xi’an, China[J].Foodborne Pathogens & Disease, 2015, 12(3): 203-206. DOI:10.1089/fpd.2014.1850.
[31] WANG Y L, WANG D C, ZHAN S W, et al. Identification of Staphylococcus aureus and SPA polymorphisms in Ma’anshan City[J].Journal of Public Health & Preventive Medicine, 2011, 22(4): 50-53.
Toxin Gene Profiles, Antimicrobial Resistance, and SPA Typing of Staphylococcus aureus Isolated from Commercial Cold Noodles
WANG Panpan1, LI Suixia1, ZENG Qi2, ZHOU Luhong1, ZHANG Pengfei1, WANG Xin1,*
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract:In order to monitor and assess the contamination level of Staphylococcus aureus in cold noodles, a total of 432 cold noodles samples were collected from supermarkets, street vendor stalls, restanuants and campus canteens in Yangling,Shaanxi Province and screened for S. aureus over one year. Of these, 105 samples (24.3%) were positive for S. aureus, and the S. aureus isolates were characterized by anti-microbial susceptibility testing and PCR for detecting nine enterotoxin genes(sea to sej). All the isolates were found positive for at lest one enterotoxin gene. The genes sea (96.2%) was detected in almost all the isolates, followed by see (64.8%), and seb and sec were also found in 57 (54.3%) and 52 (49.5%) and she in only one (1.0%) of these 105 isolates. On the other hand, sed, seg, seh, sei, and sej were not found. In addition, all the S. aureus isolates were resistant to at least one of 14 common antimicrobial agents and 90.5% of them were multiresistant to three or more anti-microbials. Resistance to penicillin and trimethoprim/sulfamethoxazole (each 100.0%) was most frequently detected, and all the isolates were sensitive to ceftriaxone, ciprof l oxacin, vancomycin and amikacin. The multidrug resistance to penicillin ampicillin, trimethoprim/sulfamethoxazole and amoxicillin/clavulanic acid (Pen-Amp-T/S-A/C)was detected in 65 (61.9%) of the 105 isolates and was identied to be the most predominant. Morever, all the isolates were spa typed. A total of 4 different spa types were detected among the 105 S. aureus isolates. The results showed that S. aureus SPA-t701 (81.9%) was the most predominant clone, followed by SPA-t441 (16.2%),while SPA-t127 and SPA-t796 were the lowest (each 1.0%). In summary, this study indicates that S. aureus isolated from cold noodles in chain supermarket, street food stalls, and strains have higher drug resistance and probability to carry enterotoxin genes. Morever, the dominant SPA types are t701 and t441. Thus, these fi ndings can provide some theoretical guidance to regulatory authorities concerned.
Keywords:Staphylococcus aureus; enterotoxin genes; SPA typing; antimicrobial susceptibility
WANG Panpan, LI Suixia, ZENG Qi, et al. Toxin gene profiles, antimicrobial resistance, and SPA typing of Staphylococcus aureus isolated from commercial cold noodles[J]. Food Science, 2018, 39(20): 287-293. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201820041. http://www.spkx.net.cn
引文格式:王盼盼, 李穗霞, 曾琪, 等. 市售凉皮中金黄色葡萄球菌的肠毒素基因、耐药特征检测及SPA分型[J]. 食品科学, 2018,39(20): 287-293. DOI:10.7506/spkx1002-6630-201820041. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0287-07
文献标志码:A
中图分类号:TS207.4
DOI:10.7506/spkx1002-6630-201820041
*通信作者简介:王新(1973—),男,教授,博士,主要从事食源性病原及分子生物学和食品安全研究。E-mail:xinwang7516@nwsuaf.edu.cn
第一作者简介:王盼盼(1992—),女,硕士研究生,主要从事食品质量安全(微生物)检测研究。E-mail:wpp8810@163.com
基金项目:国家自然科学基金面上项目(31271858);中国博士后科学基金项目(2015M582711)
收稿日期:2017-08-02






 /S 6 1 1.0 Pen-Amp-Oxa-Ery-T/S-A/C 6 2 1.9 Pen-Amp-Oxa-Rif-T/S-A/C 6 1 1.0 Pen-Amp-Ery-Cefox-T/S-A/C 6 5 4.8 Pen-Amp-Oxa-Ery-Cefox-T/S-A/C 7 1 1.0 Pen-Oxa-Tet-Cefox-Rif-T/S-A/C 7 1 1.0 Pen-Amp-Oxa-Cefox-Rif-T/S-A/C 7 1 1.0
/S 6 1 1.0 Pen-Amp-Oxa-Ery-T/S-A/C 6 2 1.9 Pen-Amp-Oxa-Rif-T/S-A/C 6 1 1.0 Pen-Amp-Ery-Cefox-T/S-A/C 6 5 4.8 Pen-Amp-Oxa-Ery-Cefox-T/S-A/C 7 1 1.0 Pen-Oxa-Tet-Cefox-Rif-T/S-A/C 7 1 1.0 Pen-Amp-Oxa-Cefox-Rif-T/S-A/C 7 1 1.0