王 强,王旭峰,赵东豪,黎智广,蔡 楠,关婉琪,黄 珂,李刘冬*
(中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,农业部水产品贮藏保鲜质量安全风险评估实验室
(广州),农业部渔业环境及水产品质量监督检验测试中心(广州),广东 广州 510300)
摘 要:将庆大霉素(gentamicin,GEN)、卡那霉素(kanamycin,KAN)和安普霉素(apramycin,APR)的抗体同时偶联到溴化氰活化的琼脂糖凝胶上,制备成复合型免疫亲和柱(immunoaffinity column,IAC)。建立鱼虾肉中3 种氨基糖苷类抗生素的免疫亲和柱净化-超高效液相色谱-串联质谱分析方法。采用BEH Amide(100 mm×2.1 mm,1.7 μm)色谱柱分离,以0.05%甲酸溶液和乙腈为流动相梯度洗脱,电喷雾正离子多反应模式监测。结果表明,所制备的IAC对GEN、KAN和APR的柱容量分别为1 127、1 368、925 ng/mL,洗脱液选用0.1%甲酸-甲醇溶液。GEN的线性范围为80.0~500 μg/L,KAN和APR的线性范围为20~500 μg/L,相关系数均大于0.995。鱼虾肉基质中3 种物质的平均回收率为71.7%~96.8%,相对标准偏差为4.2%~10.9%(n=6),检出限和定量限分别为10~40 μg/kg和20~80 μg/kg。为水产品中氨基糖苷类药物残留监控提供一种有效的技术手段。
关键词:免疫亲和柱;超高效液相色谱-串联质谱;残留检测;氨基糖苷类抗生素
氨基糖苷类药物(aminoglycosides,AGs)属于广谱类抗生素,其分子结构由氨基糖与氨基环醇通过糖苷键连接而成,临床上主要用于对革兰氏阴性菌、绿脓杆菌等感染的治疗,可有效抑制细菌的生长和繁殖[1-3]。在畜牧水产行业中,AGs常被添加到动物饲料或其他饵料中,用于预防疾病和促进生长,其进入动物机体后与动物组织有很强的亲和力,残留代谢时间较长[4-6]。耳毒性和肾毒性是AGs共有的毒副作用,会影响神经传导,引发菌群失调从而损害肠道的吸收。消费者直接食用这类残留超标的动物食品会带来潜在的危害。目前,我国农业部、美国FDA和欧盟委员会等相关管理机构对动物性食品中常用的氨基糖苷类抗生素都设置了残留限量标准[7-9]。因此,有必要建立准确有效的检测方法,从而进一步加强该类药物在动物性食品中的风险隐患排查。
目前,AGs的残留定量检测主要依靠以液相色谱法为基础的仪器分析法[10]。由于该类物质极性大,易溶于水且与样品基质结合紧密,样品提取后净化难度大,现有的文献方法多采用固相萃取技术,常用的有![]() HLB[8,10,13]和WCX[14-15]等通用型固相萃取柱,但其专属净化效果不强,样品基质干扰严重,导致方法灵敏度差,回收率不稳定。高玲等[1]建立了高效液相色谱-串联质谱法测定水产品中5 种AGs类抗生素,样品经磷酸缓冲液(含50 mmol/L庚烷磺酸钠)提取后,用HLB固相萃取进行净化;GB/T 21323—2007《动物组织中氨基糖苷类药物残留量的测定 高效液相色谱-质谱/质谱法》方法中样品提取后,在提取液中加入一定量的七氟丁酸溶液,经C18固相萃取柱净化后上机测定;这些方法引入了离子对试剂,会造成质谱检测器信号抑制和离子源的污染。
HLB[8,10,13]和WCX[14-15]等通用型固相萃取柱,但其专属净化效果不强,样品基质干扰严重,导致方法灵敏度差,回收率不稳定。高玲等[1]建立了高效液相色谱-串联质谱法测定水产品中5 种AGs类抗生素,样品经磷酸缓冲液(含50 mmol/L庚烷磺酸钠)提取后,用HLB固相萃取进行净化;GB/T 21323—2007《动物组织中氨基糖苷类药物残留量的测定 高效液相色谱-质谱/质谱法》方法中样品提取后,在提取液中加入一定量的七氟丁酸溶液,经C18固相萃取柱净化后上机测定;这些方法引入了离子对试剂,会造成质谱检测器信号抑制和离子源的污染。
相比于传统固相萃取技术,免疫亲和柱(immunoaffinity column,IAC)净化是通过抗原抗体之间特异性的分子识别而建立的分离萃取技术,具有特异性好、净化彻底和样品富集效率高等优点,可以从复杂的待测样品中有目的地捕获提取目标物[16-18]。研究表明,样品经IAC净化后无明显的基质效应,目标物响应强度高,无需采用基质匹配标准曲线定量检测结果,净化效果显著优于HLB和C18等通用型固相萃取柱,且使用后的IAC可用缓冲液平衡再生,重复利用率高[19-21]。而进一步推进IAC在复杂基质样品前处理中的推广应用,是目前兽药多残留检测的热点[22-23]。现有的AGs类IAC主要是单一型柱,即一次测定一种药物含量,李哲等[24]以四甲氧基硅烷为柱载体制备IAC,该柱对庆大霉素标准品的回收率均大于60%,可重复使用5 次。郑琦等[25]以新霉素多克隆抗体为配基制备IAC,用高效液相色谱测定南美白对虾中新霉素,所制备IAC的最大柱容量为2 182 ng/mL,该柱可重复使用5 次,并于4 ℃贮存110 d,性能良好。而目前可应用于安普霉素(apramycin,APR)和卡那霉素(kanamycin,KAN)样品净化处理的IAC国内尚鲜见报道。本研究制备了复合型IAC,其可以同时保留庆大霉素(gentamicin,GEN)、KAN和APR,样品提取液经IAC净化后,用超高效液相色谱-串联质谱法(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)分析测定,建立一种快速、简便、高效测定鱼虾肉中3 种AGs的分析方法。
鱼虾样品由农业部渔业环境及水产品质量监督检验测试中心(广州)提供。
CNBr-Sepharose 4B溴化氰活化琼脂糖凝胶(46~165 μm) 美国GE Healthcare公司;GEN、KAN、APR、链霉素、双氢链霉素、妥布霉素、大观霉素、阿米卡星标准品(纯度>92%) 德国Dr.Ehrenstorfer公司;甲醇、乙腈(色谱纯) 美国Fisher Scientic公司;Na2EDTA 广州化学试剂厂;GEN、KAN、APR多克隆抗体为本实验室自制;其他试剂均为国产分析纯。
Acquity UPLC I-Class/Xevo TQS超高效液相色谱仪串联三重四极杆质谱仪(配备电喷雾离子源及Masslynx数据处理软件) 美国Waters公司;5810型台式离心机德国Eppendorf公司;MS3旋涡混合器 德国IKA公司;Milli-Q去离子水发生器 美国Millipore公司;N-EVAP-111型12位氮吹仪 美国Organomation公司;24通道固相萃取装置 美国Phenomenex公司;UV-1601紫外-可见分光光度计 日本日立公司。
1.3.1 溶液的配制
AGs标准溶液:分别称取适量AGs标准品,用乙腈-水(1∶9,V/V)溶解并稀释成质量浓度均为500 μg/mL的标准品储备液,置于塑料离心管中4 ℃避光保存。使用时用乙腈-0.1%甲酸溶液(1∶1,V/V)配成不同质量浓度的标准工作溶液。
磷酸盐缓冲液(PBS,pH 7.4,0.01 mol/L,含0.01% NaN3):分别称取KH2PO40.2 g、NaCl 8 g、Na2HPO4·12H2O 2.9 g、KCl 0.2 g,加水溶解定容至1 000 mL。
混合提取试剂(含0.4 mmol/L EDTA和2%三氯乙酸溶液):准确称取磷酸二氢钾1.36 g,用980 mL水溶解,用1.0 mol/L盐酸溶液调pH 4.0,分别加入Na2EDTA 0.15 g和三氯乙酸20 g,溶解并定容至1 000 mL。
1.3.2 IAC的制备
参照CNBr-Sepharose 4B产品说明书并略有改变,具体操作步骤如下:
洗涤:于玻璃烧杯中准确称取CNBr-Sepharose 4B干粉1.0 g,加入5 mL HCl溶液(1 mmol/L),搅拌溶胀后转移至G3砂芯漏斗上,用200 mL HCl溶液(1 mmol/L)充分洗涤,进一步用200 mL NaHCO3溶液(pH 8.3,0.1 mol/L)洗涤平衡。
偶联:将上述湿胶转移至玻璃烧杯中,分别加入1.5 mL GEN抗体(4.6 mg/mL)、1.2 mL KAN抗体(5.8 mg/mL)和3.0 mL APR抗体(2.3 mg/mL),室温下缓慢搅拌2 h后于4 ℃反应过夜,使抗体与凝胶充分偶联。随后,将反应液转移至砂芯漏斗上,收集流出液体,进一步用约30 mL上述NaHCO3溶液洗去未与凝胶偶联的抗体,紫外分光光度计(280 nm)测定流出液和洗涤液中未偶联蛋白含量,计算反应偶联率。
封闭:先用10 mL Tris-HCl缓冲液(pH 8.0,0.1 mol/L)在砂芯漏斗洗涤上述凝胶,随后将全部凝胶用10 mL Tris-HCl缓冲液转移至烧杯中,4 ℃封闭2 h。
平衡:用25 mL醋酸盐缓冲液(pH 8.0,0.1 mol/L)和20 mL Tris-HCl缓冲液(pH 8.0,0.1 mol/L)交替冲洗平衡上述凝胶。
装柱:取6 支3 mL的固相萃取空柱,每个柱子装填0.5 mL上述湿胶,上端加装筛板后注入适量的PBS(pH 7.4,0.01 mol/L)于4 ℃密封保存。
1.3.3 色谱及质谱条件
色谱条件:色谱柱:Waters ACQUITY BEH Amide柱(100 mm×2.1 mm,1.7 μm);柱温:40 ℃;进样量:10 μL;流速:0.30 mL/min;流动相:乙腈(A)和0.05%甲酸溶液(B)。梯度洗脱程序:0~2.5 min,95%~20% A;2.5~4.5 min,20% A;4.5~5.5 min,20%~95% A;5.5~7.0 min,95% A。
质谱条件:电喷雾离子源;正离子扫描;离子源温度:150 ℃;毛细管电压:3.5 kV;脱溶剂气温度:600 ℃;脱溶剂气流量:750 L/h;碰撞气流速:0.15 mL/min,锥孔反吹气流量:150 L/h;监测方式:多反应监测,定性及定量离子对、锥孔电压、碰撞能量等质谱条件如表1所示。
表1 3 种化合物的MRM离子对及质谱条件参数
Table 1 MRM transition and mass spectrometric parameters for the 3 analytes

注:*.定量离子。
1.3.4 样品提取与净化
准确称取已充分均质的鱼虾肉样品[26]2.0 g于50 mL聚苯乙烯离心管中,加入20 mL混合提取试剂,涡旋振荡提取10 min,4 000 r/min离心5 min。取10 mL上清液于另一干净离心管中,用1 mol/L的NaOH溶液调节样品溶液pH 7.5左右,加入10 mL PBS(pH 7.4,0.01 mol/L)。IAC预先用15 mL PBS(pH 7.4,0.01 mol/L)平衡后,将上述样品提取液以每秒1~2 滴的速率通过IAC,上样结束后用5 mL PBS(pH 7.4,0.01 mol/L)和5 mL水冲洗IAC,挤干柱内液体,用4 mL 0.1%甲酸-甲醇溶液洗脱,收集洗脱液,于45 ℃氮气吹干,用1 mL乙腈-0.1%甲酸溶液(1∶1,V/V)溶解并定容,经0.2 μm滤膜后供UPLCMS/MS分析。
1.3.5 方法验证
将GEN、KAN和APR的标准储备液用乙腈-0.1%甲酸溶液(1∶1,V/V)分别配制成质量浓度为80~500、20~500 μg/L和20~500 μg/L的系列标准工作液,用UPLC-MS/MS进行分析,以标准品质量浓度为横坐标x,以对应峰面积为纵坐标y,获取相应的标准曲线和相关系数。在空白样品中添加低浓度的标准溶液,按照1.3.4节方法处理后上机测定,记录保留时间和峰面积,以信噪比RSN≥3和RSN≥10分别确定方法的检出限及定量限。
称取空白鱼肉和虾肉样品,分别添加相当于80、200 μg/kg和400 μg/kg含量水平的GEN标准工作液,20、50 μg/kg和100 μg/kg含量水平的KAN和APR标准工作液,涡旋混匀后于室温下静置30 min。每个质量浓度水平制作6 个平行样品,按1.3.4节所述方法处理,外标法定量,计算回收率和相对标准偏差(relative standard deviation,RSD),考察方法的准确度和精密度。
1.3.6 样品测定
从2016—2017年度广东省水产品例行监测样本库(水产批发市场或超市所采集)中,抽取草鱼8 份、鲫鱼6 份、鲈鱼4 份、乌鳢5 份、鳜鱼5 份和南美白对虾12 份,经1.3.4节方法处理后进行测定。
采用Waters Masslynx 4.1软件对UPLC-MS/MS所采集的数据进行积分处理,并导出色谱图,其他数据和图谱经OriginPro 8.5绘图软件分析处理。
选择电喷雾离子源正离子模式,对AGs的标准溶液进行IntelliStart扫描,对毛细管电压、脱溶剂气温度和碰撞能量等参数进行优化,结果如图1所示。AGs类物质的化学结构中含有多个氨基和羟基,极性大,亲水性强,在普通的反相C18色谱柱上难以保留,往往需要在流动相中添加七氟丁酸或三氟乙酸等离子对试剂实现色谱分离。本研究选用ACQUITY UPLC BEH Amide色谱柱,其柱体的键合固定相是基于亚乙基桥杂化(BEH)颗粒的三键键合酰胺基(Amide),属于亲水作用液相色谱柱,流动相初始比例可以保持在95%的有机相,水相中无需添加其他盐或离子对试剂等改性剂增加目标物的保留效果,非常适合于分离高极性的化合物[27-28]。

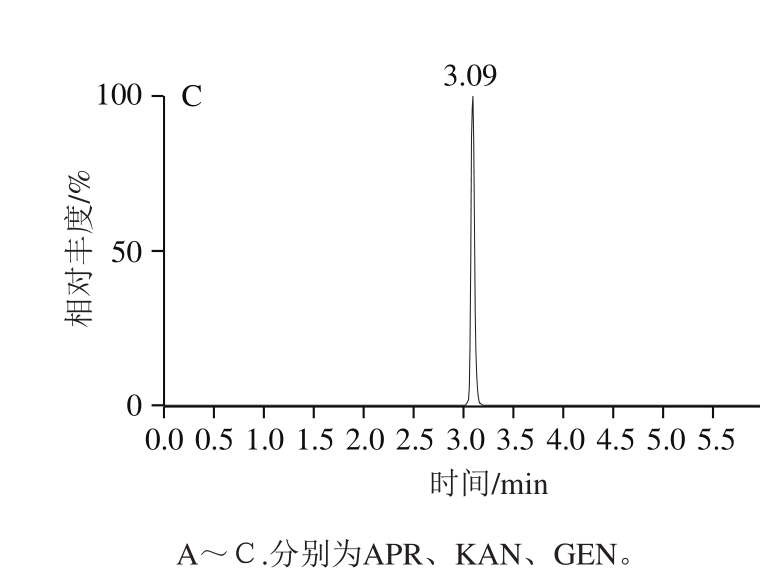
图1 3 种AGs(200 μg/L)的多反应监测色谱图
Fig. 1 MRM chromatograms of a mixed standard solution (200 μg/L)of the three AGs
流动相比较了甲醇-水、乙腈-水、甲醇-甲酸溶液和乙腈-甲酸溶液,其中甲酸的体积分数为0.01%~0.5%。结果表明,水相单纯使用水时,AGs几乎不出峰,而水相中仅添加0.01%甲酸,色谱峰形有明显的改善,甲酸的添加有助于质谱的正电离,但此时目标峰形较宽;当甲酸体积分数为0.05%时,3种AGs的峰形尖锐,进一步增加甲酸含量,目标物的峰面积响应值反而有所降低。使用乙腈洗脱的效果显著优于甲醇,向水相中添加不同浓度的乙酸铵(5~50 mmol/L),结果目标物的保留时间和峰形没有显著的变化。如图1所示,在0.05%甲酸溶液-乙腈流动相体系下进行梯度洗脱,3 种物质峰响应值高且峰形尖锐对称,保留时间稳定,满足定量分析检测的要求。
2.2.1 抗体偶联率测定结果
琼脂糖凝胶是制备IAC最常用的柱体基质,其依靠糖链之间的次级链维持网状结构,具有相对稳定的生物化学性质[18]。商业化的CNBr-Sepharose 4B具有良好的亲水性且易于活化,1 g CNBr-Sepharose 4B干粉可以溶胀获得约3.5 mL湿胶。研究表明每毫升溶胀的凝胶与4~10 mg抗体偶联可以获得性能优良的IAC[29-30]。本实验向反应液中投入约21 mg的抗体总量,即每毫升胶体与大约6 mg的抗体蛋白进行偶联,通过测定反应流出液和洗涤液中蛋白含量,测得抗体与凝胶的偶联率为91.8%。每个IAC(0.5 mL)中的单个抗体绝对质量约为0.91 mg。
2.2.2 柱容量的选择
柱容量是影响IAC性能的重要指标,通过向IAC加载过量的标准溶液,计算过柱前后目标物质含量的差异,计算IAC柱容量。取20 mL质量浓度为100 ng/mL的AGs混合标准溶液,缓慢地加载至IAC上,检测上样液中漏穿的目标物质含量X。柱容量/(ng/mL)=(2 000-X)/0.5,其中,2 000为加载至IAC上单个物质的绝对质量/ng,0.5是单个IAC凝胶的体积/mL。结果表明,GEN、KAN和APR的IAC容量分别为1 127、1 368、925 ng/mL,而针对链霉素、双氢链霉素、妥布霉素、大观霉素和阿米卡星等其他氨基糖苷类物质则无保留。
2.2.3 洗脱液及其体积的选择
取10 mL质量浓度为20 ng/mL混标上样,分别采用80%、90%、100%甲醇溶液作为洗脱液,洗脱体积均为10 mL,考察3 种AGs的回收率。结果表明,随着甲醇体积分数的增加,回收率不断增加,当使用纯甲醇洗脱时,3 种物质的回收率保持在80%左右。可能是由于AGs水溶性极强,仅使用有机溶剂无法将其从IAC上彻底洗脱,因此本研究尝试降低洗脱液的pH值,分别采用0.1%甲酸-甲醇溶液和1%甲酸-甲醇溶液进行洗脱,结果如图2所示,使用0.1%甲酸-甲醇溶液洗脱时3 种AGs的回收率为90.5%~94.1%,而使用pH值更低的1%甲酸-甲醇溶液洗脱时回收率并没有进一步提高。收集0.1%甲酸-甲醇溶液的洗脱液(1 mL/管),上机测定洗脱液中的目标物质含量,结果显示洗脱液第4管里目标物质的含量已经很低,前4 管洗脱液里3 种AGs总量的回收率均大于90%,为节约下一步氮气浓缩的时间,并降低过多溶剂对IAC容量的破坏,洗脱液体积选择4 mL。

图2 不同洗脱条件下AGs的回收率(n=3)
Fig. 2 Recoveries of AGs (200 ng) under different elution conditions (n = 3)
2.2.4 IAC稳定性

图3 IAC容量的变化
Fig. 3 Variation in the AG adsorption capacity of the IAC column after repeated use
将所制备的IAC在20 d内连续使用10 次,每隔2 d使用一次,每一次洗脱后用PBS(pH 7.4,0.01 mol/L)再生后于4 ℃密封保存,计算柱容量和回收率的变化。结果表明(图3),随着IAC的多次使用,3 种物质的柱容量随之不断下降,使用10 次后柱容量下降至392~445 ng/mL,柱容量整体下降了约60%,此时按照1.3节方法条件处理时回收率仍可以达到88.3%~96.6%。在实际样品测定中,如果待测样品中目标物含量较高,可将样品提取液进行适当的稀释后用于IAC净化处理,依然可以满足检测需求。同时,本研究结果表明,将IAC置于4 ℃密封保存1~6 个月,其柱容量没有明显的变化,3 种AGs的回收率大于90%。
表2 线性方程、相关系数、检出限、定量限
Table 2 Linear ranges, linear equations, correlation coefficients, limits of detection and limits of quantification for the AGs

由表2可知,GEN在80.0~500 μg/L质量浓度范围内,KAN和APR在20~500 μg/L质量浓度范围具有良好的线性,相关系数均大于0.995。在空白样品中分别添加AGs混合标准溶液,按照1.3节方法处理,以3 倍和10 倍信噪比计算出方法的检出限和定量限,分别为10~40 μg/kg和20~80 μg/kg。
由于待测物质具有较高的水溶性和质子化倾向,易与组织成分结合或被玻璃器皿吸附,在整个样品前处理过程均需要采用聚丙烯塑料类容器。混合提取液中含2%的三氯乙酸溶液用于除去大部分的蛋白,提取液经NaOH溶液调至中性后加入等体积的PBS(pH 7.4,0.01 mol/L),进一步用IAC对其净化。每个添加水平重复5 次,计算平均回收率和精密度。结果表明(表3),鱼肉基质中3 种目标待测物的平均回收率为71.7%~96.8%,RSD为5.2%~8.8%;虾肉基质中目标待测物的平均回收率为75.8%~96.4%,RSD为4.2%~10.9%。方法准确度和精密度良好,满足水产品中3 种AGs残留检测的要求。
表3 鱼肉和虾肉中AGs的回收率和精密度(n=6)
Table 3 Recoveries and precisions for the AGs in spiked fi sh and shrimp (n= 6)

采用所建立的方法测定了广东省内的水产批发市场或超市的40 批次鱼虾类样品,未检出GEN、KAN、APR 3 种AGs残留。
本研究制备了一种复合型IAC,其针对GEN、KAN、APR的柱容量分别为1 127、1 368、925 ng/mL,洗脱液选用4 mL 0.1%甲酸-甲醇溶液。IAC于20 d内连续使用10 次后,柱容量下降至392~445 ng/mL,但回收率没有明显的变化,有效期为6 个月。鱼虾肉样品用磷酸盐缓冲液提取,提取液经IAC净化后选用亲水性的BEH Amide色谱柱分离待测的物质。该方法操作简便,灵敏度高,杂质干扰少,能够较好地满足鱼虾中3 种AGs残留检测的需要。
参考文献:
[1] 高玲, 张丹, 高峰, 等. 水产品中氨基糖苷类药物残留的高效液相色谱-串联质谱检测方法研究[J]. 中国兽药杂志, 2012, 46(11): 27-30.
[2] 马伟, 胥传来. 动物源食品中氨基糖苷类抗生素多残留免疫检测方法研究进展[J]. 食品科学, 2009, 30(11): 289-292. DOI:10.3321/j.issn:1002-6630.2009.11.065.
[3] TAO Y, CHEN D, YU H, et al. Simultaneous determination of 15 aminoglycoside(s) residues in animal derived foods by automated solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2012, 135(2): 676-683.DOI:10.1016/j.foodchem.2012.04.086.
[4] WANG J, ZHAO Q, JIANG N, et al. Urea-formaldehyde monolithic column for hydrophilic in-tube solid-phase microextraction of aminoglycosides[J]. Journal of Chromatography A, 2017, 1485: 24-31.DOI:10.1016/j.chroma.2017.01.027.
[5] 苏晶, 汤立忠, 陈长毅, 等. 高效液相色谱串联质谱法同时测定9 种龙虾中氨基糖苷类和四环素类抗生素残留[J]. 食品工业科技, 2016,37(2): 60-63. DOI:10.13386/j.issn1002-0306.2016.02.003.
[6] 王志兵, 高杨, 刘洋, 等. 微波辅助衍生-离子液体分散液液微萃取-高效液相色谱法检测牛奶中氨基糖苷类抗生素残留[J]. 现代食品科技, 2014, 30(4): 260-267. DOI:10.13982/j.mfst.1673-9078.2014.04.013.
[7] ARSAND J B, JANK L, MARTINS M T, et al. Determination of aminoglycoside residues in milk and muscle based on a simple and fast extraction procedure followed by liquid chromatography coupled to tandem mass spectrometry and time of fl ight mass spectrometry[J].Talanta, 2016, 154: 38-45. DOI:10.1016/j.talanta.2016.03.045.
[8] ZHU W X, YANG J Z, WEI W, et al. Simultaneous determination of 13 aminoglycoside residues in foods of animal origin by liquid chromatography-electrospray ionization tandem mass spectrometry with two consecutive solid-phase extraction steps[J]. Journal of Chromatography A, 2008, 1207(1/2): 29-37. DOI:10.1016/j.chroma.2008.08.033.
[9] 刘雪红, 张秀芹, 侯颖, 等. 超高效液相色谱-串联质谱法检测牛奶中7 种氨基糖苷类药物残留[J]. 中国兽药杂志, 2015, 49(3): 48-52.
[10] DASENAKI M E, MICHALI C S, THOMAIDIS N S. Analysis of 76 veterinary pharmaceuticals from 13 classes including aminoglycosides in bovine muscle by hydrophilic interaction liquid chromatographytandem mass spectrometry[J]. Journal of Chromatography A, 2016,1452: 67-80. DOI:10.1016/j.chroma.2016.05.031.
[11] 湖南出入境检验检疫局, 山东出入境检验检疫局, 湖南师范大学,等. 动物组织中氨基糖苷类药物残留量的测定 高效液相色谱-质谱/质谱法: GB/T 21323—2007[S]. 北京: 中国标准出版社, 2007.
[12] 农业部. 动物性食品中庆大霉素残留检测 高效液相色谱法: 农业部1163号公告-7-2009[S]. 北京: 中国标准出版社, 2009.
[13] 龚强, 丁利, 朱绍华, 等. 高效液相色谱-串联质谱法检测乳制品中10种氨基糖苷类抗生素残留[J]. 色谱, 2012, 30(11): 1143-1147.
[14] KUMAR P, RUBIES A, COMPANYO R, et al. Determination of aminoglycoside residues in kidney and honey samples by hydrophilic interaction chromatography-tandem mass spectrometry[J]. Journal of Separation Science, 2012, 35(20): 2710-2717. DOI:10.1002/jssc.201200344.
[15] MARTOS P A, JAYASUNDARA F, DOLBEER J, et al. Multiclass,multiresidue drug analysis, including aminoglycosides, in animal tissue using liquid chromatography coupled to tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2010, 58(10): 5932-5944.DOI:10.1021/jf903838f.
[16] 李佩佩, 张小军, 严忠雍, 等. 免疫亲和柱净化-超高效液相色谱-串联质谱检测鱼虾中3-甲基-喹噁啉-2-羧酸[J]. 食品科学, 2016,37(24): 257-261. DOI:10.7506/spkx1002-6630-201624041.
[17] 孙雪, 郗存显, 唐柏彬, 等. 复合免疫亲和柱净化-液相色谱-串联质谱法测定动物源食品中6 种黄曲霉毒素和6 种玉米赤霉醇类真菌毒素残留量[J]. 分析化学, 2016, 44(6): 970-978. DOI:10.11895/j.issn.0253-3820.150229.
[18] XU Z L, DENG H, LEI H T, et al. Development of a broad-specificity monoclonal antibody-based immunoaffinity chromatography cleanup for organophosphorus pesticide determination in environmental samples[J]. Journal of Agricultural and Food Chemistry, 2012, 60(23):5847-5852. DOI:10.1021/jf300896z.
[19] 张家宁, 丁轲, 韩涛, 等. 不同净化柱处理对小麦粉中4 种镰刀菌毒素的净化效果[J]. 食品科学, 2017, 38(14): 316-322. DOI:10.7506/spkx1002-6630-201714049.
[20] MA F, YANG Q, MATTHAUS B, et al. Simultaneous determination of capsaicin and dihydrocapsaicin for vegetable oil adulteration by immunoaffinity chromatography cleanup coupled with LC-MS/MS[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2016, 1021: 137-144. DOI:10.1016/j.jchromb.2015.12.017.
[21] KIM H J, JEONG M H, PARK H J, et al. Development of an immunoaffinity chromatography and HPLC-UV method for determination of 16 sulfonamides in feed[J]. Food Chemistry, 2016,196: 1144-1149. DOI:10.1016/j.foodchem.2015.10.014.
[22] VAN EMON J M, CHUANG J C. Development and application of immunoaffinity chromatography for coplanar PCBs in soil and sediment[J]. Chemosphere, 2013, 90(1): 1-6. DOI:10.1016/j.chemosphere.2012.06.053.
[23] MEI L, CAO B, YANG H, et al. Development of an immunoaffinity chromatography column for selective extraction of a new agonist phenylethylamine A from feed, meat and liver samples[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2014, 945/946: 178-184. DOI:10.1016/j.jchromb.2013.11.057.
[24] 李哲, 胡拥明, 张柳伟, 等. 庆大霉素免疫亲和柱的制备及测定[J]. 食品科学, 2009, 30(22): 188-191. DOI:10.3321/j.issn:1002-6630.2009.22.042.
[25] 郑琦, 曹立民, 郑洪伟, 等. 新霉素免疫亲和柱的制备及其性能鉴定[J].食品安全质量检测学报, 2016, 7(3): 1037-1045.
[26] 赵东豪, 黎智广, 王旭峰, 等. 高效液相色谱-串联质谱法检测水产品中硝基呋喃类代谢物的优化研究[J]. 南方水产科学, 2015, 11(6):58-64. DOI:10.3969/j.issn.2095-0780.2015.06.008.
[27] 魏京华, 陈历俊, 赵军英, 等. 液相色谱-质谱法快速检测4 种乳源低聚糖[J]. 食品科学, 2016, 37(14): 86-91. DOI:10.7506/spkx1002-6630-201614015.
[28] 严忠雍, 张小军, 李奇富, 等. 免疫亲和柱净化-液相色谱-串联质谱法测定海洋生物中河豚毒素[J]. 分析化学, 2015, 43(2): 277-281.
[29] ZHANG X, YAN Z, WANG Y, et al. Immunoaffinity chromatography purification and ultrahigh performance liquid chromatography tandem mass spectrometry determination of tetrodotoxin in marine organisms[J]. Journal of Agricultural and Food Chemistry, 2015,63(12): 3129-3134. DOI:10.1021/acs.jafc.5b00045.
[30] 赵思俊, 郑增忍, 曲志娜, 等. 免疫亲和色谱-HPLC-FLD法测定动物肝脏中10 种喹诺酮类药物残留[J]. 分析化学, 2009, 37(3): 335-340.DOI:10.3321/j.issn:0253-3820.2009.03.005.
Determination of Three Aminoglycoside Antibiotics in Fish and Shrimp by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry with Immunoaffinity Column Clean-up
WANG Qiang, WANG Xufeng, ZHAO Donghao, LI Zhiguang, CAI Nan, GUAN Wanqi, HUANG Ke, LI Liudong*
(Key Laboratory of Aquatic Product Processing, Ministry of Agriculture,Laboratory of Quality and Safety Risky Assessment for Aquatic Product on Storage and Preservation (Guangzhou),Ministry of Agriculture, Fishery Environment and Aquatic Products Quality Inspection and Testing Center (Guangzhou), Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China)
Abstract:The polyclonal antibodies against gentamicin, kanamycin and apramycin were simultaneously coupled to CNBr-activated Sepharose 4B to make a composite immunoaffinity column (IAC). An ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method was developed for the simultaneous determination of the three aminoglycosides (AGs) in fi sh and shrimp with immunoaffinity column clean-up. The analytes were separated on a BEH Amide column(100 mm × 2.1 mm, 1.7 μm)utilizing gradient elution with a mixture of acetonitrile and 0.05%formic acid solution as the mobile phase. The analysis was carried out in the multiple reaction monitoring (MRM) mode using positive ion electrospray ionization (ESI). The column capacities of gentamicin, kanamycin and apramycin were 1 127, 1 368, and 925 ng/mL of gel, respectively. The optimum elution solvent was methanol containing 0.1% formic acid.The linear range of the method was 80.0–500 μg/L for gentamicin and 20–500 μg/L for kanamycin and apramycin, and the corresponding coefficients of correlation were all above 0.995. Recoveries from spiked fi sh and shrimp were in the range of 71.7%–96.8%, with relative standard deviations (RSDs) ranging from 4.2% to 10.9%. The limits of detection and the limits of quantitation were in the range of 10–40 and 20–80 μg/kg, respectively. The developed method would be a useful tool for monitoring aminoglycoside residues in aquatic products.
Keywords:immunoaffinity column (IAC); ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS);residue detection; aminoglycosides
WANG Qiang, WANG Xufeng, ZHAO Donghao, et al. Determination of three aminoglycoside antibiotics in fi sh and shrimp by ultra performance liquid chromatography-tandem mass spectrometry with immunoaffinity column clean-up[J]. Food Science,2018, 39(20): 326-331. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201820047. http://www.spkx.net.cn
引文格式:王强, 王旭峰, 赵东豪, 等. 免疫亲和柱净化-UPLC-MS/MS测定鱼虾肉中的3 种氨基糖苷类抗生素[J]. 食品科学, 2018,39(20): 326-331. DOI:10.7506/spkx1002-6630-201820047. http://www.spkx.net.cn
文章编号:1002-6630(2018)20-0326-06
文献标志码:A
中图分类号:O657.72
DOI:10.7506/spkx1002-6630-201820047
*通信作者简介:李刘冬(1959—),男,研究员,本科,研究方向为水产品检测与风险评估。E-mail:168LLd@163.com
第一作者简介:王强(1988—),男,助理研究员,硕士,研究方向为水产品检测与风险评估。E-mail:546056407@qq.com
中国水产科学研究院南海水产研究所基本科研业务费专项(2015TS17)
广东省水产品质量安全专项(GDSCZA2015008);
基金项目:国家农产品质量安全风险评估重大专项(GJFP201501003;GJFP201700901);
收稿日期:2017-10-20